Mirvaso 3Mg/G Del
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Mirvaso 3 mg/g gel
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un gramo de gel contiene 3,3 mg de brimonidina, equivalentes a 5 mg de tartrato de brimonidina. Excipientes con efecto conocido:
Un gramo de gel contiene 1 mg de parahidroxibenzoato de metilo (E218) y 55 mg de propilenglicol. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Gel.
Gel acuoso opaco, entre blanco y amarillo claro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Mirvaso está indicado para el tratamiento sintomático del eritema facial de la rosácea en pacientes adultos.
4.2 Posología y forma de administración
Posología
Una aplicación cada 24 horas, en cualquier momento que sea adecuado para el paciente, mientras persista el eritema facial.
La dosis máxima diaria recomendada es de 1 g de gel de peso total, dividido en cinco cantidades del tamaño de un guisante.
Poblaciones especiales
Pacientes de edad avanzada
La experiencia de uso de Mirvaso en pacientes de 65 años de edad es limitada (ver también sección 4.8).
Población pediátrica
No se ha establecido la seguridad y eficacia de Mirvaso en niños y adolescentes menores de 18 años. No se dispone de datos.
Mirvaso está contraindicado en niños menores de 2 años debido al riesgo grave de seguridad sistémica (ver sección 4.3). También se ha identificado preocupaciones relativas a la seguridad relacionadas con la absorción sistémica de la brimonidina para el grupo de 2 a 12 años de edad (ver sección 4.9). Mirvaso no se debe utilizar en niños o adolescentes de 2 a 18 años de edad.
Forma de administración
Sólo uso cutáneo.
Aplicación cutánea de una pequeña cantidad del medicamento, del tamaño de un guisante, en cada una de las cinco zonas de la cara: frente, barbilla, nariz y ambas mejillas.
Mirvaso se debe aplicar de forma suave y uniforme en una fina capa en toda la cara evitando los ojos, párpados, labios, boca y membrana de las fosas nasales. Mirvaso se debe aplicar únicamente en la cara.
Se deben lavar las manos inmediatamente después de la aplicación del medicamento.
Mirvaso se puede utilizar junto con otros medicamentos cutáneos para el tratamiento de las lesiones inflamatorias de la rosácea y con cosméticos. Estos productos no se deben aplicar inmediatamente antes de la aplicación diaria de Mirvaso; se podrán utilizar sólo tras la aplicación de Mirvaso, una vez que se haya secado.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Niños menores de 2 años.
Pacientes que reciban tratamiento con inhibidores de la monoaminooxidasa (IMAO) (por jemplo selegilina o moclobemida) y pacientes en tratamiento con antidepresivos tricíclicos (como imipramina) o tetracíclicos (como maprotilina, mianserina o mirtazapina) que afecten a la transmisión noradrenérgica.
4.4 Advertencias y precauciones especiales de empleo
Mirvaso no se debe aplicar en piel irritada ni en heridas abiertas. En caso de irritación intensa o de alergia de contacto, se debe suspender el tratamiento con el medicamento.
Eritema y rubefacción
El efecto de Mirvaso gel tópico comienza a disminuir a las horas de su aplicación. En algunos pacientes, se notificó que el eritema y la rubefacción vuelven a aparecer con una intensidad superior a la inicial. La mayoría de los casos se observaron en las 2 semanas posteriores al inicio del tratamiento (ver sección 4.8).
El inicio de la rubefacción respecto a la aplicación de Mirvaso gel tópico varió oscilando entre aproximadamente 30 minutos y varias horas (ver sección 4.8).
En la mayoría de los casos, el eritema y la rubefacción se resolvieron al suspender el tratamiento con Mirvaso gel tópico.
Si se produce empeoramiento del eritema, se debe interrumpir la administración de Mirvaso gel tópico. Las medidas sintomáticas como bajar la temperatura o administrar AINES y antihistamínicos, pueden ayudar a aliviar los síntomas.
Se ha notificado la recurrencia de eritema y rubefacción agravados tras la administración repetida de Mirvaso gel tópico. Antes de reanudar el tratamiento después de la interrupción temporal por el agravamiento del eritema y la rubefacción, realice una aplicación de prueba en un área pequeña del rostro antes de reanudar la aplicación facial completa.
Es importante informar al paciente de que no debe exceder la dosis recomendada ni la frecuencia de aplicación: un solo uso diario en capa fina.
Mirvaso no se debe aplicar cerca de los ojos.
Mirvaso no ha sido estudiado en pacientes con insuficiencia renal o hepática
Se debe evitar el aumento de la cantidad diaria aplicada y/o de la frecuencia de aplicación diaria del medicamento, ya que no se ha evaluado la seguridad de dosis diarias más altas ni de la aplicación diaria repetida.
El uso concomitante de otros agonistas de los receptores sistémicos alfaadrenérgicos puede potenciar los efectos adversos de esta clase de medicamentos en los pacientes:
- con enfermedad cardiovascular grave, inestable o no controlada;
- con depresión, insuficiencia cerebral o coronaria, fenómeno de Raynaud, hipotensión ortostática, tromboangitis obliterante, esclerodermia o síndrome de Sjogren.
El medicamento contiene parahidroxibenzoato de metilo (E218), que puede causar reacciones alérgicas (posiblemente retardadas), y propilenglicol, que puede causar irritación cutánea.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
Mirvaso está contraindicado en pacientes que reciben inhibidores de la monoaminooxidasa (IMAO) y en pacientes en tratamiento con antidepresivos tricíclicos o tetracíclicos que afecten a la transmisión noradrenérgica (ver sección 4.3).
Se debe tener en cuenta la posibilidad de un efecto aditivo o potenciador con los depresores del sistema nervioso central (alcohol, barbitúricos, opiáceos, sedantes o anestésicos).
No se dispone de datos sobre los niveles de catecolaminas circulantes tras la administración de Mirvaso. No obstante, se recomienda precaución en los pacientes tratados con sustancias que puedan afectar al metabolismo y a la captación de aminas circulantes, por ejemplo, clorpromazina, metilfenidato o reserpina.
Se recomienda precaución cuando se empiece a administrar (o se modifique la dosis de) una sustancia sistémica concomitante (sea cual sea su forma farmacéutica) que pueda interaccionar con los agonistas de los receptores alfaadrenérgicos o interferir en su actividad, como agonistas o antagonistas de los receptores adrenérgicos (isoprenalina, prazosina).
Brimonidina puede provocar descensos de la presión arterial insignificantes desde el punto de vista clínico en algunos pacientes. Por tanto, se recomienda precaución cuando se utilicen medicamentos como antihipertensivos y/o glucósidos cardíacos de forma concomitante con brimonidina.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de brimonidina en mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción (ver sección 5.3). Como medida de precaución, es preferible evitar el uso de Mirvaso durante el embarazo.
Lactancia
Se desconoce si brimonidina/metabolitos se excretan en la leche materna. No se puede excluir el riesgo en recién nacidos/niños. Mirvaso no se debe utilizar durante la lactancia.
Fertilidad
Brimonidina no presentó ningún riesgo especial para la reproducción o el desarrollo en especies animales.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Mirvaso sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas Resumen del perfil de seguridad
Las reacciones adversas notificadas con mayor frecuencia son eritema, prurito, rubefacción y sensación de ardor en la piel; todas ellas afectaron al 1,2 a 3,3% de los pacientes en estudios clínicos. Normalmente, son de intensidad de leve a moderada y, por lo general, no precisan de la suspensión del tratamiento. No se observaron diferencias significativas en los perfiles de seguridad entre la población de sujetos de edad avanzada y de sujetos de 18 a 65 años de edad. Durante el periodo posterior a la comercialización, se han notificado eritema, rubefacción y sensación de ardor en la piel agravados (ver sección 4.4).
Tabla de reacciones adversas
Las reacciones adversas se clasifican según el Sistema de Clasificación de Órganos y por frecuencia, utilizando la siguiente convención: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles) y se notificaron en estudios clínicos de Mirvaso (ver Tabla 1).
Tabla 1. Reacciones adversas
|
Clasificación por Órganos y Sistema |
Frecuencia |
Reacciones adversas |
|
Trastornos del sistema nervioso |
Poco frecuente |
Cefalea, parestesia |
|
Trastornos oculares |
Poco frecuente |
Edema palpebral |
|
Trastornos vasculares |
Frecuentes |
Rubefacción |
|
Raras |
Hipotensión* | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Poco frecuente |
Congestión nasal |
|
Trastornos gastrointestinales |
Poco frecuente |
Sequedad de boca |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes |
Eritema, prurito, sensación de ardor en la piel |
|
Poco frecuente |
Acné, calor cutáneo, dermatitis, dermatitis alérgica de contacto, dermatitis de contacto, dolor cutáneo, erupción papular, inflamación cutánea*, irritación cutánea, molestias cutáneas, rosácea, sequedad cutánea, urticaria* | |
|
Raras |
Angioedema* | |
|
Trastornos generales y alteraciones en el lugar de administración |
Poco frecuente |
Sensación de calor, frialdad periférica |
* Reacciones adversas notificadas de datos del periodo posterior a la comercialización.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se ha notificado que las sobredosis después del uso oral de otros agonistas alfa2 provocan síntomas como hipotensión, astenia, vómitos, letargo, sedación, bradicardia, arritmias, miosis, apnea, hipotonía, hipotermia, depresión respiratoria y crisis convulsivas.
El tratamiento de una sobredosis oral es tanto de apoyo como sintomático; se debe mantener la permeabilidad de las vías respiratorias.
No se han notificado casos de sobredosis después del uso cutáneo de Mirvaso durante el desarrollo clínico del estudio.
Población pediátrica
Se han notificado reacciones adversas graves tras la ingestión accidental de Mirvaso por los dos hijos pequeños de un participante en un estudio clínico. Los niños presentaron síntomas compatibles con sobredosis orales de agonistas alfa2 en niños pequeños previamente notificados. Ambos niños se recuperaron completamente en 24 horas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros preparados dermatológicos, Otros dermatológicos, código ATC: D11AX21
Mecanismo de acción
Brimonidina es un agonista altamente selectivo del receptor alfa2-adrenérgico, siendo 1000 veces más selectiva por el receptor alfa2-adrenérgico que por el receptor alfai-adrenérgico.
Efectos farmacodinámicos
La aplicación facial cutánea de un agonista de un receptor alfa2-adrenérgico altamente selectivo, reduce el eritema por vasoconstricción cutánea directa.
Eficacia clínica y seguridad
La eficacia de Mirvaso en el tratamiento del eritema facial de la rosácea de moderado a severo se ha demostrado en dos ensayos clínicos aleatorizados ciegos controlados con vehículo, con un diseño idéntico. Se definió el eritema de moderado a grave como un grado 3 o superior en la escala de Evaluación Clínica del Eritema (CEA) y en la escala de Evaluación del propio Paciente (PSA).
Los estudios se realizaron en 553 sujetos asignados al azar de 18 años o más, que fueron tratados una vez al día durante 4 semanas con Mirvaso o con el vehículo. De ellos, 539 completaron 29 días de tratamiento y tuvieron datos disponibles que se incluyeron en el análisis de eficacia realizado en el día 29; la mayoría eran de raza blanca y tenían entre 18 y 65 años.
El criterio principal de valoración se expresó como la eficacia combinada, es decir, los sujetos que respondieron con una reducción de 2 grados en la CEA y en la PSA el día 29. Los resultados de estos dos estudios clínicos demostraron que Mirvaso fue significativamente más eficaz (p<0,001) para la reducción del eritema facial de la rosácea que el vehículo en gel cuando se aplicaron una vez al día durante 29 días (criterio principal de valoración, ver Tabla 2). Para el subconjunto de la población de pacientes con eritema grave en el Día 1 (es decir, sujetos con grado 4 según CEA o PSA) que representa el 26% de los sujetos asignados al azar, los resultados del criterio principal de valoración el día 29 fueron similares a los resultados observados en la población general (ver Tabla 3) y fueron estadísticamente significativos para ambos estudios combinados (p=0,003). Además, Mirvaso demostró superioridad estadística (p<0,001) con respecto al vehículo en gel en cuanto al rápido inicio de un efecto clínicamente significativo (éxito combinado de 1 grado en la CEA y la PSA) tras la primera aplicación a los 30 minutos el Día 1 (criterio de valoración secundario 27,9% versus 6,9% para el Estudio 1, 28,4% versus 4,8% para Estudio 2), y a la consecución de un efecto clínicamente significativo (eficacia combinada de 1 grado en la CEA y la PSA) a Día 29 (criterio de valoración terciario, ver Tabla 4).
CEA y PSA fueron definidas de la siguiente manera:
CEA: Evaluación clínica del eritema: 0=Piel sin lesiones, sin signos de eritema, 1=Casi sin lesiones; ligero enrojecimiento, 2=Eritema leve; claro enrojecimiento, 3=Eritema moderado + enrojecimiento marcado y 4=Eritema intenso+ enrojecimiento fuerte
PSA: Evaluación del propio paciente: 0=Sin enrojecimiento, 1=Enrojecimiento muy leve, 2=Enrojecimiento leve, 3=Enrojecimiento moderado y 4=Enrojecimiento intenso
Tabla 2: Porcentaje de sujetos con una mejoría de 2 grados en la CEA y en la PSA
|
Eficacia día 29 |
Estuc |
io 1 |
Estudio 2 | |
|
Mirvaso gel n=127 |
Vehículo en gel n=128 |
Mirvaso gel n=142 |
Vehículo en gel n=142 | |
|
3 horas después de la aplicación |
31,5% |
10,9% |
25,4% |
9,2% |
|
6 horas después de la aplicación |
30,7% |
9,4% |
25,4% |
9,2% |
|
9 horas después de la aplicación |
26,0% |
10,2% |
17,6% |
10,6% |
|
12 horas después de la aplicación |
22,8% |
8,6% |
21,1% |
9,9% |
|
Valor p día 29 |
<0,001 |
- |
<0,001 |
- |
Tabla 3: Porcentaje de sujetos con eritema intenso en el Día 1 (grado 4 según CEA o PSA) con una mejoría de 2 grados en la CEA y en la PSA
|
Eficacia día 29 |
Estudio 1 + Estudio 2 | |
|
Mirvaso gel n=79 |
Vehículo en gel n=63 | |
|
3 horas después de la aplicación |
22,8% |
9,5% |
|
6 horas después de la aplicación |
26,6% |
7,9% |
|
9 horas después de la aplicación |
20,3% |
11,1% |
|
12 horas después de la aplicación |
21,5% |
4,8% |
|
Valor p día 29 |
0,003 |
- |
Tabla 4: Porcentaje de sujetos con una mejoría de 1 grado en la CEA y en la PSA
|
Éxito día 29 |
Estudio 1 |
Estudio 2 | ||
|
Mirvaso gel n=127 |
Vehículo en gel n=128 |
Mirvaso gel n=142 |
Vehículo en gel n=142 | |
|
3 horas después de la aplicación |
70,9% |
32,8% |
71,1% |
40,1% |
|
6 horas después de la aplicación |
69,3% |
32,0% |
64,8% |
43,0% |
|
9 horas después de la aplicación |
63,8% |
29,7% |
66,9% |
39,4% |
|
12 horas después de la aplicación |
56,7% |
30,5% |
53,5% |
40,1% |
|
Valor p día 29 |
<0,001 |
- |
<0,001 |
- |
No se observaron tendencias clínicamente significativas con respecto a la taquifilaxia ni efectos rebote (empeoramiento del eritema basal tras la suspensión del tratamiento) con el uso de Mirvaso durante 29 días.
Los resultados de un estudio abierto a largo plazo en 449 pacientes, con tratamiento continuo durante un año, confirmó que el uso crónico de Mirvaso es seguro y eficaz. Las reducciones diarias en el eritema durante el primer mes de uso (medida con las escalas CEA y PSA) fueron similares a los observados en los ensayos controlados, y esas reducciones fueron alcanzadas durante 12 meses sin pérdida aparente de efecto con el tiempo. Se han reflejado las frecuencias totales de las reacciones adversas en este estudio en la Tabla 1 de arriba, con las tasas más altas que ocurren en los primeros 29 días de uso. Ninguna de las reacciones adversas tuvieron un aumento en la frecuencia con el tiempo, y no hubo evidencia de que el uso prolongado de Mirvaso llevara a un mayor riesgo de aparición de cualquier tipo específico de reacción adversa.
No se ha estudiado sistemáticamente el uso concomitante de Mirvaso con otros medicamentos para el tratamiento de las lesiones inflamatorias de la rosacea.Sin embargo, en un estudio abierto a largo plazo, la eficacia y la seguridad de Mirvaso, como se describe arriba, no resultaron afectadas por el uso concomitante de cosméticos u otros medicamentos (por ejemplo metronidazol tópico, ácido azelóico y tetraciclinas orales incluyendo doxiciclina a dosis bajas) para el tratamiento de las lesiones inflamatorias de la rosácea en la subpoblación afectada (131/449 pacientes en el estudio usando medicación concomitante de la rosácea).
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos clínicos realizados con Mirvaso en todos y cada uno de los subgrupos de la población pediátrica en el tratamiento de la rosácea (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
La absorción de brimonidina de Mirvaso se evaluó en un estudio clínico realizado en 24 adultos con eritema facial de la rosácea. Todos los sujetos incluidos recibieron una única administración ocular al día de un colirio en solución de brimonidina al 0,2%, seguida de la aplicación cutánea de Mirvaso una vez al día durante 29 días (comparación intraindividual de la exposición sistémica). El Día 1 del estudio, todos los sujetos recibieron 1 gota de la solución de colirio al 0,2% en cada ojo, cada 8 horas durante un período de 24 horas (3 dosis en total).
Tras la aplicación cutánea repetida de Mirvaso en la piel facial, no se observó acumulación del fármaco en plasma durante el tratamiento: la concentración plasmática máxima (Cmax) media más alta (± desviación estándar) y el área bajo la curva de concentración-tiempo de 0 a 24 horas (AUC0-24h) fueron de 46 ± 62 pg/ml y 417 ± 264 pg.h/ml, respectivamente. Estos niveles son significativamente inferiores (dobles) a los observados tras la administración ocular una vez al día del colirio en solución de brimonidina al 0,2%.
Distribución
No se ha estudiado la unión de brimonidina a las proteínas.
Biotransformación
La brimonidina se metaboliza ampliamente en el hígado.
Eliminación
La excreción urinaria es la principal vía de eliminación de la brimonidina y sus metabolitos.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción y el desarrollo.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Carbómero
Parahidroxibenzoato de metilo (E218)
Fenoxietanol
Glicerol
Dióxido de titanio Propilenglicol Hidróxido de sodio Agua purificada
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
Este medicamento no require condiciones especiales de conservación.
No congelar.
6.5 Naturaleza y contenido del envase
[2 g]
Tubos de plástico laminado de polietileno (PE)/aluminio (Al)/polietileno (PE) con cuello de polietileno de alta densidad (HDPE) y cierre de polipropileno (PP).
[10 g; 30 g]
Tubos de plástico laminado de polietileno (PE)/aluminio (Al)/polietileno (PE) con cuello de polietileno de alta densidad (HDPE) y cierre de polipropileno (PP) a prueba de niños.
O
[2 g]
Tubos de plástico de polyfoil (tipo de laminado) de polietileno (PE)/copolímero/aluminio (Al)/copolímero/polietileno (PE) con cuello de polietileno de alta densidad (HDPE) y cierre de polietileno (PE) a prueba de niños
[10 g; 30 g]
Tubos de plástico de polyfoil (tipo de laminado) de polietileno (PE)/copolímero/aluminio (Al)/copolímero/polietileno (PE) con cuello de polietileno de alta densidad (HDPE) y cierre de polipropileno (PP) a prueba de niños.
Tamaños de los envases: 1 tubo de 2g, 10 g o 30 g.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
Galderma International
Tour Europlaza, 20 avenue André Prothin - La Défense 4
La Défense Cedex 92927
Francia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Tubos de plástico laminado de polietileno (PE)/aluminio (Al)/polietileno (PE):
EU/1/13/904/001
EU/1/13/904/002
EU/1/13/904/003
Tubos de plástico de polyfoil de polietileno (PE)/copolímero/aluminio (Al)/copolímero/polietileno (PE):
EU/1/13/904/004
EU/1/13/904/005
EU/1/13/904/006
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 21 de febrero de 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Nombre y dirección del (de los) fabricantc(s) rcsponsablc(s) de la liberación de los lotes
Laboratoires Galderma Z.I. Montdésir 74540 Alby-sur-Chéran Francia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN
SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA
1. NOMBRE DEL MEDICAMENTO
Mirvaso 3 mg/g gel brimonidina
2. PRINCIPIO(S) ACTIVO(S)
Un gramo de gel contiene 3,3 mg de brimonidina.
3. LISTA DE EXCIPIENTES
Excipientes: Carbómero, parahidroxibenzoato de metilo (E218), fenoxietanol, glicerol, dióxido de titanio, propilenglicol, hidróxido de sodio, agua purificada.
Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Gel
2 g 10 g
30 g
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
No ingerir.
Leer el prospecto antes de utilizar este medicamento. Sólo uso cutáneo.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Galderma International
Tour Europlaza, 20 avenue André Prothin
La Défense 4
92927 La Défense Cedex
Francia
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/904/001
EU/1/13/904/002
EU/1/13/904/003
EU/1/13/904/004
EU/1/13/904/005
EU/1/13/904/006
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Mirvaso
INFORMACIÓN QUE DEBE FIGURAR EN EL ACONDICIONAMIENTO PRIMARIO TUBO 30 g_
1. NOMBRE DEL MEDICAMENTO
Mirvaso 3 mg/g gel brimonidina
2. PRINCIPIO(S) ACTIVO(S)
Un gramo de gel contiene 3,3 mg de brimonidina.
3. LISTA DE EXCIPIENTES
Excipientes: Carbómero, parahidroxibenzoato de metilo (E218), fenoxietanol, glicerol, dióxido de titanio, propilenglicol, hidróxido de sodio, agua purificada. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Gel
30 g
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
No ingerir.
Leer el prospecto antes de utilizar este medicamento. Sólo uso cutáneo.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/904/003
EU/1/13/904/006
13. NÚMERO DE LOTE, CÓDIGO DE DONACIÓN Y DEL PRODUCTO
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
TUBO 10 g_
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Mirvaso 3 mg/g gel brimonidina Uso cutáneo
2. FORMA DE ADMINISTRACIÓN
No ingerir.
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
10 g
6. OTROS
Mantener fuera de la vista y del alcance de los niños.
Excipientes: Carbómero, parahidroxibenzoato de metilo (E218), fenoxietanol, glicerol, dióxido de titanio, propilenglicol, hidróxido de sodio, agua purificada.
TUBO 2 g_
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Mirvaso 3 mg/g gel brimonidina Uso cutáneo
2. FORMA DE ADMINISTRACIÓN
No ingerir.
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
2 g
6. OTROS
B. PROSPECTO
Prospecto: información para el paciente
Mirvaso 3 mg/g gel brimonidina
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Mirvaso y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Mirvaso
3. Cómo usar Mirvaso
4. Posibles efectos adversos
5. Conservación de Mirvaso
6. Contenido del envase e información adicional
1. Qué es Mirvaso y para qué se utiliza
Mirvaso contiene el principio activo brimonidina, que pertenece a un grupo de medicamentos denominados comúnmente “agonistas alfa”.
Se aplica en la piel de la cara para tratar el enrojecimiento provocado por la rosácea en pacientes adultos.
El enrojecimiento de la cara por la rosácea está causado por niveles elevados de flujo de sangre en la piel de la cara, que es el resultado de un aumento de tamaño (dilatación) de los pequeños vasos sanguíneos de la piel.
Cuando se aplica, Mirvaso actúa estrechando estos vasos sanguíneos, lo que reduce el exceso de flujo de sangre y enrojecimiento.
2. Qué necesita saber antes de empezar a usar Mirvaso
No use Mirvaso:
- si es alérgico a la brimonidina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- en niños menores de 2 años de edad, que tienen mayor riesgo de tener efectos adversos a cualquier medicamento que se absorba a través de la piel.
- si está tomando ciertos medicamentos usados para la depresión o la enfermedad de Parkinson incluyendo los denominados inhibidores de la monoaminooxidasa (IMAO) (por ejemplo selegilina o moclobemida) o, los antidepresivos tricíclicos (como imipramina) o antidepresivos tetracíclicos (como maprotilina, mianserina o mirtazapina). El uso de Mirvaso cuando se está tomando estos medicamentos puede producir una bajada de la tensión arterial.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Mirvaso si:
- la piel de su cara está irritada o tiene heridas abiertas.
- tiene problemas de corazón o circulación.
- tiene depresión, disminución del riego sanguíneo del cerebro o del corazón, bajada de la tensión arterial en pie, disminución del riego sanguíneo de las manos, de los pies o de la piel, o el síndrome de Sjogren (enfermedad crónica en la que las defensas naturales del cuerpo - sistema inmune - atacan a las glándulas productoras de humedad).
tiene problemas de riñón o de hígado o los ha tenido en el pasado.
Empeoramiento del enrojecimiento de la piel, rubefacción o sensación de ardor en la piel:
Algunos pacientes experimentan un enrojecimiento peor que el inicial. Dicho empeoramiento del enrojecimiento se desarrolla normalmente en las 2 primeras semanas de tratamiento con Mirvaso. Generalmente, desaparece espontáneamente tras interrumpir el tratamiento. El efecto debe desaparecer gradualmente en unos pocos días en la mayoría de los casos. Antes de reanudar el tratamiento con Mirvaso gel tópico, pruébelo en un área pequeña del rostro un día que pueda quedarse en casa. Si no experimenta un empeoramiento del enrojecimiento o la sensación de ardor, continúe con el tratamiento habitual (ver sección 3).
En caso de empeoramiento o enrojecimiento inesperado, interrumpa el tratamiento y póngase en contacto con su médico.
Si cualquiera de lo mencionado arriba es aplicable en su caso, hable con su médico ya que este medicamento puede que no sea adecuado para usted.
Niños y adolescentes
No administre este medicamento a niños y adolescentes menores de 18 años, ya que no se ha establecido la seguridad y eficacia en este grupo de edad. Esto es especialmente importante, en los niños menores de 2 años de edad (ver No use Mirvaso).
Uso de Mirvaso con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento, ya que estos medicamentos podrían afectar a su tratamiento con Mirvaso o Mirvaso podría afectar a su tratamiento con estos medicamentos.
No use Mirvaso con selegilina, moclobemida, imipramina, mianserina o maprotilina, que son medicamentos que pueden usarse para la depresión o la enfermedad de Parkinson, ya que podría producir un cambio en la eficacia de Mirvaso o podría aumentar las posibilidades de efectos adversos tales como una bajada en la presión arterial (ver “No use Mirvaso”).
También, informe a su médico si está tomando alguno de los medicamentos siguientes:
- medicamentos usados para el tratamiento del dolor, los trastornos del sueño o los trastornos de ansiedad.
- medicamentos utilizados para el tratamiento de los trastornos psiquiátricos (clorpromazina) o utilizados para la hiperactividad (metilfenidato) o, utilizados para la tensión arterial alta (reserpina).
- medicamentos que actúan de la misma manera que Mirvaso (otros agonistas alfa, p. ej., clonidina; los denominados alfa-bloqueantes u antagonistas alfa, p. ej., prazosina, isoprenalina, que se utilizan principalmente para el tratamiento de la tensión arterial alta, la frecuencia cardíaca lenta o el asma).
- glucósidos cardíacos (p. ej., digoxina), usados para el tratamiento de problemas de corazón.
- medicamentos para reducir la tensión arterial como los beta-bloqueantes o los bloqueantes de canales de calcio (p.ej., propanolol, amlodipino)
Si cualquiera de lo arriba mencionado es aplicable en su caso, o si usted no está seguro, hable con su médico.
Uso de Mirvaso con alcohol
Informe a su médico si consume alcohol regularmente, ya que esto podría afectar a su tratamiento con este medicamento.
Embarazo y lactancia
No se recomienda el uso de Mirvaso durante el embarazo, ya que se desconocen sus efectos para el feto. No debe utilizar este medicamento durante la lactancia.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
Conducción y uso de máquinas
La influencia de Mirvaso sobre la capacidad para conducir y utilizar máquinas es insignificante. Mirvaso contiene
- parahidroxibenzoato de metilo, que puede causar reacciones alérgicas (posiblemente retardadas).
- Propilenglicol, que puede causar irritación cutánea.
3. Cómo usar Mirvaso
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Importante: Mirvaso está indicado para adultos y solo para utilizar en la piel de la cara. No utilice este medicamento en otra parte de su cuerpo, especialmente en superficies húmedas del cuerpo, p.ej., los ojos, boca, nariz o vagina.
No ingerir.
Mantenga Mirvaso fuera del alcance de los niños.
Se recomienda aplicar Mirvaso en la cara solo una vez al día. Debe aplicar una pequeña cantidad de gel, del tamaño de un guisante, en frente, barbilla, nariz y ambas mejillas, y luego extender de forma suave y uniforme una fina capa en cada área. No se debe exceder la dosis total diaria recomendada (5 cantidades del tamaño de un guisante). Debe evitar los ojos, los párpados, los labios, la boca y el interior de las fosas nasales. Si aplica el producto en estas zonas, lávelas inmediatamente con abundante agua. Si experimenta empeoramiento del enrojecimiento o sensación de ardor en la piel, deje de utilizar Mirvaso y póngase en contacto con su médico si es necesario.
No aplique ningún otro medicamento para la piel, ni cosméticos inmediatamente antes de la aplicación diaria de Mirvaso.
Debe utilizar estos productos sólo tras la aplicación de Mirvaso, una vez que éste se haya secado.
Debe lavarse las manos inmediatamente después de la aplicación de este medicamento.
[EU/1/13/904/001-003]
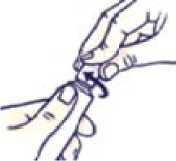
Cómo abrir el tubo con tapón a prueba de niños
No apriete el tubo al abrirlo o cerrarlo para evitar que se derrame.
Presione el tapón y gírelo en sentido contrario al de las agujas del reloj (gírelo un cuarto de vuelta a la izquierda). Después retire el tapón.
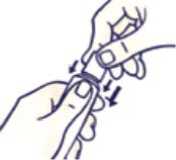
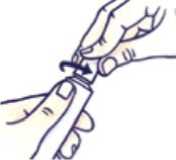
Cómo cerrar el tubo con tapón a prueba de niños
Haga coincidir las muescas del tapón y del tubo. Presione y gire en el sentido de las agujas del reloj (gire un cuarto de vuelta a la derecha).
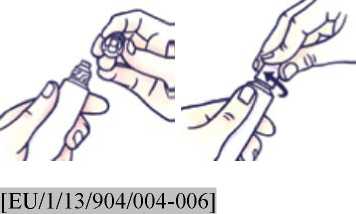
Cómo abrir el tubo con tapón a prueba de niños
No apriete el tubo al abrirlo o cerrarlo para evitar que se derrame.
Presione el tapón y gírelo en sentido contrario al de las agujas del reloj (gírelo a la izquierda). Después retire el tapón.

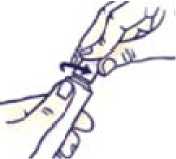
Cómo cerrar el tubo con tapón a prueba de niños
Presione y gire en el sentido de las agujas del reloj (gire a la derecha).
Si usa más Mirvaso del que debe
Si utiliza una cantidad mayor que la dosis diaria recomendada en un periodo de 24 horas, esto podría provocar irritación cutánea u otros efectos adversos en el lugar de aplicación. Las dosis repetidas en un mismo periodo de 24 horas podrían causar efectos adversos, tales como tensión arterial baja, adormecimiento o somnolencia.
Póngase en contacto con su médico, quien le aconsejará que acción tomar.
Si alguna persona, especialmente un niño, ingiere accidentalmente Mirvaso, podría presentar efectos adversos graves y necesitar tratamiento en un hospital.
Consulte a su médico de inmedianto o acuda en seguida al servicio de urgencias del hospital si usted, un niño u otra persona ingieren este medicamento y presentan alguno de estos síntomas: sensación de mareo por tensión arterial baja, vómitos, cansancio o somnolencia, latidos cardiacos lentos o irregulares, contracción de las pupilas, dificultad o frecuencia respiratoria baja, flojedad, temperatura corporal baja y convulsiones. Lleve consigo el envase del medicamento para que el médico pueda saber lo que se ha ingerido.
Si olvidó usar Mirvaso
Mirvaso actúa a diario, comenzando el primer día de tratamiento. Si se olvida una dosis diaria, el enrojecimiento no disminuirá ese día. No se aplique una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Mirvaso
Por favor pregunte a su médico antes de interrumpir el tratamiento.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si presenta una irritación intensa o alergia de contacto (p. ej., reacción alérgica, erupción), efectos adversos poco frecuentes, deje de utilizar Mirvaso y acuda al médico. En algunos casos, los síntomas se pueden extender más allá del área de tratamiento.
Mirvaso puede también causar los siguientes efectos adversos:
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas):
- rubefacción
- enrojecimiento de la piel, sensación de ardor en la piel o picor
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- acné
- congestión nasal
- dolor de cabeza
- empeoramiento de la rosácea
- erupción cutánea, dolor o molestias cutáneas, irritación o inflamación cutáneas, sensación de calor en la piel, sequedad de piel, hormigueo o sensación de pinchazos y cosquilleos
- hinchazón de los párpados
- inflamación cutánea
- sensación de calor
- sensación de frío en las manos y los pies
- sequedad de boca
- urticaria
Efectos adversos raros (pueden afectar hasta 1 de cada 1.000 personas):
- angioedema (reacción alérgica grave que cursa normalmente con hinchazón de la cara, boca o lengua). Si esto ocurre, suspenda el tratamiento.
- hipotensión (presión arterial disminuida), mareo
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Mirvaso
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en el tubo después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
No congelar.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de Mirvaso
- El principio activo es brimonidina. Un gramo de gel contiene 3,3 mg de brimonidina, equivalentes a 5 mg de tartrato de brimonidina.
- Los demás componentes son carbómero, parahidroxibenzoato de metilo (E218), fenoxietanol, glicerol, dióxido de titanio, propilenglicol, hidróxido de sodio, agua purificada. Ver al final de la sección 2 información relativa al metilparahidroxibenzoato y el propilenglicol.
Aspecto del producto y contenido del envase
Mirvaso es un gel opaco entre blanco y amarillo claro. Se presenta en tubos con 2, 10 o 30 gramos de gel.
Envase con 1 tubo.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la Autorización de comercialización Galderma International
Tour Europlaza, 20 avenue André Prothin - La Défense 4
La Défense Cedex 92927
Francia
Responsable de la fabricación Laboratoires Galderma Z.I. Montdésir 74540 Alby-sur-Chéran Francia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Ceská republika Slovenská republika
Galderma-Spirig Ceská a Slovenská republika a.s. Tel: +421 2 49 10 90 10 e-mail: czsk@galderma.com
Osterreich
Galderma Austria GmbH Tel: 0043 732 715 993 e-mail: austria@galderma.com
Belgie/Belgique/Belgien
Luxembourg/Luxemburg
Galderma Benelux BV Tél/Tel: +31 183691919 e-mail: info.be@galderma.com
Etarapna
EaaHa OapM OOfl Co$hh, ya.“naaHKOBH^“9, eT.3 Tea.: + 359 2 962 15 26 e-mail: office@elanapharm.com
Latvija
H. Abbe Pharma GmbH Tel: +371/67/103205 e-mail: birojs.habbe@apollo.lv
Lietuva
H. Abbe Pharma GmbH atstovybé Tel: +370/52/711710 e-mail: info@abbepharma.lt
Magyarország
Ewopharma Hungary Kft. Képviselete Tel.: +36 1 200 4650 e-mail: info@ewopharma.hu
|
Danmark Norge Ísland Suomi/Finland Sverige Galderma Nordic AB Tlf/Sími/Puh/Tel: + 46 18 444 0330 e-mail: nordic@galderma.com |
Malta Collis Williams Limited Tel: + 356 21244847, 21224104 e-mail: info@colliswilliams.com |
|
Deutschland Galderma Laboratorium GmbH Tel: + 49 (0) 800 - 5888850 e-mail: patientenservice@galderma. com |
Nederland Galderma Benelux BV Tel: + 31 183691919 e-mail: info.nl@galderma.com |
|
Eesti H. Abbe Pharma GmbH Tel: + 372/6/460980 e-mail: info@habbepharma.ee |
Polska Galderma Polska Sp. z o.o. Tel.: + 48 22 331 21 80 e-mail: info.poland@galderma.com |
|
ELLáóa Kúnpoq Galderma ETAág A.E. T^: + 30 210 81 04 190 e-mail: galderma.hellas@galderma.com |
Portugal Laboratorios Galderma, SA - Sucursal em Portugal Tel: + 351 21 315 19 40 e-mail: galderma.portugal@galderma.com |
|
España Laboratorios Galderma SA Tel: + 34 902 02 75 95 e-mail: Regulatory Spain@galderma.com |
Romania NEOLA PHARMA Tel: + 40 21 233 17 81 e-mail: office@neolapharma.ro |
|
France Galderma International Tél: + 33 (0)8 20 20 45 46 |
Slovenija Medical Intertrade d.o.o. T: +386 1 2529 113 F: +386 1 2529 114 e-mail: info@medical-intertrade.si |
|
Hrvatska Medical Intertrade d.o.o. T: +385 1 333 6036 |
United Kingdom Ireland Galderma (UK) Ltd. Tel: + 44 (0) 1923 208950 |
Fecha de la última revisión de este prospecto:XX/XXXX
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
ANEXO IV
CONCLUSIONES CIENTÍFICAS Y MOTIVOS POR LOS QUE SE RECOMIENDA LA MODIFICACIÓN DE LAS CONDICIONES DE LAS AUTORIZACIONES DE
COMERCIALIZACIÓN
Conclusiones científicas
Teniendo en cuenta lo dispuesto en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre los informes periódicos de seguridad (IPSs) para la brimonidina (solo el medicamento autorizado mediante el procedimiento centralizado), las conclusiones científicas del Comité de Medicamentos de Uso Humano (CHMP) son las siguientes:
Efectos hemodinámicos
Aunque no se han detectado nuevos casos durante el intervalo de notificación, se ha facilitado más información sobre algunos de los casos detectados con anterioridad. Puesto que existen al menos tres casos con una reexposición implícita claramente indicativa de un efecto hemodinámico (en especial de hipotensión y síntomas relacionados) asociado a la aplicación de Mirvaso, así como otros casos indicativos, se considera que existen suficientes indicios para justificar una actualización de la información del producto con el fin de informar a los prescriptores y los pacientes del riesgo de efectos hemodinámicos con la aplicación de Mirvaso.
Angioedema
Durante el periodo de notificación vigente dos pacientes refirieron hinchazón de la cara/lengua en asociación con otros síntomas indicativos de una reacción alérgica sistémica. Durante el periodo de notificación anterior, 4 casos que cursaron con inflamación de los labios y/o la lengua, opresión en la garganta o el pecho, o dificultad para respirar se consideraron indicativos de angioedema. Aunque el término «angioedema» no se mencionó específicamente en ninguno de los casos, el PRAC consideró que la existencia de una relación causal entre Mirvaso y el acontecimiento adverso es, al menos, una posibilidad razonable. Hasta el momento existe un total acumulado de 6 casos con características claramente indicativas de angioedema.
Por tanto, en vista de los datos disponibles relativos a los efectos hemodinámicos y el angioedema, el PRAC considera que se justifican los cambios en la información del producto.
El CHMP está de acuerdo con las conclusiones científicas realizadas por el PRAC.
Motivos por los que se recomienda la modificación de las condiciones de la Autorización de Comercialización
De acuerdo con las conclusiones científicas para el principio activo brimonidina (solo el medicamento autorizado mediante el procedimiento centralizado), el CHMP considera que el balance beneficio-riesgo del medicamento o medicamentos que contiene(n) dicho principio activo (solo el medicamento autorizado mediante el procedimiento centralizado) es favorable sujeto a los cambios propuestos en la información del producto.
El CHMP recomienda que se modifiquen las condiciones de la Autorización de Comercialización.
30