Minoxidil Viñas 50 Mg/Ml Solucion Cutanea
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
MINOXIDIL VIÑAS 50 mg/ml solución cutánea
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de solución contiene 50 mg de Minoxidil
Excipientes: propilenglicol 520 mg/ml
Para consultar la lista completa de excipientes ver sección 6.1
3. FORMA FARMACÉUTICA
Solución cutánea.
La solución es transparente, incolora o muy débilmente amarillenta.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Minoxidil Viñas está indicado en el tratamiento de la alopecia androgenética de intensidad moderada.
4.2 Posología y forma de administración Posología
Solo para uso cutáneo.
La dosis diaria recomendada es de 1 ml cada 12 horas (lo que se corresponde con 6 pulverizaciones 2 veces al día), aplicada en el cuero cabelludo empezando por el centro de la zona a tratar.
Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
La dosis diaria máxima recomendada es de 2 ml.
POBLACIÓN PEDIÁTRICA
No se recomienda el uso de minoxidil en este grupo de edad dado que no se han realizado estudios en esta población.
PACIENTES DE EDAD AVANZADA
No se recomienda el uso de minoxidil en este grupo de edad dado que no se han realizado estudios en esta población.
Forma de administración
Aplicar sobre el cuero cabelludo perfectamente seco empezando por el centro de la zona a tratar. No aplicar minoxidil en otras zonas del cuerpo.
Tanto el inicio como el grado de respuesta al tratamiento con minoxidil es individualizada para cada paciente, por ello puede ser necesario un tratamiento previo de 4 meses antes de que existan indicios de crecimiento del pelo.
Cuando se interrumpe el tratamiento con minoxidil el crecimiento puede cesar y volver al estado inicial de alopecia en 3-4 meses.
Se recomienda el lavado de manos con agua abundante tras la aplicación de minoxidil.
La forma de aplicación variará según la zona a tratar y el sistema de aplicador.
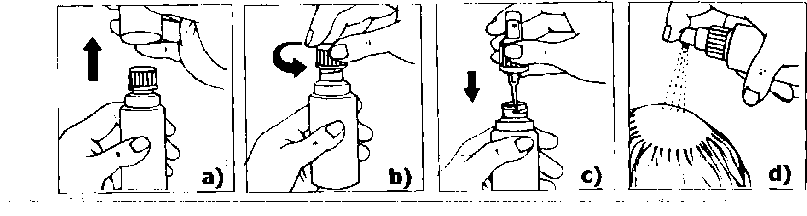
Tratamiento de superficies amplias del cuero cabelludo: se utilizará el aplicador con bomba pulverizadora y dosificadora.
a) Quitar el capuchón transparente más externo.
b) Retirar y desechar el tapón interior.
c) Colocar el pulverizador dentro del frasco y enroscarlo firmemente. Quitar el pequeño capuchón transparente.
d) Dirigir el orificio de salida del pulverizador hacia el centro de la zona a tratar. Pulsar una sola vez y extender la solución por toda la zona con la punta de los dedos. Efectuar 5 pulsaciones más (total 6) repitiendo cada vez la misma operación. Tras las 6 pulsaciones se habrá aplicado la dosis de 1 ml.
Después de utilizar el frasco, vuelva a taparlo con el capuchón transparente externo.
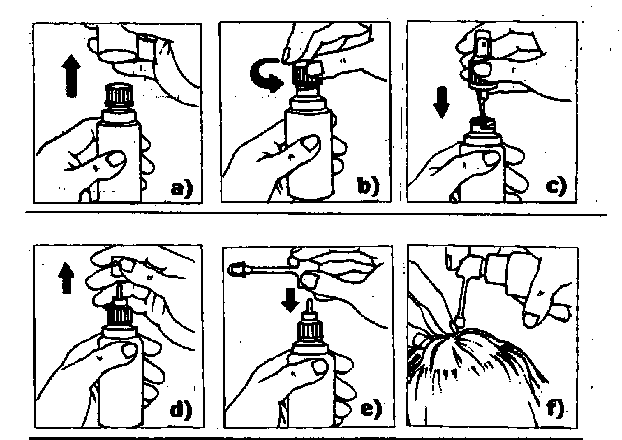
Tratamiento de pequeñas superficies o por debajo del cabello: se utilizará el aplicador con cánula y boquilla.
a) Quitar el capuchón transparente más externo.
b) Retirar y desechar el tapón interior.
c) Colocar el pulverizador dentro del frasco y enroscarlo firmemente. Quitar el pequeño capuchón transparente.
d) Tirar hacia arriba para retirar la cabeza del pulverizador.
e) Insertar la boquilla de la cánula en el extremo sin cabeza del pulverizador y presionar firmemente.
f) Dirigir la cánula hacia el centro de la superficie a tratar o bajo los cabellos, pulsar una sola vez y extender la solución con la punta de los dedos. Efectuar 5 pulsaciones más (total 6),
repitiendo cada vez la misma operación. Tras las 6 pulsaciones se habrá aplicado la dosis de 1 ml.
Evitar la inhalación del producto durante su aplicación.
4.3 Contraindicaciones
Hipersensibilidad al minoxidil, o a alguno de los excipientes.
4.4 Advertencias y precauciones especiales de empleo
• En pacientes con dermatosis o lesiones cutáneas de cuero cabelludo puede producirse una mayor absorción percutánea del principio activo, por lo que deberá asegurarse que éstas no existen antes de su aplicación.
• Previamente a su aplicación será necesaria la realización de una historia clínica y una exploración física completa.
• Aunque los estudios realizados con minoxidil no han demostrado una absorción sistémica importante, existe la posibilidad de que se produzca una pequeña absorción local a través del cuero cabelludo por lo que se recomienda una monitorización regular de la tensión arterial y de la frecuencia cardiaca en pacientes que presenten algún problema cardiaco o cardiovascular como: coronariopatías, insuficiencia cardiaca congestiva y/o valvulopatías, riesgo potencial de retención hidrosalina, edema local y generalizado, efusión pericárdica, pericarditis, taponamiento cardíaco, taquicardia, angina.
• Si aparecieran efectos sistémicos o alteraciones dermatológicas severas el tratamiento deberá ser interrumpido.
• En la mujer existe la posibilidad de aparición de hipertricosis en otras zonas corporales.
• Se debe evitar el contacto con los ojos. En caso de contacto accidental con superficies sensibles se recomienda el lavado de las mismas con abundante agua.
Advertencias sobre excipientes
Este medicamento puede producir irritación de la piel porque contiene propilenglicol.
Se han notificado varios casos de dermatitis de contacto debidas al propilenglicol, vehículo de este
preparado.
4.5 Interacción con otros medicamentos y otras formas de interacción
• Si bien no ha sido clínicamente demostrado, existe la posibilidad de que minoxidil incremente el riesgo de hipotensión ortostática en pacientes en tratamiento concomitante con vasodilatadores periféricos y fármacos antihipertensivos como guanetidina y derivados (véase apartado 4.4 Advertencias y precauciones especiales de empleo).
• No deberá aplicarse concomitantemente con otros productos tópicos tales como corticoides, retinoides o pomadas oclusivas ya que pueden aumentar su absorción.
4.6 Fertilidad, embarazo y lactancia
Los estudios realizados en animales no han demostrado un efecto nocivo en el embarazo, desarrollo embrionario/fetal, parto o durante el desarrollo postnatal (véase apartado 5.3. Datos preclínicos sobre seguridad).
No existen datos clínicos disponibles sobre la exposición de mujeres embarazadas a minoxidil por lo que no se recomienda su uso durante el embarazo.
Debido a que el minoxidil administrado por vía oral se excreta en la leche materna, no se recomienda su uso durante el periodo de lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No existen datos que sugieran que minoxidil ejerce alguna influencia sobre la capacidad de conducir vehículos o de utilizar maquinaria en los pacientes en tratamiento con este principio activo.
4.8 Reacciones adversas
Las reacciones adversas más frecuentemente notificadas son de naturaleza dermatológica (prurito, dermatitis, sequedad, irritación cutánea, eccema, hipertricosis), generalmente de intensidades leve-moderadas y reversibles al suspender el tratamiento. Estos efectos adversos pueden depender de la dosis de minoxidil administrada (prurito, sequedad, irritación, eccema) así como de la forma de administración (hipertricosis).
La incidencia de las reacciones adversas se ha calculado a partir de los datos obtenidos en 1.932 pacientes que recibieron tratamiento con minoxidil, así como de los datos obtenidos después de su comercialización.
Las reacciones adversas están clasificadas por órganos y sistemas y según su frecuencia:
Frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000) y muy raras (< 1/10.000).
|
Trastornos del sistema nervioso Poco frecuentes (>1/1.000 a <1/100) |
Cefaleas, parestesias |
|
Trastornos oculares Muy raras (<1/10.000) |
Lagrimeo alterado |
|
Trastornos cardiacos Poco frecuentes (>1/1.000 a <1/100) |
Taquicardia, palpitaciones, hipotensión |
|
Trastornos de la piel y del tejido subcutáneo Frecuentes (>1/100 a <1/10) |
Prurito, irritación cutánea local, dermatitis de contacto, sequedad cutánea, exfoliación cutánea |
|
Poco frecuentes (>1/1.000 a <1/100) Raras (>1/10.000 a <1/1.000) |
Rash eritematoso, eccema, alopecia, hipertricosis Rash pustular, acné |
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
La sobredosis accidental o voluntaria tras la aplicación tópica de minoxidil producirá un aumento en la intensidad de las reacciones adversas dermatológicas, especialmente prurito, sequedad, irritación cutánea y eccema. Asimismo, la absorción sistémica será mayor, con el consiguiente incremento en la probabilidad de sufrir efectos sistémicos.
Los signos y síntomas tras la ingestión oral accidental o voluntaria de minoxidil son como consecuencia de la rápida y casi completa absorción que de este principio activo se produce a nivel del tracto gastrointestinal. Entre estos signos y síntomas están hipotensión, taquicardia, retención hidrosalina con aparición de edemas, derrame pleural o fallo cardiaco congestivo. El tratamiento del cuadro desarrollado requiere el empleo de diuréticos para el edema, beta-bloqueantes u otros inhibidores del sistema nervioso simpático para la taquicardia y cloruro sódico en solución isotónica intravenosa para la hipotensión. Simpaticomiméticos, como adrenalina y noradrenalina, deben evitarse por la sobre-estimulación cardiaca que producen.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros productos dermatológicos Código ATC: D11AX01 - Minoxidil
Minoxidil (2,4 - diamino-6-piperidinopirimidina-3-óxido) cuando se administra por vía oral es un vasodilatador actuando directamente sobre las células de músculo liso vascular, ocasionando una disminución de las resistencias vasculares periféricas y reduciendo la presión arterial, tanto sistólica como diastólica, aún en pacientes con hipertensión severa o refractaria. Su efecto hipotensor se asocia con incremento de la frecuencia cardíaca.
Minoxidil aplicado tópicamente tiene efecto antialopécico. La documentación bibliográfica existente pone de manifiesto que minoxidil estimula el crecimiento de queratinocitos in vitro e in vivo junto con el crecimiento del pelo en algunos pacientes con alopecia androgenética. La aparición de este fenómeno tiene lugar tras la utilización de este producto durante un tiempo no inferior a 4 meses, y varía en función de cada paciente, aunque su mecanismo de acción no está completamente dilucidado.
Cuando se interrumpe el tratamiento con minoxidil, el crecimiento puede cesar y volver al estado inicial de alopecia en 3-4 meses.
5.2 Propiedades farmacocinéticas
Absorción
Tras su aplicación tópica minoxidil 5% presenta una mínima absorción, solo una cantidad media de 1,7% (0,3-4,5%) de la dosis aplicada, pasaría a la circulación general.
Por encima de dosis comprendidas entre 2,4-5,4 mg/día se podría prever algún efecto sistémico. Esta dosis podría alcanzarse si se realizase una aplicación de minoxidil en toda la superficie del cuero cabelludo sin limitarse a la placa alopécica.
A modo de comparación, la administración por vía oral de comprimidos de minoxidil, para el tratamiento de ciertos tipos de hipertensión, determina su completa absorción a nivel del tracto gastrointestinal. Una dosis de 1 ml en forma de solución, que corresponde a una aplicación cutánea de 50 mg de minoxidil, produce una absorción de 0,85 mg de minoxidil.
La modificación de su absorción en afecciones dérmicas concomitantes no ha sido determinada.
Metabolismo o Biotransformación
La concentración sérica de minoxidil tras su aplicación tópica está en función de su grado de absorción percutánea.
Eliminación
La vida media de eliminación del 95% del minoxidil absorbido, tras su aplicación tópica, es de 96 h (cuatro días). Tanto minoxidil como su metabolito se excretan principalmente en orina.
En un estudio en voluntarios sanos en el que el minoxidil fue marcado radiactivamente se observaron unos niveles bajos en orina, con unos valores medios entre 1.6-3.9% de la dosis aplicada. No se observaron niveles de minoxidil en heces.
La cantidad de minoxidil recuperado en la superficie cutánea del cuero cabelludo osciló entre el 41%-45% de la dosis aplicada.
5.3 Datos preclínicos sobre seguridad
La administración de minoxidil en los estudios de toxicidad con animales a dosis elevadas no se asoció con toxicidad en ningún órgano principal. Las dosis a las cuales se manifiesta toxicidad son muy elevadas en comparación con las dosis y los niveles plasmáticos que pueden alcanzarse tras su administración tópica. Minoxidil no resultó ni mutagénico ni genotóxico. Tampoco mostró potencial carcinogénico.
La administración de minoxidil en los estudios sobre función reproductora, toxicidad embrio/fetal y perinatal en animales, no demostró toxicidad en ninguno de los parámetros estudiados.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Propilenglicol, etanol al 96% y agua purificada.
6.2 Incompatibilidades No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30 °C.
6.5 Naturaleza y contenido del envase
Se presenta en envases de 60 ml de solución, 120 ml (2 frascos de 60 ml), 180 ml (3 frascos de 60 ml) y 240 ml (2 frascos de 120 ml), provistos de bomba pulverizadora y dosificadora, y una cánula con boquilla para aplicación localizada.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratorios Viñas, S.A.
Provenza, 386 08025 - Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN 66954
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN 1 de septiembre 2005
10. FECHA DE LA REVISIÓN DEL TEXTO Noviembre 2011
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
7 de 7