Mibi Institute Of Atomic Energy 1 Mg Equipo De Reactivos Para Preparacion Radiofarmaceutica Efg
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
MIBI Institute of Atomic Energy 1 mg equipo de reactivos para preparación radiofarmacéutica EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene 1 mg de tetrafluoroborato de [Tetrakis (2-metoxi-isobutil-isonitrilo) cobre(I)]
Para reconstituir con solución inyectable de pertecnetato (99mTc) de sodio El radionucleido no forma parte del equipo de reactivos.
Excipientes:
Cada vial contiene 0,009 mmol (0,2 mg) de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Equipo de reactivos para preparación radiofarmacéutica El producto es un polvo liofilizado blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Este medicamento es únicamente para uso diagnóstico.
Después de la reconstitución y marcaje con solución inyectable de pertecnetato (99mTc) de sodio , la solución de tecnecio (99mTc) sestamibi obtenida tiene las siguientes indicaciones:
- Gammagrafía miocárdica de perfusión para la detección y localización de la enfermedad arterial coronaria e infarto de miocardio.
- Evaluación de la función ventricular global (tomogammagrafía sincronizada [gated SPECT] con el ECG para la evaluación de la fracción de ejección, volúmenes y la motilidad regional de la pared del ventrículo izquierdo).
- Mamogammagrafía isotópica para la detección del cáncer de mama: Detección del cáncer de mama cuando la mamografía es no concluyente, insuficiente o indeterminada.
Localización de tejido paratiroideo hiperfuncionante en pacientes con hiperparatiroidismo recurrente o persistente, y en pacientes programados a cirugía de las glándulas paratiroides.
4.2 Posología y forma de administración
Para uso intravenoso tras reconstitución y marcaje con solución inyectable de pertecnetato (99mTc) de sodio (que no se incluye en este equipo de reactivos).
Para consultar las instrucciones para la preparación y el control de la pureza radioquímica del radiofármaco, ver sección 12.
Para consultar la preparación del paciente, ver sección 4.4.
Posología Pauta posológica
Adultos, incluidos _pacientes de edad avanzada (mayor de 65 años de edad) :
El intervalo de dosis recomendadas para administración intravenosa a un paciente de peso medio (70 kg) es la siguiente:
Gammagrafía miocárdica de perfusión para la detección y localización de la enfermedad arterial coronaria e infarto de miocardio:
400 - 900 MBq
Evaluación de la función ventricular global:
600 - 800 MBq inyectados en bolo.
Para obtención de imágenes de la mama:
740 a 925 MBq inyectados en bolo, en el brazo opuesto a la lesion
Para la obtención de imágenes de las paratiroides:
200 a 750 MBq inyectados en bolo
Población_pediátrica (menor de 18 años de edad):
Se ha de sopesar con cuidado el uso en la población pediátrica, teniendo en cuenta las necesidades clínicas y valorando la relación riesgo/beneficio en este grupo de pacientes. No se han establecido completamente la seguridad y la eficacia en población pediátrica menores de 18 años.
Las dosis de radiactividad a administrar a pacientes pediátricos deberán modificarse de acuerdo con las recomendaciones del Grupo de Trabajo de Pediatría de la EANM (1990).
Debe administrarse una fracción de la actividad recomendada para los adultos en función del peso corporal, utilizando los siguientes coeficientes:
52-54 kg = 0,90 56-58 kg = 0,92 60-62 kg = 0,96 64-66 kg = 0,98 68 kg = 0,99
3 kg = 0,10 12 kg = 0,32 22 kg = 0,50 32 kg = 0,62 42 kg = 0,78
4 kg = 0,14 14 kg = 0,36 24 kg = 0,53 34 kg = 0,64 44 kg = 0,80
6 kg = 0,19 16 kg = 0,40 26 kg = 0,56 36 kg = 0,66 46 kg = 0,82
8 kg = 0,23 18 kg = 0,44 28 kg = 0,58 38 kg = 0,68 48 kg = 0,85
10 kg = 0,27 20 kg = 0,46 30 kg = 0,60 40 kg = 0,70 50 kg = 0,88
Pacientes con insuficiencia hepática:
La selección de la dosis para pacientes con disminución de la función hepática debe realizarse en general con cautela y empezando habitualmente en el extremo inferior del intervalo de dosis.
Pacientes con insuficiencia renal:
La exposición a la radiación ionizante puede verse aumentada en caso de fallo renal. Eso debe tenerse en cuenta al calcular la actividad que se va a administrar.
Forma de administración
Método de administración de MIBI Institute of Atomic Energy y exploración gammagráfica:
Para el diagnóstico de cardiopatía isquémica se requieren dos inyecciones (en condiciones de esfuerzo y en reposo) con el fin de poder diferenciar entre la disminución de la captación miocárdica de carácter transitorio o persistente. Para el protocolo de esfuerzo/reposo de dos días, entre 600 y 900 MBq por estudio inyectando una dosis en reposo y otra dosis tras ejercicio, en dos días diferentes, pero sin superar una dosis total de 1.800 MBq. Para el protocolo de un día, entre 400 y 500 MBq para la primera inyección y entre 1.200 y 1.500 MBq para la segunda, pero sin superar una dosis total de 2.000 MBq. El protocolo de un día se puede realizar en cualquier orden (esfuerzo/reposo o reposo/esfuerzo) pero las dos inyecciones deben ser administradas con al menos dos horas de separación entre sí (para permitir el decaimiento físico del tecnecio (99mTc) de la primera inyección) y tras el esfuerzo se debería instar al paciente a continuar con el mismo durante un minuto más (dentro de lo posible).
Para el diagnóstico de infarto de miocardio suele ser suficiente con una inyección en reposo.
La dosis de radiación administrada debe ser la mínima posible en función del objetivo médico esperado.
Debe justificarse cualquier inyección de actividades mayores a los NRD (niveles de referencia diagnósticos).
La gammagrafía debe comenzar aproximadamente 60 minutos después de la inyección con el fin de permitir el aclaramiento hepatobiliar. Se pueden demorar únicamente las imágenes tanto en reposo como tras esfuerzo obtenidas tras la administración de vasodilatadores por el riesgo de mayor actividad de subdiafragmática de tecnecio (99mTc). No existen evidencias de cambios significativos en la concentración o redistribución del trazador en el miocardio. Es por tanto posible adquirir las imágenes hasta pasadas 6 horas después de la inyección. La prueba se puede realizar según un protocolo de un día o dos días.
Para el diagnóstico de cardiopatía isquémica e infarto de miocardio se pueden realizar imágenes planares o tomográficas. Ambas pueden estar sincronizadas con el ECG.
Para la obtención de imágenes planares se deberían utilizar las tres proyecciones planares estándar (anterior, OAI (oblicua anterior izquierda) 45°, OAI 70° o LI (lateral izquierda)) (p.ej. 5-10 minutos cada una).
Las imágenes tomográficas se deben obtener, dependiendo de la dosis inyectada, durante aproximadamente 20-40 segundos.
Para la valoración de la función ventricular global se pueden utilizar las mismas técnicas y proyecciones estándar establecidas para estudios de fracción de eyección de primer paso con pertecnetato de tecnecio (99mTc); los datos se deben adquirir en modo lista o en modo trama rápida de imágenes ("frame mode") en un ordenador con una gammacámara de alta tasa de contaje. Se pueden utilizar protocolos de tomogammagrafía sincronizada (gated SPECT) con el ECG para la valoración de la motilidad regional de la pared ventricular; no obstante, en ese caso la interpretación de las imágenes debe ser exclusivamente visual salvo que se disponga de un programa informático específico para la evaluación de tales imágenes.
Obtención de imágenes de la mama
La obtención de imágenes de la mama se inicia óptimamente 5 a 10 minutos después de la inyección, con la paciente en posición prona, con la mama pendiente libremente. Debe obtenerse una imagen lateral, durante 10 minutos, de la mama sospechosa de estar afectada de cáncer, con la parte frontal de la cámara lo más cerca posible de la mama.
A continuación, deberá cambiarse la posición de la paciente, para que la otra mama quede pendiente, y debe obtenerse una imagen lateral de la misma. Luego, puede obtenerse una imagen en posición supina anterior, con los brazos de la paciente detrás de la cabeza.
Obtención de imágenes de las glándulas paratiroides:
La obtención de imágenes de las glándulas paratiroides depende de si se emplea una técnica de sustracción o de lavado. Para la técnica de sustracción puede emplearse iodo (123I) o tecnecio (99mTc), y debe efectuarse según la bibliografía, las guías y las actividades recomendadas.
Si se emplea una técnica de doble fase, se inyectan 370 a 740 MBq de Tecnecio (99mTc) sestamibi, y la primera imagen del cuello y del tórax se obtiene 10 minutos después. Después de un periodo de lavado de una a dos horas, se obtienen de nuevo imágenes del cuello y del tórax.
Las imágenes planares pueden complementarse mediante SPECT o SPECT/TAC precoces y tardías.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes.
4.4 Advertencias y precauciones especiales de empleo
Embarazo: ver sección 4.6
Población pediátrica (menor de 18 años de edad) : ver sección 4.2
Se deben considerar especialmente técnicas alternativas que no impliquen radiación ionizante.
Indicación de la exploración
Para todos los pacientes, la exposición a la radiación ionizante debe estar justificada en función del objetivo médico esperado, obtenido con la mínima dosis posible de radiación recibida por el paciente.
En pacientes con disminución de la función renal: es posible que la exposición a la radiación sea mayor en estos pacientes.
Preparación del paciente
Este producto debe administrarse a los pacientes suficientemente hidratados.
Para reducir la exposición de la vejiga a la radiación se debe pedir a los pacientes que ingieran suficiente cantidad de líquido y que vacíen la vejiga con frecuencia.
Gammagrafía miocárdica de perfusión: Si es posible, los pacientes deben ayunar durante al menos cuatro horas antes de la realización del estudio. Se recomienda que después de cada inyección y previamente a la adquisición de las imágenes los pacientes ingieran una comida ligeramente grasa o beban uno o dos vasos de leche. Eso estimulará un aclaramiento hepatobiliar rápido del tecnecio (99mTc) sestamibi visualizando menor actividad hepática en la imagen.
Para la prueba de esfuerzo es necesario tener en consideración las contraindicaciones y precauciones generales de la ergometría y la prueba de estrés farmacológico.
Si se produce alguna reacción de hipersensibilidad, debe interrumpirse inmediatamente la administración del medicamento y, si fuera necesario, iniciarse el tratamiento apropiado por vía intravenosa. Se debe disponer de los medicamentos y equipos oportunos (p.ej. tubo endotraqueal y respirador) fácilmente accesibles.
Advertencias generales
Los radiofármacos deben ser recibidos, utilizados y administrados exclusivamente por personal cualificado, que esté debidamente autorizado para el uso y manipulación de radionucleidos, en centros asistenciales autorizados. Su recepción, almacenamiento, uso, transporte y eliminación están sujetos a las normas y/o licencias correspondientes de los organismos oficiales competentes.
Los radiofármacos destinados a la administración a pacientes deben ser preparados por el usuario de manera que cumplan tanto los requisitos de seguridad radiológica como de calidad farmacéutica. Se deben tomar las precauciones asépticas apropiadas de acuerdo con las Normas de Correcta Fabricación y Uso de Radiofármacos.
El contenido del vial está previsto exclusivamente para uso en la preparación de tecnecio (99mTc) sestamibi y no debe administrarse directamente al paciente sin haber seguido antes el procedimiento de preparación.

Debe evitarse estrictamente la extravasación del radiofármaco durante la inyección por el potencial daño tisular.
Advertencias para obtención de imágenes de la mama
Utilizando detectores estándar, no se ha descrito ninguna lesión de < 5 mm.
Advertencias relacionadas con los excipientes
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, esto es, está esencialmente "libre de sodio".
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones. No obstante, los medicamentos que afectan a la función y/o el flujo sanguíneo miocárdicos pueden originar resultados falsos negativos en el diagnóstico de la enfermedad arterial coronaria. Por esa razón, debe tenerse en cuenta la medicación concomitante cuando se interpretan los resultados de la exploración gammagráfica.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil:
Cuando sea necesario administrar radiofármacos a mujeres en edad fértil, deben buscarse siempre indicios sobre un posible embarazo. Toda mujer que presente un retraso en la menstruación debe considerarse que está embarazada mientras no se demuestre lo contrario. En caso de duda, es fundamental que la exposición a la radiación sea la mínima necesaria para obtener la información clínica deseada. Debe considerarse la posibilidad de realizar técnicas alternativas que no impliquen el uso de radiaciones ionizantes.
Mujeres embarazadas
La dosis anticipada en el útero como consecuencia de una inyección en reposo de 740 MBq sería de 5,8 mGy. Una dosis de radiación superior a 0,5 mGy (aproximadamente equivalente a la exposición procedente de la radiación anual de fondo) podría dar lugar a riesgos para el feto; no está, por tanto, recomendada la administración de tecnecio (99mTc) sestamibi en mujeres embarazadas. Si se decide llevar a cabo el procedimiento en mujeres embarazadas, deberá prestarse especial atención a la optimización de la exposición, teniendo en cuenta tanto la exposición de la madre gestante como la del feto. No se debe superar una dosis fetal de 1 mGy. La disminución de la actividad administrada no debe afectar a la probabilidad de alcanzar un resultado diagnóstico.
Lactancia
Antes de administrar este radiofármaco a una madre que está amamantando a su hijo/a, debe considerarse la posibilidad de retrasar razonablemente la exploración hasta que la madre haya suspendido la lactancia y plantearse si se ha seleccionado el radiofármaco más adecuado, teniendo en cuenta la secreción de actividad en la leche materna. Si la administración durante la lactancia es inevitable, la lactancia debe suspenderse durante 24 horas tras la administración de este radiofármaco y desecharse la leche extraída durante ese periodo.
El contacto directo de la madre con el niño debe restringirse durante este período.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han descrito efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
La tabla siguiente recoge las frecuencias de ocurrencia a que se hace referencia en esta sección:
Muy frecuentes (>1/10)
Frecuentes (>1/100 a <1/10)
Poco frecuentes (>1/1.000 a <1/100) Raras (>1/10.000 a <1/1.000)
Muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Trastornos cardíacos
Poco frecuentes: Dolor torácico/angina de pecho, ECG anómalo.
Raros: Arritmia.
Trastornos del sistema nervioso:
Poco frecuentes: Cefalea.
Raros: Convulsiones (poco tiempo después de la administración), síncope.
Trastornos gastrointestinales:
Poco frecuentes: Náuseas.
Raros: Dolor abdominal.
Trastornos de la piel y del tejido subcutáneo:
Raros: Reacciones alérgicas en la piel o las mucosas con exantema (prurito, urticaria, edema), vasodilatación, reacciones locales en el lugar de inyección, sarpullido sin picazón, hipoestesia y parestesia, rubefacción.
Muy raros: Se han descrito otras reacciones de hipersensibilidad en pacientes predispuestos.
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles): Eritema multiforme.
Trastornos generales y alteraciones en el lugar de administración:
Frecuentes: Inmediatamente después de la inyección puede observarse un sabor metálico o amargo, parcialmente en combinación con sequedad bucal y la alteración del sentido del olfato.
Raros: Fiebre, fatiga, mareos, dolor transitorio de tipo artrítico, dispepsia.
Trastornos del sistema inmunológico:
Raros: Reacciones de hipersensibilidad severas tales como disnea, hipotensión, bradicardia, astenia y vómitos (habitualmente dentro de las dos horas siguientes a la administración), angioedema.
Otros trastornos:
La exposición a la radiación ionizante está vinculada a la inducción de cáncer y a la posibilidad de desarrollar defectos hereditarios. Como la mayoría de las exploraciones de Medicina Nuclear se realizan con bajos niveles de radiación, inferiores a 20 mSv, la probabilidad de que se produzcan estas reacciones es baja. Después de la administración de la máxima actividad recomendada de este producto de 2.000 MMBq, la dosis efectiva es de 18 mSv en reposo y 15,8 mSv tras el esfuerzo.
4.9 Sobredosis
En caso de administración accidental de una sobredosis de tecnecio (99mTc) sestamibi, la dosis de radiación recibida por el paciente debe reducirse aumentando la eliminación corporal del radionucleido, en la medida de lo posible, mediante diuresis forzada, vaciamiento frecuente de la vejiga y estimulación del tránsito gastrointestinal.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: radiofármacos para diagnóstico; compuestos marcados con tecnecio (99mTc), código ATC: V 09G A01
A las concentraciones químicas y actividades utilizadas para las exploraciones diagnósticas no parece que el tecnecio (99mTc) sestamibi tenga actividad farmacodinámica.
Tras la reconstitución y marcaje con solución inyectable de pertecnetato (99mTc) de sodio, Ph. Eur., se forma el siguiente complejo tecnecio (99mTc) sestamibi:
99m
Tc (MIBI)6+ Donde: MIBI = 2-metoxiisobutilisonitrilo.
El Tecnecio (9mTc) sestamibi, si se administra a las actividades habituales y de la manera habitual, no tiene efectos farmacodinámicos detectables clínicamente.
Consideraciones generales
El (99mTc) sestamibi, al ser un complejo catiónico lipofílico, penetra en las células atraído por los potenciales transmembrana negativos y se acumula en el compartimento celular de carga más negativa, las mitocondrias.
Este procedimiento depende principalmente de la vascularización tisular y el correspondiente flujo sanguíneo en relación con el tamaño del objetivo, la concentración extracelular de sestamibi y la actividad metabólica celular, principalmente representada por el número y la actividad de las mitocondrias.
La acumulación de sestamibi no permite en principio diferenciar entre tejidos malignos y benignos. No obstante, la comparación con hallazgos citológicos/histológicos indica que podría permitir distinguir entre lesiones con diferente metabolismo mitocondrial.
Aunque generalmente se supone que las células tumorales presentan potenciales de membrana intrínsecos elevados y una actividad mitocondrial aumentada, la captación celular de sestamibi se considera un procedimiento predominantemente inespecífico de la presencia de tumores.
En casos de multirresistencia a fármacos (MDR), se ha constatado un aumento de la salida de sestamibi correlacionado con la actividad y la sobreexpresión de la glicoproteína P. Eso podría tener utilidad pronóstica pero también dar lugar a resultados falsos negativos si no se tiene en cuenta.
Imágenes cardiacas
El tecnecio (99mTc) sestamibi se une a la membrana mitocondrial, y contar con un potencial de membrana mitocondrial intacta resulta importante para su unión intracelular.
La captación de tecnecio (99mTc) sestamibi en el miocardio es proporcional al flujo sanguíneo en el intervalo fisiológico de fluojo. La tasa de captación pasiva viene determinada por la permeabilidad de la membrana al fármaco y por el área superficial del lecho vascular al que está expuesto. Puesto que el radiotrazador entra en la célula mediante difusión, se infraestimará el flujo sanguíneo cuando el flujo sea elevado (>2,0 ml/g/minuto).
Para un flujo coronario entre 0,52 y 3,19 ml/g/minuto, se obtuvo un valor promedio de extracción miocárdica de tecnecio (99mTc) sestamibi de 0,38 +/- 0,09. El tecnecio (99mTc) sestamibi presente en la sangre se distribuye rápidamente en los tejidos. Cinco minutos después de la inyección, sólo en torno a un 8 por ciento de la dosis inyectada permanece aún en circulación.
El tecnecio (99mTc) sestamibi sufre una redistribución mínima en el transcurso del tiempo. Eso puede afectar a la detección de lesiones, ya que las diferencias en cuanto a lavado farmacológico entre miocardio normal y isquémico pueden traducirse en una disminución del tamaño o la gravedad del defecto en el transcurso del tiempo.
Indicación en mastología
Se ha demostrado que la concentración celular de tecnecio (99mTc) sestamibi está aumentada en tejidos tumorales mamarios, probablemente debido al alto contenido en mitocondrias de las células tumorales y el alto potencial de membrana de las células tumorales.
Varios estudios in vitro demostraron que el tecnecio (99mTc) sestamibi es sustrato de la glicoproteína P. Se ha establecido una correlación directa entre la expresión de la glicoproteína P y la eliminación de tecnecio (99mTc) sestamibi de tumores. La sobreexpresión celular de la glicoproteína P podría dar lugar a imágenes falsos negativos de tumores, especialmente de tumores mayores de 1 cm.
Adicionalmente, su captación en tejidos mamarios parece mostrar dependencia del ciclo reproductor femenino.
Indicación en paratiroides
En el adenoma de las glándulas paratiroides, el flujo sanguíneo y el número de mitocondrias están aumentados. Este hecho puede explicar la elevada captación y retención de tecnecio (99mTc) sestamibi en adenomas de paratiroides.
La localización del tecnecio (99mTc) sestamibi parece depender del flujo sanguíneo al tejido, la concentración de tecnecio (99mTc) presentada al tejido y el tamaño del adenoma de paratiroides.
5.2 Propiedades farmacocinéticas
El complejo catiónico se acumula en el tejido miocárdico viable de manera proporcional al flujo sanguíneo coronario de la zona.
El tecnecio (99mTc) sestamibi presente en la sangre se distribuye rápidamente en los tejidos: 5 minutos después de la inyección, sólo aproximadamente un 8 % de la dosis inyectada continúa en la circulación.
Experimentos con animales han mostrado que la captación no depende de la capacidad funcional de la bomba de sodio-potasio.
Eliminación
La principal vía de eliminación metabólica del tecnecio (99mTc) sestamibi es el sistema hepatobiliar. La actividad de la vesícula biliar aparece en el intestino en el plazo de una hora desde la inyección. Aproximadamente el veintisiete por ciento de la dosis inyectada se aclara mediante eliminación renal transcurridas 24 horas y aproximadamente un treinta y tres por ciento de la dosis inyectada se elimina en las heces en el plazo de 48 horas. Cinco minutos después de la inyección permanece en circulación en torno a un 8 % de la dosis inyectada.
Semivida
La semivida (T'A) biológica en el miocardio es de aproximadamente siete (7) horas en condiciones de reposo y tras esfuerzo. La semivida (T'A) efectiva (que incluye la semivida biológica y el periodo de semidesintegración) es de aproximadamente tres (3) horas.
Captación miocárdica
La captación miocárdica, que depende del flujo coronario, es de un 1,5 % de la dosis inyectada en condiciones de esfuerzo y un 1,2 % de la dosis inyectada en reposo.
Puesto que el radiotrazador entra en la célula mediante difusión, infraestimará el flujo sanguíneo cuando sea elevado (>2,0 ml/g/minuto). Con flujo coronario variable entre 0,52 y 3,10 ml/g/minuto, se obtuvo un valor promedio de extracción miocárdica del tecnecio (99mTc) sestamibi de 0,38 +/- 0,09.
Se puede utilizar la tomogammagrafía sincronizada (gated SPECT) con el ECG para monitorizar los cambios (o la estabilidad) de la función ventricular izquierda a lo largo del tiempo.
5.3 Datos preclínicos sobre seguridad
En estudios de toxicidad intravenosa aguda realizados en ratones, ratas y perros, la dosis más baja de tecnecio (99mTc) sestamibi que resultó mortal fue de 7 mg/kg (expresada como contenido de Cu (MIBI)4 BF4) en ratas hembra. Eso corresponde a 500 veces la dosis máxima en humanos (DMH) de 0,014 mg/kg para adultos (70 kg). El valor DL50 (calculado según el método de Litchfield-Wilcoxon) en ratones es de 19 mg/kg de masa corporal, que corresponde a 1.300 veces la dosis máxima en humanos (DMH). Ni las ratas ni los perros presentaron efectos relacionados con el tratamiento a dosis de tecnecio (99mTc) sestamibi de 0,42 mg/kg (30 veces la DMH) y 0,07 mg/kg (5 veces la DMH) respectivamente durante 28 días. No se han llevado a cabo estudios de toxicidad reproductiva. El Cu (MIBI)4 BF4 no mostró genotoxicidad en las pruebas de Ames, CHO/HPRT y de intercambio de cromátidas hermanas. A concentraciones citotóxicas se observó un aumento de las aberraciones cromosómicas en el ensayo in vitro con linfocitos humanos. No se observó genotoxicidad en el ensayo en vivo de micronúcleos de ratón a 9 mg/kg. No se han llevado a cabo estudios para evaluar el potencial carcinogénico del tecnecio (99mTc) sestamibi.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
cloruro de estaño(II) dihidratado clorhidrato de L-cisteína monohidratado citrato de sodio dihidratado D-manitol (E 421)
6.2 Incompatibilidades
Las reacciones de marcaje con tecnecio implicadas dependen del mantenimiento del nivel de estaño (II) en el estado reducido. No se debe utilizar, por tanto, pertecnetato (99mTc) de sodio inyectable que contenga oxidantes.
6.3 Periodo de validez
1 año
En su uso se ha demostrado su estabilidad química y física durante 12 horas a temperaturas por debajo de 25 °C.
Desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente, a menos que el método de abertura, de marcación y de dilución imposibilite el riesgo de contaminación microbiológica.
Si no se utiliza inmediatamente, los tiempos y las condiciones de conservación antes de su empleo quedarán bajo la responsabilidad del usuario.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C).
El contenido del vial no es radiactivo. No obstante, tras el mareaje con solución inyectable de pertecnetato (99mTc) de sodio, el radiofármaco obtenido es radiactivo y debe cumplirse la normativa sobre protección y seguridad vigente.
Para consultar las condiciones de conservación del medicamento reconstituido y marcado, ver sección 6.3.
6.5 Naturaleza y contenido del envase
El envase es un vial de vidrio borosilicato multidosis con una capacidad nominal de 10 ml (tipo I de la Ph.Eur.) sellado con un tapón de goma de clorobutilo sintética y una cápsula de cierre de aluminio.
Los viales se suministran empaquetados en cajas de cartón y hay disponibles paquetes de 3 ó 6 viales. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
El producto marcado puede diluirse con una solución salina al 0.9% de cloruro de sodio antes de su administración.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con el mismo se realizará de acuerdo con la normativa local.
El contenido del equipo antes de la preparación no es radiactivo. No obstante, tras la adición de la solución inyectable de pertecnetato 99mTc de sodio, la preparación final deberá mantenerse adecuadamente protegida con blindaje.
Tras la reconstitución, tanto el envase como el contenido no utilizado deberán eliminarse como residuos radiactivos de acuerdo con la legislación nacional e internacional relativa a materiales radiactivos.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
NATIONAL CENTRE FOR NUCLEAR RESEARCH Andrzej Soltan 7 05-400 Otwock, Polonia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
71371
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Septiembre de 2008
10. FECHA DE LA REVISIÓN DEL TEXTO
09/2010
DOSIMETRÍA
El tecnecio 99mTc se produce por medio de un generador de 99Mo/99mTc y decae mediante emisión de radiación gamma con una energía media de 140 keV y un perído de semidesintegración de 6,02 horas, a tecnecio (99Tc), que en vista de su prolongado perído de semidesintegración de 2,13 x 105 años, puede ser considerado casi estable.
A continuación se indican las dosis de radiación proyectadas en órganos y tejidos de un paciente de peso medio (70 kg) tras la inyección intravenosa de tecnecio (99mTc) sestamibi.
Los datos corresponden a las recomendaciones ICRP 80 y están calculados en base a las suposiciones siguientes: Tras la inyección intravenosa el producto desaparece rápidamente de la sangre y se acumula principalmente en los tejidos musculares (incluido el corazón), el hígado, los riñones y en menor cantidad en las glándulas salivares y tiroides. Cuando la sustancia se inyecta durante una prueba de esfuerzo se produce un aumento considerable de la captación en órganos y tejidos. El producto se excreta en el hígado y los riñones en proporciones del 75 % y el 25 % respectivamente.
Dosis absorbida por unidad de actividad administrada (mGy/MBq)
Órgano (prueba en reposo)
|
Adulto |
15 años |
10 años |
5 años |
1 año | |
|
Glándulas adrenales |
0,0075 |
0,0099 |
0,015 |
0,022 |
0,038 |
|
Vejiga |
0,011 |
0,014 |
0,019 |
0,023 |
0,041 |
|
Superficies óseas |
0,0082 |
0,010 |
0,016 |
0,021 |
0,038 |
|
Cerebro |
0,0052 |
0,0071 |
0,011 |
0,016 |
0,027 |
|
Mamas |
0,0038 |
0,0053 |
0,0071 |
0,011 |
0,020 |
|
Vesícula biliar |
0,039 |
0,045 |
0,058 |
0,10 |
0,32 |
|
Tracto gastrointestinal Estómago |
0,0065 |
0,0090 |
0,015 |
0,021 |
0,035 |
|
Intestino delgado |
0,015 |
0,018 |
0,029 |
0,045 |
0,080 |
|
Colon |
0,024 |
0,031 |
0,050 |
0,079 |
0,015 |
|
Intestino grueso ascendente |
0,027 |
0,035 |
0,057 |
0,089 |
0,17 |
|
Intestino grueso descendente |
0,019 |
0,025 |
0,041 |
0,065 |
0,12 |
|
Corazón |
0,0063 |
0,0082 |
0,012 |
0,018 |
0,030 |
|
Riñones |
0,036 |
0,043 |
0,059 |
0,085 |
0,15 |
|
Hígado |
0,011 |
0,014 |
0,021 |
0,030 |
0,052 |
|
Pulmones |
0,0046 |
0,0064 |
0,0097 |
0,014 |
0,025 |
|
Músculos |
0,0029 |
0,0037 |
0,0054 |
0,0076 |
0,014 |
|
Esófago |
0,0041 |
0,0057 |
0,0086 |
0,013 |
0,023 |
|
Ovarios |
0,0091 |
0,012 |
0,018 |
0,025 |
0,045 |
|
Páncreas |
0,0077 |
0,010 |
0,016 |
0,024 |
0,039 |
|
Médula ósea roja |
0,0055 |
0,0071 |
0,011 |
0,030 |
0,044 |
|
Glándulas salivares |
0,014 |
0,017 |
0,022 |
0,015 |
0,026 |
|
Piel |
0,0031 |
0,0041 |
0,0064 |
0,0098 |
0,019 |
|
Bazo |
0,0065 |
0,0086 |
0,014 |
0,020 |
0,034 |
|
Testículos |
0,0038 |
0,0050 |
0,0075 |
0,011 |
0,021 |
|
Timo |
0,0041 |
0,0057 |
0,0086 |
0,013 |
0,023 |
|
Tiroides |
0,0053 |
0,0079 |
0,012 |
0,024 |
0,045 |
|
Útero |
0,0078 |
0,010 |
0,015 |
0,022 |
0,038 |
|
Resto del organismo |
0,0031 |
0,0039 |
0,0060 |
0,0088 |
0,016 |
|
Dosis efectiva (mSv/MBq) |
0,0090 |
0,012 |
0,018 |
0,028 |
0,053 |
Dosis absorbida por unidad de actividad administrada (mGy/MBq) Órgano (prueba durante el ejercicio)
|
Adulto |
15 años |
10 años |
5 años |
1 año | |
|
Glándulas adrenales |
0,0066 |
0,0087 |
0,013 |
0,019 |
0,033 |
|
Vejiga |
0,0098 |
0,013 |
0,017 |
0,021 |
0,038 |
|
Superficies óseas |
0,0078 |
0,0097 |
0,014 |
0,020 |
0,036 |
|
Cerebro |
0,0044 |
0,0060 |
0,0093 |
0,014 |
0,023 |
|
Mamas |
0,0034 |
0,0047 |
0,0062 |
0,0097 |
0,018 |
|
Vesícula biliar |
0,033 |
0,038 |
0,049 |
0,086 |
0,26 |
|
Tracto gastrointestinal Estómago |
0,0059 |
0,0081 |
0,013 |
0,019 |
0,032 |
|
Intestino delgado |
0,012 |
0,015 |
0,024 |
0,037 |
0,066 |
|
Colon |
0,019 |
0,025 |
0,041 |
0,064 |
0,12 |
|
Intestino grueso ascendente |
0,022 |
0,028 |
0,046 |
0,072 |
0,13 |
|
Intestino grueso descendente |
0,016 |
0,021 |
0,034 |
0,053 |
0,099 |
|
Corazón |
0,0072 |
0,0094 |
0,010 |
0,021 |
0,035 |
|
Riñones |
0,026 |
0,032 |
0,044 |
0,063 |
0,11 |
|
Hígado |
0,0092 |
0,012 |
0,018 |
0,025 |
0,044 |
|
Pulmones |
0,0044 |
0,0060 |
0,0087 |
0,013 |
0,023 |
|
Músculos |
0,0032 |
0,0041 |
0,0060 |
0,0090 |
0,017 |
|
Esófago |
0,0040 |
0,0055 |
0,0080 |
0,012 |
0,023 |
|
Ovarios |
0,0081 |
0,011 |
0,015 |
0,023 |
0,040 |
|
Páncreas |
0,0069 |
0,0091 |
0,014 |
0,021 |
0,035 |
|
Médula ósea roja |
0,0050 |
0,0064 |
0,0095 |
0,013 |
0,023 |
|
Glándulas salivares |
0,0092 |
0,011 |
0,0015 |
0,0020 |
0,0029 |
|
Piel |
0,0029 |
0,0037 |
0,0058 |
0,0090 |
0,017 |
|
Bazo |
0,0058 |
0,0076 |
0,012 |
0,017 |
0,030 |
|
Testículos |
0,0037 |
0,0048 |
0,0071 |
0,011 |
0,020 |
|
Timo |
0,0040 |
0,0055 |
0,0080 |
0,012 |
0,023 |
|
Tiroides |
0,0044 |
0,0064 |
0,0099 |
0,019 |
0,035 |
|
Útero |
0,0072 |
0,0093 |
0,014 |
0,020 |
0,035 |
|
Resto del organismo |
0,0033 |
0,0043 |
0,0064 |
0,0098 |
0,018 |
|
Dosis efectiva (mSv/MBq) |
0,0079 |
0,010 |
0,016 |
0,023 |
0,045 |
La dosis efectiva por unidad de actividad administrada se ha calculado para una frecuencia de micción de cada 3,5 horas en adultos.
La dosis efectiva resultante de la administración de una actividad (máxima recomendada) de 2.000 MBq de tecnecio (99mTc) sestamibi a un adulto con un peso de 70 kg es de aproximadamente 18 mSv en reposo y
15,8 mSv en condiciones de esfuerzo.
INSTRUCCIONES PARA LA PREPARACIÓN DE RADIOFÁRMACOS
El vial se reconstituye con un volumen 1 -5 ml de solución inyectable con un máximo de 11 GBq de solución estéril y libre de oxidantes de pertecnetato (99mTc) de sodio. Previamente a la administración al paciente se debe comprobar la pureza radioquímica de la solución procedente del vial reconstituido con el método recomendado que se describe a continuación.
El procedimiento de mareaje radiactivo debe ser llevado a cabo en condiciones asépticas por personal cualificado y experimentado.
Como ocurre con cualquier fármaco, no debe utilizarse cuando la integridad del vial se haya visto comprometida en cualquier momento durante la preparación del producto. Por lo tanto, es preciso inspeccionar atentamente el vial en busca de posibles daños, en particular fisuras, antes de proceder con el procedimiento de marcado radiactivo. No utilice un vial dañado, ya que podría romperse durante el calentamiento.
Previamente a la adición de pertecnetato (99mTc) de sodio al vial deberá incorporarse al cuello de éste una etiqueta con la fecha, la hora, la radioactividad que se va a añadir y el símbolo indicativo de radiactividad.
Durante la preparación del producto radiomarcado, el operador debe protegerse las manos con guantes impermeables. Retire la cápsula de plástico del vial y desinfecte la superficie del tapón de goma con alcohol.
Una vez completado el procedimiento de radiomarcado, compruebe que el contenido del vial es transparente y no presenta materia particulada o decoloración.
Instrucciones para la preparación de tecnecio (99mTc) sestamibi:
A) Procedimiento de ebullición
- Coloque un vial con liofilizado en un recipiente protector de plomo.
- Con una jeringa estéril blindada con plomo (perforando el tapón de goma), introduzca de 1 a 5 ml de solución inyectable de pertecnetato (99mTc) de sodio, Ph.Eur., con una actividad máxima de 11.000 MBq (o el volumen de eluido con la radiactividad deseada ajustado con solución salina fisiológica)] en un vial que contenga tetrafluoroborato de [Tetrakis (2-metoxi-isobutil-isonitrilo) cobre(I)] liofilizado.
- Sin extraer la aguja, retire un volumen de gas igual al volumen de solución introducido con la misma jeringa a fin de compensar la acumulación de presión.
- Agite el vial hasta disolver completamente su contenido (aproximadamente 1 minuto).
- Extraiga el vial del recipiente de plomo, introdúzcalo en un baño de agua hirviendo (el agua debe estar en ebullición durante el procedimiento de marcado) y déjelo allí durante 10 - 12 minutos. No permita que el agua hirviendo entre en contacto con la cápsula de aluminio. Para mantenerlo erguido, se puede colocar el vial en un cubilete plomado estándar montado en el baño de agua por medio de una abrazadera para Erlenmeyer o de cuatro dedos acoplada a un soporte de laboratorio. Para facilitar una mejor conducción térmica, se pueden añadir unos pocos ml de agua al cubilete de plomo.
- Extraiga el vial del baño de agua hirviendo, introdúzcalo en un recipiente de plomo y déjelo enfriar a temperatura ambiente (unos 15 minutos).
- La solución resultante es una solución inyectable lista para su uso.
B) Procedimiento en termociclador
- Coloque un vial con liofilizado en un recipiente protector de plomo.
- Con una jeringa (perforando el tapón de goma), introduzca de 1 a 5 ml de eluido con pertecnetato (99mTc ) de sodio) con una actividad máxima de 11.000 MBq (o el volumen de eluido con la actividad deseada complementado con solución salina fisiológica) en un vial que contenga tetrafluoroborato de [Tetrakis (2-metoxi-isobutil-isonitrilo) cobre(I)] liofilizado.
- Sin extraer la aguja, retire un volumen de gas igual al volumen de solución introducido con la misma jeringa a fin de compensar la acumulación de presión.
- Agite el vial hasta disolver completamente su contenido (aproximadamente 1 minuto).
- Extraiga el vial del recipiente de plomo, colóquelo (bien ajustado) en el bloque de un termociclador destinado a radiomarcado y ponga en marcha el termociclador en programa automático.
- Alternativamente, coloque el vial en un cubilete de latón o cobre donde quede ajustado (con un espesor
de pared > 3 mm para que ofrezca protección frente a la radiactividad) y coloque el cubilete en un termociclador de placa plana programable precalentado. Programe el termociclador para un ciclo de precalentamiento hasta 99 °C durante 5 minutos, seguido de un ciclo de calentamiento del vial a 99 °C durante 12 minutos y finalmente un ciclo de enfriamiento hasta 25-30 °C de temperatura constante (aproximadamente 10 minutos). Las duraciones mencionadas pueden diferir en función de la capacidad de calentamiento/enfriamiento del ciclador utilizado.
- La solución resultante es una solución inyectable lista para su uso.
Métodos de control de calidad del tecnecio (99mTc) sestamibi:
Además del método recomendado que se describe a continuación, se puede utilizar también el método recogido en la monografía n° 1926 de la Farmacopea Europea relativa a la solución inyectable de tecnecio (99mTc) sestamibi.
• Deposite de 2 a 5 pl de tecnecio (99mTc) sestamibi a unos 1,5 cm de la base de una placa cromatográfica de óxido de aluminio de 2 cm x 8 cm.
• Introduzca la placa en una cámara cromatográfica y revele los cromatogramas en etanol absoluto hasta que el frente de disolvente se haya desplazado unos 6 cm desde el origen.
• Extraiga la placa y déj ela secar al aire.
• Determine la distribución de la radiactividad barriendo el cromatograma con un detector de radiación apropiado o corte la placa tal como se muestra a continuación (tres porciones) y mida la actividad de tecnecio (99mTc) de cada porción con un detector de radiación apropiado.
• En estas condiciones:
El radiocoloide permanece en el origen (Rf = 0,0 - 0,1).
El pertecnetato libre, 99mTcO4", migra con el disolvente (Rf = 0,4 - 0,7).
El complejo marcado, tecnecio (99mTc) sestamibi, migra con el disolvente.
Frente de disolvente
Cortar aquí
t
2,5 cm
t
2,5 cm
i
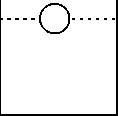
.............t.................
1,5 cm
i
Cortar aquí Origen
Depositar aquí las gotas de muestra
• Calcule el % de pureza radioquímica como sigue: % tecnecio (99mTc) sestamibi = actividad de la porción superior (Rf 0,8-1,0) dividida por la suma de las actividades de todas las porciones y multiplicada por 100:
Actividad de la porción superior
% PRQ = .....................................................
Suma de actividades de todas las porciones
• El % de tecnecio (99mTc) sestamibi debe ser del 94 %; de lo contrario debería desecharse la preparación.
Nota: No utilice material cuya pureza radioquímica sea inferior al 94 %.
15 de 15