Metalyse 8.000 Unidades. Polvo Y Disolvente Para Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Metalyse 8.000 unidades. Polvo y disolvente para solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Metalyse 8.000 unidades
1 vial contiene 8.000 unidades (40 mg) de tenecteplasa.
1 jeringa precargada contiene 8 ml de agua para inyectables.
La solución reconstituida contiene 1.000 unidades (5 mg) de tenecteplasa por ml.
La potencia de la tenecteplasa se expresa en unidades (U), utilizando un patrón de referencia que es específico para tenecteplasa y no es comparable con las unidades utilizadas para otros fármacos trombolíticos.
La tenecteplasa es un activador del plasminógeno específico para la fibrina producido mediante la técnica del ADN recombinante, utilizando una línea celular ovárica de hámster chino.
Para la lista completa de excipientes, ver sección 6.1
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
El polvo es blanco o blanquecino. La preparación reconstituida es una solución clara e incolora o ligeramente amarilla.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Metalyse está indicado en adultos para el tratamiento trombolítico de sospecha de infarto de miocardio con elevación ST persistente o Bloqueo reciente del Haz de Rama izquierda, en las 6 horas siguientes a la aparición de los síntomas del infarto agudo de miocardio (IAM).
4.2 Posología y forma de administración
Posología
Metalyse debe ser prescrito por médicos expertos en la administración de tratamiento trombolítico y con medios para monitorizar esta administración.
El tratamiento con Metalyse debe iniciarse lo antes posible, después de la aparición de los síntomas.
Metalyse debe administrarse en función del peso corporal, con una dosis máxima de 10.000 unidades (50 mg de tenecteplasa). El volumen requerido para administrar la dosis correcta puede calcularse a partir del siguiente esquema:
|
Categoría de peso corporal del paciente (kg) |
Tenecteplasa (U) |
Tenecteplasa (mg) |
Volumen correspondiente de solución reconstituida (ml) |
|
<60 |
6.000 |
30 |
6 |
|
>60 a <70 |
7.000 |
35 |
7 |
|
>70 a <80 |
8.000 |
40 |
8 |
|
>80 a <90 |
9.000 |
45 |
9 |
|
>90 |
10.000 |
50 |
10 |
|
Ver sección 6.6.: Precauciones especiales de eliminación y otras manipulaciones | |||
Pacientes de edad avanzada (> 75 años)
Metalyse se debe administrar con precaución en pacientes de edad avanzada (> 75 años) ya que tienen un mayor riesgo de hemorragia (ver información sobre hemorragia en sección 4.4 y en el estudio STREAM en sección 5.1).
Población pediátrica
No se ha establecido la seguridad y eficacia de Metalyse en niños (menores de 18 años). No se dispone de datos.
Forma de administración
La dosis requerida debe administrarse como bolo intravenoso único en aproximadamente 10 segundos.
Puede utilizarse un circuito intravenoso pre-existente exclusivo para la administración de Metalyse en solución de cloruro sódico 0.9%. Metalyse es incompatible con soluciones de dextrosa.
No debe añadirse ningún otro medicamento a la solución inyectable.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
Tratamiento coadyuvante
De acuerdo con las guías actuales, debe administrarse tratamiento antitrombótico coadyuvante con inhibidores plaquetarios y anticoagulantes para el tratamiento de pacientes con infarto de miocardio con elevación de ST.
Para intervención coronaria ver sección 4.4.
Se ha utilizado heparina no fraccionada y enoxaparina como tratamiento antitrombótico coadyuvante en ensayos clínicos con Metalyse.
Debe iniciarse el tratamiento con ácido acetilsalicílico lo antes posible tras la presentación de los síntomas y debe continuarse durante toda la vida a menos que esté contraindicado.
4.3 Contraindicaciones
Metalyse no debe ser administrado a pacientes con historia de reacción anafiláctica (i.e. con peligro para la vida) a cualquier de los componentes (i.e. tenecteplasa o cualquier excipiente) o a la gentamicina (una sustancia residual del proceso de fabricación). Si de todos modos el tratamiento con Metalyse se considera necesario, se debe disponer inmediatamente de mecanismos de reanimación por si fuera necesario.
Además, como el tratamiento trombolítico se asocia a un mayor riesgo de hemorragia, Metalyse está contraindicado en las siguientes situaciones:
- Trastorno hemorrágico significativo actual o durante los últimos 6 meses
- Pacientes que reciben tratamiento efectivo con anticoagulantes orales, p. ej., warfarina sódica (INR > 1,3) (ver sección 4.4, subsección “Hemorragia”).
- Historia de lesión del sistema nervioso central (por ej., neoplasma, aneurisma, cirugía intracraneal o espinal)
- Diátesis hemorrágica conocida
- Hipertensión no controlada grave
- Cirugía mayor, biopsia de un órgano parenquimatoso o traumatismo significativo durante los últimos 2 meses (incluyendo cualquier traumatismo asociado con el IAM actual)
- Traumatismo reciente de la cabeza o el cráneo
- Reanimación cardiopulmonar prolongada (> 2 minutos) durante las últimas 2 semanas
- Pericarditis aguda y/o endocarditis bacteriana subaguda
- Pancreatitis aguda
- Disfunción hepática grave, incluyendo fallo hepático, cirrosis, hipertensión portal (varices esofágicas) y hepatitis activa
- Ulcera péptica activa
- Aneurisma arterial y malformación arterial/venosa conocida
- Neoplasma con riesgo aumentado de hemorragia
- Cualquier historia conocida de ictus hemorrágico o ictus de origen desconocido
- Historia conocida de ictus isquémico o ataque isquémico transitorio (AIT) en los 6 meses anteriores
- Demencia
4.4 Advertencias y precauciones especiales de empleo
Intervención coronaria
Si está programada una intervención coronaria percutánea (ICP) de acuerdo a las guías actuales de tratamiento, no se debe administrar tenecteplasa (ver sección 5.1 estudio ASSENT-4).
Los pacientes que no se pueden someter a una ICP primaria en 1 hora tal y como se recomienda en las guías y que reciben tenecteplasa como tratamiento de recanalización coronaria primaria deben ser trasladados sin demora a un centro habilitado para intervención coronaria para angiografía e intervención coronaria adyuvante a tiempo en 6-24 horas o antes si el médico lo indica (ver sección 5.1 Estudio STREAM).
Hemorragia
Durante el tratamiento con tenecteplasa la complicación más común detectada es la hemorragia. Puede contribuir a esta hemorragia la administración concomitante de heparina como anticoagulante. Como durante el tratamiento con tenecteplasa se produce lisis de fibrina, puede producirse hemorragia en el sitio de punción reciente. Por lo tanto, el tratamiento trombolítico requiere cuidadosa atención de todos los posibles puntos de hemorragia (incluyendo puntos de inserción de catéteres, puntos de punción arterial o venosa, zonas de corte y sitios de punción con aguja). Durante el tratamiento con tenecteplasa debe evitarse el uso de catéteres rígidos, las inyecciones intramusculares y la manipulación innecesaria del paciente.
Las hemorragias observadas con mayor frecuencia se produjeron en el sitio de inyección, y ocasionalmente se observó hemorragia genitourinaria y gingival.
Si se produce una hemorragia grave, en particular hemorragia cerebral, debe suspenderse de inmediato la administración simultánea de heparina. Debe considerarse la administración de protamina si se ha administrado heparina durante las 4 horas precedentes al inicio de la hemorragia. En los pocos pacientes que no respondan a estas medidas conservadoras, puede estar indicada una administración cautelosa de perfusiones. Debe considerarse la perfusión de crioprecipitados, plasma fresco congelado y plaquetas, con una reevaluación clínica y de laboratorio después de cada administración. Con la perfusión de crioprecipitados es deseable obtener un nivel de fibrinógeno de 1g/l. Los fármacos antifibrinolíticos estarán disponibles como última alternativa._En las siguientes condiciones el riesgo del tratamiento con tenecteplasa puede verse incrementado y debe ponderarse frente a los beneficios previstos:
- Presión arterial sistólica > 160 mm Hg
- Enfermedad cerebrovascular
- Hemorragia gastrointestinal o genitourinaria reciente (durante los últimos 10 días)
- Elevada probabilidad de trombo cardiaco en el ventrículo izquierdo, por ej., estenosis mitral con fibrilación auricular
- Cualquier inyección intramuscular reciente conocida (durante los últimos 2 días)
- Edad avanzada, por ej., mayor de 75 años
- Bajo peso corporal < 60 kg.
- Pacientes que reciben anticoagulantes orales: el uso de Metalyse se puede considerar cuando la dosis o el tiempo desde la última toma de tratamiento anticoagulante hace improbable que haya una eficacia residual y si las pruebas de actividad anticoagulante apropiadas para los correspondientes medicamentos no muestran actividad clínicamente relevante sobre el sistema de coagulación (p. ej., INR <1,3 para antagonistas de la vitamina K u otras pruebas pertinentes para otros anticoagulantes orales que estén dentro del correspondiente límite superior de la normalidad).
Arritmias
La trombolisis coronaria puede dar lugar a arritmias asociadas a la reperfusión. Se recomienda tener disponible un tratamiento antiarrítmico para la bradicardia y/o taquiarritmia ventricular (marcapasos, desfibrilador) cuando se administre tenecteplasa.
Antagonistas GPIIb/IIIa
El uso concomitante de antagonistas GPIIb/IIIa aumenta el riesgo de hemorragia. Hipersensibilidad/Re-administración
No se ha observado formación sostenida de anticuerpos a tenecteplasa tras el tratamiento. Sin embargo, no se dispone de experiencia sistemática en la re-administración de tenecteplasa. Tenecteplasa debe administrarse con precaución a individuos con hipersensibilidad conocida (distinta a reacciones anafilácticas) al principio activo, cualquier excipiente o a la gentamicina (sustancia residual del proceso de fabricación). Si se produce una reacción anafilactoide, debe interrumpirse inmediatamente la inyección y debe iniciarse un tratamiento adecuado. En cualquier caso, no debe re-administrarse la tenecteplasa antes de la valoración de los factores hemostáticos tales como, el fibrinógeno, el plasminógeno y la a2-antiplasmina.
Población pediátrica
Metalyse no está recomendado para uso en niños (menores de 18 años) debido a la ausencia de datos sobre seguridad y eficacia.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacción con tenecteplasa y los medicamentos administrados habitualmente en pacientes con IAM. No obstante, el análisis de datos de más de 12.000 pacientes tratados durante las Fases I, II y III no reveló interacciones clínicas importantes con medicamentos utilizados habitualmente en pacientes con IAM y administrados simultáneamente contenecteplasa.
Los medicamentos que afectan a la coagulación o aquellos que alteran la función plaquetaria (p.ej. ticlopidina, clopidogrel, heparinas de bajo peso molecular (LMWH)) pueden aumentar el riesgo de hemorragia antes, durante o después del tratamiento contenecteplasa.
El uso concomitante de antagonistas GPIIb/nIa aumenta el riesgo de hemorragia.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Hay datos limitados relativos al uso de Metalyse en mujeres embarazadas. Los datos preclínicos obtenidos con tenecteplasa mostraron hemorragias con mortalidad secundaria de los animales madre debido a la actividad farmacológica conocida del principio activo y en algunos casos se produjo aborto y reabsorción del feto (efectos solo observados con una administración repetida de la dosis). Tenecteplasa no se considera teratogénica (ver sección 5.3).
Se debe valorar el beneficio del tratamiento frente a los riesgos potenciales en caso de infarto de miocardio durante el embarazo.
Lactancia
Se desconoce si la tenecteplasa se excreta en la leche materna. Se debe evitar la lactancia durante las primeras 24 horas después del tratamiento trombolítico.
Fertilidad
No se dispone de datos clínicos ni preclínicos en fertilidad contenecteplasa (Metalyse).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
Resumen del perfil de seguridad
La hemorragia es una reacción adversa muy frecuente asociada al uso de la tenecteplasa. El tipo de hemorragia es principalmente superficial en el sitio de inyección. Frecuentemente se han observado casos de equimosis que,_normalmente, no requieren ninguna acción específica. Se han descrito muerte e incapacidad permanente en pacientes que han presentado ictus (incluyendo hemorragia intracraneal) y otros episodios graves de hemorragia.
Tabla de reacciones adversas
Las reacciones adversas se clasifican según la frecuencias y según la clasificación por órganos y sistemas según las siguientes categorías: muy frecuente (> 1/10); frecuente (> 1/100 a < 1/10); poco frecuente (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1.000); muy raras (< 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1. Muestra las frecuencias de las reacciones adversas
|
Clasificación por órganos y sistemas |
Reacción adversa |
|
Trastornos del sistema inmunológico | |
|
Raras |
Reacción anafilactoide (incluyendo exantema, urticaria, broncoespasmo, edema laríngeo) |
|
Trastornos del sistema nervioso | |
|
Poco frecuentes |
Hemorragia intracraneal (como hemorragia cerebral, hematoma cerebral, ictus hemorrágico, transformación hemorrágica del ictus, hematoma intracraneal, hemorragia subaracnoidea) incluyendo síntomas asociados como somnolencia, afasia, hemiparesia, convulsiones |
|
Trastornos oculares | |
|
Poco frecuentes |
Hemorragia en el ojo |
|
Trastornos cardíacos | |
|
Poco frecuentes |
La aparición de arritmias de reperfusión (como asistolia, arritmia idioventricular acelerada, arritmia, extrasístoles, fibrilación auricular, bloqueo auriculo-ventricular de primer grado a bloqueo auriculo-ventricular completo, bradicardia, taquicardia, arritmia ventricular, fibrilación ventricular, taquicardia ventricular) guarda una estrecha relación temporal con el tratamiento con tenecteplasa. Las arritmias de reperfusión pueden conducir a un paro cardíaco, pueden ser una amenaza para la vida y pueden necesitar el uso de tratamiento antiarrítmico convencional |
|
Raras |
Hemorragia del pericardio |
|
Trastornos vasculares | |
|
Muy frecuentes |
Hemorragia |
|
Raras |
Embolia (embolización trombótica) |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes |
Epistaxis |
|
Raras |
Hemorragia pulmonar |
|
Trastornos gastrointestinales | |
|
Frecuentes |
Hemorragia gastrointestinal (como hemorragia gástrica, úlcera gástrica sangrante, hemorragia rectal, hematemesis, melena, hemorragia bucal) |
|
Poco frecuentes |
Hemorragia retroperitoneal (como hematoma retroperitoneal) |
|
Frecuencia no conocida |
Náuseas, vómitos |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes |
Equimosis |
|
Trastornos renales y urinarios | |
|
Frecuentes |
Hemorragia urogenital (como hematuria, hemorragia en el tracto urinario) |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Frecuentes |
Hemorragia en el lugar de inyección, hemorragia en el lugar de punción. |
|
Clasificación por órganos y sistemas |
Reacción adversa |
|
Exploraciones complementarias | |
|
Raras |
Presión arterial disminuida |
|
Frecuencia no conocida |
Temperatura corporal aumentada |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos | |
|
Frecuencia no conocida |
Embolia grasa, lo cual puede conducir a las correspondientes consecuencias en los órganos afectados |
Al igual que con otros agentes trombolíticos, se han descrito los siguientes acontecimientos como secuelas
del infarto de miocardio y/o de la administración de trombolíticos:
- muy frecuentes (>1/10): hipotensión, trastornos del ritmo y frecuencia cardíacos, angina de pecho
- frecuentes (>1/100, <1/10): isquemia recurrente, insuficiencia cardíaca, infarto de miocardio, shock cardiogénico, pericarditis, edema pulmonar
- poco frecuentes (>1/1.000, <1/100): paro cardíaco, regurgitación de la válvula mitral, derrame pericárdico, trombosis venosa, taponamiento cardíaco, rotura del miocardio
- raras (>1/10.000, <1/1.000): embolia pulmonar
Estas reacciones cardiovasculares pueden suponer un riesgo para la vida y conducir a la muerte.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
En caso de sobredosis puede existir un riesgo aumentado de hemorragia. Si se produce una hemorragia prolongada grave, puede considerarse un tratamiento sustitutivo (plasma, plaquetas), ver también sección
4.4.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: agentes antitrombóticos, código ATC: B01A D11 Mecanismo de acción
La tenecteplasa es un activador recombinante del plasminógeno específico para la fibrina, derivado del t-PA natural por modificación en tres puntos de la estructura proteica. Se une al componente fibrina del trombo (coágulo sanguíneo) y convierte selectivamente el plasminógeno unido al trombo en plasmina, la cual degrada la matriz de fibrina del trombo. La tenecteplasa posee una mayor especificidad para la fibrina y una mayor resistencia a la inactivación por su inhibidor endógeno (IAP-1), en comparación con t-PA natural.
Efectos farmacodinámicos
Después de la administración de tenecteplasa, se ha observado un consumo de a2-antiplasmina dosis-dependiente (el inhibidor de la plasmina de la fase fluida), con el consiguiente aumento en el nivel de producción de plasmina sistémica. Esta observación es concordante con el pretendido efecto de activación del plasminógeno. En estudios comparativos, se observó una reducción del fibrinógeno inferior al 15 % y una reducción del plasminógeno inferior al 25 %, en sujetos tratados con la dosis máxima de tenecteplasa (10.000 U, correspondientes a 50 mg), mientras que la alteplasa ocasionó una disminución de aproximadamente un 50 % en los niveles de fibrinógeno y plasminógeno. No se detectó una formación de anticuerpos clínicamente relevante a los 30 días.
Eficacia clínica y seguridad
Los datos de permeabilidad de los estudios angiográficos en Fases I y II sugieren que la tenecteplasa, administrada como bolo intravenoso único en sujetos con IAM, es eficaz en la disolución de los coágulos sanguíneos de la arteria relacionada con el infarto de forma dosis-dependiente.
ASSENT-2
Un estudio a gran escala de la mortalidad (ASSENT II) en aproximadamente 17.000 pacientes, mostró que la tenecteplasa es terapéuticamente equivalente a la alteplasa en la reducción de la mortalidad (6,2 % para ambos tratamientos, a 30 días, siendo 1,124 el límite superior del intervalo de confianza (IC) del 95 % para el riesgo relativo) y que el uso de tenecteplasa se asocia con una incidencia de hemorragias no intracraneales significativamente inferior (26,4 % vs. 28,9%, p = 0,0003). Esto se traduce en una necesidad de transfusiones significativamente inferior (4,3 % vs. 5,5%, p = 0,0002). La hemorragia intracraneal se produjo en una proporción del 0,93 % vs. 0,94 % para tenecteplasa y alteplasa, respectivamente.
La permeabilidad coronaria y los datos limitados de los resultados clínicos, mostraron que los pacientes con IAM, después de 6 horas de aparición de los síntomas, han sido tratados satisfactoriamente.
ASSENT-4
El estudio ASSENT-4 PCI se diseñó para poner de manifiesto si en 4.000 pacientes con infarto de miocardio extenso, el pre-tratamiento con dosis completas de tenecteplasa y un bolo único concomitante de hasta 4.000 UI de heparina no fraccionada, administrados previamente a una intervención coronaria percutánea (ICP) primaria que debe realizarse en los 60-180 minutos posteriores, se obtienen mejores resultados que mediante la ICP primaria solamente. El estudio se detuvo prematuramente con 1.667 pacientes aleatorizados, debido a una mortalidad numérica mayor en el grupo de la ICP facilitada que recibía tenecteplasa. La incidencia de la variable principal, siendo ésta la combinación de muerte o shock cardiogénico o insuficiencia cardíaca congestiva en 90 días, fue significativamente mayor en el grupo que recibía el tratamiento exploratorio de tenecteplasa seguido de ICP inmediata de rutina: 18,6% (151/810) en comparación con 13,4% (110/819) en el grupo que únicamente recibió ICP, p=0,0045. Esta diferencia significativa entre grupos, en cuanto al criterio de valoración primario a los 90 días, ya apareció a nivel intra-hospitalario y a los 30 días.
Numéricamente, todos los componentes de la variable clínica principal combinada eran favorables al tratamiento con ICP únicamente: muerte: 6,7% vs. 4,9% p=0,14; shock cardiogénico: 6,3% vs. 4,8% p=0,19; insuficiencia cardíaca congestiva: 12,0% vs. 9,2% p=0,06, respectivamente. Las variables secundarias, reinfarto y revascularización repetida de los vasos diana, aumentaron significativamente en el grupo pre-tratado con tenecteplasa: re-infarto: 6,1% vs. 3,7% p=0,0279; revascularización repetida de los vasos diana: 6,6% vs. 3,4% p=0,0041. Las siguientes reacciones adversas se presentaron con mayor frecuencia con el uso de tenecteplasa previamente a la ICP: hemorragia intracraneal: 1% vs. 0% p=0,0037; ictus: 1,8% vs. 0% p<0,0001; hemorragias mayores: 5,6% vs. 4,4% p=0,3118; hemorragias menores: 25,3% vs. 19,0% p= 0,0021; transfusiones de sangre: 6,2% vs. 4,2% p=0,0873; cierre brusco del vaso: 1,9% vs. 0,1% p=0,0001.
Estudio STREAM
El estudio STREAM fue diseñado para evaluar la eficacia y seguridad de una estrategia fármaco-invasiva frente a una estrategia de ICP primaria estándar en pacientes con infarto agudo de miocardio con elevación ST en las 3 horas siguientes al inicio de los síntomas y en los que era imposible realizar una ICP primaria en el plazo de una hora desde el primer contacto médico. La estrategia fármaco-invasiva consistió en un tratamiento fibrinolítico precoz con un bolo de tenecteplasa y tratamiento adicional con medicamentos antiagregantes plaquetarios y antitrombóticos seguido de angiografía en las siguientes 6-24 horas o intervención coronaria de rescate.
La población en estudio consistió en 1.892 pacientes aleatorizados por medio de un sistema de respuesta de voz interactivo. La variable principal, combinación de muerte o shock cardiogénico o insuficiencia cardíaca congestiva o reinfarto en 30 días, se observó en un 12,4% (116/939) en el brazo fármaco-invasivo frente a un 14,3% (135/943) en el brazo de ICP primaria (riesgo relativo 0,86 (0,68-1,09)).
Los componentes individuales de la variable principal compuesta para la estrategia fármaco-invasiva frente a la ICP primaria se observaron con las siguientes frecuencias:
|
Fármaco-invasivo (n=944) |
ICP primaria (n=948) |
P | |
|
Combinación de muerte, shock, insuficiencia cardíaca congestiva, reinfarto |
116/939 (12,4%) |
135/943 (14,3%) |
0,21 |
|
Mortalidad por cualquier causa |
43/939 (4,6%) |
42/946 (4,4%) |
0,88 |
|
Shock cardiogénico |
41/939 (4,4%) |
56/944 (5,9%) |
0,13 |
|
Insuficiencia cardíaca congestiva |
57/939 (6,1%) |
72/943 (7,6%) |
0,18 |
|
Reinfarto |
23/938 (2,5%) |
21/944 (2,2%) |
0,74 |
|
Mortalidad cardíaca |
31/939 (3,3%) |
32/946 (3,4%) |
0,92 |
La incidencia observada de hemorragias no-HIC mayor y menor fue similar en los dos grupos:
|
Fármaco-invasivo (n=944) |
ICP primaria (n=948) |
P | |
|
Hemorragia no-HIC mayor |
61/939 (6,5%) |
45/944 (4,8%) |
0,11 |
|
Hemorragia no-HIC menor |
205/939 (21,8%) |
191/944 (20,2%) |
0,40 |
Incidencia de ictus totales y hemorragia intracraneal:
|
Fármaco-invasivo (n=944) |
ICP primaria (n=948) |
P | |
|
Ictus totales (de todo tipo) |
15/939 (1,6%) |
5/946 (0,5%) |
0,03* |
|
Hemorragia intracranial Hemorragia intracranial después de modificar el protocolo reduciendo la |
9/939 (0,96%) |
2/946 (0,21%) |
0,04** |
|
dosis a la mitad en pacientes >75 años: |
4/747 (0,5%) |
2/758 (0,3%) |
0,45 |
* Las incidencias en ambos grupos son las esperadas en pacientes STEMI tratados con fibrinolíticos o ICP primaria (como se observó en estudios previos).
** La incidencia en el grupo fármaco-invasivo es la esperada para fibrinolisis con tenecteplasa (como se observó en estudios previos).
Después de la reducción a la mitad de la dosis de tenecteplasa en pacientes >75 años no hubo más hemorragias intracraneales (0 de 97 pacientes) (95% IC: 0,0-3,7) frente a 8,1% (3 de 37 pacientes) (95% IC: 1,7-21,9) antes de la reducción de la dosis. Los límites del intervalo de confianza de las incidencias observadas antes y después de la reducción de la dosis se superponen.
En pacientes > 75 años la incidencia observada de la eficacia en la variable principal combinada para la estrategia fármaco-invasiva y para la ICP primaria fue la siguiente: antes de la reducción de la dosis 11/37 (29,7%) (95% IC: 15,9-47,0) frente a 10/32 (31,3%) (95% IC: 16,1-50,0), después de la reducción de dosis: 25/97 (25,8%) (95% IC: 17,4-35,7) frente a 25/88 (24,8%) (95% IC: 19,3-39,0). En ambos grupos los límites del intervalo de confianza de las incidencias observadas antes y después de la reducción de la dosis se superponen.
5.2 Propiedades farmacocinéticas
Absorción y distribución
La tenecteplasa es una proteína recombinante activadora del plasminógeno, que se administra por vía intravenosa. Después de la administración intravenosa de un bolo de 30 mg de tenecteplasa en pacientes con infarto agudo de miocardio, la concentración plasmática inicialmente estimada fue de 6,45 ± 3,60 pg/mL (media ± DE). La fase de distribución representa del 31% ± 22% al 69% ± 15% (media ± DE) del AUC total después de la administración de dosis en el rango de 5 a 50 mg.
En estudios en ratas con tenecteplasa marcada radioactivamente, se obtuvieron datos sobre la distribución tisular. El principal órgano en el que se distribuyó la tenecteplasa fue el hígado. Se desconoce si la tenecteplasa se une a las proteínas plasmáticas humanas y en qué medida El tiempo medio de residencia (TMR) en el cuerpo es aproximadamente 1 h y el volumen medio (± DE) de distribución en el estado estacionario (Vss) es de 6,3 ± 2 L a 15 ± 7 L.
Biotransformación
La tenecteplasa se elimina de la circulación por unión a receptores específicos en el hígado, seguida de su catabolismo a péptidos pequeños. Sin embargo, la unión a receptores hepáticos es reducida si se compara con t-PA natural, dando como resultado una vida media prolongada.
Eliminación
Después de la inyección de un bolo intravenoso único de tenecteplasa, en pacientes con infarto agudo de miocardio, el antígeno tenecteplasa muestra una eliminación bifásica del plasma. En el rango de dosis terapéutica, en el aclaramiento de tenecteplasa no hay dependencia de dosis. La vida media dominante inicial es de 24 ± 5,5 (media ± DE) min, la cual es cinco veces más prolongada que la del t-PA natural. La vida media terminal es de 129 ± 87 min y el aclaramiento plasmático es de 119 ± 49 ml/min.
Un incremento del peso corporal tuvo como consecuencia un aumento moderado del aclaramiento de tenecteplasa y el aumento de edad tuvo como consecuencia una ligera reducción del aclaramiento. Por lo general, las mujeres presentan un aclaramiento menor que los hombres, pero esto puede explicarse por el peso corporal, que es generalmente inferior en las mujeres.
Linealidad/No-linealidad
El análisis de linealidad de dosis basado en el AUC sugirió que tenecteplasa muestra una farmacocinética no-lineal en el rango de dosis estudiado, es decir, de 5 a 50 mg.
Insuficiencia renal y hepática
Debido a que la tenecteplasa se elimina a través del hígado, no es de esperar que la insuficiencia renal afecte a su farmacocinética. Esto está también sustentado por los datos en animales. Sin embargo, el efecto de la insuficiencia renal y hepática en la farmacocinética de tenecteplasa en humanos no ha sido específicamente investigado. En consecuencia, no hay ninguna guía para el ajuste de dosis de tenecteplasa en pacientes con insuficiencia renal y hepática.
5.3 Datos preclínicos sobre seguridad
La administración intravenosa de una dosis única en ratas, conejos y perros sólo produjo alteraciones dosis-dependientes y reversibles de los parámetros de la coagulación, con hemorragia local en el sitio de inyección, que se consideró como una consecuencia del efecto farmacodinámico de la tenecteplasa. Los estudios de toxicidad a dosis múltiples en ratas y perros, confirmaron las observaciones mencionadas anteriormente pero la duración del estudio se limitó a dos semanas por la formación de anticuerpos a la proteína humana tenecteplasa, que produjeron anafilaxia.
Los datos farmacológicos de seguridad en monos cynomolgus revelaron una disminución de la presión arterial seguida de alteraciones del ECG, pero éstas se produjeron con exposiciones que eran considerablemente superiores a la exposición clínica.
En relación con la indicación y la administración de una dosis única en humanos, los estudios de toxicidad reproductiva se limitaron a estudios de embriotoxicidad en conejos, como especies sensibles. La tenecteplasa indujo la muerte total de la descendencia durante el periodo embrionario medio. Cuando la tenecteplasa se administró durante el periodo embrionario medio o final, las hembras grávidas mostraron hemorragia vaginal en el día después de la primera dosis. La mortalidad secundaria se observó 1- 2 días después. No se dispone de datos en el periodo fetal.
Para esta clase de proteínas recombinantes no son de esperar mutagenicidad ni carcinogenicidad y no fueron necesarios estudios de genotoxicidad ni carcinogenicidad.
No se observó irritación local del vaso sanguíneo después de la administración intravenosa, intraarterial o paravenosa de la formulación final de tenecteplasa.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
L-arginina Ácido fosfórico Polisorbato 20.
Disolvente:
Agua para inyectables.
6.2 Incompatibilidades
Metalyse es incompatible con soluciones de dextrosa para perfusión intravenosa.
6.3 Período de validez
Período de validez del envase para la venta 2 años
Solución reconstituida
Se ha demostrado una estabilidad química y física, en condiciones de uso, de 24 horas a 2-8°C y de 8 horas a 30°C.
Desde un punto de vista microbiológico, el producto debe utilizarse inmediatamente después de su reconstitución. Si no se utiliza de inmediato, los tiempos de almacenamiento en condiciones de uso, y las condiciones previas a la utilización son responsabilidad del usuario y, normalmente, no deben ser superiores a 24 horas a 2-8°C.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C. Mantener el envase en el embalaje exterior. Para las condiciones de conservación del medicamento reconstituido, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de vidrio tipo I de 20 ml, con tapón de goma gris recubierto (B2-42) y cierre “flip-off’, conteniendo polvo para solución inyectable.
Jeringa de plástico de 10 ml precargada con 8 ml de agua para inyectables para la reconstitución.
Adaptador del vial estéril.
Aguja de un solo uso estéril.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Metalyse debe reconstituirse añadiendo el volumen total de agua para inyectables de la jeringa precargada al vial que contiene el polvo para inyectable.
1. Asegurar que se ha elegido el tamaño del vial adecuado según el peso corporal del paciente.
|
Categoría de peso corporal del paciente (kg) |
Volumen de solución reconstituida (ml) |
Tenecteplasa (U) |
Tenecteplasa (mg) |
|
<60 |
6 |
6.000 |
30 |
|
>60 a <70 |
7 |
7.000 |
35 |
|
>70 a <80 |
8 |
8.000 |
40 |
|
>80 a <90 |
9 |
9.000 |
45 |
|
>90 |
10 |
10.000 |
50 |
2. Verificar que el cierre del vial está todavía intacto.
3. Retirar el cierre “flip-off’ del vial.
4. Retirar el cierre de la punta de la jeringa. Inmediatamente enroscar la jeringa precargada en el adaptador del vial e insertar el tapón del vial en el medio con la punta del adaptador.
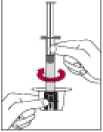
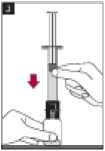
5. Añadir el agua para inyectables al interior del vial empujando el émbolo de la jeringa hacia abajo lentamente para evitar la formación de espuma.
6. Reconstituir agitando suavemente.
7. La preparación reconstituida es una solución transparente, incolora o de color amarillo claro.
Solo debe ser administrada una solución transparente y sin partículas.
8. Inmediatamente antes de administrar la solución, invertir el vial con la jeringa todavía insertada, de forma que la jeringa se encuentre debajo del vial.
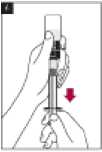
9. Transferir el volumen adecuado de solución reconstituida de Metalyse a la jeringa, según el peso del paciente.
10. Desconectar la jeringa del adaptador del vial.
11. Metalyse debe administrarse al paciente por vía intravenosa, en aproximadamente 10 segundos.
No debe administrarse en un circuito que contenga dextrosa.
12. Debe desecharse la solución no utilizada.
Como alternativa, la reconstitución puede realizarse con la aguja que se incluye.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/00/169/005
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 23 de febrero 2001
Fecha de la última renovación de la autorización: 23 de febrero de 2006
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
1. NOMBRE DEL MEDICAMENTO
Metalyse 10.000 unidades. Polvo y disolvente para solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Metalyse 10.000 unidades
1 vial contiene 10.000 unidades (50 mg) de tenecteplasa.
1 jeringa precargada contiene 10 ml de agua para inyectables.
La solución reconstituida contiene 1.000 unidades (5 mg) de tenecteplasa por ml.
La potencia de la tenecteplasa se expresa en unidades (U), utilizando un patrón de referencia que es específico para tenecteplasa y no es comparable con las unidades utilizadas para otros fármacos trombolíticos.
La tenecteplasa es un activador del plasminógeno específico para la fibrina producido mediante la técnica del ADN recombinante, utilizando una línea celular ovárica de hámster chino.
Para la lista completa de excipientes, ver sección 6.1
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
El polvo es blanco o blanquecino. La preparación reconstituida es una solución clara e incolora o ligeramente amarilla.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Metalyse está indicado en adultos para el tratamiento trombolítico de sospecha de infarto de miocardio con elevación ST persistente o Bloqueo reciente del Haz de Rama izquierda, en las 6 horas siguientes a la aparición de los síntomas del infarto agudo de miocardio (IAM).
4.2 Posología y forma de administración
Posología
Metalyse debe ser prescrito por médicos expertos en la administración de tratamiento trombolítico y con medios para monitorizar esta administración.
El tratamiento con Metalyse debe iniciarse lo antes posible, después de la aparición de los síntomas.
Metalyse debe administrarse en función del peso corporal, con una dosis máxima de 10.000 unidades (50 mg de tenecteplasa). El volumen requerido para administrar la dosis correcta puede calcularse a partir del siguiente esquema:
|
Categoría de peso corporal del paciente (kg) |
Tenecteplasa (U) |
Tenecteplasa (mg) |
Volumen correspondiente de solución reconstituida (ml) |
|
<60 |
6.000 |
30 |
6 |
|
>60 a <70 |
7.000 |
35 |
7 |
|
>70 a <80 |
8.000 |
40 |
8 |
|
>80 a <90 |
9.000 |
45 |
9 |
|
>90 |
10.000 |
50 |
10 |
|
Ver sección 6.6.: Precauciones especiales de eliminación y otras manipulaciones | |||
Pacientes de edad avanzada (> 75 años)
Metalyse se debe administrar con precaución en pacientes de edad avanzada (> 75 años) ya que tienen un mayor riesgo de hemorragia (ver información sobre hemorragia en sección 4.4 y en el estudio STREAM en sección 5.1).
Población pediátrica
No se ha establecido la seguridad y eficacia de Metalyse en niños (menores de 18 años). No se dispone de datos.
Forma de administración
La dosis requerida debe administrarse como bolo intravenoso único en aproximadamente 10 segundos.
Puede utilizarse un circuito intravenoso pre-existente exclusivo para la administración de Metalyse en solución de cloruro sódico 0.9%. Metalyse es incompatible con soluciones de dextrosa.
No debe añadirse ningún otro medicamento a la solución inyectable.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
Tratamiento coadyuvante
De acuerdo con las guías actuales, debe administrarse tratamiento antitrombótico coadyuvante con inhibidores plaquetarios y anticoagulantes para el tratamiento de pacientes con infarto de miocardio con elevación de ST.
Para intervención coronaria ver sección 4.4.
Se ha utilizado heparina no fraccionada y enoxaparina como tratamiento antitrombótico coadyuvante en ensayos clínicos con Metalyse.
Debe iniciarse el tratamiento con ácido acetilsalicílico lo antes posible tras la presentación de los síntomas y debe continuarse durante toda la vida a menos que esté contraindicado.
4.3 Contraindicaciones
Metalyse no debe ser administrado a pacientes con historia de reacción anafiláctica (i.e. con peligro para la vida) a cualquier de los componentes (i.e. tenecteplasa o cualquier excipiente) o a la gentamicina (una sustancia residual del proceso de fabricación). Si de todos modos el tratamiento con Metalyse se considera necesario, se debe disponer inmediatamente de mecanismos de reanimación por si fuera necesario.
Además, como el tratamiento trombolítico se asocia a un mayor riesgo de hemorragia, Metalyse está contraindicado en las siguientes situaciones:
- Trastorno hemorrágico significativo actual o durante los últimos 6 meses
- Pacientes que reciben tratamiento efectivo con anticoagulantes orales, p. ej., warfarina sódica(INR > 1,3) (ver sección 4.4, subsección “Hemorragia”)
- Historia de lesión del sistema nervioso central (por ej., neoplasma, aneurisma, cirugía intracraneal o espinal)
- Diátesis hemorrágica conocida
- Hipertensión no controlada grave
- Cirugía mayor, biopsia de un órgano parenquimatoso o traumatismo significativo durante los últimos 2 meses (incluyendo cualquier traumatismo asociado con el IAM actual)
- Traumatismo reciente de la cabeza o el cráneo
- Reanimación cardiopulmonar prolongada (> 2 minutos) durante las últimas 2 semanas
- Pericarditis aguda y/o endocarditis bacteriana subaguda
- Pancreatitis aguda
- Disfunción hepática grave, incluyendo fallo hepático, cirrosis, hipertensión portal (varices esofágicas) y hepatitis activa
- Ulcera péptica activa
- Aneurisma arterial y malformación arterial/venosa conocida
- Neoplasma con riesgo aumentado de hemorragia
- Cualquier historia conocida de ictus hemorrágico o ictus de origen desconocido
- Historia conocida de ictus isquémico o ataque isquémico transitorio (AIT) en los 6 meses anteriores
- Demencia
4.4 Advertencias y precauciones especiales de empleo
Intervención coronaria
Si está programada una intervención coronaria percutánea (ICP) de acuerdo a las guías actuales de tratamiento, no se debe administrar tenecteplasa (ver sección 5.1 estudio ASSENT-4).
Los pacientes que no se pueden someter a una ICP primaria en 1 hora tal y como se recomienda en las guías y que reciben tenecteplasa como tratamiento de recanalización coronaria primaria deben ser trasladados sin demora a un centro habilitado para intervención coronaria para angiografía e intervención coronaria adyuvante a tiempo en 6-24 horas o antes si el médico lo indica (ver sección 5.1 Estudio STREAM).
Hemorragia
Durante el tratamiento con tenecteplasa la complicación más común detectada es la hemorragia. Puede contribuir a esta hemorragia la administración concomitante de heparina como anticoagulante. Como durante el tratamiento con tenecteplasa se produce lisis de fibrina, puede producirse hemorragia en el sitio de punción reciente. Por lo tanto, el tratamiento trombolítico requiere cuidadosa atención de todos los posibles puntos de hemorragia (incluyendo puntos de inserción de catéteres, puntos de punción arterial o venosa, zonas de corte y sitios de punción con aguja). Durante el tratamiento con tenecteplasa debe evitarse el uso de catéteres rígidos, las inyecciones intramusculares y la manipulación innecesaria del paciente.
Las hemorragias observadas con mayor frecuencia se produjeron en el sitio de inyección, y ocasionalmente se observó hemorragia genitourinaria y gingival.
Si se produce una hemorragia grave, en particular hemorragia cerebral, debe suspenderse de inmediato la administración simultánea de heparina. Debe considerarse la administración de protamina si se ha administrado heparina durante las 4 horas precedentes al inicio de la hemorragia. En los pocos pacientes que no respondan a estas medidas conservadoras, puede estar indicada una administración cautelosa de perfusiones. Debe considerarse la perfusión de crioprecipitados, plasma fresco congelado y plaquetas, con una reevaluación clínica y de laboratorio después de cada administración. Con la perfusión de crioprecipitados es deseable obtener un nivel de fibrinógeno de 1g/l. Los fármacos antifibrinolíticos estarán disponibles como última alternativa._En las siguientes condiciones el riesgo del tratamiento con tenecteplasa puede verse incrementado y debe ponderarse frente a los beneficios previstos:
- Presión arterial sistólica > 160 mm Hg
- Enfermedad cerebrovascular
- Hemorragia gastrointestinal o genitourinaria reciente (durante los últimos 10 días)
- Elevada probabilidad de trombo cardiaco en el ventrículo izquierdo, por ej., estenosis mitral con fibrilación auricular
- Cualquier inyección intramuscular reciente conocida (durante los últimos 2 días)
- Edad avanzada, por ej., mayor de 75 años
- Bajo peso corporal < 60 kg.
- Pacientes que reciben anticoagulantes orales: el uso de Metalyse se puede considerar cuando la dosis o el tiempo desde la última toma de tratamiento anticoagulante hace improbable que haya una eficacia residual y si las pruebas de actividad anticoagulante apropiadas para los correspondientes medicamentos no muestran actividad clínicamente relevante sobre el sistema de coagulación (p. ej., INR <1,3 para antagonistas de la vitamina K u otras pruebas pertinentes para otros anticoagulantes orales que estén dentro del correspondiente límite superior de la normalidad).
Arritmias
La trombolisis coronaria puede dar lugar a arritmias asociadas a la reperfusión. Se recomienda tener disponible un tratamiento antiarrítmico para la bradicardia y/o taquiarritmia ventricular (marcapasos, desfibrilador) cuando se administre tenecteplasa.
Antagonistas GPIIb/IIIa
El uso concomitante de antagonistas GPIIb/IIIa aumenta el riesgo de hemorragia. Hipersensibilidad/Re-administración
No se ha observado formación sostenida de anticuerpos a tenecteplasa tras el tratamiento. Sin embargo, no se dispone de experiencia sistemática en la re-administración de tenecteplasa. Tenecteplasa debe administrarse con precaución a individuos con hipersensibilidad conocida (distinta a reacciones anafilácticas) al principio activo, cualquier excipiente o a la gentamicina (sustancia residual del proceso de fabricación). Si se produce una reacción anafilactoide, debe interrumpirse inmediatamente la inyección y debe iniciarse un tratamiento adecuado. En cualquier caso, no debe re-administrarse la tenecteplasa antes de la valoración de los factores hemostáticos tales como, el fibrinógeno, el plasminógeno y la a2-antiplasmina.
Población pediátrica
Metalyse no está recomendado para uso en niños (menores de 18 años) debido a la ausencia de datos sobre seguridad y eficacia.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacción con tenecteplasa y los medicamentos administrados habitualmente en pacientes con IAM. No obstante, el análisis de datos de más de 12.000 pacientes tratados durante las Fases I, II y III no reveló interacciones clínicas importantes con medicamentos utilizados habitualmente en pacientes con IAM y administrados simultáneamente con tenecteplasa.
Los medicamentos que afectan a la coagulación o aquellos que alteran la función plaquetaria (p.ej. ticlopidina, clopidogrel, heparinas de bajo peso molecular (LMWH)) pueden aumentar el riesgo de hemorragia antes, durante o después del tratamiento con tenecteplasa.
El uso concomitante de antagonistas GPIIb/IIIa aumenta el riesgo de hemorragia.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Hay datos limitados relativos al uso de Metalyse en mujeres embarazadas. Los datos preclínicos obtenidos con tenecteplasa mostraron hemorragias con mortalidad secundaria de los animales madre debido a la actividad farmacológica conocida del principio activo y en algunos casos se produjo aborto y reabsorción del feto (efectos solo observados con una administración repetida de la dosis). Tenecteplasa no se considera teratogénica (ver sección 5.3).
Se debe valorar el beneficio del tratamiento frente a los riesgos potenciales en caso de infarto de miocardio durante el embarazo.
Lactancia
Se desconoce si la tenecteplasa se excreta en la leche materna. Se debe evitar la lactancia durante las primeras 24 horas después del tratamiento trombolítico.
Fertilidad
No se dispone de datos clínicos ni preclínicos en fertilidad con tenecteplasa (Metalyse).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
Resumen del perfil de seguridad
La hemorragia es una reacción adversa muy frecuente asociada al uso de la tenecteplasa. El tipo de hemorragia es principalmente superficial en el sitio de inyección. Frecuentemente se han observado casos de equimosis que,_normalmente, no requieren ninguna acción específica. Se han descrito muerte e incapacidad permanente en pacientes que han presentado ictus (incluyendo hemorragia intracraneal) y otros episodios graves de hemorragia.
Tabla de reacciones adversas
Las reacciones adversas se clasifican según la frecuencias y según la clasificación por órganos y sistemas según las siguientes categorías: muy frecuente (> 1/10); frecuente (> 1/100 a < 1/10); poco frecuente (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1.000); muy raras (< 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1. Muestra las frecuencias de las reacciones adversas
|
Clasificación por órganos y sistemas |
Reacción adversa |
|
Trastornos del sistema inmunológico | |
|
Raras |
Reacción anafilactoide (incluyendo exantema, urticaria, broncoespasmo, edema laríngeo) |
|
Trastornos del sistema nervioso | |
|
Poco frecuentes |
Hemorragia intracraneal (como hemorragia cerebral, hematoma cerebral, ictus hemorrágico, transformación hemorrágica del ictus, hematoma intracraneal, hemorragia subaracnoidea) incluyendo síntomas asociados como somnolencia, afasia, hemiparesia, convulsiones |
|
Trastornos oculares | |
|
Poco frecuentes |
Hemorragia en el ojo |
|
Trastornos cardíacos | |
|
Poco frecuentes |
La aparición de arritmias de reperfusión (como asistolia, arritmia idioventricular acelerada, arritmia, extrasístoles, fibrilación auricular, bloqueo auriculo-ventricular de primer grado a bloqueo auriculo-ventricular completo, bradicardia, taquicardia, arritmia ventricular, fibrilación ventricular, taquicardia ventricular) guarda una estrecha relación temporal con el tratamiento con tenecteplasa. Las arritmias de reperfusión pueden conducir a un paro cardíaco, pueden ser una amenaza para la vida y pueden necesitar el uso de tratamiento antiarrítmico convencional |
|
Raras |
Hemorragia del pericardio |
|
Trastornos vasculares | |
|
Muy frecuentes |
Hemorragia |
|
Raras |
Embolia (embolización trombótica) |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes |
Epistaxis |
|
Raras |
Hemorragia pulmonar |
|
Trastornos gastrointestinales | |
|
Frecuentes |
Hemorragia gastrointestinal (como hemorragia gástrica, úlcera gástrica sangrante, hemorragia rectal, hematemesis, melena, hemorragia bucal) |
|
Poco frecuentes |
Hemorragia retroperitoneal (como hematoma retroperitoneal) |
|
Frecuencia no conocida |
Náuseas, vómitos |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes |
Equimosis |
|
Trastornos renales y urinarios | |
|
Frecuentes |
Hemorragia urogenital (como hematuria, hemorragia en el tracto urinario) |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Frecuentes |
Hemorragia en el lugar de inyección, hemorragia en el lugar de punción. |
|
Clasificación por órganos y sistemas |
Reacción adversa |
|
Exploraciones complementarias | |
|
Raras |
Presión arterial disminuida |
|
Frecuencia no conocida |
Temperatura corporal aumentada |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos | |
|
Frecuencia no conocida |
Embolia grasa, lo cual puede conducir a las correspondientes consecuencias en los órganos afectados |
Al igual que con otros agentes trombolíticos, se han descrito los siguientes acontecimientos como secuelas
del infarto de miocardio y/o de la administración de trombolíticos:
- muy frecuentes (>1/10): hipotensión, trastornos del ritmo y frecuencia cardíacos, angina de pecho
- frecuentes (>1/100, <1/10): isquemia recurrente, insuficiencia cardíaca, infarto de miocardio, shock cardiogénico, pericarditis, edema pulmonar
- poco frecuentes (>1/1.000, <1/100): paro cardíaco, regurgitación de la válvula mitral, derrame pericárdico, trombosis venosa, taponamiento cardíaco, rotura del miocardio
- raras (>1/10.000, >1/1.000): embolia pulmonar
Estas reacciones cardiovasculares pueden suponer un riesgo para la vida y conducir a la muerte.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
En caso de sobredosis puede existir un riesgo aumentado de hemorragia. Si se produce una hemorragia prolongada grave, puede considerarse un tratamiento sustitutivo (plasma, plaquetas), ver también sección
4.4.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: agentes antitrombóticos, código ATC: B01A D11 Mecanismo de acción
La tenecteplasa es un activador recombinante del plasminógeno específico para la fibrina, derivado del t-PA natural por modificación en tres puntos de la estructura proteica. Se une al componente fibrina del trombo (coágulo sanguíneo) y convierte selectivamente el plasminógeno unido al trombo en plasmina, la cual degrada la matriz de fibrina del trombo. La tenecteplasa posee una mayor especificidad para la fibrina y una mayor resistencia a la inactivación por su inhibidor endógeno (IAP-1), en comparación con t-PA natural.
Efectos farmacodinámicos
Después de la administración de tenecteplasa, se ha observado un consumo de a2-antiplasmina dosis-dependiente (el inhibidor de la plasmina de la fase fluida), con el consiguiente aumento en el nivel de producción de plasmina sistémica. Esta observación es concordante con el pretendido efecto de activación del plasminógeno. En estudios comparativos, se observó una reducción del fibrinógeno inferior al 15 % y una reducción del plasminógeno inferior al 25 %, en sujetos tratados con la dosis máxima de tenecteplasa (10.000 U, correspondientes a 50 mg), mientras que la alteplasa ocasionó una disminución de aproximadamente un 50 % en los niveles de fibrinógeno y plasminógeno. No se detectó una formación de anticuerpos clínicamente relevante a los 30 días.
Eficacia clínica y seguridad
Los datos de permeabilidad de los estudios angiográficos en Fases I y II sugieren que la tenecteplasa, administrada como bolo intravenoso único en sujetos con IAM, es eficaz en la disolución de los coágulos sanguíneos de la arteria relacionada con el infarto de forma dosis-dependiente.
ASSENT-2
Un estudio a gran escala de la mortalidad (ASSENT II) en aproximadamente 17.000 pacientes, mostró que la tenecteplasa es terapéuticamente equivalente a la alteplasa en la reducción de la mortalidad (6,2 % para ambos tratamientos, a 30 días, siendo 1,124 el límite superior del intervalo de confianza (IC) del 95 % para el riesgo relativo) y que el uso de tenecteplasa se asocia con una incidencia de hemorragias no intracraneales significativamente inferior (26,4 % vs. 28,9%, p = 0,0003). Esto se traduce en una necesidad de transfusiones significativamente inferior (4,3 % vs. 5,5%, p = 0,0002). La hemorragia intracraneal se produjo en una proporción del 0,93 % vs. 0,94 % para tenecteplasa y alteplasa, respectivamente.
La permeabilidad coronaria y los datos limitados de los resultados clínicos, mostraron que los pacientes con IAM, después de 6 horas de aparición de los síntomas, han sido tratados satisfactoriamente.
ASSENT-4
El estudio ASSENT-4 PCI se diseñó para poner de manifiesto si en 4.000 pacientes con infarto de miocardio extenso, el pre-tratamiento con dosis completas de tenecteplasa y un bolo único concomitante de hasta 4.000 UI de heparina no fraccionada, administrados previamente a una intervención coronaria percutánea (ICP) primaria que debe realizarse en los 60-180 minutos posteriores, se obtienen mejores resultados que mediante la ICP primaria solamente. El estudio se detuvo prematuramente con 1.667 pacientes aleatorizados, debido a una mortalidad numérica mayor en el grupo de la ICP facilitada que recibía tenecteplasa. La incidencia de la variable principal, siendo ésta la combinación de muerte o shock cardiogénico o insuficiencia cardíaca congestiva en 90 días, fue significativamente mayor en el grupo que recibía el tratamiento exploratorio de tenecteplasa seguido de ICP inmediata de rutina: 18,6% (151/810) en comparación con 13,4% (110/819) en el grupo que únicamente recibió ICP, p=0,0045. Esta diferencia significativa entre grupos, en cuanto al criterio de valoración primario a los 90 días, ya apareció a nivel intra-hospitalario y a los 30 días.
Numéricamente, todos los componentes de la variable clínica principal combinada eran favorables al tratamiento con ICP únicamente: muerte: 6,7% vs. 4,9% p=0,14; shock cardiogénico: 6,3% vs. 4,8% p=0,19; insuficiencia cardíaca congestiva: 12,0% vs. 9,2% p=0,06, respectivamente. Las variables secundarias, reinfarto y revascularización repetida de los vasos diana, aumentaron significativamente en el grupo pre-tratado con tenecteplasa: re-infarto: 6,1% vs. 3,7% p=0,0279; revascularización repetida de los vasos diana: 6,6% vs. 3,4% p=0,0041. Las siguientes reacciones adversas se presentaron con mayor frecuencia con el uso de tenecteplasa previamente a la ICP: hemorragia intracraneal: 1% vs. 0% p=0,0037; ictus: 1,8% vs. 0% p<0,0001; hemorragias mayores: 5,6% vs. 4,4% p=0,3118; hemorragias menores: 25,3% vs. 19,0% p= 0,0021; transfusiones de sangre: 6,2% vs. 4,2% p=0,0873; cierre brusco del vaso: 1,9% vs. 0,1% p=0,0001.
Estudio STREAM
El estudio STREAM fue diseñado para evaluar la eficacia y seguridad de una estrategia fármaco-invasiva frente a una estrategia de ICP primaria estándar en pacientes con infarto agudo de miocardio con elevación ST en las 3 horas siguientes al inicio de los síntomas y en los que era imposible realizar una ICP primaria en el plazo de una hora desde el primer contacto médico. La estrategia fármaco-invasiva consistió en un tratamiento fibrinolítico precoz con un bolo de tenecteplasa y tratamiento adicional con medicamentos antiagregantes plaquetarios y antitrombóticos seguido de angiografía en las siguientes 6-24 horas o intervención coronaria de rescate.
La población en estudio consistió en 1.892 pacientes aleatorizados por medio de un sistema de respuesta de voz interactivo. La variable principal, combinación de muerte o shock cardiogénico o insuficiencia cardíaca congestiva o reinfarto en 30 días, se observó en un 12,4% (116/939) en el brazo fármaco-invasivo frente a un 14,3% (135/943) en el brazo de ICP primaria (riesgo relativo 0,86 (0,68-1,09)).
Los componentes individuales de la variable principal compuesta para la estrategia fármaco-invasiva frente a la ICP primaria se observaron con las siguientes frecuencias:
|
Fármaco-invasivo (n=944) |
ICP primaria (n=948) |
P | |
|
Combinación de muerte, shock, insuficiencia cardíaca congestiva, reinfarto |
116/939 (12,4%) |
135/943 (14,3%) |
0,21 |
|
Mortalidad por cualquier causa |
43/939 (4,6%) |
42/946 (4,4%) |
0,88 |
|
Shock cardiogénico |
41/939 (4,4%) |
56/944 (5,9%) |
0,13 |
|
Insuficiencia cardíaca congestiva |
57/939 (6,1%) |
72/943 (7,6%) |
0,18 |
|
Reinfarto |
23/938 (2,5%) |
21/944 (2,2%) |
0,74 |
|
Mortalidad cardíaca |
31/939 (3,3%) |
32/946 (3,4%) |
0,92 |
La incidencia observada de hemorragias no-HIC mayor y menor fue similar en los dos grupos:
|
Fármaco-invasivo (n=944) |
ICP primaria (n=948) |
P | |
|
Hemorragia no-HIC mayor |
61/939 (6,5%) |
45/944 (4,8%) |
0,11 |
|
Hemorragia no-HIC menor |
205/939 (21,8%) |
191/944 (20,2%) |
0,40 |
Incidencia de ictus totales y hemorragia intracraneal:
|
Fármaco-invasivo (n=944) |
ICP primaria (n=948) |
P | |
|
Ictus totales (de todo tipo) |
15/939 (1,6%) |
5/946 (0,5%) |
0,03* |
|
Hemorragia intracranial Hemorragia intracranial después de modificar el protocolo reduciendo la |
9/939 (0,96%) |
2/946 (0,21%) |
0,04** |
|
dosis a la mitad en pacientes >75 años: |
4/747 (0,5%) |
2/758 (0,3%) |
0,45 |
* Las incidencias en ambos grupos son las esperadas en pacientes STEMI tratados con fibrinolíticos o ICP primaria (como se observó en estudios previos).
** La incidencia en el grupo fármaco-invasivo es la esperada para fibrinolisis con tenecteplasa (como se observó en estudios previos).
Después de la reducción a la mitad de la dosis de tenecteplasa en pacientes >75 años no hubo más hemorragias intracraneales (0 de 97 pacientes) (95% IC: 0,0-3,7) frente a 8,1% (3 de 37 pacientes) (95% IC: 1,7-21,9) antes de la reducción de la dosis. Los límites del intervalo de confianza de las incidencias observadas antes y después de la reducción de la dosis se superponen.
En pacientes >75 años la incidencia observada de la eficacia en la variable principal combinada para la estrategia fármaco-invasiva y para la ICP primaria fue la siguiente: antes de la reducción de la dosis 11/37 (29,7%) (95% IC: 15,9-47,0) frente a 10/32 (31,3%) (95% IC: 16,1-50,0), después de la reducción de dosis: 25/97 (25,8%) (95% IC: 17,4-35,7) frente a 25/88 (24,8%) (95% IC: 19,3-39,0).
En ambos grupos los límites del intervalo de confianza de las incidencias observadas antes y después de la reducción de la dosis se superponen.
5.2 Propiedades farmacocinéticas
Absorción y distribución
La tenecteplasa es una proteína recombinante activadora del plasminógeno, que se administra por vía intravenosa. Después de la administración intravenosa de un bolo de 30 mg de tenecteplasa en pacientes con infarto agudo de miocardio, la concentración plasmática inicialmente estimada fue de 6,45 ± 3,60 pg/mL (media ± DE). La fase de distribución representa del 31% ± 22% al 69% ± 15% (media ± DE) del AUC total después de la administración de dosis en el rango de 5 a 50 mg.
En estudios en ratas con tenecteplasa marcada radioactivamente, se obtuvieron datos sobre la distribución tisular. El principal órgano en el que se distribuyó la tenecteplasa fue el hígado. Se desconoce si la tenecteplasa se une a las proteínas plasmáticas humanas y en qué medida. El tiempo medio de residencia (TMR) en el cuerpo es aproximadamente 1 h y el volumen medio (± DE) de distribución en el estado estacionario (Vss) es de 6,3 ± 2 L a 15 ± 7 L.
Biotransformación
La tenecteplasa se elimina de la circulación por unión a receptores específicos en el hígado, seguida de su catabolismo a péptidos pequeños. Sin embargo, la unión a receptores hepáticos es reducida si se compara con t-PA natural, dando como resultado una vida media prolongada.
Eliminación
Después de la inyección de un bolo intravenoso único de tenecteplasa, en pacientes con infarto agudo de miocardio, el antígeno tenecteplasa muestra una eliminación bifásica del plasma. En el rango de dosis terapéutica, en el aclaramiento de tenecteplasa no hay dependencia de dosis. La vida media dominante inicial es de 24 ± 5,5 (media ± DE) min, la cual es cinco veces más prolongada que la del t-PA natural. La vida media terminal es de 129 ± 87 min y el aclaramiento plasmático es de 119 ± 49 ml/min.
Un incremento del peso corporal tuvo como consecuencia un aumento moderado del aclaramiento de tenecteplasa y el aumento de edad tuvo como consecuencia una ligera reducción del aclaramiento. Por lo general, las mujeres presentan un aclaramiento menor que los hombres, pero esto puede explicarse por el peso corporal, que es generalmente inferior en las mujeres.
Linealidad/No-linealidad
El análisis de linealidad de dosis basado en el AUC sugirió que tenecteplasa muestra una farmacocinética no-lineal en el rango de dosis estudiado, es decir, de 5 a 50 mg.
Insuficiencia renal y hepática
Debido a que la tenecteplasa se elimina a través del hígado, no es de esperar que la insuficiencia renal afecte a su farmacocinética. Esto está también sustentado por los datos en animales. Sin embargo, el efecto de la insuficiencia renal y hepática en la farmacocinética de tenecteplasa en humanos no ha sido específicamente investigado. En consecuencia, no hay ninguna guía para el ajuste de dosis de tenecteplasa en pacientes con insuficiencia renal y hepática.
5.3 Datos preclínicos sobre seguridad
La administración intravenosa de una dosis única en ratas, conejos y perros sólo produjo alteraciones dosis-dependientes y reversibles de los parámetros de la coagulación, con hemorragia local en el sitio de inyección, que se consideró como una consecuencia del efecto farmacodinámico de la tenecteplasa. Los estudios de toxicidad a dosis múltiples en ratas y perros, confirmaron las observaciones mencionadas anteriormente pero la duración del estudio se limitó a dos semanas por la formación de anticuerpos a la proteína humana tenecteplasa, que produjeron anafilaxia.
Los datos farmacológicos de seguridad en monos cynomolgus revelaron una disminución de la presión arterial seguida de alteraciones del ECG, pero éstas se produjeron con exposiciones que eran considerablemente superiores a la exposición clínica.
En relación con la indicación y la administración de una dosis única en humanos, los estudios de toxicidad reproductiva se limitaron a estudios de embriotoxicidad en conejos, como especies sensibles. La tenecteplasa indujo la muerte total de la descendencia durante el periodo embrionario medio. Cuando la tenecteplasa se administró durante el periodo embrionario medio o final, las hembras grávidas mostraron hemorragia vaginal en el día después de la primera dosis. La mortalidad secundaria se observó 1-2 días después. No se dispone de datos en el periodo fetal.
Para esta clase de proteínas recombinantes no son de esperar mutagenicidad ni carcinogenicidad y no fueron necesarios estudios de genotoxicidad ni carcinogenicidad.
No se observó irritación local del vaso sanguíneo después de la administración intravenosa, intraarterial o paravenosa de la formulación final de tenecteplasa.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
L-arginina Ácido fosfórico Polisorbato 20.
Disolvente:
Agua para inyectables.
6.2 Incompatibilidades
Metalyse es incompatible con soluciones de dextrosa para perfusión intravenosa.
6.3 Período de validez
Período de validez del envase para la venta 2 años
Solución reconstituida
Se ha demostrado una estabilidad química y física, en condiciones de uso, de 24 horas a 2-8°C y de 8 horas a 30°C.
Desde un punto de vista microbiológico, el producto debe utilizarse inmediatamente después de su reconstitución. Si no se utiliza de inmediato, los tiempos de almacenamiento en condiciones de uso, y las condiciones previas a la utilización son responsabilidad del usuario y, normalmente, no deben ser superiores a 24 horas a 2-8°C.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C. Mantener el envase en el embalaje exterior.
Para las condiciones de conservación del medicamento reconstituido, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de vidrio tipo I de 20 ml, con tapón de goma gris recubierto (B2-42) y cierre “flip-off’, conteniendo polvo para solución inyectable.
Jeringa de plástico de 10 ml precargada con 10 ml de agua para inyectables para la reconstitución. Adaptador del vial estéril.
Aguja de un solo uso estéril.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Metalyse debe reconstituirse añadiendo el volumen total de agua para inyectables de la jeringa precargada al vial que contiene el polvo para inyectable.
1. Asegurar que se ha elegido el tamaño del vial adecuado según el peso corporal del paciente.
|
Categoría de peso corporal del paciente (kg) |
Volumen de solución reconstituida (ml) |
Tenecteplasa (U) |
Tenecteplasa (mg) |
|
<60 |
6 |
6.000 |
30 |
|
>60 a <70 |
7 |
7.000 |
35 |
|
>70 a <80 |
8 |
8.000 |
40 |
|
>80 a <90 |
9 |
9.000 |
45 |
|
>90 |
10 |
10.000 |
50 |
2. Verificar que el cierre del vial está todavía intacto.
3. Retirar el cierre “flip-off’ del vial.
4. Retirar el cierre de la punta de la jeringa. Inmediatamente enroscar la jeringa precargada en el adaptador del vial e insertar el tapón del vial en el medio con la punta del adaptador.
5. Añadir el agua para inyectables al interior del vial empujando el émbolo de la jeringa hacia abajo lentamente para evitar la formación de espuma.
6. Reconstituir agitando suavemente.
7. La preparación reconstituida es una solución transparente, incolora o de color amarillo claro.
Solo debe ser administrada una solución transparente y sin partículas.
8. Inmediatamente antes de administrar la solución, invertir el vial con la jeringa todavía insertada, de forma que la jeringa se encuentre debajo del vial.
9. Transferir el volumen adecuado de solución reconstituida de Metalyse a la jeringa, según el peso del paciente.
10. Desconectar la jeringa del adaptador del vial.
11. Metalyse debe administrarse al paciente por vía intravenosa, en aproximadamente 10 segundos. No debe administrarse en un circuito que contenga dextrosa.
12. Debe desecharse la solución no utilizada.
Como alternativa, la reconstitución puede realizarse con la aguja que se incluye.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él
se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/00/169/006
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 23 de febrero 2001
Fecha de la última renovación de la autorización: 23 de febrero de 2006
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTE(S) DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Nombre y dirección del (de los) fabricante(s) del (de los) principio(s) biológico(s) activo(s) Boehringer Ingelheim Pharma GmbH & Co. KG Birkendorfer Strasse 65, 88397 Biberach/Riss Alemania
Nombre y dirección del (de los) fabricante(s) responsables de la liberación de los lotes Boehringer Ingelheim Pharma GmbH & Co. KG Birkendorfer Strasse 65, 88397 Biberach/Riss Alemania
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Véase anexo I: Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
No procede.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
JERINGA DE COPOLÍMERO DE CICLOOLEFINAS/EMBALAJE EXTERIOR
1. NOMBRE DEL MEDICAMENTO
Metalyse 8.000 U
Polvo y disolvente para solución inyectable Tenecteplasa
2. PRINCIPIO(S) ACTIVO(S)
8.000 U de tenecteplasa por vial
Después de su reconstitución con 8 ml de agua para inyectables, cada ml contiene 1.000 U de tenecteplasa
3. LISTA DE EXCIPIENTES
Excipientes: L-arginina, ácido fosfórico, polisorbato 20 Sustancias residuales del proceso de fabricación: Gentamicina
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1 vial de polvo para solución inyectable 1 jeringa precargada de disolvente para uso parenteral
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa después de su reconstitución con 8 ml de disolvente Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Seguir exactamente las instrucciones de uso. El no realizarlo puede conducir a que sea administrada una dosis de Metalyse mayor de la requerida.
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
Mantener el envase en el embalaje exterior para preservarlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/00/169/005
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
INFORMACION QUE DEBE FIGURAR EN LA PARTE INTERIOR DE LA SOLAPA DEL CARTONAJE EN FORMA DE PICTOGRAMA
|
- 1 |
t |
|
t | |
|
1 | |
|
_n |
Q |
Retirar vi ciifiv de la pu r ta se |a gringa.
Retira? e|
Enroscar fLitücmcr.tc la jeringa precavida en e| adaptador
del vial.
Insertar el tapón del vial en el medio con |a 3l nta de| adaptador del vial.
Abrir la caja de| adjptariur del vial.
‘fliF.-n"-del y i al.

|
a ~1¡T |
Desconectar |
|
la Jeringa dc| | |
|
r |
adap'jdo' |
|
del vi al. La | |
|
Mr— -■ |
solución esta |
|
ahora lista | |
|
para \¿ | |
|
cm |
m/ttilír |
|
com&bolo | |
|
intravenoso, |
Invertir e| v|a|/]erln£? y transFerir el volumen adecuado de solución a |a pringa de acuerdo con Ins instrucciones de dosificación.
16. INFORMACIÓN EN BRAILLE
ETIQUETA DEL VIAL DE POLVO PARA SOLUCIÓN NYECTABLE/ACONDICIONAMIENTO PRIMARIO
1. NOMBRE DEL MEDICAMENTO
Metalyse 8.000 U
Polvo para solución inyectable
Tenecteplasa
2. PRINCIPIO(S) ACTIVO(S)
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa después de su reconstitución con 8 ml de disolvente
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Mantener el envase en el embalaje exterior para preservarlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ETIQUETA DE LA JERINGA DE DISOLVENTE
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Disolvente para Metalyse 8.000 U Disolvente para uso parenteral
2. FORMA DE ADMINISTRACIÓN
Solución reconstituida, para pacientes de peso corporal (kg):
3. FECHA DE CADUCIDAD
CAD {MM/AAAA}
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
8 ml de agua para inyectables
6. OTROS
JERINGA DE COPOLÍMERO DE CICLOOLEFINAS/EMBALAJE EXTERIOR
1. NOMBRE DEL MEDICAMENTO
Metalyse 10.000 U
Polvo y disolvente para solución inyectable Tenecteplasa
2. PRINCIPIO(S) ACTIVO(S)
10.000 U de tenecteplasa por vial
Después de su reconstitución con 10 ml de agua para inyectables, cada ml contiene 1.000 U de tenecteplasa
3. LISTA DE EXCIPIENTES
Excipientes: L-arginina, ácido fosfórico, polisorbato 20 Sustancias residuales del proceso de fabricación: Gentamicina
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1 vial de polvo para solución inyectable 1 jeringa precargada de disolvente para uso parenteral
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa después de su reconstitución con 10 ml de disolvente Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Seguir exactamente las instrucciones de uso. El no realizarlo puede conducir a que sea administrada una dosis de Metalyse mayor de la requerida.
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
Mantener el envase en el embalaje exterior para preservarlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/00/169/006
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
INFORMACION QUE DEBE FIGURAR EN LA PARTE INTERIOR DE LA SOLAPA DEL CARTONAJE EN FORMA DE PICTOGRAMA
|
- 1 |
t |
|
t | |
|
1 | |
|
_n |
Q |
Retirar vi ciifiv de la pu r ta se |a gringa.
Retira? e|
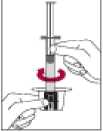
Enroscar fLitücmcr.tc la jeringa precavida en e| adaptador
del vial.
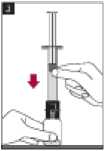
Insertar el tapón del vial en el medio con |a 3l nta de| adaptador del vial.
Abrir la caja de| adjptariur del vial.
‘fliF.-n"-del y i al.

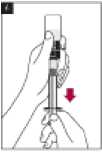
|
a ~1¡T |
Desconectar |
|
la Jeringa dc| | |
|
r |
adap'jdo' |
|
del vi al. La | |
|
Mr— -■ |
solución esta |
|
ahora lista | |
|
para \¿ | |
|
cm |
m/ttilír |
|
com&bolo | |
|
intravenoso, |
Invertir e| v|a|/]erln£? y transFerir el volumen adecuado de solución a |a pringa de acuerdo con Ins instrucciones de dosificación.
16. INFORMACIÓN EN BRAILLE
ETIQUETA DEL VIAL DE POLVO PARA SOLUCIÓN NYECTABLE/ACONDICIONAMIENTO PRIMARIO
1. NOMBRE DEL MEDICAMENTO
Metalyse 10.000 U
Polvo para solución inyectable
Tenecteplasa
2. PRINCIPIO(S) ACTIVO(S)
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa después de su reconstitución con 10 ml de disolvente
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Mantener el envase en el embalaje exterior para preservarlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ETIQUETA DE LA JERINGA DE DISOLVENTE
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Disolvente para Metalyse 10.000 U Disolvente para uso parenteral
2. FORMA DE ADMINISTRACIÓN
Solución reconstituida, para pacientes de peso corporal (kg):
3. FECHA DE CADUCIDAD
CAD {MM/AAAA}
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
10 ml de agua para inyectables
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Metalyse 8.000 unidades polvo y disolvente para solución inyectable
Tenecteplasa
Lea todo el prospecto detenidamente antes de que le sea administrado este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Metalyse y para qué se utiliza
2. Qué necesita saber antes de que le sea administrado Metalyse
3. Cómo se administra Metalyse
4. Posibles efectos adversos
5 Conservación de Metalyse
6. Contenido del envase e información adicional
1. Qué es Metalyse y para qué se utiliza
Metalyse está constituido por polvo y disolvente para solución inyectable. Esto significa que cada envase contiene:
- un vial de 8.000 unidades de Metalyse polvo y
- una jeringa precargada que contiene 8 ml de agua para inyectables.
Antes de usar, el disolvente (agua para inyectables) debe añadirse al polvo para formar una solución que se administra mediante inyección.
Metalyse pertenece a un grupo de medicamentos denominados trombolíticos. Estos medicamentos contribuyen a la disolución de los coágulos de sangre. La tenecteplasa es un activador del plasminógeno recombinante específico para la fibrina.
Metalyse se utiliza para el tratamiento de los infartos de miocardio (ataques al corazón) en las 6 horas siguientes a la aparición de los síntomas y contribuye a la disolución de los coágulos de sangre que se han formado en los vasos sanguíneos del corazón. Esto ayuda a evitar el daño ocasionado por los ataques al corazón y se ha demostrado que salva vidas.
2. Qué necesita saber antes de que le sea administrado Metalyse Metalyse no será prescrito ni administrado por su médico:
si previamente ha sufrido una reacción alérgica repentina que haya puesto en peligro su vida (hipersensibilidad grave) al principio activo tenecteplasa, a la gentamicina (sustancia residual del proceso de fabricación) o a cualquiera de los demás componentes de Metalyse. Si de todos modos el tratamiento con Metalyse se considera necesario, se debe disponer inmediatamente de mecanismos de reanimación por si fuera necesario;
si usted padece, o ha padecido recientemente, una enfermedad que aumente su riesgo de sangrado (hemorragia), incluyendo:
❖ un trastorno hemorrágico o tendencia al sangrado
❖ ictus (accidente cerebrovascular)
presión arterial muy elevada, no controlada
una herida en la cabeza
enfermedad grave del hígado
una úlcera de estómago (úlcera péptica)
venas varicosas en el esófago (varices esofágicas)
anomalía de los vasos sanguíneos (p.ej. un aneurisma)
determinados tumores
inflamación de la capa que envuelve el corazón (pericarditis); inflamación o infección de
las válvulas del corazón (endocarditis)
demencia;
- si usted está tomando comprimidos/cápsulas para "diluir" la sangre, como warfarina o cumarina (anti-coagulantes);
- si usted tiene el páncreas inflamado (pancreatitis);
- si usted ha sido sometido recientemente a una operación importante, incluyendo cirugía cerebral o espinal;
- si durante las dos últimas semanas se le ha practicado reanimación cardiopulmonar (compresiones torácicas), de más de 2 minutos de duración;
Advertencias y precauciones
Su médico tendrá especial cuidado con Metalyse
- si usted ha tenido cualquier reacción alérgica distinta a reacciones alérgicas repentinas que pongan en peligro la vida (hipersensibilidad grave) al principio activo tenecteplasa, a la gentamicina (una sustancia residual del proceso de fabricación), o a cualquier ingrediente de Metalyse (ver sección 6: "Contenido del envase e información adicional”);
- si usted presenta una presión arterial elevada;
- si usted tiene problemas con la circulación sanguínea cerebral (enfermedad cerebrovascular);
- si usted ha padecido hemorragia gastrointestinal o genitourinaria durante los últimos diez días (esto podría causar la presencia de sangre en las deposiciones u orina);
- si usted tiene una anomalía en las válvulas cardíacas (p.ej. estenosis mitral) con ritmo cardiaco anormal (p.ej. fibrilación auricular);
- si usted ha recibido una inyección intramuscular en los dos últimos días;
- si usted tiene más de 75 años;
- si usted pesa menos de 60 kg;
- si a usted se le ha administrado Metalyse anteriormente.
Niños y adolescentes
No se recomienda el uso de Metalyse en niños y adolescentes de hasta 18 años.
Uso de Metalyse con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de que le sea administrado este medicamento.
3. Cómo se administra Metalyse
El médico calcula su dosis de Metalyse de acuerdo con su peso corporal, según el siguiente esquema:
|
Peso corporal (kg) |
Inferior a 60 |
60 a 70 |
70 a 80 |
80 a 90 |
Superior a 90 |
|
Metalyse (U) |
6.000 |
7.000 |
8.000 |
9.000 |
10.000 |
Metalyse se administra mediante una inyección única en una vena por un médico con experiencia en el uso de este tipo de medicamento.
Su médico le administrará Metalyse lo antes posible después del inicio de su dolor en el pecho, en forma de una dosis única.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede tener efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos descritos a continuación han sido experimentados por pacientes que han recibido Metalyse:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- hemorragia
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- hemorragia en el lugar de inyección o punción
- hemorragias nasales
- hemorragia genitourinaria (es posible que observe sangre en su orina)
- moratones
- hemorragia gastrointestinal (p. ej. hemorragia del estómago o del recto)
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- latidos de corazón irregulares (arritmias por reperfusión), que ocasionalmente conducen a paro cardíaco. El paro cardíaco (del corazón) puede poner en peligro su vida.
- hemorragia interna en el abdomen (hemorragia retroperitoneal)
- hemorragia en el cerebro (hemorragia cerebral). Después de una hemorragia en el cerebro u otros acontecimientos graves de hemorragia puede producirse muerte o incapacidad permanente
- hemorragia en los ojos (hemorragia ocular)
Raros (pueden afectar hasta 1 de cada 1.000 personas):
- presión arterial baja (hipotensión)
- hemorragia en los pulmones (hemorragia pulmonar)
- hipersensibilidad (reacciones anafilactoides) p. ej. erupción, urticaria, dificultad para respirar (broncoespasmo)
- hemorragia en la zona que rodea el corazón (hemopericardio)
- coágulos de sangre en el pulmón (embolia pulmonar) y en los vasos de otros sistemas de órganos (embolias trombóticas)
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
- embolismo graso (coágulos formados por grasa)
- náuseas
- vómitos
- aumento de la temperatura corporal (fiebre)
- transfusiones de sangre como consecuencia de hemorragias
Al igual que con otros agentes trombolíticos. se han descrito los siguientes acontecimientos como secuelas del infarto de miocardio y/o de la administración de trombolíticos:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- presión arterial baja (hipotensión)
- latidos del corazón irregulares
- dolor en el pecho (angina de pecho)
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- dolor en el pecho/angina adicionales (isquemia recurrente)
- ataques al corazón
- insuficiencia cardíaca
- shock debido a insuficiencia cardíaca
- inflamación del recubrimiento del corazón
- fluido en los pulmones (edema del pulmón)
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- paro cardíaco
- problemas en la válvula del corazón o el recubrimiento del corazón (regurgitación de la válvula mitral, derrame pericárdico)
- coágulos de sangre en las venas (trombosis venosa)
- fluido entre el recubrimiento del corazón y el corazón (taponamiento cardíaco)
- rotura del músculo del corazón (rotura del miocardio)
Raros (pueden afectar hasta 1 de cada 1.000 personas):
- coágulos de sangre en los pulmones (embolismo pulmonar)
Estos acontecimientos cardiovasculares pueden ser potencialmente mortales y pueden conducir a la muerte.
En caso de hemorragias cerebrales se han descrito efectos relacionados con el sistema nervioso, p.ej. somnolencia, trastornos del habla, parálisis de partes del cuerpo (hemiparesia) y convulsiones.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Metalyse
Mantener este medicamento fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30°C.
Conservar el envase en el embalaje exterior para protegerlo de la luz.
Una vez reconstituido Metalyse puede conservarse durante 24 horas a 2-8°C y 8 horas a 30°C. Sin embargo, por razones microbiológicas, normalmente su médico utilizará inmediatamente la solución inyectable reconstituida.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta/embalaje.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Contenido de Metalyse
- El principio activo es tenecteplasa. Un vial contiene 8.000 unidades de tenecteplasa. Una jeringa precargada contiene 8 ml de agua para inyectables.
- Los demás componentes son L-arginina, ácido fosfórico y polisorbato 20.
- El disolvente de Metalyse es agua para inyectables.
- Contiene gentamicina como sustancia residual del proceso de fabricación.
Aspecto del producto y contenido del envase
La caja contiene un vial con un polvo liofilizado, una jeringa preparada para usar con un disolvente, un adaptador del vial y una aguja.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Alemania
Fabricante
Boehringer Ingelheim Pharma GmbH & Co. KG Birkendorfer Strasse 65 D-88397 Biberach/Riss Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
Lietuva Boehringer Ingelheim RCV GmbH & Co Lietuvos filialas Tel.: +370 37 473922 |
|
Etarapna Eboprarep HHreaxaHM PUB Tm6X h Ko Kr -KaoH Ebarapna Tea: +359 2 958 79 98 |
Luxembourg/Luxemburg SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
|
Ceská republika Boehringer Ingelheim spol. s r.o. Tel: +420 234 655 111 |
Magyarország Boehringer Ingelheim RCV GmbH & Co Lel.: +36 1 299 8900 |
|
Danmark Boehringer Ingelheim Danmark A/S Tlf: +45 39158888 |
Malta Boehringer Ingelheim Ltd. Tel: +44 1344 424 600 |
|
Deutschland Boehringer Ingelheim Pharma GmbH & Co. KG Tel: +49 (0) 800 77 90 900 |
Nederland Boehringer Ingelheim b.v. Tel: +31 (0) 800 22 55 889 |
|
Eesti Boehringer Ingelheim RCV GmbH & Co KG Eesti Filiaal Tel: +372 612 8000 |
Norge Boehringer Ingelheim Norway LS Tlf: +47 66 76 13 00 |
|
EXXáSa Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300 |
Osterreich Boehringer Ingelheim RCV GmbH & Co Lel: +43 1 80 105-0 |
|
España Boehringer Ingelheim España S.A. Tel: +34 93 404 51 00 |
Polska Boehringer Ingelheim Sp.zo.o. Tel.: +48 22 699 0 699 |
|
France Boehringer Ingelheim France S.A.S. Tél: +33 3 26 50 45 33 |
Portugal Boehringer Ingelheim, Unipessoal, Lda. Tel: +351 21 313 53 00 |
|
Hrvatska Boehringer Ingelheim Zagreb d.o.o. Tel: +385 1 2444 600 |
Romania Boehringer Ingelheim RCV GmbH & Co Viena - Sucursala Bucuresti Tel: +40 21 302 28 00 |
|
Ireland Boehringer Ingelheim Ireland Ltd. Tel: +353 1 295 9620 |
Slovenija Boehringer Ingelheim RCV GmbH & Co Podruznica Ljubljana Tel: +386 1 586 40 00 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Boehringer Ingelheim RCV GmbH & Co prganizacná zlozka Tel: +421 2 5810 1211 |
Italia
Boehringer Ingelheim Italia S.p.A. Tel: +39 02 5355 1
Kúrcpo?
Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300
Suomi/Finland
Boehringer Ingelheim Finland Ky Puh/Tel: +358 10 3102 800
Sverige
Boehringer Ingelheim AB Tel: +46 8 721 21 00
Latvija United Kingdom
Boehringer Ingelheim RCV GmbH & Co KG Boehringer Ingelheim Ltd.
Latvijas filíale Tel: +44 1344 424 600
Tel: +371 67 240 011
Fecha de la última revisión de este prospecto: {MM/AAAA}
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Prospecto: información para el usuario
Metalyse 10.000 unidades polvo y disolvente para solución inyectable
Tenecteplasa
Lea todo el prospecto detenidamente antes de que le sea administrado este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Metalyse y para qué se utiliza
2. Qué necesita saber antes de que le sea administrado Metalyse
3. Cómo se administra Metalyse
4. Posibles efectos adversos
5 Conservación de Metalyse
6. Contenido del envase e información adicional
1. Qué es Metalyse y para qué se utiliza
Metalyse está constituido por polvo y disolvente para solución inyectable. Esto significa que cada envase contiene:
- un vial de 10.000 unidades de Metalyse polvo y
- una jeringa precargada que contiene 10 ml de agua para inyectables.
Antes de usar, el disolvente (agua para inyectables) debe añadirse al polvo para formar una solución que se administra mediante inyección.
Metalyse pertenece a un grupo de medicamentos denominados trombolíticos. Estos medicamentos contribuyen a la disolución de los coágulos de sangre. La tenecteplasa es un activador del plasminógeno recombinante específico para la fibrina.
Metalyse se utiliza para el tratamiento de los infartos de miocardio (ataques al corazón) en las 6 horas siguientes a la aparición de los síntomas y contribuye a la disolución de los coágulos de sangre que se han formado en los vasos sanguíneos del corazón. Esto ayuda a evitar el daño ocasionado por los ataques al corazón y se ha demostrado que salva vidas.
2. Qué necesita saber antes de que le sea administrado Metalyse Metalyse no será prescrito ni administrado por su médico:
- si previamente ha sufrido una reacción alérgica repentina que haya puesto en peligro su vida (hipersensibilidad grave) al principio activo tenecteplasa, a la gentamicina (sustancia residual del proceso de fabricación) o a cualquiera de los demás componentes de Metalyse. Si de todos modos el tratamiento con Metalyse se considera necesario, se debe disponer inmediatamente de mecanismos de reanimación por si fuera necesario;
- si usted padece, o ha padecido recientemente, una enfermedad que aumente su riesgo de sangrado (hemorragia), incluyendo:
❖ un trastorno hemorrágico o tendencia al sangrado
❖ ictus (accidente cerebrovascular)
presión arterial muy elevada, no controlada
una herida en la cabeza
enfermedad grave del hígado
una úlcera de estómago (úlcera péptica)
venas varicosas en el esófago (varices esofágicas)
anomalía de los vasos sanguíneos (p.ej. un aneurisma)
determinados tumores
inflamación de la capa que envuelve el corazón (pericarditis); inflamación o infección de
las válvulas del corazón (endocarditis)
demencia;
- si usted está tomando comprimidos/cápsulas para "diluir" la sangre, como warfarina o cumarina (anti-coagulantes);
- si usted tiene el páncreas inflamado (pancreatitis);
- si usted ha sido sometido recientemente a una operación importante, incluyendo cirugía cerebral o espinal;
- si durante las dos últimas semanas se le ha practicado reanimación cardiopulmonar (compresiones torácicas), de más de 2 minutos de duración;
Advertencias y precauciones
Su médico tendrá especial cuidado con Metalyse
- si usted ha tenido cualquier reacción alérgica distinta a reacciones alérgicas repentinas que pongan en peligro la vida (hipersensibilidad grave) al principio activo tenecteplasa, a la gentamicina (una sustancia residual del proceso de fabricación), o a cualquier ingrediente de Metalyse (ver sección 6: "Contenido del envase e información adicional”);
- si usted presenta una presión arterial elevada;
- si usted tiene problemas con la circulación sanguínea cerebral (enfermedad cerebrovascular);
- si usted ha padecido hemorragia gastrointestinal o genitourinaria durante los últimos diez días (esto podría causar la presencia de sangre en las deposiciones u orina);
- si usted tiene una anomalía en las válvulas cardíacas (p.ej. estenosis mitral) con ritmo cardiaco anormal (p.ej. fibrilación auricular);
- si usted ha recibido una inyección intramuscular en los dos últimos días;
- si usted tiene más de 75 años;
- si usted pesa menos de 60 kg;
- si a usted se le ha administrado Metalyse anteriormente.
Niños y adolescentes
No se recomienda el uso de Metalyse en niños y adolescentes de hasta 18 años.
Uso de Metalyse con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de que le sea administrado este medicamento.
3. Cómo se administra Metalyse
El médico calcula su dosis de Metalyse de acuerdo con su peso corporal, según el siguiente esquema:
|
Peso corporal (kg) |
Inferior a 60 |
60 a 70 |
70 a 80 |
80 a 90 |
Superior a 90 |
|
Metalyse (U) |
6.000 |
7.000 |
8.000 |
9.000 |
10.000 |
Su médico le administrará medicación para la prevención de la coagulación de la sangre, además de Metalyse, lo antes posible después de que empiece el dolor en el pecho.
Metalyse se administra mediante una inyección única en una vena por un médico con experiencia en el uso de este tipo de medicamento.
Su médico le administrará Metalyse lo antes posible después del inicio de su dolor en el pecho, en forma de una dosis única.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede tener efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos descritos a continuación han sido experimentados por pacientes que han recibido Metalyse:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- hemorragia
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- hemorragia en el lugar de inyección o punción
- hemorragias nasales
- hemorragia genitourinaria (es posible que observe sangre en su orina)
- moratones
- hemorragia gastrointestinal (p. ej. hemorragia del estómago o del recto)
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- latidos del corazón irregulares (arritmias por reperfusión), que ocasionalmente conducen a paro cardíaco. El paro cardíaco (del corazón) puede poner en peligro su vida.
- hemorragia interna en el abdomen (hemorragia retroperitoneal)
- hemorragia en el cerebro (hemorragia cerebral). Después de una hemorragia en el cerebro u otros acontecimientos graves de hemorragia puede producirse muerte o incapacidad permanente
- hemorragia en los ojos (hemorragia ocular)
Raros (pueden afectar hasta 1 de 1.000 personas):
- presión arterial baja (hipotensión)
- hemorragia en los pulmones (hemorragia pulmonar)
- hipersensibilidad (reacciones anafilactoides) p. ej. erupción, urticaria, dificultad para respirar (broncoespasmo)
- hemorragia en la zona que rodea el corazón (hemopericardio)
- coágulos de sangre en el pulmón (embolia pulmonar) y en los vasos de otros sistemas de órganos (embolias trombóticas)
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
- embolismo graso (coágulos formados por grasa)
- náuseas
- vómitos
- aumento de la temperatura corporal (fiebre)
- transfusiones de sangre como consecuencia de hemorragias
Al igual que con otros agentes trombolíticos. se han descrito los siguientes acontecimientos como secuelas del infarto de miocardio y/o de la administración de trombolíticos:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- presión arterial baja (hipotensión)
- latidos del corazón irregulares
- dolor en el pecho (angina de pecho)
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- dolor en el pecho/angina adicionales (isquemia recurrente)
- ataques al corazón
- insuficiencia cardíaca
- shock debido a insuficiencia cardíaca
- inflamación del recubrimiento del corazón
- fluido en los pulmones (edema del pulmón)
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- paro cardíaco
- problemas en la válvula del corazón o el recubrimiento del corazón (regurgitación de la válvula mitral, derrame pericárdico)
- coágulos de sangre en las venas (trombosis venosa)
- fluido entre el recubrimiento del corazón y el corazón (taponamiento cardíaco)
- rotura del músculo del corazón (rotura del miocardio)
Raros (pueden afectar hasta 1 de cada 1.000 personas):
- coágulos de sangre en los pulmones (embolismo pulmonar)
Estos acontecimientos cardiovasculares pueden ser potencialmente mortales y pueden conducir a la muerte.
En caso de hemorragias cerebrales se han descrito efectos relacionados con el sistema nervioso, p.ej. somnolencia, trastornos del habla, parálisis de partes del cuerpo (hemiparesia) y convulsiones.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Metalyse
Mantener este medicamento fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30°C.
Conservar el envase en el embalaje exterior para protegerlo de la luz.
Una vez reconstituido Metalyse puede conservarse durante 24 horas a 2-8°C y 8 horas a 30°C. Sin embargo, por razones microbiológicas, normalmente su médico utilizará inmediatamente la solución inyectable reconstituida.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta/embalaje.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Contenido de Metalyse
- El principio activo es tenecteplasa. Un vial contiene 10.000 unidades de tenecteplasa. Una jeringa precargada contiene 10 ml de agua para inyectables.
- Los demás componentes son L-arginina, ácido fosfórico y polisorbato 20.
- El disolvente de Metalyse es agua para inyectables.
- Contiene gentamicina como sustancia residual del proceso de fabricación.
Aspecto del producto y contenido del envase
La caja contiene un vial con un polvo liofilizado, una jeringa preparada para usar con un disolvente, un adaptador del vial y una aguja.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Alemania
Fabricante
Boehringer Ingelheim Pharma GmbH & Co. KG Birkendorfer Strasse 65 D-88397 Biberach/Riss Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
|
Belgie/Belgique/Belgien SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
Lietuva Boehringer Ingelheim RCV GmbH & Co Lietuvos filialas Tel.: +370 37 473922 |
|
Etarapna Eboprarep HHreaxaHM PUB Tm6X h Ko Kr -KaoH Ebarapna Tea: +359 2 958 79 98 |
Luxembourg/Luxemburg SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
|
Ceská republika Boehringer Ingelheim spol. s r.o. Tel: +420 234 655 111 |
Magyarország Boehringer Ingelheim RCV GmbH & Co Lel.: +36 1 299 8900 |
|
Danmark Boehringer Ingelheim Danmark A/S Tlf: +45 39158888 |
Malta Boehringer Ingelheim Ltd. Tel: +44 1344 424 600 |
|
Deutschland Boehringer Ingelheim Pharma GmbH & Co. KG Tel: +49 (0) 800 77 90 900 |
Nederland Boehringer Ingelheim b.v. Tel: +31 (0) 800 22 55 889 |
|
Eesti Boehringer Ingelheim RCV GmbH & Co KG Eesti Filiaal Tel: +372 612 8000 |
Norge Boehringer Ingelheim Norway LS Tlf: +47 66 76 13 00 |
|
EXXáSa Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300 |
Osterreich Boehringer Ingelheim RCV GmbH & Co Lel: +43 1 80 105-0 |
|
España Boehringer Ingelheim España S.A. Tel: +34 93 404 51 00 |
Polska Boehringer Ingelheim Sp.zo.o. Tel.: +48 22 699 0 699 |
|
France Boehringer Ingelheim France S.A.S. Tél: +33 3 26 50 45 33 |
Portugal Boehringer Ingelheim, Unipessoal, Lda. Tel: +351 21 313 53 00 |
|
Hrvatska Boehringer Ingelheim Zagreb d.o.o. Tel: +385 1 2444 600 |
Romania Boehringer Ingelheim RCV GmbH & Co Viena - Sucursala Bucuresti Tel: +40 21 302 28 00 |
|
Ireland Boehringer Ingelheim Ireland Ltd. Tel: +353 1 295 9620 |
Slovenija Boehringer Ingelheim RCV GmbH & Co Podruznica Ljubljana Tel: +386 1 586 40 00 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Boehringer Ingelheim RCV GmbH & Co prganizacná zlozka Tel: +421 2 5810 1211 |
Italia
Boehringer Ingelheim Italia S.p.A. Tel: +39 02 5355 1
Kúrcpo?
Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300
Suomi/Finland
Boehringer Ingelheim Finland Ky Puh/Tel: +358 10 3102 800
Sverige
Boehringer Ingelheim AB Tel: +46 8 721 21 00
Latvija United Kingdom
Boehringer Ingelheim RCV GmbH & Co KG Boehringer Ingelheim Ltd.
Latvijas filíale Tel: +44 1344 424 600
Tel: +371 67 240 011
Fecha de la última revisión de este prospecto: {MM/AAAA}
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
58