Lomper 100 Mg Comprimidos
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Lomper 100 mg comprimidos Lomper 20 mg/ml suspensión oral
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Lomper comprimidos
Cada comprimido contiene 100 mg de mebendazol.
Excipientes con efecto conocido: cada comprimido contiene 0.06 mg de amarillo anaranjado S (E-110) y 6 x 10 "6 mg de sulfitos (formando parte del aroma de naranja).
Lomper suspensión oral
Cada militro de suspensión oral contiene 20 mg de mebendazol.
Excipientes con efecto conocido: cada mililitro contiene 3.5 mg de etanol (formando parte de la esencia de tutti fruti), 1.8 mg de parahidroxibenzoato de metilo (E-218), 0.2 mg de parahidroxibenzoato de propilo (E-216) y 100 mg de sacarosa.
PARA CONSULTAR LA LISTA COMPLETA DE EXCIPIENTES, VER SECCIÓN 6.1.
3. FORMA FARMACÉUTICA
Lomper 100 mg comprimidos Comprimido.
Comprimidos redondos, planos, biselados, de color anaranjado, ranurados por una cara y con “Lomper” marcado en la otra. La ranura sirve únicamente para fraccionar y facilitar la deglución, pero no para dividir en dosis iguales.
Lomper suspensión oral Suspensión oral.
Suspensión homogénea de color amarillo.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Lomper está indicado en el tratamiento de las siguientes parasitosis intestinales, tanto simples como mixtas (ver sección 5.1):
- Enterobiasis (oxiuriasis)
- Trichuriasis
- Ascariasis
- Anquilostomiasis
- Necatoriasis
Se deben tener en cuenta las recomendaciones oficiales sobre el uso adecuado de agentes antiparasitarios.
4.2 Posología y forma de administración
Posología
Adultos
- Enterobiasis (oxiuriasis): Una única dosis de 1 comprimido o 5 ml (1 cucharadita) de suspensión oral. Se recomienda repetir el tratamiento después de 2 y 4 semanas.
- Trichuriasis, Ascariasis, Anquilostomiasis, Necatoriasis y parasitosis mixtas: un comprimido o 5 ml (1 cucharadita) de suspensión oral dos veces al día, durante tres días consecutivos.
Niños a partir de 2 años y adolescentes
- Enterobiasis: Una única dosis de 1 comprimido o 5 ml (1 cucharadita) de suspensión oral. Se recomienda repetir el tratamiento después de 2 y 4 semanas.
- Ascariasis, Trichuriasis, Anquilostomiasis, Necatoriasis y parasitosis mixtas:_un comprimido o 5 ml (1 cucharadita) de suspensión oral dos veces al día, durante tres días consecutivos.
Se debe evitar el uso concomitante de mebendazol y metronidazol (ver sección 4.4).
Si este medicamento se administra conjuntamente con cimetidina se debe ajustar la dosis de mebendazol (ver sección 4.5).
Poblaciones especiales
Pacientes de edad avanzada No hay datos disponibles.
Población pediátrica
No se recomienda utilizar en el tratamiento de niños menores de 2 años (ver sección 4.4).
Forma de administración Vía oral.
Lomper comprimidos y suspensión oral se pueden administrar con o sin comida.
Lomper Suspensión Oral.
Agitar la suspensión oral antes de su utilización. Se incluye una cucharita de medida para el ajuste de la dosis.
4.3 Contraindicaciones
Hipersensibilidad conocida al principio activo (mebendazol) o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se debe evitar el uso concomitante de mebendazol y metronidazol. Los resultados de un estudio de casos y controles en el que se investigó un brote de Síndrome Stevens-Johnson/ necrólisis epidérmica tóxica
¡m
sugirieron una posible relación entre Síndrome Stevens-Johnson/ necrólisis epidérmica tóxica (ver sección 4.8) y el uso concomitante de mebendazol y metronidazol.
Población pediátrica
Se han notificado convulsiones en niños (muy rararamente), incluyendo a menores de un año (ver sección 4.8) durante la experiencia post-comercialización. Por este motivo, únicamente se administrará este medicamento a niños menores de 2 años cuando la infección parasitaria interfiera significativamente con su estado nutricional y desarrollo físico.
Información importante sobre excipientes Lomper Comprimidos
Este medicamento puede producir reacciones alérgicas porque contiene amarillo anaranjado S (E-110). Puede provocar asma, especialmente en pacientes alérgicos al ácido acetilsalicílico.
Este medicamento puede producir reacciones alérgicas graves y broncoespasmo porque contiene sulfitos.
Lomper Suspensión oral
Este medicamento contiene sacarosa. Los pacientes con intolerancia hereditaria a la fructosa, malabsorción de glucosa o galactosa, o insuficiencia de sacarasa-isomaltasa, no deben tomar este medicamento.
Este medicamento contiene 0.35 % de etanol (alcohol) esta pequeña cantidad se corresponden con una cantidad de 17.5 mg/5 ml.
Puede producir reacciones alérgicas (posiblemente retardadas) porque contiene parahidroxibenzoato de metilo (E-218) y parahidroxibenzoato de propilo (E-216).
4.5 Interacción con otros medicamentos y otras formas de interacción
Se debe evitar el uso concomitante de mebendazol y metronidazol (ver sección 4.4).
Cimetidina podría inhibir el metabolismo hepático de mebendazol, lo que implicaría un incremento de los niveles plasmáticos de este medicamento. Por tanto, en este último caso se recomienda determinar los niveles plasmáticos de mebendazol con el fin de ajustar la dosis adecuadamente.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Mebendazol ha mostrado actividad embriotóxica y teratogénica en ratas y ratones a dosis únicas orales (ver sección 5.3). No se han observado efectos perjudiciales para la reproducción en otras especies de animales probadas.
Se deben valorar los posibles riesgos asociados con la prescripción de Lomper durante el embarazo, especialmente durante el primer trimestre, frente a los beneficios terapéuticos esperados.
Lactancia
Se desconoce si mebendazol/metabolitos se excreta en la leche materna. Por este motivo, se debe tener precaución al administrar Lomper a mujeres lactantes.
Fertilidad
No hay datos disponibles
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Lomper sobre la capacidad para conducir y utilizar máquinas nula o insignificante.
4.8 Reacciones adversas
Se ha observado que los pacientes con una expulsión elevada de parásitos han manifestado diarrea y dolor abdominal.
La seguridad de mebendazol se ha evaluado en 6.276 pacientes que participaron en 39 ensayos clínicos para el tratamiento de parasitosis del tracto gastrointestinal (simples o mixtas). En estos ensayos no se observaron reacciones adversas con una frecuencia >1 % en pacientes tratados con este medicamento.
En la tabla 1 se muestran las reacciones adversas notificadas durante la experiencia postcomercialización, incluyendose también las reacciones adversas procedentes de ensayos clínicos1'*'1.
Las reacciones adversas al medicamento se clasifican según su frecuencia, usando el siguiente convenio:
Muy frecuentes (>1/10)
Frecuentes (>1/100 a <1/10)
Poco frecuentes (>1/1.000 a <1/100)
Raras (>1/10.000 a <1/1.000)
Muy raras (<1/10.000), incluyendo notificaciones aisladas
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Tabla 1
|
Trastornos de la sangre y del sistema linfático | |
|
Muy raras |
Neutropenia |
|
Trastornos del sistema inmunológico | |
|
Muy raras |
Reacciones de hipersensibilidad como reacciones anafilácticas y anafilactoides. |
|
Trastornos del sistema nervioso | |
|
Muy raras |
Convulsiones (ver sección 4.4) |
|
Raras |
Mareo |
|
Trastornos gastrointestinales | |
|
Frecuentes |
Dolor abdominal |
|
Poco frecuentes |
Malestar abdominal1'*'1, diarrea1'*'1 y flatulencia1'*'1 (estos síntomas también pueden ser consecuencia de la infección parasitaria por si misma) |
|
Trastornos hepatobiliares | |
|
Muy raras |
Hepatitis y función hepática anormal |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Poco frecuentes |
Erupción1'*'1 |
|
Muy raras |
Necrólisis epidérmica tóxica, síndrome Stevens-Johnson, exantema, angio-edema, urticaria, alopecia |
¡m
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
En caso de sobredosis accidental, se pueden producir calambres abdominales, náuseas, vómitos y diarreas. Con dosis sustancialmente superiores a las recomendadas o por periodos de tiempo prolongados se han notificado las siguientes reacciones adversas raramente: alopecia, alteraciones reversibles de la función hepática, hepatitis, agranulocitosis, neutropenia y glomerulonefritis.
Tratamiento
No hay disponible un antídoto específico. Se puede realizar lavado gástrico en la primera hora después de la ingestión. Si se considera apropiado puede administrarse carbón activado.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antihelmíntico, antinematodo, derivados del benzimidazol, código ATC: P02CA01.
Mecanismo de acción
Mebendazol actúa, a nivel local en el lumen intestinal, interfiriendo con la síntesis de tubulina celular del intestino de los parásitos. Se une específicamente a la tubulina causando cambios degenerativos ultraestructurales en el intestino. Como consecuencia de esto, la recaptación de glucosa y las funciones digestivas del parásito se interrumpen de tal manera que se produce la autolisis celular.
Mebendazol es activo frente a nematodos, entre los que se incluyen Enterobius vermicularis, Trichuris trichura, Ascaris lumbricoides, Ancylostoma duodenal y, Necator americanus.
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración oral, aproximadamente el 20% de la dosis pasa a circulación sistémica, debido a una absorción incompleta y al efecto de primer paso. La concentración máxima plasmática, se observa entre 2 y 4 horas después de la administración. La biodisponibilidad de mebendazol se ve ligeramente aumentada cuando se administra junto con comidas con un alto contenido en grasas.
Distribución
La unión a proteínas plasmáticas de mebendazol es de entre un 90 a 95%. El volumen de distribución es 1 a 2 L/kg, lo que indica que mebendazol penetra en áreas fuera del espacio vascular. Esto está respaldado por los datos obtenidos de pacientes en tratamiento crónico de mebendazol (p.e. 40 mg/kg/día durante 3-21 meses) en los que se muestran niveles de fármaco en tejido.
¡m
Metabolismo o Biotransformación
Se metaboliza principalmente a nivel hepático. Las concentraciones plasmáticas de sus metabolitos principales (formas amino y amino hidroxiladas de mebendazol) son sustancialmente mayores que las de mebendazol. En caso de disfunción de la función hepática, del metabolismo o de la eliminación biliar los niveles plasmáticos de mebendazol podrían verse aumentados.
Eliminación
Mebendazol, las formas conjugadas de mebendazol, y sus metabolitos probablemente sufren recirculación enterohepática y se excretan por orina y bilis. Tras la administración oral la semivida de eliminación aparente oscila de 3 a 6 horas en la mayoría de pacientes.
Datos de farmacocinética/ farmacodinamia(s)
Farmacocinética en estado estacionario
Tras una administración crónica (p.e 40 mg/kg/día durante 3-21 meses) las concentraciones plasmáticas de mebendazol y sus metabolitos principales se incrementan, resultando en una exposición aproximadamente 3 veces mayor en estado estacionario comparado con una dosis única.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de toxicidad a dosis única y de potencial carcinogénico.
Datos de estudios de toxicidad oral a dosis repetidas y crónicas en ratas, con dosis tóxicas de 40 mg/kg y superiores, mostraron alteraciones en el peso del hígado, con ligera inflamación centrilobular y vacuolización hepatocelular y en el peso testicular con una degeneración tubular, descamación y una marcada inhibición de la actividad espermatogénica.
No se observó actividad mutagénica en los estudios in vitro de mutagenicidad.
Datos de estudios in vivo no revelaron daños en la estructura del cromosoma.
Datos de estudios de micronúcleos muestran efectos aneugénicos en células somáticas de mamífero a partir de concentraciones plasmáticas de 115 ng/ml.
En ratas gestantes se han observado efectos embriotóxicos y teratogénicos con dosis únicas tóxicas maternales de 10 mg/kg y superiores. Además, en ratones también se han observado efectos teratogénicos y fetotóxicos con dosis maternalmente tóxicas de 10 mg/kg y superiores. En estudios en otras especies animales no se observaron efectos nocivos para la reproducción.
6 . DATOS FARMACÉUTICOS 6.1 Lista de excipientes
Comprimidos
- Almidón de maíz,
- amarillo anaranjado S (E-110),
- aroma de naranja (que contiene, entre otros ,sulfitos),
- carboximetilalmidón sódico tipo A (procedente de almidón de patata),
- celulosa microcristalina,
- sílice coloidal anhidra,
- estearato de magnesio,
- laurilsulfato de sodio,
- sacarina sódica y
- talco.
Suspensión oral
- Ácido cítrico monohidrato,
- amarillo de quinoleína (E-104),
- carboximetilcelulosa sódica,
- celulosa microcristalina,
- esencia de tutti fruti (que contiene entre otros etanol),
- laurilsulfato de sodio,
- metilcelulosa,
- parahidroxibenzoato de metilo (E-218),
- parahidroxibenzoato de propilo (E-216),
- sacarina sódica,
- sacarosa y
- agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
5 años.
6.4 Precauciones especiales de conservación
Lomper suspensión
No conservar a temperatura superior a 25 °C. Conservar en el embalaje original.
Lomper comprimidos
No requiere condiciones especiales de conservación. Conservar en el embalaje original.
6.5 Naturaleza y contenido del envase
Lomper comprimidos
Envases de 6 comprimidos en blisteres de AL-PVC.
Lomper suspensión oral
Frasco de plástico de 30 ml, con tapón de polietileno de seguridad, con cuentagotas incorporado de polietileno de color blanco y cucharilla de medida (5 ml) de plástico.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo a la normativa local.
Lomper suspensión
jgjl
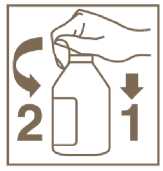
Instrucciones para el abrir el frasco :
Para abrir el tapón de seguridad, presione el lateral hacia abajo(l) y gire según indica la flecha (2)
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratorios Esteve, S.A.
Av. Mare de Déu de Montserrat, 221 08041-Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Lomper comprimidos: 51.200
Lomper suspensión oral: 53.775
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Lomper comprimidos
Fecha de la primera autorización 01/mayo/1973 Fecha de la última renovación 5 agosto/2008
Lomper suspensión
Fecha de la primera autorización 01/noviembre/1976 Fecha de la última renovación 24/noviembre/2011
10. FECHA DE LA REVISIÓN DEL TEXTO
05/2014
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
8 de 8