Lactest 0,45 G Polvo Para Solucion Oral
FICHA TÉCNICA
0. ADVERTENCIA TRIÁNGULO NEGRO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
LacTEST 0,45 g polvo para solución oral.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un sobre contiene 0,45 g de gaxilosa.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo blanco o casi blanco para solución oral.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Este medicamento es únicamente para uso diagnóstico.
LacTEST está indicado para diagnóstico de hipolactasia en adultos y en pacientes ancianos que presenten síntomas clínicos de intolerancia a la lactosa.
4.2 Posología y forma de administración
Este medicamento debe estar prescrito por un gastroenterólogo y solo debe ser administrado por un profesional sanitario debidamente autorizado y bajo adecuada supervisión médica.
Posología
En adultos, se administran por vía oral 0,45 g de gaxilosa.
Población anciana
El uso de LacTEST no está recomendado en pacientes ancianos con función renal anormal (demostrado previamente por la medida de la tasa de filtración glomerular, TFG <90 ml/ min/1,73m2), ya que la excreción renal de xilosa puede estar reducida y la seguridad y eficacia de LacTEST no han sido establecidas.
Población pediátrica
La seguridad y eficacia de LacTEST en niños de 0 a 18 años de edad, no han sido establecidas. No hay datos disponibles.
Pacientes con insuficiencia renal
La seguridad y eficacia de LacTEST en pacientes con insuficiencia renal no han sido establecidas. En los
¡m
pacientes con enfermedad renal grave, el uso de LacTEST está contraindicado (ver sección 4.3).
Pacientes con insuficiencia hepática
La seguridad y eficacia de LacTEST en pacientes con insuficiencia hepática no han sido establecidas. En los pacientes con hipertensión portal (ascitis, cirrosis), el uso de LacTEST está contraindicado (ver sección 4.3).
Forma de administración
Precauciones a considerar antes de manipular o administrar este medicamento
Después de la reconstitución del producto disuelto en agua, se obtiene una solución clara e incolora.
La realización de la prueba debe seguir la siguiente secuencia: el paciente debe vaciar su vejiga dos horas antes del comienzo de la prueba, y de nuevo entre los 15 y 30 minutos previos al comienzo de la misma. LacTEST será administrado. A partir de este momento, el paciente debe beber hasta un máximo de 500 ml de agua para facilitar la diuresis y recoger la orina acumulada en las 5 horas de duración de la prueba en un recipiente adecuado asegurándose de vaciar la vejiga antes de finalizar la prueba. Esto permitirá determinar la cantidad de xilosa acumulada en orina de 0 a 5 horas. Si el paciente vomita durante la realización de la prueba es necesario repetirla. Si es necesario repetir la prueba, no debe hacerse hasta pasados 3 días.
Para la preparación del paciente, ver sección 4.4.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración y las instrucciones de uso, ver sección 6.6.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a algunos de los excipientes incluidos en la sección 6.1
• Galactosemia
• Pentosuria.
• Pacientes con enfermedad renal grave, hipertensión portal (ascitis, cirrosis), mixedema (hipotiroidismo severo), diabetes mellitus o antecedentes de gastrectomía total y/o vagotomía.
4.4 Advertencias y precauciones especiales de empleo
Población pediátrica
Para información de uso en población pediátrica, ver sección 4.2.
Preparación del paciente
Durante la realización de la prueba en orina, a los pacientes se les pedirá que beban hasta un máximo de 500 ml de agua para facilitar la diuresis. Los pacientes deben estar en ayunas de desde 10 horas antes del comienzo de la prueba y durante su realización.
Debido a que se ha descrito que la aspirina y la indometacina disminuyen la excreción de xilosa en la orina, a los pacientes se les pedirá que no tomen estos medicamentos al menos desde 48 horas antes de la realización del test de gaxilosa hasta la finalización de la prueba.
Advertencias especiales
Debido a que la eliminación de xilosa en orina puede estar reducida en pacientes con función renal anormal, es obligatoria la evaluación en estos pacientes cuando se sospecha una potencial disfunción renal.
¡m
El uso de LacTEST no está recomendado en pacientes cuya tasa de filtración glomerular (TFG) sea inferior a 90 ml/min/1,73 m2 (ver sección 4.2.).
Si el paciente vomita durante la realización de la prueba es necesario que la repita. (Esto) no debe hacerse hasta pasados 3 días.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
Se ha descrito que la aspirina y la indometacina disminuyen la excreción de xilosa en la orina, por lo tanto se les pedirá a los pacientes que no tomen estos medicamentos al menos desde 48 horas antes de la realización del test de gaxilosa hasta la finalización de la prueba.
No se puede descartar completamente la posibilidad de interacción entre LacTEST 0,45 g y la arabinosa contenida en algunos alimentos, por tanto los pacientes serán advertidos de evitar tomar alimentos que contengan arabinosa al menos 10 horas (máximo 24 horas) antes de ingerir LacTEST 0,45 g y hasta la finalización de la prueba.
Población pediátrica
Los estudios de interacción solamente se han realizado en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se prevén efectos durante el embarazo, ya que la exposición sistémica a gaxilosa es insignificante. LacTEST se puede utilizar durante el embarazo.
Lactancia
No se prevén efectos durante la lactancia, ya que la exposición sistémica a gaxilosa es insignificante. LacTEST se puede utilizar durante la lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de LacTEST sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
El programa clínico de gaxilosa consta de 3 estudios, que representan 540 sujetos que recibieron gaxilosa vía oral (113 mg - 5,4 g) y 12 recibieron placebo. Las investigaciones utilizando el test de gaxilosa mostraron un perfil de seguridad aceptable en voluntarios sanos y en la población de destino. No se han descritos efectos adversos graves, ni efectos que fueran causa de retirada del estudio. Solamente 13 efectos adversos fueron considerados como probable o posiblemente relacionados con el producto en investigación, y ninguno de ellos dio lugar a la retirada. Cuatro de ellos fueron de intensidad moderada (prurito y urticaria) y 9 fueron leves (distensión abdominal, dolor abdominal, vómito, diarrea, náuseas y migraña).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los
profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Human; website: www.notificaRAM.es
4.9 Sobredosis
Debido al hecho que solo se ingieren 0,45 g de gaxilosa, no es esperable una sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros agentes diagnósticos, código ATC: VO4CX.
No se ha descrito actividad farmacodinámica para la cantidad de 0,45 g de gaxilosa.
LacTEST es un método no invasivo que permite evaluar la actividad global de lactasa intestinal in vivo mediante una determinación colorimétrica de xilosa en orina o en sangre, después de la administración oral de 4-O-B-D-galactopiranosil-D-xilopiranosa (gaxilosa), un disacárido producido mediante síntesis enzimática que actúa como un análogo estructural de lactosa, el sustrato fisiológico de la lactasa intestinal. Alternativamente, la xilosa en muestras de orina puede también medirse por un método enzimático. Después de su administración oral, gaxilosa es hidrolizada por la enzima de la mucosa intestinal en galactosa y xilosa, y estos productos de hidrólisis fisiológicos pasan a la sangre. La aparición de xilosa en orina se correlaciona estrechamente con los niveles de actividad lactasa intestinal determinada post-mortem en animales de experimentación, por lo tanto, el uso de gaxilosa permite evaluar in vivo la actividad de este enzima.
El punto crítico para la clasificación de los pacientes como normolactásicos o hipolactásicos mediante esta prueba diagnóstica es el siguiente: los pacientes con una cantidad total de xilosa excretada en orina de 0-5 horas igual o superior a 37,87 mg de xilosa son considerados como normolactásicos, si la xilosa es determinada por el método del floroglucinol. Si la xilosa es cuantificada por el método enzimático, los pacientes son considerados como normolactásicos cuando la cantidad total de xilosa excretada en orina de 0-5 horas es igual o superior a 19,18 mg. Si la cantidad de xilosa es menor que el valor anterior, el paciente será considerado como hipolactásico.
5.2 Propiedades farmacocinéticas
Después de la administración oral, este compuesto es hidrolizado por el enzima de la mucosa intestinal en galactosa y xilosa, y estos productos fisiológicos de la reacción pasan a la sangre.
Absorción
La gaxilosa no se absorbe a través de la mucosa intestinal como ya se ha descrito previamente. Este compuesto es hidrolizado por la lactasa intestinal en dos monosacáridos, galactosa y xilosa, los cuales son absorbidos por la mucosa intestinal, transportados a la sangre y uno de ellos, la xilosa, es eliminada en la orina.
Distribución
El producto es hidrolizado por la lactasa intestinal en galactosa y xilosa, que tras ser absorbidos, pasan a la sangre y de ahí a las vías fisiológicas normales. La galactosa se transforma en glucosa en el hígado y la xilosa se metaboliza parcialmente en forma endógena [alrededor del 50% de la xilosa ingerida independientemente de la dosis y la edad, demostrado en animales de experimentación], y el resto aparece en la sangre y finalmente se elimina en la orina. El disacárido no hidrolizado es eliminado a través del intestino.
Metabolismo
Para evaluar la velocidad de metabolización de gaxilosa y la medida en la cual la xilosa producida es metabolizada, fue necesario estudiar previamente la asimilación de xilosa en ratas de 15, 18 y 30 días de edad, evaluando la proporción en la cual este monosacárido es recuperado en la orina. Se observó que aproximadamente el 48% de la xilosa administrada es eliminada en la orina.
Un ensayo clínico, realizado en 12 voluntarios sanos (los cuales recibieron 115, 225, 450, 900, 2700 y 5400 mg de gaxilosa y placebo), mostraron claramente que la ingestión de gaxilosa fue seguido por la aparición de xilosa en sangre y orina, de tal manera que depende de la dosis oral administrada. Esto demuestra que el disacárido sintético es sustrato in vivo de la actividad lactasa intestinal en humanos y que puede ser utilizado para la evaluación no invasiva de esta actividad enzimática. La dosis mínima de gaxilosa que permite una detección fiable de la cantidad total de xilosa en orina es la de 450 mg, garantizando la recogida de la cantidad suficiente de xilosa eliminada.
Eliminación
La xilosa se absorbe de forma pasiva a través del intestino delgado y aunque una parte de ella se metaboliza (como se ha indicado anteriormente), el resto es eliminada en la orina.
Insuficiencia renal/hepática
La farmacocinética en pacientes con insuficiencia renal o hepática no se ha estudiado.
5.3 Datos preclínicos sobre seguridad
Los ensayos a diferentes dosis en animales no han detectado toxicidad a dosis altas. La dosis letal 50 en ratas y ratones tanto por vía oral como por vía intravenosa fue superior a 4000 mg/kg.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Ninguno.
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez Sobres cerrados: 2 años.
Una vez reconstituido, la solución debe usarse inmediatamente.
6.4 Precauciones especiales de conservación
Sobres cerrados. Este medicamento no requiere condiciones especiales de temperatura para su almacenamiento.
Mantener el sobre en la caja.
Para condiciones de almacenamiento después de la reconstitución, ver sección 6.3.
]£
6.5 Naturaleza y contenido del envase
Envase con un sobre de un solo uso.
Sobres formados por una hoja de PVC y una lámina de Alu/Surlyn/Opalina, conteniendo 0,45 g de gaxilosa.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Con mucho cuidado disuelva todo el contenido del sobre en unos 100 ml de agua. Se obtiene una solución clara e incolora. El paciente debe tomar inmediatamente la solución y registrar la hora de inicio de la prueba. Se recogerá la orina total desde 0 a 5 horas.
La medida de los niveles de xilosa en orina acumulada de 0-5 horas se hará tanto usando el kit enzimático en el analizador automático o haciendo uso del método manual de floroglucinol, ambos descritos a continuación. Los pacientes con una cantidad total de xilosa excretada en orina de 0-5 horas igual o superior a 19,18 mg de xilosa, utilizando el kit enzimático, y 37,87 mg de xilosa, cuantificados haciendo uso del método manual de floroglucinol, son considerados como normolactásicos. Si la cantidad de xilosa es menor que los valores anteriores (según el método usado), el paciente es considerado hipolactásico.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Análisis de las muestras y especificaciones del ensayo para los laboratorios.
Determinación de xilosa usando el Kit enzimático en analizadores automáticos
El Kit enzimático para la determinación de xilosa incluye los siguientes reactivos:
Vial 1. Tampón fosfato 50 mM, pH 8,0 (solución)
Vial 2. NAD+ liofilizado
Vial 3. Enzima xilosa deshidrogenasa liofilizada
Vial 4. Calibrador: solución estándar de xilosa (3,75 mg/dl)
Preparación de los reactivos del Kit
Importante: la preparación de los reactivos debe ser llevada a cabo en el siguiente orden.
1. Añadir tampón fosfato (vial 1) en el vial 3, para disolver la enzima liofilizada a una concentración final de 0,24 mg/ml. Mezclar suavemente para evitar pérdida de actividad de la enzima resuspendida. Mantener fría la solución durante su uso. Éste será llamado REACTIVO 2.
2. Añadir tampón fosfato (vial 1) en el vial 2 (NAD+ liofilizado) y mezclar hasta que esté totalmente disuelto (usar vórtex si es necesario).
3. Añadir la totalidad del NAD+ disuelto (NAD+ + tampón) en el vial 1. De esta forma, el vial 1 contendrá tampón fosfato más NAD+ a la concentración apropiada para los ensayos (3,4 mg/ml). Manténgase frío durante su uso si es posible. Éste será llamado REACTIVO 1.
4. La solución estándar de xilosa está lista para usarse.
Protocolo del ensayo con analizadores automáticos:
Preparación de las muestras: Tras su descongelación, cada muestra de orina debe agitarse y centrifugarse para homogeneizarla y eliminar cualquier precipitado que pudiese afectar al ensayo.
Parámetros instrumentales: Cinética de reacción con dos reactivos (R1 y R2), reacción de punto final, longitud de onda de 340 nm. La reacción se llevará a cabo a la temperatura estándar del equipo
¡m
(generalmente 37°C). La aplicación instrumental del ensayo debe ser diseñada e incorporada por el técnico responsable del equipo, de acuerdo a las siguientes especificaciones:
PROTOCOLO GENERAL DEL ENSAYO CON ANALIZADORES AUTOMÁTICOS:
En este protocolo, el volumen final de reacción (VR) es la suma de los volúmenes de reactivo 1, reactivo 2 y de agua destilada (en el caso del blanco), muestra o calibrador de xilosa.
|
Etapas |
Reactivos |
Blanco |
Calibrador |
Muestra |
|
1 |
Agua destilada |
0,175 x Vr pl |
- |
- |
|
REACTIVO 1 (tampón fosfato +NAD+) |
0,725 x Vr pl |
0,725 x Vr pl |
0,725 x Vr pl | |
|
Muestra (Orina) |
- |
- |
0,175 x Vr pl | |
|
Calibrador de xilosa (3,75 mg/dl) |
- |
0,175 x Vr pl |
- | |
|
Mezclar la reacción e incubar 5 minutos. Después, leer la absorbancia (A1) | ||||
|
2 |
REACTIVO 2 (Xilosa deshidrogenasa) |
0,1 x Vr pl |
0,1 x Vr pl |
0,1 x Vr pl |
|
Mezclar la reacción, incubar 5 minutos y leer la absorbancia final (A2) | ||||
|
Nota: Cada vez que se mida xilosa en muestras de orina, se deben medir los controles de xilosa después de la calibración. Estos controles, uno con concentración baja y otro con concentración alta, deben medirse como si fueran muestras. | ||||
Ejemplo para VR = 200 pl:
|
Etapas |
Reactivos |
Blanco |
Calibrador |
Muestra |
|
1 |
Agua destilada |
35 pl |
- |
- |
|
REACTIVO 1 (tampón fosfato +NAD+) |
145 pl |
145 pl |
145 pl | |
|
Muestra (Orina) |
- |
- |
35 pl | |
|
Calibrador de xilosa (3,75 mg/dl) |
- |
35 pl |
- | |
|
Mezclar la reacción e incubar 5 minutos. Después, leer la absorbancia (A1) | ||||
|
2 |
REACTIVO 2 (Xilosa deshidrogenasa) |
20 pl |
20 pl |
20 pl |
|
Mezclar la reacción, incubar 5 minutos y leer la absorbancia final (A2) | ||||
|
Nota: Cada vez que se mida xilosa en muestras de orina, se deben medir los controles de xilosa después de la calibración. Estos controles, uno con concentración baja y otro con concentración alta, deben medirse como si fueran muestras. | ||||
Observación: el protocolo indicado ha sido diseñado de acuerdo a especificaciones generales. Sin embargo, los volúmenes finales y las diluciones de los reactivos pueden ser diferentes en los distintos
¿lili® 2
ÍITI
analizadores, siempre que su concentración y ratio finales se mantengan en la mezcla final de la reacción (2,46 mg/ml de NAD+, 0,024 mg/ml de xilosa deshidrogenasa, y tampón fosfato 50 mM).
Cálculos:
Cantidad total de xilosa en muestras de orina
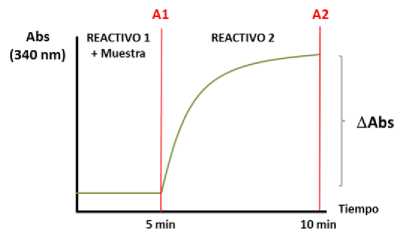
Se registrarán dos valores de Absorbancia (340 nm) en cada ensayo:
- A1 = Absorbancia inicial de la mezcla REACTIVO 1 + Muestra (incubada 5 min)
- A2 = Absorbancia final después de añadir el REACTIVO 2 (incubado 5 min)
Las diferencias entre los dos valores de Absorbancia son proporcionales a la concentración de xilosa que puede ser calculada usando la solución estándar de xilosa proporcionada como referencia:
- AAbsorbancia (340 nm) = AAbs = A2 - A1
- Concentración de xilosa en la Muestra (Orina) = [Muestra] (mg/dl)
- Concentración de xilosa en la solución estándar = 3,75 mg/dl
AAbs (Ensayo de la muestra)
[Muestra] (mg/dl) =- x 3,75 mg/dl
AAbs (Calibrador)
La cantidad total de xilosa en la Muestra (mg) se calculará a partir de su volumen total:
Xilosa (mg) = [Muestra] (mg/dl) x Volumen Muestra (di)
Ejemplo:
Determinación de la cantidad total de xilosa en una muestra de orina:
- Volumen total de la muestra (orina) = 557 ml = 5,57 dl
1) Ensayo de la muestra: A1 = 0,122
A2 = 0,146
AAbs (Ensayo de la muestra) - 0,146 - 0,122 = 0,024
2) Ensayo del calibrador: A1 = 0,087
A2 = 0,166
[Muestra] (mg/dl) =
0,024
x 3,75 mg/dl = 1,139 mg/dl
AAbs {Calibrador)— 0,166 —0,087 = 0,079
Valores normales en adultos
|
Prueba |
Xilosa en orina (mg) |
|
LacTEST 0,45 g |
> 19,18 |
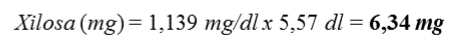
Valores por debajo de 19,18 mg son considerados indicativos de hipolactasia.
Nota:
Aspectos a considerar en cuanto a la conservación de las muestras de orina:
1. Se recomienda guardar las muestras de orina para la medida de xilosa, a 4oC si la determinación se va a realizar en el día; o de otro modo, cuando la determinación de xilosa se fuera a realizar otro día, las muestras se deben almacenar a -20oC o -70oC (las muestras congeladas son estables al menos hasta dos meses).
2. Si fuese necesario repetir la medida, las muestras pueden ser congeladas y descongeladas hasta tres veces en un periodo de 2 meses.
Validación del método de cuantificación de xilosa en orina usando el kit enzimático
|
Parámetros analíticos(*) | |
|
Rango de la curva de calibración |
De 0,25 a 15 mg/dl |
|
Linealidad |
r2 > 0,9996 |
|
Límites |
Límite de Blanco: 0,046 - 0,072 mg/dl Límite de Detección: 0,13 - 0,49 mg/dl Límite de Cuantificación: 0,42 - 1,64 mg/dl |
|
Precisión (coeficientes de variación) |
Precisión intra-ensayo < 13,6% Precisión inter-ensayo < 11,5% |
|
Exactitud (Porcentaje del valor nominal) |
Exactitud intra-ensayo < 17,2% Exactitud inter-ensayo < 5,9% |
|
Arrastre |
3,3 - 4,0% |
(*) Rangos calculados a partir de 3 analizadores automáticos diferentes.
Nota: Antes de introducir el test enzimático en un analizador específico, se debe realizar la validación analítica siguiendo las actuales Guías aprobadas.
Cuantificación de xilosa usando el método manual de floroglucinol
El método consiste en una determinación espectrofotométrica de un compuesto coloreado formado entre el reactivo floroglucinol (1,3,5-OH-benceno) y el furfural, el cual es el producto de la reacción de la xilosa en un medio fuertemente ácido.
Se incluye un protocolo validado para la determinación de xilosa en muestras de orina de pacientes, que han recibido LacTEST 0,45 g, así como las recomendaciones para el tratamiento y la conservación de las muestras.
Protocolo de determinación de Xilosa

¡m
Preparar:
a) Solución de xilosa 6,66 mM (100 mg/dl) en agua Milli Q. A partir de esta solución, se prepara la de 0,66 mM (10 mg/dl), que se utilizará en las curvas de calibración.
b) Reactivo de color con floroglucinol:
- 0,5 g de floroglucinol
- 100 ml de ácido acético glacial
- 10 ml de ácido clorhídrico.
Esta mezcla es suficiente para procesar 50 muestras (50 tubos) y se debe preparar en el momento de ser usada. Una vez preparada la mezcla no debe utilizarse pasadas 5 horas.
c) Preparar una curva patrón de xilosa dentro del rango de 0,0125 a 0,5 mg/dl (0,25 a 10 pg).
La curva patrón se expresa tanto en mg/dl como en pg de xilosa, debido a que los resultados de xilosa en orina se expresan en cantidad total (mg) referidos al volumen de orina recolectada de cada paciente durante la prueba (se utiliza la unidad de cantidad debido a que el diagnóstico en orina se expresa como la cantidad total de xilosa presente en orina). La solución estándar de xilosa se debe preparar fresca en el día, es decir cuando se vayan a realizar las medidas de xilosa en las muestras. Una vez preparada la solución estándar de xilosa no debe utilizarse pasadas 5 horas de su preparación.
|
Curva estándar de xilosa |
Muestras | |||||||
|
Xilosa, mg/dl |
0 0,0125 |
0,025 |
0,05 |
0,1 |
0,2 |
0,4 |
0,5 | |
|
Xilosa, 10 mg/dl (pl) |
- 2,5 |
5 |
10 |
20 |
40 |
80 |
100 |
- - - - |
|
Orina (pl) |
- - |
- |
- |
- |
- |
- |
- |
25 50 75 100 |
|
Agua Milli Q (pl) |
100 97,5 |
95 |
90 |
80 |
60 |
20 |
- |
75 50 25 0 |
|
React. floroglucinol (ml) |
1 9 ml | |||||||
• Se usan tubos de polipropileno de 10 ml, resistentes a ácidos y calor. Se añaden las muestras. Se hace una curva patrón de xilosa, la cual se prepara con las cantidades indicadas anteriormente.
• Se añade a cada tubo el reactivo de color con floroglucinol hasta completar un volumen de 2 ml.
• Los tubos se incuban a 100°C en un baño durante 4 minutos exactos y se enfrían en agua.
• Se mide la absorbancia a 554 nm en un colorímetro o espectrofotómetro inmediatamente después de enfriar la reacción.
• El espectrofotómetro se ajusta a cero de absorbancia, con el blanco reactivo que contiene agua y reactivo floroglucinol, antes de leer la curva patrón y las muestras. Este blanco reactivo debe calentarse y enfriarse del mismo modo que las muestras a valorar.
• Cálculos: la concentración de xilosa en las muestras de orina se calcula interpolando los valores desde la curva de calibración. El valor del volumen total de orina recogido durante las 5 horas que dura la prueba debe quedar registrado, para calcular la cantidad total de xilosa en orina de 5 horas.
Valores normales en adultos
|
Prueba |
Xilosa en orina (mg) |
|
LacTEST 0,45 g |
> 37,87 |
Valores por debajo de 37,87 mg son considerados indicativos de hipolactasia. Nota:
Aspectos a considerar en cuanto a la conservación de las muestras de orina:
¡m
1. Se recomienda guardar las muestras de orina para la medida de xilosa, a 4oC si la determinación se va a realizar en el día; o de otro modo, cuando la determinación de xilosa se fuera a realizar otro día, las muestras se deben almacenar a -20oC o -70oC (las muestras congeladas son estables al menos hasta dos meses).
2. Si fuese necesario repetir la medida, las muestras pueden ser congeladas y descongeladas hasta tres veces en un periodo de 2 meses.
Aspectos a considerar en cuanto a la solución de trabajo y al procesamiento de las muestras.
1. El reactivo de color con floroglucinol sólo es estable durante las primeras 5 horas desde su preparación.
2. Una vez que las muestras han sido procesadas por calentamiento en presencia del reactivo con floroglucinol, las muestras son estables durante las tres primeras horas después de su procesamiento.
Validación del método de medida de xilosa en orina con el método manual de floroglucinol.
|
Rango de la curva de calibración : |
0,5 - 20 mg/dl |
|
Linealidad: |
y = 1,2225x + 0,0095 r2> 0,9997 |
|
Sensibilidad: |
El límite de cuantificación para las muestras en orina y sangre es 0,5 mg/dl. |
|
Reproducibilidad |
El CV entre las diferentes muestras no debe ser mayor al 15%. |
|
Exactitud: |
El CV entre las diferentes muestras no debe ser superior al 15% |
|
Error en la medida: |
0,48 - 6,45 % |
Valores de sensibilidad y especificidad del método de detección con floroglucinol y del método enzimático.
|
Método |
Sensibilidad |
Especificidad |
Método de Referencia |
|
Método del Floroglucinol |
0,935 |
0,918 |
Biopsia |
|
Método enzimático |
0,955 |
0,993 |
Método del Floroglucinol |
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Venter Pharma S.L.
Azalea, 1.
28109 Alcobendas-Madrid España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
75797
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Abril de 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
¡y
taños
Diciembre de 2015