Kyprolis 60Mg Polvo Para Solucion Para Perfusion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Kyprolis 10 mg polvo para solución para perfusión Kyprolis 30 mg polvo para solución para perfusión Kyprolis 60 mg polvo para solución para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Kyprolis 10 mg polvo para solución para perfusión Cada vial contiene 10 mg de carfilzomib.
Kyprolis 30 mg polvo para solución para perfusión Cada vial contiene 30 mg de carfilzomib.
Kyprolis 60 mg polvo para solución para perfusión Cada vial contiene 60 mg de carfilzomib.
Tras la reconstitución, 1 ml de la solución contiene 2 mg de carfilzomib. Excipiente con efecto conocido
Cada ml de solución reconstituida contiene 7 mg de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para solución para perfusión.
Polvo liofilizado entre blanco y blanquecino.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Kyprolis en combinación con lenalidomida y dexametasona o dexametasona sola está indicado para el tratamiento de pacientes adultos con mieloma múltiple que han recibido como mínimo un tratamiento previo (ver sección 5.1).
4.2. Posología y forma de administración
El tratamiento con Kyprolis debe ser supervisado por un médico con experiencia en el uso de quimioterapia.
Posología
La dosis se calcula a partir del área de superficie corporal basal del paciente (ASC). Los pacientes con el ASC superior a 2,2 m2 deben recibir una dosis en función del ASC de 2,2 m2. No es necesario efectuar ajustes de la dosis para variaciones en el peso inferiores o equivalentes al 20%.
Cuando se combina con lenalidomida y dexametasona, Kyprolis se administra por vía intravenosa como perfusión durante 10 minutos, en dos días consecutivos, cada semana durante tres semanas (días 1, 2, 8, 9, 15 y 16), seguidas de un período de descanso de 12-días (días 17 a 28) tal y como se muestra en la tabla 1. Cada período de 28-días se considera como un ciclo de tratamiento.
Kyprolis se administra a una dosis inicial de 20 mg/m2 (dosis máxima 44 mg) en el ciclo 1, en los días 1 y 2. Si se tolera, el día 8 del ciclo 1 la dosis se debe aumentar a 27 mg/m2 (dosis máxima 60 mg). Desde el ciclo 13, las dosis de los días 8 y 9 de Kyprolis se omiten.
El tratamiento podría continuar hasta la progresión de la enfermedad o la aparición de toxicidad inaceptable.
El tratamiento con Kyprolis combinado con lenalinomida y dexametasona durante más de 18 ciclos se debe basar en la evaluación individual del balance beneficio/riesgo, puesto que los datos de la tolerabilidad y la toxicidad de carfilzomib durante más de 18 ciclos son limitados (ver sección 5.1).
Lenalidomida en combinación con Kyprolis, se administra a una dosis de 25 mg por vía oral en los días 1-21 y dexametasona se administra en una dosis de 40 mg por vía oral o intravenosa en los días 1, 8, 15 y 22 de los ciclos de 28 días. Se debe considerar una reducción adecuada de la dosis inicial de lenalidomida en conformidad con las recomendaciones de la ficha técnica actual de lenalidomida, por ejemplo, para pacientes con insuficiencia renal previa. Se debe administrar dexametasona entre 30 minutos y 4 horas antes que Kyprolis.
|
Ciclo 1 | |||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 | ||||||||
|
Día |
Día |
Días |
Día |
Día |
Días |
Día |
Día |
Días |
Día |
Días | |
|
1 |
2 |
3-7 |
8 |
9 |
10-14 |
15 |
16 |
17-21 |
22 |
23-28 | |
|
Kyprolis (mg/m2) |
20 |
20 |
- |
27 |
27 |
- |
27 |
27 |
- |
- |
- |
|
Dexametasona |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
40 |
- |
|
(mg) | |||||||||||
|
Lenalidomida |
25 mg diariamente |
- |
- | ||||||||
|
Ciclos 2-12 | |||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 | ||||||||
|
Día |
Día |
Días |
Día |
Día |
Días |
Día |
Día |
Días |
Día |
Días | |
|
1 |
2 |
3-7 |
8 |
9 |
10-14 |
15 |
16 |
17-21 |
22 |
23-28 | |
|
Kyprolis (mg/m2) |
27 |
27 |
- |
27 |
27 |
- |
27 |
27 |
- |
- |
- |
|
Dexametasona |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
40 |
- |
|
(mg) | |||||||||||
|
Lenalidomida |
25 mg diariamente |
- |
- | ||||||||
|
Ciclos 13 y en adelante | |||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 | ||||||||
|
Día |
Día |
Días |
Día |
Día |
Días |
Día |
Día |
Días |
Día |
Días | |
|
1 |
2 |
3-7 |
8 |
9 |
10-14 |
15 |
16 |
17-21 |
22 |
23-28 | |
|
Kyprolis (mg/m2) |
27 |
27 |
- |
- |
- |
- |
27 |
27 |
- |
- |
- |
|
Dexametasona |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
40 |
- |
|
(mg) | |||||||||||
|
Lenalidomida |
25 mg diariamente |
- |
- | ||||||||
El tiempo de perfusión es de 10 minutos y se mantiene constante a lo largo del régimen
Kyprolis en combinación con dexametasona
Cuando se combina con dexametasona, Kyprolis se administra por vía intravenosa como perfusión durante 30 minutos en dos días consecutivos, cada semana durante tres semanas (días 1, 2, 8, 9, 15 y 16), seguido de un período de descanso de 12 días (días 17 a 28), tal y como se muestra en la tabla 2. Cada período de 28 días se considera como un ciclo de tratamiento.
Kyprolis se administra a una dosis inicial de 20 mg/m2 (dosis máxima 44 mg) en el ciclo 1, en los días 1 y 2. Si se tolera, la dosis se debe aumentar el día 8 del ciclo 1 a 56 mg/m2 (dosis máxima 123 mg).
El tratamiento podría continuar hasta la progresión de la enfermedad o la aparición de toxicidad inaceptable.
Cuando Kyprolis se combina con dexametasona sola , dexametasona se administra en una dosis de 20 mg por vía oral o intravenosa en los días 1, 2, 8, 9, 15, 16, 22 y 23 de los ciclos de 28 días. Se debe administrar dexametasona entre 30 minutos y 4 horas antes que Kyprolis.
|
Ciclo 1 | ||||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 | |||||||||
|
Días |
Días | |||||||||||
|
Día |
Día |
Días |
Día |
10- |
Día |
Día |
Días |
Día |
Día |
24-28 | ||
|
1 |
2 |
3-7 |
Día 8 |
9 |
14 |
15 |
16 |
17-21 |
22 |
23 | ||
|
Kyprolis |
20 |
20 |
56 |
56 |
56 |
56 | ||||||
|
(mg/m2) | ||||||||||||
|
Dexametasona |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
|
(mg) | ||||||||||||
|
Ciclo 2 y todos los siguientes ciclos | ||||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 | |||||||||
|
Días |
Días | |||||||||||
|
Día |
Día |
Días |
Día |
10- |
Día |
Día |
Días |
Día |
Día |
24-28 | ||
|
1 |
2 |
3-7 |
Día 8 |
9 |
14 |
15 |
16 |
17-21 |
22 |
23 | ||
|
Kyprolis |
56 |
56 |
56 |
56 |
56 |
56 | ||||||
|
(mg/m2) | ||||||||||||
|
Dexametasona |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
|
(mg) | ||||||||||||
El tiempo de perfusión es de 30 minutos y se mantiene constante a lo largo del régimen
Medicación concomitante
Se debe considerar la profilaxis antivírica en pacientes tratados con Kyprolis para disminuir el riesgo de reactivación del herpes zóster. La mayoría de los pacientes incluidos en los estudios con Kyprolis recibieron profilaxis antivírica, por lo tanto, no es posible calcular la incidencia real de infección por herpes zóster en pacientes tratados con Kyprolis.
Se recomienda a los pacientes que reciben tratamiento con Kyprolis en combinación con dexametasona o con lenalidomida y dexametasona medidas profilácticas antitrombóticas, de acuerdo con la evaluación de los riesgos subyacentes y el estatus clínico de los pacientes. Para otros medicamentos concomitantes que puedan ser necesarios, como el uso de profilaxis con antiácidos, consultar la Ficha Técnica actual de lenalidomida y dexametasona.
Hidratación, control de líquidos y electrolitos
Se requiere una hidratación adecuada antes de administrar la dosis en el ciclo 1, especialmente en pacientes con un riesgo elevado de síndrome de lisis tumoral o toxicidad renal. Todos los pacientes deben ser controlados para detectar signos de sobrecarga de volumen y la necesidad de líquidos se debe adaptar a las necesidades individuales de los pacientes. El volumen total de líquidos se debe ajustar según se indique clínicamente en pacientes con insuficiencia cardíaca previa o con riesgo de insuficiencia cardíaca (ver sección 4.4).
La hidratación recomendada incluye tanto líquidos orales (30 ml/kg/día durante 48 horas antes del día 1 del ciclo 1) y líquidos por vía intravenosa (250 ml a 500 ml de líquidos intravenosos apropiados antes de cada dosis en el ciclo 1). Administre entre 250 ml y 500 ml de líquidos intravenosos adicionales, si fuera necesario, tras la administración de Kyprolis en el ciclo 1. Se debe continuar la hidratación oral y/o intravenosa, según sea necesario, en los ciclos posteriores.
Se deben controlar los niveles de potasio sérico mensualmente, o con más frecuencia durante el tratamiento con Kyprolis, tal y como está indicado clínicamente y dependerá de los niveles de potasio medidos antes del inicio del tratamiento, del tratamiento concomitante utilizado (por ejemplo, medicamentos conocidos que aumentan el riesgo de hipopotasemia) y de las comorbilidades asociadas.
Se debe modificar la dosis según la toxicidad de Kyprolis. Las acciones recomendadas y las modificaciones de la dosis se presentan en la tabla 3. Las reducciones de dosis se muestran en la tabla 4.
Tabla 3 Modificaciones de la dosis durante el tratamiento con Kyprolis
|
Toxicidad hematológica |
Acción recomendada |
|
• Recuento absoluto de neutrófilos < 0,5 x 109/l (ver sección 4.4) |
• Suspender la dosis - Si se recupera hasta > 0,5 x 109/l, continuar al mismo nivel de dosis • Para las disminuciones posteriores a < 0,5 x 109/l, seguir las mismas recomendaciones señaladas anteriormente y considerar 1 reducción del nivel de la dosis al reiniciar Kyprolisa |
|
• Neutropenia febril • Recuento absoluto de neutrófilos < 0,5 x 109/l y una temperatura oral > 38,5oC o dos lecturas consecutivas de > 38,0oC durante 2 horas |
• Suspender la dosis • Si el recuento absoluto de neutrófilos vuelve al valor inicial y la fiebre se resuelve, reanudar con el mismo nivel de dosis |
|
• Recuento plaquetario < 10 x 109/l o signos de hemorragia con trombocitopenia (ver sección 4.4) |
• Suspender la dosis - Si se recupera hasta > 10 x 109/l y/o se controla la hemorragia, continuar al mismo nivel de dosis • Para las disminuciones posteriores a < 10 x 109/l, seguir las mismas recomendaciones señaladas anteriormente y considerar 1 reducción del nivel de la dosis al reiniciar Kyprolisa |
|
Toxicidad no hematológica (renal) |
Acción recomendada |
|
• Creatinina sérica equivalente o superior a 2 x basal; o • Aclaramiento de creatinina < 15 ml/min (o disminución del aclaramiento de creatinina a < 50% del nivel inicial) o necesidad de diálisis (ver sección 4.4) |
• Suspender la dosis y continuar controlando la función renal (creatinina sérica o aclaramiento de creatinina) " Kyprolis se debe retomar cuando la función renal se haya recuperado dentro de un 25% del valor inicial; considerar reanudar con la reducción de 1 nivel de dosisa • Para los pacientes sometidos a diálisis que reciben Kyprolis, la dosis se debe administrar después del procedimiento de diálisis |
|
Otra toxicidad no hematológica |
Acción recomendada |
|
• Todas las otras toxicidades no hematológicas de grado 3 ó 4 (ver sección 4.4) |
• Suspender hasta que desaparezca o vuelva al valor inicial • Considerar reiniciar el siguiente tratamiento programado con 1 reducción del nivel de dosisa |
Ver tabla 4 para reducciones de dosis
a Si los síntomas no desaparecen, suspender el tratamiento con Kyprolis
|
Régimen |
Dosis de Kyprolis |
Primera reducción de la dosis de Kyprolis |
Segunda reducción de la dosis de Kyprolis |
Tercera reducción de la dosis de Kyprolis |
|
Kyprolis, lenalidomida, y dexametasona |
27 mg/m2 |
20 mg/m2 |
15 mg/m2 a |
— |
|
Kyprolis y dexametasona |
56 mg/m2 |
45 mg/m2 |
36 mg/m2 |
27 mg/m2 a |
Nota: Los tiempos de perfusión de Kyprolis se mantienen inalterados durante las reducciones de la dosis
Poblaciones especiales
Insuficiencia renal
Los pacientes con insuficiencia renal moderada o grave fueron excluidos de los estudios de Kyprolis en combinación con lenalidomida. Se debe considerar una reducción adecuada de la dosis de inicio de lenalidomida en pacientes con insuficiencia renal previa, de acuerdo con las recomendaciones de la ficha técnica de lenalidomida.
No se requiere un ajuste de la dosis inicial de Kyprolis en los pacientes con insuficiencia renal previa leve, moderada o grave o en los pacientes en diálisis crónica. No se ha estudiado el aclaramiento de las concentraciones de Kyprolis en diálisis, por lo que el medicamento se debe administrar después del procedimiento de diálisis (ver sección 5.2). En estudios clínicos de fase 3, la incidencia de efectos adversos de insuficiencia renal aguda fue mayor en sujetos con un aclaramiento de creatinina basal menor, que entre sujetos con un aclaramiento de creatinina basal mayor.
La función renal se debe controlar por lo menos mensualmente o de acuerdo con las guías aceptadas de la práctica clínica, especialmente en pacientes con menor aclaramiento de creatinina basal.
Insuficiencia hepática
Los pacientes con insuficiencia hepática no han sido evaluados sistemáticamente (ver sección 5.2). Las enzimas hepáticas y la bilirrubina se deben controlar al inicio del tratamiento y mensualmente durante el tratamiento con carfilzomib, independientemente de los valores basales.
Población de edad avanzada
En conjunto, la incidencia de algunos efectos adversos (incluida insuficiencia cardíaca) en ensayos clínicos fue mayor en pacientes que tenían > 75 años de edad en comparación con pacientes que tenían < 75 años (ver sección 4.4).
Población pediátrica
No se ha establecido la seguridad y eficacia de Kyprolis en pacientes pediátricos. No se dispone de datos.
Forma de administración
Kyprolis se administra por vía intravenosa como perfusión. La dosis de 20/27 mg/m2 se administra durante 10 minutos. La dosis de 20/56 mg/m2 se debe administrar durante 30 minutos.
No se debe administrar Kyprolis en forma de bolo.
El catéter de administración intravenosa se debe lavar con una solución normal de cloruro de sodio o solución para inyección de glucosa al 5% inmediatamente antes y después de la administración de Kyprolis.
No mezclar Kyprolis ni administrarlo como perfusión simultáneamente con otros medicamentos.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3. Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Mujeres en periodo de lactancia (ver sección 4.6).
Kyprolis se administra en combinación con otros medicamentos, por lo tanto, consultar sus fichas técnicas para contraindicaciones adicionales.
4.4. Advertencias y precauciones especiales de empleo
Kyprolis se administra en combinación con otros medicamentos, por lo que se debe consultar las fichas técnicas de aquellos medicamentos antes de iniciar el tratamiento con Kyprolis. Dado que lenalidomida se puede utilizar en combinación con Kyprolis, se debe prestar especial atención a los requisitos de lenalidomida sobre pruebas y prevención del embarazo (ver sección 4.6).
Trastornos cardíacos
Tras la administración de Kyprolis, se han dado casos de empeoramiento de insuficiencia cardíaca o nuevos casos (por ejemplo, insuficiencia cardíaca congestiva, edema pulmonar, disminución de la fracción de eyección), isquemias miocárdicas e infartos de miocardio. Se han producido fallecimientos por parada cardíaca en el período de un día tras la administración de Kyprolis y se han notificado casos de insuficiencia cardíaca e infarto de miocardio con desenlace mortal.
Se requiere una hidratación adecuada antes de la dosis del ciclo 1; asimismo, se debe controlar a todos los pacientes para detectar signos de sobrecarga de volumen, especialmente en los pacientes con riesgo de insuficiencia cardíaca. El volumen total de líquidos se debe ajustar según se indique clínicamente en pacientes con insuficiencia cardíaca previa o con riesgo de insuficiencia cardíaca (ver sección 4.2).
Suspender Kyprolis en caso de acontecimientos cardíacos de grado 3 ó 4 hasta la recuperación y considerar si se debe reiniciar Kyprolis con una reducción de 1 nivel de dosis en función de la evaluación del balance beneficio/riesgo (ver sección 4.2).
El riesgo de insuficiencia cardíaca aumenta en los pacientes de edad avanzada (> 75 años). Los pacientes con insuficiencia cardíaca de clase III y IV según la clasificación de la New York Heart Association (NYHA), infarto de miocardio reciente y anomalías de la conducción no controladas con medicación, no fueron seleccionados para participar en los ensayos clínicos. Estos pacientes pueden presentar un mayor riesgo de desarrollar complicaciones cardíacas. Los pacientes con signos o síntomas de insuficiencia cardíaca de clase III o IV de la NYHA, antecedentes recientes de infarto de miocardio (en los últimos 4 meses) y en pacientes con angina o arritmia no controladas, se deben someter a una evaluación médica completa, antes de empezar el tratamiento con Kyprolis. Esta evaluación debe optimizar el estatus del paciente, con atención particular a la presión arterial y la gestión de los líquidos. Posteriormente, los pacientes se deben tratar con precaución y permanecer bajo estrecho seguimiento.
Cambios en el electrocardiograma
Se han notificado casos de prolongación del intervalo QT en ensayos clínicos. No se puede excluir el efecto de Kyprolis sobre el intervalo QT (ver sección 5.1).
Toxicidad pulmonar
Pacientes que recibían Kyprolis, presentaron Síndrome de distrés respiratorio agudo (SDRA), insuficiencia respiratoria aguda y neumopatía infiltrativa difusa aguda como neumonitis y enfermedad
pulmonar intersticial. Algunos de estos acontecimientos han sido mortales. Se debe evaluar y suspender Kyprolis hasta que estos acontecimientos se hayan resuelto y considerar si reiniciar Kyprolis en función de la evaluación del balance beneficio/riesgo (ver sección 4.2).
Hipertensión pulmonar
Se ha notificado hipertensión pulmonar en pacientes tratados con Kyprolis. Algunos de estos acontecimientos han sido mortales. Se debe evaluar según corresponda. Suspender Kyprolis en caso de hipertensión pulmonar hasta la resolución o la recuperación del valor inicial y considerar si se debe reiniciar Kyprolis en función de la evaluación del balance beneficio/riesgo (ver sección 4.2).
Disnea
Frecuentemente se ha notificado disnea en pacientes tratados con Kyprolis. Evaluar la disnea para excluir condiciones cardiopulmonares incluyendo insuficiencia cardíaca y síndromes pulmonares. Suspender Kyprolis en caso de disnea de grado 3 y 4 hasta la resolución o recuperación del valor inicial y considerar si se debe reiniciar Kyprolis en función de la evaluación del beneficio/riesgo (ver sección 4.2 y 4.8).
Hipertensión
Se ha observado hipertensión, incluyendo crisis hipertensiva y emergencia hipertensiva con Kyprolis. Algunos de estos acontecimientos han sido mortales. Todos los pacientes deben ser evaluados rutinariamente en caso de hipertensión y tratados según sea necesario. Si la hipertensión no se puede controlar, la dosis de Kyprolis se debe reducir. En el caso de crisis hipertensivas, suspender Kyprolis hasta la resolución o recuperación del valor inicial y considerar si se debe reiniciar Kyprolis en función de la evaluación del beneficio/riesgo (ver sección 4.2).
Insuficiencia renal aguda
Se han notificado casos de insuficiencia renal aguda en pacientes que recibieron Kyprolis. Se notificaron casos de insuficiencia renal aguda con mayor frecuencia en pacientes con mieloma múltiple en recaída avanzado y refractario que recibieron Kyprolis en monoterapia. En estudios clínicos de fase 3, la incidencia de efectos adversos de insuficiencia renal aguda fue mayor en sujetos con un aclaramiento de creatinina basal menor, que entre sujetos con un aclaramiento de creatinina basal mayor. El aclaramiento de creatinina fue estable con el tiempo para la mayoría de los pacientes. Se debe controlar la función renal por lo menos mensualmente o de acuerdo con las guías aceptadas de la práctica clínica, especialmente en pacientes con menor aclaramiento de creatinina basal. Se debe reducir o suspender la dosis según corresponda (ver sección 4.2).
Síndrome de lisis tumoral
Se han notificado casos de síndrome de lisis tumoral (SLT), incluidos casos con desenlace mortal, en pacientes que recibieron Kyprolis. Se debe considerar que los pacientes con una elevada carga tumoral tienen un mayor riesgo de SLT. Es preciso asegurarse que los pacientes estén bien hidratados antes de la administración de Kyprolis en el ciclo 1 y en los ciclos posteriores, en caso de necesidad (ver sección 4.2.). Se deben tener en cuenta los medicamentos que disminuyen el ácido úrico en pacientes con un riesgo elevado de SLT. Se debe controlar los signos de SLT durante el tratamiento, incluida la determinación regular de los electrolitos séricos, y tratarlos inmediatamente. Se debe suspender el tratamiento con Kyprolis hasta que se resuelva el SLT (ver sección 4.2).
Reacciones a la perfusión
Se han notificado casos de reacciones a la perfusión, entre ellas reacciones potencialmente mortales, en pacientes que recibieron Kyprolis. Los síntomas pueden incluir fiebre, escalofríos, artralgia, mialgia, congestión facial, edema facial, vómitos, debilidad, dificultad para respirar, hipotensión, síncope, opresión en el pecho o angina de pecho. Estas reacciones pueden aparecer inmediatamente o hasta 24 horas después de la administración de Kyprolis. Se debe administrar dexametasona antes de Kyprolis para reducir la incidencia y la gravedad de las reacciones (ver sección 4.2).
Hemorragia y trombocitopenia
Se han notificado casos de hemorragia (p. ej. gastrointestinal, pulmonar y hemorragia intracraneal) en pacientes tratados con Kyprolis, asociados con frecuencia a trombocitopenia. Algunos de ellos han sido mortales (ver sección 4.8).
Kyprolis produce trombocitopenia con nadir plaquetario observado en el día 8 o el día 15 de cada ciclo de 28 días, con recuperación del recuento plaquetario basal al iniciar el nuevo ciclo (ver sección 4.8). Se debe controlar con frecuencia los recuentos plaquetarios durante el tratamiento con Kyprolis. Se debe reducir o suspender la dosis según corresponda (ver sección 4.2).
Trombosis venosa
Se han notificado acontecimientos tromboembólicos venosos, incluyendo trombosis venosa profunda y embolismo pulmonar con desenlaces mortales en pacientes que recibieron Kyprolis.
Se debe hacer un seguimiento estrecho en aquellos pacientes con factores de riesgo conocidos de tromboembolismo, incluidas trombosis previas. Se debe actuar para intentar reducir todos los factores de riesgo modificables (p. ej. fumar, hipertensión e hiperlipidemia). Se debe prestar atención a la administración concomitante de otros agentes que puedan incrementar el riesgo de trombosis (p. ej. agentes eritropoyéticos o terapia hormonal sustitutiva). Se advierte a pacientes y médicos que presten especial atención a la aparición de signos y síntomas de tromboembolismo. Se debe instruir a los pacientes sobre cómo solicitar ayuda médica si desarrollan síntomas como dificultad respiratoria, dolor en el pecho, hemoptisis, hinchazón o dolor en piernas o brazos.
Se deben considerar medidas profilácticas antitrombóticas en base a una evaluación individual del balance beneficio/riesgo.
Toxicidad hepática
Se han notificado casos de insuficiencia hepática, incluyendo casos mortales. Kyprolis puede causar elevaciones de las transaminasas séricas (ver sección 4.8). Se debe reducir o suspender la dosis según corresponda (ver sección 4.2). Se deben controlar con regularidad las enzimas hepáticas y la bilirrubina al inicio del tratamiento y mensualmente durante el tratamiento con carfilzomib, independientemente de los valores iniciales.
Microangiopatía trombótica
Se han notificado casos de microangiopatía trombótica, incluyendo púrpura trombocitopénica trombótica y síndrome urémico hemolítico (PTT/SUH) en pacientes que recibieron Kyprolis. Algunos de estos acontecimientos han sido mortales. Se deben controlar los signos y síntomas de PTT/SUH. Si se sospecha el diagnóstico, se debe suspender Kyprolis y evaluar los pacientes con posible PTT/SUH. Si se excluye el diagnóstico de PTT/SUH, se puede reiniciar Kyprolis. Se desconoce la seguridad del reinicio del tratamiento con Kyprolis en pacientes que anteriormente padecieron PTT/SUH.
Síndrome de encefalopatía posterior reversible
Se han notificado casos de síndrome de encefalopatía posterior reversible (PRES) en pacientes que recibían Kyprolis. PRES, anteriormente denominado síndrome de leucoencefalopatía posterior reversible (SLPR), es un trastorno neurológico raro, que puede producir convulsiones, cefaleas, letargia, estados confusionales, ceguera, alteración del nivel de la conciencia y otros trastornos visuales y neurológicos, junto con hipertensión, y el diagnóstico se confirma mediante imágenes neuroradiológicas. Se debe suspender Kyprolis si se sospecha de PRES. Se desconoce la seguridad del reinicio del tratamiento con Kyprolis en pacientes que anteriormente padecieron PRES.
Anticoncepción
Las pacientes en edad fértil (y/o sus parejas) deben utilizar métodos anticonceptivos efectivos durante y hasta 1 mes tras finalizar el tratamiento. Los pacientes hombres deben utilizar métodos anticonceptivos efectivos durante y hasta 3 meses tras finalizar el tratamiento, si su pareja está embarazada o en edad fértil y no utiliza métodos anticonceptivos efectivos (ver sección 4.6). Carfilzomib puede reducir la eficacia de anticonceptivos orales (ver sección 4.5).
Contenido en sodio
Este medicamento contiene 0,3 mmol (7 mg) de sodio, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
4.5. Interacción con otros medicamentos y otras formas de interacción
Carfilzomib se metaboliza principalmente por la vía de la peptidasa y la epóxido hidrolasa y, en consecuencia, es poco probable que el perfil farmacocinético de carfilzomib se vea afectado por la administración concomitante de inhibidores e inductores del citocromo P450.
Según estudios in vitro, carfilzomib no provocó la inducción de CYP3A4 en hepatocitos humanos cultivados. En un ensayo clínico en el que se utilizó midazolam oral como sonda de la CYP3A, realizado con carfilzomib a una dosis de 27 mg/m2 (perfusión de 2-10 minutos), se demostró que la farmacocinética de midazolam no se vio afectada por la administración concomitante de carfilzomib, indicando que no se espera que carfilzomib inhiba el metabolismo del sustrato de CYP3A4/5 y no sea inductor de CYP3A4 en seres humanos. No se realizó ningún ensayo clínico con dosis de 56 mg/m2. Sin embargo, se desconoce si carfilzomib induce CYP1A2, 2C8, 2C9, 2C19 y 2B6 en concentraciones terapéuticas. Se debe observar con precaución cuando carfilzomib se combina con medicamentos que son sustrato de estas enzimas, como anticonceptivos orales. Se deben tomar medidas eficaces para evitar el embarazo (ver sección 4.6 y también consultar la ficha técnica actual de lenalidomida), se debe utilizar un método alternativo para anticoncepción efectiva, en caso de que el paciente use anticonceptivos orales.
Carfilzomib no inhibe CYP1A2, 2B6, 2C8, 2C9, 2C19 y 2D6 in vitro, por lo que no se espera que influya la exposición de medicamentos que son sustratos de estas enzimas como resultado de la inhibición.
Carfilzomib es una glicoproteína P (P-gp) pero no un sustrato del BCRP. No obstante, Kyprolis se administra por vía intravenosa y se metaboliza ampliamente, por lo que es poco probable que el perfil farmacocinético de carfilzomib se vea afectado por los inhibidores o inductores de la P-gp o BCRP. In vitro, en concentraciones (3 pM) más bajas que las esperadas a dosis terapéuticas, carfilzomib inhibe el transporte de flujo de la digoxina, un sustrato de P-gp, por 25%. Se debe observar con precaución cuando carfilzomib se combina con sustratos de P-gp (por ejemplo, digoxina, colchicina).
Carfilzomib inhibe la OATP1B1 in vitro con un IC 50 = 2,01 pM, mientras se desconoce si carfilzomib puede o no inhibir a nivel sistémico otros transportadores OATP1B3, OAT1, OAT3, OCT2 y BSEP. Carfilzomib no inhibe la UGT2B7 humana pero inhibe la UGT1A1 humana con un IC 50 de 5,5 pM. No obstante, tomando en consideración la eliminación rápida de carfilzomib, que 5 minutos tras la finalización de la perfusión presenta una disminución rápida notable en la concentración sistémica, el riesgo de tener interacciones clínicamente relevantes con sustratos de OATP1B1 y UGT1A1 es probablemente bajo.
4.6. Fertilidad, embarazo y lactancia
Mujeres en edad fértil/Anticoncepción en hombres y mujeres
Las pacientes en edad fértil (y/o sus parejas) deben utilizar métodos anticonceptivos efectivos durante el tratamiento y hasta el mes posterior a finalizarlo.
No se puede excluir que la eficacia de los anticonceptivos orales se pueda reducir durante el tratamiento con carfilzomib (ver sección 4.5). Además, debido a un mayor riesgo de eventos tromboembólicos venosos asociados a carfilzomib, las mujeres deben evitar el uso de anticonceptivos hormonales asociados con riesgo de trombosis durante el tratamiento con carfilzomib (ver sección 4.4 y 4.8). Si algún paciente actualmente está utilizando anticonceptivos orales o algún método de anticoncepción hormonal asociado con riesgo de trombosis, el paciente debe cambiar a un método alternativo de anticoncepción eficaz.
Los pacientes hombres deben utilizar métodos anticonceptivos efectivos durante el tratamiento y en los 3 meses posteriores a su finalización, si su pareja está embarazada o en edad fértil y no utiliza métodos anticonceptivos efectivos.
Embarazo
No hay datos relativos al uso de carfilzomib en mujeres embarazadas.
Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3).
Teniendo en cuenta su mecanismo de acción y los hallazgos en animales, Kyprolis puede producir efectos perjudiciales en el feto si se administra a una mujer embarazada. No se debe usar Kyprolis durante el embarazo a menos que el beneficio potencial supere claramente al riesgo potencial para el feto. Si se utiliza Kyprolis durante el embarazo o si la paciente se queda embarazada mientras utiliza este medicamento, se le debe advertir de los riesgos potenciales para el feto.
Lenalidomida es estructuralmente similar a talidomida. Talidomida es una sustancia activa conocida por la teratogénesis en humanos, que causa graves defectos potencialmente mortales en recién nacidos. Si se usa lenalidomida durante el embarazo, es de esperar un efecto teratogénico de lenalidomida en humanos. Las condiciones del Programa de Prevención del Embarazo para lenalidomida se deben cumplir sin excepciones a menos que existan indicios fiables de que la paciente no sea fértil. Por favor, consulte la ficha técnica actual de lenalidomida.
Lactancia
Se desconoce si carfilzomib o sus metabolitos se excretan en la leche materna. Basándose en sus propiedades farmacológicas, no se puede excluir el riesgo en el lactante. Consecuentemente, como medida de precaución, la lactancia está contraindicada durante y por lo menos 2 días tras finalizar el tratamiento con Kyprolis.
Fertilidad
No se han realizado estudios de fertilidad en animales (ver sección 5.3).
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Kyprolis sobre la capacidad para conducir y utilizar máquinas es pequeña.
Se ha observado fatiga, mareo, desfallecimientos, visión borrosa, somnolencia y/o caída de la presión arterial en ensayos clínicos. Se debe recomendar a los pacientes tratados con Kyprolis que no conduzcan o utilicen máquinas en caso de que padezcan cualquiera de estos síntomas.
4.8. Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas más graves que se pueden producir durante el tratamiento con Kyprolis son: toxicidad cardíaca, toxicidades pulmonares, hipertensión pulmonar, disnea, hipertensión incluyendo crisis hipertensivas, insuficiencia renal aguda, síndrome de lisis tumoral, reacciones a la perfusión, trombocitopenia, toxicidad hepática, PRES y PTT/SUH. En ensayos clínicos con Kyprolis, la toxicidad cardíaca y la disnea generalmente ocurrieron en una fase temprana en el transcurso del tratamiento con Kyprolis (ver sección 4.4). Las reacciones adversas más frecuentes (que aparecieron en > 20% de los sujetos) fueron: anemia, fatiga, diarrea, trombocitopenia, náuseas, pirexia, disnea, infecciones del tracto respiratorio, tos y edema periférico.
Siguiendo la dosis inicial de carfilzomib de 20 mg/m2, la dosis se incrementó a 27 mg/m2 en el estudio PX-171-009 y a 56 mg/m2 en el estudio 2011-003 (ver sección 5.1). Una comparación de las reacciones adversas ocurridas en el brazo de Kyprolis y dexametasona (Kd) del estudio 2011-003 frente al brazo Kyprolis, lenalidomida y dexametasona (KRd) del estudio PX-171-009 sugiere que puede haber una potencial relación entre la dosis y las siguientes reacciones adversas: insuficiencia cardíaca (Kd 8,2%; KRd 6,4%), disnea (Kd 30,9%; KRd 22,7%), hipertensión (Kd 25,9%; KRd 15,8%), e hipertensión pulmonar (Kd 1,3%; KRd 0,8%).
Tabla de reacciones adversas
Las reacciones adversas se presentan a continuación según el sistema de clasificación de órganos y la categoría de frecuencia (tabla 5). Las categorías de frecuencias se determinaron a partir de la tasa bruta de incidencia notificada para cada reacción adversa en el conjunto de datos de un grupo de estudios clínicos (n = 2.044). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro del sistema de clasificación de órganos y de frecuencia.
Tabla 5 Tabla de reacciones adversas
|
Clasificación de órganos del sistema MedDRA |
Muy frecuentes (> 1/10) |
Frecuentes (> 1/100 a < 1/10) |
Poco frecuentes (> 1/1.000 a < 1/100) |
Raras (> 1/10.000 a < 1/1.000) |
|
Infecciones e infestaciones |
Neumonía Infección del tracto respiratorio Nasofaringitis |
Sepsis Gripe Infección del tracto urinario Bronquitis Infección vírica Rinitis |
Infección pulmonar | |
|
Trastornos del sistema inmunológico |
Hipersensibilidad al medicamento | |||
|
Trastornos de la sangre y del sistema linfático |
Trombocitopenia Neutropenia Anemia Linfopenia |
Neutropenia febril Leucopenia |
SUH |
PTT Microangiopatía trombótica |
|
Trastornos del metabolismo y de la nutrición |
Hipopotasemia Hiperglucemia Apetito disminuido |
Deshidratación Hiperpotasemia Hipomagnesemia Hiponatremia Hipercalcemia Hipocalcemia Hipofosfatemia Hiperuricemia Hipoalbuminemia |
Síndrome de lisis tumoral | |
|
Trastornos psiquiátricos |
Insomnio |
Ansiedad |
|
Clasificación de órganos del sistema MedDRA |
Muy frecuentes (> 1/10) |
Frecuentes (> 1/100 a < 1/10) |
Poco frecuentes (> 1/1.000 a < 1/100) |
Raras (> 1/10.000 a < 1/1.000) |
|
Trastornos del sistema nervioso |
Mareos Neuropatía periférica Cefalea |
Parestesia Hipoestesia |
Hemorragia intracraneal Accidente cerebrovascular |
PRES |
|
Trastornos oculares |
Cataratas Visión borrosa | |||
|
Trastornos cardíacos |
Insuficiencia cardiaca Fibrilación atrial Taquicardia Palpitaciones |
Parada cardíaca Infarto de miocardio Isquemia miocárdica Fracción de eyección disminuida Pericarditis Derrame pericárdico | ||
|
Trastornos vasculares |
Hipertensión |
Trombosis venosa profunda Hipotensión Rubefacción |
Crisis hipertensiva Hemorragia |
Emergencia hipertensiva |
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea Tos |
Embolia pulmonar Edema pulmonar Epistaxis Dolor orofaríngeo Disfonía Sibilancias Hipertensión pulmonar |
SDRA Insuficiencia respiratoria aguda Hemorragia pulmonar Enfermedad pulmonar intersticial Pneumonitis | |
|
Trastornos gastrointestinales |
Vómitos Diarrea Estreñimiento Dolor abdominal Náuseas |
Dispepsia Dolor dental |
Hemorragia gastrointestinal Perforación gastrointestinal | |
|
Trastornos hepatobiliares |
Aumento de la alanina aminotransferasa Aumento de la aspartato aminotransferasa Gamma- glutamiltransferasa incrementada Hiperbilirrubinemia |
Insuficiencia hepática Colestasis | ||
|
Trastornos de la piel y del tejido subcutáneo |
Erupción cutánea Prurito Eritema Hiperhidrosis |
|
Clasificación de órganos del sistema MedDRA |
Muy frecuentes (> 1/10) |
Frecuentes (> 1/100 a < 1/10) |
Poco frecuentes (> 1/1.000 a < 1/100) |
Raras (> 1/10.000 a < 1/1.000) |
|
Trastornos musculoesqueléti-cos y del tejido conjuntivo |
Dolor de espalda Artralgia Dolor en una extremidad Espasmos musculares |
Dolor musculoesquelético Dolor torácico musculoesquelético Dolor óseo Mialgia Debilidad muscular | ||
|
Trastornos renales y urinarios |
Creatinina elevada en sangre |
Insuficiencia renal aguda Insuficiencia renal Alteración renal Disminución del aclaramiento renal de creatinina | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Reacción a la perfusión Pirexia Edema periférico Astenia Fatiga |
Dolor torácico Dolor Reacción en la zona de perfusión Escalofríos |
Insuficiencia multiorgánica | |
|
Exploraciones complementarias |
Proteína C reactiva elevada Ácido úrico elevado en sangre |
Descripción de reacciones adversas seleccionadas
Insuficiencia cardíaca, infarto de miocardio e isquemia miocárdica
En los estudios clínicos con Kyprolis, la insuficiencia cardíaca se notificó en aproximadamente el 7% de los sujetos (< 5% de los sujetos experimentaron eventos de grado > 3), el infarto de miocardio se notificó en aproximadamente el 2% de los sujetos (< 1,5% de los sujetos experimentaron eventos de grado > 3) y la isquemia miocárdica se notificó en aproximadamente el 1% de los sujetos (< 1% de los sujetos experimentaron eventos de grado > 3). Estos eventos se produjeron habitualmente en una fase temprana del tratamiento con Kyprolis (< 5 ciclos). Para el control clínico de los trastornos cardíacos durante el tratamiento con Kyprolis, ver sección 4.4.
Disnea
Se notificó disnea en aproximadamente el 30% de los sujetos de los estudios clínicos con Kyprolis. La mayoría de reacciones adversas de disnea no fueron graves (< 5% de los sujetos experimentaron eventos de grado > 3), se resolvieron, en raras ocasiones produjeron la interrupción del tratamiento y aparecieron en una fase temprana del estudio (< 3 ciclos). Para el control clínico de la disnea durante el tratamiento con Kyprolis, ver sección 4.4.
Hipertensión incluyendo crisis hipertensivas
Han ocurrido casos de crisis hipertensivas (urgencia hipertensiva o emergencia hipertensiva) después de la administración de Kyprolis. Algunos de estos acontecimientos han sido mortales. En los estudios clínicos, los acontecimientos adversos de hipertensión ocurrieron en aproximadamente el 20% de los sujetos y aproximadamente el 6% de los sujetos experimentaron acontecimientos de hipertensión de grado > 3, pero las crisis hipertensivas ocurrieron en el < 0,5% de los sujetos. La incidencia de acontecimientos adversos de hipertensión fue similar entre aquellos que tenían o no antecedentes de hipertensión previa. Para el control clínico de la hipertensión durante el tratamiento con Kyprolis, ver sección 4.4.
Trombocitopenia
Se ha notificado trombocitopenia en aproximadamente el 40% de los sujetos de los estudios clínicos con Kyprolis y aproximadamente el 20% de los sujetos experimentaron acontecimientos de grado > 3. Kyprolis causa trombocitopenia mediante la inhibición de la gemación plaquetaria de los megacariocitos, lo que produce una trombocitopenia cíclica clásica con nadir plaquetario en el día 8 ó 15 de cada ciclo de 28-días y normalmente está asociado con una recuperación hasta el valor basal al iniciar el siguiente ciclo. Para el control clínico de la trombocitopenia durante el tratamiento con Kyprolis, ver sección 4.4.
Acontecimientos tromboembólicos venosos
En pacientes que han recibido Kyprolis se han notificado casos de acontecimientos tromboembólicos venosos, incluyendo trombosis venosa profunda y embolismo pulmonar con desenlace mortal (ver sección 4.4). La incidencia global de acontecimientos tromboembólicos venosos fue mayor en los brazos de Kyprolis de dos estudios de fase 3. En el estudio PX 171 009, la incidencia de acontecimientos tromboembólicos venosos fue de un 15,3% en el brazo de KRd y de un 9,0% en el brazo de Rd. Se notificaron acontecimientos tromboembólicos venosos de grado > 3 en un 5,6% de los pacientes del brazo KRd y en un 3,9% de los pacientes del brazo Rd. La incidencia de acontecimientos tromboembólicos venosos en el estudio 2011 003 fue de un 10,6% en el brazo de Kd y de un 3,1% en el brazo de bortezomib más dexametasona (Vd). Se han notificado acontecimientos tromboembólicos venosos de grado > 3 en un 3,0% de los pacientes en el brazo Kd y en un 1,5% de los pacientes en el brazo Vd.
Insuficiencia hepática
Se han notificado casos de insuficiencia hepática, incluyendo casos mortales, en el < 1% de los sujetos de los estudios clínicos con Kyprolis. Para el control clínico de la toxicidad hepática durante el tratamiento con Kyprolis, ver sección 4.4.
Neuropatía periférica
Se han notificado acontecimientos de neuropatía periférica de grado 2 y superior en un 6% de los pacientes con mieloma múltiple en recaída en el brazo Kd, comparado con un 32% en el brazo Vd, en un estudio aleatorizado, abierto, multicéntrico en pacientes que recibieron 20/56 mg/m2 de Kyprolis como perfusión durante 30 minutos en combinación con dexametasona (Kd, n = 464) frente a bortezomib más dexametasona (Vd, n = 465).
Otras poblaciones especiales
Población de edad avanzada (> 75 años)
En general, en los ensayos clínicos con Kyprolis, la incidencia de determinados acontecimientos adversos (incluidas arritmias cardíacas, insuficiencia cardíaca (ver sección 4.4), disnea, leucopenia y trombocitopenia) fue superior en pacientes de > 75 años que en pacientes de < 75 años.
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional de
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del notificación incluido en el Apéndice V.
4.9. Sobredosis
Actualmente no se dispone de suficiente información para concluir sobre la seguridad de dosis más elevadas que las evaluadas en los estudios clínicos. Se ha notificado la aparición repentina de escalofríos, hipotensión, insuficiencia renal, trombocitopenia y linfopenia después de una dosis de 200 mg de Kyprolis administrados de forma errónea.
No existe ningún antídoto específico conocido para la sobredosis de carfilzomib. En caso de sobredosis, se debe controlar al paciente para detectar específicamente las reacciones adversas debidas a Kyprolis descritas en la sección 4.8.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: agentes antineoplásicos, código ATC: L01XX45 Mecanismo de acción
Carfilzomib es un tetrapéptido con un grupo epoxicetona inhibidor del proteosoma que se une de forma selectiva e irreversible a la treonina en el extremo N terminal de los sitios activos del proteosoma 20S, el núcleo proteolítico del proteosoma 26S, y que muestra poca o ninguna actividad frente a otros tipos de proteasas. Carfilzomib presentó actividad antiproliferativa y proapoptótica en modelos preclínicos de tumores hematológicos. En animales, carfilzomib inhibió la actividad del proteosoma en la sangre y los tejidos y retrasó el crecimiento tumoral en modelos de mieloma múltiple. In vitro, carfilzomib presentó una neurotoxicidad mínima y una reacción mínima a las proteasas no proteosómicas.
Efectos farmacodinámicos
La administración intravenosa de carfilzomib produjo una supresión de la actividad proteosómica análoga a la quimotripsina (CT-L) al efectuar la medición en sangre 1 hora después de la primera dosis. Dosis > 15 mg/m2 indujeron sistemáticamente a una inhibición (> 80%) de la actividad CT-L del proteosoma. Además, la administración de carfilzomib a 20 mg/m2 produjo una inhibición de la proteína latente de membrana 2 (LMP2) y las subunidades del complejo multicatalítico de endopeptidasa tipo 1 (MECL1) del inmunoproteosoma del 26% al 32% y del 41% al 49%, respectivamente. La inhibición del proteosoma se mantuvo durante > 48 horas después de la primera dosis de carfilzomib en cada semana de administración. La administración combinada de lenalidomida y dexametasona no afectó a la inhibición del proteosoma.
Con la dosis más alta de 56 mg/m2, no sólo se observó un incremento en la inhibición de las subunidades CT-L (> 90%) comparado con la dosis de 15 a 20 mg/m2, sino también una mayor inhibición de otras subunidades del proteosoma (LMP7, MECL1, y LMP2). Hubo un incremento en la inhibición de las subunidades LMP7, MECL1 y LMP2 de aproximadamente un 8%, 23% y 34% respectivamente con la dosis de 56 mg/m2, comparado con dosis de 15 a 20 mg/m2. Se alcanzó una inhibición similar del proteosoma con perfusiones de carfilzomib de 2 a 10 minutos y a 30 minutos en los 2 niveles de dosis (20 y 36 mg/m2) en los que se analizó.
Eficacia clínica y seguridad
Kyprolis en combinación con lenalidomida y dexametasona para el tratamiento de pacientes con mieloma múltiple en recaída - estudio PX-171-009 (ASPIRE)
La seguridad y la eficacia de Kyprolis se evaluó en un estudio aleatorizado, multicéntrico y abierto de 792 pacientes con mieloma múltiple en recaída, en el que se evaluó la combinación de Kyprolis con lenalidomida y dexametasona frente a lenalidomida y dexametasona, aleatorizados con una distribución 1:1.
Este estudio evaluó Kyprolis a una dosis inicial de 20 mg/m2, que fue incrementada a 27 mg/m2 en el ciclo 1, día 8, administrado dos veces a la semana en 3 de cada 4 semanas como perfusión durante 10 minutos. El tratamiento con Kyprolis se administró durante un máximo de 18 ciclos a menos que se discontinuara de forma prematura debido a la progresión de la enfermedad o a una toxicidad inaceptable. La administración de lenalidomida y dexametasona se podía continuar hasta la progresión o una toxicidad inaceptable.
Los pacientes con las siguientes características fueron excluidos del ensayo: tasas de aclaramiento de creatinina < 50 ml/min, insuficiencia cardíaca congestiva de clase III a IV de la NYHA, o infarto de miocardio en los últimos 4 meses, progresión de la enfermedad durante el tratamiento con cualquier régimen conteniendo bortezomib, o progresión durante los 3 primeros meses al iniciar el tratamiento con lenalidomida y dexametasona, o progresión durante cualquier período del tratamiento si lenalidomida y dexametasona eran la línea de tratamiento más reciente del sujeto. Los criterios de selección permitieron la inclusión en el estudio de un subgrupo pequeño de pacientes con mieloma refractario a bortezomib (n = 118) o lenalidomida (n = 57). Los pacientes incluidos en el estudio se consideraron refractarios a un tratamiento si cumplían cualquiera de los siguientes 3 criterios: no respondían (< respuesta mínima) a ningún régimen, progresión durante cualquier tratamiento, o progresión dentro de los 60 días tras finalizar cualquier régimen. Este estudio no evaluó la relación beneficio/riesgo en la población refractaria más amplia.
El estatus de la enfermedad y las otras características basales estuvieron equilibradas entre los dos brazos, incluyendo la edad (64 años, rango de 31-91 años), el género (56% varones), el estado funcional ECOG (48% con estado funcional 1), las mutaciones genéticas de alto riesgo, consistente en subtipos genéticos t(4;14), t(14;16), o deleción de 17p en > 60% de las células plasmáticas (13%), mutaciones genéticas de riesgo desconocido, que incluyeron sujetos con resultados que no se recogieron o no se analizaron (47%), y la enfermedad en estadio III del ISS basal (20%). Los sujetos habían recibido de 1 a 3 líneas de tratamiento previas (mediana de 2), que incluían tratamiento previo con bortezomib (66%), talidomida (44%) y lenalidomida (20%).
Los resultados del estudio PX-171-009 se resumen en la tabla 6 y en la figura 1 y figura 2.
Tabla 6 Resumen del análisis de eficacia del estudio PX-171-009 sobre mieloma múltiple en recaída
|
Tratamiento combinado KRd | ||
|
Brazo KRda |
Brazo Rda | |
|
(n = 396) |
(n = 396) | |
|
Mediana de meses de SLP (IC del 95%) |
26,3 (23,3; 30,5) |
17,6 (15,0; 20,6) |
|
HR (IC del 95%); valor p unilateralb |
0,69 (0,57; 0,83); < 0,0001 | |
|
Mediana de meses de SG (IC del 95%) |
NE (NE, NE) |
NE (32,1; NE) |
|
HR (IC del 95%); valor p unilateral0 |
0,79 (0,63; 0,99); 0,0182 | |
|
TRG, n (%) |
345 (87,1) |
264 (66,7) |
|
RCe |
56 (14,1) |
17 (4,3) |
|
RC |
70 (17,7) |
20 (5,1) |
|
RPMB |
151 (38,1) |
123 (31,1) |
|
RP |
68 (17,2) |
104 (26,3) |
|
IC del 95% de la TRG |
83,4; 90,3 |
61,8; 71,3 |
|
Valor p unilateralc |
<0,0001 | |
KRd = Kyprolis, lenalidomida y dexametasona; Rd = lenalidomida y dexametasona; SLP = supervivencia libre de progresión; HR = hazard ratio; IC = intervalo de confianza; SG = supervivencia global; TRG = tasa de respuesta global; NE = no estimable; RCe = respuesta completa estricta; RC = respuesta completa; RPMB = respuesta parcial muy buena; RP = respuesta parcial; IMWG = International Myeloma Working Group; EBMT = European blood and marrow transplantation;
Según lo determinado por un Comité de Revisión Independiente con el uso de los criterios de respuesta objetiva estándar de IMWG/EBMT Estadísticamente significativo
El análisis intermedio de la SG no cumplió el límite de finalización temprano para la SG especificado en el protocolo (p = 0,0051); por ello, debido a la naturaleza jerárquica del diseño del estudio, todos los valores p
a
b
c
Los pacientes del brazo de Kyprolis, lenalidomida y dexametasona (KRd) mostraron una mejor supervivencia libre de progresión (SLP) en comparación con los del brazo de lenalidomida y dexametasona (Rd) (HR = 0,69; con un valorp unilateral < 0,0001), que representa una mejora del 45% en la SLP o una reducción del 31% en el riesgo de acontecimientos determinados por parte de un Comité de Revisión Independiente (CRI) mediante el uso de criterios de respuesta objetiva estándar del International Myeloma Working Group (IMWG)/European Blood and Marrow Transplantation (EBMT).
El beneficio de SLP de KRd se observó sistemáticamente en todos los subgrupos, incluyendo los pacientes > 75 años de edad (n = 96), pacientes con mutaciones genéticas de alto riesgo (n = 100) o desconocido (n = 375) y pacientes con un aclaramiento de creatinina basal de 30 - < 50 ml/min (n = 56).
Figura 1 Curva de Kaplan-Meier de la supervivencia libre de progresión en el mieloma múltiple en recaída3
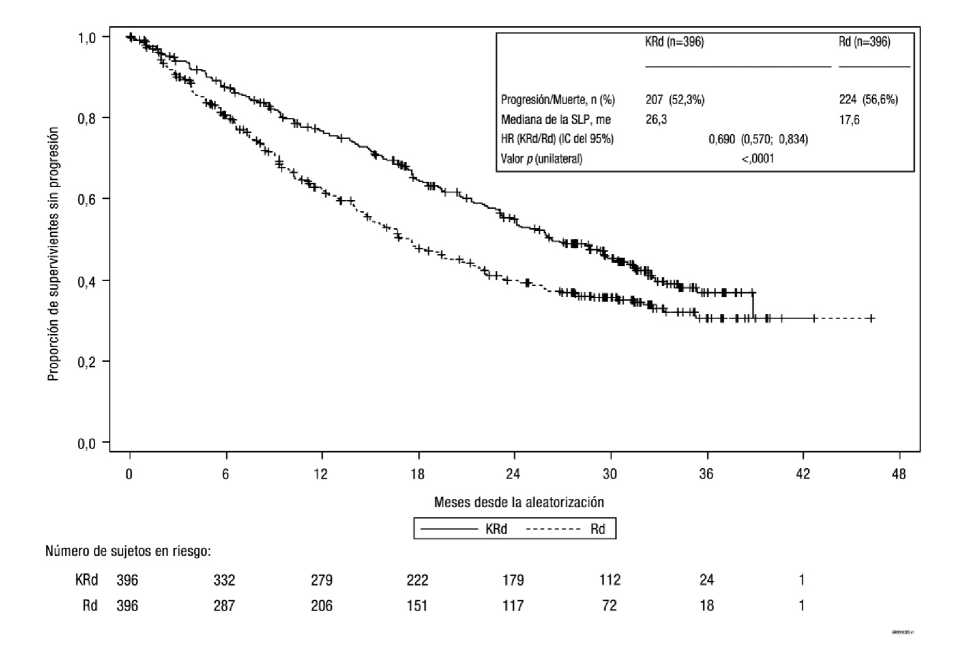
KRd = Kyprolis, lenalidomida y dexametasona; Rd = lenalidomida, dexametasona; SLP = supervivencia libre de progresión; HR = hazard ratio; IC = intervalo de confianza; IMWG = International Myeloma Working Group; EBMT = European Blood and Marrow Transplantation
Nota: La respuesta y los resultados farmacodinámicos fueron determinados mediante los criterios de respuesta objetiva estándar de IMWG/EBMT.
a
Estudio PX-171-009
La tasa libre de acontecimientos de Kaplan-Meier para la SG a los 24 meses fue del 73,3% (IC del 95%: 68,6% al 77,5%) en el brazo KRd y el 65,0% (IC del 95%: 59,9% al 69,5%) en el brazo Rd.
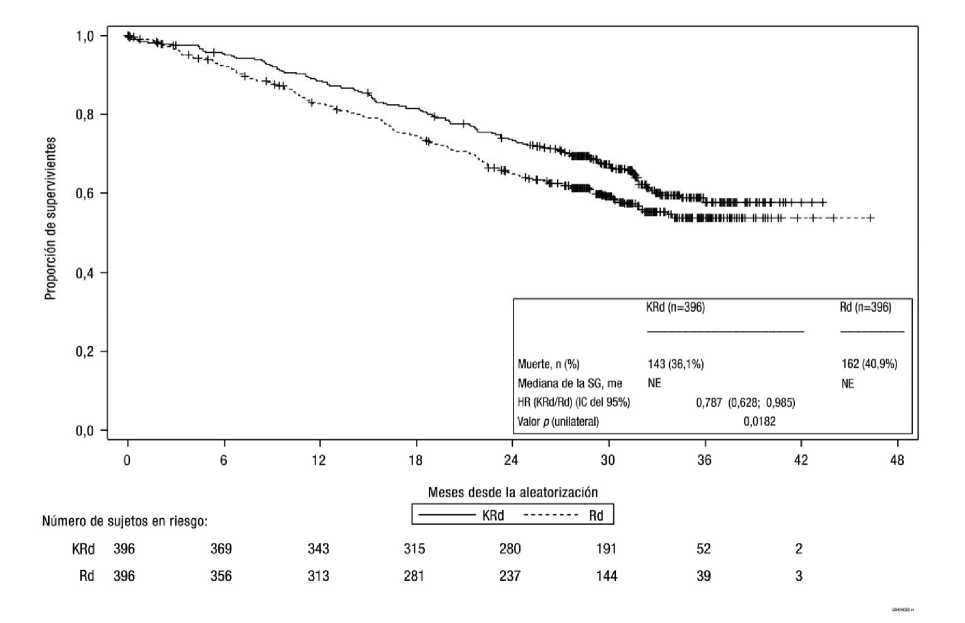
KRd = Kyprolis, lenalidomida y dexametasona; Rd= lenalidomida y dexametasona; SG = supervivencia global; NE = no estimable; HR = hazard ratio; IC = intervalo de confianza
Nota: El análisis intermedio de la SG no cumplió el límite de finalización temprana especificado en el protocolo para la SG (p = 0,0051). a Estudio PX-171-009
Los pacientes tratados con KRd notificaron una mejora del Estado de Salud Global, con puntuaciones de Estado de Salud Global/Calidad de Vida (QoL) más elevadas en comparación con Rd durante 18 ciclos de tratamiento (multiplicidad sin ajustar valor p unilateral = 0,0001) determinadas con EORTC QLQ-C30, un instrumento validado en el mieloma múltiple. Los valoresp para la TRG y las puntuaciones de Estado de Salud Global/Calidad de Vida (QoL) son descriptivos y se basan en el plan de ajuste de multiplicidad prespecificado.
Kyprolis en combinación con dexametasona para el tratamiento de pacientes con mieloma múltiple en recaída- estudio 2011-003 (ENDEAVOR)
La seguridad y la eficacia de Kyprolis se evaluó en un estudio de fase 3 aleatorizado, abierto, multicéntrico de Kyprolis más dexametasona (Kd) comparado con bortezomib más dexametasona (Vd). Fueron incluidos y aleatorizados un total de 929 pacientes con mieloma múltiple en recaída o refractario que habían recibido previamente de 1 a 3 líneas de tratamiento (464 en el brazo Kd; 465 en el brazo Vd).
Este estudio evaluó Kyprolis a una dosis inicial de 20 mg/m2, que fue incrementada a 56 mg/m2 en el ciclo 1, día 8, administrado 2 veces a la semana en 3 de cada 4 semanas como perfusión durante 30 minutos hasta la progresión o toxicidad inaceptable.
Los pacientes asignados aleatoriamente al brazo Vd podían recibir bortezomib por vía intravenosa (n = 108) o por vía subcutánea (n = 357). Los pacientes con las siguientes características se excluyeron del ensayo: tasas de aclaramiento de creatinina < 15 ml/min, insuficiencia cardíaca congestiva de clase III a IV de la NYHA, infarto de miocardio en los últimos 4 meses o aquellos con fracción de eyección del ventrículo izquierdo (FEVI) < 40%. Los criterios de inclusión del estudio permitieron incluir pacientes previamente tratados con carfilzomib (n = 3) o bortezomib (n = 502), siempre y cuando los
pacientes tuvieran al menos una respuesta parcial (RP) al tratamiento con el inhibidor del proteosoma previa, no fueran retirados del tratamiento con el inhibidor del proteosoma debido a la toxicidad, y hubieran tenido al menos un intervalo libre de tratamiento con el inhibidor del proteosoma de 6 meses desde la última dosis.
Los datos demográficos y las características basales del estudio 2011-003 estuvieron equilibradas entre los dos brazos, incluido el tratamiento previo con bortezomib (54%), el tratamiento previo con lenalidomida (38%), refractario a lenalidomida (25%), la edad (65 años, rango 30-89 años), el sexo (51% de varones), el estado funcional ECOG (45% con estado funcional 1), las mutaciones genéticas de alto riesgo, consistiendo en subtipos genéticos t(4;14), t(14;16), o deleción 17p en > 60% de células plasmáticas (23%), las mutaciones genéticas de riesgo desconocido, que incluyeron sujetos con resultados que no se recogieron o no se analizaron (9%) y de enfermedad en estadio III del ISS basal (24%).
Los resultados del estudio 2011-003 se resumen en la tabla 7.
Tabla 7 Resumen del análisis de eficacia en mieloma múltiple en recaída estudio 2011-003
|
Brazo Kd |
Brazo Vd | |
|
(n = 464) |
(n = 465) | |
|
Mediana de meses de SLP (IC del 95%)a |
18,7 (15,6; NE) |
9,4 (8,4; 10,4) |
|
HR (IC del 95%); valor p unilateralb |
0,533 (0,44; 0,65); < 0,0001 | |
|
TRG, n (%)a, c |
357 (76,9) |
291 (62,6) |
|
> RCd |
58 (12,5) |
29 (6,2) |
|
> RPMB e |
252 (54,3) |
133 (28,6) |
|
IC del 95% de la TRG |
72,8; 80,7 |
58,0; 67,0 |
|
Valor p unilateralb |
<0,0001 | |
Kd = Kyprolis más dexametasona; Vd = bortezomib más dexametasona; IC = intervalo de confianza; NE = no estimable; HR = hazard ratio; TRG = tasa de respuesta global; RC = respuesta completa; RPMB = respuesta parcial muy buena
a
b
c
d
e
Estas variables fueron determinadas por un Comité de Revisión Independiente Estadísticamente significativo
La respuesta global está definida como el alcance de una mejor respuesta global de RP, RPMB, RC, o RCs. Estadísticamente significativo, Valorp unilateral = 0,0005 Estadísticamente significativo, Valorp unilateral = 0,0001
El estudio mostró una mejora significativa en la SLP en pacientes del brazo Kd, respecto a los pacientes del brazo Vd (HR: 0,53; IC del 95%: 0,44; 0,65 [valor p = 0,0001]) (ver figura 3).
Se observaron resultados similares en la SLP, en pacientes que habían recibido previamente tratamiento con bortezomib (HR 0,56; IC del 95%: 0,44; 0,73) y pacientes que no habían recibido previamente tratamiento con bortezomib (HR 0,48; IC del 95%: 0,36; 0,66).
El beneficio de la SLP de Kd fue consistentemente observado en todos los subgrupos, incluidos pacientes > 75 años (n = 143), pacientes con mutaciones genéticas de alto riesgo (n = 210), y pacientes con un aclaramiento de creatinina basal de 30 < 50 ml/min (n = 128).
En pacientes que recibieron previamente bortezomib (54%), la mediana de SLP fue 15,6 meses en el brazo Kd, frente a 8,1 meses en el brazo de Vd (HR = 0,56; IC del 95% = [0,44; 0,73]), la TRG fue 71,2% frente a 60,3%.
En pacientes que habían recibido previamente lenalidomida (38%), la mediana de SLP fue 12,9 meses en el brazo de Kd frente a 7,3 meses en el brazo de Vd (HR = 0,69, IC del 95% = [0,52; 0,92]),la TRG fue 70,1% frente a 59,3%. En pacientes refractarios a lenalidomida (25%), la mediana de SLP fue 8,6 meses en el brazo de Kd frente a 6,6 meses en el brazo Vd (HR = 0,80, IC del 95% = [0,57; 1,11]), la TRG fue 61,9% frente a 54,9%.
Figura 3 Curva de Kaplan-Meier de la supervivencia libre de progresión determinado por el CRI (población por intención a tratar) estudio 2011-003
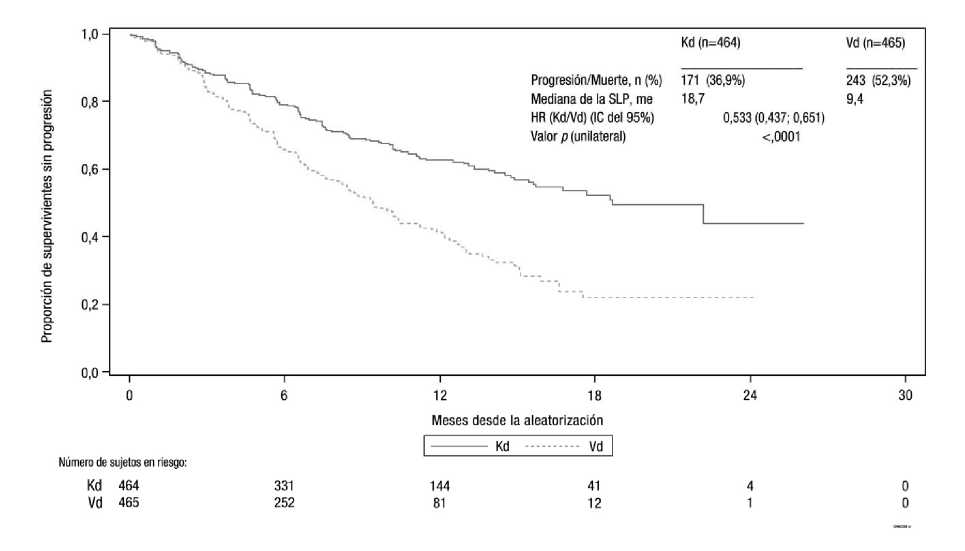
Kd = Kyprolis más dexametasona; Vd = bortezomib más dexametasona; SLP = supervivencia libre de progresión; me = meses; HR = hazard ratio; IC = intervalo de confianza;
A partir de la fecha de corte del análisis intermedio, 75 (16,2%) de los sujetos en el brazo Kd y 88 (18,9%) de los sujetos en el brazo Vd habían fallecido, correspondiendo a 33% del total de los 496 eventos requeridos para el análisis final (HR = 0,786; IC del 95%: 0,575; 1,075) (ver figura 4).
Figura 4 Curva de Kaplan-Meier de supervivencia global intermedia de mieloma múltiple en recaída estudio 2011-003
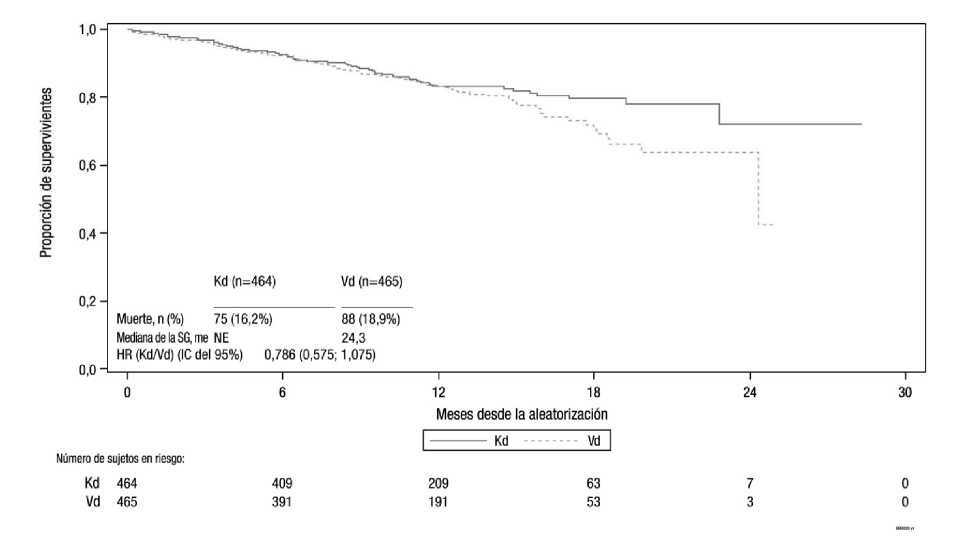
Kd = Kyprolis más dexametasona; Vd = bortezomib más dexametasona; SG = supervivencia global; me = meses; NE = no estimable; HR = hazard ratio; IC = intervalo de confianza;
Se ha generado experiencia clínica adicional con Kyprolis en monoterapia en pacientes con mieloma múltiple refractario y en recaída. El estudio PX-171-011 fue un estudio de fase 3 aleatorizado, abierto (n = 315; requería exposición a > 3 tratamientos previos). Los pacientes incluidos en el estudio PX 171-011 recibieron un tratamiento previo más fuerte con una función orgánica y medular inferior en comparación con los del estudio PX 171-009. PX 171-011 evaluó Kyprolis en monoterapia frente a un brazo control (corticosteroides y ciclofosfamida). El estudio no cumplió su variable principal de valoración de eficacia de demostrar superioridad en supervivencia global de Kyprolis en monoterapia frente al brazo control activo (HR = 0,975 [IC del 95%: 0,760-1,249]. PX 171-003A1 fue un estudio de fase 2 de un solo brazo (n = 266; requería exposición a > 2 tratamientos previos), que cumplió su variable principal de eficacia de la TRG evaluada por el CRI (22,9%).
Electrofisiología cardíaca
Se realizó una evaluación de los posibles efectos adversos de carfilzomib sobre la función cardíaca analizando, por la lectura central a ciegas, un triplicado de ECG en 154 sujetos con neoplasias avanzadas, incluyendo mieloma múltiple. El efecto de carfilzomib en la repolarización cardíaca usando el intervalo QT con la corrección de Fridericia (intervalo QTcF) y el análisis de las relaciones de la concentración con el QTc, no muestra señales claras de ningún efecto relacionado con la dosis. La cota superior de un intervalo de confianza (IC) del 95% de un sólo lado para un efecto predictivo sobre el QTcF a Cmax fue < 4,8 ms. Con la corrección de Bazett (intervalo QTcB), la cota superior de un intervalo de confianza (IC) del 95% de un sólo lado para un efecto predictivo sobre el QTcB a Cmax fue 5,9 ms.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Kyprolis en todos los grupos de la población pediátrica en mieloma múltiple (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2. Propiedades farmacocinéticas
Absorción
La Cmáx. y el AUC después de una perfusión intravenosa de 2 a 10 minutos de 27 mg/m2 fueron de 4.232 ng/ml y 379 ng^h/ml, respectivamente. Después de repetidas dosis de Kyprolis a 15 y 20 mg/m2, la exposición sistémica (AUC) y la semivida fueron similares en los días 1 y 15 ó 16 del ciclo 1, lo que indica que no se produjo una acumulación sistémica de carfilzomib. A dosis entre 20 y 56 mg/m2, parece que se produjo un aumento de la exposición dependiente de la dosis.
Una perfusión de 30 minutos mostró una semivida y una AUC similar, pero una Cmáx entre 2 y 3 veces inferior en comparación con la observada con una perfusión de 2 a 10 minutos de la misma dosis. Después de una perfusión de 30 minutos de la dosis de 56 mg/m2, la AUC (948 ng^h/ml) fue aproximadamente 2,5 veces respecto a la observada con la dosis de 27 mg/m2, y la Cmáx (2.079 ng/ml) fue inferior a la comparada con la de 27 mg/m2 durante la perfusión de 2 a 10 minutos.
Distribución
El volumen de distribución medio en el estado estable de una dosis de 20 mg/m2 de carfilzomib fue de 28 l. Al realizar pruebas in vitro, la unión de carfilzomib a las proteínas plasmáticas humanas fue, en promedio, del 97% sobre el intervalo de concentración de 0,4 a 4 micromolar.
Biotransformación
Carfilzomib se metabolizó rápida y extensamente. Los metabolitos predominantes determinados en el plasma humano y en la orina, y generados in vitro por hepatocitos humanos, fueron fragmentos peptídicos y el diol de carfilzomib, lo que indica que la escisión por peptidasas y la hidrólisis de los epóxidos fueron las vías principales de metabolismo. Los mecanismos mediados por el citocromo P450
desempeñaron un papel menor en el metabolismo global de carfilzomib. Se desconoce la actividad biológica de los metabolitos.
Eliminación
Después de la administración intravenosa de dosis > 15 mg/m2, carfilzomib fue eliminado rápidamente de la circulación sistémica con una semivida de < 1 hora en el día 1 del ciclo 1. El aclaramiento sistémico fue de entre 151 y 263 l/hora, y superó el flujo sanguíneo hepático, lo que indica que carfilzomib se eliminó en gran parte extrahepáticamente. Carfilzomib se elimina principalmente por medio del metabolismo con la excreción posterior de sus metabolitos en la orina.
Poblaciones especiales
Los análisis farmacocinéticos poblacionales indican que la edad, el sexo o la raza no tienen efectos sobre la farmacocinética de carfilzomib.
No se han completado estudios farmacocinéticos específicos en pacientes con insuficiencia hepática (ver la sección 4.4).
El estado de la función renal no influyó en el aclaramiento o la exposición de carfilzomib después de una única administración o una administración de dosis repetidas en dosis de hasta 20 mg/m2 (ver la sección 4.2).
5.3. Datos preclínicos sobre seguridad
Carfilzomib fue clastogénico en la prueba in vitro de aberración cromosómica en linfocitos de sangre periférica. Carfilzomib no fue mutagénico en la prueba in vitro de mutación inversa en bacterias (Ames) y no fue clastogénico en el ensayo in vivo de micronúcleos en médula ósea de ratones.
Los monos a los que se administró una única dosis en bolo por vía intravenosa de carfilzomib a 3 mg/kg (que corresponde a 36 mg/m2 y es similar a la dosis recomendada en los humanos, de 27 mg/m2 según el ASC) presentaron hipotensión, aumento de la frecuencia cardíaca y un aumento de los niveles séricos de troponina T. La administración intravenosa repetida en bolo de carfilzomib a > 2 mg/kg/dosis en ratas y 2 mg/kg/dosis en monos con el uso de pautas posológicas similares a las utilizadas clínicamente, produjeron mortalidades causadas por toxicidades en los sistemas cardiovascular (insuficiencia cardíaca, fibrosis cardíaca, acumulación de líquido pericárdico, hemorragia/degeneración cardíaca), gastrointestinal (necrosis/hemorragia), renal (glomerulonefropatía, necrosis tubular, disfunción) y pulmonar (hemorragia/inflamación). La dosis de 2 mg/kg/dosis en ratas es aproximadamente la mitad de la dosis recomendada en humanos, de 27 mg/m2, basada en el ASC. La dosis más alta no gravemente tóxica de 0,5 mg/kg en monos, dio lugar a una inflamación intersticial en el riñón junto con glomerulopatía leve y ligera inflamación del corazón. Estos hallazgos se notificaron a 6 mg/m2 que están por debajo de la dosis recomendada en humanos de 27 mg/m2.
No se han realizado estudios de fertilidad con carfilzomib. No se observaron efectos sobre los tejidos reproductivos durante los estudios de toxicidad en ratas y monos a dosis repetidas durante 28 días o en estudios de toxicidad crónicos de 6-meses en ratas y 9-meses en monos. Carfilzomib causó toxicidad embriofetal en conejos gestantes a dosis inferiores a las de los pacientes que recibieron la dosis recomendada. Carfilzomib administrado en ratas gestantes durante el período de organogénesis no fue teratogénico a dosis de hasta 2 mg/kg/día que es aproximadamente la mitad de la dosis recomendada de 27 mg/m2 en humanos, basándose en el ASC.
DATOS FARMACÉUTICOS
6.
6.1. Lista de excipientes
Sulfobutil éter beta-ciclodextrina sódica Ácido cítrico anhidro (E330)
Hidróxido sódico (para el ajuste del pH)
6.2. Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
Kyprolis en polvo para solución para perfusión no debe mezclarse con cloruro de sodio 9 mg/ml (0,9%) solución para inyectable.
6.3. Período de validez
Polvo vial 3 años.
Solución reconstituida
La estabilidad química y física en uso de las soluciones reconstituidas en el vial, la jeringa o la bolsa intravenosa ha sido demostrada durante 24 horas a entre 2°C y 8°C o durante 4 horas a 25°C. El tiempo transcurrido desde la reconstitución hasta la administración no debe exceder las 24 horas.
Desde un punto de vista microbiológico, el producto se debe utilizar inmediatamente. Si no se utiliza inmediatamente, los tiempos y las condiciones de conservación en uso son responsabilidad del usuario y no deben ser superiores a 24 horas a entre 2°C y 8°C.
6.4. Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar el producto en el embalaje original para protegerlo de la luz.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5. Naturaleza y contenido del envase Kyprolis 10 mg polvo para solución para perfusión
Vial transparente de vidrio de tipo I de 10 ml, cerrado con tapón de elastómero con laminado de fluoropolímero y precinto de aluminio con tapaflip off de plástico azul.
Kyprolis 30 mg polvo para solución para perfusión
Vial transparente de vidrio de tipo I de 30 ml, cerrado con tapón de elastómero con laminado de fluoropolímero y precinto de aluminio con tapa flip off de plástico naranja.
Kyprolis 60 mg polvo para solución para perfusión
Vial transparente de vidrio de tipo I de 50 ml, cerrado con tapón de elastómero con laminado de fluoropolímero y precinto de aluminio con tapa flip off de plástico púrpura.
Tamaño de envase de un vial.
6.6. Precauciones especiales de eliminación y otras manipulaciones
Reconstitución y preparación para la administración intravenosa
Los viales de Kyprolis no contienen conservantes antimicrobianos y están destinados a un solo uso. Se
debe observar una técnica aséptica adecuada.
La solución reconstituida contiene carfilzomib a una concentración de 2 mg/ml. Leer las instrucciones de
preparación completas antes de la reconstitución.
1. Extraer el vial de la nevera justo antes de su uso.
2. Calcular la dosis (mg/m2) y el número de viales de Kyprolis necesarios teniendo en cuenta el ASC basal del paciente. Los pacientes con un ASC superior a 2,2 m2 deben recibir una dosis basada en una superficie corporal de 2,2 m2. No es necesario efectuar ajustes de la dosis para cambios de peso < 20%.
3. Reconstituir de forma aséptica cada vial inyectando lentamente 5 ml (para el vial de 10 mg), 15 ml (para el vial de 30 mg) o 29 ml (para el vial de 60 mg) de agua estéril para preparaciones inyectables a través del tapón y dirigiendo la solución hacia la PARED INTERNA DEL VIAL para minimizar la formación de espuma.
4. Girar y/o invertir el vial suave y lentamente durante aproximadamente un minuto, o hasta que se complete la disolución. NO AGITAR. Si se forma espuma, dejar que la solución se asiente en el vial hasta que disminuya la espuma (aproximadamente 5 minutos) y la solución sea transparente.
5. Revisar visualmente para detectar partículas y alteraciones del color antes de la administración. El producto reconstituido debe ser una solución transparente, entre incolora y ligeramente amarillenta y no se debe administrar si se observa una alteración del color o la presencia de partículas.
6. Desechar cualquier porción no utilizada que quede en el vial.
7. Opcionalmente, Kyprolis se puede administrar en una bolsa para vía intravenosa.
8. Al administrarlo en una bolsa para vía intravenosa, extraer la dosis calculada del vial y diluir en una bolsa para vía intravenosa de 50 o 100 ml con solución para inyección de glucosa al 5%.
Eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Amgen Europe B.V.
Minervum 7061 NL-4817 ZK Breda Países Bajos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1060/002
EU/1/15/1060/003
EU/1/15/1060/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 19 noviembre 2015
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes responsables de la liberación de los lotes Amgen Europe B.V.
Minervum 7061 4817 ZK Breda Países Bajos
Amgen Technology Ireland Pottery Road Dun Laoghaire Co Dublin Irlanda
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo
acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de
Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Kyprolis 10 mg polvo para solución para perfusión carfilzomib
Cada vial contiene 10 mg de carfilzomib.
Tras la reconstitución, 1 ml de solución contiene 2 mg de carfilzomib.
Excipientes: Sulfobutil éter beta-ciclodextrina sódica, ácido cítrico anhidro (E330), hidróxido sódico. Para mayor información consultar el prospecto.
Polvo para solución para perfusión. 1 vial
Leer el prospecto antes de utilizar este medicamento. Para vía intravenosa.
Para un solo uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar el producto en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
Eliminar las dosis no utilizadas de acuerdo con la normativa local.
Amgen Europe B.V. Minervum 7061, NL-4817 ZK Breda, Países Bajos
EU/1/15/1060/002
Lote
Se acepta la justificación para no incluir la información en Braille.
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC
SN
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DEL VIAL
1. NOMBRE DEL MEDICAMENTO
Kyprolis 10 mg polvo para solución para perfusión
carfilzomib
IV
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
10 mg
6. OTROS
Kyprolis 30 mg polvo para solución para perfusión carfilzomib
Cada vial contiene 30 mg de carfilzomib.
Tras la reconstitución, 1 ml de solución contiene 2 mg de carfilzomib.
Excipientes: Sulfobutil éter beta-ciclodextrina sódica, ácido cítrico anhidro (E330), hidróxido sódico. Para mayor información consultar el prospecto.
Polvo para solución para perfusión. 1 vial
Leer el prospecto antes de utilizar este medicamento. Para vía intravenosa.
Para un solo uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar el producto en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
Eliminar las dosis no utilizadas de acuerdo con la normativa local.
Amgen Europe B.V. Minervum 7061, NL-4817 ZK Breda, Países Bajos
EU/1/15/1060/003
Lote
Se acepta la justificación para no incluir la información en Braille.
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC
SN
Kyprolis 30 mg polvo para solución para perfusión carfilzomib
Cada vial contiene 30 mg de carfilzomib.
Tras la reconstitución, 1 ml de solución contiene 2 mg de carfilzomib.
Sulfobutil éter beta-ciclodextrina sódica, ácido cítrico anhidro (E330), hidróxido sódico.
Polvo para solución para perfusión.
Leer el prospecto antes de utilizar este medicamento. Para vía intravenosa.
Para un solo uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar el producto en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
Eliminar las dosis no utilizadas de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Amgen Europe B.V. Minervum 7061, NL-4817 ZK Breda, Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1060/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille.
Kyprolis 60 mg polvo para solución para perfusión carfilzomib
Cada vial contiene 60 mg de carfilzomib.
Tras la reconstitución, 1 ml de solución contiene 2 mg de carfilzomib.
Excipientes: Sulfobutil éter beta-ciclodextrina sódica, ácido cítrico anhidro (E330), hidróxido sódico. Para mayor información consultar el prospecto.
Polvo para solución para perfusión. 1 vial
Leer el prospecto antes de utilizar este medicamento. Para vía intravenosa.
Para un solo uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar el producto en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
Eliminar las dosis no utilizadas de acuerdo con la normativa local.
Amgen Europe B.V. Minervum 7061, NL-4817 ZK Breda, Países Bajos
EU/1/15/1060/001
Lote
Se acepta la justificación para no incluir la información en Braille.
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC
SN
Kyprolis 60 mg polvo para solución para perfusión carfilzomib
Cada vial contiene 60 mg de carfilzomib.
Tras la reconstitución, 1 ml de solución contiene 2 mg de carfilzomib.
Sulfobutil éter beta-ciclodextrina sódica, ácido cítrico anhidro (E330), hidróxido sódico.
Polvo para solución para perfusión.
Leer el prospecto antes de utilizar este medicamento. Para vía intravenosa.
Para un solo uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar el producto en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
Eliminar las dosis no utilizadas de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Amgen Europe B.V. Minervum 7061, NL-4817 ZK Breda, Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1060/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille.
B. PROSPECTO
Prospecto: información para el paciente
Kyprolis 10 mg polvo para solución para perfusión Kyprolis 30 mg polvo para solución para perfusión Kyprolis 60 mg polvo para solución para perfusión
carfilzomib
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Kyprolis y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Kyprolis
3. Cómo usar Kyprolis
4. Posibles efectos adversos
5. Conservación de Kyprolis
6. Contenido del envase e información adicional
1. Qué es Kyprolis y para qué se utiliza
Kyprolis es un medicamento que contiene el principio activo carfilzomib.
Carfilzomib funciona bloqueando el proteosoma. El proteosoma es un sistema dentro de las células que descompone las proteínas cuando están dañadas o ya no son necesarias. Previniendo la descomposición de las proteínas en las células cancerosas, que son más probables que contengan una cantidad superior de proteínas anómalas, Kyprolis causa la muerte de las células cancerosas.
Kyprolis es utilizado para tratar a pacientes adultos con mieloma múltiple que han tenido como mínimo un tratamiento previo para esta enfermedad. El mieloma múltiple es un cáncer de células plasmáticas (un tipo de glóbulos blancos).
Se le administrará Kyprolis junto con lenalidomida y dexametasona, o solo con dexametasona. Lenalidomida y dexametasona son otros medicamentos para tratar el mieloma múltiple.
2. Qué necesita saber antes de empezar a usar Kyprolis
Su médico le examinará y revisará su historia clínica completa. Será sometido a un seguimiento estricto durante el tratamiento. Antes de iniciar el tratamiento con Kyprolis, y durante el tratamiento, se le efectuarán análisis de sangre. De este modo, se podrá verificar que dispone de suficientes glóbulos sanguíneos y que su hígado y riñones funcionan correctamente. Su médico o enfermero controlará que usted reciba suficiente cantidad de líquidos.
Debe leer el prospecto de todos los medicamentos que utiliza en combinación con Kyprolis, de modo que pueda comprender la información relacionada con estos medicamentos.
No use Kyprolis si es alérgico a carfilzomib o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o enfermero antes de empezar a usar Kyprolis si presenta alguna de las condiciones listadas abajo. Es posible que se deba someter a pruebas adicionales para comprobar que su corazón, sus riñones y su hígado funcionan correctamente.
• Problemas cardíacos, incluidos antecedentes de dolor torácico (angina de pecho), ataque cardíaco, latido cardíaco irregular, o si alguna vez ha tomado un medicamento para el corazón
• Problemas pulmonares, incluidos antecedentes de dificultad para respirar en reposo o al realizar actividades (disnea)
• Problemas renales, incluida insuficiencia renal, o si ha recibido diálisis alguna vez
• Problemas hepáticos, incluidos antecedentes de hepatitis, hígado graso, o si alguna vez le han comunicado que su hígado no funciona correctamente
• Hemorragias inusuales, incluida la formación fácil de cardenales, hemorragias debido a una lesión, como un corte que tarda más de lo esperado en parar de sangrar; o hemorragias internas como toser sangre, vomitar sangre, heces negras, o heces con sangre roja brillante; o hemorragias cerebrales que inducen entumecimiento repentino o parálisis en un lado de la cara, piernas o brazos, dolor de cabeza intenso y repentino o dificultad de visión o dificultad del habla o dificultad para tragar (deglución). Esto puede indicar un recuento plaquetario bajo (células que ayudan en la coagulación de la sangre)
• Antecedentes de coágulos sanguíneos en sus venas
• Dolor en piernas o brazos o hinchazón (que podrían ser síntomas de presencia de coágulos sanguíneos en las venas profundas de las piernas o los brazos), dolor en el pecho o dificultad respiratoria (que podrían ser síntomas de presencia de coágulos de sangre en los pulmones)
• Cualquier otra enfermedad grave para la que haya sido hospitalizado o recibido alguna medicación.
Síntomas a los que debe estar atento
Debe estar atento a determinados síntomas mientras tome Kyprolis para reducir el riesgo de problemas. Kyprolis puede empeorar algunos síntomas o producir efectos adversos graves que podrían ser mortales, como problemas cardíacos, pulmonares, renales, síndrome de lisis tumoral (una enfermedad potencialmente mortal que ocurre cuando las células cancerosas se rompen y liberan su contenido en la sangre), reacciones a la perfusión de Kyprolis, formación de hematomas o hemorragias inusuales (incluidas hemorragias internas), coágulos sanguíneos en sus venas, problemas hepáticos, determinados trastornos sanguíneos o un síndrome neurológico conocido como SEPR. Consulte el apartado ‘Signos y síntomas a los que debe estar atento’ en el apartado 4.
Uso de Kyprolis con otros medicamentos
Informe a su médico si está tomado, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento. Entre ellos, cualquier medicamento obtenido sin receta, como vitaminas o medicamentos a base de plantas.
Informe a su médico o enfermero si está tomando medicamentos utilizados para prevenir el embarazo, tales como anticonceptivos orales u otros anticonceptivos hormonales, debido a que estos no pueden ser adecuados para su uso con Kyprolis.
Embarazo y lactancia
Para mujeres que toman Kyprolis
No tome Kyprolis si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada. El tratamiento con Kyprolis no se ha evaluado en mujeres embarazadas. Mientras tome Kyprolis, y tras 30 días después de suspender el tratamiento, debe utilizar un método anticonceptivo adecuado para asegurarse de no quedar embarazada. Debe consultar con su médico o enfermero sobre los métodos adecuados de anticoncepción.
Si se queda embarazada mientras recibe Kyprolis, informe a su médico o enfermero inmediatamente.
No tome Kyprolis si está en periodo de lactancia. Se desconoce si Kyprolis se excreta en la leche materna.
Se prevé que lenalidomida puede ser nocivo para el feto. Kyprolis se administra en combinación con lenalidomida, por lo que debe seguir el Programa de Prevención del Embarazo (consulte el prospecto de lenalidomida para información de la prevención del embarazo y hable con su médico, farmacéutico o enfermero).
Para varones que toman Kyprolis
Mientras tome Kyprolis, y tras 90 días después de suspender el tratamiento, debe utilizar un condón, incluso si su pareja está embarazada.
Si su pareja se queda embarazada mientras recibe Kyprolis o tras 90 días después de suspender el tratamiento, informe a su médico o enfermero inmediatamente.
Conducción y uso de máquinas
Mientras reciba tratamiento con Kyprolis es posible que padezca fatiga, mareos, desvanecimientos y/o caída de la presión arterial. Esto puede afectar su capacidad para conducir o utilizar máquinas. No conduzca o utilice máquinas si tiene estos síntomas.
Kyprolis contiene sodio
Este medicamento contiene 0,3 mmol de sodio (es decir, 7 mg de sodio) por mililitro de solución reconstituida, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
3. Cómo usar Kyprolis
El médico o el enfermero le administrarán Kyprolis. La dosis se calculará según su altura y su peso (área de superficie corporal). Su médico o enfermero determinarán la dosis de Kyprolis que usted recibe.
Recibirá Kyprolis mediante perfusión en la vena. La perfusión puede durar hasta 30 minutos. Kyprolis se recibe 2 días seguidos cada semana, durante 3 semanas, seguidas de una semana sin tratamiento.
Cada período de 28 días es un ciclo de tratamiento. Esto significa que le administrarán Kyprolis los días 1, 2, 8, 9, 15 y 16 de cada ciclo de 28 días. Si usted recibe tratamiento con Kyprolis en combinación con lenalidomida y dexametasona, las dosis de los días 8 y 9 de cada ciclo no se administrarán a partir del ciclo 13.
La mayoría de los pacientes recibirán tratamiento mientras su enfermedad mejore o se mantenga estable. No obstante, el tratamiento con Kyprolis también se debe suspender si padece efectos adversos que no puedan ser controlados.
De forma conjunta con Kyprolis, también se le administrará lenalidomida y dexametasona o solo dexametasona. Usted también podría recibir otros medicamentos.
Si usa más Kyprolis del que debe
Este medicamento será administrado por un médico o enfermero, por lo que es improbable que reciba más del debido. No obstante, si recibe más Kyprolis del debido, su médico le supervisará para detectar efectos adversos.
En caso de duda sobre el uso de este medicamento, consulte a su médico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Signos y síntomas a los que debe estar atento
Algunos efectos adversos pueden ser importantes. Informe a su médico inmediatamente si
experimenta alguno de los siguientes síntomas:
• Dolores en el pecho, dificultad para respirar, o hinchazón en los pies, los cuales pueden ser síntomas de problemas cardíacos
• Dificultades respiratorias, incluidas dificultad para respirar en reposo o con la actividad o tos (disnea), respiración rápida, sensación de no poder respirar cuando hay oxígeno suficiente, sibilancias (ruidos al respirar) o tos, las cuales pueden ser signos de toxicidad pulmonar
• Presión arterial muy elevada, dolor torácico intenso, dolor de cabeza agudo, confusión, visión borrosa, náuseas y vómitos o crisis de ansiedad, los cuales pueden ser signos de un trastorno conocido como crisis hipertensiva
• Dificultad para respirar en las actividades diarias o en reposo, latido cardíaco irregular, aceleración del pulso, cansancio, mareos y desmayos, los cuales pueden ser signos de un trastorno conocido como hipertensión pulmonar
• Hinchazón en los tobillos, los pies o las manos, pérdida de apetito, menor expulsión de orina, o resultados anómalos en los análisis de sangre, los cuales pueden ser síntomas de problemas renales o insuficiencia renal
• Un efecto adverso denominado Síndrome de Lisis Tumoral, que se puede deber a la rápida descomposición de las células Inmorales y producir latidos cardíacos irregulares, insuficiencia renal o resultados anómalos en los análisis de sangre
• Fiebre, escalofríos o temblores, dolor articular, dolor muscular, congestión o hinchazón facial, debilidad, dificultad para respirar, presión arterial baja, desmayos, opresión en el pecho o dolor torácico pueden ocurrir como una reacción a la perfusión
• Formación de hematomas o hemorragias inusuales, como un corte que tarda más de lo habitual en dejar de sangrar; o hemorragias internas como toser sangre, vomitar sangre, heces negras o heces con sangre roja brillante; o hemorragias cerebrales que inducen repentino entumecimiento o parálisis en un lado de la cara, piernas o brazos, dolor de cabeza intenso y repentino o dificultad de visión o dificultad del habla o dificultad para tragar (deglución)
• Dolor en piernas o brazos o hinchazón (que podrían ser síntomas de presencia de coágulos sanguíneos en las venas profundas de las piernas o los brazos), dolor en el pecho o dificultad respiratoria (que podrían ser síntomas de presencia de coágulos de sangre en los pulmones)
• Coloración amarillenta de la piel y los ojos (ictericia), dolor o hinchazón abdominal, náuseas o vómitos, que podrían ser síntomas de problemas hepáticos, incluida insuficiencia hepática
• Hemorragias, hematomas, debilidad, confusión, fiebre, náuseas, vómitos y diarrea e insuficiencia renal aguda, los cuales pueden ser signos de un trastorno sanguíneo conocido como microangiopatía trombótica
• Dolores de cabeza, confusión, convulsiones (ataques), pérdida visual y presión arterial elevada (hipertensión), los cuales pueden ser síntomas de un trastorno neurológico denominado síndrome de encefalopatía posterior reversible (SERP).
Otros efectos adversos posibles
Efectos adversos muy frecuentes (que pueden afectar a más de 1 persona de cada 10)
• Reacciones a la perfusión
• Infección pulmonar grave (neumonía)
• Infección del tracto respiratorio (infección de las vías respiratorias)
• Secreción o congestión nasal
• Recuentos de plaquetas bajos, que puede causar hematomas o hemorragias (trombocitopenia)
• Recuento de glóbulos blancos bajo, que puede disminuir su capacidad de combatir las infecciones y asociarse con fiebre
• Recuento de glóbulos rojos bajo (anemia), que puede causar cansancio y fatiga
• Cambios en los análisis de sangre (disminución de los niveles sanguíneos de potasio, aumento de los niveles sanguíneos de azúcar y/o creatinina)
• Disminución del apetito
• Dificultad para dormir (insomnio)
• Dolor de cabeza
• Entumecimiento, hormigueo o disminución de la sensibilidad en las manos y/o los pies
• Mareos
• Presión arterial alta (hipertensión)
• Dificultad para respirar
• Tos
• Diarrea
• Náuseas
• Estreñimiento
• Vómitos
• Dolor de estómago
• Dolor de espalda
• Dolor en las articulaciones
• Dolor en las extremidades, las manos o los pies
• Espasmos musculares
• Fiebre
• Hinchazón de las manos, los pies o los tobillos
• Debilidad
• Cansancio (fatiga)
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas)
• Insuficiencia cardíaca y problemas cardíacos incluidos latidos cardíacos rápidos, fuertes o irregulares
• Problemas renales, incluida insuficiencia renal
• Coágulos sanguíneos en las venas (trombosis venosa profunda)
• Sofocos
• Coágulos de sangre en los pulmones
• Líquido en los pulmones
• Sibilancias (ruidos al respirar)
• Infección grave, incluida infección en la sangre (sepsis)
• Problemas hepáticos, incluido un aumento de las enzimas hepáticas en sangre
• Síntomas de tipo gripal (gripe)
• Infección del tracto urinario (infección de las estructuras que transportan orina)
• Tos que podría incluir opresión en el pecho o dolor, congestión nasal (bronquitis)
• Dolor de garganta
• Inflamación de la nariz y la garganta
• Moqueo en la nariz o estornudos
• Infección vírica
• Cambios en los análisis de sangre (disminución de los niveles sanguíneos de sodio, magnesio, proteínas, calcio o fosfatos, aumento de los niveles sanguíneos de calcio, ácido úrico, potasio, bilirrubina o proteína c reactiva)
• Deshidratación
• Ansiedad
• Visión borrosa
• Cataratas
• Presión arterial baja (hipotensión)
• Hemorragia nasal
• Cambios en la voz o ronquera
• Indigestión
• Dolor dental
• Erupción cutánea
• Dolor óseo, dolor muscular y dolor torácico
• Debilidad muscular
• Músculos doloridos
• Picazón en la piel
• Enrojecimiento de la piel
• Aumento de la sudoración
• Dolor
• Escalofríos
• Dolor, hinchazón, irritación o molestia en el lugar donde recibió la inyección intravenosa
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
• Reacción alérgica a Kyprolis
• Fallo multiorgánico
• Ataque cardíaco
• Reducción del flujo sanguíneo hacia el corazón
• Hemorragia cerebral
• Infarto cerebral
• Hinchazón del revestimiento del corazón (pericarditis), los síntomas incluyen dolor detrás del esternón, a veces difundiéndose al cuello y los hombros, en ocasiones con fiebre
• Acumulación de líquido en el revestimiento del corazón (derrame pericárdico), los síntomas incluyen dolor torácico o presión y dificultad para respirar
• Una obstrucción del flujo de bilis desde el hígado (colestasis), la cual puede causar picazón en la piel, coloración amarillenta de la piel, orina muy oscura y heces muy pálidas
• Perforación del sistema digestivo
• Infección pulmonar
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero,
incluso si se trata de posibles efectos adversos que no aparecen en este prospecto.
También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el
Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Kyprolis
Mantener este medicamento fuera de la vista y del alcance de los niños.
Kyprolis se conservará en la farmacia.
No utilice Kyprolis después de la fecha de caducidad que aparece en el vial y en la caja. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
El producto reconstituido debe ser una solución transparente, entre incolora y ligeramente amarillenta y no se debe administrar si se observa una alteración del color o la presencia de partículas.
Kyprolis está previsto únicamente para un solo uso. La eliminación del medicamento no utilizado y de todos los materiales derivados de su uso se realizará de acuerdo con la normativa local.
Contenido del envase e información adicional
6.
Composición de Kyprolis
- El principio activo es carfilzomib. Cada vial contiene 10 mg, 30 mg o 60 mg de carfilzomib. Después de la reconstitución, 1 ml de solución contiene 2 mg de carfilzomib.
- Los demás componentes son sulfobutil éter beta-ciclodextrina sódica, ácido cítrico anhidro (E330) e hidróxido sódico (ver sección 2 “Kyprolis contiene sodio”).
Aspecto de Kyprolis y contenido del envase
Kyprolis se suministra en un vial de vidrio como un polvo entre blanco y blanquecino para solución para perfusión, que se reconstituye (disuelve) antes del uso. La solución reconstituida es una solución transparente, incolora o ligeramente amarillenta.
Cada envase contiene 1 vial.
Titular de la autorización de comercialización y responsable de la fabricación
Amgen Europe B.V.
Minervum 7061,
NL-4817 ZK Breda,
Países Bajos
Titular de la autorización de comercialización:
Amgen Europe B.V.
Minervum 7061,
NL-4817 ZK Breda,
Países Bajos
Fabricante:
Amgen Technology Ireland (ADL)
Pottery Road Dun Laoghaire Co Dublin Irlanda
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Belgie/Belgique/Belgien
s.a. Amgen n.v.
Tel/Tél: +32 (0)2 7752711
Lietuva
Amgen Switzerland AG Vilniaus filialas
Tel: +370 5 219 7474
Etarapna
AMg^eH Etarapua EOOfl Tea.: +359 (0)2 424 7440
Ceská republika
Amgen s.r.o.
Tel: +420 221 773 500
Luxembourg/Luxemburg
s.a. Amgen Belgique/Belgien Tel/Tél: +32 (0)2 7752711
Magyarország
Amgen Kft.
Tel.: +36 1 35 44 700
|
Danmark Amgen, filial af Amgen AB, Sverige Tlf: +45 39617500 |
Malta Amgen B.V. The Netherlands Tel: +31 (0)76 5732500 |
|
Deutschland AMGEN GmbH Tel.: +49 89 1490960 |
Nederland Amgen B.V. Tel: +31 (0)76 5732500 |
|
Eesti Amgen Switzerland AG Vilniaus filialas Tel: +372 586 09553 |
Norge Amgen AB Tel: +47 23308000 |
|
EXXáSa Amgen Ekkág OappaKeuxiKá E.n.E. Tnk.: +30 210 3447000 |
Osterreich Amgen GmbH Tel: +43 (0)1 50 217 |
|
España Amgen S.A. Tel: +34 93 600 18 60 |
Polska Amgen Biotechnologia Sp. z o.o. Tel.: +48 22 581 3000 |
|
France Amgen S.A.S. Tél: +33 (0)9 69 363 363 |
Portugal Amgen Biofarmaceutica, Lda. Tel: +351 21 4220550 |
|
Hrvatska Amgen d.o.o. Tel: +385 (0)1 562 57 20 |
Romania Amgen Romania SRL Tel: +4021 527 3000 |
|
Ireland Amgen Limited United Kingdom Tel: +44 (0)1223 420305 |
Slovenija AMGEN zdravila d.o.o. Tel: +386 (0)1 585 1767 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Amgen Slovakia s.r.o. Tel: +421 33 321 13 22 |
|
Italia Amgen S.r.l. Tel: +39 02 6241121 |
Suomi/Finland Amgen AB, sivuliike Suomessa/Amgen AB, filial i Finland Puh/Tel: +358 (0)9 54900500 |
|
Kúnpoq C.A.Papaellinas Ltd Tnk.: +357 22741 741 |
Sverige Amgen AB Tel: +46 (0)8 6951100 |
|
Latvija Amgen Switzerland AG Rlgas filióle Tel: +371 257 25888 |
United Kingdom Amgen Limited Tel: +44 (0)1223 420305 |
Fecha de la última revisión de este prospecto Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Esta información está destinada únicamente a profesionales sanitarios:
Instrucciones para la reconstitución y la preparación de Kyprolis polvo para solución para perfusión para la administración intravenosa
Los viales de Kyprolis no contienen conservantes antimicrobianos y están destinados a un solo uso. Se debe aplicar una técnica aséptica adecuada.
La solución reconstituida contiene carfilzomib a una concentración de 2 mg/ml. Leer las instrucciones de preparación completas antes de la reconstitución.
1. Extraer el vial de la nevera justo antes de su uso.
2. Calcular la dosis (mg/m2) y el número de viales de Kyprolis necesarios teniendo en cuenta la superficie corporal basal (ASC) del paciente. Los pacientes con un ASC superior a 2,2 m2 deben recibir una dosis basada en un ASC de 2,2 m2. No es necesario efectuar ajustes de la dosis para cambios de peso < 20%.
3. Reconstituir de forma aséptica cada vial inyectando lentamente 5 ml (para el vial de 10 mg), 15 ml (para el vial de 30 mg) o 29 ml (para el vial de 60 mg) de agua estéril para preparaciones inyectables a través del tapón y dirigiendo la solución hacia la PARED INTERNA DEL VIAL para minimizar la formación de espuma.
4. Girar y/o invertir el vial suave y lentamente durante aproximadamente 1 minuto, o hasta que se complete la disolución. NO AGITAR. Si se forma espuma, dejar que la solución se asiente en el vial hasta que disminuya la espuma (aproximadamente 5 minutos) y la solución sea transparente.
5. Revisar visualmente para detectar partículas y alteraciones del color antes de la administración. El producto reconstituido debe ser una solución transparente, entre incolora y ligeramente amarillenta y no se debe administrar si se observa una alteración del color o la presencia de partículas.
6. Desechar cualquier porción no utilizada que quede en el vial.
7. Opcionalmente, Kyprolis se puede administrar en una bolsa para vía intravenosa.
8. Al administrarlo en una bolsa para vía intravenosa, extraer la dosis calculada del vial y diluir en una bolsa para vía intravenosa de 50 o 100 ml con solución para inyección de glucosa al 5%.
Desde un punto de vista microbiológico, el producto se debe utilizar inmediatamente. Si no se utiliza inmediatamente, los tiempos y las condiciones de conservación en uso son responsabilidad del usuario y no deben ser superiores a 24 horas a entre 2°C y 8°C.
Eliminación
La eliminación del medicamento no utilizado y de todos los materiales derivados de su uso se realizará de acuerdo con la normativa local.
56