Keytruda 50Mg Polvo Para Concentrado Para Solucion Para Perfusion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
KEYTRUDA 50 mg polvo para concentrado para solución para perfusión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un vial de polvo contiene 50 mg de pembrolizumab.
Después de la reconstitución, 1 ml de concentrado contiene 25 mg de pembrolizumab.
Pembrolizumab es un anticuerpo monoclonal humanizado (IgG4/isotipo kappa con una alteración de la secuencia estabilizadora en la región Fc) frente a la muerte celular programada-1 (PD-1), producido en células de ovario de hámster chino mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para concentrado para solución para perfusión. Polvo liofilizado de color blanco a blanquecino.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
KEYTRUDA en monoterapia está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos.
KEYTRUDA está indicado para el tratamiento del cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico en adultos cuyos tumores expresen PD-L1 y que hayan recibido al menos un tratamiento de quimioterapia previo. Los pacientes con mutaciones positivas de EGFR o ALK también deben haber recibido tratamiento aprobado para estas mutaciones antes de recibir KEYTRUDA.
4.2 Posología y forma de administración
El tratamiento se debe iniciar y supervisar por médicos especialistas con experiencia en el tratamiento del cáncer.
Pruebas de PD-L1 en pacientes con CPNM
Se debe seleccionar a los pacientes con CPNM para el tratamiento, de acuerdo a la expresión tumoral de PD-L1 confirmada mediante una prueba validada (ver sección 5.1).
Posología
La dosis recomendada de KEYTRUDA es de 2 mg/kg administrados por vía intravenosa durante 30 minutos cada 3 semanas. Los pacientes deben recibir tratamiento con KEYTRUDA hasta progresión de la enfermedad o toxicidad inaceptable. Se han observado respuestas atípicas (por ej., un aumento transitorio inicial del tamaño tumoral o nuevas lesiones pequeñas dentro de los primeros meses, seguido por una reducción del tamaño del tumor). Se recomienda continuar el tratamiento en pacientes clínicamente estables con evidencia inicial de progresión de la enfermedad hasta que se confirme la progresión de la enfermedad.
Suspensión temporal de la dosis o suspensión definitiva del tratamiento (ver también sección 4.4)
Tabla 1: Modificaciones del tratamiento recomendadas para KEYTRUDA
|
Reacciones adversas relacionadas con el sistema inmunitario |
Gravedad |
Modificación del tratamiento |
|
Neumonitis |
Grado 2 |
Suspender temporalmente* |
|
Grado 3 o 4 o recurrente de Grado 2 |
Suspender definitivamente | |
|
Colitis |
Grado 2 o 3 |
Suspender temporalmente* |
|
Grado 4 |
Suspender definitivamente | |
|
Nefritis |
Grado 2 con creatinina >1,5 a 3 veces el límite superior de la normalidad (LSN) |
Suspender temporalmente* |
|
Grado > 3 con creatinina > 3 veces el LSN |
Suspender definitivamente | |
|
Endocrinopatías |
Hipofisitis sintomática Diabetes tipo 1 asociada a hiperglucemia de Grado > 3 (glucosa >250 mg/dl o > 13,9 mmol/l) o asociada a cetoacidosis Hipertiroidismo de Grado > 3 |
Suspender temporalmente* Se puede valorar la continuación del tratamiento con pembrolizumab después de la reducción progresiva de los corticosteroides, si es necesario, en pacientes con endocrinopatía de Grado 3 o Grado 4 que mejora a Grado 2 o menor y se controla con terapia hormonal sustitutiva, si está indicado. En caso contrario, el tratamiento se debe suspender definitivamente. El hipotiroidismo se puede controlar con terapia hormonal sustitutiva sin interrumpir el tratamiento. |
|
Hepatitis |
Grado 2 con la aspartato aminotransferasa (AST) o la alanina aminotransferasa (ALT) >3 a 5 veces el LSN o la bilirrubina total >1,5 a 3 veces el LSN |
Suspender temporalmente* |
|
Grado > 3 con la AST o la ALT > 5 veces el LSN o la bilirrubina total > 3 veces el LSN |
Suspender definitivamente | |
|
En caso de metástasis hepática en estado basal con elevación de Grado 2 de la AST o la ALT, hepatitis con la AST o la ALT elevadas > 50% y ésta dura > 1 semana |
Suspender definitivamente | |
|
Reacciones adversas asociadas a la perfusión |
Grado 3 o 4 |
Suspender definitivamente |
Nota: los grados de toxicidad son coherentes con los Criterios de Terminología Comunes para Acontecimientos Adversos del National Cancer Institute versión 4 (CTCAE del NCI v.4).
hasta que las reacciones adversas se recuperen a Grado 0-1.
KEYTRUDA se debe suspender definitivamente:
• Por toxicidad de Grado 4 excepto por endocrinopatías que están controladas con terapia hormonal sustitutiva
• Si no se puede reducir la dosis de corticosteroide a <10 mg de prednisona o equivalente al día en el plazo de 12 semanas
• Si una toxicidad relacionada con el tratamiento no se recupera a Grado 0-1 en el plazo de 12 semanas después de la última dosis de KEYTRUDA
• Si se produce por segunda vez cualquier acontecimiento de gravedad de Grado > 3
Se debe dar a los pacientes tratados con KEYTRUDA la tarjeta de información para el paciente y se les debe informar sobre los riesgos de KEYTRUDA (ver también el prospecto).
Poblaciones especiales Pacientes de edad avanzada
En general, no se han notificado diferencias en la seguridad o la eficacia entre los pacientes de edad avanzada (> 65 años) y los pacientes más jóvenes (< 65 años). No es necesario un ajuste de la dosis en esta población.
Insuficiencia renal
No es necesario un ajuste de la dosis en pacientes con insuficiencia renal leve o moderada. No se ha estudiado KEYTRUDA en pacientes con insuficiencia renal grave (ver sección 5.2).
Insuficiencia hepática
No es necesario un ajuste de la dosis en pacientes con insuficiencia hepática leve. No se ha estudiado KEYTRUDA en pacientes con insuficiencia hepática moderada o grave (ver sección 5.2).
Melanoma ocular
Los datos sobre la seguridad y eficacia de KEYTRUDA en pacientes con melanoma ocular son limitados (ver sección 5.1).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de KEYTRUDA en niños menores de 18 años. No se dispone de datos.
Forma de administración
KEYTRUDA se debe administrar mediante perfusión intravenosa durante 30 minutos. KEYTRUDA no se debe administrar como inyección intravenosa rápida (bolus).
Para consultar las instrucciones de reconstitución y dilución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo Determinación de la expresión de PD-L1
Al evaluar el estado de PD-L1 del tumor, es importante que se elija una metodología bien validada y robusta para reducir al mínimo los resultados falsos negativos o falsos positivos.
Reacciones adversas relacionadas con el sistema inmunitario
La mayoría de las reacciones adversas relacionadas con el sistema inmunitario que se produjeron durante el tratamiento con pembrolizumab fueron reversibles y se controlaron con interrupciones de pembrolizumab, la administración de corticosteroides y/o terapia de apoyo. También se produjeron reacciones adversas relacionadas con el sistema inmunitario después de la última dosis de pembrolizumab.
En caso de sospecha de reacciones adversas relacionadas con el sistema inmunitario, se debe asegurar una evaluación adecuada para confirmar la etiología o descartar otras causas. De acuerdo con la gravedad de la reacción adversa, pembrolizumab se debe suspender temporalmente y se debe administrar corticosteroides. Tras la mejoría a Grado <1, se debe iniciar la reducción progresiva de los corticosteroides y continuar durante al menos 1 mes. De acuerdo a los datos limitados de ensayos clínicos en pacientes cuyas reacciones adversas relacionadas con el sistema inmunitario no pudieron ser controladas con el uso de corticosteroides, se puede evaluar la administración de otros inmunosupresores sistémicos.
Pembrolizumab se podría reiniciar en el plazo de 12 semanas después de la última dosis de KEYTRUDA, si la reacción adversa se mantiene en Grado <1 y la dosis de corticosteroide se ha reducido a <10 mg de prednisona o equivalente al día.
Pembrolizumab se debe suspender definitivamente por cualquier reacción adversa relacionada con el sistema inmunitario recurrente de Grado 3 y por toxicidad de la reacción adversa relacionada con el sistema inmunitario de Grado 4, excepto por endocrinopatías que estén controladas con terapia hormonal sustitutiva (ver las secciones 4.2 y 4.8).
Neumonitis relacionada con el sistema inmunitario
Se ha notificado neumonitis, incluyendo casos mortales, en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a signos y síntomas de neumonitis. Si se sospecha neumonitis, se debe confirmar con pruebas de imagen radiográficas y descartar otras causas. Se debe administrar corticosteroides en caso de acontecimientos de Grado > 2 (dosis inicial de 12 mg/kg/día de prednisona o equivalente, seguida por una reducción progresiva); pembrolizumab se debe suspender temporalmente en caso de neumonitis de Grado 2 y se debe suspender definitivamente en caso de neumonitis de Grado 3, Grado 4 o recurrente de Grado 2 (ver sección 4.2).
Colitis relacionada con el sistema inmunitario
Se ha notificado colitis en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a signos y síntomas de colitis y descartar otras causas. Se debe administrar corticosteroides en caso de acontecimientos de Grado > 2 (dosis inicial de 1-2 mg/kg/día de prednisona o equivalente, seguida por una reducción progresiva); pembrolizumab se debe suspender temporalmente en caso de colitis de Grado 2 o Grado 3 y se debe suspender definitivamente en caso de colitis de Grado 4 (ver sección 4.2). Se debe tener en cuenta el riesgo potencial de perforación gastrointestinal.
Hepatitis relacionada con el sistema inmunitario
Se ha notificado hepatitis en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a cambios en la función hepática (al comienzo del tratamiento, periódicamente durante el tratamiento y según esté indicado de acuerdo con la evaluación clínica) y en cuanto a síntomas de hepatitis y descartar otras causas. Se debe administrar corticosteroides (dosis inicial de 0,5-1 mg/kg/día (en caso de acontecimientos de Grado 2) y 1-2 mg/kg/día (en acontecimientos de Grado > 3) de prednisona o equivalente, seguida por una reducción progresiva) y, de acuerdo con la intensidad de las elevaciones de las enzimas hepáticas, pembrolizumab se debe suspender temporalmente o suspender definitivamente (ver sección 4.2).
Nefritis relacionada con el sistema inmunitario
Se ha notificado nefritis en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a cambios en la función renal y descartar otras causas de disfunción renal. Se debe administrar corticosteroides en caso de acontecimientos de Grado > 2 (dosis inicial de 1-2 mg/kg/día de prednisona o equivalente, seguida por una reducción progresiva) y, de acuerdo con la intensidad de las elevaciones de la creatinina, pembrolizumab se debe suspender temporalmente en caso de nefritis de Grado 2 y se debe suspender definitivamente en caso de nefritis de Grado 3 o Grado 4 (ver sección 4.2).
Endocrinopatías relacionadas con el sistema inmunitario
Con el tratamiento con pembrolizumab se han observado endocrinopatías graves, tales como hipofisitis, diabetes mellitus tipo 1, cetoacidosis diabética, hipotiroidismo e hipertiroidismo.
En casos de endocrinopatías relacionadas con el sistema inmunitario podría ser necesario el tratamiento a largo plazo con terapia hormonal sustitutiva.
Se ha notificado hipofisitis en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a signos y síntomas de hipofisitis (incluido hipopituitarismo e insuficiencia suprarrenal secundaria) y descartar otras causas. Se debe administrar corticosteroides para tratar la insuficiencia suprarrenal secundaria y otras terapias hormonales sustitutivas según esté clínicamente indicado, y pembrolizumab se debe suspender temporalmente por hipofisitis sintomática hasta que el acontecimiento se ha controlado con terapia hormonal sustitutiva. Se puede valorar la continuación del tratamiento con pembrolizumab, después de la reducción progresiva del corticosteoride, si es necesario (ver sección 4.2). Se debe vigilar la función hipofisaria y los niveles hormonales para asegurar que la terapia hormonal sustitutiva es la adecuada.
Se ha notificado diabetes mellitus tipo 1, incluida cetoacidosis diabética, en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a hiperglucemia u otros signos y síntomas de diabetes. Se debe administrar insulina para la diabetes tipo 1 y se debe suspender temporalmente pembrolizumab en casos de hiperglucemia de Grado 3, hasta que se alcance el control metabólico (ver sección 4.2).
Se han notificado trastornos del tiroides, como hipotiroidismo, hipertiroidismo y tiroiditis, en pacientes que recibieron pembrolizumab y se pueden producir en cualquier momento durante el tratamiento; por lo tanto, se debe vigilar a los pacientes en cuanto a cambios en la función tiroidea (al comienzo del tratamiento, periódicamente durante el tratamiento y según esté indicado de acuerdo con la evaluación clínica) y en cuanto a signos y síntomas clínicos de trastornos tiroideos. El hipotiroidismo se puede manejar con tratamiento sustitutivo sin interrupción del tratamiento y sin corticosteroides. El hipertiroidismo se puede manejar sintomáticamente. Pembrolizumab se debe suspender temporalmente por hipertiroidismo de Grado > 3 hasta que se recupere a Grado < 1. Se puede valorar la continuación del tratamiento con pembrolizumab, después de la reducción progresiva del corticosteroide, si es necesario, en pacientes con hipertiroidismo de Grado 3 o Grado 4 que mejore a Grado 2 o menor (ver secciones 4.2 y 4.8). Se debe vigilar la función tiroidea y los niveles hormonales para asegurar que la terapia hormonal sustitutiva es la adecuada.
Otras reacciones adversas relacionadas con el sistema inmunitario
Se han notificado las siguientes reacciones adversas adicionales clínicamente significativas, relacionadas con el sistema inmunitario, en pacientes que recibieron pembrolizumab: uveítis, artritis, miositis, pancreatitis, reacciones cutáneas graves, síndrome de Guillain-Barré, síndrome miasténico, anemia hemolítica y crisis parciales surgidas en un paciente con foco inflamatorio en el parénquima cerebral (ver sección 4.8).
De acuerdo a la gravedad de la reacción adversa, pembrolizumab se debe suspender temporalmente y administrar corticosteroides.
Pembrolizumab se puede reiniciar en el plazo de 12 semanas después de la última dosis de KEYTRUDA, si la reacción adversa se mantiene en Grado <1 y la dosis del corticosteoride se ha reducido a <10 mg de prednisona o equivalente al día.
Pembrolizumab se debe suspender definitivamente por cualquier reacción adversa relacionada con el sistema inmunitario recurrente de Grado 3 y por toxicidad de cualquier reacción adversa relacionada con el sistema inmunitario de Grado 4 (ver secciones 4.2 y 4.8).
Reacciones asociadas a la perfusión
Se han notificado reacciones graves asociadas a la perfusión en pacientes que recibieron pembrolizumab (ver sección 4.8). En las reacciones graves a la perfusión, se debe detener la perfusión y pembrolizumab se debe suspender definitivamente (ver sección 4.2). Los pacientes con reacción a la perfusión leve o moderada pueden seguir recibiendo pembrolizumab con una vigilancia estrecha; se puede valorar la medicación previa con antipiréticos y antihistamínicos.
Pacientes excluidos de los ensayos clínicos
Se excluyeron de los ensayos clínicos los pacientes con los siguientes problemas: metástasis activas en el SNC; infección por VIH, hepatitis B o hepatitis C; enfermedad autoinmune sistémica activa; enfermedad pulmonar intersticial; neumonitis previa que precisa tratamiento con corticosteroides sistémicos; antecedentes de hipersensibilidad grave a otros anticuerpos monoclonales; que estén recibiendo tratamiento inmunosupresor y antecedentes de reacciones adversas graves relacionadas con el sistema inmunitario, debidas al tratamiento con ipilimumab, definidas como cualquier toxicidad de Grado 4 o de Grado 3 que requirió tratamiento con corticosteroides (> 10 mg/día de prednisona o equivalente) durante más de 12 semanas. Los pacientes con infecciones activas fueron excluidos de los ensayos clínicos y se requirió el tratamiento de la infección antes de recibir pembrolizumab. Los pacientes con infecciones activas que se produjeron durante el tratamiento con pembrolizumab fueron controlados con tratamiento médico adecuado. Los pacientes con anomalías, clínicamente significativas en el estado basal, renales (creatinina > 1,5 x LSN) o hepáticas (bilirrubina > 1,5 x LSN, ALT, AST > 2,5 x LSN en ausencia de metástasis hepáticas) fueron excluidos de los ensayos clínicos, por lo que la información en pacientes con insuficiencia renal grave e insuficiencia hepática de moderada a grave es limitada.
Después de considerar cuidadosamente el potencial aumento del riesgo, se puede usar pembrolizumab con un control médico adecuado en estos pacientes.
Tarjeta de información para el paciente
Todos los prescriptores de KEYTRUDA deben estar familiarizados con la Información para el médico y las Directrices de manejo. El prescriptor debe explicar al paciente los riesgos del tratamiento con KEYTRUDA. Se le debe proporcionar al paciente la tarjeta de información para el paciente con cada prescripción.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacciones medicamentosas farmacocinéticas con pembrolizumab. Como pembrolizumab se elimina de la circulación mediante catabolismo, no se esperan interacciones medicamentosas metabólicas.
Se debe evitar el uso de corticosteroides sistémicos o de inmunosupresores antes de comenzar el tratamiento con pembrolizumab, debido a su posible interferencia con la actividad farmacodinámica y la eficacia de pembrolizumab. Sin embargo, se puede usar corticosteroides sistémicos u otros inmunosupresores después de comenzar el tratamiento con pembrolizumab, para tratar las reacciones adversas relacionadas con el sistema inmunitario (ver sección 4.4).
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento con pembrolizumab y hasta al menos 4 meses después de la última dosis de pembrolizumab.
Embarazo
No hay datos relativos al uso de pembrolizumab en mujeres embarazadas. No se han realizado estudios de reproducción animal con pembrolizumab; sin embargo, en modelos murinos de gestación se ha demostrado que el bloqueo de la señalización de PD-L1 altera la tolerancia al feto y conduce a un aumento de la pérdida fetal (ver sección 5.3). Estos resultados indican un posible riesgo, de acuerdo a su mecanismo de acción, de que la administración de pembrolizumab durante el embarazo pudiera causar daño fetal, incluido aumento de las tasas de abortos o de fetos nacidos muertos. Se sabe que las inmunoglobulinas humanas G4 (IgG4) atraviesan la barrera placentaria; por lo tanto, siendo una IgG4, pembrolizumab tiene el potencial de transmitirse de la madre al feto en desarrollo. Pembrolizumab no se debe usar durante el embarazo a menos que el estado clínico de la mujer precise tratamiento con pembrolizumab.
Lactancia
Se desconoce si pembrolizumab se excreta en la leche materna. Dado que se sabe que los anticuerpos se pueden excretar en la leche materna, no se puede excluir el riesgo en recién nacidos/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con pembrolizumab, tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento con pembrolizumab para la madre.
Fertilidad
No se dispone de datos clínicos relativos a los posibles efectos de pembrolizumab sobre la fertilidad. No hubo efectos notables en los órganos reproductores masculinos y femeninos en monos, de acuerdo a los estudios de toxicidad a dosis repetidas de 1 mes y 6 meses (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Pembrolizumab puede tener una influencia pequeña sobre la capacidad para conducir y utilizar máquinas. Se ha notificado fatiga después de la administración de pembrolizumab (ver sección 4.8).
4.8 Reacciones adversas
Resumen del perfil de seguridad
Pembrolizumab se asocia más frecuentemente a reacciones adversas relacionadas con el sistema inmunitario. La mayoría de éstas, incluyendo las reacciones graves, se resolvieron después de iniciar el tratamiento médico adecuado o de suspender definitivamente el tratamiento con pembrolizumab (ver “Descripción de reacciones adversas seleccionadas” más abajo).
Se ha evaluado la seguridad de pembrolizumab en ensayos clínicos en 2.799 pacientes con melanoma avanzado o CPNM en tres dosis (2 mg/kg cada 3 semanas o 10 mg/kg cada 2 o 3 semanas). En esta población de pacientes, las reacciones adversas más frecuentes (> 10%) con pembrolizumab fueron fatiga (24%), erupción (19%), prurito (18%), diarrea (12%), náuseas (11%) y artralgia (10%). La mayoría de las reacciones adversas notificadas fueron de intensidad de Grado 1 o 2. Las reacciones adversas más graves fueron reacciones adversas relacionadas con el sistema inmunitario y reacciones graves asociadas a la perfusión (ver sección 4.4).
Tabla de reacciones adversas
Las reacciones adversas notificadas en ensayos clínicos en 2.799 pacientes tratados con pembrolizumab se notifican en la Tabla 2. Estas reacciones se presentan según el sistema de clasificación de órganos y por frecuencia. Las frecuencias se definen como: muy frecuentes (> 1/10); frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1.000); muy raras (< 1/10.000). Dentro de cada grupo de frecuencias, se presentan las reacciones adversas en orden decreciente de gravedad.
Tabla 2: Reacciones adversas en pacientes tratados con pembrolizumab en ensayos clínicos
|
Trastornos de la sangre y del sistema linfático | |
|
Frecuentes |
anemia |
|
Poco frecuentes |
neutropenia, leucopenia, trombocitopenia, linfopenia, eosinofilia |
|
Raras |
púrpura trombocitopénica inmune, anemia hemolítica |
|
Trastornos del sistema inmunológico | |
|
Frecuentes |
reacción asociada a perfusión3 |
|
Trastornos endocrinos | |
|
Frecuentes |
hipertiroidismo, hipotiroidismob |
|
Poco frecuentes |
hipofisitisc, insuficiencia suprarrenal, tiroiditis |
|
Trastornos del metabolismo y de la nutrición | |
|
Frecuentes |
apetito disminuido |
|
Poco frecuentes |
diabetes mellitus tipo 1d, hiponatremia, hipocaliemia, hipocalcemia |
|
Trastornos psiquiátricos | |
|
Poco frecuentes |
insomnio |
|
Trastornos del sistema nervioso | |
|
Frecuentes |
cefalea, mareo, disgeusia |
|
Poco frecuentes |
epilepsia, letargia, neuropatía periférica |
|
Raras |
síndrome de Guillain-Barré, síndrome miasténico |
|
Trastornos oculares | |
|
Frecuentes |
ojo seco |
|
Poco frecuentes |
uveítise |
|
Trastornos vasculares | |
|
Poco frecuentes |
hipertensión |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes |
neumonitisf, disnea, tos |
|
Trastornos gastrointestinales | |
|
Muy frecuentes |
diarrea, náuseas |
|
Frecuentes |
colitisg, vómitos, dolor abdominal11, estreñimiento, boca seca |
|
Poco frecuentes |
pancreatitisi |
|
Raras |
perforación de intestino delgado |
|
Trastornos hepatobiliares | |
|
Poco frecuentes |
hepatitisj |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy frecuentes |
. , k • l erupción , prurito |
|
Frecuentes |
reacciones cutáneas gravesm, vitÍligo11, dermatitis acneiforme, piel seca, eritema, eczema |
|
Poco frecuentes |
queratosis liquenoideo, psoriasis, alopecia, eritema nudoso, dermatitis, cambios de color del pelo, pápula |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
Muy frecuentes |
artralgia |
|
Frecuentes |
miositisp, dolor musculoesqueléticoq, dolor en una extremidad, artritis1 |
|
Poco frecuentes |
tenosinovitiss |
|
Trastornos renales y urinarios | |
|
Poco frecuentes |
nefritist |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes |
fatiga |
|
Frecuentes |
astenia, edemau, pirexia, enfermedad de tipo gripal, escalofrío |
|
Exploraciones complementarias | |
|
Frecuentes |
alanina aminotransferasa elevada, aspartato aminotransferasa elevada, fosfatasa alcalina en sangre aumentada, creatinina elevada en sangre |
|
Poco frecuentes |
amilasa elevada, bilirrubina elevada en sangre, hipercalcemia |
* Los siguientes términos representan a un grupo de eventos relacionados que describen a una enfermedad más que a un evento aislado.
a. reacción asociada a perfusión (hipersensibilidad a fármaco, reacción anafiláctica, hipersensibilidad y síndrome de liberación de citocina)
b. hipotiroidismo (mixedema)
c. hipofisitis (hipopituitarismo)
d. diabetes mellitus tipo 1 (cetoacidosis diabética)
e. uveítis (iritis e iridociclitis)
f. neumonitis (enfermedad pulmonar intersticial)
g. colitis (colitis microscópica y enterocolitis)
h. dolor abdominal (molestia abdominal, dolor en la zona superior del abdomen y dolor en la zona inferior del abdomen)
i. pancreatitis (pancreatitis autoinmune y pancreatitis aguda)
j. hepatitis (hepatitis autoinmunitaria y lesión hepática inducida por fármacos)
k. erupción (erupción eritematosa, erupción folicular, erupción generalizada, erupción macular, erupción maculopapular, erupción papular, erupción prurítica, erupción vesicular y erupción genital)
l. prurito (urticaria, urticaria papular, prurito generalizado y prurito genital)
m. reacciones cutáneas graves (dermatitis exfoliativa, eritema multiforme, erupción exfoliativa, penfigoide, síndrome de Stevens-Johnson y las siguientes reacciones de Grado > 3: prurito, erupción, erupción generalizada y erupción maculopapular)
n. vitíligo (despigmentación de la piel, hipopigmentación de la piel e hipopigmentación del párpado)
o. queratosis liquenoide (liquen plano y liquen escleroso)
p. miositis (mialgia, miopatía, polimialgia reumática y rabdomiolisis)
q. dolor musculoesquelético (molestia musculoesquelética, dolor de espalda, rigidez musculoesquelética, dolor torácico musculoesquelético y tortícolis)
r. artritis (hinchazón articular, poliartritis y derrame articular)
s. tenosinovitis (tendinitis, sinovitis y dolor tendinoso)
t. nefritis (nefritis autoinmune, nefritis tubulointersticial y fallo renal o fallo renal agudo con evidencia de nefritis)
u. edema (edema periférico, edema generalizado, sobrecarga de líquido, retención de líquidos, edema palpebral y edema de labio, edema de cara, edema localizado y edema periorbital)
Descripción de reacciones adversas seleccionadas
Los datos de las siguientes reacciones adversas relacionadas con el sistema inmunitario se basan en pacientes que recibieron pembrolizumab en tres dosis (2 mg/kg cada 3 semanas o 10 mg/kg cada 2 o 3 semanas) en ensayos clínicos (ver sección 5.1). Las directrices para el manejo de estas reacciones adversas se describen en la sección 4.4.
Reacciones adversas relacionadas con el sistema inmunitario (ver sección 4.4)
Neumonitis relacionada con el sistema inmunitario
Se produjo neumonitis en 94 (3,4%) pacientes, incluidos casos de Grado 2, 3, 4 o 5 en 36 (1,3%),
25 (0,9%), 7 (0,3%) y 4 (0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de neumonitis fue de 3,3 meses (rango, 2 días a 19,3 meses). La mediana de duración fue de 1,5 meses (rango, 1 día a 17,2+ meses). La neumonitis condujo a la suspensión definitiva de pembrolizumab en 36 (1,3%) pacientes y se resolvió en 55 pacientes.
Colitis relacionada con el sistema inmunitario
Se produjo colitis en 48 (1,7%) pacientes, incluidos casos de Grado 2, 3 o 4 en 10 (0,4%), 31 (1,1%) y 2 (<0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de colitis fue de 3,5 meses (rango, 10 días a 16,2 meses). La mediana de duración fue de 1,3 meses (rango, 1 día a 8,7+ meses). La colitis condujo a la suspensión definitiva de pembrolizumab en 15 (0,5%) pacientes y se resolvió en 41 pacientes.
Hepatitis relacionada con el sistema inmunitario
Se produjo hepatitis en 19 (0,7%) pacientes, incluidos casos de Grado 2, 3 o 4 en 4 (0,1%), 12 (0,4%) y 2 (<0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de hepatitis fue de 1,3 meses (rango, 8 días a 21,4 meses). La mediana de duración fue de
1,8 meses (rango, 8 días a 20,9+ meses). La hepatitis condujo a la suspensión definitiva de pembrolizumab en 6 (0,2%) pacientes y se resolvió en 15 pacientes.
Nefritis relacionada con el sistema inmunitario
Se produjo nefritis en 9 (0,3%) pacientes, incluidos casos de Grado 2, 3 o 4 en 3 (0,1%), 4 (0,1%) y 1 (<0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de nefritis fue de 5,1 meses (rango, 12 días a 12,8 meses). La mediana de duración fue de 3,3 meses (rango, 12 días a 8,9+ meses). La nefritis condujo a la suspensión definitiva de pembrolizumab en 3 (0,1%) paciente y se resolvió en 5 pacientes.
Endocrinopatías relacionadas con el sistema inmunitario
Se produjo hipofisitis en 17 (0,6%) pacientes, incluidos casos de Grado 2, 3 o 4 en 6 (0,2%), 8 (0,3%) y 1 (<0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de hipofisitis fue de 3,7 meses (rango, 1 día a 11,9 meses). La mediana de duración fue de 4,7 meses (rango, 8+ días a 12,7 meses). La hipofisitis condujo a la suspensión definitiva de pembrolizumab en 4 (0,1%) pacientes y se resolvió en 7 pacientes, 2 con secuelas.
Se produjo hipertiroidismo en 96 (3,4%) pacientes, incluidos casos de Grado 2 o 3 en 22 (0,8%) y 4 (0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de hipertiroidismo fue de 1,4 meses (rango, 1 día a 21,9 meses). La mediana de duración fue de 2,1 meses (rango, 3 días a 15,0+ meses). El hipertiroidismo condujo a la suspensión definitiva de pembrolizumab en 2 (<0,1%) pacientes y se resolvió en 71 (74%) pacientes.
Se produjo hipotiroidismo en 237 (8,5%) pacientes, incluidos casos de Grado 2 o 3 en 174 (6,2%) y 3 (0,1%) pacientes, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de hipotiroidismo fue de 3,5 meses (rango, 1 día a 18,9 meses). La mediana de duración no se alcanzó (rango, 2 días a 27,7+ meses). Un paciente (<0,1%) discontinuó pembrolizumab debido a hipotiroidismo. El hipotiroidismo se resolvió en 48 (20%) pacientes.
Inmunogenicidad
En ensayos clínicos en pacientes tratados con pembrolizumab 2 mg/kg cada 3 semanas o 10 mg/kg cada 2 o 3 semanas, 19 (1,7%) de 1.087 pacientes evaluables dió positivo a anticuerpos generados por el organismo frente a pembrolizumab. No hubo evidencia de alteración de la farmacocinética o del perfil de seguridad con el desarrollo de anticuerpos de unión anti-pembrolizumab.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No hay información acerca de la sobredosis con pembrolizumab.
En caso de sobredosis, los pacientes deben ser vigilados estrechamente en cuanto a signos o síntomas de reacciones adversas y se debe instaurar tratamiento sintomático adecuado.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: otros agentes antineoplásicos, anticuerpos monoclonales. Código ATC: L01XC18
Mecanismo de acción
KEYTRUDA es un anticuerpo monoclonal humanizado, que se une al receptor de la muerte celular programada-1 (PD-1) y bloquea su interacción con los ligandos PD-L1 y PD-L2. El receptor PD-1 es un regulador negativo de la actividad de las células T que se ha demostrado que está involucrado en el control de las respuestas inmunitarias de las células T. KEYTRUDA potencia las respuestas de las células T, incluyendo las respuestas antitumorales, mediante el bloqueo de PD-1, unido a PD-L1 y
PD-L2, que se expresan en las células presentadoras de antígenos y que se pueden expresar por tumores u otras células en el microambiente tumoral.
Eficacia clínica y seguridad
Melanoma
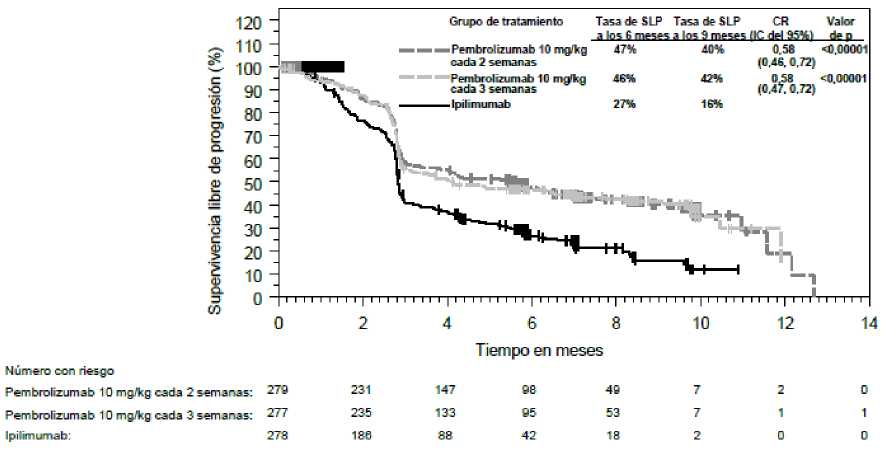
KEYNOTE-006: Ensayo controlado en _pacientes con melanoma naive al tratamiento con ipilimumab La seguridad y eficacia de pembrolizumab se investigó en el ensayo KEYNOTE-006, un ensayo de Fase III, multicéntrico, controlado, para el tratamiento del melanoma avanzado en pacientes naive al tratamiento con ipilimumab. Los pacientes fueron aleatorizados (1:1:1) a recibir pembrolizumab 10 mg/kg cada 2 (n=279) o 3 semanas (n=277) o ipilimumab 3 mg/kg cada 3 semanas (n=278). No se requirió que los pacientes con melanoma con mutación de BRAF V600E hubieran recibido tratamiento previo con un inhibidor de BRAF.
Los pacientes fueron tratados con pembrolizumab hasta progresión de la enfermedad o toxicidad inaceptable. A los pacientes clínicamente estables con evidencia inicial de progresión de la enfermedad se les permitió permanecer en tratamiento hasta que se confirmó la progresión de la enfermedad. Se realizó la evaluación del estado tumoral a las 12 semanas y luego cada 6 semanas hasta la semana 48, seguido posteriormente por la evaluación cada 12 semanas.
De los 834 pacientes, el 60% eran varones, el 44% eran > 65 años (la mediana de edad era de 62 años [rango, 18-89]) y el 98% eran de raza blanca. El 65% de los pacientes tenían estadio M1c, el 9% tenían antecedentes de metástasis cerebral, el 66% no habían recibido tratamiento sistémico previo y el 34% habían recibido un tratamiento previo. El 31% tenían estado funcional ECOG de 1, el 69% tenían estado funcional ECOG de 0 y el 32% tenían LDH elevada. Se notificaron mutaciones de BRAF en 302 (36%) pacientes. Entre los pacientes con tumores con mutación de BRAF, 139 (46%) habían sido tratados previamente con un inhibidor de BRAF.
Las medidas principales de resultados de eficacia fueron la supervivencia libre de progresión (SLP; evaluada mediante una revisión por Evaluación Radiológica y Oncológica Integrada [ROI] usando los Criterios de Evaluación de la Respuesta en Tumores Sólidos [RECIST], versión 1.1) y la supervivencia global (SG). Las medidas secundarias de resultados de eficacia fueron la tasa de respuesta global (TRG) y la duración de la respuesta. La Tabla 3 resume las medidas principales de eficacia en pacientes naive al tratamiento con ipilimumab y en las Figuras 1 y 2 se muestran las curvas de Kaplan-Meier para la SG y la SLP.
|
Criterio de valoración |
Pembrolizumab |
Pembrolizumab |
Ipilimumab |
|
10 mg/kg cada |
10 mg/kg cada |
3 mg/kg cada | |
|
3 semanas |
2 semanas |
3 semanas | |
|
n=277 |
n=279 |
n=278 | |
|
SG | |||
|
Número (%) de pacientes con evento |
92 (33%) |
85 (30%) |
112 (40%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,69 (0,52, 0,90) |
0,63 (0,47, 0,83) |
--- |
|
Valor de pt |
0,00358 |
0,00052 |
--- |
|
Mediana en meses (IC del 95%) |
No alcanzada |
No alcanzada |
No alcanzada |
|
(ND, ND) |
(ND, ND) |
(13, ND) | |
|
SLP | |||
|
Número (%) de pacientes con evento |
157 (57%) |
157 (56%) |
188 (68%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,58 (0,47, 0,72) |
0,58 (0,46, 0,72) |
--- |
|
Valor de pt |
<0,00001 |
<0,00001 |
--- |
|
Mediana en meses (IC del 95%) |
4,1 (2,9, 6,9) |
5,5 (3,4, 6,9) |
2,8 (2,8, 2,9) |
|
Mejor respuesta global | |||
|
% de TRG (IC del 95%) |
33% (27, 39) |
34% (28, 40) |
12% (8, 16) |
|
% de respuesta completa |
6% |
5% |
1% |
|
% de respuesta parcial |
27% |
29% |
10% |
|
Duración de la respuestat | |||
|
Mediana en meses (rango) |
No alcanzada |
8,3 |
No alcanzada |
|
(1,4+, 8,1+) |
(1,4+, 8,3) |
(1,1+, 7,9+) | |
|
% que continúan |
97% |
89% |
88% |
*
t
t
ND
Cociente de riesgo (Hazard Ratio) (pembrolizumab en comparación con ipilimumab) de acuerdo al modelo de riesgos
proporcionales de Cox estratificado
Basado en la prueba de orden logarítmico estratificada
Basado en pacientes con una mejor respuesta como respuesta completa o parcial confirmadas = no disponible
Figura 1: Curva de Kaplan-Meier para la supervivencia global por grupo de tratamiento en el ensayo KEYNOTE-006 (población con intención de tratar)
90 -se 70 -60 -
50 -
40 -
Grupo de tratamiento
Tasa de SG
va :r
a os 12 meses
3C
20 -
<IC del 95S)
de p
Pembrolizumab 10 mg/kg
cada 2 semanas
Pembrolizumab 10 mg/ka
0,63
0.00052
10.4?. 0.83)
(0.52. 0.90
cada 3 semanas
Ipihmumab
I.........I.........r
6 8 10
Tiempo en meses
Numero con riesgo
Pembrolizumab 10 mg/kg cada 2 semanas
Pembrolizumab 10 mg/kg cada 3 semanas pihmumab
Figura 2: Curva de Kaplan-Meier para la supervivencia libre de progresión por grupo de tratamiento en el ensayo KEYNOTE-006 (población con intención de tratar)
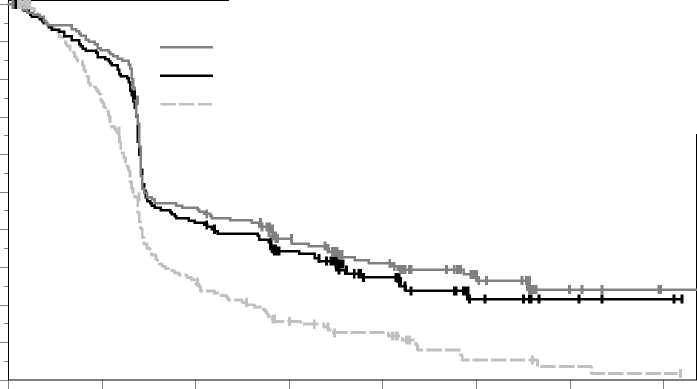
KEYNOTE-002: Ensayo controlado en _pacientes con melanoma tratados _previamente con ipilimumab La seguridad y eficacia de pembrolizumab se investigó en el ensayo KEYNOTE-002, un ensayo multicéntrico, controlado, para el tratamiento del melanoma avanzado en pacientes tratados previamente con ipilimumab y si eran positivos para la mutación de BRAF V600, con un inhibidor de BRAF o de MEK. Los pacientes fueron aleatorizados (1:1:1) a recibir pembrolizumab a una dosis de 2 (n=180) o 10 mg/kg (n=181) cada 3 semanas o quimioterapia (n=179; incluidas dacarbazina, temozolomida, carboplatino, paclitaxel o carboplatino+paclitaxel). El ensayo excluyó a pacientes con enfermedad autoinmune o a aquellos que recibían inmunosupresores; criterios adicionales de exclusión fueron antecedentes de reacciones adversas relacionadas con el sistema inmunitario graves o potencialmente mortales con el tratamiento con ipilimumab, definidas como cualquier toxicidad de Grado 4 o de Grado 3 que requería tratamiento con corticosteroides (dosis >10 mg/día de prednisona o equivalente) durante más de 12 semanas; reacciones adversas en curso de Grado > 2 por tratamientos previos con ipilimumab; hipersensibilidad grave previa a otros anticuerpos monoclonales; antecedentes de neumonitis o enfermedad pulmonar intersticial; infección por VIH, hepatitis B o hepatitis C y estado funcional ECOG > 2.
Los pacientes fueron tratados con pembrolizumab hasta progresión de la enfermedad o toxicidad inaceptable. A los pacientes clínicamente estables con evidencia inicial de progresión de la enfermedad se les permitió permanecer en tratamiento hasta que se confirmó la progresión de la enfermedad. Se realizó la evaluación del estado tumoral a las 12 semanas y luego cada 6 semanas hasta la semana 48, seguida posteriormente por la evaluación cada 12 semanas. Los pacientes en quimioterapia que experimentaron progresión de la enfermedad, verificada independientemente después de la primera evaluación programada de la enfermedad, pudieron cambiar y recibir 2 mg/kg o 10 mg/kg de pembrolizumab cada 3 semanas, en un modelo a doble ciego.
De los 540 pacientes, el 61% eran varones, el 43% eran > 65 años (la mediana de edad era de 62 años [rango, 15-89]) y el 98% eran de raza blanca. El 82% tenían estadio M1c, el 73% habían recibido al menos dos tratamientos sistémicos previos para el melanoma avanzado y el 32% de los pacientes habían recibido tres o más. El 45% tenían estado funcional ECOG de 1, el 40% tenían LDH elevada y el 23% tenían un tumor con mutación de BRAF.
Las medidas principales de resultados de eficacia fueron la SLP evaluada mediante ROI usando los criterios RECIST versión 1.1 y la SG. Las medidas secundarias de resultados de eficacia fueron la TRG y la duración de la respuesta. La Tabla 4 resume las medidas principales de eficacia en pacientes tratados previamente con ipilimumab y en la Figura 3 se muestra la curva de Kaplan-Meier para la SLP. Los dos grupos de tratamiento con pembrolizumab fueron superiores a la quimioterapia para la SLP, y no hubo diferencias entre las dosis de pembrolizumab. Los datos de SG no estaban maduros en el momento del análisis de la SLP. No hubo diferencia estadísticamente significativa entre pembrolizumab y la quimioterapia en el análisis preliminar de la SG, que no se ajustó en cuanto a los posibles efectos de confusión debidos al cambio de tratamiento. De los pacientes aleatorizados al grupo de quimioterapia, el 48% cambiaron de tratamiento y, posteriormente, recibieron tratamiento con pembrolizumab.
|
Criterio de valoración |
Pembrolizumab 2 mg/kg cada 3 semanas n=180 |
Pembrolizumab 10 mg/kg cada 3 semanas n=181 |
Quimioterapia n=179 |
|
SLP | |||
|
Número (%) de pacientes con evento |
129 (72%) |
126 (70%) |
155 (87%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,57 (0,45, 0,73) |
0,50 (0,39, 0,64) |
--- |
|
Valor de p^ |
<0,0001 |
<0,0001 |
--- |
|
Mediana en meses (IC del 95%) |
2,9 (2,8, 3,8) |
2,9 (2,8, 4,7) |
2,7 (2,5, 2,8) |
|
SG | |||
|
Número (%) de pacientes con evento |
73 (41%) |
69 (38%) |
78 (44%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,88 (0,64, 1,22) |
0,78 (0,56, 1,08) |
--- |
|
Valor de p^ |
0,2294 |
0,0664 |
--- |
|
Mejor respuesta global | |||
|
% de TRG (IC del 95%) |
21% (15, 28) |
25% (19, 32) |
4% (2, 9) |
|
% de respuesta completa |
2% |
3% |
0% |
|
% de respuesta parcial |
19% |
23% |
4% |
|
Duración de la respuesta | |||
|
Mediana en meses (rango) |
No alcanzada (1,4+, 11,5+) |
No alcanzada (1,2+, 11,1+) |
8,5 (1,6+, 9,5) |
|
% que continúan |
87% |
80% |
63% |
* Cociente de riesgo (Hazard Ratio) (pembrolizumab en comparación con quimioterapia) de acuerdo al modelo de riesgos proporcionales de Cox estratificado t Basado en la prueba de orden logarítmico estratificada
Figura 3: Curva de Kaplan-Meier para la supervivencia libre de progresión por grupo de tratamiento en el ensayo KEYNOTE-002 (población con intención de tratar)
100
90
80
70
o>
o
60
<D
T3
50
■Q
40
30
20
|
Grupo de tratamiento Tasa de SLP a los 6 meses |
Tasa de SLP a los 9 meses |
CR (IC del 95%) |
Valor de p | |
|
Pembrolizumab 10 mg/kg |
38% |
29% |
0,50 |
<0,0001 |
|
cada 3 semanas |
(0,39, 0,64) | |||
|
Pembrolizumab 2 mg/kg |
34% |
24% |
0,57 |
<0,0001 |
|
cada 3 semanas |
(0,45, 0,73) | |||
|
Quimioterapia |
16% |
8% | ||
10
0
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 | |
|
Número con riesgo |
Tiempo en meses | |||||||
|
Pembrolizumab 10 mg/kg: |
181 |
158 |
82 |
55 |
39 |
15 |
5 |
1 |
|
Pembrolizumab 2 mg/kg: |
180 |
153 |
74 |
53 |
26 |
9 |
4 |
2 |
|
Quimioterapia: |
179 |
128 |
43 |
22 |
15 |
4 |
2 |
1 |
KEYNOTE-001: Ensayo no controlado en pacientes con melanoma na'ive al tratamiento con ipilimumab y previamente tratados con ipilimumab
La seguridad y eficacia de pembrolizumab se investigó en pacientes con melanoma avanzado en un ensayo no controlado, abierto, KEYNOTE-001. Se evaluó la eficacia en 276 pacientes de dos cohortes definidas, una que incluyó a pacientes tratados previamente con ipilimumab (y, si eran positivos para la mutación de BRAF V600, con un inhibidor de BRAF o de MEK) y, la otra, que incluyó a pacientes naíve al tratamiento con ipilimumab. Los pacientes fueron asignados aleatoriamente a recibir pembrolizumab a una dosis de 2 mg/kg cada 3 semanas o 10 mg/kg cada 3 semanas. Los pacientes fueron tratados con pembrolizumab hasta progresión de la enfermedad o toxicidad inaceptable. A los pacientes clínicamente estables con evidencia inicial de progresión de la enfermedad se les permitió permanecer en tratamiento hasta que se confirmó la progresión de la enfermedad. Los criterios de exclusión fueron similares a los del ensayo KEYNOTE-002.
De los 89 pacientes que recibieron 2 mg/kg de pembrolizumab que fueron tratados previamente con ipilimumab, el 53% eran varones, el 33% eran > 65 años de edad y la mediana de edad era de 59 años (rango, 18-88). Todos, excepto dos pacientes, eran de raza blanca. El 84% tenían estadio M1c y el 8% de los pacientes tenían antecedentes de metástasis cerebral. El 70% habían recibido al menos dos tratamientos sistémicos previos para el melanoma avanzado y el 35% de los pacientes habían recibido tres o más. Se notificaron mutaciones de BRAF en el 13% de la población del ensayo. Todos los pacientes con tumores con mutación de BRAF fueron tratados previamente con un inhibidor de BRAF.
De los 51 pacientes que recibieron 2 mg/kg de pembrolizumab que eran naíve al tratamiento con ipilimumab, el 63% eran varones, el 35% tenían > 65 años de edad y la mediana de edad era de 60 años (rango, 35-80). Todos, excepto uno de los pacientes, eran de raza blanca. El 63% tenían estadio M1c y el 2% de los pacientes tenían antecedentes de metástasis cerebral. El 45% no habían recibido tratamientos previos para el melanoma avanzado. Se notificaron mutaciones de BRAF en 20 (39%) pacientes. Entre los pacientes con tumores con mutación de BRAF, 10 (50%) fueron tratados previamente con un inhibidor de BRAF.
La medida principal de resultado de eficacia fue la TRG evaluada mediante una revisión independiente usando los criterios RECIST 1.1. Las medidas de resultados secundarias de eficacia fueron la tasa de control de la enfermedad (TCE; incluyendo la respuesta completa, la respuesta parcial y la enfermedad estable), la duración de la respuesta, la SLP y la SG. La respuesta tumoral se evaluó a intervalos de 12 semanas. La Tabla 5 resume las medidas principales de eficacia en pacientes tratados previamente o naíve al tratamiento con ipilimumab, que recibían pembrolizumab a la dosis recomendada.
|
Criterio de valoración |
Pembrolizumab 2 mg/kg cada 3 semanas en pacientes tratados previamente con ipilimumab n=89 |
Pembrolizumab 2 mg/kg cada 3 semanas en pacientes na'íve al tratamiento con ipilimumab n=51 |
|
Mejor respuesta global* por ROIt | ||
|
% de TRG (IC del 95%) |
25% (16, 35) |
33% (21, 48) |
|
Respuesta completa |
3% |
10% |
|
Respuesta parcial |
21% |
24% |
|
% de tasa de control de la enfermedad* |
49% |
49% |
|
Duración de la respuesta § | ||
|
Mediana en meses (rango) |
No alcanzada (2,8+, 14,3+) |
No alcanzada (1,6+, 13,8+) |
|
% que continúan |
86%1 |
82%# |
|
SLP | ||
|
Mediana en meses (IC del 95%) |
4,9 (2,8, 8,3) |
5,5 (2,8, 14,0) |
|
Tasa de SLP a los 6 meses |
43% |
50% |
|
SG | ||
|
Mediana en meses (IC del 95%) |
No alcanzada (11, no disponible) |
No alcanzada (14, no disponible) |
|
Tasa de SG a los 12 meses |
60% |
72% |
t
t
§
Incluye pacientes sin enfermedad medible en el estado basal mediante revisión radiológica independiente ROI = Evaluación radiológica y oncológica integrada usando los criterios RECIST 1.1 Basado en la mejor respuesta de enfermedad estable o mejor
Basado en los pacientes con una respuesta confirmada mediante revisión independiente, comenzando desde la fecha en la que se registró por primera vez la respuesta; n=22 para pacientes tratados previamente con ipilimumab; n=17 para pacientes naive al tratamiento con ipilimumab
Los pacientes respondedores fueron seguidos durante un mínimo de 12 meses después del inicio del tratamiento Los pacientes respondedores fueron seguidos durante un mínimo de 15 meses después del inicio del tratamiento
i
#
Los resultados de los pacientes tratados previamente con ipilimumab (n=84) y naive al tratamiento con ipilimumab (n=52), que recibieron 10 mg/kg de pembrolizumab cada 3 semanas, fueron similares a los observados en pacientes que recibieron 2 mg/kg de pembrolizumab cada 3 semanas.
Análisis de subpoblaciones
Estado de la mutación BRAF en melanoma
Se realizó un análisis de subgrupos del ensayo KEYNOTE-002 en pacientes que tenían BRAF sin mutación (n=415; 77%) o BRAF con mutación con tratamiento previo con un inhibidor de BRAF (n=125; 23%). Los cocientes de riesgo (Hazard Ratio) de la SLP (grupos de pembrolizumab en conjunto [2 mg/kg o 10 mg/kg cada 3 semanas] frente a quimioterapia) fueron 0,51 (IC del 95%: 0,41, 0,65) en BRAF sin mutación y 0,56 (IC del 95%: 0,37, 0,85) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Los CR de la SLP para pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron 0,51 (IC del 95%: 0,39, 0,67) en BRAF sin mutación y 0,74 (IC del 95%: 0,46, 1,18) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Los CR de la SG para los grupos de pembrolizumab en conjunto frente a quimioterapia fueron 0,83 (IC del 95%: 0,60, 1,15) en BRAF sin mutación y 0,82 (IC del 95%: 0,47, 1,43) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Los CR de la SG para pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron 0,80 (IC del 95%: 0,55, 1,18) en BRAF sin mutación y 1,03 (IC del 95%: 0,55, 1,91) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Las TRG en los grupos de pembrolizumab en conjunto y de pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron del 27% y del 25% frente al 6% en BRAF sin mutación y
del 12% y del 9% frente al 0% en BRAF con mutación con tratamiento previo con un inhibidor de BRAF.
Se realizó un análisis de subgrupos del ensayo KEYNOTE-006 en pacientes que tenían BRAF sin mutación (n=525; 63%), BRAF con mutación naive al tratamiento con un inhibidor de BRAF (n=163; 20%) y BRAF con mutación con tratamiento previo con un inhibidor de BRAF (n=139; 17%). Los CR de la SLP (grupos de pembrolizumab en conjunto [10 mg/kg cada 2 o 3 semanas] frente a ipilimumab) fueron 0,57 (IC del 95%: 0,45, 0,73) en BRAF sin mutación, 0,50 (IC del 95%: 0,32, 0,77) en BRAF con mutación naive al tratamiento con un inhibidor de BRAF y 0,73 (IC del 95%: 0,48, 1,11) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Los CR de la SG para los grupos de pembrolizumab en conjunto con un inhibidor de ipilimumab fueron 0,61 (IC del 95%: 0,46, 0,82) en BRAF sin mutación, 0,69 (IC del 95%: 0,33, 1,45) en BRAF con mutación naive al tratamiento con un inhibidor de BRAF y 0,75 (IC del 95%: 0,45, 1,26) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. La TRG de los grupos de pembrolizumab en conjunto frente a ipilimumab fue del 34% frente al 13% en BRAF sin mutación, del 41% frente al 13% en BRAF con mutación naive al tratamiento con un inhibidor de BRAF y del 21% frente al 6% en BRAF con mutación con tratamiento previo con un inhibidor de BRAF.
Estado de PD-L1 en melanoma
Se realizó un análisis de subgrupos del ensayo KEYNOTE-002 en pacientes que eran PD-L1 positivo (puntuación de proporción de Allred > 2, presentando una expresión de membrana de PD-L1 en > 1% de los tumores celulares) frente a PD-L1 negativo (puntuación de proporción de Allred de 0 o 1). La expresión de PD-L1 se estudió retrospectivamente mediante un test de investigación de inmunohistoquímica con el anticuerpo anti PD-L1 22C3. Entre los pacientes que eran evaluables en cuanto a expresión de PD-L1 (78%), el 69% (n=291) eran PD-L1 positivo y el 31% (n=130) eran PD-L1 negativo. Los CR de la SLP (grupos de pembrolizumab en conjunto [2 mg/kg o 10 mg/kg cada 3 semanas] frente a quimioterapia) fueron 0,52 (IC del 95%: 0,39, 0,68) en los pacientes PD-L1 positivo y 0,60 (IC del 95%: 0,38, 0,94) en los pacientes PD-L1 negativo. Los CR de la SLP para pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron 0,54 (IC del 95%: 0,39, 0,75) en los pacientes PD-L1 positivo y 0,89 (IC del 95%: 0,53, 1,50) en los pacientes PD-L1 negativo. Los CR de la SG en los grupos de pembrolizumab en conjunto frente a quimioterapia fueron 0,82 (IC del 95%: 0,55, 1,23) en pacientes PD-L1 positivo y 0,77 (IC del 95%: 0,43, 1,37) en pacientes PD-L1 negativo. Los CR de la SG para pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron 0,93 (IC del 95%: 0,58, 1,49) en los pacientes PD-L1 positivo y 1,19 (IC del 95%: 0,58, 2,46) en los pacientes PD-L1 negativo. Las TRG en los grupos de pembrolizumab en conjunto y de pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron del 26% y del 23% frente al 4% en pacientes PD-L1 positivo y del 15% y del 11% frente al 8% en pacientes PD-L1 negativo.
Se realizó un análisis de subgrupos del ensayo KEYNOTE-006 en pacientes que eran PD-L1 positivo (n=671; 80%) frente a PD-L1 negativo (n=150; 18%). Entre los pacientes que eran evaluables en cuanto a expresión de PD-L1 (98%), el 82% eran PD-L1 positivo y el 18% eran PD-L1 negativo. Los CR de la SLP (grupos de pembrolizumab en conjunto [10 mg/kg cada 2 o 3 semanas] frente a ipilimumab) fueron 0,53 (IC del 95%: 0,43, 0,65) en pacientes PD-L1 positivo y 0,73 (IC del 95%: 0,47, 1,11) en pacientes PD-L1 negativo. Los CR de la SG en los grupos de pembrolizumab en conjunto frente a ipilimumab fueron 0,56 (IC del 95%: 0,43, 0,73) en pacientes PD-L1 positivo y 0,95 (IC del 95%: 0,56, 1,62) en pacientes PD-L1 negativo. Las TRG en los grupos de pembrolizumab en conjunto frente a ipilimumab fueron del 37% frente al 12% en pacientes PD-L1 positivo y del 18% frente al 11% en pacientes PD-L1 negativo.
Melanoma ocular
En 20 sujetos con melanoma ocular incluidos en el ensayo KEYNOTE-001, no se notificaron respuestas objetivas; se comunicó enfermedad estable en 6 pacientes.
CPNM
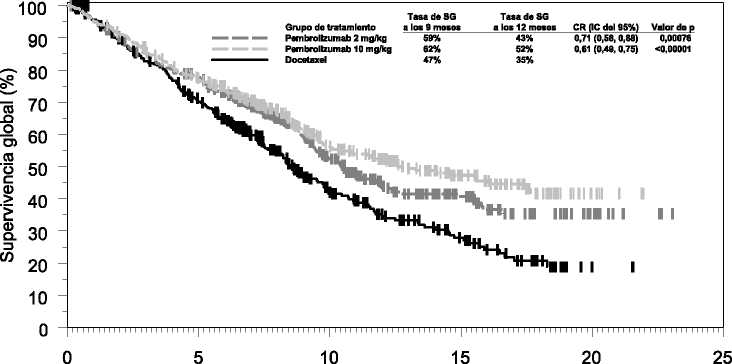
KEYNOTE-010: Ensayo controlado en pacientes con CPNM tratados previamente con quimioterapia La seguridad y la eficacia de pembrolizumab se investigó en el ensayo KEYNOTE-010, un ensayo multicéntrico, abierto, controlado, para el tratamiento del CPNM avanzado en pacientes tratados previamente con quimioterapia que incluyera platino. Los pacientes tenían expresión positiva de PD-L1 (puntuación de proporción tumoral >1% de acuerdo al Kit de inmuno histoquímica (IHQ) de PD-L1 22C3 pharmDx™). Los pacientes con activación de las mutaciones de EGFR o translocación de ALK también tuvieron progresión de la enfermedad con el tratamiento aprobado para estas mutaciones antes de recibir pembrolizumab. Los pacientes fueron asignados aleatoriamente (1:1:1) a recibir pembrolizumab a una dosis de 2 mg (n=344) o 10 mg/kg (n=346) cada 3 semanas o docetaxel a una dosis de 75 mg/m2 cada 3 semanas (n=343) hasta progresión de la enfermedad o toxicidad inaceptable. El ensayo excluyó a los pacientes con enfermedad autoinmune; un problema médico que precisara inmunosupresión; o que hubieran recibido más de 30 Gy de radiación torácica dentro de las 26 semanas previas. Se realizó evaluación del estado tumoral cada 9 semanas.
Las características basales para esta población incluyeron: mediana de edad de 63 años (42% de 65 años o más); 61% varones; 72% de raza blanca y 21% asiáticos y 34% y 66% con un estado funcional ECOG de 0 y 1, respectivamente. Las características de la enfermedad fueron escamosa (21%) y no escamosa (70%); M1 (91%); metástasis cerebrales estables (15%) y la incidencia de mutaciones fue de EGFR (8%) o de ALK (1%). El tratamiento previo incluyó un régimen en doblete con platino (100%); los pacientes recibieron una (69%) o dos o más (29%) líneas de tratamiento.
Las medidas principales de resultados de eficacia fueron la SG y la SLP evaluadas mediante una Revisión Central Independiente Enmascarada (RCIE) usando los criterios RECIST 1.1. Las medidas secundarias de resultados de eficacia fueron la TRG y la duración de la respuesta. La Tabla 6 resume las medidas principales de eficacia para toda la población (puntuación de proporción tumoral >1%) y para los pacientes con puntuación de proporción tumoral > 50% y en la Figura 4 se muestra la curva de Kaplan-Meier para la SG (puntuación de proporción tumoral >1%).
|
Criterio de valoración principal |
Pembrolizumab 2 mg/kg cada 3 semanas |
Pembrolizumab 10 mg/kg cada 3 semanas |
Docetaxel 75 mg/m2 cada 3 semanas |
|
Puntuación de proporción tumoral > 1% | |||
|
Número de pacientes |
344 |
346 |
343 |
|
SG | |||
|
Número (%) de los pacientes con evento |
172 (50%) |
156 (45%) |
193 (56%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,71 (0,58, 0,88) |
0,61 (0,49, 0,75) |
--- |
|
Valor de p* |
<0,001* |
<0,001* |
--- |
|
Mediana en meses (IC del 95%) |
10,4 (9,4, 11,9) |
12,7 (10,0, 17,3) |
8,5 (7,5, 9,8) |
|
SLP5 | |||
|
Número (%) de pacientes con evento |
266 (77%) |
255 (74%) |
257 (75%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,88 (0,73, 1,04) |
0,79 (0,66, 0,94) |
--- |
|
Valor de p* |
0,068 |
0,005 |
--- |
|
Mediana en meses (IC del 95%) |
3,9 (3,1, 4,1) |
4,0 (2,6, 4,3) |
4,0 (3,1, 4,2) |
|
Tasa de respuesta global5 | |||
|
% de TRG1 (IC del 95%) |
18% (14, 23) |
18% (15, 23) |
9% (7, 13) |
|
Duración de la respuesta5#’^ | |||
|
Mediana en meses (rango) |
No alcanzada (0,7+, 20,1+) |
No alcanzada (2,1+, 17,8+) |
6,2 (1,4+, 8,8+) |
|
% que continúan |
73% |
72% |
34% |
|
Puntuación de proporción tumoral > 50% | |||
|
Número de pacientes |
139 |
151 |
152 |
|
SG | |||
|
Número (%) de los pacientes con evento |
58 (42%) |
60 (40%) |
86 (57%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,54 (0,38, 0,77) |
0,50 (0,36, 0,70) |
--- |
|
Valor de p* |
<0,001* |
<0,001* |
--- |
|
Mediana en meses (IC del 95%) |
14,9 (10,4, ND) |
17,3 (11,8, ND) |
8,2 (6,4, 10,7) |
|
SLP5 | |||
|
Número (%) de pacientes con evento |
89 (64%) |
97 (64%) |
118 (78%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,58 (0,43, 0,77) |
0,59 (0,45, 0,78) |
--- |
|
Valor de p* |
<0,001* |
<0,001* |
--- |
|
Mediana en meses (IC del 95%) |
5,2 (4,0, 6,5) |
5,2 (4,1, 8,1) |
4,1 (3,6, 4,3) |
|
Tasa de respuesta global5 | |||
|
% de TRG1 (IC del 95%) |
30% (23, 39) |
29% (22, 37) |
8% (4, 13) |
|
Duración de la respuesta5’#’1* | |||
|
Mediana en meses (rango) |
No alcanzada (0,7+, 16,8+) |
No alcanzada (2,1+, 17,8+) |
8,1 (2,1+, 8,8+) |
|
% que continúa |
76% |
75% |
33% |
Cociente de riesgo (Hazard Ratio) (pembrolizumab en comparación con docetaxel) de acuerdo al modelo de riesgos proporcionales de Cox estratificado
^ Basado en la prueba de orden logarítmico estratificada
* Estadísticamente significativo de acuerdo a un nivel de a preespecificado ajustado por multiplicidad
§ Evaluado mediante revisión central independiente enmascarada (RCIE) usando los criterios RECIST 1.1
^ Todas las respuestas fueron respuestas parciales
# Basado en los pacientes con una mejor respuesta global de respuesta completa o parcial confirmadas
B Incluye 30, 31 y 2 pacientes con respuestas que se mantienen de 6 meses o más en los grupos de pembrolizumab 2 mg/kg, pembrolizumab 10 mg/kg y docetaxel, respectivamente
B Incluye 22, 24 y 1 pacientes con respuestas que se mantienen de 6 meses o más en los grupos de pembrolizumab 2 mg/kg, pembrolizumab 10 mg/kg y docetaxel, respectivamente
Figura 4: Curva de Kaplan-Meier de la supervivencia global por grupo de tratamiento en el ensayo KEYNOTE-010 (pacientes con puntuación > 1% de proporción tumoral de expresión de
PD-L1, población de intención de tratar)
344
Tiempo en meses
259 115 49
255 124 56
212 79 33
12
6
1
Número en riesgo Pembrolizumab 2 mg/kg:
Pembrolizumab 10 mg/kg: 346
343
Docetaxel:
Los resultados de eficacia fueron similares en los grupos de 2 mg/kg y 10 mg/kg de pembrolizumab. Los resultados de eficacia en la SG fueron coherentes independientemente de la antigüedad de la muestra tumoral (muestra nueva frente a muestra de archivo) de acuerdo a una comparación entre grupos.
En el análisis de subgrupo, se observó un beneficio reducido de la supervivencia con pembrolizumab comparado con docetaxel, en pacientes que nunca fueron fumadores o en pacientes con tumores que albergaban la activación de mutaciones de EGFR, que recibieron al menos quimioterapia basada en platino y un inhibidor de tirosina kinasa; sin embargo, debido al bajo número de pacientes, no se pueden extraer conclusiones definitivas de estos datos.
No se ha establecido la eficacia y seguridad de pembrolizumab en pacientes con tumores que no expresen PD-L1.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con pembrolizumab en uno o más grupos de la población
5.2 Propiedades farmacocinéticas
Se estudió la farmacocinética de pembrolizumab en 2.856 pacientes con melanoma metastásico o irresecable, CPNM o carcinoma que recibieron dosis en el rango de 1 a 10 mg/kg cada 2 o 3 semanas.
Absorción
Pembrolizumab se administra por vía intravenosa y, por lo tanto, tiene una biodisponibilidad inmediata y completa.
Distribución
De forma coherente con una distribución extravascular limitada, el volumen de distribución de pembrolizumab en el estado estacionario es pequeño (~7,4 l; CV: 19%). Como se esperaba de un anticuerpo, pembrolizumab no se une a las proteínas plasmáticas de una forma específica.
Biotransformación
Pembrolizumab se cataboliza mediante vías inespecíficas; el metabolismo no contribuye a su eliminación.
Eliminación
El aclaramiento sistémico de pembrolizumab es de ~0,2 l/día (CV: 37%) y la semivida terminal (f/2) es de ~27 días (CV: 38%).
Linealidad/No linealidad
La exposición a pembrolizumab expresada mediante concentración máxima (Cmax) o área bajo la curva de tiempo-concentración plasmática (AUC) aumentó de forma proporcional a la dosis dentro del rango de dosis para la eficacia. Con la administración repetida, se observó que el aclaramiento de pembrolizumab era independiente del tiempo y la acumulación sistémica fue aproximadamente
2.2 veces mayor cuando se administró cada 3 semanas. Las concentraciones de pembrolizumab cerca del estado estacionario se alcanzaron a las 18 semanas; la mediana de Cmín a las 18 semanas fue aproximadamente de 24 mcg/ml, a una dosis de 2 mg/kg cada 3 semanas.
Poblaciones especiales
Se evaluaron los efectos de diversas covariables sobre la farmacocinética de pembrolizumab mediante análisis de farmacocinética de poblaciones. El aclaramiento de pembrolizumab aumentó con el aumento del peso corporal; las diferencias resultantes en la exposición se abordan adecuadamente mediante la administración sobre una base de mg/kg. Los siguientes factores no tuvieron un efecto clínicamente importante sobre el aclaramiento de pembrolizumab: edad (rango, 15-94 años), sexo, raza, insuficiencia renal leve o moderada, insuficiencia hepática leve y carga tumoral.
Insuficiencia renal
Se evaluó el efecto de la insuficiencia renal sobre el aclaramiento de pembrolizumab mediante análisis de farmacocinética de poblaciones en pacientes con insuficiencia renal leve o moderada en comparación con pacientes con función renal normal. No se observaron diferencias clínicamente importantes en el aclaramiento de pembrolizumab entre los pacientes con insuficiencia renal leve o moderada y los pacientes con función renal normal. No se ha estudiado pembrolizumab en pacientes con insuficiencia renal grave.
Insuficiencia hepática
Se evaluó el efecto de la insuficiencia hepática sobre el aclaramiento de pembrolizumab mediante análisis de farmacocinética de poblaciones en pacientes con insuficiencia hepática leve (definida usando los criterios de disfunción hepática del National Cancer Institute de EE.UU.) en comparación con los pacientes con función hepática normal. No se observaron diferencias clínicamente importantes
en el aclaramiento de pembrolizumab entre los pacientes con insuficiencia hepática leve y los pacientes con función hepática normal. No se ha estudiado pembrolizumab en pacientes con insuficiencia hepática moderada o grave (ver sección 4.2).
5.3 Datos preclínicos sobre seguridad
Se evaluó la seguridad de pembrolizumab en un estudio de toxicidad a dosis repetidas de 1 mes y otro de 6 meses en monos Cynomolgus que recibieron dosis intravenosas de 6, 40 o 200 mg/kg una vez a la semana en el estudio de 1 mes y una vez cada dos semanas en el estudio de 6 meses, seguido por un periodo de 4 meses sin tratamiento. No se observaron hallazgos de importancia toxicológica y el nivel sin efecto adverso observado (NOAEL) en ambos estudios fue > 200 mg/kg, que es 19 veces la exposición en seres humanos a la dosis más alta estudiada clínicamente (10 mg/kg).
No se han realizado estudios de reproducción animal con pembrolizumab. La vía PD-1/PD-L1 se piensa que está involucrada en mantener la tolerancia al feto durante el embarazo. Se ha demostrado que el bloqueo de la señalización PD-L1 en modelos murinos de embarazo altera la tolerancia al feto y conduce a un aumento de pérdidas fetales.
No se han llevado a cabo estudios de fertilidad en animales con pembrolizumab. En estudios de toxicología a dosis repetidas de 1 mes y 6 meses, no hubo efectos notables en los órganos reproductores masculinos y femeninos; sin embargo, muchos animales de estos estudios no eran sexualmente maduros.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
L-histidina
Hidrocloruro de L-histidina monohidrato
Sacarosa
Polisorbato 80
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
Vial no abierto 2 años
Después de la reconstitución
Se ha demostrado la estabilidad química y física en uso de la solución reconstituida y diluida durante 24 horas a temperatura ambiente (a o por debajo de 25°C). Desde un punto de vista microbiológico, el producto se debe utilizar inmediatamente. No se debe congelar la solución reconstituida o diluida. Si no se usa inmediatamente, los tiempos y las condiciones de conservación en uso antes de utilizarlo son responsabilidad del usuario y no deben ser superiores a un total de 24 horas. Este periodo de 24 horas puede incluir hasta 6 horas a temperatura ambiente (a o por debajo de 25°C); en cualquier tiempo de espera restante, la temperatura debe ser de entre 2°C y 8°C. Si se refrigera, se debe dejar que los viales y/o las bolsas intravenosas alcancen la temperatura ambiente antes de su uso.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
Para las condiciones de conservación tras la reconstitución o dilución del medicamento, ver
sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de vidrio de tipo I de 15 ml con un tapón de bromobutilo de color gris y una cápsula de aluminio
con una tapa desprendible de color aguacate, que contiene 50 mg de pembrolizumab.
Cada caja contiene un vial.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Preparación y administración
• Antes de la reconstitución, el vial de polvo liofilizado puede estar fuera de la nevera (temperaturas a o por debajo de 25°C) hasta 24 horas.
• Añadir asépticamente 2,3 ml de agua para preparaciones inyectables para obtener una solución de 25 mg/ml (pH 5,2-5,8) de KEYTRUDA. Cada vial contiene un exceso de llenado de 10 mg (0,4 ml) para asegurar la recuperación de 50 mg de KEYTRUDA por vial. Después de la reconstitución, 1 ml de concentrado contiene 25 mg de pembrolizumab.
• Para evitar la formación de espuma, verter el agua por las paredes del vial y no directamente sobre el polvo liofilizado.
• Girar lentamente el vial para permitir la reconstitución del polvo liofilizado. Dejar que pasen hasta 5 minutos para que se eliminen las burbujas. No agitar el vial.
• Los medicamentos parenterales se deben inspeccionar visualmente por si tienen partículas extrañas y cambio de color antes de la administración. KEYTRUDA reconstituido es una solución transparente a ligeramente opalescente, incolora a ligeramente amarilla. Desechar el vial si se observan partículas visibles.
• Extraer el volumen necesario hasta 2 ml (50 mg) de KEYTRUDA y transferirlo a una bolsa para administración intravenosa que contenga 9 mg/ml de cloruro sódico (0,9%) o 50 mg/ml de glucosa (5%), para preparar una solución diluida con una concentración final que vaya de 1a 10 mg/ml. Mezclar la solución diluida mediante inversión suave.
• Se ha demostrado la estabilidad química y física en uso de la solución reconstituida y diluida durante 24 horas a temperatura ambiente (a o por debajo de 25°C). Desde un punto de vista microbiológico, el producto se debe usar inmediatamente. No se debe congelar la solución reconstituida o diluida. Si no se usa inmediatamente, los tiempos y condiciones de conservación en uso antes de utilizarlo son responsabilidad del usuario y no deben ser superiores a un total de 24 horas. Este periodo de 24 horas puede incluir hasta 6 horas a temperatura ambiente (a o por debajo de 25°C); en cualquier tiempo de espera restante, la temperatura debe ser de entre 2°C y 8°C. Si se refrigera, se debe dejar que los viales y/o las bolsas intravenosas alcancen la temperatura ambiente antes de su uso. Administrar la solución de perfusión por vía intravenosa durante 30 minutos, usando un filtro de 0,2 a 5 ^m, estéril, no pirógeno, de baja unión a proteínas, conectado en línea o añadido.
• No administrar junto con otros medicamentos a través de la misma vía de perfusión.
• KEYTRUDA es para un solo uso. Desechar cualquier parte no utilizada que quede en el vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto
con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited
Hertford Road
Hoddesdon
Hertfordshire EN11 9BU
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1024/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 17/julio/2015
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
KEYTRUDA 25 mg/ml concentrado para solución para perfusión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un vial de 4 ml de concentrado contiene 100 mg de pembrolizumab.
Cada ml de concentrado contiene 25 mg de pembrolizumab.
Pembrolizumab es un anticuerpo monoclonal humanizado (IgG4/isotipo kappa con una alteración de la secuencia estabilizadora en la región Fc) frente a la muerte celular programada-1 (PD-1), producido en células de ovario de hámster chino mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Concentrado para solución para perfusión.
Solución transparente a ligeramente opalescente, incolora a ligeramente amarilla, con pH entre
5,2 y 5,8.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
KEYTRUDA en monoterapia está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos.
KEYTRUDA está indicado para el tratamiento del cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico en adultos cuyos tumores expresen PD-L1 y que hayan recibido al menos un tratamiento de quimioterapia previo. Los pacientes con mutaciones positivas de EGFR o ALK también deben haber recibido tratamiento aprobado para estas mutaciones antes de recibir KEYTRUDA.
4.2 Posología y forma de administración
El tratamiento se debe iniciar y supervisar por médicos especialistas con experiencia en el tratamiento del cáncer.
Pruebas de PD-L1 en pacientes con CPNM
Se debe seleccionar a los pacientes con CPNM para el tratamiento, de acuerdo a la expresión tumoral de PD-L1 confirmada mediante una prueba validada (ver sección 5.1).
Posología
La dosis recomendada de KEYTRUDA es de 2 mg/kg administrados por vía intravenosa durante 30 minutos cada 3 semanas. Los pacientes deben recibir tratamiento con KEYTRUDA hasta progresión de la enfermedad o toxicidad inaceptable. Se han observado respuestas atípicas (por ej., un aumento transitorio inicial del tamaño tumoral o nuevas lesiones pequeñas dentro de los primeros meses, seguido por una reducción del tamaño del tumor). Se recomienda continuar el tratamiento en pacientes clínicamente estables con evidencia inicial de progresión de la enfermedad hasta que se confirme la progresión de la enfermedad.
Suspensión temporal de la dosis o suspensión definitiva del tratamiento (ver también sección 4.4)
Tabla 1: Modificaciones del tratamiento recomendadas para KEYTRUDA
|
Reacciones adversas relacionadas con el sistema inmunitario |
Gravedad |
Modificación del tratamiento |
|
Neumonitis |
Grado 2 |
Suspender temporalmente* |
|
Grado 3 o 4 o recurrente de Grado 2 |
Suspender definitivamente | |
|
Colitis |
Grado 2 o 3 |
Suspender temporalmente* |
|
Grado 4 |
Suspender definitivamente | |
|
Nefritis |
Grado 2 con creatinina >1,5 a 3 veces el límite superior de la normalidad (LSN) |
Suspender temporalmente* |
|
Grado > 3 con creatinina > 3 veces el LSN |
Suspender definitivamente | |
|
Endocrinopatías |
Hipofisitis sintomática Diabetes tipo 1 asociada a hiperglucemia de Grado > 3 (glucosa >250 mg/dl o > 13,9 mmol/l) o asociada a cetoacidosis Hipertiroidismo de Grado > 3 |
Suspender temporalmente* Se puede valorar la continuación del tratamiento con pembrolizumab después de la reducción progresiva de los corticosteroides, si es necesario, en pacientes con endocrinopatía de Grado 3 o Grado 4 que mejora a Grado 2 o menor y se controla con terapia hormonal sustitutiva, si está indicado. En caso contrario, el tratamiento se debe suspender definitivamente. El hipotiroidismo se puede controlar con terapia hormonal sustitutiva sin interrumpir el tratamiento. |
|
Hepatitis |
Grado 2 con la aspartato aminotransferasa (AST) o la alanina aminotransferasa (ALT) >3 a 5 veces el LSN o la bilirrubina total >1,5 a 3 veces el LSN |
Suspender temporalmente* |
|
Grado > 3 con la AST o la ALT > 5 veces el LSN o la bilirrubina total > 3 veces el LSN |
Suspender definitivamente | |
|
En caso de metástasis hepática en estado basal con elevación de Grado 2 de la AST o la ALT, hepatitis con la AST o la ALT elevadas > 50% y ésta dura > 1 semana |
Suspender definitivamente | |
|
Reacciones adversas asociadas a la perfusión |
Grado 3 o 4 |
Suspender definitivamente |
Nota: los grados de toxicidad son coherentes con los Criterios de Terminología Comunes para Acontecimientos Adversos del National Cancer Institute versión 4 (CTCAE del NCI v.4).
hasta que las reacciones adversas se recuperen a Grado 0-1.
KEYTRUDA se debe suspender definitivamente:
• Por toxicidad de Grado 4 excepto por endocrinopatías que están controladas con terapia hormonal sustitutiva
• Si no se puede reducir la dosis de corticosteroide a <10 mg de prednisona o equivalente al día en el plazo de 12 semanas
• Si una toxicidad relacionada con el tratamiento no se recupera a Grado 0-1 en el plazo de 12 semanas después de la última dosis de KEYTRUDA
• Si se produce por segunda vez cualquier acontecimiento de gravedad de Grado > 3
Se debe dar a los pacientes tratados con KEYTRUDA la tarjeta de información para el paciente y se les debe informar sobre los riesgos de KEYTRUDA (ver también el prospecto).
Poblaciones especiales Pacientes de edad avanzada
En general, no se han notificado diferencias en la seguridad o la eficacia entre los pacientes de edad avanzada (> 65 años) y los pacientes más jóvenes (< 65 años). No es necesario un ajuste de la dosis en esta población.
Insuficiencia renal
No es necesario un ajuste de la dosis en pacientes con insuficiencia renal leve o moderada. No se ha estudiado KEYTRUDA en pacientes con insuficiencia renal grave (ver sección 5.2).
Insuficiencia hepática
No es necesario un ajuste de la dosis en pacientes con insuficiencia hepática leve. No se ha estudiado KEYTRUDA en pacientes con insuficiencia hepática moderada o grave (ver sección 5.2).
Melanoma ocular
Los datos sobre la seguridad y eficacia de KEYTRUDA en pacientes con melanoma ocular son limitados (ver sección 5.1).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de KEYTRUDA en niños menores de 18 años. No se dispone de datos.
Forma de administración
KEYTRUDA se debe administrar mediante perfusión intravenosa durante 30 minutos. KEYTRUDA no se debe administrar como inyección intravenosa rápida (bolus).
Para consultar las instrucciones de dilución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo Determinación de la expresión de PD-L1
Al evaluar el estado de PD-L1 del tumor, es importante que se elija una metodología bien validada y robusta para reducir al mínimo los resultados falsos negativos o falsos positivos.
Reacciones adversas relacionadas con el sistema inmunitario
La mayoría de las reacciones adversas relacionadas con el sistema inmunitario que se produjeron durante el tratamiento con pembrolizumab fueron reversibles y se controlaron con interrupciones de pembrolizumab, la administración de corticosteroides y/o terapia de apoyo. También se produjeron reacciones adversas relacionadas con el sistema inmunitario después de la última dosis de pembrolizumab.
En caso de sospecha de reacciones adversas relacionadas con el sistema inmunitario, se debe asegurar una evaluación adecuada para confirmar la etiología o descartar otras causas. De acuerdo con la gravedad de la reacción adversa, pembrolizumab se debe suspender temporalmente y se debe administrar corticosteroides. Tras la mejoría a Grado < 1, se debe iniciar la reducción progresiva de los corticosteroides y continuar durante al menos 1 mes. De acuerdo a los datos limitados de ensayos clínicos en pacientes cuyas reacciones adversas relacionadas con el sistema inmunitario no pudieron ser controladas con el uso de corticosteroides, se puede evaluar la administración de otros inmunosupresores sistémicos.
Pembrolizumab se podría reiniciar en el plazo de 12 semanas después de la última dosis de KEYTRUDA, si la reacción adversa se mantiene en Grado <1 y la dosis de corticosteroide se ha reducido a <10 mg de prednisona o equivalente al día.
Pembrolizumab se debe suspender definitivamente por cualquier reacción adversa relacionada con el sistema inmunitario recurrente de Grado 3 y por toxicidad de la reacción adversa relacionada con el sistema inmunitario de Grado 4, excepto por endocrinopatías que estén controladas con terapia hormonal sustitutiva (ver las secciones 4.2 y 4.8).
Neumonitis relacionada con el sistema inmunitario
Se ha notificado neumonitis, incluyendo casos mortales, en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a signos y síntomas de neumonitis. Si se sospecha neumonitis, se debe confirmar con pruebas de imagen radiográficas y descartar otras causas. Se debe administrar corticosteroides en caso de acontecimientos de Grado > 2 (dosis inicial de 12 mg/kg/día de prednisona o equivalente, seguida por una reducción progresiva); pembrolizumab se debe suspender temporalmente en caso de neumonitis de Grado 2 y se debe suspender definitivamente en caso de neumonitis de Grado 3, Grado 4 o recurrente de Grado 2 (ver sección 4.2).
Colitis relacionada con el sistema inmunitario
Se ha notificado colitis en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a signos y síntomas de colitis y descartar otras causas. Se debe administrar corticosteroides en caso de acontecimientos de Grado > 2 (dosis inicial de 1-2 mg/kg/día de prednisona o equivalente, seguida por una reducción progresiva); pembrolizumab se debe suspender temporalmente en caso de colitis de Grado 2 o Grado 3 y se debe suspender definitivamente en caso de colitis de Grado 4 (ver sección 4.2). Se debe tener en cuenta el riesgo potencial de perforación gastrointestinal.
Hepatitis relacionada con el sistema inmunitario
Se ha notificado hepatitis en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a cambios en la función hepática (al comienzo del tratamiento, periódicamente durante el tratamiento y según esté indicado de acuerdo con la evaluación clínica) y en cuanto a síntomas de hepatitis y descartar otras causas. Se debe administrar corticosteroides (dosis inicial de 0,5-1 mg/kg/día (en caso de acontecimientos de Grado 2) y 1-2 mg/kg/día (en acontecimientos de Grado > 3) de prednisona o equivalente, seguida por una reducción progresiva) y, de acuerdo con la intensidad de las elevaciones de las enzimas hepáticas, pembrolizumab se debe suspender temporalmente o suspender definitivamente (ver sección 4.2).
Nefritis relacionada con el sistema inmunitario
Se ha notificado nefritis en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a cambios en la función renal y descartar otras causas de disfunción renal. Se debe administrar corticosteroides en caso de acontecimientos de Grado > 2 (dosis inicial de 1-2 mg/kg/día de prednisona o equivalente, seguida por una reducción progresiva) y, de acuerdo con la intensidad de las elevaciones de la creatinina, pembrolizumab se debe suspender temporalmente en caso de nefritis de Grado 2 y se debe suspender definitivamente en caso de nefritis de Grado 3 o Grado 4 (ver sección 4.2).
Endocrinopatías relacionadas con el sistema inmunitario
Con el tratamiento con pembrolizumab se han observado endocrinopatías graves, tales como hipofisitis, diabetes mellitus tipo 1, cetoacidosis diabética, hipotiroidismo e hipertiroidismo.
En casos de endocrinopatías relacionadas con el sistema inmunitario podría ser necesario el tratamiento a largo plazo con terapia hormonal sustitutiva.
Se ha notificado hipofisitis en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a signos y síntomas de hipofisitis (incluido hipopituitarismo e insuficiencia suprarrenal secundaria) y descartar otras causas. Se debe administrar corticosteroides para tratar la insuficiencia suprarrenal secundaria y otras terapias hormonales sustitutivas según esté clínicamente indicado, y pembrolizumab se debe suspender temporalmente por hipofisitis sintomática hasta que el acontecimiento se ha controlado con terapia hormonal sustitutiva. Se puede valorar la continuación del tratamiento con pembrolizumab, después de la reducción progresiva del corticosteoride, si es necesario (ver sección 4.2). Se debe vigilar la función hipofisaria y los niveles hormonales para asegurar que la terapia hormonal sustitutiva es la adecuada.
Se ha notificado diabetes mellitus tipo 1, incluida cetoacidosis diabética, en pacientes que recibieron pembrolizumab (ver sección 4.8). Se debe vigilar a los pacientes en cuanto a hiperglucemia u otros signos y síntomas de diabetes. Se debe administrar insulina para la diabetes tipo 1 y se debe suspender temporalmente pembrolizumab en casos de hiperglucemia de Grado 3, hasta que se alcance el control metabólico (ver sección 4.2).
Se han notificado trastornos del tiroides, como hipotiroidismo, hipertiroidismo y tiroiditis, en pacientes que recibieron pembrolizumab y se pueden producir en cualquier momento durante el tratamiento; por lo tanto, se debe vigilar a los pacientes en cuanto a cambios en la función tiroidea (al comienzo del tratamiento, periódicamente durante el tratamiento y según esté indicado de acuerdo con la evaluación clínica) y en cuanto a signos y síntomas clínicos de trastornos tiroideos. El hipotiroidismo se puede manejar con tratamiento sustitutivo sin interrupción del tratamiento y sin corticosteroides. El hipertiroidismo se puede manejar sintomáticamente. Pembrolizumab se debe suspender temporalmente por hipertiroidismo de Grado > 3 hasta que se recupere a Grado < 1. Se puede valorar la continuación del tratamiento con pembrolizumab, después de la reducción progresiva del corticosteroide, si es necesario, en pacientes con hipertiroidismo de Grado 3 o Grado 4 que mejore a Grado 2 o menor (ver secciones 4.2 y 4.8). Se debe vigilar la función tiroidea y los niveles hormonales para asegurar que la terapia hormonal sustitutiva es la adecuada.
Otras reacciones adversas relacionadas con el sistema inmunitario
Se han notificado las siguientes reacciones adversas adicionales clínicamente significativas, relacionadas con el sistema inmunitario, en pacientes que recibieron pembrolizumab: uveítis, artritis, miositis, pancreatitis, reacciones cutáneas graves, síndrome de Guillain-Barré, síndrome miasténico, anemia hemolítica y crisis parciales surgidas en un paciente con foco inflamatorio en el parénquima cerebral (ver sección 4.8).
De acuerdo a la gravedad de la reacción adversa, pembrolizumab se debe suspender temporalmente y administrar corticosteroides.
Pembrolizumab se puede reiniciar en el plazo de 12 semanas después de la última dosis de KEYTRUDA, si la reacción adversa se mantiene en Grado <1 y la dosis del corticosteoride se ha reducido a <10 mg de prednisona o equivalente al día.
Pembrolizumab se debe suspender definitivamente por cualquier reacción adversa relacionada con el sistema inmunitario recurrente de Grado 3 y por toxicidad de cualquier reacción adversa relacionada con el sistema inmunitario de Grado 4 (ver secciones 4.2 y 4.8).
Reacciones asociadas a la perfusión
Se han notificado reacciones graves asociadas a la perfusión en pacientes que recibieron pembrolizumab (ver sección 4.8). En las reacciones graves a la perfusión, se debe detener la perfusión y pembrolizumab se debe suspender definitivamente (ver sección 4.2). Los pacientes con reacción a la perfusión leve o moderada pueden seguir recibiendo pembrolizumab con una vigilancia estrecha; se puede valorar la medicación previa con antipiréticos y antihistamínicos.
Pacientes excluidos de los ensayos clínicos
Se excluyeron de los ensayos clínicos los pacientes con los siguientes problemas: metástasis activas en el SNC; infección por VIH, hepatitis B o hepatitis C; enfermedad autoinmune sistémica activa; enfermedad pulmonar intersticial; neumonitis previa que precisa tratamiento con corticosteroides sistémicos; antecedentes de hipersensibilidad grave a otros anticuerpos monoclonales; que estén recibiendo tratamiento inmunosupresor y antecedentes de reacciones adversas graves relacionadas con el sistema inmunitario, debidas al tratamiento con ipilimumab, definidas como cualquier toxicidad de Grado 4 o de Grado 3 que requirió tratamiento con corticosteroides (> 10 mg/día de prednisona o equivalente) durante más de 12 semanas. Los pacientes con infecciones activas fueron excluidos de los ensayos clínicos y se requirió el tratamiento de la infección antes de recibir pembrolizumab. Los pacientes con infecciones activas que se produjeron durante el tratamiento con pembrolizumab fueron controlados con tratamiento médico adecuado. Los pacientes con anomalías, clínicamente significativas en el estado basal, renales (creatinina > 1,5 x LSN) o hepáticas (bilirrubina > 1,5 x LSN, ALT, AST > 2,5 x LSN en ausencia de metástasis hepáticas) fueron excluidos de los ensayos clínicos, por lo que la información en pacientes con insuficiencia renal grave e insuficiencia hepática de moderada a grave es limitada.
Después de considerar cuidadosamente el potencial aumento del riesgo, se puede usar pembrolizumab con un control médico adecuado en estos pacientes.
Tarjeta de información para el paciente
Todos los prescriptores de KEYTRUDA deben estar familiarizados con la Información para el médico y las Directrices de manejo. El prescriptor debe explicar al paciente los riesgos del tratamiento con KEYTRUDA. Se le debe proporcionar al paciente la tarjeta de información para el paciente con cada prescripción.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacciones medicamentosas farmacocinéticas con pembrolizumab. Como pembrolizumab se elimina de la circulación mediante catabolismo, no se esperan interacciones medicamentosas metabólicas.
Se debe evitar el uso de corticosteroides sistémicos o de inmunosupresores antes de comenzar el tratamiento con pembrolizumab, debido a su posible interferencia con la actividad farmacodinámica y la eficacia de pembrolizumab. Sin embargo, se puede usar corticosteroides sistémicos u otros inmunosupresores después de comenzar el tratamiento con pembrolizumab, para tratar las reacciones adversas relacionadas con el sistema inmunitario (ver sección 4.4).
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento con pembrolizumab y hasta al menos 4 meses después de la última dosis de pembrolizumab.
Embarazo
No hay datos relativos al uso de pembrolizumab en mujeres embarazadas. No se han realizado estudios de reproducción animal con pembrolizumab; sin embargo, en modelos murinos de gestación se ha demostrado que el bloqueo de la señalización de PD-L1 altera la tolerancia al feto y conduce a un aumento de la pérdida fetal (ver sección 5.3). Estos resultados indican un posible riesgo, de acuerdo
a su mecanismo de acción, de que la administración de pembrolizumab durante el embarazo pudiera causar daño fetal, incluido aumento de las tasas de abortos o de fetos nacidos muertos. Se sabe que las inmunoglobulinas humanas G4 (IgG4) atraviesan la barrera placentaria; por lo tanto, siendo una IgG4, pembrolizumab tiene el potencial de transmitirse de la madre al feto en desarrollo. Pembrolizumab no se debe usar durante el embarazo a menos que el estado clínico de la mujer precise tratamiento con pembrolizumab.
Lactancia
Se desconoce si pembrolizumab se excreta en la leche materna. Dado que se sabe que los anticuerpos se pueden excretar en la leche materna, no se puede excluir el riesgo en recién nacidos/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con pembrolizumab, tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento con pembrolizumab para la madre.
Fertilidad
No se dispone de datos clínicos relativos a los posibles efectos de pembrolizumab sobre la fertilidad. No hubo efectos notables en los órganos reproductores masculinos y femeninos en monos, de acuerdo a los estudios de toxicidad a dosis repetidas de 1 mes y 6 meses (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Pembrolizumab puede tener una influencia pequeña sobre la capacidad para conducir y utilizar máquinas. Se ha notificado fatiga después de la administración de pembrolizumab (ver sección 4.8).
4.8 Reacciones adversas
Resumen del perfil de seguridad
Pembrolizumab se asocia más frecuentemente a reacciones adversas relacionadas con el sistema inmunitario. La mayoría de éstas, incluyendo las reacciones graves, se resolvieron después de iniciar el tratamiento médico adecuado o de suspender definitivamente el tratamiento con pembrolizumab (ver “Descripción de reacciones adversas seleccionadas” más abajo).
Se ha evaluado la seguridad de pembrolizumab en ensayos clínicos en 2.799 pacientes con melanoma avanzado o CPNM en tres dosis (2 mg/kg cada 3 semanas o 10 mg/kg cada 2 o 3 semanas). En esta población de pacientes, las reacciones adversas más frecuentes (> 10%) con pembrolizumab fueron fatiga (24%), erupción (19%), prurito (18%), diarrea (12%), náuseas (11%) y artralgia (10%). La mayoría de las reacciones adversas notificadas fueron de intensidad de Grado 1 o 2. Las reacciones adversas más graves fueron reacciones adversas relacionadas con el sistema inmunitario y reacciones graves asociadas a la perfusión (ver sección 4.4).
Tabla de reacciones adversas
Las reacciones adversas notificadas en ensayos clínicos en 2.799 pacientes tratados con pembrolizumab se notifican en la Tabla 2. Estas reacciones se presentan según el sistema de clasificación de órganos y por frecuencia. Las frecuencias se definen como: muy frecuentes (> 1/10); frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1.000); muy raras (< 1/10.000). Dentro de cada grupo de frecuencias, se presentan las reacciones adversas en orden decreciente de gravedad.
Tabla 2: Reacciones adversas en pacientes tratados con pembrolizumab en ensayos clínicos
|
Trastornos de la sangre y del sistema linfático | |
|
Frecuentes |
anemia |
|
Poco frecuentes |
neutropenia, leucopenia, trombocitopenia, linfopenia, eosinofilia |
|
Raras |
púrpura trombocitopénica inmune, anemia hemolítica |
|
Trastornos del sistema inmunológico | |
|
Frecuentes |
reacción asociada a perfusión3 |
|
Trastornos endocrinos | |
|
Frecuentes |
hipertiroidismo, hipotiroidismob |
|
Poco frecuentes |
hipofisitisc, insuficiencia suprarrenal, tiroiditis |
|
Trastornos del metabolismo y de la nutrición | |
|
Frecuentes |
apetito disminuido |
|
Poco frecuentes |
diabetes mellitus tipo 1d, hiponatremia, hipocaliemia, hipocalcemia |
|
Trastornos psiquiátricos | |
|
Poco frecuentes |
insomnio |
|
Trastornos del sistema nervioso | |
|
Frecuentes |
cefalea, mareo, disgeusia |
|
Poco frecuentes |
epilepsia, letargia, neuropatía periférica |
|
Raras |
síndrome de Guillain-Barré, síndrome miasténico |
|
Trastornos oculares | |
|
Frecuentes |
ojo seco |
|
Poco frecuentes |
uveítise |
|
Trastornos vasculares | |
|
Poco frecuentes |
hipertensión |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes |
neumonitisf, disnea, tos |
|
Trastornos gastrointestinales | |
|
Muy frecuentes |
diarrea, náuseas |
|
Frecuentes |
colitisg, vómitos, dolor abdominal11, estreñimiento, boca seca |
|
Poco frecuentes |
pancreatitisi |
|
Raras |
perforación de intestino delgado |
|
Trastornos hepatobiliares | |
|
Poco frecuentes |
hepatitisj |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy frecuentes |
. , k • l erupción , prurito |
|
Frecuentes |
reacciones cutáneas gravesm, vitÍligo11, dermatitis acneiforme, piel seca, eritema, eczema |
|
Poco frecuentes |
queratosis liquenoideo, psoriasis, alopecia, eritema nudoso, dermatitis, cambios de color del pelo, pápula |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
Muy frecuentes |
artralgia |
|
Frecuentes |
miositisp, dolor musculoesqueléticoq, dolor en una extremidad, artritis1 |
|
Poco frecuentes |
tenosinovitiss |
|
Trastornos renales y urinarios | |
|
Poco frecuentes |
nefritist |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes |
fatiga |
|
Frecuentes |
astenia, edemau, pirexia, enfermedad de tipo gripal, escalofrío |
|
Exploraciones complementarias | |
|
Frecuentes |
alanina aminotransferasa elevada, aspartato aminotransferasa elevada, fosfatasa alcalina en sangre aumentada, creatinina elevada en sangre |
|
Poco frecuentes |
amilasa elevada, bilirrubina elevada en sangre, hipercalcemia |
* Los siguientes términos representan a un grupo de eventos relacionados que describen a una enfermedad más que a un evento aislado.
a . reacción asociada a perfusión (hipersensibilidad a fármaco, reacción anafiláctica, hipersensibilidad y síndrome de liberación de citocina)
b. hipotiroidismo (mixedema)
c. hipofisitis (hipopituitarismo)
d. diabetes mellitus tipo 1 (cetoacidosis diabética)
e. uveítis (iritis e iridociclitis)
f. neumonitis (enfermedad pulmonar intersticial)
g. colitis (colitis microscópica y enterocolitis)
h. dolor abdominal (molestia abdominal, dolor en la zona superior del abdomen y dolor en la zona inferior del abdomen)
i. pancreatitis (pancreatitis autoinmune y pancreatitis aguda)
j. hepatitis (hepatitis autoinmunitaria y lesión hepática inducida por fármacos)
k. erupción (erupción eritematosa, erupción folicular, erupción generalizada, erupción macular, erupción maculopapular, erupción papular, erupción prurítica, erupción vesicular y erupción genital)
l. prurito (urticaria, urticaria papular, prurito generalizado y prurito genital)
m. reacciones cutáneas graves (dermatitis exfoliativa, eritema multiforme, erupción exfoliativa, penfigoide, síndrome de Stevens-Johnson y las siguientes reacciones de Grado > 3: prurito, erupción, erupción generalizada y erupción maculopapular)
n. vitíligo (despigmentación de la piel, hipopigmentación de la piel e hipopigmentación del párpado)
o. queratosis liquenoide (liquen plano y liquen escleroso)
p. miositis (mialgia, miopatía, polimialgia reumática y rabdomiolisis)
q. dolor musculoesquelético (molestia musculoesquelética, dolor de espalda, rigidez musculoesquelética, dolor torácico musculoesquelético y tortícolis)
r. artritis (hinchazón articular, poliartritis y derrame articular)
s. tenosinovitis (tendinitis, sinovitis y dolor tendinoso)
t. nefritis (nefritis autoinmune, nefritis tubulointersticial y fallo renal o fallo renal agudo con evidencia de nefritis)
u. edema (edema periférico, edema generalizado, sobrecarga de líquido, retención de líquidos, edema palpebral y edema de labio, edema de cara, edema localizado y edema periorbital)
Descripción de reacciones adversas seleccionadas
Los datos de las siguientes reacciones adversas relacionadas con el sistema inmunitario se basan en pacientes que recibieron pembrolizumab en tres dosis (2 mg/kg cada 3 semanas o 10 mg/kg cada 2 o 3 semanas) en ensayos clínicos (ver sección 5.1). Las directrices para el manejo de estas reacciones adversas se describen en la sección 4.4.
Reacciones adversas relacionadas con el sistema inmunitario (ver sección 4.4)
Neumonitis relacionada con el sistema inmunitario
Se produjo neumonitis en 94 (3,4%) pacientes, incluidos casos de Grado 2, 3, 4 o 5 en 36 (1,3%),
25 (0,9%), 7 (0,3%) y 4 (0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de neumonitis fue de 3,3 meses (rango, 2 días a 19,3 meses). La mediana de duración fue de 1,5 meses (rango, 1 día a 17,2+ meses). La neumonitis condujo a la suspensión definitiva de pembrolizumab en 36 (1,3%) pacientes y se resolvió en 55 pacientes.
Colitis relacionada con el sistema inmunitario
Se produjo colitis en 48 (1,7%) pacientes, incluidos casos de Grado 2, 3 o 4 en 10 (0,4%), 31 (1,1%) y 2 (<0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de colitis fue de 3,5 meses (rango, 10 días a 16,2 meses). La mediana de duración fue de 1,3 meses (rango, 1 día a 8,7+ meses). La colitis condujo a la suspensión definitiva de pembrolizumab en 15 (0,5%) pacientes y se resolvió en 41 pacientes.
Hepatitis relacionada con el sistema inmunitario
Se produjo hepatitis en 19 (0,7%) pacientes, incluidos casos de Grado 2, 3 o 4 en 4 (0,1%), 12 (0,4%) y 2 (<0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de hepatitis fue de 1,3 meses (rango, 8 días a 21,4 meses). La mediana de duración fue de
1,8 meses (rango, 8 días a 20,9+ meses). La hepatitis condujo a la suspensión definitiva de pembrolizumab en 6 (0,2%) pacientes y se resolvió en 15 pacientes.
Nefritis relacionada con el sistema inmunitario
Se produjo nefritis en 9 (0,3%) pacientes, incluidos casos de Grado 2, 3 o 4 en 3 (0,1%), 4 (0,1%) y 1 (<0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de nefritis fue de 5,1 meses (rango, 12 días a 12,8 meses). La mediana de duración fue de 3,3 meses (rango, 12 días a 8,9+ meses). La nefritis condujo a la suspensión definitiva de pembrolizumab en 3 (0,1%) paciente y se resolvió en 5 pacientes.
Endocrinopatías relacionadas con el sistema inmunitario
Se produjo hipofisitis en 17 (0,6%) pacientes, incluidos casos de Grado 2, 3 o 4 en 6 (0,2%), 8 (0,3%) y 1 (<0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de hipofisitis fue de 3,7 meses (rango, 1 día a 11,9 meses). La mediana de duración fue de 4,7 meses (rango, 8+ días a 12,7 meses). La hipofisitis condujo a la suspensión definitiva de pembrolizumab en 4 (0,1%) pacientes y se resolvió en 7 pacientes, 2 con secuelas.
Se produjo hipertiroidismo en 96 (3,4%) pacientes, incluidos casos de Grado 2 o 3 en 22 (0,8%) y 4 (0,1%) pacientes, respectivamente, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de hipertiroidismo fue de 1,4 meses (rango, 1 día a 21,9 meses). La mediana de duración fue de 2,1 meses (rango, 3 días a 15,0+ meses). El hipertiroidismo condujo a la suspensión definitiva de pembrolizumab en 2 (<0,1%) pacientes y se resolvió en 71 (74%) pacientes.
Se produjo hipotiroidismo en 237 (8,5%) pacientes, incluidos casos de Grado 2 o 3 en 174 (6,2%) y 3 (0,1%) pacientes, que recibieron pembrolizumab. La mediana de tiempo hasta la aparición de hipotiroidismo fue de 3,5 meses (rango, 1 día a 18,9 meses). La mediana de duración no se alcanzó (rango, 2 días a 27,7+ meses). Un paciente (<0,1%) discontinuó pembrolizumab debido a hipotiroidismo. El hipotiroidismo se resolvió en 48 (20%) pacientes.
Inmunogenicidad
En ensayos clínicos en pacientes tratados con pembrolizumab 2 mg/kg cada 3 semanas o 10 mg/kg cada 2 o 3 semanas, 19 (1,7%) de 1.087 pacientes evaluables dió positivo a anticuerpos generados por el organismo frente a pembrolizumab. No hubo evidencia de alteración de la farmacocinética o del perfil de seguridad con el desarrollo de anticuerpos de unión anti-pembrolizumab.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No hay información acerca de la sobredosis con pembrolizumab.
En caso de sobredosis, los pacientes deben ser vigilados estrechamente en cuanto a signos o síntomas de reacciones adversas y se debe instaurar tratamiento sintomático adecuado.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: otros agentes antineoplásicos, anticuerpos monoclonales. Código ATC: L01XC18
Mecanismo de acción
KEYTRUDA es un anticuerpo monoclonal humanizado, que se une al receptor de la muerte celular programada-1 (PD-1) y bloquea su interacción con los ligandos PD-L1 y PD-L2. El receptor PD-1 es un regulador negativo de la actividad de las células T que se ha demostrado que está involucrado en el control de las respuestas inmunitarias de las células T. KEYTRUDA potencia las respuestas de las células T, incluyendo las respuestas antitumorales, mediante el bloqueo de PD-1, unido a PD-L1 y
PD-L2, que se expresan en las células presentadoras de antígenos y que se pueden expresar por tumores u otras células en el microambiente tumoral.
Eficacia clínica y seguridad
Melanoma
KEYNOTE-006: Ensayo controlado en _pacientes con melanoma naive al tratamiento con ipilimumab La seguridad y eficacia de pembrolizumab se investigó en el ensayo KEYNOTE-006, un ensayo de Fase III, multicéntrico, controlado, para el tratamiento del melanoma avanzado en pacientes naive al tratamiento con ipilimumab. Los pacientes fueron aleatorizados (1:1:1) a recibir pembrolizumab 10 mg/kg cada 2 (n=279) o 3 semanas (n=277) o ipilimumab 3 mg/kg cada 3 semanas (n=278). No se requirió que los pacientes con melanoma con mutación de BRAF V600E hubieran recibido tratamiento previo con un inhibidor de BRAF.
Los pacientes fueron tratados con pembrolizumab hasta progresión de la enfermedad o toxicidad inaceptable. A los pacientes clínicamente estables con evidencia inicial de progresión de la enfermedad se les permitió permanecer en tratamiento hasta que se confirmó la progresión de la enfermedad. Se realizó la evaluación del estado tumoral a las 12 semanas y luego cada 6 semanas hasta la semana 48, seguido posteriormente por la evaluación cada 12 semanas.
De los 834 pacientes, el 60% eran varones, el 44% eran > 65 años (la mediana de edad era de 62 años [rango, 18-89]) y el 98% eran de raza blanca. El 65% de los pacientes tenían estadio M1c, el 9% tenían antecedentes de metástasis cerebral, el 66% no habían recibido tratamiento sistémico previo y el 34% habían recibido un tratamiento previo. El 31% tenían estado funcional ECOG de 1, el 69% tenían estado funcional ECOG de 0 y el 32% tenían LDH elevada. Se notificaron mutaciones de BRAF en 302 (36%) pacientes. Entre los pacientes con tumores con mutación de BRAF, 139 (46%) habían sido tratados previamente con un inhibidor de BRAF.
Las medidas principales de resultados de eficacia fueron la supervivencia libre de progresión (SLP; evaluada mediante una revisión por Evaluación Radiológica y Oncológica Integrada [ROI] usando los Criterios de Evaluación de la Respuesta en Tumores Sólidos [RECIST], versión 1.1) y la supervivencia global (SG). Las medidas secundarias de resultados de eficacia fueron la tasa de respuesta global (TRG) y la duración de la respuesta. La Tabla 3 resume las medidas principales de eficacia en pacientes naive al tratamiento con ipilimumab y en las Figuras 1 y 2 se muestran las curvas de Kaplan-Meier para la SG y la SLP.
|
Criterio de valoración |
Pembrolizumab |
Pembrolizumab |
Ipilimumab |
|
10 mg/kg cada |
10 mg/kg cada |
3 mg/kg cada | |
|
3 semanas |
2 semanas |
3 semanas | |
|
n=277 |
n=279 |
n=278 | |
|
SG | |||
|
Número (%) de pacientes con evento |
92 (33%) |
85 (30%) |
112 (40%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,69 (0,52, 0,90) |
0,63 (0,47, 0,83) |
--- |
|
Valor de pt |
0,00358 |
0,00052 |
--- |
|
Mediana en meses (IC del 95%) |
No alcanzada |
No alcanzada |
No alcanzada |
|
(ND, ND) |
(ND, ND) |
(13, ND) | |
|
SLP | |||
|
Número (%) de pacientes con evento |
157 (57%) |
157 (56%) |
188 (68%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,58 (0,47, 0,72) |
0,58 (0,46, 0,72) |
--- |
|
Valor de pt |
<0,00001 |
<0,00001 |
--- |
|
Mediana en meses (IC del 95%) |
4,1 (2,9, 6,9) |
5,5 (3,4, 6,9) |
2,8 (2,8, 2,9) |
|
Mejor respuesta global | |||
|
% de TRG (IC del 95%) |
33% (27, 39) |
34% (28, 40) |
12% (8, 16) |
|
% de respuesta completa |
6% |
5% |
1% |
|
% de respuesta parcial |
27% |
29% |
10% |
|
Duración de la respuestat | |||
|
Mediana en meses (rango) |
No alcanzada |
8,3 |
No alcanzada |
|
(1,4+, 8,1+) |
(1,4+, 8,3) |
(1,1+, 7,9+) | |
|
% que continúan |
97% |
89% |
88% |
*
t
t
ND
Cociente de riesgo (Hazard Ratio) (pembrolizumab en comparación con ipilimumab) de acuerdo al modelo de riesgos
proporcionales de Cox estratificado
Basado en la prueba de orden logarítmico estratificada
Basado en pacientes con una mejor respuesta como respuesta completa o parcial confirmadas = no disponible
90 -
se
70 -
60 -
50 -
40 -
Grupo de tratamiento
Tasa de SG
va :r
a os 12 meses
3C
20 -
<IC del 95S)
de p
Pembrolizumab 10 mg/kg
cada 2 semanas
Pembrolizumab 10 mg/ka
cada 3 semanas
Ipihmumab
0,63
0.00052
10.4?. 0.83)
(0.52. 0.90
I.........I.........r
6 8 10
Tiempo en meses
Numero con riesgo
Pembrolizumab 10 mg/kg cada 2 semanas
Pembrolizumab 10 mg/kg cada 3 semanas pihmumab
Figura 2: Curva de Kaplan-Meier para la supervivencia libre de progresión por grupo de tratamiento en el ensayo KEYNOTE-006 (población con intención de tratar)
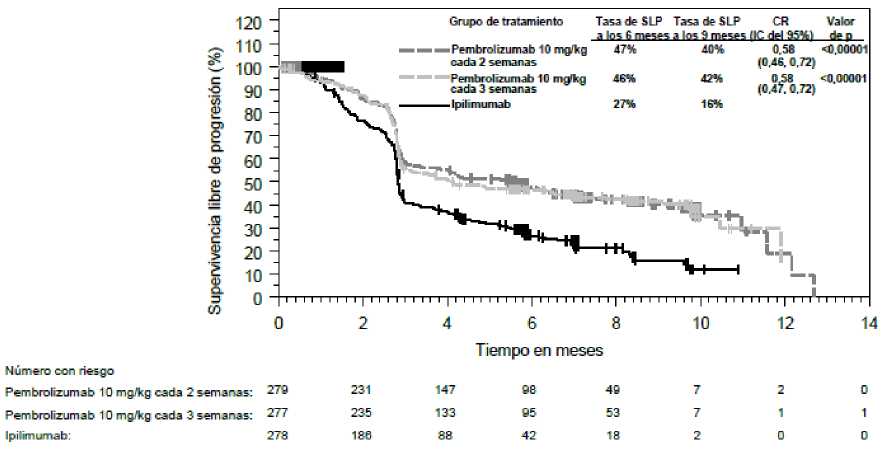
KEYNOTE-002: Ensayo controlado en _pacientes con melanoma tratados _previamente con ipilimumab La seguridad y eficacia de pembrolizumab se investigó en el ensayo KEYNOTE-002, un ensayo multicéntrico, controlado, para el tratamiento del melanoma avanzado en pacientes tratados previamente con ipilimumab y si eran positivos para la mutación de BRAF V600, con un inhibidor de BRAF o de MEK. Los pacientes fueron aleatorizados (1:1:1) a recibir pembrolizumab a una dosis de 2 (n=180) o 10 mg/kg (n=181) cada 3 semanas o quimioterapia (n=179; incluidas dacarbazina, temozolomida, carboplatino, paclitaxel o carboplatino+paclitaxel). El ensayo excluyó a pacientes con enfermedad autoinmune o a aquellos que recibían inmunosupresores; criterios adicionales de exclusión fueron antecedentes de reacciones adversas relacionadas con el sistema inmunitario graves o potencialmente mortales con el tratamiento con ipilimumab, definidas como cualquier toxicidad de Grado 4 o de Grado 3 que requería tratamiento con corticosteroides (dosis >10 mg/día de prednisona o equivalente) durante más de 12 semanas; reacciones adversas en curso de Grado > 2 por tratamientos
previos con ipilimumab; hipersensibilidad grave previa a otros anticuerpos monoclonales; antecedentes de neumonitis o enfermedad pulmonar intersticial; infección por VIH, hepatitis B o hepatitis C y estado funcional ECOG > 2.
Los pacientes fueron tratados con pembrolizumab hasta progresión de la enfermedad o toxicidad inaceptable. A los pacientes clínicamente estables con evidencia inicial de progresión de la enfermedad se les permitió permanecer en tratamiento hasta que se confirmó la progresión de la enfermedad. Se realizó la evaluación del estado tumoral a las 12 semanas y luego cada 6 semanas hasta la semana 48, seguida posteriormente por la evaluación cada 12 semanas. Los pacientes en quimioterapia que experimentaron progresión de la enfermedad, verificada independientemente después de la primera evaluación programada de la enfermedad, pudieron cambiar y recibir 2 mg/kg o 10 mg/kg de pembrolizumab cada 3 semanas, en un modelo a doble ciego.
De los 540 pacientes, el 61% eran varones, el 43% eran > 65 años (la mediana de edad era de 62 años [rango, 15-89]) y el 98% eran de raza blanca. El 82% tenían estadio M1c, el 73% habían recibido al menos dos tratamientos sistémicos previos para el melanoma avanzado y el 32% de los pacientes habían recibido tres o más. El 45% tenían estado funcional ECOG de 1, el 40% tenían LDH elevada y el 23% tenían un tumor con mutación de BRAF.
Las medidas principales de resultados de eficacia fueron la SLP evaluada mediante ROI usando los criterios RECIST versión 1.1 y la SG. Las medidas secundarias de resultados de eficacia fueron la TRG y la duración de la respuesta. La Tabla 4 resume las medidas principales de eficacia en pacientes tratados previamente con ipilimumab y en la Figura 3 se muestra la curva de Kaplan-Meier para la SLP. Los dos grupos de tratamiento con pembrolizumab fueron superiores a la quimioterapia para la SLP, y no hubo diferencias entre las dosis de pembrolizumab. Los datos de SG no estaban maduros en el momento del análisis de la SLP. No hubo diferencia estadísticamente significativa entre pembrolizumab y la quimioterapia en el análisis preliminar de la SG, que no se ajustó en cuanto a los posibles efectos de confusión debidos al cambio de tratamiento. De los pacientes aleatorizados al grupo de quimioterapia, el 48% cambiaron de tratamiento y, posteriormente, recibieron tratamiento con pembrolizumab.
|
Criterio de valoración |
Pembrolizumab 2 mg/kg cada 3 semanas n=180 |
Pembrolizumab 10 mg/kg cada 3 semanas n=181 |
Quimioterapia n=179 |
|
SLP | |||
|
Número (%) de pacientes con evento |
129 (72%) |
126 (70%) |
155 (87%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,57 (0,45, 0,73) |
0,50 (0,39, 0,64) |
--- |
|
Valor de p^ |
<0,0001 |
<0,0001 |
--- |
|
Mediana en meses (IC del 95%) |
2,9 (2,8, 3,8) |
2,9 (2,8, 4,7) |
2,7 (2,5, 2,8) |
|
SG | |||
|
Número (%) de pacientes con evento |
73 (41%) |
69 (38%) |
78 (44%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,88 (0,64, 1,22) |
0,78 (0,56, 1,08) |
--- |
|
Valor de p^ |
0,2294 |
0,0664 |
--- |
|
Mejor respuesta global | |||
|
% de TRG (IC del 95%) |
21% (15, 28) |
25% (19, 32) |
4% (2, 9) |
|
% de respuesta completa |
2% |
3% |
0% |
|
% de respuesta parcial |
19% |
23% |
4% |
|
Duración de la respuesta | |||
|
Mediana en meses (rango) |
No alcanzada (1,4+, 11,5+) |
No alcanzada (1,2+, 11,1+) |
8,5 (1,6+, 9,5) |
|
% que continúan |
87% |
80% |
63% |
* Cociente de riesgo (Hazard Ratio) (pembrolizumab en comparación con quimioterapia) de acuerdo al modelo de riesgos proporcionales de Cox estratificado t Basado en la prueba de orden logarítmico estratificada
Figura 3: Curva de Kaplan-Meier para la supervivencia libre de progresión por grupo de tratamiento en el ensayo KEYNOTE-002 (población con intención de tratar)
0
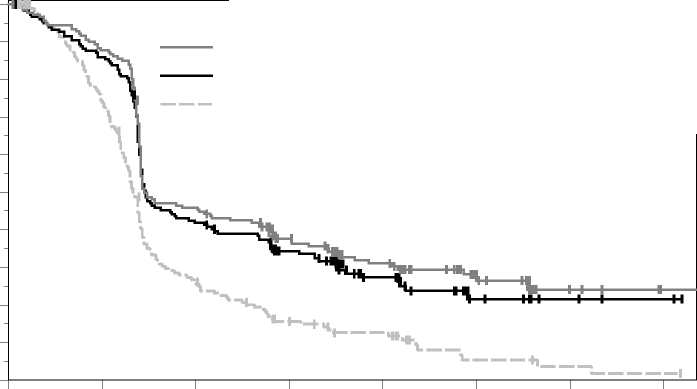
|
Grupo de tratamiento Tasa de SLP a los 6 meses |
Tasa de SLP a los 9 meses |
CR (IC del 95%) |
Valor de p | |
|
Pembrolizumab 10 mg/kg |
38% |
29% |
0,50 |
<0,0001 |
|
cada 3 semanas |
(0,39, 0,64) | |||
|
Pembrolizumab 2 mg/kg |
34% |
24% |
0,57 |
<0,0001 |
|
cada 3 semanas |
(0,45, 0,73) | |||
|
Quimioterapia |
16% |
8% | ||
100
90
80
■o
'(/)
70
O)
o
60
(D
"O
50
.Q
40
C
(D
30
aj
20
w
10
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 | |
|
Número con riesgo |
Tiempo en meses | |||||||
|
Pembrolizumab 10 mg/kg: |
181 |
158 |
82 |
55 |
39 |
15 |
5 |
1 |
|
Pembrolizumab 2 mg/kg: |
180 |
153 |
74 |
53 |
26 |
9 |
4 |
2 |
|
Quimioterapia: |
179 |
128 |
43 |
22 |
15 |
4 |
2 |
1 |
KEYNOTE-001: Ensayo no controlado en pacientes con melanoma na'ive al tratamiento con ipilimumab y previamente tratados con ipilimumab
La seguridad y eficacia de pembrolizumab se investigó en pacientes con melanoma avanzado en un ensayo no controlado, abierto, KEYNOTE-001. Se evaluó la eficacia en 276 pacientes de dos cohortes definidas, una que incluyó a pacientes tratados previamente con ipilimumab (y, si eran positivos para la mutación de BRAF V600, con un inhibidor de BRAF o de MEK) y, la otra, que incluyó a pacientes naíve al tratamiento con ipilimumab. Los pacientes fueron asignados aleatoriamente a recibir pembrolizumab a una dosis de 2 mg/kg cada 3 semanas o 10 mg/kg cada 3 semanas. Los pacientes fueron tratados con pembrolizumab hasta progresión de la enfermedad o toxicidad inaceptable. A los pacientes clínicamente estables con evidencia inicial de progresión de la enfermedad se les permitió permanecer en tratamiento hasta que se confirmó la progresión de la enfermedad. Los criterios de exclusión fueron similares a los del ensayo KEYNOTE-002.
De los 89 pacientes que recibieron 2 mg/kg de pembrolizumab que fueron tratados previamente con ipilimumab, el 53% eran varones, el 33% eran > 65 años de edad y la mediana de edad era de 59 años (rango, 18-88). Todos, excepto dos pacientes, eran de raza blanca. El 84% tenían estadio M1c y el 8% de los pacientes tenían antecedentes de metástasis cerebral. El 70% habían recibido al menos dos tratamientos sistémicos previos para el melanoma avanzado y el 35% de los pacientes habían recibido tres o más. Se notificaron mutaciones de BRAF en el 13% de la población del ensayo. Todos los pacientes con tumores con mutación de BRAF fueron tratados previamente con un inhibidor de BRAF.
De los 51 pacientes que recibieron 2 mg/kg de pembrolizumab que eran naíve al tratamiento con ipilimumab, el 63% eran varones, el 35% tenían > 65 años de edad y la mediana de edad era de 60 años (rango, 35-80). Todos, excepto uno de los pacientes, eran de raza blanca. El 63% tenían estadio M1c y el 2% de los pacientes tenían antecedentes de metástasis cerebral. El 45% no habían recibido tratamientos previos para el melanoma avanzado. Se notificaron mutaciones de BRAF en 20 (39%) pacientes. Entre los pacientes con tumores con mutación de BRAF, 10 (50%) fueron tratados previamente con un inhibidor de BRAF.
La medida principal de resultado de eficacia fue la TRG evaluada mediante una revisión independiente usando los criterios RECIST 1.1. Las medidas de resultados secundarias de eficacia fueron la tasa de control de la enfermedad (TCE; incluyendo la respuesta completa, la respuesta parcial y la enfermedad estable), la duración de la respuesta, la SLP y la SG. La respuesta tumoral se evaluó a intervalos de 12 semanas. La Tabla 5 resume las medidas principales de eficacia en pacientes tratados previamente o naíve al tratamiento con ipilimumab, que recibían pembrolizumab a la dosis recomendada.
|
Criterio de valoración |
Pembrolizumab 2 mg/kg cada 3 semanas en pacientes tratados previamente con ipilimumab n=89 |
Pembrolizumab 2 mg/kg cada 3 semanas en pacientes naiVe al tratamiento con ipilimumab n=51 |
|
Mejor respuesta global* por ROIt | ||
|
% de TRG (IC del 95%) |
25% (16, 35) |
33% (21, 48) |
|
Respuesta completa |
3% |
10% |
|
Respuesta parcial |
21% |
24% |
|
% de tasa de control de la enfermedad* |
49% |
49% |
|
Duración de la respuesta § | ||
|
Mediana en meses (rango) |
No alcanzada (2,8+, 14,3+) |
No alcanzada (1,6+, 13,8+) |
|
% que continúan |
86%1 |
82%# |
|
SLP | ||
|
Mediana en meses (IC del 95%) |
4,9 (2,8, 8,3) |
5,5 (2,8, 14,0) |
|
Tasa de SLP a los 6 meses |
43% |
50% |
|
SG | ||
|
Mediana en meses (IC del 95%) |
No alcanzada (11, no disponible) |
No alcanzada (14, no disponible) |
|
Tasa de SG a los 12 meses |
60% |
72% |
t
t
§
Incluye pacientes sin enfermedad medible en el estado basal mediante revisión radiológica independiente ROI = Evaluación radiológica y oncológica integrada usando los criterios RECIST 1.1 Basado en la mejor respuesta de enfermedad estable o mejor
Basado en los pacientes con una respuesta confirmada mediante revisión independiente, comenzando desde la fecha en la que se registró por primera vez la respuesta; n=22 para pacientes tratados previamente con ipilimumab; n=17 para pacientes naive al tratamiento con ipilimumab
Los pacientes respondedores fueron seguidos durante un mínimo de 12 meses después del inicio del tratamiento Los pacientes respondedores fueron seguidos durante un mínimo de 15 meses después del inicio del tratamiento
i
#
Los resultados de los pacientes tratados previamente con ipilimumab (n=84) y naive al tratamiento con ipilimumab (n=52), que recibieron 10 mg/kg de pembrolizumab cada 3 semanas, fueron similares a los observados en pacientes que recibieron 2 mg/kg de pembrolizumab cada 3 semanas.
Análisis de subpoblaciones
Estado de la mutación BRAF en melanoma
Se realizó un análisis de subgrupos del ensayo KEYNOTE-002 en pacientes que tenían BRAF sin mutación (n=415; 77%) o BRAF con mutación con tratamiento previo con un inhibidor de BRAF (n=125; 23%). Los cocientes de riesgo (Hazard Ratio) de la SLP (grupos de pembrolizumab en conjunto [2 mg/kg o 10 mg/kg cada 3 semanas] frente a quimioterapia) fueron 0,51 (IC del 95%: 0,41, 0,65) en BRAF sin mutación y 0,56 (IC del 95%: 0,37, 0,85) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Los CR de la SLP para pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron 0,51 (IC del 95%: 0,39, 0,67) en BRAF sin mutación y 0,74 (IC del 95%: 0,46, 1,18) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Los CR de la SG para los grupos de pembrolizumab en conjunto frente a quimioterapia fueron 0,83 (IC del 95%: 0,60, 1,15) en BRAF sin mutación y 0,82 (IC del 95%: 0,47, 1,43) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Los CR de la SG para pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron 0,80 (IC del 95%: 0,55, 1,18) en BRAF sin mutación y 1,03 (IC del 95%: 0,55, 1,91) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Las TRG en los grupos de pembrolizumab en conjunto y de pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron del 27% y del 25% frente al 6% en BRAF sin mutación y
del 12% y del 9% frente al 0% en BRAF con mutación con tratamiento previo con un inhibidor de BRAF.
Se realizó un análisis de subgrupos del ensayo KEYNOTE-006 en pacientes que tenían BRAF sin mutación (n=525; 63%), BRAF con mutación naive al tratamiento con un inhibidor de BRAF (n=163; 20%) y BRAF con mutación con tratamiento previo con un inhibidor de BRAF (n=139; 17%). Los CR de la SLP (grupos de pembrolizumab en conjunto [10 mg/kg cada 2 o 3 semanas] frente a ipilimumab) fueron 0,57 (IC del 95%: 0,45, 0,73) en BRAF sin mutación, 0,50 (IC del 95%: 0,32, 0,77) en BRAF con mutación naive al tratamiento con un inhibidor de BRAF y 0,73 (IC del 95%: 0,48, 1,11) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. Los CR de la SG para los grupos de pembrolizumab en conjunto con un inhibidor de ipilimumab fueron 0,61 (IC del 95%: 0,46, 0,82) en BRAF sin mutación, 0,69 (IC del 95%: 0,33, 1,45) en BRAF con mutación naive al tratamiento con un inhibidor de BRAF y 0,75 (IC del 95%: 0,45, 1,26) en BRAF con mutación con tratamiento previo con un inhibidor de BRAF. La TRG de los grupos de pembrolizumab en conjunto frente a ipilimumab fue del 34% frente al 13% en BRAF sin mutación, del 41% frente al 13% en BRAF con mutación naive al tratamiento con un inhibidor de BRAF y del 21% frente al 6% en BRAF con mutación con tratamiento previo con un inhibidor de BRAF.
Estado de PD-L1 en melanoma
Se realizó un análisis de subgrupos del ensayo KEYNOTE-002 en pacientes que eran PD-L1 positivo (puntuación de proporción de Allred > 2, presentando una expresión de membrana de PD-L1 en > 1% de los tumores celulares) frente a PD-L1 negativo (puntuación de proporción de Allred de 0 o 1). La expresión de PD-L1 se estudió retrospectivamente mediante un test de investigación de inmunohistoquímica con el anticuerpo anti PD-L1 22C3. Entre los pacientes que eran evaluables en cuanto a expresión de PD-L1 (78%), el 69% (n=291) eran PD-L1 positivo y el 31% (n=130) eran PD-L1 negativo. Los CR de la SLP (grupos de pembrolizumab en conjunto [2 mg/kg o 10 mg/kg cada 3 semanas] frente a quimioterapia) fueron 0,52 (IC del 95%: 0,39, 0,68) en los pacientes PD-L1 positivo y 0,60 (IC del 95%: 0,38, 0,94) en los pacientes PD-L1 negativo. Los CR de la SLP para pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron 0,54 (IC del 95%: 0,39, 0,75) en los pacientes PD-L1 positivo y 0,89 (IC del 95%: 0,53, 1,50) en los pacientes PD-L1 negativo. Los CR de la SG en los grupos de pembrolizumab en conjunto frente a quimioterapia fueron 0,82 (IC del 95%: 0,55, 1,23) en pacientes PD-L1 positivo y 0,77 (IC del 95%: 0,43, 1,37) en pacientes PD-L1 negativo. Los CR de la SG para pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron 0,93 (IC del 95%: 0,58, 1,49) en los pacientes PD-L1 positivo y 1,19 (IC del 95%: 0,58, 2,46) en los pacientes PD-L1 negativo. Las TRG en los grupos de pembrolizumab en conjunto y de pembrolizumab 2 mg/kg cada 3 semanas frente a quimioterapia fueron del 26% y del 23% frente al 4% en pacientes PD-L1 positivo y del 15% y del 11% frente al 8% en pacientes PD-L1 negativo.
Se realizó un análisis de subgrupos del ensayo KEYNOTE-006 en pacientes que eran PD-L1 positivo (n=671; 80%) frente a PD-L1 negativo (n=150; 18%). Entre los pacientes que eran evaluables en cuanto a expresión de PD-L1 (98%), el 82% eran PD-L1 positivo y el 18% eran PD-L1 negativo. Los CR de la SLP (grupos de pembrolizumab en conjunto [10 mg/kg cada 2 o 3 semanas] frente a ipilimumab) fueron 0,53 (IC del 95%: 0,43, 0,65) en pacientes PD-L1 positivo y 0,73 (IC del 95%: 0,47, 1,11) en pacientes PD-L1 negativo. Los CR de la SG en los grupos de pembrolizumab en conjunto frente a ipilimumab fueron 0,56 (IC del 95%: 0,43, 0,73) en pacientes PD-L1 positivo y 0,95 (IC del 95%: 0,56, 1,62) en pacientes PD-L1 negativo. Las TRG en los grupos de pembrolizumab en conjunto frente a ipilimumab fueron del 37% frente al 12% en pacientes PD-L1 positivo y del 18% frente al 11% en pacientes PD-L1 negativo.
Melanoma ocular
En 20 sujetos con melanoma ocular incluidos en el ensayo KEYNOTE-001, no se notificaron respuestas objetivas; se comunicó enfermedad estable en 6 pacientes.
CPNM
KEYNOTE-010: Ensayo controlado en pacientes con CPNM tratados previamente con quimioterapia La seguridad y la eficacia de pembrolizumab se investigó en el ensayo KEYNOTE-010, un ensayo multicéntrico, abierto, controlado, para el tratamiento del CPNM avanzado en pacientes tratados previamente con quimioterapia que incluyera platino. Los pacientes tenían expresión positiva de PD-L1 (puntuación de proporción tumoral >1% de acuerdo al Kit de inmuno histoquímica (IHQ) de PD-L1 22C3 pharmDx™). Los pacientes con activación de las mutaciones de EGFR o translocación de ALK también tuvieron progresión de la enfermedad con el tratamiento aprobado para estas mutaciones antes de recibir pembrolizumab. Los pacientes fueron asignados aleatoriamente (1:1:1) a recibir pembrolizumab a una dosis de 2 mg (n=344) o 10 mg/kg (n=346) cada 3 semanas o docetaxel a una dosis de 75 mg/m2 cada 3 semanas (n=343) hasta progresión de la enfermedad o toxicidad inaceptable. El ensayo excluyó a los pacientes con enfermedad autoinmune; un problema médico que precisara inmunosupresión; o que hubieran recibido más de 30 Gy de radiación torácica dentro de las 26 semanas previas. Se realizó evaluación del estado tumoral cada 9 semanas.
Las características basales para esta población incluyeron: mediana de edad de 63 años (42% de 65 años o más); 61% varones; 72% de raza blanca y 21% asiáticos y 34% y 66% con un estado funcional ECOG de 0 y 1, respectivamente. Las características de la enfermedad fueron escamosa (21%) y no escamosa (70%); M1 (91%); metástasis cerebrales estables (15%) y la incidencia de mutaciones fue de EGFR (8%) o de ALK (1%). El tratamiento previo incluyó un régimen en doblete con platino (100%); los pacientes recibieron una (69%) o dos o más (29%) líneas de tratamiento.
Las medidas principales de resultados de eficacia fueron la SG y la SLP evaluadas mediante una Revisión Central Independiente Enmascarada (RCIE) usando los criterios RECIST 1.1. Las medidas secundarias de resultados de eficacia fueron la TRG y la duración de la respuesta. La Tabla 6 resume las medidas principales de eficacia para toda la población (puntuación de proporción tumoral >1%) y para los pacientes con puntuación de proporción tumoral > 50% y en la Figura 4 se muestra la curva de Kaplan-Meier para la SG (puntuación de proporción tumoral >1%).
|
Criterio de valoración principal |
Pembrolizumab 2 mg/kg cada 3 semanas |
Pembrolizumab 10 mg/kg cada 3 semanas |
Docetaxel 75 mg/m2 cada 3 semanas |
|
Puntuación de proporción tumoral > 1% | |||
|
Número de pacientes |
344 |
346 |
343 |
|
SG | |||
|
Número (%) de los pacientes con evento |
172 (50%) |
156 (45%) |
193 (56%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,71 (0,58, 0,88) |
0,61 (0,49, 0,75) |
--- |
|
Valor de p* |
<0,001* |
<0,001* |
--- |
|
Mediana en meses (IC del 95%) |
10,4 (9,4, 11,9) |
12,7 (10,0, 17,3) |
8,5 (7,5, 9,8) |
|
SLP5 | |||
|
Número (%) de pacientes con evento |
266 (77%) |
255 (74%) |
257 (75%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,88 (0,73, 1,04) |
0,79 (0,66, 0,94) |
--- |
|
Valor de p* |
0,068 |
0,005 |
--- |
|
Mediana en meses (IC del 95%) |
3,9 (3,1, 4,1) |
4,0 (2,6, 4,3) |
4,0 (3,1, 4,2) |
|
Tasa de respuesta global5 | |||
|
% de TRG1 (IC del 95%) |
18% (14, 23) |
18% (15, 23) |
9% (7, 13) |
|
Duración de la respuesta5#’^ | |||
|
Mediana en meses (rango) |
No alcanzada (0,7+, 20,1+) |
No alcanzada (2,1+, 17,8+) |
6,2 (1,4+, 8,8+) |
|
% que continúan |
73% |
72% |
34% |
|
Puntuación de proporción tumoral > 50% | |||
|
Número de pacientes |
139 |
151 |
152 |
|
SG | |||
|
Número (%) de los pacientes con evento |
58 (42%) |
60 (40%) |
86 (57%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,54 (0,38, 0,77) |
0,50 (0,36, 0,70) |
--- |
|
Valor de p* |
<0,001* |
<0,001* |
--- |
|
Mediana en meses (IC del 95%) |
14,9 (10,4, ND) |
17,3 (11,8, ND) |
8,2 (6,4, 10,7) |
|
SLP5 | |||
|
Número (%) de pacientes con evento |
89 (64%) |
97 (64%) |
118 (78%) |
|
Cociente de riesgo (Hazard Ratio)* (IC del 95%) |
0,58 (0,43, 0,77) |
0,59 (0,45, 0,78) |
--- |
|
Valor de p* |
<0,001* |
<0,001* |
--- |
|
Mediana en meses (IC del 95%) |
5,2 (4,0, 6,5) |
5,2 (4,1, 8,1) |
4,1 (3,6, 4,3) |
|
Tasa de respuesta global5 | |||
|
% de TRG1 (IC del 95%) |
30% (23, 39) |
29% (22, 37) |
8% (4, 13) |
|
Duración de la respuesta5’#’1* | |||
|
Mediana en meses (rango) |
No alcanzada (0,7+, 16,8+) |
No alcanzada (2,1+, 17,8+) |
8,1 (2,1+, 8,8+) |
|
% que continúa |
76% |
75% |
33% |
Cociente de riesgo (Hazard Ratio) (pembrolizumab en comparación con docetaxel) de acuerdo al modelo de riesgos proporcionales de Cox estratificado
^ Basado en la prueba de orden logarítmico estratificada
* Estadísticamente significativo de acuerdo a un nivel de a preespecificado ajustado por multiplicidad
§ Evaluado mediante revisión central independiente enmascarada (RCIE) usando los criterios RECIST 1.1
^ Todas las respuestas fueron respuestas parciales
# Basado en los pacientes con una mejor respuesta global de respuesta completa o parcial confirmadas
B Incluye 30, 31 y 2 pacientes con respuestas que se mantienen de 6 meses o más en los grupos de pembrolizumab 2 mg/kg, pembrolizumab 10 mg/kg y docetaxel, respectivamente
B Incluye 22, 24 y 1 pacientes con respuestas que se mantienen de 6 meses o más en los grupos de pembrolizumab 2 mg/kg, pembrolizumab 10 mg/kg y docetaxel, respectivamente
Figura 4: Curva de Kaplan-Meier de la supervivencia global por grupo de tratamiento en el ensayo KEYNOTE-010 (pacientes con puntuación > 1% de proporción tumoral de expresión de
PD-L1, población de intención de tratar)
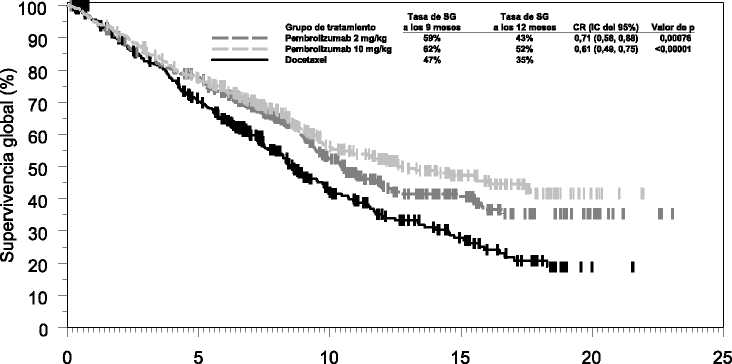
344
Tiempo en meses
259 115 49
255 124 56
212 79 33
12
6
1
Número en riesgo Pembrolizumab 2 mg/kg:
Pembrolizumab 10 mg/kg: 346
343
Docetaxel:
Los resultados de eficacia fueron similares en los grupos de 2 mg/kg y 10 mg/kg de pembrolizumab. Los resultados de eficacia en la SG fueron coherentes independientemente de la antigüedad de la muestra tumoral (muestra nueva frente a muestra de archivo) de acuerdo a una comparación entre grupos.
En el análisis de subgrupo, se observó un beneficio reducido de la supervivencia con pembrolizumab comparado con docetaxel, en pacientes que nunca fueron fumadores o en pacientes con tumores que albergaban la activación de mutaciones de EGFR, que recibieron al menos quimioterapia basada en platino y un inhibidor de tirosina kinasa; sin embargo, debido al bajo número de pacientes, no se pueden extraer conclusiones definitivas de estos datos.
No se ha establecido la eficacia y seguridad de pembrolizumab en pacientes con tumores que no expresen PD-L1.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con pembrolizumab en uno o más grupos de la población
5.2 Propiedades farmacocinéticas
Se estudió la farmacocinética de pembrolizumab en 2.856 pacientes con melanoma metastásico o irresecable, CPNM o carcinoma que recibieron dosis en el rango de 1 a 10 mg/kg cada 2 o 3 semanas.
Absorción
Pembrolizumab se administra por vía intravenosa y, por lo tanto, tiene una biodisponibilidad inmediata y completa.
Distribución
De forma coherente con una distribución extravascular limitada, el volumen de distribución de pembrolizumab en el estado estacionario es pequeño (~7,4 l; CV: 19%). Como se esperaba de un anticuerpo, pembrolizumab no se une a las proteínas plasmáticas de una forma específica.
Biotransformación
Pembrolizumab se cataboliza mediante vías inespecíficas; el metabolismo no contribuye a su eliminación.
Eliminación
El aclaramiento sistémico de pembrolizumab es de ~0,2 l/día (CV: 37%) y la semivida terminal (t/) es de ~27 días (CV: 38%).
Linealidad/No linealidad
La exposición a pembrolizumab expresada mediante concentración máxima (Cmax) o área bajo la curva de tiempo-concentración plasmática (AUC) aumentó de forma proporcional a la dosis dentro del rango de dosis para la eficacia. Con la administración repetida, se observó que el aclaramiento de pembrolizumab era independiente del tiempo y la acumulación sistémica fue aproximadamente
2.2 veces mayor cuando se administró cada 3 semanas. Las concentraciones de pembrolizumab cerca del estado estacionario se alcanzaron a las 18 semanas; la mediana de Cmín a las 18 semanas fue aproximadamente de 24 mcg/ml, a una dosis de 2 mg/kg cada 3 semanas.
Poblaciones especiales
Se evaluaron los efectos de diversas covariables sobre la farmacocinética de pembrolizumab mediante análisis de farmacocinética de poblaciones. El aclaramiento de pembrolizumab aumentó con el aumento del peso corporal; las diferencias resultantes en la exposición se abordan adecuadamente mediante la administración sobre una base de mg/kg. Los siguientes factores no tuvieron un efecto clínicamente importante sobre el aclaramiento de pembrolizumab: edad (rango, 15-94 años), sexo, raza, insuficiencia renal leve o moderada, insuficiencia hepática leve y carga tumoral.
Insuficiencia renal
Se evaluó el efecto de la insuficiencia renal sobre el aclaramiento de pembrolizumab mediante análisis de farmacocinética de poblaciones en pacientes con insuficiencia renal leve o moderada en comparación con pacientes con función renal normal. No se observaron diferencias clínicamente importantes en el aclaramiento de pembrolizumab entre los pacientes con insuficiencia renal leve o moderada y los pacientes con función renal normal. No se ha estudiado pembrolizumab en pacientes con insuficiencia renal grave.
Insuficiencia hepática
Se evaluó el efecto de la insuficiencia hepática sobre el aclaramiento de pembrolizumab mediante análisis de farmacocinética de poblaciones en pacientes con insuficiencia hepática leve (definida usando los criterios de disfunción hepática del National Cancer Institute de EE.UU.) en comparación con los pacientes con función hepática normal. No se observaron diferencias clínicamente importantes
en el aclaramiento de pembrolizumab entre los pacientes con insuficiencia hepática leve y los pacientes con función hepática normal. No se ha estudiado pembrolizumab en pacientes con insuficiencia hepática moderada o grave (ver sección 4.2).
5.3 Datos preclínicos sobre seguridad
Se evaluó la seguridad de pembrolizumab en un estudio de toxicidad a dosis repetidas de 1 mes y otro de 6 meses en monos Cynomolgus que recibieron dosis intravenosas de 6, 40 o 200 mg/kg una vez a la semana en el estudio de 1 mes y una vez cada dos semanas en el estudio de 6 meses, seguido por un periodo de 4 meses sin tratamiento. No se observaron hallazgos de importancia toxicológica y el nivel sin efecto adverso observado (NOAEL) en ambos estudios fue > 200 mg/kg, que es 19 veces la exposición en seres humanos a la dosis más alta estudiada clínicamente (10 mg/kg).
No se han realizado estudios de reproducción animal con pembrolizumab. La vía PD-1/PD-L1 se piensa que está involucrada en mantener la tolerancia al feto durante el embarazo. Se ha demostrado que el bloqueo de la señalización PD-L1 en modelos murinos de embarazo altera la tolerancia al feto y conduce a un aumento de pérdidas fetales.
No se han llevado a cabo estudios de fertilidad en animales con pembrolizumab. En estudios de toxicología a dosis repetidas de 1 mes y 6 meses, no hubo efectos notables en los órganos reproductores masculinos y femeninos; sin embargo, muchos animales de estos estudios no eran sexualmente maduros.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
L-histidina
Hidrocloruro de L-histidina monohidrato
Sacarosa
Polisorbato 80
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
Vial no abierto 2 años
Después de la preparación para perfusión
Se ha demostrado la estabilidad química y física en uso de la solución diluida durante 24 horas a temperatura ambiente (a o por debajo de 25°C). Desde un punto de vista microbiológico, el producto se debe utilizar inmediatamente. No se debe congelar la solución diluida. Si no se usa inmediatamente, los tiempos y las condiciones de conservación en uso antes de utilizarlo son responsabilidad del usuario y no deben ser superiores a un total de 24 horas. Este periodo de 24 horas puede incluir hasta 6 horas a temperatura ambiente (a o por debajo de 25°C); en cualquier tiempo de espera restante, la temperatura debe ser de entre 2°C y 8°C. Si se refrigera, se debe dejar que los viales y/o las bolsas intravenosas alcancen la temperatura ambiente antes de su uso.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Para las condiciones de conservación tras la dilución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
4 ml de concentrado en un vial de vidrio de tipo I de 10 ml con un tapón de clorobutilo de color gris y
una cápsula de aluminio con una tapa desprendible de color azul oscuro, que contiene 100 mg de
pembrolizumab.
Cada caja contiene un vial.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Preparación y administración de la perfusión
• No agitar el vial.
• Mantener el vial a temperatura ambiente (a o por debajo de 25°C).
• Antes de la dilución, el vial de líquido puede estar fuera de la nevera (temperaturas a o por debajo de 25°C) hasta 24 horas.
• Los medicamentos parenterales se deben inspeccionar visualmente por si tienen partículas extrañas y cambio de color antes de la administración. El concentrado es una solución transparente a ligeramente opalescente, incolora a ligeramente amarilla. Desechar el vial si se observan partículas visibles.
• Extraer el volumen necesario hasta 4 ml (100 mg) de concentrado y transferirlo a una bolsa para administración intravenosa que contenga 9 mg/ml de cloruro sódico (0,9%) o 50 mg/ml de glucosa (5%), para preparar una solución diluida con una concentración final que vaya de 1a 10 mg/ml. Cada vial contiene un exceso de llenado de 0,25 ml (4,25 ml de contenido total por vial) para asegurar la recuperación de 4 ml de concentrado. Mezclar la solución diluida mediante inversión suave.
• Se ha demostrado la estabilidad química y física en uso de la solución diluida durante 24 horas a temperatura ambiente (a o por debajo de 25°C). Desde un punto de vista microbiológico, el producto se debe usar inmediatamente. No se debe congelar la solución diluida. Si no se usa inmediatamente, los tiempos y condiciones de conservación en uso antes de utilizarlo son responsabilidad del usuario y no deben ser superiores a un total de 24 horas. Este periodo de 24 horas puede incluir hasta 6 horas a temperatura ambiente (a o por debajo de 25°C); en cualquier tiempo de espera restante, la temperatura debe ser de entre 2°C y 8°C. Si se refrigera, se debe dejar que los viales y/o las bolsas intravenosas alcancen la temperatura ambiente antes de su uso. Administrar la solución de perfusión por vía intravenosa durante 30 minutos, usando un filtro de 0,2 a 5 ^m, estéril, no pirógeno, de baja unión a proteínas, conectado en línea o añadido.
• No administrar junto con otros medicamentos a través de la misma vía de perfusión.
• KEYTRUDA es para un solo uso. Desechar cualquier parte no utilizada que quede en el vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto
con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited
Hertford Road
Hoddesdon
Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1024/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 17/julio/2015
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
ANEXO II
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico.
MedImmune, LLC Frederick Manufacturing Center (FMC)
633/636/660 Research Court Frederick MD 21703-8619, Estados Unidos
Boehringer Ingelheim (BIB)
Pharma GmbH & Co. KG Birkendorfer StraBe 65 88397 Biberach an der Riss Alemania
Nombre y dirección del fabricante responsable de la liberación de los lotes
Schering-Plough Labo NV Industriepark 30, Heist-op-den-Berg B-2220, Bélgica
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo
acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de
Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Medidas adicionales de minimización de riesgos
Antes de la comercialización de KEYTRUDA en cada Estado Miembro, el TAC debe acordar con la Autoridad Nacional Competente el contenido y formato del programa informativo, incluidos los medios de comunicación, las modalidades de distribución y cualquier otro aspecto del programa.
El programa informativo está dirigido a incrementar el conocimiento de los médicos sobre los posibles:
• acontecimientos adversos relacionados con el sistema inmunitario
• reacciones asociadas con la perfusión
asociados con el uso de KEYTRUDA y sobre cómo controlarlos, y a aumentar el conocimiento de los pacientes y/o sus cuidadores sobre los signos y síntomas relevantes para el reconocimiento e identificación precoz de esos acontecimientos adversos.
El TAC se asegurará de que en cada Estado Miembro en el que se comercialice KEYTRUDA, todos los profesionales sanitarios y pacientes/cuidadores que se espera que prescriban y utilicen KEYTRUDA tengan acceso a o se les proporcionen los siguientes materiales informativos:
• Material informativo para el médico
• Material informativo para el paciente
El material informativo para el médico debe contener:
• La Ficha Técnica o Resumen de las Características del Producto
• Manual de preguntas frecuentes para el profesional sanitario
El Manual de preguntas frecuentes para el profesional sanitario incluirá los siguientes elementos clave:
• Lista de reacciones adversas relacionadas con el sistema inmunitario importantes y sus síntomas, incluidas las precauciones y el tratamiento, como se describen en la sección 4.4 de la Ficha Técnica o Resumen de las Características del Producto:
o Reacciones adversas relacionadas con el sistema inmunitario
■ Neumonitis
■ Colitis
■ Hepatitis
■ Nefritis
■ Endocrinopatías graves, incluyendo hipofisitis (que incluye hipopituitarismo e insuficiencia suprarrenal secundaria), diabetes mellitus tipo 1, cetoacidosis diabética, hipotiroidismo, hipertiroidismo y tiroiditis
o Otras reacciones adversas relacionadas con el sistema inmunitario incluyendo: uveítis, miositis, pancreatitis, reacciones cutáneas graves y síndrome de Guillain-Barré o Reacciones adversas asociadas a la perfusión
• Detalles sobre cómo minimizar los problemas de seguridad mediante revisión y control apropiados
• Recordatorio de distribuir el manual de información para pacientes y la tarjeta de información para pacientes.
El material informativo para el paciente debe contener:
• Manual de información para el paciente
• La Tarjeta de información para el paciente
El Manual de información para el paciente y la Tarjeta de información para el paciente incluirán los siguientes elementos clave:
• Descripción de los signos o síntomas principales de las reacciones adversas relacionadas con el sistema inmunitario y la importancia de comunicarlas inmediatamente al médico que le trata si aparecen síntomas
• La importancia de no intentar tratarse uno mismo ningún síntoma sin consultar primero con su profesional sanitario
• La importancia de llevar la Tarjeta de información para el paciente en todo momento y de enseñarla en todas las visitas médicas a profesionales sanitarios que no sean su médico prescriptor (por ej. profesionales sanitarios de urgencias).
La Tarjeta recuerda a los pacientes los síntomas principales que se deben comunicar inmediatamente al médico/enfermero. También permite anotar los datos de contacto con el médico que lo trata y avisa a otros médicos de que el paciente está en tratamiento con KEYTRUDA
• Obligación de llevar a cabo medidas post-autorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
1. Estudio de eficacia post-autorización (PAES): el TAC debe presentar el informe final del estudio del ensayo P002: Ensayo de Fase II, aleatorizado, de MK-3475 frente a quimioterapia en pacientes con melanoma avanzado - Informe final del estudio |
Primer trimestre de 2017 |
|
2. Estudio de eficacia post-autorización (PAES): el TAC debe presentar el informe final del estudio del ensayo P006: Ensayo de Fase III, multicéntrico, aleatorizado, controlado, de tres grupos, para evaluar la seguridad y la eficacia de dos esquemas de dosis de MK-3475 en comparación con ipilimumab en pacientes con melanoma avanzado - Informe final del estudio |
Primer trimestre de 2017 |
|
3. Estudio de eficacia post-autorización (PAES): para confirmar el beneficio en subgrupos de pacientes con mutación de BRAF V600 y PD-L1 negativo a la dosis recomendada, el TAC debe proporcionar análisis actualizados de los ensayos P001 y P002: • Datos actualizados de eficacia en subgrupos que comparen 2 frente a 10 mg/kg cada 3 semanas del análisis final del ensayo P002. • Datos de eficacia en subgrupos que comparen 2 frente a 10 mg/kg cada 3 semanas del ensayo P001, usando los datos desde la fecha de corte de 18 de octubre de 2014 de las Partes B2 y D del ensayo P001 por niveles de dosis. |
Primer trimestre de 2017 Tercer trimestre de 2015 |
|
Descripción |
Fecha límite |
|
4. El valor de los biomarcadores para predecir la eficacia de pembrolizumab se debe investigar con mayor profundidad, concretamente: Aunque el estado PD-L1es predictivo de respuesta en pacientes con melanoma avanzado, se han observado respuestas duraderas en pacientes PD-L1 negativo. Se debe investigar otros biomarcadores adicionales predictivos de la eficacia de pembrolizumab, distintos del estado de la expresión PD-L1 mediante inmuno histoquímica (IHQ) (por ej. PD-L2, huella RNA, etc.), junto con más información en relación con el patrón de la expresión de PD-L1 obtenida en los estudios de melanoma en marcha (P001, P002 y P006) y estudios de CPNM (P001, P010, P024 y P042): • Comparación de PD-L1 mediante tinción IHQ en tejidos de referencia y nuevas muestras de tejidos obtenidos (solo para estudios de melanoma) • Comparación de PD-L1 mediante tinción IHQ entre los tejidos tumorales pre y post tratamiento (solo para estudios de melanoma) • Datos de la huella genética Nanostring RNA • Tinción IHQ para PD-L2 • Datos sobre el RNA y el perfil sérico proteómico • Datos sobre el perfil celular inmunológico (sangre periférica) (solo para estudios de melanoma) |
Primer trimestre de 2017 Segundo trimestre de 2020 |
ANEXO III
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
KEYTRUDA 50 mg polvo para concentrado para solución para perfusión pembrolizumab
2. PRINCIPIO(S) ACTIVO(S)
Un vial de polvo contiene 50 mg de pembrolizumab. Después de la reconstitución, 1 ml de concentrado contiene 25 mg de pembrolizumab.
3. LISTA DE EXCIPIENTES
Excipientes: L-histidina, hidrocloruro de L-histidina monohidrato, sacarosa, polisorbato 80.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
polvo para concentrado para solución para perfusión 1 vial
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa.
Para un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Los viales reconstituidos y/o diluidos en bolsas de suero intravenoso se pueden conservar hasta 24 horas en nevera (entre 2°C y 8°C).
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera (entre 2°C y 8°C).
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1024/001 (1 vial)
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
VIAL
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
KEYTRUDA 50 mg polvo para concentrado para solución para perfusión
pembrolizumab
Vía intravenosa
IV
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
1. NOMBRE DEL MEDICAMENTO
KEYTRUDA 25 mg/ml concentrado para solución para perfusión
pembrolizumab
100 mg/4 ml
2. PRINCIPIO(S) ACTIVO(S)
Un vial de 4 ml contiene 100 mg de pembrolizumab. Cada ml de concentrado contiene 25 mg de pembrolizumab.
3. LISTA DE EXCIPIENTES
Excipientes: L-histidina, hidrocloruro de L-histidina monohidrato, sacarosa, polisorbato 80, agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Concentrado para solución para perfusión 1 vial
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa después de la dilución.
Para un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
No agitar.
8. FECHA DE CADUCIDAD
CAD
La solución diluida se puede conservar hasta 24 horas en nevera (entre 2°C y 8°C).
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1024/002 (1 vial)
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
VIAL
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
KEYTRUDA 25 mg/ml concentrado para solución para perfusión
pembrolizumab
100 mg/4 ml
IV
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
B. PROSPECTO
Prospecto: información para el paciente
KEYTRUDA 50 mg polvo para concentrado para solución para perfusión
pembrolizumab
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que se le administre este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Es importante que lleve siempre consigo la tarjeta de información para el paciente durante el tratamiento.
- Si tiene alguna duda, consulte a su médico.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto
1. Qué es KEYTRUDA y para qué se utiliza
2. Qué necesita saber antes de que se le administre KEYTRUDA
3. Cómo se le administra KEYTRUDA
4. Posibles efectos adversos
5. Conservación de KEYTRUDA
6. Contenido del envase e información adicional
1. Qué es KEYTRUDA y para qué se utiliza
KEYTRUDA contiene el principio activo pembrolizumab, que es un anticuerpo monoclonal. KEYTRUDA actúa ayudando a su sistema inmunitario a combatir su cáncer.
KEYTRUDA se usa en adultos para tratar:
• un tipo de cáncer de piel llamado melanoma
• un tipo de cáncer de pulmón llamado cáncer de pulmón no microcítico.
Las personas reciben KEYTRUDA cuando su cáncer se ha extendido o no se puede eliminar con cirugía.
2. Qué necesita saber antes de que se le administre KEYTRUDA
No se le debe administrar KEYTRUDA:
- si es alérgico a pembrolizumab o a alguno de los demás componentes de este medicamento (incluidos en la sección 6 “Contenido del envase e información adicional”). En caso de duda, consulte a su médico.
Advertencias y precauciones
Consulte a su médico o enfermero antes de recibir KEYTRUDA.
Antes de recibir KEYTRUDA, informe a su médico si:
- tiene una enfermedad autoinmune (una enfermedad en la que el cuerpo ataca a sus propias células)
- tiene neumonía o inflamación de los pulmones (llamada neumonitis)
- ha sido tratado previamente con ipilimumab, otro medicamento para tratar el melanoma, y ha tenido efectos adversos graves debido a este medicamento
- ha tenido una reacción alérgica a otros tratamientos con anticuerpos monoclonales
- tiene o ha tenido infección crónica del hígado por virus, como la hepatitis B o la hepatitis C
- tiene infección por el virus de la inmunodeficiencia humana (VIH) o síndrome de inmunodeficiencia adquirida (SIDA)
- tiene el hígado dañado o le han hecho un trasplante de hígado
- tiene el riñón dañado o le han hecho un trasplante de riñón.
Cuando reciba KEYTRUDA, puede sufrir algunos efectos adversos graves.
Si sufre cualquiera de las siguientes enfermedades, llame o acuda a su médico inmediatamente. Su médico puede darle otros medicamentos para prevenir complicaciones más graves y reducir sus síntomas. Su médico puede retrasar la dosis siguiente de KEYTRUDA o interrumpir el tratamiento con KEYTRUDA.
- inflamación de los pulmones, que puede incluir dificultad para respirar, dolor en el pecho o tos
- inflamación de los intestinos que puede incluir diarrea o más movimientos de lo habitual del
intestino, heces negras, alquitranadas, pegajosas o heces con sangre o moco, dolor o hipersensibilidad de estómago intensa, náuseas, vómitos
- inflamación del hígado, que puede incluir náuseas o vómitos, sensación de menos hambre, dolor en la parte derecha del estómago, coloración amarilla de la piel o de la parte blanca de los ojos, orina oscura, o sangrado o formación de moretones con más facilidad de lo habitual
- inflamación de los riñones, que puede incluir cambios en la cantidad o el color de la orina
- inflamación de las glándulas hormonales (especialmente la tiroides, la hipófisis y las glándulas
suprarrenales), que puede incluir latido rápido del corazón, pérdida de peso, aumento de la sudoración, aumento de peso, pérdida de pelo, sensación de frío, estreñimiento, voz más grave, dolores musculares, mareos o desmayos, dolores de cabeza que no se van o dolor de cabeza inusual
- diabetes tipo 1, que puede incluir sensación de más hambre o sed de lo normal, necesidad de orinar con más frecuencia, o pérdida de peso
- inflamación de los ojos, que puede incluir cambios en la vista
- inflamación de los músculos, que puede incluir dolor o debilidad de los músculos
- inflamación del páncreas, que puede incluir dolor abdominal, náuseas y vómitos
- inflamación de la piel, que puede incluir erupción
- reacciones a la perfusión, que pueden incluir dificultad para respirar, picor o erupción, mareos o fiebre
Niños y adolescentes
KEYTRUDA no se debe usar en niños y adolescentes menores de 18 años.
Uso de KEYTRUDA con otros medicamentos
Consulte a su médico
- Si está tomando otros medicamentos que debilitan su sistema inmunitario. Algunos ejemplos de éstos podrían ser los corticosteroides, como la prednisona. Estos medicamentos pueden influir en el efecto de KEYTRUDA. Sin embargo, una vez que esté en tratamiento con KEYTRUDA, su médico puede darle corticosteroides para reducir los efectos adversos que pueda tener con KEYTRUDA.
- Si está tomando, ha tomado recientemente o pudiera tener que tomar otros medicamentos. Embarazo
- No debe usar KEYTRUDA si está embarazada a menos que su médico se lo recomiende específicamente.
- Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico.
- KEYTRUDA puede causar daño o la muerte a su bebé no nacido.
- Si es usted una mujer que podría quedarse embarazada, debe usar un método anticonceptivo adecuado mientras esté recibiendo tratamiento con KEYTRUDA y durante al menos 4 meses después de su última dosis.
Lactancia
- Si está en periodo de lactancia, consulte a su médico.
- No dé el pecho mientras tome KEYTRUDA.
- Se desconoce si KEYTRUDA pasa a la leche materna.
Conducción y uso de máquinas
No conduzca ni use máquinas después de que se le haya administrado KEYTRUDA a menos que esté seguro de que se encuentra bien. Sentirse cansado o débil es un efecto adverso muy frecuente de KEYTRUDA. Esto puede afectar a su capacidad para conducir o usar máquinas.
3. Cómo se le administra KEYTRUDA
KEYTRUDA se le administrará en un hospital o clínica bajo la supervisión de un médico experimentado en el tratamiento del cáncer.
- Su médico le administrará KEYTRUDA mediante una perfusión en la vena (IV) durante unos 30 minutos, cada 3 semanas.
- Su médico decidirá cuántos tratamientos necesita.
La dosis recomendada es de 2 mg de pembrolizumab por kilogramo de peso corporal.
Si falta a una cita para recibir KEYTRUDA
- Llame a su médico inmediatamente para volver a programar su cita.
- Es muy importante que no omita ninguna dosis de este medicamento.
Si se interrumpe el tratamiento con KEYTRUDA
Interrumpir su tratamiento puede detener el efecto del medicamento. No interrumpa el tratamiento con KEYTRUDA a menos que lo haya comentado con su médico.
Si tiene cualquier otra duda sobre su tratamiento, pregunte a su médico.
Encontrará también esta información en la tarjeta de información para el paciente que le ha dado su médico. Es importante que guarde esta tarjeta de información y se la enseñe a su pareja o cuidadores.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Cuando reciba KEYTRUDA, puede sufrir efectos adversos graves. Ver sección 2.
Se han comunicado los siguientes efectos adversos en ensayos clínicos:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
- diarrea; náuseas
- picor; erupción en la piel
- dolor en las articulaciones
- sensación de cansancio
Frecuentes (pueden afectar hasta 1 de cada 10 personas)
- disminución del número de glóbulos rojos
- problemas en las glándulas de la tiroides; sofocos
- tener menos hambre
- dolor de cabeza; mareo; cambio en su sentido del gusto
- inflamación de los pulmones; respiración entrecortada; tos
- inflamación de los intestinos; sequedad de boca
- ojo seco
- dolor de estómago; estreñimiento; vómitos
- erupción inflamada enrojecida, a veces con ampollas; zonas de la piel que han perdido el color; problema de la piel parecido al acné; sequedad y picor en la piel
- dolor muscular, dolores continuos o hipersensibilidad; dolor en los músculos y en los huesos; dolor en los brazos o las piernas; dolor de las articulaciones con hinchazón
- hinchazón; cansancio o debilidad inusual; escalofríos; enfermedad parecida a la gripe; fiebre
- niveles elevados de enzimas del hígado en la sangre; pruebas anormales de la función renal
- reacciones asociadas a la perfusión del medicamento
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
- número de glóbulos blancos disminuido (neutrófilos, leucocitos, linfocitos y eosinófilos); disminución en el número de plaquetas (moratones o sangrado con mayor facilidad)
- inflamación de la glándula pituitaria situada en la base del cerebro; disminución de la secreción de hormonas producida por las glándulas suprarrenales; inflamación de la tiroides
- diabetes tipo 1; disminución de sodio, potasio y calcio en la sangre
- dificultad para dormir
- convulsiones; falta de energía; inflamación de los nervios causando entumecimiento, debilidad, hormigueo o ardor de los brazos y de las piernas
- inflamación de los ojos; dolor, irritación, picor o enrojecimiento de los ojos; sensación de incomodidad a la luz; ver puntos
- presión sanguínea alta
- inflamación del páncreas
- inflamación del hígado
- engrasamiento o descamación de la piel; pérdida de pelo; protuberancias rojas blandas bajo la piel; inflamación de la piel; cambios en el color del pelo; pequeñas protuberancias, bultos o ampollas en la piel
- inflamación del tejido que rodea a los tendones
- inflamación de los riñones
- aumento de los niveles de amilasa, una enzima que descompone el almidón; aumento de calcio en la sangre
Raros (pueden afectar hasta 1 de cada 1.000 personas)
- respuesta inflamatoria contra las plaquetas o los glóbulos rojos
- inflamación temporal de los nervios que causa dolor, debilidad y parálisis en las extremidades; condición en la que los músculos se debilitan y se cansan fácilmente
- perforación en el intestino delgado
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de KEYTRUDA
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en el vial después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C).
Se ha demostrado la estabilidad química y física en uso de la solución reconstituida y diluida durante 24 horas a temperatura ambiente (a o por debajo de 25°C). Desde un punto de vista microbiológico, el producto se debe usar inmediatamente. No se debe congelar la solución reconstituida o diluida. Si no
se usa inmediatamente, los tiempos y condiciones de conservación en uso antes de su utilización son responsabilidad del usuario y no deben ser superiores a un total de 24 horas. Este tiempo de conservación de 24 horas puede incluir hasta 6 horas a temperatura ambiente (a o por debajo de 25°C); en cualquier tiempo de espera restante, la temperatura debe ser de entre 2°C y 8°C. Si se refrigera, se debe dejar que los viales y/o las bolsas intravenosas alcancen la temperatura ambiente antes de su uso.
No conservar ninguna parte no utilizada de la solución para perfusión para su reutilización. Todo medicamento no utilizado o material residual se debe eliminar de acuerdo con los requisitos locales.
6. Contenido del envase e información adicional Composición de KEYTRUDA
El principio activo es pembrolizumab. Un vial contiene 50 mg de pembrolizumab.
Después de la reconstitución, 1 ml de concentrado contiene 25 mg de pembrolizumab.
Los demás componentes son L-histidina, hidrocloruro de L-histidina monohidrato, sacarosa y polisorbato 80.
Aspecto de KEYTRUDA y contenido del envase
KEYTRUDA es un polvo liofilizado de color blanco a blanquecino.
Está disponible en cajas que contienen un vial de vidrio.
Titular de la autorización de comercialización
Merck Sharp & Dohme Limited
Hertford Road
Hoddesdon
Hertfordshire EN11 9BU Reino Unido
Responsable de la fabricación
Schering-Plough Labo NV Industriepark 30 B-2220 Heist-op-den-Berg Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Lietuva
UAB Merck Sharp & Dohme Tel. + 370 5 278 02 47 msd_lietuva@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL Tél/Tel: +32(0)27766211 dpoc_belux@merck.com
Magyarország
MSD Pharma Hungary Kft Tel.: +36 1 888 5300 hungary_msd@merck.com
Belgie/Belgique/Belgien
MSD Belgium BVBA/SPRL
Tél/Tel: 0800 38 693 (+32(0)27766211)
Etarapna
MepK fflapn h floyM Buarapua EOOfl Tea.: +359 2 819 3737 info-msdbg@merck.com
Ceská republika
Merck Sharp & Dohme s.r.o. Tel: +420 233 010 111 dpoc_czechslovak@merck.com
|
Danmark MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com |
Malta Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta info@merck.com |
|
Deutschland MSD SHARP & DOHME GMBH Tel: 0800 673 673 673 (+49 (0) 89 4561 2612) |
Nederland Merck Sharp & Dohme BV Tel: 0800 9999000 (+31 23 5153153) medicalinfo.nl@merck.com |
|
Eesti Merck Sharp & Dohme OÜ Tel.: +372 6144 200 msdeesti@merck.com |
Norge MSD (Norge) AS Tlf: +47 32 20 73 00 msdnorge@msd.no |
|
EXXáSa MSD A.O.B.E.E. T^: +30 210 98 97 300 dpoc_greece@merck.com |
Osterreich Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 msd-medizin@merck.com |
|
España Merck Sharp & Dohme de España, S.A. Tel: +34 91 321 06 00 msd info@merck.com |
Polska MSD Polska Sp. z o.o. Tel: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél: + 33 (0) 1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: +351 21 4465700 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia info@merck.com |
Romanía Merck Sharp & Dohme Romania S.R.L. Tel: +40 21 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o Tel: +386 1 5204 201 msd.slovenia@merck.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika Merck Sharp & Dohme, s. r. o. Tel: +421 2 58282010 dpoc_czechslovak@merck.com |
|
Italia MSD Italia S.r.l. Tel: +39 06 361911 medicalinformation.it@merck.com |
Suomi/Finland MSD Finland Oy Puh/Tel: +358 (0)9 804 650 info@msd.fi |
Kúrcpog
Merck Sharp & Dohme Cyprus Limited TpL: 800 00 673 (+357 22866700) cyprus_info@merck.com
Latvija
SIA Merck Sharp & Dohme Latvija Tel: + 371 67364224 msd_lv@merck.com
Sverige
Merck Sharp & Dohme (Sweden) AB Tel: +46 77 5700488 medicinskinfo@merck.com
United Kingdom
Merck Sharp & Dohme Limited Tel: +44 (0) 1992 467272 medicalinformationuk@merck.com
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
Preparación y administración
• Antes de la reconstitución, el vial de polvo liofilizado puede estar fuera de la nevera (temperaturas a o por debajo de 25°C) hasta 24 horas.
• Añadir asépticamente 2,3 ml de agua para preparaciones inyectables para obtener una solución de 25 mg/ml (pH 5,2-5,8) de KEYTRUDA. Cada vial contiene un exceso de llenado de 10 mg (0,4 ml) para asegurar la recuperación de 50 mg de KEYTRUDA por vial. Después de la reconstitución, 1 ml de concentrado contiene 25 mg de pembrolizumab.
• Para evitar la formación de espuma, verter el agua por las paredes del vial y no directamente sobre el polvo liofilizado.
• Girar lentamente el vial para permitir la reconstitución del polvo liofilizado. Dejar que pasen hasta 5 minutos para que se eliminen las burbujas. No agitar el vial.
• Los medicamentos parenterales se deben inspeccionar visualmente por si tienen partículas extrañas y cambio de color antes de la administración. KEYTRUDA reconstituido es una solución transparente a ligeramente opalescente, incolora a ligeramente amarilla. Desechar el vial si se observan partículas visibles.
• Extraer el volumen necesario hasta 2 ml (50 mg) de KEYTRUDA y transferirlo a una bolsa para administración intravenosa que contenga 9 mg/ml de cloruro sódico (0,9%) o 50 mg/ml de glucosa (5%) para preparar una solución diluida con una concentración final que vaya de 1a 10 mg/ml. Mezclar la solución diluida mediante inversión suave.
• Se ha demostrado la estabilidad química y física en uso de la solución reconstituida y diluida durante 24 horas a temperatura ambiente (a o por debajo de 25°C). Desde un punto de vista microbiológico, el producto se debe usar inmediatamente. No se debe congelar la solución reconstituida o diluida. Si no se usa inmediatamente, los tiempos y condiciones de conservación en uso antes de utilizarlo son responsabilidad del usuario y no deben ser superiores a un total de 24 horas. Este periodo de 24 horas puede incluir hasta 6 horas a temperatura ambiente (a o por debajo de 25°C); en cualquier tiempo de espera restante la temperatura debe ser de entre 2°C y 8°C. Si se refrigera, se debe dejar que los viales y/o las bolsas intravenosas alcancen la temperatura ambiente antes de su uso. Administrar la solución de perfusión por vía intravenosa durante 30 minutos, usando un filtro de 0,2 a 5 pm, estéril, no pirógeno, de baja unión a proteínas, conectado en línea o añadido.
• No administrar junto con otros medicamentos a través de la misma vía de perfusión.
• KEYTRUDA es para un solo uso. Desechar cualquier parte no utilizada que quede en el vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto
con él se realizará de acuerdo con la normativa local.
Prospecto: información para el paciente
KEYTRUDA 25 mg/ml concentrado para solución para perfusión
pembrolizumab
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que se le administre este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Es importante que lleve siempre consigo la tarjeta de información para el paciente durante el tratamiento.
- Si tiene alguna duda, consulte a su médico.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto
1. Qué es KEYTRUDA y para qué se utiliza
2. Qué necesita saber antes de que se le administre KEYTRUDA
3. Cómo se le administra KEYTRUDA
4. Posibles efectos adversos
6. Conservación de KEYTRUDA 6. Contenido del envase e información adicional
1. Qué es KEYTRUDA y para qué se utiliza
KEYTRUDA contiene el principio activo pembrolizumab, que es un anticuerpo monoclonal. KEYTRUDA actúa ayudando a su sistema inmunitario a combatir su cáncer.
KEYTRUDA se usa en adultos para tratar:
• un tipo de cáncer de piel llamado melanoma
• un tipo de cáncer de pulmón llamado cáncer de pulmón no microcítico.
Las personas reciben KEYTRUDA cuando su cáncer se ha extendido o no se puede eliminar con cirugía.
2. Qué necesita saber antes de que se le administre KEYTRUDA
No se le debe administrar KEYTRUDA:
- si es alérgico a pembrolizumab o a alguno de los demás componentes de este medicamento (incluidos en la sección 6 “Contenido del envase e información adicional”). En caso de duda, consulte a su médico.
Advertencias y precauciones
Consulte a su médico o enfermero antes de recibir KEYTRUDA.
Antes de recibir KEYTRUDA, informe a su médico si:
- tiene una enfermedad autoinmune (una enfermedad en la que el cuerpo ataca a sus propias células)
- tiene neumonía o inflamación de los pulmones (llamada neumonitis)
- ha sido tratado previamente con ipilimumab, otro medicamento para tratar el melanoma, y ha tenido efectos adversos graves debido a este medicamento
- ha tenido una reacción alérgica a otros tratamientos con anticuerpos monoclonales
- tiene o ha tenido infección crónica del hígado por virus, como la hepatitis B o la hepatitis C
- tiene infección por el virus de la inmunodeficiencia humana (VIH) o síndrome de inmunodeficiencia adquirida (SIDA)
- tiene el hígado dañado o le han hecho un trasplante de hígado
- tiene el riñón dañado o le han hecho un trasplante de riñón.
Cuando reciba KEYTRUDA, puede sufrir algunos efectos adversos graves.
Si sufre cualquiera de las siguientes enfermedades, llame o acuda a su médico inmediatamente. Su médico puede darle otros medicamentos para prevenir complicaciones más graves y reducir sus síntomas. Su médico puede retrasar la dosis siguiente de KEYTRUDA o interrumpir el tratamiento con KEYTRUDA.
- inflamación de los pulmones, que puede incluir dificultad para respirar, dolor en el pecho o tos
- inflamación de los intestinos que puede incluir diarrea o más movimientos de lo habitual del
intestino, heces negras, alquitranadas, pegajosas o heces con sangre o moco, dolor o hipersensibilidad de estómago intensa, náuseas, vómitos
- inflamación del hígado, que puede incluir náuseas o vómitos, sensación de menos hambre, dolor en la parte derecha del estómago, coloración amarilla de la piel o de la parte blanca de los ojos, orina oscura, o sangrado o formación de moretones con más facilidad de lo habitual
- inflamación de los riñones, que puede incluir cambios en la cantidad o el color de la orina
- inflamación de las glándulas hormonales (especialmente la tiroides, la hipófisis y las glándulas
suprarrenales), que puede incluir latido rápido del corazón, pérdida de peso, aumento de la sudoración, aumento de peso, pérdida de pelo, sensación de frío, estreñimiento, voz más grave, dolores musculares, mareos o desmayos, dolores de cabeza que no se van o dolor de cabeza inusual
- diabetes tipo 1, que puede incluir sensación de más hambre o sed de lo normal, necesidad de orinar con más frecuencia, o pérdida de peso
- inflamación de los ojos, que puede incluir cambios en la vista
- inflamación de los músculos, que puede incluir dolor o debilidad de los músculos
- inflamación del páncreas, que puede incluir dolor abdominal, náuseas y vómitos
- inflamación de la piel, que puede incluir erupción
- reacciones a la perfusión, que pueden incluir dificultad para respirar, picor o erupción, mareos o fiebre
Niños y adolescentes
KEYTRUDA no se debe usar en niños y adolescentes menores de 18 años.
Uso de KEYTRUDA con otros medicamentos
Consulte a su médico
- Si está tomando otros medicamentos que debilitan su sistema inmunitario. Algunos ejemplos de éstos podrían ser los corticosteroides, como la prednisona. Estos medicamentos pueden influir en el efecto de KEYTRUDA. Sin embargo, una vez que esté en tratamiento con KEYTRUDA, su médico puede darle corticosteroides para reducir los efectos adversos que pueda tener con KEYTRUDA.
- Si está tomando, ha tomado recientemente o pudiera tener que tomar otros medicamentos. Embarazo
- No debe usar KEYTRUDA si está embarazada a menos que su médico se lo recomiende específicamente.
- Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico.
- KEYTRUDA puede causar daño o la muerte a su bebé no nacido.
- Si es usted una mujer que podría quedarse embarazada, debe usar un método anticonceptivo adecuado mientras esté recibiendo tratamiento con KEYTRUDA y durante al menos 4 meses después de su última dosis.
Lactancia
- Si está en periodo de lactancia, consulte a su médico.
- No dé el pecho mientras tome KEYTRUDA.
- Se desconoce si KEYTRUDA pasa a la leche materna.
Conducción y uso de máquinas
No conduzca ni use máquinas después de que se le haya administrado KEYTRUDA a menos que esté seguro de que se encuentra bien. Sentirse cansado o débil es un efecto adverso muy frecuente de KEYTRUDA. Esto puede afectar a su capacidad para conducir o usar máquinas.
3. Cómo se le administra KEYTRUDA
KEYTRUDA se le administrará en un hospital o clínica bajo la supervisión de un médico experimentado en el tratamiento del cáncer.
- Su médico le administrará KEYTRUDA mediante una perfusión en la vena (IV) durante unos 30 minutos, cada 3 semanas.
- Su médico decidirá cuántos tratamientos necesita.
La dosis recomendada es de 2 mg de pembrolizumab por kilogramo de peso corporal.
Si falta a una cita para recibir KEYTRUDA
- Llame a su médico inmediatamente para volver a programar su cita.
- Es muy importante que no omita ninguna dosis de este medicamento.
Si se interrumpe el tratamiento con KEYTRUDA
Interrumpir su tratamiento puede detener el efecto del medicamento. No interrumpa el tratamiento con KEYTRUDA a menos que lo haya comentado con su médico.
Si tiene cualquier otra duda sobre su tratamiento, pregunte a su médico.
Encontrará también esta información en la tarjeta de información para el paciente que le ha dado su médico. Es importante que guarde esta tarjeta de información y se la enseñe a su pareja o cuidadores.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Cuando reciba KEYTRUDA, puede sufrir efectos adversos graves. Ver sección 2.
Se han comunicado los siguientes efectos adversos en ensayos clínicos:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
- diarrea; náuseas
- picor; erupción en la piel
- dolor en las articulaciones
- sensación de cansancio
Frecuentes (pueden afectar hasta 1 de cada 10 personas)
- disminución del número de glóbulos rojos
- problemas en las glándulas de la tiroides; sofocos
- tener menos hambre
- dolor de cabeza; mareo; cambio en su sentido del gusto
- inflamación de los pulmones; respiración entrecortada; tos
- inflamación de los intestinos; sequedad de boca
- ojo seco
- dolor de estómago; estreñimiento; vómitos
- erupción inflamada enrojecida, a veces con ampollas; zonas de la piel que han perdido el color; problema de la piel parecido al acné; sequedad y picor en la piel
- dolor muscular, dolores continuos o hipersensibilidad; dolor en los músculos y en los huesos; dolor en los brazos o las piernas; dolor de las articulaciones con hinchazón
- hinchazón; cansancio o debilidad inusual; escalofríos; enfermedad parecida a la gripe; fiebre
- niveles elevados de enzimas del hígado en la sangre; pruebas anormales de la función renal
- reacciones asociadas a la perfusión del medicamento
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
- número de glóbulos blancos disminuido (neutrófilos, leucocitos, linfocitos y eosinófilos); disminución en el número de plaquetas (moratones o sangrado con mayor facilidad)
- inflamación de la glándula pituitaria situada en la base del cerebro; disminución de la secreción de hormonas producida por las glándulas suprarrenales; inflamación de la tiroides
- diabetes tipo 1; disminución de sodio, potasio y calcio en la sangre
- dificultad para dormir
- convulsiones; falta de energía; inflamación de los nervios causando entumecimiento, debilidad, hormigueo o ardor de los brazos y de las piernas
- inflamación de los ojos; dolor, irritación, picor o enrojecimiento de los ojos; sensación de incomodidad a la luz; ver puntos
- presión sanguínea alta
- inflamación del páncreas
- inflamación del hígado
- engrasamiento o descamación de la piel; pérdida de pelo; protuberancias rojas blandas bajo la piel; inflamación de la piel; cambios en el color del pelo; pequeñas protuberancias, bultos o ampollas en la piel
- inflamación del tejido que rodea a los tendones
- inflamación de los riñones
- aumento de los niveles de amilasa, una enzima que descompone el almidón; aumento de calcio en la sangre
Raros (pueden afectar hasta 1 de cada 1.000 personas)
- respuesta inflamatoria contra las plaquetas o los glóbulos rojos
- inflamación temporal de los nervios que causa dolor, debilidad y parálisis en las extremidades; condición en la que los músculos se debilitan y se cansan fácilmente
- perforación en el intestino delgado
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de KEYTRUDA
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en el vial después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Se ha demostrado la estabilidad química y física en uso de la solución diluida durante 24 horas a temperatura ambiente (a o por debajo de 25°C). Desde un punto de vista microbiológico, el producto se debe usar inmediatamente. No se debe congelar la solución diluida. Si no se usa inmediatamente, los tiempos y condiciones de conservación en uso antes de su utilización son responsabilidad del usuario y no deben ser superiores a un total de 24 horas. Este tiempo de conservación de 24 horas puede incluir hasta 6 horas a temperatura ambiente (a o por debajo de 25°C); en cualquier tiempo de espera restante, la temperatura debe ser de entre 2°C y 8°C. Si se refrigera, se debe dejar que los viales y/o las bolsas intravenosas alcancen la temperatura ambiente antes de su uso.
No conservar ninguna parte no utilizada de la solución para perfusión para su reutilización. Todo medicamento no utilizado o material residual se debe eliminar de acuerdo con los requisitos locales.
6. Contenido del envase e información adicional
Composición de KEYTRUDA
El principio activo es pembrolizumab.
Un vial de 4 ml contiene 100 mg de pembrolizumab.
Cada ml de concentrado contiene 25 mg de pembrolizumab.
Los demás componentes son L-histidina, hidrocloruro de L-histidina monohidrato, sacarosa, polisorbato 80 y agua para preparaciones inyectables.
Aspecto de KEYTRUDA y contenido del envase
KEYTRUDA es una solución transparente a ligeramente opalescente, incolora a ligeramente amarilla, con pH entre 5,2 y 5,8.
Está disponible en cajas que contienen un vial de vidrio.
Titular de la autorización de comercialización
Merck Sharp & Dohme Limited
Hertford Road
Hoddesdon
Hertfordshire EN11 9BU Reino Unido
Responsable de la fabricación
Schering-Plough Labo NV Industriepark 30 B-2220 Heist-op-den-Berg Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Lietuva
UAB Merck Sharp & Dohme Tel. + 370 5 278 02 47 msd_lietuva@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL Tél/Tel: +32(0)27766211 dpoc_belux@merck.com
Belgie/Belgique/Belgien
MSD Belgium BVBA/SPRL
Tél/Tel: 0800 38 693 (+32(0)27766211)
Etarapna
MepK fflapn h floyM Etarapua EOOfl Tea.: +359 2 819 3737 info-msdbg@merck.com
|
Ceská republika Merck Sharp & Dohme s.r.o. Tel: +420 233 010 111 dpoc_czechslovak@merck.com |
Magyarország MSD Pharma Hungary Kft Tel.: +36 1 888 5300 hungary_msd@merck.com |
|
Danmark MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com |
Malta Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com |
|
Deutschland MSD SHARP & DOHME GMBH Tel: 0800 673 673 673 (+49 (0) 89 4561 2612) |
Nederland Merck Sharp & Dohme BV Tel: 0800 9999000 (+31 23 5153153) medicalinfo.nl@merck.com |
|
Eesti Merck Sharp & Dohme OÜ Tel.: +372 6144 200 msdeesti@merck.com |
Norge MSD (Norge) AS Tlf: +47 32 20 73 00 msdnorge@msd.no |
|
EXXáSa MSD A.O.B.E.E. Tp^: +30 210 98 97 300 dpoc_greece@merck.com |
Osterreich Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 msd-medizin@merck.com |
|
España Merck Sharp & Dohme de España, S.A. Tel: +34 91 321 06 00 msd_info@merck.com |
Polska MSD Polska Sp. z o.o. Tel: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél: + 33 (0) 1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: +351 21 4465700 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia info@merck.com |
Romanía Merck Sharp & Dohme Romania S.R.L. Tel: +40 21 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o Tel: +386 1 5204 201 msd.slovenia@merck.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika Merck Sharp & Dohme, s. r. o. Tel: +421 2 58282010 dpoc_czechslovak@merck.com |
Italia
MSD Italia S.r.l.
Tel: +39 06 361911 medicalinformation.it@merck.com
Kúrcpog
Merck Sharp & Dohme Cyprus Limited TqA.: 800 00 673 (+357 22866700) cyprus_info@merck.com
Latvija
SIA Merck Sharp & Dohme Latvija Tel: + 371 67364224 msd_lv@merck.com
Suomi/Finland
MSD Finland Oy Puh/Tel: +358 (0)9 804 650 info@msd.fi
Sverige
Merck Sharp & Dohme (Sweden) AB Tel: +46 77 5700488 medicinskinfo@merck.com
United Kingdom
Merck Sharp & Dohme Limited Tel: +44 (0) 1992 467272 medicalinformationuk@merck.com
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
Preparación y administración de la perfusión
• No agitar el vial.
• Mantener el vial a temperatura ambiente (a o por debajo de 25°C). Antes de la dilución, el vial de líquido puede estar fuera de la nevera (temperaturas a o por debajo de 25°C) hasta 24 horas. Los medicamentos parenterales se deben inspeccionar visualmente por si tienen partículas extrañas y cambio de color antes de la administración. El concentrado es una solución transparente a ligeramente opalescente, incolora a ligeramente amarilla. Desechar el vial si se observan partículas visibles.
• Extraer el volumen necesario hasta 4 ml (100 mg) de concentrado y transferirlo a una bolsa para administración intravenosa que contenga 9 mg/ml de cloruro sódico (0,9%) o 50 mg/ml de glucosa (5%) para preparar una solución diluida con una concentración final que vaya de 1a 10 mg/ml. Cada vial contiene un exceso de llenado de 0,25 ml (4,25 ml de contenido total por vial) para asegurar la recuperación de 4 ml de concentrado. Mezclar la solución diluida mediante inversión suave.
• Se ha demostrado la estabilidad química y física en uso de la solución diluida durante 24 horas a temperatura ambiente (a o por debajo de 25°C). Desde un punto de vista microbiológico, el producto se debe usar inmediatamente. No se debe congelar la solución diluida. Si no se usa inmediatamente, los tiempos y condiciones de conservación en uso antes de utilizarlo son responsabilidad del usuario y no deben ser superiores a un total de 24 horas. Este periodo de 24 horas puede incluir hasta 6 horas a temperatura ambiente (a o por debajo de 25°C); en cualquier tiempo de espera restante la temperatura debe ser de entre 2°C y 8°C. Si se refrigera, se debe dejar que los viales y/o las bolsas intravenosas alcancen la temperatura ambiente antes de su uso. Administrar la solución de perfusión por vía intravenosa durante 30 minutos, usando un filtro de 0,2 a 5 pm, estéril, no pirógeno, de baja unión a proteínas, conectado en línea o añadido.
• No administrar junto con otros medicamentos a través de la misma vía de perfusión.
• KEYTRUDA es para un solo uso. Desechar cualquier parte no utilizada que quede en el vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto
con él se realizará de acuerdo con la normativa local.
80