Instanyl 200 Microgramos Solucion Para Pulverizacion Nasal En Envase Unidosis
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Instanyl 50 microgramos/dosis solución para pulverización nasal Instanyl 100 microgramos/dosis solución para pulverización nasal Instanyl 200 microgramos/dosis solución para pulverización nasal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Instanyl 50 microgramos/dosis solución para pulverización nasal
Cada ml de solución contiene citrato de fentanilo equivalente a 500 microgramos de fentanilo.
1 dosis (100 microlitros) contiene 50 microgramos de fentanilo.
Instanyl 100 microgramos/dosis solución para pulverización nasal
Cada ml de solución contiene citrato de fentanilo equivalente a 1000 microgramos de fentanilo. 1 dosis (100 microlitros) contiene 100 microgramos de fentanilo.
Instanyl 200 microgramos/dosis solución para pulverización nasal
Cada ml de solución contiene citrato de fentanilo equivalente a 2000 microgramos de fentanilo. 1 dosis (100 microlitros) contiene 200 microgramos de fentanilo.
Para consultar la lista completa de excipientes ver sección 6.1
3. FORMA FARMACÉUTICA
Solución para pulverización nasal (pulverizador nasal). Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Instanyl está indicado para el tratamiento del dolor irruptivo en adultos que ya reciben tratamiento de mantenimiento con opioides para el dolor crónico oncológico. El dolor irruptivo es una exacerbación transitoria del dolor que se produce sobre una base de dolor persistente controlado por otros medios. Los pacientes en tratamiento de mantenimiento con opioides son los que reciben al menos 60 mg de morfina oral al día, al menos 25 microgramos de fentanilo transdérmico cada hora, al menos 30 mg de oxicodona al día, al menos 8 mg de hidromorfona al día o una dosis equianalgésica de otro opioide durante un mínimo de una semana
4.2 Posología y forma de administración
El tratamiento debe ser instaurado y seguido bajo la supervisión de un médico con experiencia en el uso de opioides en pacientes oncológicos. Los médicos deben considerar el riesgo del abuso de fentanilo.
Posología
Se deberá ajustar individualmente la dosis hasta obtener una analgesia adecuada con reacciones adversas tolerables. Durante el proceso de ajuste de la dosis se realizará una estrecha monitorización a los pacientes.
El ajuste a dosis más altas requiere la intervención de un profesional sanitario.
En los ensayos clínicos la dosis de Instanyl utilizada para el tratamiento del dolor irruptivo fue independiente de la dosis diaria de mantenimiento con opioides (ver sección 5.1).
Dosis diaria máxima: tratamiento de un máximo de cuatro episodios de dolor irruptivo, administrándose en cada episodio un máximo de dos dosis, con una separación entre ambas de al menos 10 minutos.
Durante la titulación y la terapia de mantenimiento, el paciente deberá esperar al menos 4 horas antes de tratar con Instanyl otro episodio de dolor irruptivo.
Titulación o ajuste de la dosis
Antes de ajustar la dosis de Instanyl, se confirmará que el dolor de base persistente está controlado mediante terapia crónica con opioides y que no padecen más de cuatro episodios de dolor irruptivo al día.
Ajuste de la dosis
La concentración inicial deberá ser una dosis de 50 microgramos en una fosa nasal, ajustando a dosis superiores según sea necesario dentro del rango de concentraciones disponibles (50, 100 y 200 microgramos). Si no se obtiene la analgesia adecuada, se puede administrar de nuevo la misma dosis una vez transcurridos un mínimo de 10 minutos. Cada etapa del ajuste de la dosis (concentración de la dosis) se deberá evaluar en varios episodios.
Terapia de mantenimiento
Una vez se ha establecido la dosis de acuerdo con las etapas descritas anteriormente, se deberá mantener al paciente con esta concentración de Instanyl. Si el paciente experimenta un alivio insuficiente del dolor se puede administrar de nuevo la misma dosis una vez transcurridos un mínimo de 10 minutos.
Ajuste de la dosis
En general, se deberá aumentar la concentración de mantenimiento con Instanyl cuando un paciente requiera más de una dosis por episodio de dolor irruptivo durante varios episodios consecutivos. Puede ser necesario ajustar la dosis del tratamiento de base con opioides si el paciente presenta de forma continuada más de cuatro episodios de dolor irruptivo cada 24 horas.
Si las reacciones adversas son intolerables o persistentes, se deberá reducir la dosis o bien reemplazar el tratamiento con Instanyl por otros analgésicos.
Interrupción del tratamiento
Se deberá suspender inmediatamente el tratamiento con Instanyl si el paciente deja de padecer episodios de dolor irruptivo. El tratamiento para el dolor de base persistente deberá mantenerse según lo prescrito.
En caso de que sea necesario interrumpir el tratamiento con opioides, se realizará un estrecho control médico al paciente para evitar los efectos repentinos de la retirada, ya que los opioides requieren una reducción gradual de la dosis.
Poblaciones especiales
Pacientes de edad avanzada
Se dispone de datos escasos sobre la farmacocinética, eficacia y seguridad del uso de Instanyl en pacientes mayores de 65 años de edad. Los pacientes de edad avanzada pueden padecer una reducción del aclaramiento, una semivida más prolongada y una mayor sensibilidad al fentanilo que pacientes más jóvenes. Por lo tanto, se deberá tener precaución en el tratamiento de pacientes de edad avanzada, caquécticos o debilitados.
En los ensayos clínicos, los pacientes de edad avanzada mostraron tendencia a una titulación de dosis efectiva más baja que los pacientes de 65 años de edad. Se deberá tener especial precaución en el ajuste de dosis de Instanyl en pacientes de edad avanzada.
Insuficiencia hepática
Se deberá administrar Instanyl con precaución en pacientes con insuficiencia hepática de moderada a grave (ver sección 4.4).
Insuficiencia renal
Se deberá administrar Instanyl con precaución en pacientes con insuficiencia renal de moderada a grave (ver sección 4.4).
Población pediátrica
No se ha establecido la seguridad y eficacia de Instanyl en niños menores de 18 años de edad. No hay datos disponibles.
Forma de administración:
Instanyl se administra por vía nasal.
Se recomienda que el paciente permanezca sentado o de pie en posición erguida cuando se administre Instanyl.
Después de cada utilización es necesario limpiar el extremo del pulverizador nasal.
Precauciones que se deben tomar antes de manipular o administrar el medicamento
Antes de utilizar Instanyl por primera vez, se debe preparar el pulverizador nasal hasta que aparezca
una vaporización fina; normalmente se necesitan de 3 a 4 pulsaciones del pulverizador nasal.
Si el medicamento no se ha utilizado durante un periodo de más de siete días, se debe pulsar el pulverizador nasal una vez para eliminar el medicamento sobrante antes de administrar la siguiente dosis.
Durante el proceso de cebado se expulsará parte del medicamento. En consecuencia, se debe instruir al paciente para que ese proceso se realice en zonas bien ventiladas, apuntando lejos de sí o de otras personas, y lejos de superficies u objetos que puedan entrar en contacto con otras personas, en especial niños.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Pacientes que no estén en tratamiento de mantenimiento con opioides, por el mayor riesgo de depresión respiratoria.
Tratamiento del dolor agudo distinto al dolor irruptivo.
Depresión respiratoria grave o enfermedades pulmonares obstructivas graves.
Radioterapia facial previa
Episodios recurrentes de epistaxis (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Depresión respiratoria
Fentanilo puede provocar depresión respiratoria clínicamente significativa y, por tanto, este efecto se deberá vigilar en los pacientes. Los pacientes con dolor que reciben tratamiento crónico con opioides desarrollan tolerancia a la depresión respiratoria, por lo tanto, en estos pacientes se reduce el riesgo de depresión respiratoria. El uso concomitante de depresores del sistema nervioso central puede aumentar el riesgo de depresión respiratoria (ver sección 4.5).
Enfermedad pulmonar crónica
En pacientes con enfermedades pulmonares obstructivas crónicas, fentanilo puede tener reacciones adversas más graves. En estos pacientes, los opioides pueden disminuir el impulso respiratorio y aumentar la resistencia de las vías respiratorias.
Deterioro de la función hepática o renal
Fentanilo deberá ser administrado con precaución en pacientes con insuficiencia hepática o renal de moderada a grave. No se ha evaluado la influencia de la insuficiencia hepática y renal en la farmacocinética de Instanyl; no obstante, cuando se administra por vía intravenosa, el aclaramiento de fentanilo se ve alterado debido a la insuficiencia hepática y renal causada por cambios en el aclaramiento metabólico y proteínas plasmáticas.
Aumento de la presión intracraneal
Fentanilo deberá ser utilizado con precaución en pacientes que muestren evidencia de presión intracraneal elevada, trastorno de la consciencia o coma.
Instanyl se deberá utilizar con precaución en pacientes con tumor cerebral o traumatismo craneal. Cardiopatías
Fentanilo puede producir bradicardia. Por lo tanto, fentanilo deberá utilizarse con precaución en pacientes con bradiarritmias previas o ya existentes. Los opioides pueden causar hipotensión, especialmente en pacientes con hipovolemia. Instanyl deberá ser administrado con precaución en pacientes con hipotensión y/o hipovolemia.
Síndrome serotoninérgico
Se recomienda precaución cuando Instanyl se administre de forma concomitante con fármacos que afecten a los sistemas de neurotransmisores serotoninérgicos.
El desarrollo de un síndrome serotoninérgico potencialmente mortal puede aparecer con el uso concomitante de fármacos serotoninérgicos, como los inhibidores selectivos de la recaptación de serotonina (ISRS) y los inhibidores de la recaptación de serotonina y noradrenalina (IRSN), y con los fármacos que afectan al metabolismo de la serotonina (incluidos los inhibidores de la monoamino oxidasa [IMAO]). Esto puede ocurrir con la dosis recomendada.
El síndrome serotoninérgico puede incluir cambios en el estado mental (p. ej., agitación, alucinaciones, coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, hipertermia), anomalías neuromusculares (p. ej., hiperreflexia, descoordinación, rigidez) y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea).
Si se sospecha de un síndrome serotoninérgico, debe suspenderse el tratamiento con Instanyl.
Afecciones nasales
Si el paciente experimenta episodios repetidos de epistaxis o molestias nasales durante el tratamiento con Instanyl, se deberá considerar una vía de administración alternativa para tratar el dolor irruptivo.
Resfriado común
La exposición general a fentanilo en pacientes con resfriado común sin tratamiento previo con un vasoconstrictor nasal es comparable a la obtenida en sujetos sanos. Para el uso concomitante de vasoconstrictores nasales ver sección 4.5.
Posible abuso y dependencia
Pueden desarrollarse tolerancia y dependencia física y/o psicológica tras la administración repetida de opioides como fentanilo. Sin embargo, la adicción iatrogénica por el uso terapéutico de opioides es rara en el tratamiento del dolor oncológico.
Síntomas de abstinencia
Los síntomas de abstinencia se pueden desencadenar al administrar sustancias con actividad antagonista de opioides, ej. naloxona, o analgésicos mixtos agonista/antagonista (ej. pentazocina, butorfanol, buprenorfina, nalbufina).
4.5 Interacción con otros medicamentos y otras formas de interacción
La administración concomitante de fentanilo con un fármaco serotoninérgico, como un inhibidor selectivo de la recaptación de serotonina (ISRS), un inhibidor de la recaptación de serotonina y noradrenalina (IRSN) o un inhibidor de la monoamino oxidasa (IMAO), puede aumentar el riesgo de síndrome serotoninérgico, un trastorno potencialmente mortal.
No se recomienda el uso de Instanyl en pacientes que han sido tratados con inhibidores de la Monoamino Oxidasa (IMAOs) en los 14 días previos debido a que se ha notificado un aumento grave e impredecible de la potencia analgésica de los opioides con inhibidores IMAO.
Fentanilo se metaboliza principalmente por medio del sistema isoenzimático humano citocromo P450 3A4 (CYP3A4), por lo que pueden producirse interacciones cuando Instanyl se administra conjuntamente con medicamentos que afectan a la actividad de CYP3A4. La administración conjunta con medicamentos que inducen la actividad CYP3A4 puede reducir la eficacia de Instanyl. El uso concomitante de Instanyl e inhibidores potentes de CYP3A4 (ej. ritonavir, ketoconazol, intraconazol, trolendomicina, claritromicina y nelfinavir) o inhibidores moderados de CYP3A4 (ej., amprenavir, aprepitant, diltiazem, eritromicina, fluconazol, fosamprenavir y verapamilo) puede aumentar las concentraciones plasmáticas de fentanilo, lo que puede causar reacciones adversas graves al fármaco, incluyendo la depresión respiratoria mortal.
Se deberá monitorizar durante un periodo de tiempo prolongado a los pacientes que reciban Instanyl de forma concomitante con inhibidores moderados o fuertes de CYP3A4. El incremento de dosis se deberá realizar con precaución.
En un estudio de interacción farmacocinética se ha demostrado que la concentración plasmática máxima de fentanilo administrado por vía nasal se reducía en aproximadamente un 50% con el uso concomitante de oximetazolina, mientras que el tiempo en alcanzar la Cmax (Tmax) se duplicaba. Ésto puede disminuir la eficacia de Instanyl. Se recomienda evitar el uso concomitante con descongestionantes nasales (ver sección 5.2).
El uso concomitante de otros depresores del sistema nervioso central, incluyendo otros opioides, sedantes o hipnóticos, anestésicos generales, fenotiazinas, tranquilizantes, relajantes musculares, antihistamínicos sedantes y alcohol pueden potenciar los efectos depresores.
No se recomienda el uso concomitante de agonistas/antagonistas parciales de opioides (ej. buprenorfina, nalbufina, pentazocina). Estos fármacos tienen una elevada afinidad por los receptores de los opioides pero con una actividad intrínseca relativamente baja, por lo que antagonizan parcialmente el efecto analgésico de fentanilo, y pueden inducir síntomas de abstinencia en los pacientes dependientes de opioides.
En los ensayos clínicos no se ha evaluado el uso concomitante de Instanyl con otros medicamentos (diferentes a oximetazolina) administrados por vía nasal. Se recomienda valorar formas de administración alternativas para el tratamiento simultáneo de otras enfermedades que puedan tratarse por vía nasal.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de fentanilo en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (véase 5.3). Se desconoce el riesgo potencial en seres humanos. No debería utilizarse Instanyl en mujeres embarazadas, a menos que fuese claramente necesario.
Después de un tratamiento a largo plazo, fentanilo puede producir síndrome de abstinencia en el recién nacido. Se recomienda no utilizar fentanilo durante el periodo de dilatación y parto (incluso por cesárea) debido a que fentanilo atraviesa la placenta y puede causar depresión respiratoria en el feto.
En el caso de administrar Instanyl, deberá estar disponible fácilmente un antídoto para el niño.
Lactancia
El fentanilo se excreta a través de la leche materna y puede causar sedación y depresión respiratoria en el lactante. El fentanilo no debe usarse durante la lactancia, no pudiendo reiniciarse la lactancia hasta transcurridos como mínimo 5 días desde la última administración de fentanilo.
Fertilidad
No hay datos disponibles sobre la fertilidad en humanos. En estudios con animales, la fertilidad en machos y hembras se vio afectada a dosis que producen sedación (ver sección 5.3).
4.7 Efectos sobre la capacidad de conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad de conducir y utilizar máquinas. No obstante, los analgésicos opioides son conocidos por disminuir la capacidad mental y/o física necesaria para conducir o utilizar máquinas. Se aconsejará a los pacientes que no conduzcan ni utilicen máquinas si padecen somnolencia, mareos, trastornos visuales u otros efectos adversos que puedan disminuir la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Con Instanyl deben esperarse las reacciones adversas típicas de los opioides. Con frecuencia, la mayoría desaparecerá o disminuirá en intensidad con el uso mantenido del medicamento. Las reacciones adversas más graves son depresión respiratoria (que puede conducir a apnea o parada respiratoria), depresión circulatoria, hipotensión y shock, por lo que se deberá hacer un estrecho seguimiento a todos los pacientes.
Los ensayos clínicos con Instanyl se diseñaron para evaluar la seguridad y eficacia en el tratamiento del dolor irruptivo. Todos los pacientes estaban recibiendo opioides al mismo tiempo, como morfina de liberación sostenida o fentanilo transdérmico para el dolor persistente. Por lo tanto, no es posible aislar los efectos debidos únicamente a Instanyl. En la tabla siguiente se incluyen las reacciones adversas relacionadas según los ensayos clínicos con el tratamiento con Instanyl.
Tabla de reacciones adversas
Para clasificar las reacciones adversas por frecuencia de aparición se utilizan las siguientes categorías: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); y muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Se han notificado las siguientes reacciones adversas con Instanyl y/u otros compuestos que contienen fentanilo provenientes de ensayos clínicos y de la experiencia postcomercialización.
|
Sistema de clasificación de órganos |
Frecuentes |
Poco frecuentes |
Frecuencia no conocida |
|
Trastornos psiquiátricos |
Dependencia, insomnio |
Alucinaciones | |
|
Trastornos del sistema nervioso |
Somnolencia, mareos, cefalea |
Sedación, mioclonía, parestesia, disestesia, disgeusia |
Convulsión |
|
Trastornos del oído y del laberinto |
Vértigo |
Cinetosis | |
|
Trastornos cardiacos |
Hipotensión | ||
|
Trastornos vasculares |
Rubor, sofoco | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
Irritación de garganta |
Depresión respiratoria, epistaxis, úlcera nasal, rinorrea |
Perforación del tabique nasal |
|
Trastornos gastrointestinales |
Náuseas, vómitos |
Estreñimiento, estomatitis, boca seca |
Diarrea |
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis |
Dolor cutáneo, prurito | |
|
Trastornos generales y alteraciones en el lugar de administración |
Pirexia |
Fatiga, malestar general, edema periférico, síndrome de abstinencia* | |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Caídas |
* Se han observado síntomas de síndrome de abstinencia de opioides como náuseas, vómitos, diarrea, ansiedad, escalofríos, temblores y sudoración con la administración de fentanilo por vía transmucosa.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Síntomas
Los síntomas de sobredosis con fentanilo son una extensión de sus acciones farmacológicas, ej. letargia, coma y depresión respiratoria grave. Otros síntomas pueden ser hipotermia, disminución del tono muscular, bradicardia e hipotensión. Los signos de toxicidad son sedación profunda, ataxia, miosis, convulsiones y depresión respiratoria, que es el síntoma principal.
Tratamiento
Se deberán tomar medidas urgentes para el tratamiento de la depresión respiratoria, como la estimulación física o verbal del paciente. Estas medidas pueden continuarse con la administración de un antagonista específico de los opioides como naloxona. La depresión respiratoria después de una sobredosis puede durar más que la acción del antagonista de opioides. La semivida del antagonista puede ser breve, por lo que podría ser necesaria una administración repetida o una infusión continua. La inversión del efecto narcótico puede dar lugar a dolor agudo y liberación de catecolaminas.
Si la situación clínica lo requiere, se fijará y mantendrá una abertura en las vías respiratorias a través de un conducto orofaríngeo o tubo endotraqueal, y se deberá administrar el oxígeno así como mantener una respiración asistida y controlada, según proceda. Se deberá mantener una temperatura corporal y una toma de líquidos adecuada.
Si se produce hipotensión grave o persistente, se considerará la hipovolemia y se tratará la afección con la administración adecuada de líquidos por vía parenteral.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Analgésicos; opioides. Código ATC: N02AB03 Mecanismo de acción
Fentanilo es un analgésico opioide con afinidad fundamentalmente por el receptor ^ de los opioides, actuando como agonista puro y con baja afinidad por los receptores de opioides 5 y k. La acción terapéutica principal es la analgesia. Los efectos farmacológicos secundarios son depresión respiratoria, bradicardia, hipotermia, estreñimiento, miosis, dependencia física y euforia.
Eficacia clínica y seguridad
Se ha valorado la eficacia y seguridad de Instanyl (50, 100 y 200 microgramos) frente a placebo en dos estudios pivotales, aleatorizados, doble ciego, cruzados y controlados, en 279 pacientes oncológicos adultos (32-86 años de edad) y con tolerancia a los opioides y que padecían dolor irruptivo. Los pacientes sufrían un promedio de 1 a 4 episodios diarios mientras recibían tratamiento de mantenimiento con opioides. En el segundo estudio pivotal los pacientes habían participado previamente en el estudio farmacocinético de Instanyl o en el primer estudio pivotal.
Los estudios clínicos mostraron la eficacia y seguridad de Instanyl. No se ha establecido una relación clara entre la dosis del opioide de base y la dosis de Instanyl. No obstante, en el segundo estudio pivotal los pacientes con baja dosis de mantenimiento con opioide mostraron tendencia a conseguir un alivio efectivo del dolor con una dosis menor de Instanyl, comparado con los pacientes que recibían dosis de mantenimiento con opioide superiores. Esto se observó con mayor claridad en los pacientes que utilizaron Instanyl 50 microgramos.
En los ensayos clínicos en pacientes oncológicos las concentraciones más frecuentes utilizadas fueron de 100 y de 200 microgramos.
Las tres dosis de Instanyl mostraron de forma estadísticamente significativa (p<0,001) una elevada diferencia de la intensidad de dolor a los 10 minutos (DID10) frente a placebo. Además, Instanyl fue significativamente superior a placebo en el alivio del dolor irruptivo a los 10, 20, 40, y 60 minutos después de la administración. Los resultados de la suma de las diferencias de la intensidad del dolor (DID) a los 60 minutos (SDID0-60) mostraron que todas las dosis de Instanyl tenían resultados SDID0-60 significativamente más elevados frente a placebo (p<0,001), lo que demuestra un mejor alivio del dolor con Instanyl que con placebo durante 60 minutos.
Se ha evaluado la seguridad y eficacia de Instanyl en pacientes tratados con el medicamento al iniciarse un episodio de dolor irruptivo. Instanyl no deberá utilizarse como preventivo.
La experiencia clínica con Instanyl en pacientes con tratamiento con opioide de base equivalente a > 500 mg/día de morfina o > 200 microgramos/hora de fentanilo transdérmico es limitada.
Dosis superiores a 400 microgramos de Instanyl no han sido evaluadas en ensayos clínicos.
5.2 Propiedades farmacocinéticas
Absorción
Fentanilo es muy lipofílico. Fentanilo muestra tres cinéticas de distribución compartimental. Los datos en animales muestran que después de la absorción, fentanilo se distribuye rápidamente al cerebro, corazón, pulmones, riñones y bazo seguido de una redistribución más lenta a músculos y tejido adiposo. La unión a proteínas plasmáticas de fentanilo es aproximadamente del 80%. La biodisponibilidad absoluta de Instanyl es aproximadamente del 89%.
Los datos clínicos muestran que fentanilo se absorbe muy rápidamente a través de la mucosa nasal. La administración de Instanyl en dosis únicas en el intervalo de 50 a 200 microgramos de fentanilo por dosis en pacientes oncológicos con tolerancia a los opioides produce rápidamente un nivel de Cmáx de 0,35 a 1,2 ng/ml. La correspondiente mediana de Tmáx es de 12-15 minutos. Aún así, en un estudio en voluntarios sanos sobre la proporcionalidad de la dosis se observaron valores más altos de Tmax.
Distribución
Tras la administración intravenosa de fentanilo la semivida de distribución inicial es de aproximadamente 6 minutos y se observa una semivida similar a ésta después de la administración nasal de Instanyl. La semivida de eliminación de fentanilo en pacientes oncológicos es aproximadamente de 3-4 horas.
Biotransformación
Fentanilo se metaboliza principalmente en el hígado a través del sistema CYP3A4. El metabolito principal, norfentanilo, es inactivo.
Eliminación
Aproximadamente el 75% de fentanilo se excreta por la orina, en su mayor parte como metabolitos inactivos, y con menos del 10% como principio activo inalterado. Aproximadamente el 9% de la cantidad administrada se recupera en las heces, principalmente como metabolitos.
Linealidad/No linealidad
Instanyl muestra una cinética lineal. La linealidad de la dosis de 50 microgramos a 400 microgramos de Instanyl se ha demostrado en sujetos sanos.
Se realizó un estudio de interacción medicamentosa con un vasoconstrictor nasal (oximetazolina). Los sujetos con rinitis alérgica recibieron oximetazolina por pulverización nasal una hora antes de Instanyl. Se observó que la biodisponibilidad (AUC) de fentanilo era comparable con y sin oximetazolina, mientras que la Cmáx de fentanilo disminuyó y el Tmáx aumentó al doble cuando se administraba oximetazolina. La exposición total a fentanilo en pacientes con rinitis alérgica sin tratamiento previo con un vasoconstrictor nasal es comparable a la observada en sujetos sanos. Se deberá evitar el uso de un vasoconstrictor nasal de forma concomitante (ver sección 4.5).
Bioequivalencia
Un estudio farmacocinético ha mostrado que el pulverizador nasal Instanyl de dosis unitaria y el de dosis múltiple son bioequivalentes.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad y carcinogenicidad.
En un estudio de fertilidad y desarrollo embriogénico precoz en ratas, se observó un efecto relacionado con la rata macho a altas dosis (300 ^g/Kg/día, c.s), que fue consistente con los efectos sedantes de fentanilo en estudios previos realizados en animales. Además, estudios con ratas hembra revelaron una disminución de la fertilidad y una mayor mortalidad embrionaria. Estudios más recientes mostraron que los efectos sobre los embriones se debieron a la toxicidad materna y no a efectos directos de las sustancias sobre el desarrollo embrionario. En un estudio del desarrollo pre y posnatal, el índice de supervivencia se redujo de forma significativa a dosis en las cuales se había producido una reducción del peso materno. Este efecto puede ser debido a alteración de los cuidados en la madre o a un efecto directo de fentanilo sobre las crías. No se observaron efectos sobre el desarrollo somático y de conducta de la descendencia. No se han demostrado efectos teratogénicos.
Los estudios de tolerancia local con Instanyl en mini cerdos demostraron que la administración de Instanyl fue bien tolerada.
Los estudios de carcinogenicidad (bioensayo dérmico alternativo de 26 semanas en ratones transgénicos Tg.AC; estudio de carcinogenicidad subcutánea de 2 años en ratas) con fentanilo no pusieron de manifiesto ningún hallazgo indicativo de potencial oncogénico. La evaluación de los cortes laminares de cerebro del estudio de carcinogenicidad en ratas mostró lesiones cerebrales en los animales tratados con dosis altas de citrato de fentanilo. Se desconoce la relevancia de estos hallazgos para los seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Fosfato de sodio dihidrogenado dihidrato Fosfato disódico dihidratado.
Agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
Instanyl 50 microgramos/dosis solución para pulverización nasal
3 años.
Instanyl 100 microgramos/dosis solución para pulverización nasal 42 meses
Instanyl 200 microgramos/dosis solución para pulverización nasal
4 años.
6.4 Precauciones especiales de conservación
Conservar por debajo de 30°C.
No congelar.
Conservar el dispositivo en posición vertical.
6.5 Naturaleza y contenido del envase
Frasco (vidrio marrón Tipo I) con bomba dosificadora y tapa protectora acondicionado en una caja resistente a niños.
Disponible en las siguientes presentaciones:
Instanyl 50 microgramos/dosis solución para pulverización nasal
1.8 ml con 0,90 mg de fentanilo, que contienen 10 dosis de 50 microgramos
2.9 ml con 1,45 mg de fentanilo, que contienen 20 dosis de 50 microgramos
5,0 ml con 2,50 mg de fentanilo, que contienen 40 dosis de 50 microgramos
Instanyl 100 microgramos/dosis solución para pulverización nasal
1.8 ml con 1,80 mg de fentanilo, que contienen 10 dosis de 100 microgramos
2.9 ml con 2,90 mg de fentanilo, que contienen 20 dosis de 100 microgramos
5.0 ml con 5,00 mg de fentanilo, que contienen 40 dosis de 100 microgramos
Instanyl 200 microgramos/dosis solución para pulverización nasal
1.8 ml con 3,60 mg de fentanilo, que contienen 10 dosis de 200 microgramos
2.9 ml con 5,80 mg de fentanilo, que contienen 20 dosis de 200 microgramos
5.0 ml con 10,00 mg de fentanilo, que contienen 40 dosis de 200 microgramos
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Debido al posible abuso de fentanilo y a la posible cantidad de solución remanente, las soluciones para pulverización nasal utilizadas y no utilizadas deben ser devueltas sistemáticamente de forma correcta en la caja exterior resistente a niños y ser eliminadas, de acuerdo con la normativa local, o devolverse a la farmacia.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Instanyl 50 microgramos/dosis solución para pulverización nasal EU/1/09/531/001-003
Instanyl 100 microgramos/dosis solución para pulverización nasal EU/1/09/531/004-006
Instanyl 200 microgramos/dosis solución para pulverización nasal EU/1/09/531/007-009
9. FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20 Julio 2009 Fecha de la última renovación: 23 Abril 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Instanyl 50 microgramos solución para pulverización nasal en envase unidosis Instanyl 100 microgramos solución para pulverización nasal en envase unidosis Instanyl 200 microgramos solución para pulverización nasal en envase unidosis
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Instanyl 50 microgramos solución para pulverización nasal en envase unidosis
Cada envase unidosis contiene una dosis (100 microlitros) de citrato de fentanilo equivalente a
50 microgramos de fentanilo.
Instanyl 100 microgramos solución para pulverización nasal en envase unidosis
Cada envase unidosis contiene una dosis (100 microlitros) de citrato de fentanilo equivalente a
100 microgramos de fentanilo.
Instanyl 200 microgramos solución para pulverización nasal en envase unidosis
Cada envase unidosis contiene una dosis (100 microlitros) de citrato de fentanilo equivalente a
200 microgramos de fentanilo.
Para consultar la lista completa de excipientes ver sección 6.1
3. FORMA FARMACÉUTICA
Solución para pulverización nasal (pulverizador nasal). Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Instanyl está indicado para el tratamiento del dolor irruptivo en adultos que ya reciben tratamiento de mantenimiento con opioides para el dolor crónico oncológico. El dolor irruptivo es una exacerbación transitoria del dolor que se produce sobre una base de dolor persistente controlado por otros medios. Los pacientes en tratamiento de mantenimiento con opioides son los que reciben al menos 60 mg de morfina oral al día, al menos 25 microgramos de fentanilo transdérmico cada hora, al menos 30 mg de oxicodona al día, al menos 8 mg de hidromorfona al día o una dosis equianalgésica de otro opioide durante un mínimo de una semana
4.2 Posología y forma de administración
El tratamiento debe ser instaurado y seguido bajo la supervisión de un médico con experiencia en el uso de opioides en pacientes oncológicos. Los médicos deben considerar el riesgo del abuso de fentanilo.
Posología
Se deberá ajustar individualmente la dosis hasta obtener una analgesia adecuada con reacciones adversas tolerables. Durante el proceso de ajuste de la dosis se realizará una estrecha monitorización a los pacientes.
El ajuste a dosis más altas requiere la intervención de un profesional sanitario.
En los ensayos clínicos la dosis de Instanyl utilizada para el tratamiento del dolor irruptivo fue independiente de la dosis diaria de mantenimiento con opioides (ver sección 5.1).
Dosis diaria máxima: tratamiento de un máximo de cuatro episodios de dolor irruptivo, administrándose en cada episodio un máximo de dos dosis, con una separación entre ambas de al menos 10 minutos.
Durante la titulación y la terapia de mantenimiento, el paciente deberá esperar al menos 4 horas antes de tratar con Instanyl otro episodio de dolor irruptivo.
Titulación o ajuste de la dosis
Antes de ajustar la dosis de Instanyl, se confirmará que el dolor de base persistente está controlado mediante terapia crónica con opioides y que no padecen más de cuatro episodios de dolor irruptivo al día.
Ajuste de la dosis
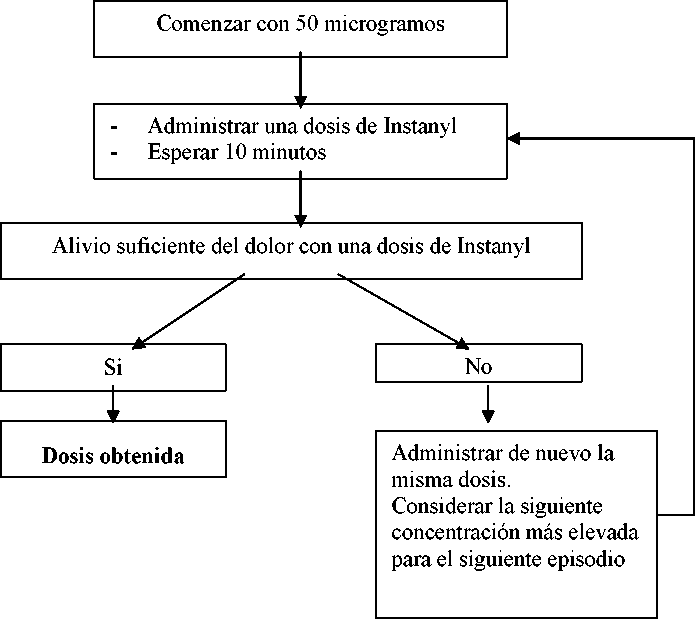
La concentración inicial deberá ser una dosis de 50 microgramos en una fosa nasal, ajustando a dosis superiores según sea necesario dentro del rango de concentraciones disponibles (50, 100 y 200 microgramos). Si no se obtiene la analgesia adecuada, se puede administrar de nuevo la misma dosis una vez transcurridos un mínimo de 10 minutos. Cada etapa del ajuste de la dosis (concentración de la dosis) se deberá evaluar en varios episodios.
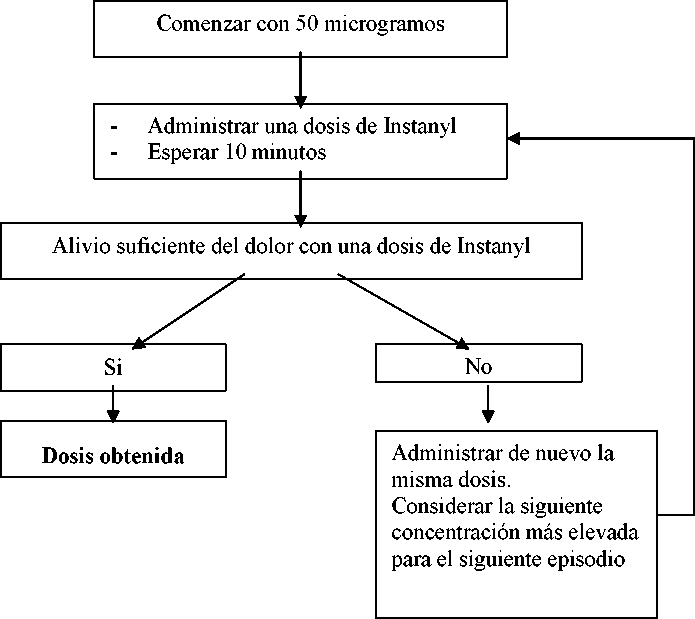
Terapia de mantenimiento
Una vez se ha establecido la dosis de acuerdo con las etapas descritas anteriormente, se deberá mantener al paciente con esta concentración de Instanyl. Si el paciente experimenta un alivio insuficiente del dolor se puede administrar de nuevo la misma dosis una vez transcurridos un mínimo de 10 minutos.
Ajuste de la dosis
En general, se deberá aumentar la concentración de mantenimiento con Instanyl cuando un paciente requiera más de una dosis por episodio de dolor irruptivo durante varios episodios consecutivos. Puede ser necesario ajustar la dosis del tratamiento de base con opioides si el paciente presenta de forma continuada más de cuatro episodios de dolor irruptivo cada 24 horas.
Si las reacciones adversas son intolerables o persistentes, se deberá reducir la dosis o bien reemplazar el tratamiento con Instanyl por otros analgésicos.
Interrupción del tratamiento
Se deberá suspender inmediatamente el tratamiento con Instanyl si el paciente deja de padecer episodios de dolor irruptivo. El tratamiento para el dolor de base persistente deberá mantenerse según lo prescrito.
En caso de que sea necesario interrumpir el tratamiento con opioides, se realizará un estrecho control médico al paciente para evitar los efectos repentinos de la retirada, ya que los opioides requieren una reducción gradual de la dosis.
Poblaciones especiales
Pacientes de edad avanzada
Se dispone de datos escasos sobre la farmacocinética, eficacia y seguridad del uso de Instanyl en pacientes mayores de 65 años de edad. Los pacientes de edad avanzada pueden padecer una reducción del aclaramiento, una semivida más prolongada y una mayor sensibilidad al fentanilo que pacientes más jóvenes. Por lo tanto, se deberá tener precaución en el tratamiento de pacientes de edad avanzada, caquécticos o debilitados.
En los ensayos clínicos, los pacientes de edad avanzada mostraron tendencia a una titulación de dosis efectiva más baja que los pacientes de 65 años de edad. Se deberá tener especial precaución en el ajuste de dosis de Instanyl en pacientes de edad avanzada.
Insuficiencia hepática
Se deberá administrar Instanyl con precaución en pacientes con insuficiencia hepática de moderada a grave (ver sección 4.4).
Insuficiencia renal
Se deberá administrar Instanyl con precaución en pacientes con insuficiencia renal de moderada a grave (ver sección 4.4).
Población pediátrica
No se ha establecido la seguridad y eficacia de Instanyl en niños menores de 18 años de edad. No hay datos disponibles.
Forma de administración:
Instanyl se administra por vía nasal.
Se recomienda que el paciente mantenga erguida la cabeza cuando se administre Instanyl.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Pacientes que no estén en tratamiento de mantenimiento con opioides, por el mayor riesgo de depresión respiratoria.
Tratamiento del dolor agudo distinto al dolor irruptivo.
Depresión respiratoria grave o enfermedades pulmonares obstructivas graves.
Radioterapia facial previa
Episodios recurrentes de epistaxis (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Depresión respiratoria
Fentanilo puede provocar depresión respiratoria clínicamente significativa y, por tanto, este efecto se deberá vigilar en los pacientes. Los pacientes con dolor que reciben tratamiento crónico con opioides desarrollan tolerancia a la depresión respiratoria, por lo tanto, en estos pacientes se reduce el riesgo de depresión respiratoria. El uso concomitante de depresores del sistema nervioso central puede aumentar el riesgo de depresión respiratoria (ver sección 4.5).
Enfermedad pulmonar crónica
En pacientes con enfermedades pulmonares obstructivas crónicas, fentanilo puede tener reacciones adversas más graves. En estos pacientes, los opioides pueden disminuir el impulso respiratorio y aumentar la resistencia de las vías respiratorias.
Deterioro de la función hepática o renal
Fentanilo deberá ser administrado con precaución en pacientes con insuficiencia hepática o renal de moderada a grave. No se ha evaluado la influencia de la insuficiencia hepática y renal en la farmacocinética de Instanyl; no obstante, cuando se administra por vía intravenosa, el aclaramiento de fentanilo se ve alterado debido a la insuficiencia hepática y renal causada por cambios en el aclaramiento metabólico y proteínas plasmáticas.
Aumento de la presión intracraneal
Fentanilo deberá ser utilizado con precaución en pacientes que muestren evidencia de presión intracraneal elevada, trastorno de la consciencia o coma.
Instanyl se deberá utilizar con precaución en pacientes con tumor cerebral o traumatismo craneal. Cardiopatías
Fentanilo puede producir bradicardia. Por lo tanto, fentanilo deberá utilizarse con precaución en pacientes con bradiarritmias previas o ya existentes. Los opioides pueden causar hipotensión, especialmente en pacientes con hipovolemia. Instanyl deberá ser administrado con precaución en pacientes con hipotensión y/o hipovolemia.
Síndrome serotoninérgico
Se recomienda precaución cuando Instanyl se administre de forma concomitante con fármacos que afecten a los sistemas de neurotransmisores serotoninérgicos.
El desarrollo de un síndrome serotoninérgico potencialmente mortal puede aparecer con el uso concomitante de fármacos serotoninérgicos, como los inhibidores selectivos de la recaptación de serotonina (ISRS) y los inhibidores de la recaptación de serotonina y noradrenalina (IRSN), y con los fármacos que afectan al metabolismo de la serotonina (incluidos los inhibidores de la monoamino oxidasa [IMAO]). Esto puede ocurrir con la dosis recomendada.
El síndrome serotoninérgico puede incluir cambios en el estado mental (p. ej., agitación, alucinaciones, coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, hipertermia), anomalías neuromusculares (p. ej., hiperreflexia, descoordinación, rigidez) y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea).
Si se sospecha de un síndrome serotoninérgico, debe suspenderse el tratamiento con Instanyl. Afecciones nasales
Si el paciente experimenta episodios repetidos de epistaxis o molestias nasales durante el tratamiento con Instanyl, se deberá considerar una vía de administración alternativa para tratar el dolor irruptivo.
Resfriado común
La exposición general a fentanilo en pacientes con resfriado común sin tratamiento previo con un vasoconstrictor nasal es comparable a la obtenida en sujetos sanos. Para el uso concomitante de vasoconstrictores nasales ver sección 4.5.
Posible abuso y dependencia
Pueden desarrollarse tolerancia y dependencia física y/o psicológica tras la administración repetida de opioides como fentanilo. Sin embargo, la adicción iatrogénica por el uso terapéutico de opioides es rara en el tratamiento del dolor oncológico.
Síntomas de abstinencia
Los síntomas de abstinencia se pueden desencadenar al administrar sustancias con actividad antagonista de opioides, ej. naloxona, o analgésicos mixtos agonista/antagonista (ej. pentazocina, butorfanol, buprenorfina, nalbufina).
4.5 Interacción con otros medicamentos y otras formas de interacción
La administración concomitante de fentanilo con un fármaco serotoninérgico, como un inhibidor selectivo de la recaptación de serotonina (ISRS), un inhibidor de la recaptación de serotonina y noradrenalina (IRSN) o un inhibidor de la monoamino oxidasa (IMAO), puede aumentar el riesgo de síndrome serotoninérgico, un trastorno potencialmente mortal.
No se recomienda el uso de Instanyl en pacientes que han sido tratados con inhibidores de la Monoamino Oxidasa (IMAOs) en los 14 días previos debido a que se ha notificado un aumento grave e impredecible de la potencia analgésica de los opioides con inhibidores IMAO.
Fentanilo se metaboliza principalmente por medio del sistema isoenzimático humano citocromo P450 3A4 (CYP3A4), por lo que pueden producirse interacciones cuando Instanyl se administra conjuntamente con medicamentos que afectan a la actividad de CYP3A4. La administración conjunta con medicamentos que inducen la actividad CYP3A4 puede reducir la eficacia de Instanyl. El uso concomitante de Instanyl e inhibidores potentes de CYP3A4 (ej. ritonavir, ketoconazol, intraconazol, trolendomicina, claritromicina y nelfinavir) o inhibidores moderados de CYP3A4 (ej., amprenavir, aprepitant, diltiazem, eritromicina, fluconazol, fosamprenavir, y verapamilo) puede aumentar las concentraciones plasmáticas de fentanilo, lo que puede causar reacciones adversas graves al fármaco, incluyendo la depresión respiratoria mortal.
Se deberá monitorizar durante un periodo de tiempo prolongado a los pacientes que reciban Instanyl de forma concomitante con inhibidores moderados o fuertes de CYP3A4. El incremento de dosis se deberá realizar con precaución.
En un estudio de interacción farmacocinética se ha demostrado que la concentración plasmática máxima de fentanilo administrado por vía nasal se reducía en aproximadamente un 50% con el uso concomitante de oximetazolina, mientras que el tiempo en alcanzar la Cmax (Tmax) se duplicaba. Ésto puede disminuir la eficacia de Instanyl. Se recomienda evitar el uso concomitante con descongestionantes nasales (ver sección 5.2).
El uso concomitante de otros depresores del sistema nervioso central, incluyendo otros opioides, sedantes o hipnóticos, anestésicos generales, fenotiazinas, tranquilizantes, relajantes musculares, antihistamínicos sedantes y alcohol pueden potenciar los efectos depresores.
No se recomienda el uso concomitante de agonistas/antagonistas parciales de opioides (ej. buprenorfina, nalbufina, pentazocina). Estos fármacos tienen una elevada afinidad por los receptores de los opioides pero con una actividad intrínseca relativamente baja, por lo que antagonizan parcialmente el efecto analgésico de fentanilo, y pueden inducir síntomas de abstinencia en los pacientes dependientes de opioides.
En los ensayos clínicos no se ha evaluado el uso concomitante de Instanyl con otros medicamentos (diferentes a oximetazolina) administrados por vía nasal. Se recomienda valorar formas de administración alternativas para el tratamiento simultáneo de otras enfermedades que puedan tratarse por vía nasal.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de fentanilo en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (véase 5.3). Se desconoce el riesgo potencial en seres humanos. No debería utilizarse Instanyl en mujeres embarazadas, a menos que fuese claramente necesario.
Después de un tratamiento a largo plazo, fentanilo puede producir síndrome de abstinencia en el recién nacido. Se recomienda no utilizar fentanilo durante el periodo de dilatación y parto (incluso por cesárea) debido a que fentanilo atraviesa la placenta y puede causar depresión respiratoria en el feto.
En el caso de administrar Instanyl, deberá estar disponible fácilmente un antídoto para el niño.
Lactancia
El fentanilo se excreta a través de la leche materna y puede causar sedación y depresión respiratoria en el lactante. El fentanilo no debe usarse durante la lactancia, no pudiendo reiniciarse la lactancia hasta transcurridos como mínimo 5 días desde la última administración de fentanilo.
Fertilidad
No hay datos disponibles sobre la fertilidad en humanos. En estudios con animales, la fertilidad en machos y hembras se vio afectada a dosis que producen sedación (ver sección 5.3).
4.7 Efectos sobre la capacidad de conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad de conducir y utilizar máquinas. No obstante, los analgésicos opioides son conocidos por disminuir la capacidad mental y/o física necesaria para conducir o utilizar máquinas. Se aconsejará a los pacientes que no conduzcan ni utilicen máquinas si padecen somnolencia, mareos, trastornos visuales u otros efectos adversos que puedan disminuir la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Con Instanyl deben esperarse las reacciones adversas típicas de los opioides. Con frecuencia, la mayoría desaparecerá o disminuirá en intensidad con el uso mantenido del medicamento. Las reacciones adversas más graves son depresión respiratoria (que puede conducir a apnea o parada respiratoria), depresión circulatoria, hipotensión y shock, por lo que se deberá hacer un estrecho seguimiento a todos los pacientes.
Los ensayos clínicos con Instanyl se diseñaron para evaluar la seguridad y eficacia en el tratamiento del dolor irruptivo. Todos los pacientes estaban recibiendo opioides al mismo tiempo, como morfina de liberación sostenida o fentanilo transdérmico para el dolor persistente. Por lo tanto, no es posible aislar los efectos debidos únicamente a Instanyl. En la tabla siguiente se incluyen las reacciones adversas relacionadas según los ensayos clínicos con el tratamiento con Instanyl.
Tabla de reacciones adversas
Para clasificar las reacciones adversas por frecuencia de aparición se utilizan las siguientes categorías: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); y muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Se han notificado las siguientes reacciones adversas con Instanyl y/u otros compuestos que contienen fentanilo provenientes de ensayos clínicos y de la experiencia postcomercialización.
|
Clasificación de órganos del sistema |
Frecuentes |
Poco frecuentes |
Frecuencia no conocida |
|
Trastornos psiquiátricos |
Dependencia, insomnio |
Alucinaciones | |
|
Trastornos del sistema nervioso |
Somnolencia, mareos, cefalea |
Sedación, mioclonía, parestesia, disestesia, disgeusia |
Convulsión |
|
Trastornos del oído y del laberinto |
Vértigo |
Cinetosis | |
|
Trastornos cardiacos |
Hipotensión | ||
|
Trastornos vasculares |
Rubor, sofoco | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
Irritación de garganta |
Depresión respiratoria, epistaxis, úlcera nasal, rinorrea |
Perforación del tabique nasal |
|
Trastornos gastrointestinales |
Náuseas, vómitos |
Estreñimiento, estomatitis, boca seca |
Diarrea |
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis |
Dolor cutáneo, prurito | |
|
Trastornos generales y alteraciones en el lugar de administración |
Pirexia |
Fatiga, malestar general, edema periférico, síndrome de abstinencia* | |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Caídas |
* Se han observado síntomas de síndrome de abstinencia de opioides como náuseas, vómitos, diarrea, ansiedad, escalofríos, temblores y sudoración con la administración de fentanilo por vía transmucosa.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Síntomas
Los síntomas de sobredosis con fentanilo son una extensión de sus acciones farmacológicas, ej. letargia, coma y depresión respiratoria grave. Otros síntomas pueden ser hipotermia, disminución del tono muscular, bradicardia e hipotensión. Los signos de toxicidad son sedación profunda, ataxia, miosis, convulsiones y depresión respiratoria, que es el síntoma principal.
Tratamiento
Se deberán tomar medidas urgentes para el tratamiento de la depresión respiratoria, como la estimulación física o verbal del paciente. Estas medidas pueden continuarse con la administración de un antagonista específico de los opioides como naloxona. La depresión respiratoria después de una sobredosis puede durar más que la acción del antagonista de opioides. La semivida del antagonista puede ser breve, por lo que podría ser necesaria una administración repetida o una infusión continua. La inversión del efecto narcótico puede dar lugar a dolor agudo y liberación de catecolaminas.
Si la situación clínica lo requiere, se fijará y mantendrá una abertura en las vías respiratorias a través de un conducto orofaríngeo o tubo endotraqueal, y se deberá administrar el oxígeno así como mantener una respiración asistida y controlada, según proceda. Se deberá mantener una temperatura corporal y una toma de líquidos adecuada.
Si se produce hipotensión grave o persistente, se considerará la hipovolemia y se tratará la afección con la administración adecuada de líquidos por vía parenteral.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Analgésicos; opioides. Código ATC: N02AB03 Mecanismo de acción
Fentanilo es un analgésico opioide con afinidad fundamentalmente por el receptor ^ de los opioides, actuando como agonista puro y con baja afinidad por los receptores de opioides 5 y k. La acción terapéutica principal es la analgesia. Los efectos farmacológicos secundarios son depresión respiratoria, bradicardia, hipotermia, estreñimiento, miosis, dependencia física y euforia.
Eficacia clínica y seguridad
Se ha valorado la eficacia y seguridad de Instanyl (50, 100 y 200 microgramos) frente a placebo en dos estudios pivotales, aleatorizados, doble ciego, cruzados y controlados, en 279 pacientes oncológicos adultos (32-86 años de edad) y con tolerancia a los opioides y que padecían dolor irruptivo. Los pacientes sufrían un promedio de 1 a 4 episodios diarios mientras recibían tratamiento de mantenimiento con opioides. En el segundo estudio pivotal los pacientes habían participado previamente en el estudio farmacocinético de Instanyl o en el primer estudio pivotal.
Los estudios clínicos mostraron la eficacia y seguridad de Instanyl. No se ha establecido una relación clara entre la dosis del opioide de base y la dosis de Instanyl. No obstante, en el segundo estudio pivotal los pacientes con baja dosis de mantenimiento con opioide mostraron tendencia a conseguir un alivio efectivo del dolor con una dosis menor de Instanyl, comparado con los pacientes que recibían dosis de mantenimiento con opioide superiores. Esto se observó con mayor claridad en los pacientes que utilizaron Instanyl 50 microgramos.
En los ensayos clínicos en pacientes oncológicos la concentración más frecuente utilizada fue de 100 y de 200 microgramos.
Las tres dosis de Instanyl mostraron de forma estadísticamente significativa (p<0,001) una elevada diferencia de la intensidad de dolor a los 10 minutos (DID10) frente a placebo. Además, Instanyl fue significativamente superior a placebo en el alivio del dolor irruptivo a los 10, 20, 40, y 60 minutos después de la administración. Los resultados de la suma de las diferencias de la intensidad del dolor (DID) a los 60 minutos (SDID0-60) mostraron que todas las dosis de Instanyl tenían resultados SDID0-60 significativamente más elevados frente a placebo (p<0,001), lo que demuestra un mejor alivio del dolor con Instanyl que con placebo durante 60 minutos.
Se ha evaluado la seguridad y eficacia de Instanyl en pacientes tratados con el medicamento al iniciarse un episodio de dolor irruptivo. Instanyl no deberá utilizarse como preventivo.
La experiencia clínica con Instanyl en pacientes con tratamiento con opioide de base equivalente a > 500 mg/día de morfina o > 200 microgramos/hora de fentanilo transdérmico es limitada.
Dosis superiores a 400 microgramos de Instanyl no han sido evaluadas en ensayos clínicos.
5.2 Propiedades farmacocinéticas Absorción
Fentanilo es muy lipofílico. Fentanilo muestra tres cinéticas de distribución compartimental. Los datos en animales muestran que después de la absorción, fentanilo se distribuye rápidamente al cerebro, corazón, pulmones, riñones y bazo seguido de una redistribución más lenta a músculos y tejido adiposo. La unión a proteínas plasmáticas de fentanilo es aproximadamente del 80%. La biodisponibilidad absoluta de Instanyl es aproximadamente del 89%.
Los datos clínicos muestran que fentanilo se absorbe muy rápidamente a través de la mucosa nasal. La administración de Instanyl en dosis únicas en el intervalo de 50 a 200 microgramos de fentanilo por dosis en pacientes oncológicos con tolerancia a los opioides produce rápidamente un nivel de Cmáx de 0,35 a 1,2 ng/ml. La correspondiente mediana de Tmáx es de 12-15 minutos. Aún así, en un estudio en voluntarios sanos sobre la proporcionalidad de la dosis se observaron valores más altos de Tmax.
Distribución
Tras la administración intravenosa de fentanilo la semivida de distribución inicial es de aproximadamente 6 minutos y se observa una semivida similar a ésta después de la administración nasal de Instanyl. La semivida de eliminación de fentanilo en pacientes oncológicos es aproximadamente de 3-4 horas.
Biotransformación
Fentanilo se metaboliza principalmente en el hígado a través del sistema CYP3A4. El metabolito principal, norfentanilo, es inactivo.
Eliminación
Aproximadamente el 75% de fentanilo se excreta por la orina, en su mayor parte como metabolitos inactivos, y con menos del 10% como principio activo inalterado. Aproximadamente el 9% de la cantidad administrada se recupera en las heces, principalmente como metabolitos.
Linealidad/No linealidad
Instanyl muestra una cinética lineal. La linealidad de la dosis de 50 microgramos a 400 microgramos de Instanyl se ha demostrado en sujetos sanos.
Se realizó un estudio de interacción medicamentosa con un vasoconstrictor nasal (oximetazolina). Los sujetos con rinitis alérgica recibieron oximetazolina por pulverización nasal una hora antes de Instanyl. Se observó que la biodisponibilidad (AUC) de fentanilo era comparable con y sin oximetazolina, mientras que la Cmáx de fentanilo disminuyó y el Tmáx aumentó al doble cuando se administraba oximetazolina. La exposición total a fentanilo en pacientes con rinitis alérgica sin tratamiento previo con un vasoconstrictor nasal es comparable a la observada en sujetos sanos. Se deberá evitar el uso de un vasoconstrictor nasal de forma concomitante (ver sección 4.5).
Bioequivalencia
Un estudio farmacocinético ha mostrado que el pulverizador nasal de Instanyl de dosis unitaria y el de dosis múltiple son bioequivalentes.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad y carcinogenicidad.
En un estudio de fertilidad y desarrollo embriogénico precoz en ratas, se observó a un efecto relacionado con la rata macho a altas dosis (300 ^g/Kg/día, c.s.) que fue consistente con los efectos sedantes de fentanilo en estudios previos realizados en animales. Además, estudios con ratas hembra revelaron una disminución de la fertilidad y una mayor mortalidad embrionaria. Estudios más recientes mostraron que los efectos sobre los embriones se debieron a la toxicidad materna y no a efectos directos de las sustancias sobre el desarrollo embrionario. En un estudio del desarrollo pre y posnatal, el índice de supervivencia se redujo de forma significativa a dosis en las cuales se había producido una reducción del peso materno. Este efecto puede ser debido a alteración de los cuidados en la madre o a un efecto directo de fentanilo sobre las crías. No se observaron efectos sobre el desarrollo somático y de conducta de la descendencia. No se han demostrado efectos teratogénicos.
Los estudios de tolerancia local con Instanyl en mini cerdos demostraron que la administración de Instanyl fue bien tolerada.
Los estudios de carcinogenicidad (bioensayo dérmico alternativo de 26 semanas en ratones transgénicos Tg.AC; estudio de carcinogenicidad subcutánea de 2 años en ratas) con fentanilo no pusieron de manifiesto ningún hallazgo indicativo de potencial oncogénico. La evaluación de los cortes laminares de cerebro del estudio de carcinogenicidad en ratas mostró lesiones cerebrales en los animales tratados con dosis altas de citrato de fentanilo. Se desconoce la relevancia de estos hallazgos para los seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Fosfato de sodio dihidrogenado dihidrato Fosfato disódico dihidratado.
Agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
Instanyl 50 microgramos solución para pulverización nasal en envase unidosis 23 meses.
Instanyl 100 microgramos solución para pulverización nasal en envase unidosis 36 meses
Instanyl 200 microgramos solución para pulverización nasal en envase unidosis 42 meses
6.4 Precauciones especiales de conservación
Conservar por debajo de 30°C.
Conservar el blíster en el embalaje exterior. Conservar en posición vertical.
6.5 Naturaleza y contenido del envase
Envase unidosis formado por un vial (vidrio claro tipo I) integrado en un pulverizador de polipropileno, envasado en un blíster resistente a niños.
Tamaños de envase: 2, 6, 8 y 10 envases unidosis.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Cada envase unidosis contiene sólo una dosis. El envase unidosis no se debe probar antes de ser utilizado.
Debido al posible abuso de fentanilo los pulverizadores nasales en envase unidosis no utilizados deben ser devueltos sistemáticamente de forma correcta al blisterresistente a niños y ser eliminados, de acuerdo con la normativa local, o devolverse a la farmacia.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alie 10 DK-2630 Taastrup Dinamarca
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Instanyl 50 microgramos solución para pulverización nasal en envase unidosis EU/1/09/531/010-013
Instanyl 100 microgramos solución para pulverización nasal en envase unidosis EU/1/09/531/014-017
Instanyl 200 microgramos solución para pulverización nasal en envase unidosis EU/1/09/531/018-021
9. FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización:20 Julio 2009 Fecha de la última renovación: 23 Abril 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Instanyl 50 microgramos/dosis solución para pulverización nasal Instanyl 100 microgramos/dosis solución para pulverización nasal Instanyl 200 microgramos/dosis solución para pulverización nasal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Instanyl 50 microgramos/dosis solución para pulverización nasal
Cada ml de solución contiene citrato de fentanilo equivalente a 500 microgramos de fentanilo.
1 dosis (100 microlitros) contiene 50 microgramos de fentanilo.
Instanyl 100 microgramos/dosis solución para pulverización nasal
Cada ml de solución contiene citrato de fentanilo equivalente a 1000 microgramos de fentanilo. 1 dosis (100 microlitros) contiene 100 microgramos de fentanilo.
Instanyl 200 microgramos/dosis solución para pulverización nasal
Cada ml de solución contiene citrato de fentanilo equivalente a 2000 microgramos de fentanilo. 1 dosis (100 microlitros) contiene 200 microgramos de fentanilo.
Para consultar la lista completa de excipientes ver sección 6.1
3. FORMA FARMACÉUTICA
Solución para pulverización nasal (pulverizador nasal). DoseGuard Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Instanyl está indicado para el tratamiento del dolor irruptivo en adultos que ya reciben tratamiento de mantenimiento con opioides para el dolor crónico oncológico. El dolor irruptivo es una exacerbación transitoria del dolor que se produce sobre una base de dolor persistente controlado por otros medios. Los pacientes en tratamiento de mantenimiento con opioides son los que reciben al menos 60 mg de morfina oral al día, al menos 25 microgramos de fentanilo transdérmico cada hora, al menos 30 mg de oxicodona al día, al menos 8 mg de hidromorfona al día o una dosis equianalgésica de otro opioide durante un mínimo de una semana
4.2 Posología y forma de administración
El tratamiento debe ser instaurado y seguido bajo la supervisión de un médico con experiencia en el uso de opioides en pacientes oncológicos. Los médicos deben considerar el riesgo del abuso de fentanilo.
Posología
Se deberá ajustar individualmente la dosis hasta obtener una analgesia adecuada con reacciones adversas tolerables. Durante el proceso de ajuste de la dosis se realizará una estrecha monitorización a los pacientes.
El ajuste a dosis más altas requiere la intervención de un profesional sanitario.
En los ensayos clínicos la dosis de Instanyl utilizada para el tratamiento del dolor irruptivo fue independiente de la dosis diaria de mantenimiento con opioides (ver sección 5.1).
Dosis diaria máxima: tratamiento de un máximo de cuatro episodios de dolor irruptivo, administrándose en cada episodio un máximo de dos dosis, con una separación entre ambas de al menos 10 minutos.
Durante la titulación y la terapia de mantenimiento, el paciente deberá esperar al menos 4 horas antes de tratar con Instanyl otro episodio de dolor irruptivo.
Titulación o ajuste de la dosis
Antes de ajustar la dosis de Instanyl, se confirmará que el dolor de base persistente está controlado mediante terapia crónica con opioides y que no padecen más de cuatro episodios de dolor irruptivo al día.
Ajuste de la dosis
La concentración inicial deberá ser una dosis de 50 microgramos en una fosa nasal, ajustando a dosis superiores según sea necesario dentro del rango de concentraciones disponibles (50, 100 y 200 microgramos). Si no se obtiene la analgesia adecuada, se puede administrar de nuevo la misma dosis una vez transcurridos un mínimo de 10 minutos. Cada etapa del ajuste de la dosis (concentración de la dosis) se deberá evaluar en varios episodios.
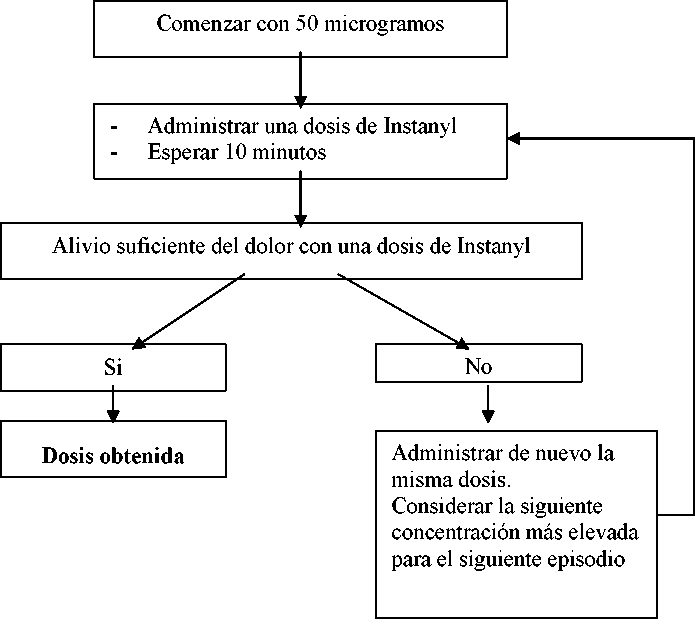
Terapia de mantenimiento
Una vez se ha establecido la dosis de acuerdo con las etapas descritas anteriormente, se deberá mantener al paciente con esta concentración de Instanyl. Si el paciente experimenta un alivio insuficiente del dolor se puede administrar de nuevo la misma dosis una vez transcurridos un mínimo de 10 minutos.
Ajuste de la dosis
En general, se deberá aumentar la concentración de mantenimiento con Instanyl cuando un paciente requiera más de una dosis por episodio de dolor irruptivo durante varios episodios consecutivos. Puede ser necesario ajustar la dosis del tratamiento de base con opioides si el paciente presenta de forma continuada más de cuatro episodios de dolor irruptivo cada 24 horas.
Si las reacciones adversas son intolerables o persistentes, se deberá reducir la dosis o bien reemplazar el tratamiento con Instanyl por otros analgésicos.
Interrupción del tratamiento
Se deberá suspender inmediatamente el tratamiento con Instanyl si el paciente deja de padecer episodios de dolor irruptivo. El tratamiento para el dolor de base persistente deberá mantenerse según lo prescrito.
En caso de que sea necesario interrumpir el tratamiento con opioides, se realizará un estrecho control médico al paciente para evitar los efectos repentinos de la retirada, ya que los opioides requieren una reducción gradual de la dosis.
Poblaciones especiales
Pacientes de edad avanzada
Se dispone de datos escasos sobre la farmacocinética, eficacia y seguridad del uso de Instanyl en pacientes mayores de 65 años de edad. Los pacientes de edad avanzada pueden padecer una reducción del aclaramiento, una semivida más prolongada y una mayor sensibilidad al fentanilo que pacientes más jóvenes. Por lo tanto, se deberá tener precaución en el tratamiento de pacientes de edad avanzada, caquécticos o debilitados.
En los ensayos clínicos, los pacientes de edad avanzada mostraron tendencia a una titulación de dosis efectiva más baja que los pacientes de 65 años de edad. Se deberá tener especial precaución en el ajuste de dosis de Instanyl en pacientes de edad avanzada.
Insuficiencia hepática
Se deberá administrar Instanyl con precaución en pacientes con insuficiencia hepática de moderada a grave (ver sección 4.4).
Insuficiencia renal
Se deberá administrar Instanyl con precaución en pacientes con insuficiencia renal de moderada a grave (ver sección 4.4).
Población pediátrica
No se ha establecido la seguridad y eficacia de Instanyl en niños menores de 18 años de edad. No hay datos disponibles.
Forma de administración:
Instanyl se administra por vía nasal.
Se recomienda que el paciente permanezca sentado o de pie en posición erguida cuando se administre Instanyl.
Después de cada utilización es necesario limpiar el extremo del pulverizador nasal.
Instanyl incorpora un contador de dosis electrónico, y un periodo de bloqueo entre dosis para minimizar el riesgo de sobredosis accidental, uso inadecuado o abuso, y para ofrecer garantías sobre esos riesgos al paciente. Tras la administración de dos dosis dentro del lapso de 60 minutos, Instanyl se bloqueará durante un periodo de 2 horas, a contar desde la primera dosis recibida, antes de que se pueda dispensar otra dosis más.
Precauciones que se deben tomar antes de manipular o administrar el medicamento Antes de utilizar Instanyl por primera vez, se deberá preparar el pulverizador nasal. Se requiere una secuencia de 5 accionamientos del spray nasal, lo que viene indicado por “P5”, “P4”, “P3”, “P2” y “P1” en el indicador.
Si el medicamento no se ha utilizado durante un periodo de más de siete días, se debe pulsar el pulverizador nasal una vez para eliminar el medicamento sobrante antes de administrar la siguiente dosis, lo que viene marcado por una “P” en el indicador.
Durante el proceso de cebado se expulsará parte del medicamento. En consecuencia, se debe instruir al paciente para que ese proceso se realice en zonas bien ventiladas, apuntando lejos de sí o de otras personas, y lejos de superficies u objetos que puedan entrar en contacto con otras personas, en especial niños.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Pacientes que no estén en tratamiento de mantenimiento con opioides, por el mayor riesgo de depresión respiratoria.
Tratamiento del dolor agudo distinto al dolor irruptivo.
Depresión respiratoria grave o enfermedades pulmonares obstructivas graves.
Radioterapia facial previa
Episodios recurrentes de epistaxis (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Depresión respiratoria
Fentanilo puede provocar depresión respiratoria clínicamente significativa y, por tanto, este efecto se deberá vigilar en los pacientes. Los pacientes con dolor que reciben tratamiento crónico con opioides desarrollan tolerancia a la depresión respiratoria, por lo tanto, en estos pacientes se reduce el riesgo de depresión respiratoria. El uso concomitante de depresores del sistema nervioso central puede aumentar el riesgo de depresión respiratoria (ver sección 4.5).
Enfermedad pulmonar crónica
En pacientes con enfermedades pulmonares obstructivas crónicas, fentanilo puede tener reacciones adversas más graves. En estos pacientes, los opioides pueden disminuir el impulso respiratorio y aumentar la resistencia de las vías respiratorias.
Deterioro de la función hepática o renal
Fentanilo deberá ser administrado con precaución en pacientes con insuficiencia hepática o renal de moderada a grave. No se ha evaluado la influencia de la insuficiencia hepática y renal en la farmacocinética de Instanyl; no obstante, cuando se administra por vía intravenosa, el aclaramiento de fentanilo se ve alterado debido a la insuficiencia hepática y renal causada por cambios en el aclaramiento metabólico y proteínas plasmáticas.
Aumento de la presión intracraneal
Fentanilo deberá ser utilizado con precaución en pacientes que muestren evidencia de presión intracraneal elevada, trastorno de la consciencia o coma.
Instanyl se deberá utilizar con precaución en pacientes con tumor cerebral o traumatismo craneal. Cardiopatías
Fentanilo puede producir bradicardia. Por lo tanto, fentanilo deberá utilizarse con precaución en pacientes con bradiarritmias previas o ya existentes. Los opioides pueden causar hipotensión, especialmente en pacientes con hipovolemia. Instanyl deberá ser administrado con precaución en pacientes con hipotensión y/o hipovolemia.
Síndrome serotoninérgico
Se recomienda precaución cuando Instanyl se administre de forma concomitante con fármacos que afecten a los sistemas de neurotransmisores serotoninérgicos.
El desarrollo de un síndrome serotoninérgico potencialmente mortal puede aparecer con el uso concomitante de fármacos serotoninérgicos, como los inhibidores selectivos de la recaptación de serotonina (ISRS) y los inhibidores de la recaptación de serotonina y noradrenalina (IRSN), y con los fármacos que afectan al metabolismo de la serotonina (incluidos los inhibidores de la monoamino oxidasa [IMAO]). Esto puede ocurrir con la dosis recomendada.
El síndrome serotoninérgico puede incluir cambios en el estado mental (p. ej., agitación, alucinaciones, coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, hipertermia), anomalías neuromusculares (p. ej., hiperreflexia, descoordinación, rigidez) y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea).
Si se sospecha de un síndrome serotoninérgico, debe suspenderse el tratamiento con Instanyl. Afecciones nasales
Si el paciente experimenta episodios repetidos de epistaxis o molestias nasales durante el tratamiento con Instanyl, se deberá considerar una vía de administración alternativa para tratar el dolor irruptivo.
Resfriado común
La exposición general a fentanilo en pacientes con resfriado común sin tratamiento previo con un vasoconstrictor nasal es comparable a la obtenida en sujetos sanos. Para el uso concomitante de vasoconstrictores nasales ver sección 4.5.
Posible abuso y dependencia
Pueden desarrollarse tolerancia y dependencia física y/o psicológica tras la administración repetida de opioides como fentanilo. Sin embargo, la adicción iatrogénica por el uso terapéutico de opioides es rara en el tratamiento del dolor oncológico.
Síntomas de abstinencia
Los síntomas de abstinencia se pueden desencadenar al administrar sustancias con actividad antagonista de opioides, ej. naloxona, o analgésicos mixtos agonista/antagonista (ej. pentazocina, butorfanol, buprenorfina, nalbufina).
4.5 Interacción con otros medicamentos y otras formas de interacción
La administración concomitante de fentanilo con un fármaco serotoninérgico, como un inhibidor selectivo de la recaptación de serotonina (ISRS), un inhibidor de la recaptación de serotonina y noradrenalina (IRSN) o un inhibidor de la monoamino oxidasa (IMAO), puede aumentar el riesgo de síndrome serotoninérgico, un trastorno potencialmente mortal.
No se recomienda el uso de Instanyl en pacientes que han sido tratados con inhibidores de la Monoamino Oxidasa (IMAOs) en los 14 días previos debido a que se ha notificado un aumento grave e impredecible de la potencia analgésica de los opioides con inhibidores IMAO.
Fentanilo se metaboliza principalmente por medio del sistema isoenzimático humano citocromo P450 3A4 (CYP3A4), por lo que pueden producirse interacciones cuando Instanyl se administra conjuntamente con medicamentos que afectan a la actividad de CYP3A4. La administración conjunta con medicamentos que inducen la actividad CYP3A4 puede reducir la eficacia de Instanyl. El uso concomitante de Instanyl e inhibidores potentes de CYP3A4 (ej. ritonavir, ketoconazol, intraconazol, trolendomicina, claritromicina y nelfinavir) o inhibidores moderados de CYP3A4 (ej., amprenavir, aprepitant, diltiazem, eritromicina, fluconazol, fosamprenavir y verapamilo) puede aumentar las concentraciones plasmáticas de fentanilo, lo que puede causar reacciones adversas graves al fármaco, incluyendo la depresión respiratoria mortal.
Se deberá monitorizar durante un periodo de tiempo prolongado a los pacientes que reciban Instanyl de forma concomitante con inhibidores moderados o fuertes de CYP3A4. El incremento de dosis se deberá realizar con precaución.
En un estudio de interacción farmacocinética se ha demostrado que la concentración plasmática máxima de fentanilo administrado por vía nasal se reducía en aproximadamente un 50% con el uso concomitante de oximetazolina, mientras que el tiempo en alcanzar la Cmax (Tmax) se duplicaba. Ésto puede disminuir la eficacia de Instanyl. Se recomienda evitar el uso concomitante con descongestionantes nasales (ver sección 5.2).
El uso concomitante de otros depresores del sistema nervioso central, incluyendo otros opioides, sedantes o hipnóticos, anestésicos generales, fenotiazinas, tranquilizantes, relajantes musculares, antihistamínicos sedantes y alcohol pueden potenciar los efectos depresores.
No se recomienda el uso concomitante de agonistas/antagonistas parciales de opioides (ej. buprenorfina, nalbufina, pentazocina). Estos fármacos tienen una elevada afinidad por los receptores de los opioides pero con una actividad intrínseca relativamente baja, por lo que antagonizan parcialmente el efecto analgésico de fentanilo, y pueden inducir síntomas de abstinencia en los pacientes dependientes de opioides.
En los ensayos clínicos no se ha evaluado el uso concomitante de Instanyl con otros medicamentos (diferentes a oximetazolina) administrados por vía nasal. Se recomienda valorar formas de administración alternativas para el tratamiento simultáneo de otras enfermedades que puedan tratarse por vía nasal.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de fentanilo en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (véase 5.3). Se desconoce el riesgo potencial en seres humanos. No debería utilizarse Instanyl en mujeres embarazadas, a menos que fuese claramente necesario.
Después de un tratamiento a largo plazo, fentanilo puede producir síndrome de abstinencia en el recién nacido. Se recomienda no utilizar fentanilo durante el periodo de dilatación y parto (incluso por cesárea) debido a que fentanilo atraviesa la placenta y puede causar depresión respiratoria en el feto.
En el caso de administrar Instanyl, deberá estar disponible fácilmente un antídoto para el niño.
Lactancia
El fentanilo se excreta a través de la leche materna y puede causar sedación y depresión respiratoria en el lactante. El fentanilo no debe usarse durante la lactancia, no pudiendo reiniciarse la lactancia hasta transcurridos como mínimo 5 días desde la última administración de fentanilo.
Fertilidad
No hay datos disponibles sobre la fertilidad en humanos. En estudios con animales, la fertilidad en machos y hembras se vio afectada a dosis que producen sedación (ver sección 5.3).
4.7 Efectos sobre la capacidad de conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad de conducir y utilizar máquinas. No obstante, los analgésicos opioides son conocidos por disminuir la capacidad mental y/o física necesaria para conducir o utilizar máquinas. Se aconsejará a los pacientes que no conduzcan ni utilicen máquinas si padecen somnolencia, mareos, trastornos visuales u otros efectos adversos que puedan disminuir la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Con Instanyl deben esperarse las reacciones adversas típicas de los opioides. Con frecuencia, la mayoría desaparecerá o disminuirá en intensidad con el uso mantenido del medicamento. Las reacciones adversas más graves son depresión respiratoria (que puede conducir a apnea o parada respiratoria), depresión circulatoria, hipotensión y shock, por lo que se deberá hacer un estrecho seguimiento a todos los pacientes.
Los ensayos clínicos con Instanyl se diseñaron para evaluar la seguridad y eficacia en el tratamiento del dolor irruptivo. Todos los pacientes estaban recibiendo opioides al mismo tiempo, como morfina de liberación sostenida o fentanilo transdérmico para el dolor persistente. Por lo tanto, no es posible
aislar los efectos debidos únicamente a Instanyl. En la tabla siguiente se incluyen las reacciones adversas relacionadas según los ensayos clínicos con el tratamiento con Instanyl.
Tabla de reacciones adversas
Para clasificar las reacciones adversas por frecuencia de aparición se utilizan las siguientes categorías: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); y muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Se han notificado las siguientes reacciones adversas con Instanyl y/u otros compuestos que contienen fentanilo provenientes de ensayos clínicos y de la experiencia postcomercialización.
|
Sistema de clasificación de órganos |
Frecuentes |
Poco frecuentes |
Frecuencia no conocida |
|
Trastornos psiquiátricos |
Dependencia, insomnio |
Alucinaciones | |
|
Trastornos del sistema nervioso |
Somnolencia, mareos, cefalea |
Sedación, mioclonía, parestesia, disestesia, disgeusia |
Convulsión |
|
Trastornos del oído y del laberinto |
Vértigo |
Cinetosis | |
|
Trastornos cardiacos |
Hipotensión | ||
|
Trastornos vasculares |
Rubor, sofoco | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
Irritación de garganta |
Depresión respiratoria, epistaxis, úlcera nasal, rinorrea |
Perforación del tabique nasal |
|
Trastornos gastrointestinales |
Náuseas, vómitos |
Estreñimiento, estomatitis, boca seca |
Diarrea |
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis |
Dolor cutáneo, prurito | |
|
Trastornos generales y alteraciones en el lugar de administración |
Pirexia |
Fatiga, malestar general, edema periférico, síndrome de abstinencia* | |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Caídas |
* Se han observado síntomas de síndrome de abstinencia de opioides como náuseas, vómitos, diarrea, ansiedad, escalofríos, temblores y sudoración con la administración de fentanilo por vía transmucosa.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Síntomas
Los síntomas de sobredosis con fentanilo son una extensión de sus acciones farmacológicas, ej. letargia, coma y depresión respiratoria grave. Otros síntomas pueden ser hipotermia, disminución del tono muscular, bradicardia e hipotensión. Los signos de toxicidad son sedación profunda, ataxia, miosis, convulsiones y depresión respiratoria, que es el síntoma principal.
Tratamiento
Se deberán tomar medidas urgentes para el tratamiento de la depresión respiratoria, como la estimulación física o verbal del paciente. Estas medidas pueden continuarse con la administración de un antagonista específico de los opioides como naloxona. La depresión respiratoria después de una sobredosis puede durar más que la acción del antagonista de opioides. La semivida del antagonista puede ser breve, por lo que podría ser necesaria una administración repetida o una infusión continua. La inversión del efecto narcótico puede dar lugar a dolor agudo y liberación de catecolaminas.
Si la situación clínica lo requiere, se fijará y mantendrá una abertura en las vías respiratorias a través de un conducto orofaríngeo o tubo endotraqueal, y se deberá administrar el oxígeno así como mantener una respiración asistida y controlada, según proceda. Se deberá mantener una temperatura corporal y una toma de líquidos adecuada.
Si se produce hipotensión grave o persistente, se considerará la hipovolemia y se tratará la afección con la administración adecuada de líquidos por vía parenteral.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Analgésicos; opioides. Código ATC: N02AB03 Mecanismo de acción
Fentanilo es un analgésico opioide con afinidad fundamentalmente por el receptor ^ de los opioides, actuando como agonista puro y con baja afinidad por los receptores de opioides 5 y k. La acción terapéutica principal es la analgesia. Los efectos farmacológicos secundarios son depresión respiratoria, bradicardia, hipotermia, estreñimiento, miosis, dependencia física y euforia.
Eficacia clínica y seguridad
Se ha valorado la eficacia y seguridad de Instanyl (50, 100 y 200 microgramos) frente a placebo en dos estudios pivotales, aleatorizados, doble ciego, cruzados y controlados, en 279 pacientes oncológicos adultos (32-86 años de edad) y con tolerancia a los opioides y que padecían dolor irruptivo. Los pacientes sufrían un promedio de 1 a 4 episodios diarios mientras recibían tratamiento de mantenimiento con opioides. En el segundo estudio pivotal los pacientes habían participado previamente en el estudio farmacocinético de Instanyl o en el primer estudio pivotal.
Los estudios clínicos mostraron la eficacia y seguridad de Instanyl. No se ha establecido una relación clara entre la dosis del opioide de base y la dosis de Instanyl. No obstante, en el segundo estudio pivotal los pacientes con baja dosis de mantenimiento con opioide mostraron tendencia a conseguir un alivio efectivo del dolor con una dosis menor de Instanyl, comparado con los pacientes que recibían dosis de mantenimiento con opioide superiores. Esto se observó con mayor claridad en los pacientes que utilizaron Instanyl 50 microgramos.
En los ensayos clínicos en pacientes oncológicos las concentraciones más frecuentes utilizadas fueron de 100 y de 200 microgramos.
Las tres dosis de Instanyl mostraron de forma estadísticamente significativa (p<0,001) una elevada diferencia de la intensidad de dolor a los 10 minutos (DID10) frente a placebo. Además, Instanyl fue significativamente superior a placebo en el alivio del dolor irruptivo a los 10, 20, 40, y 60 minutos después de la administración. Los resultados de la suma de las diferencias de la intensidad del dolor (DID) a los 60 minutos (SDID0-60) mostraron que todas las dosis de Instanyl tenían resultados SDID0-60 significativamente más elevados frente a placebo (p<0,001), lo que demuestra un mejor alivio del dolor con Instanyl que con placebo durante 60 minutos.
Se ha evaluado la seguridad y eficacia de Instanyl en pacientes tratados con el medicamento al iniciarse un episodio de dolor irruptivo. Instanyl no deberá utilizarse como preventivo.
La experiencia clínica con Instanyl en pacientes con tratamiento con opioide de base equivalente a > 500 mg/día de morfina o > 200 microgramos/hora de fentanilo transdérmico es limitada.
Dosis superiores a 400 microgramos de Instanyl no han sido evaluadas en ensayos clínicos.
5.2 Propiedades farmacocinéticas Absorción
Fentanilo es muy lipofílico. Fentanilo muestra tres cinéticas de distribución compartimental. Los datos en animales muestran que después de la absorción, fentanilo se distribuye rápidamente al cerebro, corazón, pulmones, riñones y bazo seguido de una redistribución más lenta a músculos y tejido adiposo. La unión a proteínas plasmáticas de fentanilo es aproximadamente del 80%. La biodisponibilidad absoluta de Instanyl es aproximadamente del 89%.
Los datos clínicos muestran que fentanilo se absorbe muy rápidamente a través de la mucosa nasal. La administración de Instanyl en dosis únicas en el intervalo de 50 a 200 microgramos de fentanilo por dosis en pacientes oncológicos con tolerancia a los opioides produce rápidamente un nivel de Cmáx de 0,35 a 1,2 ng/ml. La correspondiente mediana de Tmáx es de 12-15 minutos. Aún así, en un estudio en voluntarios sanos sobre la proporcionalidad de la dosis se observaron valores más altos de Tmax.
Distribución
Tras la administración intravenosa de fentanilo la semivida de distribución inicial es de aproximadamente 6 minutos y se observa una semivida similar a ésta después de la administración nasal de Instanyl. La semivida de eliminación de fentanilo en pacientes oncológicos es aproximadamente de 3-4 horas.
Biotransformación
Fentanilo se metaboliza principalmente en el hígado a través del sistema CYP3A4. El metabolito principal, norfentanilo, es inactivo.
Eliminación
Aproximadamente el 75% de fentanilo se excreta por la orina, en su mayor parte como metabolitos inactivos, y con menos del 10% como principio activo inalterado. Aproximadamente el 9% de la cantidad administrada se recupera en las heces, principalmente como metabolitos.
Linealidad/No linealidad
Instanyl muestra una cinética lineal. La linealidad de la dosis de 50 microgramos a 400 microgramos de Instanyl se ha demostrado en sujetos sanos.
Se realizó un estudio de interacción medicamentosa con un vasoconstrictor nasal (oximetazolina). Los sujetos con rinitis alérgica recibieron oximetazolina por pulverización nasal una hora antes de Instanyl. Se observó que la biodisponibilidad (AUC) de fentanilo era comparable con y sin oximetazolina, mientras que la Cmáx de fentanilo disminuyó y el Tmáx aumentó al doble cuando se administraba oximetazolina. La exposición total a fentanilo en pacientes con rinitis alérgica sin tratamiento previo con un vasoconstrictor nasal es comparable a la observada en sujetos sanos. Se deberá evitar el uso de un vasoconstrictor nasal de forma concomitante (ver sección 4.5).
Bioequivalencia
Un estudio farmacocinético ha mostrado que el pulverizador nasal Instanyl de dosis unitaria y el de dosis múltiple son bioequivalentes.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad y carcinogenicidad.
En un estudio de fertilidad y desarrollo embriogénico precoz en ratas, se observó un efecto relacionado con la rata macho a altas dosis (300 ^g/Kg/día, c.s), que fue consistente con los efectos sedantes de fentanilo en estudios previos realizados en animales. Además, estudios con ratas hembra revelaron una disminución de la fertilidad y una mayor mortalidad embrionaria. Estudios más recientes mostraron que los efectos sobre los embriones se debieron a la toxicidad materna y no a efectos directos de las sustancias sobre el desarrollo embrionario. En un estudio del desarrollo pre y posnatal, el índice de supervivencia se redujo de forma significativa a dosis en las cuales se había producido una reducción del peso materno. Este efecto puede ser debido a alteración de los cuidados en la madre o a un efecto directo de fentanilo sobre las crías. No se observaron efectos sobre el desarrollo somático y de conducta de la descendencia. No se han demostrado efectos teratogénicos.
Los estudios de tolerancia local con Instanyl en mini cerdos demostraron que la administración de Instanyl fue bien tolerada.
Los estudios de carcinogenicidad (bioensayo dérmico alternativo de 26 semanas en ratones transgénicos Tg.AC; estudio de carcinogenicidad subcutánea de 2 años en ratas) con fentanilo no pusieron de manifiesto ningún hallazgo indicativo de potencial oncogénico. La evaluación de los cortes laminares de cerebro del estudio de carcinogenicidad en ratas mostró lesiones cerebrales en los animales tratados con dosis altas de citrato de fentanilo. Se desconoce la relevancia de estos hallazgos para los seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Fosfato de sodio dihidrogenado dihidrato Fosfato disódico dihidratado.
Agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
Instanyl 50 microgramos/dosis solución para pulverización nasal Instanyl 100 microgramos/dosis solución para pulverización nasal Instanyl 200 microgramos/dosis solución para pulverización nasal 18 meses
6.4 Precauciones especiales de conservación
Conservar por debajo de 30°C.
No congelar.
6.5 Naturaleza y contenido del envase
Envase para pulverización nasal de polipropileno (PP) consistente en un frasco de vidrio (vidrio marrón Tipo I) con bomba dosificadora. El envase para pulverización nasal tiene un indicador electrónico, un contador de dosis, un mecanismo de bloqueo y un cierre de seguridad a prueba de niños .
Disponible en las siguientes presentaciones:
Instanyl 50 microgramos/dosis solución para pulverización nasal DoseGuard
2,0 ml con 1,00 mg de fentanilo, que contienen 10 dosis de 50 microgramos
3,2 ml con 1,60 mg de fentanilo, que contienen 20 dosis de 50 microgramos
4.3 ml con 2,15 mg de fentanilo, que contienen 30 dosis de 50 microgramos
5.3 ml con 2,65 mg de fentanilo, que contienen 40 dosis de 50 microgramos
Instanyl 100 microgramos/dosis solución para pulverización nasal DoseGuard
2.0 ml con 2,00 mg de fentanilo, que contienen 10 dosis de 100 microgramos
3.2 ml con 3,20 mg de fentanilo, que contienen 20 dosis de 100 microgramos
4.3 ml con 4,30 mg de fentanilo, que contienen 30 dosis de 100 microgramos
5.3 ml con 5,30 mg de fentanilo, que contienen 40 dosis de 100 microgramos
Instanyl 200 microgramos/dosis solución para pulverización nasal DoseGuard
2.0 ml con 4,00 mg de fentanilo, que contienen 10 dosis de 200 microgramos
3.2 ml con 6,40 mg de fentanilo, que contienen 20 dosis de 200 microgramos
4.3 ml con 8,60 mg de fentanilo, que contienen 30 dosis de 200 microgramos
5.3 ml con 10,60 mg de fentanilo, que contienen 40 dosis de 200 microgramos
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Por el posible uso inadecuado de fentanilo y la posible cantidad de solución que pueda quedar, todos los spray nasales, utilizados o no, deben ser devueltos de forma sistemática y desecharse de acuerdo con la normativa local, o devolverse a la farmacia.
El pulverizador nasal contiene baterías. Las baterías no pueden ser reemplazadas.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Instanyl 50 microgramos/dosis solución para pulverización nasal EU/1/09/531/022-025
Instanyl 100 microgramos/dosis solución para pulverización nasal EU/1/09/531/026-029
Instanyl 200 microgramos/dosis solución para pulverización nasal EU/1/09/531/030-033
9. FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización:
Fecha de la última renovación:
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
ANEXO II
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes responsables de la liberación de los lotes para el pulverizador nasal multidosis
Takeda Nycomed AS Solbaervegen 5 NO-2409 Elverum Noruega
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Alemania
Nombre y dirección de los fabricantes responsables de la liberación de los lotes para el pulverizador nasal en dosis unitarias
Takeda Nycomed AS Solbaervegen 5 NO-2409 Elverum Noruega
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Alemania
Nombre y dirección del fabricante responsable de la liberación de los lotes para el pulverizador nasal
multidosis DoseGuard
Takeda GmbH
Robert-Bosch-Strasse 8
D - 78224 Singen
Alemania
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica especial y restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Medidas adicionales de minimización de riesgos
Antes de lanzar el medicamento en cada Estado Miembro en formato multidosis y dosis unitaria, el TAC deberá acordar el material educativo final con las Autoridades Sanitarias Competentes.
El TAC deberá asegurarse que a todos los médicos, farmacéuticos y pacientes susceptibles de prescribir/dispensar/utilizar Instanyl se les proporciona del material educativo para el uso adecuado y seguro del medicamento.
El material educativo para los pacientes deberá contener lo siguiente:
• Instrucciones de uso del dispositivo de Instanyl pulverizador nasal.
• Instrucciones de apertura y cierre de la caja de seguridad para niños (para el pulverizador nasal multidosis) o el cierre de seguridad a prueba de niños (para el spray multidosis DoseGuard) o de apertura del blíster (para el pulverizador nasal en dosis unitarias).
• Para el pulverizador nasal multidosis: información sobre el cuadro contador de dosis.
• Sólo usar el pulverizador nasal de Instanyl si están tomando otro medicamento opioide de base a diario.
• Sólo usar el pulverizador nasal de Instanyl si han padecido episodios de dolor irruptivo en cancer.
• No usar el pulverizador nasal de Instanyl para tratar cualquier otro tipo de dolor , tales como dolor de cabeza, dolor de espalda o dolor de muelas.
• No usar el pulverizador nasal de Instanyl para tratar más de 4 episodios de dolor irruptivo oncológico al día.
• Sólo usar el pulverizador nasal de Instanyl si han recibido la información apropiada sobre el uso del dispositivo y las precauciones de seguridad de su médico prescriptor y/o farmacéutico.
• Guardar siempre el pulverizador nasal multidosis en la caja de seguridad para niños después de ser utilizado.
• Recolocar siempre el cierre de seguridad a prueba de niños en el spray nasal multidosis DoseGuard, y cerrarla después de cada uso.
• Mantener siempre Instanyl fuera del alcance y de la vista de los niños puesto que puede ser perjudicial para ellos. Si un niño se expone accidentalmente a Instanyl le puede causar la muerte, por lo que se debe buscar asistencia médica de forma inmediata.
• Sólo el paciente o el cuidador deben manejar el pulverizador nasal puesto que contiene un medicamento que es atractivo a las personas por su posible abuso.
• En el caso del pulverizador nasal multidosis y el spray nasal multidosis DoseGuard, todos los dispositivos no usados o envases vacíos deben devolverse sistemáticamente de acuerdo a la normativa local.
• En el caso del pulverizador nasal en dosis unitarias, todos los dispositivos no usados o recipientes vacíos deben devolverse sistemáticamente de acuerdo a la normativa local.
El material educativo para los médicos deberá contener lo siguiente:
• El pulverizador nasal de Instanyl se usará solo por médicos con experiencia, conocimiento y destreza en el uso de la terapia con opioides en pacientes con cancer.
• El pulverizador nasal de Instanyl sólo está indicado para el tratamiento del dolor irruptivo en adultos que ya reciben tratamiento de mantenimiento con opioides para el dolor crónico oncológico.
• El pulverizador nasal de Instanyl no deberá ser utilizado para tratar cualquier otro dolor de corta duración u otros episodios de dolor.
• Los médicos prescriptores deben asegurarse que el paciente entiende como se debe usar correctamente Instanyl, de acuerdo con la ficha técnica o el resumen de las características del producto (RCP) y el prospecto de información al paciente, así como asegurarse que tanto pacientes como cuidadores son conscientes de los riesgos asociados con Instanyl, incluyendo riesgos de sobredosis, mala utilización, dependencia y abuso.
• Los médicos prescriptores del pulverizador nasal de Instanyl deberán realizar una selección crítica de los pacientes, vigilarles cuidadosamente durante todo el tratamiento y asesorarles al respecto.
• Instrucciones de uso del dispositivo del pulverizador nasal de fentanilo
• Instrucciones de apertura y cierre de la caja de seguridad para niños (para el pulverizador nasal multidosis) o el cierre de seguridad a prueba de niños (para el spray multidosis DoseGuard) o la apertura del blíster (para el pulverizador nasal en dosis unitarias).
• Información sobre el cuadro contador de dosis incluido en el desplegable de la caja y en el material educativo del pulverizador nasal multidosis.
• En el caso del pulverizador nasal multidosis y el spray nasal multidosis DoseGuard, todos los dispositivos no usados o envases vacios deben devolverse sistematicamente de acuerdo a la normativa local.
• En el caso del pulverizador nasal en envase unitario, todos los dispositivos no usados o envases vacíos deben devolverse sistemáticamente de acuerdo a la normativa local.
• El médico prescriptor debe utilizar un listado de verificación para prescriptores.
El material educativo para los farmacéuticos deberá contener lo siguiente:
• El pulverizador nasal de Instanyl esta sólo indicado y autorizado para el uso de dolor irruptivo en adultos que ya reciben terapia de base con opioides para el dolor crónico oncológico.
• El pulverizador nasal de Instanyl no se usará para tratar cualquier otro dolor de corta duración u otros episodios de dolor.
• El farmacéutico debe ser consciente de que cualquier prescripción fuera de indicación y sospecha de abuso o mal uso de Instanyl debe ser notificado de acuerdo con la normativa local sobre notificación de reacciones adversas. Se debe considerar contactar con el médico para comentar estos casos.
• El farmacéutico deberá familiarizarse con el material educativo del pulverizador nasal de Instanyl antes de utilizarlo dentro de su organización.
• Las concentraciones de dosis del pulverizador nasal de Instanyl no se pueden comparar con otros productos de Fentanilo.
• Instrucciones de uso del dispositivo de Instanyl pulverizador nasal.
• Instrucciones de apertura y cierre de la caja de seguridad para niños (para el pulverizador nasal multidosis) o el cierre de seguridad a prueba de niños (para el spray multidosis DoseGuard) o la apertura del blíster (para el pulverizador nasal en dosis unitarias).
• Información sobre el cuadro contador de dosis incluido en el desplegable de la caja y en el material educativo del pulverizador nasal multidosis.
• El farmacéutico debe informar al paciente que para evitar el robo y mal uso del pulverizador nasal de Instanyl, tienen que guardarlo en un lugar seguro para evitar su mal uso y malversación.
• En el caso del pulverizador nasal multidosis y el spray nasal multidosis DoseGuard, todos los dispositivos no usados o envases vacios deben devolverse sistematicamente de acuerdo a la normativa local.
• En el caso del pulverizador nasal en dosis unitarias, todos los dispositivos no usados o envases vacíos deben devolverse sistemáticamente de acuerdo a la normativa local.
• El farmacéutico debe hacer uso de un formulario para farmacéuticos.
ANEXO III
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA EXTERIOR CON SEGURIDAD PARA NIÑOS (Multidosis)_
1. NOMBRE DEL MEDICAMENTO
Instanyl 50 microgramos/dosis solución para pulverización nasal Fentanilo
2. PRINCIPIO(S) ACTIVO(S)
1 ml contiene citrato de fentanilo equivalente a 500 microgramos de fentanilo. 1 dosis de 100 microlitros equivale a 50 microgramos de fentanilo.
3. LISTA DE EXCIPIENTES
También contiene: fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado, agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1.8 ml de solución para pulverización nasal
2.9 ml de solución para pulverización nasal
5.0 ml de solución para pulverización nasal
1.8 ml 10 dosis
2.9 ml 20 dosis
5.0 ml 40 dosis
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Por vía nasal
Instrucciones de apertura y cierre de la caja:
- Coja la caja
- Retire el precinto comprobando que el envase no ha sido abierto anteriormente.
- Coloque el pulgar y el dedo índice/corazón/anular en las pestañas laterales.
- Presione las pestañas laterales hacia dentro utilizando el dedo pulgar y el índice/corazón/anular.
- Al mismo tiempo, coloque el pulgar de la otra mano en la pestaña de presión frontal y presione también hacia dentro.
- Continúe aplicando presión en los tres puntos.
- Tire de la tapa para abrir.
- Despues del uso de Instanyl el spray nasal se deberá colocar de nuevo en la bandeja interior de la
caja y cerrar la caja.

- Al cerrar la caja asegúrese que las pestañas laterales se introducen correctamente en las ranuras.
- Presione hacia abajo firmemente hasta que las pestañas laterales vuelvan a su posición con un “click”.
Marque una casilla despues de cada dosis administrada [Marque las casillas de 10, 20 o 40]

Después de su uso, coloque siempre el pulverizador nasal en la caja de seguridad para niños.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7.
OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar por debajo de 30°C. Mantener el envase en posición vertical. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Consulte el prospecto para información sobre eliminación
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/531/001
EU/1/09/531/002
EU/1/09/531/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Instanyl 50
ETIQUETADO FRASCO (Multidosis)_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Instanyl 50 microgramos/dosis pulverización nasal Fentanilo
Vía nasal
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1.8 ml 10 dosis
2.9 ml 20 dosis 5.0 ml 40 dosis
6. OTROS
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA EXTERIOR CON SEGURIDAD PARA NIÑOS (Multidosis)_
1. NOMBRE DEL MEDICAMENTO
Instanyl 100 microgramos/dosis solución para pulverización nasal Fentanilo
2. PRINCIPIO(S) ACTIVO(S)
1 ml contiene citrato de fentanilo equivalente a 1000 microgramos de fentanilo. 1 dosis de 100 microlitros equivale a 100 microgramos de fentanilo.
3. LISTA DE EXCIPIENTES
También contiene: fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado, agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1.8 ml de solución para pulverización nasal
2.9 ml de solución para pulverización nasal
5.0 ml de solución para pulverización nasal
1.8 ml - 10 dosis
2.9 ml - 20 dosis
5.0 ml - 40 dosis
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Por vía nasal
Instrucciones de apertura y cierre de la caja:
- Coja la caja
- Retire el precinto comprobando que el envase no ha sido abierto anteriormente.
- Coloque el pulgar y el dedo índice/corazón/anular en las pestañas laterales.
- Presione las pestañas laterales hacia dentro utilizando el dedo pulgar y el índice/corazón/anular.
- Al mismo tiempo, coloque el pulgar de la otra mano en la pestaña de presión frontal y presione también hacia dentro.
- Continúe aplicando presión en los tres puntos.
- Tire de la tapa para abrir.
- Despues del uso de Instanyl el spray nasal se deberá colocar de nuevo en la bandeja interior de la
caja y cerrar la caja.
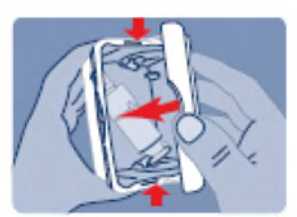

- Al cerrar la caja asegúrese que las pestañas laterales se introducen correctamente en las ranuras.
- Presione hacia abajo firmemente hasta que las pestañas laterales vuelvan a su posición con un “click”.
Marque una casilla despues de cada dosis administrada (Marque las casillas de 10, 20 o 40)

Después de su uso, coloque siempre el pulverizador nasal en la caja de seguridad para niños
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7.
OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar por debajo de 30°C. Mantener el envase en posición vertical. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Consulte el prospecto para información sobre eliminación
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/531/004
EU/1/09/531/005
EU/1/09/531/006
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Instanyl 100
ETIQUETADO FRASCO (Multidosis)_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Instanyl 100 microgramos/dosis pulverización nasal
Fentanilo
Vía nasal
|
2. |
FORMA DE ADMINISTRACIÓN |
|
3. |
FECHA DE CADUCIDAD |
|
CAD | |
|
4. |
NÚMERO DE LOTE |
|
Lote | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES |
1.8 ml -10 dosis
2.9 ml -20 dosis 5.0 ml -40 dosis
6. OTROS
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA EXTERIOR CON SEGURIDAD PARA NIÑOS (Multidosis)_
1. NOMBRE DEL MEDICAMENTO
Instanyl 200 microgramos/dosis solución para pulverización nasal Fentanilo
2. PRINCIPIO(S) ACTIVO(S)
1 ml contiene citrato de fentanilo equivalente a 2000 microgramos de fentanilo. 1 dosis de 100 microlitros equivale a 200 microgramos de fentanilo.
3. LISTA DE EXCIPIENTES
También contiene: fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado, agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1.8 ml de solución para pulverización nasal
2.9 ml de solución para pulverización nasal
5.0 ml de solución para pulverización nasal
1.8 ml -10 dosis
2.9 ml -20 dosis
5.0 ml -40 dosis
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Por vía nasal
Leer el prospecto antes de utilizar este medicamento.
Instrucciones de apertura y cierre de la caja:
- Coja la caja
- Retire el precinto comprobando que el envase no ha sido abierto anteriormente.
- Coloque el pulgar y el dedo índice/corazón/anular en las pestañas laterales.

- Presione las pestañas laterales hacia dentro utilizando el dedo pulgar y el índice/corazón/anular.
- Al mismo tiempo, coloque el pulgar de la otra mano en la pestaña de presión frontal y presione también hacia dentro.
- Continúe aplicando presión en los tres puntos.
- Despues del uso de Instanyl el spray nasal se deberá colocar de nuevo en la bandeja interior de la
caja y cerrar la caja.
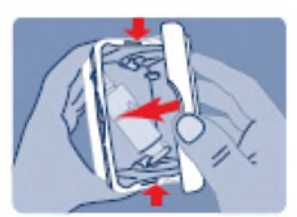
- Al cerrar la caja asegúrese que las pestañas laterales se introducen correctamente en las ranuras.
- Presione hacia abajo firmemente hasta que las pestañas laterales vuelvan a su posición con un “click”.
Marque una casilla despues de cada dosis administrada (Marque las casillas de 10, 20 o 40)

Después de su uso, coloque siempre el pulverizador nasal en la caja de seguridad para niños
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7.
OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar por debajo de 30°C. Mantener el envase en posición vertical. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Consulte el prospecto para información sobre eliminación
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/531/007
EU/1/09/531/008
EU/1/09/531/009
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Instanyl 200
ETIQUETADO FRASCO (Multidosis)_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Instanyl 200 microgramos/dosis pulverización nasal
Fentanilo
Vía nasal
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1.8 ml - 10 dosis
2.9 ml - 20 dosis 5.0 ml - 40 dosis
6. OTROS
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CARTONAJE EXTERIOR (Unidosis)_
1. NOMBRE DEL MEDICAMENTO
Instanyl 50 microgramos solución para pulverización nasal en envase unidosis Fentanilo
2. PRINCIPIO(S) ACTIVO(S)
1 dosis (100 microlitros) contiene citrato de fentanilo equivalente a 50 microgramos (^g) de fentanilo.
3. LISTA DE EXCIPIENTES
También contiene: fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado, agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución para pulverización nasal
2 envases unidosis 6 envases unidosis 8 envases unidosis 10 envases unidosis
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Por vía nasal
El pulverizador contiene una sola dosis, por tanto, no probar antes de ser utilizado.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9.
CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar por debajo de 30°C.
Conservar el blíster en el embalaje exterior. Conservar en posición vertical.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Consulte el prospecto para información sobre eliminación
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/531/010
EU/1/09/531/011
EU/1/09/531/012
EU/1/09/5331/013
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Instanyl 50, dosis unitaria
ACONDICIONAMIENTO INTERMEDIO EN BLISTER RESISTENTE A NIÑOS (Unidosis)
1. NOMBRE DEL MEDICAMENTO_
Instanyl 50 microgramos pulverizador nasal Fentanilo
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
Vía nasal 1 dosis
Mantener fuera de la vista y del alcance de los niños
ETIQUETADO PULVERIZADOR NASAL DE DOSIS UNITARIA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Instanyl 50 ^g pulverizador nasal
Fentanilo
Vía nasal
|
2. |
FORMA DE ADMINISTRACIÓN |
|
3. |
FECHA DE CADUCIDAD |
|
CAD |
4. NÚMERO DE LOTE
|
Lote | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES |
|
1 dosis | |
|
6. |
OTROS |
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CARTONAJE EXTERIOR (Unidosis)_
1. NOMBRE DEL MEDICAMENTO
Instanyl 100 microgramos solución para pulverización nasal en envase unidosis Fentanilo
2. PRINCIPIO(S) ACTIVO(S)
1 dosis (100 microlitros) contieen citrato de fentanilo equivalente a 100 microgramos (^g) de fentanilo
3. LISTA DE EXCIPIENTES
También contiene: fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado, agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución para pulverización nasal
2 envases unidosis 6 envases unidosis 8 envases unidosis 10 envases unidosis
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Por vía nasal El pulverizador contiene una sola dosis, por tanto, no probar antes de ser utilizado.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar por debajo de 30°C.
Conservar el blíster en el embalaje exterior. Conservar en posición vertical.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Consulte el prospecto para información sobre eliminación
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/531/014
EU/1/09/531/015
EU/1/09/531/016
EU/1/09/531/017
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Instanyl 100, dosis unitaria
ACONDICIONAMIENTO INTERMEDIO EN BLISTER RESISTENTE A NIÑOS (Unidosis)
1. NOMBRE DEL MEDICAMENTO_
Instanyl 100 microgramos pulverizador nasal Fentanilo
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
Vía nasal 1 dosis
Mantener fuera de la vista y del alcance de los niños
ETIQUETADO PULVERIZADOR NASAL DE DOSIS UNITARIA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Instanyl 100 ^g pulverizador nasal Fentanilo
Vía nasal
|
2. |
FORMA DE ADMINISTRACIÓN |
|
3. |
FECHA DE CADUCIDAD |
|
CAD |
4. NÚMERO DE LOTE
|
Lote | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES |
|
1 dosis | |
|
6. |
OTROS |
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CARTONAJE EXTERIOR (Unidosis)_
1. NOMBRE DEL MEDICAMENTO
Instanyl 200 microgramos solución para pulverización nasal en envase unidosis Fentanilo
2. PRINCIPIO(S) ACTIVO(S)
1 dosis (100 microlitros) contiene citrato de fentanilo equivalente a 200 microgramos (^g) de fentanilo
3. LISTA DE EXCIPIENTES
También contiene: fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado, agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución para pulverización nasal
2 envases unidosis 6 envases unidosis 8 envases unidosis 10 envases unidosis
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento Por vía nasal
El pulverizador contiene una sola dosis, por tanto, no probar antes de ser utilizado.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Conservar por debajo de 30°C.
Conservar el blíster en el embalaje exterior. Conservar en posición vertical.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Consulte el prospecto para información sobre eliminación
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/531/018
EU/1/09/531/019
EU/1/09/531/020
EU/1/09/531/021
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Instanyl 200, dosis unitaria
ACONDICIONAMIENTO INTERMEDIO EN BLISTER RESISTENTE A NIÑOS (Unidosis)
1. NOMBRE DEL MEDICAMENTO_
Instanyl 200 microgramos pulverizador nasal Fentanilo
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
Vía nasal 1 dosis
Mantener fuera de la vista y del alcance de los niños
ETIQUETADO PULVERIZADOR NASAL DE DOSIS UNITARIA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Instanyl 200 ^g pulverizador nasal
Fentanilo
Vía nasal
|
2. |
FORMA DE ADMINISTRACIÓN |
|
3. |
FECHA DE CADUCIDAD |
|
CAD |
4. NÚMERO DE LOTE
|
Lote | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES |
|
1 dosis | |
|
6. |
OTROS |
CARTONAJE EXTERIOR: DoseGuard_
1. NOMBRE DEL MEDICAMENTO
Instanyl 50 microgramos/dosis solución para pulverización nasal Fentanilo
2. PRINCIPIO(S) ACTIVO(S)
1 ml contiene citrato de fentanilo equivalente a 500 microgramos de fentanilo. 1 dosis de 100 microlitros equivale a 50 microgramos de fentanilo.
3. LISTA DE EXCIPIENTES
También contiene: fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado, agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
DoseGuard
2,0 ml de solución para pulverización nasal
3.2 ml de solución para pulverización nasal
4.3 ml de solución para pulverización nasal
5.3 ml de solución para pulverización nasal
10 dosis (2,0 ml)
20 dosis (3,2 ml)
30 dosis (4,3 ml)
40 dosis (5,3 ml)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Por vía nasal
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Cerrar siempre después de su uso colocando de nuevo el cierre de seguridad a prueba de niños en el spray nasal.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO

CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar por debajo de 30°C. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Consulte el prospecto para información sobre eliminación
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/531/022
EU/1/09/531/023
EU/1/09/531/024
EU/1/09/531/025
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
ETIQUETADO / SPRAY NASAL DoseGuard
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Instanyl 50 microgramos/dosis pulverización nasal
Fentanilo
Vía nasal
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
10 dosis (2,0 ml) 20 dosis (3,2 ml) 30 dosis (4,3 ml) 40 dosis (5,3 ml)
6. OTROS
Mantener fuera de la vista y del alcance de los niños.
Cerrar siempre después de su uso colocando de nuevo el cierre de seguridad a prueba de niños en el spray nasal.
CARTONAJE EXTERIOR DoseGuard_
1. NOMBRE DEL MEDICAMENTO
Instanyl 100 microgramos/dosis solución para pulverización nasal Fentanilo
2. PRINCIPIO(S) ACTIVO(S)
1 ml contiene citrato de fentanilo equivalente a 1000 microgramos de fentanilo. 1 dosis de 100 microlitros equivale a 100 microgramos de fentanilo.
3. LISTA DE EXCIPIENTES
También contiene: fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado, agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
DoseGuard
2,0 ml de solución para pulverización nasal
3.2 ml de solución para pulverización nasal
4.3 ml de solución para pulverización nasal
5.3 ml de solución para pulverización nasal
10 dosis (2,0 ml)
20 dosis (3,2 ml)
30 dosis (4,3 ml)
40 dosis (5,3 ml)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Por vía nasal
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Cerrar siempre después de su uso colocando de nuevo el cierre de seguridad a prueba de niños en el spray nasal.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO

CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar por debajo de 30°C. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Consulte el prospecto para información sobre eliminación
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/531/026
EU/1/09/531/027
EU/1/09/531/028
EU/1/09/531/029
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
ETIQUETADO / SPRAY NASAL DoseGuard
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Instanyl 100 microgramos/dosis pulverización nasal
Fentanilo
Vía nasal
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
10 dosis (2,0 ml) 20 dosis (3,2 ml) 30 dosis (4,3 ml) 40 dosis (5,3 ml)
6. OTROS
Mantener fuera de la vista y del alcance de los niños.
Cerrar siempre después de su uso colocando de nuevo el cierre de seguridad a prueba de niños en el spray nasal.
CARTONAJE EXTERIOR DoseGuard_
1. NOMBRE DEL MEDICAMENTO
Instanyl 200 microgramos/dosis solución para pulverización nasal Fentanilo
2. PRINCIPIO(S) ACTIVO(S)
1 ml contiene citrato de fentanilo equivalente a 2000 microgramos de fentanilo. 1 dosis de 100 microlitros equivale a 200 microgramos de fentanilo.
3. LISTA DE EXCIPIENTES
También contiene: fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado, agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
DoseGuard
2,0 ml de solución para pulverización nasal
3.2 ml de solución para pulverización nasal
4.3 ml de solución para pulverización nasal
5.3 ml de solución para pulverización nasal
10 dosis (2,0 ml)
20 dosis (3,2 ml)
30 dosis (4,3 ml)
40 dosis (5,3 ml)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Por vía nasal
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Cerrar siempre después de su uso colocandode nuevo el cierre de seguridad a prueba de niños en el spray nasal.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO

CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar por debajo de 30°C. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Consulte el prospecto para información sobre eliminación
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/531/030
EU/1/09/531/031
EU/1/09/531/032
EU/1/09/531/033
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
ETIQUETADO / SPRAY NASAL DoseGuard
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Instanyl 200 microgramos/dosis pulverización nasal
Fentanilo
Vía nasal
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
10 dosis (2,0 ml) 20 dosis (3,2 ml) 30 dosis (4,3 ml) 40 dosis (5,3 ml)
6. OTROS
Mantener fuera de la vista y del alcance de los niños.
Cerrar siempre después de su uso colocando de nuevo el cierre de seguridad a prueba de niños en el spray nasal.
B. PROSPECTO
Instanyl 50 microgramos/dosis solución para pulverización nasal Instanyl 100 microgramos/dosis solución para pulverización nasal Instanyl 200 microgramos/dosis solución para pulverización nasal
Fentanilo
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya quede puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos signos de enfermedad que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, enfermero o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto:
1. Qué es Instanyl y para qué se utiliza.
2. Qué necesita saber antes de empezar a usar Instanyl
3. Cómo usar Instanyl
4. Posibles afectos adversos
5. Conservación de Instanyl
6. Contenido del envase e información adicional
1. Qué es Instanyl y para qué se utiliza
Instanyl contiene el principio activo fentanilo y pertenece a un grupo de analgésicos fuertes denominados opioides. Los opioides actúan bloqueando las señales del dolor que van al cerebro. Instanyl actúa con mucha rapidez y se utiliza para aliviar el dolor irruptivo en pacientes adultos con cáncer que ya tratan con opioides su dolor de base. El dolor irruptivo es un dolor adicional repentino que aparece a pesar del uso de los analgésicos opioides habituales para aliviar el dolor.
2. Qué necesita saber antes de empezar a usar Instanyl
No use Instanyl:
- si es alérgico (hipersensible) al fentanilo o cualquiera de los demás componentes de Instanyl;
- si no está usando regularmente un medicamento opioide prescrito por su médico (p. ej., codeína, fentanilo, hidromorfona, morfina, oxicodona, meperidina), todos los días a la misma hora, al menos durante una semana, para controlar el dolor persistente. Si no ha estado usando esos medicamentos, no use Instanyl dado que su uso puede aumentar el riesgo de que su respiración se vuelva más lenta y/o poco profunda, e incluso de que llegue a pararse.
- si padece dolor de corta duración distinto al dolor irruptivo.
- si tiene graves dificultades al respirar o sufre alguna enfermedad pulmonar obstructiva grave;
- si ha recibido previamente radioterapia facial;
- si sufre episodios repetidos de hemorragia nasal;
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Instanyl, especialmente
- si padece una enfermedad pulmonar obstructiva crónica, Instanyl puede alterar su ritmo respiratorio;
- si tiene problemas de corazón, especialmente frecuencia cardiaca bajapresión sanguínea baja o bajo volumen sanguíneo;
- si tiene problemas de hígado o riñones;
- si tiene problemas con su función cerebral, por ejemplo, debido a un tumor cerebral, a un traumatismo craneal o a un aumento de la presión intracraneal;
- si toma antidepresivos o antipsicóticos; consulte la sección Uso de Instanyl con otros medicamentos.
- si utiliza otros productos para pulverización nasal, por ejemplo, para el resfriado común o para la alergia;
Es importante que consulte inmediatamente con su médico u hospital si experimenta dificultades en la respiración mientras recibe tratamiento con Instanyl.
Si le sangra la nariz de forma repetida o nota molestias nasales durante el tratamiento con Instanyl, deberá consultar con su médico, que estudiará un tratamiento alternativo para tratar su dolor irruptivo.
Es importante que informe a su médico si cree que está desarrollando dependencia a Instanyl.
Niños y adolescentes
Instanyl no se debe usar en niños y adolescentes menores de 18 años.
Uso de Instanyl con otros medicamentos
Informe a su médico o farmacéutico si está utilizando,o ha utilizado recientemente, o podría tener que utilizar cualquier otro medicamento, incluso los adquiridos sin receta.
Instanyl puede afectar o verse afectado por otros medicamentos.
Se deberá tener especial cuidado si está siendo tratado con alguno de los siguientes medicamentos:
- Cualquier medicamento que pueda producirle sueño (que tenga efecto sedante) como comprimidos para dormir, medicamentos para tratar la ansiedad, antihistamínicos o tranquilizantes.
- Cualquier medicamento que pueda modificar la forma en que su cuerpo metaboliza Instanyl, como
• ritonavir, nelfinavir, amprenavir, y fosamprenavir (medicamentos que ayudan a controlar las infecciones por VIH)
• inhibidores de CYP3A4, como ketoconazol, itraconazol, o fluconazol (utilizados para el tratamiento de infecciones por hongos)
• troleandomicina, claritromicina, o eritromicina (medicamentos para el tratamiento de las infecciones por bacterias)
• aprepitant (utilizado para tratar náuseas fuertes)
• diltiazem y verapamilo (medicamentos para tratar la tensión alta o enfermedades del corazón)
- Medicamentos denominados inhibidores de la Monoamino-Oxidasa (IMAO), utilizados para la depresión grave, incluso si se le ha tratado con uno de ellos en las últimas 2 semanas.
- El riesgo de efectos adversos aumenta si está tomando medicamentos tales como ciertos antidepresivos o antipsicóticos. Instanyl puede interactuar con estos medicamentos y usted puede presentar cambios en el estado mental (p. ej., agitación, alucinaciones, coma) y otros efectos como temperatura corporal mayor de 38°C, aumento de la frecuencia cardiaca, presión arterial inestable y exageración de los reflejos, rigidez muscular, falta de coordinación y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea). Su medico le dirá si Instanyl es adecuado para usted.
- Medicamentos denominados agonistas/antagonistas parciales, ej. buprenorfina, nalbufina y pentazocina (medicamentos para tratar el dolor). Es posible que experimente síntomas de síndrome de abstinencia (náuseas, vómitos, diarrea, ansiedad, escalofríos, temblores y sudoración).
- Otros medicamentos administrados por vía nasal, especialmente oximetazolina, xilometazolina y medicamentos similares, que se utilizan para el alivio de la congestión nasal.
Uso de Instanyl con los alimentos, bebidas y alcohol
No tome bebidas alcohólicas durante el tratamiento con Instanyl, ya que pueden aumentar el riesgo de sufrir efectos adversos peligrosos.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte con su médico o farmacéutico antes de utilizar cualquier medicamento.
No se deberá utilizar Instanyl durante el embarazo, a menos que lo haya consultado con su médico.
No se deberá utilizar Instanyl durante el parto ya que fentanilo puede causar problemas respiratorios graves en el recién nacido.
El fentanilo puede pasar a la sangre materna y causar efectos adversos en el lactante. No use Instanyl si está dando el pecho a su hijo. No debe iniciar la lactancia hasta transcurridos al menos 5 días desde la última dosis de Instanyl.
Conducción y uso de máquinas
No deberá conducir ni usar máquinas mientras recibe tratamiento con Instanyl. Instanyl puede causar mareos y somnolencia, que pueden afectar a la capacidad para conducir o usar máquinas.
3. Cómo usar Instanyl
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis de Instanyl es independiente de su tratamiento de base para el dolor oncológico.
Cuando comience a utilizar Instanyl, su médico determinará con usted la dosis que alivie su dolor irruptivo.
La dosis inicial es una pulverización de 50 microgramos en una fosa nasal cada vez que tenga un episodio de dolor irruptivo. Durante la determinación de su dosis adecuada, su médico le puede indicar que cambie a una dosis mayor.
En caso de que el dolor irruptivo no se alivie pasados 10 minutos, puede utilizar sólo una pulverización más para este episodio.
Deberá esperar cuatro horas antes de tratar el siguiente episodio de dolor irruptivo.
Puede utilizar Instanyl para tratar un máximo de cuatro episodios de dolor irruptivo al día.
Deberá consultar con su médico si sufre más de cuatro episodios de dolor irruptivo al día, ya que puede ser necesario cambiar su tratamiento de base para el dolor oncológico.
Con el fin de hacer un seguimiento del número de dosis de Instanyl aplicadas, deberá marcar las casillas que aparecen en el desplegable colocado en la parte superior de la caja exterior con seguridad para niños.
No modifique por su cuenta la dosis de Instanyl o de sus otros medicamentos para el dolor. Los cambios en la dosis deben hacerse con su médico.
Instanyl es para via nasal.
Se deben leer las Instrucciones de Uso que se encuentran al final de este prospecto para aprender a utilizar Instanyl.
Si usa más Instanyl del que debe o si cree que alguien ha usado Instanyl de forma accidental
Si ha utilizado más Instanyl del que debe, contacte con su médico, hospital o servicio de urgencias para que valoren el riesgo e indiquen cómo actuar.
Los síntomas de sobredosis son:
Somnolencia, letargo, mareos, disminución de la temperatura corporal, disminución de la frecuencia cardiaca, dificultades en la coordinación de brazos y piernas.
En casos graves, los síntomas por un exceso en la administración de Instanyl pueden incluir coma, sedación, convulsiones o dificultades respiratorias graves (respiración muy lenta o superficial).
Si nota alguno de los síntomas anteriores debe solicitar inmediatamente asistencia médica.
Nota para las personas que cuiden al paciente:
Si observa que la persona tratada con Instanyl actúa con lentitud de forma repentina, tiene problemas para respirar o tiene dificultades para mantenerla despierta:
- Debe solicitar inmediatamente ayuda urgente.
- Mientras espera la ayuda, intentará mantener a la persona despierta hablándola o agitándola suavemente de vez en cuando.
- Si la persona tiene dificultades para respirar, debe indúcirla a respirar cada 5-10 segundos.
- Si la persona deja de respirar, debe intentar reanimarla hasta que llegue la ayuda de urgencia.
Si cree que alguien ha usado Instanyl de forma accidental, solicite inmediatamente asistencia médica. Intente mantener a la persona despierta hasta que llegue el servicio de urgencias.
Si alguien ha usado Instanyl de forma accidental, puede padecer los mismos síntomas descritos anteriormente en caso de sobredosificación.
Si olvidó usar Instanyl
Si continúa el dolor irruptivo, puede utilizar Instanyl según lo prescrito por su médico. Si el dolor irruptivo ha cesado, no utilice Instanyl hasta que se produzca el siguiente episodio de dolor irruptivo.
Si interrumpe el tratamiento con Instanyl
Debe interrumpir el tratamiento con Instanyl cuando deje de sufrir dolor irruptivo. Aun así, debe seguir usando su analgésico de base para tratar el dolor oncológico. En caso de duda, consulte con su médico para confirmar la dosis correcta de su analgésico habitual.
Puede padecer síntomas repentinos de la retirada similares a los posibles efectos adversos de Instanyl si interrumpe el uso de Instanyl. Si presenta síntomas de abstinencia debe consultar con su médico. Su médico evaluará si necesita medicamento para reducir o eliminar estos síntomas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Con frecuencia, los efectos adversos desaparecerán o se reducirán con el uso mantenido del medicamento.
Interrumpa el tratamiento y contacte inmediatamente con su médico, hospital o servicio de urgencias si:
- Experimenta dificultades graves para respirar.
- Presenta sonido al inspirar.
- Tiene dolor convulsivo,
- Experimenta mareos extremos.
Estos efectos adversos pueden ser muy graves.
Otros efectos adversos observados tras el uso de Instanyl:
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas): Somnolencia, mareos incluso con dificultad para mantener el equilibrio, dolor de cabeza, irritación de garganta, náuseas, vómitos, sofoco, sensación de calor muy intenso, sudoración excesiva.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas). Dependencia al medicamento, insomnio, letargo, contracciones convulsivas de los músculos, sensación extraña en la piel o incluso desagradable, alteración del gusto, mareo causado por movimiento, tensión arterial baja, problemas respiratorios graves, hemorragia nasal, úlcera nasal, goteo de nariz estreñimiento, inflamación de la boca, boca seca, molestias el la piel, picor de la piel, fiebre.
Frecuencia no conocida (frecuencia que no puede estimarse a partir de los datos disponibles): Caídas, diarrea, convulsión (crisis epiléptica), inflamación de brazos o piernas, ver o escuchar cosas que no son reales (alucinaciones), fatiga, malestar general, síndrome de abstinencia (que se puede manifestar con la aparición de los siguientes efectos adversos: náuseas, vómitos, diarrea, ansiedad, escalofríos, temblores y sudoración).
Se han observado también casos de pacientes que han desarrollado una perforación en el tabique nasal - la estructura que separa los orificios nasales.
Debe informar a su médico en caso de que sufra episodios repetidos de hemorragia nasal o molestias en la nariz.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Instanyl
El analgésico que contiene Instanyl es muy potente y puede ser mortal en niños. Instanyl debe mantenerse fuera de la vista y del alcance de los niños. Después de su uso, coloque siempre el pulverizador nasal en la caja de seguridad para niños.
No utilice Instanyl después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar por debajo de 30°C. Mantener el spray nasal en posición vertical. No congelar. Si se congela el pulverizador nasal de Instanyl, el dispositivo se puede romper. Debe comprobar el pulsador del pulverizador antes de usarlo si no está seguro de la forma en que lo ha conservado.
Los envases de Instanyl que hayan superado la fecha de caducidad o que no se vayan a utilizar más pueden contener aún medicamento suficiente para dañar a otras personas, especialmente a los niños. Los medicamentos no se deben tirar por los desagües ni a la basura. Cualquier spray nasal utilizado o no, debe desecharse según la normativa local o devolverse a la farmacia en la caja de seguridad para niños. Pregunte a su farmacéutico cómo deshacerse de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Instanyl solución para pulverización nasal
El principio activo es citrato de fentanilo. El contenido es.
50 microgramos/dosis: 1 ml contiene citrato de fentanilo equivalente a 500 microgramos de fentanilo. Una pulverización (100 microlitros) contiene 50 microgramos de fentanilo.
100 microgramos/dosis: 1 ml contiene citrato de fentanilo equivalente a 1.000 microgramos de fentanilo. Una pulverización (100 microlitros) contiene 100 microgramos de fentanilo.
200 microgramos/dosis: 1 ml contiene citrato de fentanilo equivalente a 2.000 microgramos. Una pulverización (100 microlitros) contiene 200 microgramos de fentanilo.
Los demás componentes son fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado y agua purificada.
Aspecto de Instanyl y contenido del envase
Instanyl es una solución para pulverización nasal. La solución es transparente e incolora. Está acondicionada en un frasco de vidrio marrón con una bomba dosificadora. El pulverizador nasal se dispensa en una caja de seguridad para niños y se presenta en tres tamaños de envase diferentes:
1,8 ml (equivalente a 10 dosis), 2,9 ml (equivalente a 20 dosis) y 5,0 ml (equivalente a 40 dosis). Puede que solamente estén comercializados algunos tamaños de envase.
El etiquetado de las tres concentraciones de Instanyl se diferencia por el color:
Para 50 microgramos/dosis el etiquetado es naranja.
Para 100 microgramos/dosis el etiquetado es morado.
Para 200 microgramos/dosis el etiquetado es azul verdoso.
Titular de la autorización de comercialización
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
Responsable de fabricación
Takeda Nycomed AS Solbaervegen 5 N-2409 Elverum Noruega
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Alemania
Pueden solicitar más información respecto a este Titular de la Autorización de Comercialización
Belgie/Belgique/Belgien/Luxembourg/
Luxemburg
Takeda Belgium Tel./Tél.: +32 2 464 06 11 takeda-belgium@takeda.com
Etarapna
TaKega Etarapna Tea.: + 359 2 958 27 36
Ceská republika
Takeda Pharmaceuticals Czech Republic s.r.o. Tel.: + 420 234 722 722
Danmark
Takeda Pharma A/S Tlf./Tel.: +45 46 77 11 11
medicamento dirigiéndose al representante local del
Magyarország
Takeda Pharma Kft.
Tel.: +361 2707030
Malta / Kúnpoq
Takeda Pharma A/S Tel./ Tnk.: +45 46 77 11 11
Nederland
Takeda Nederland bv Tel.: +31 23 56 68 777
|
Deutschland Takeda GmbH Tel.: +49 (0) 800 825 3325 |
Norge Takeda AS Tlf.: +47 6676 3030 |
|
Eesti Takeda Pharma AS Tel.: +372 6177 669 info@takeda.ee |
Osterreich Takeda Pharma Ges.m.b.H. Tel.: +43 (0) 800 20 80 50 |
|
EXláSa TAKEDA EAAAI A.E. TqA.: +30 210 6387800 gr.info@takeda.com |
Polska Takeda Polska Sp. z o.o. Tel.: +48 22 608 13 00 |
España Portugal
Takeda Farmacéutica España S.A. Takeda Farmacéuticos Portugal, Lda.
Tel.: +34 917 14 99 00 Tel.: + 351 21 120 1457
|
France Takeda France S.A.S Tel.: +33 1 46 25 16 16 |
Romania Takeda Pharmaceuticals SRL Tel.: +40 21 335 03 91 |
Hrvatska Slovenija
Takeda Pharmaceuticals Croatia d.o.o Takeda GmbH Podruznica Slovenija
|
Tel: +385 1 377 88 96 |
Tel.: +386 (0) 59 082 480 |
|
Ireland Takeda Products Ireland Ltd. Tel.: +353 (0) 1 6420021 |
Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o. Tel.: +421 (2) 20 602 600 |
|
Ísland Vistor hf. Tel.: +354 535 7000 vistor@vistor.is |
Suomi/Finland Takeda Oy Puh./Tel.: +358 20 746 5000 infoposti@takeda.com |
|
Italia Grünenthal Italia S.r.l. Tel.: +39 02 4305 1 |
Sverige Takeda Pharma AB Tel.: +46 8 731 28 00 infosweden@takeda.com |
|
Latvija Takeda Latvia SIA Tel.: +371 67840082 |
United Kingdom Takeda UK Ltd Tel.: +44 (0)1628 537 900 |
Fecha de la última revisión de este prospecto {MM/YYYY}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA) http://www.ema.europa.eu.
INSTRUCCIONES DE USO PARA EL SPRAY NASAL INSTANYL
Lea detenidamente las siguientes instrucciones para aprender a utilizar el spray nasal Instanyl
- Antes de utilizar el atomizador por primera vez: prepare el spray apretándolo hasta que aparezca una fina nebulización (será necesario presionar 3 ó 4 veces sobre el spray nasal). Es importante que el usuario evite apuntar hacía sí o hacia otras personas.
Si no ha utilizado Instanyl durante más de 7 días, el atomizador se debe preparar de nuevo haciendo presión sobre él una vez antes de recibir la siguiente dosis.
- Durante ese proceso de preparación o cebado, se expulsará parte del producto.
- El cebado debe realizarse en una zona bien ventilada.
- No debe apuntarse el spray nasal en dirección al usuario ni hacia otras personas.
- No debe apuntarse hacia superficies u objetos que pudieran entrar en contacto con otras personas, en especial niños.
Instanyl se debe utilizar como se indica a continuación:
- Suénese la nariz si la tiene taponada o si está resfriado.
- Debe permanecer sentado o de pie en posición erguida.
- Retirar el tapón del pulverizador.
- Antes de utilizar el pulverizador por primera vez, pulsar hasta que aparezca una fina nebulización (se pueden requerir de 3 a 4 pulsaciones de solución nasal). Es importante que evite orientar el pulverizador en dirección a otras personas.
- Mantener el pulverizador en posición vertical.
- Inclinar ligeramente la cabeza hacia delante.
- Tapar un orificio nasal presionando el lateral con el dedo e insertar la punta del pulverizador en el otro (aproximadamente 1 cm). No importa qué orificio nasal utilice. Si pasados 10 minutos tiene que usar una segunda dosis para conseguir un alivio suficiente del dolor, esta dosis se debe administrar en el otro orificio nasal.
- Presione el pulsador una vez y con rapidez mientras inhala a través de la nariz. Puede que no sienta la dosis en su nariz, pero ya la habrá recibido al presionar el pulsador.
- Coloque siempre Instanyl en la caja de seguridad a pueba de niños después de utilizarlo.
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Instanyl 50 microgramos solución para pulverización nasal en envase unidosis Instanyl 100 microgramos solución para pulverización nasal en envase unidosis Instanyl 200 microgramos solución para pulverización nasal en envase unidosis
Fentanilo
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya quede puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos signos de enfermedad que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, enfermero o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto:
1. Qué es Instanyl y para qué se utiliza.
2. Qué necesita saber antes de empezar a usar Instanyl
3. Cómo usar Instanyl
4. Posibles afectos adversos
5. Conservación de Instanyl
6. Contenido del envase e información adicional
1. Qué es Instanyl y para qué se utiliza
Instanyl contiene el principio activo fentanilo y pertenece a un grupo de analgésicos fuertes denominados opioides. Los opioides actúan bloqueando las señales del dolor que van al cerebro. Instanyl actúa con mucha rapidez y se utiliza para aliviar el dolor irruptivo en pacientes adultos con cáncer que ya tratan con opioides su dolor de base. El dolor irruptivo es un dolor adicional repentino que aparece a pesar del uso de los analgésicos opioides habituales para aliviar el dolor.
2. Qué necesita saber antes de empezar a usar Instanyl
No use Instanyl:
- si es alérgico (hipersensible) al fentanilo o cualquiera de los demás componentes de Instanyl;
- si no está usando regularmente un medicamento opioide prescrito por su médico (p. ej., codeína, fentanilo, hidromorfona, morfina, oxicodona, meperidina), todos los días a la misma hora, al menos durante una semana, para controlar el dolor persistente. Si no ha estado usando esos medicamentos, no use Instanyl dado que su uso puede aumentar el riesgo de que su respiración se vuelva más lenta y/o poco profunda, e incluso de que llegue a pararse.
- si padece dolor de corta duración distinto al dolor irruptivo.
- si tiene graves dificultades al respirar o sufre alguna enfermedad pulmonar obstructiva grave.
- si ha recibido previamente radioterapia facial;
- si sufre episodios repetidos de hemorragia nasal;
Advertencias y precauciones
Consulte a su medico antes de empezar a usar Instanyl, especialmente
- si padece una enfermedad pulmonar obstructiva crónica, Instanyl puede alterar su ritmo
respiratorio;
- si tiene problemas de corazón, especialmente frecuencia cardiaca baja, presión sanguínea baja o bajo volumen sanguíneo;
- si tiene problemas de hígado o riñones;
- si tiene problemas con su función cerebral, por ejemplo, debido a un tumor cerebral, a un traumatismo craneal o a un aumento de la presión intracraneal;
- si toma antidepresivos o antipsicóticos; consulte la sección Uso de Instanyl con otros
medicamentos.
- si utiliza otros productos para pulverización nasal, por ejemplo, para el resfriado común o para la alergia;
Es importante que consulte inmediatamente con su médico u hospital si experimenta dificultades en la respiración mientras recibe tratamiento con Instanyl.
Si le sangra la nariz de forma repetida o nota molestias nasales durante el tratamiento con Instanyl, deberá consultar con su médico, que estudiará un tratamiento alternativo para tratar su dolor irruptivo.
Es importante que informe a su médico si cree que está desarrollando dependencia a Instanyl.
Niños y adolescentes
Instanyl no deberá usarse en niños y adolescentes menores de 18 años.
Uso de Instanyl con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente, o podría tener que utilizar cualquier otro medicamento, incluso los adquiridos sin receta.
Instanyl puede afectar o verse afectado por otros medicamentos.
Se deberá tener especial cuidado si está siendo tratado con alguno de los siguientes medicamentos:
- Cualquier medicamento que pueda producirle sueño (que tenga efecto sedante) como comprimidos para dormir, medicamentos para tratar la ansiedad, antihistamínicos o tranquilizantes.
- Cualquier medicamento que pueda modificar la forma en que su cuerpo metaboliza Instanyl, como
• ritonavir, nelfinavir, amprenavir, y fosamprenavir (medicamentos que ayudan a controlar las infecciones por VIH)
• inhibidores de CYP3A4, como ketoconazol, itraconazol, o fluconazol (utilizados para el tratamiento de infecciones por hongos)
• troleandomicina, claritromicina, o eritromicina (medicamentos para el tratamiento de las infecciones por bacterias)
• aprepitant (utilizado para tratar náuseas fuertes)
• diltiazem y verapamilo (medicamentos para tratar la tensión alta o enfermedades del corazón)
- Medicamentos denominados inhibidores de la Monoamino-Oxidasa (IMAO), utilizados para la depresión grave, incluso si se le ha tratado con uno de ellos en las últimas 2 semanas.
- El riesgo de efectos adversos aumenta si está tomando medicamentos tales como ciertos antidepresivos o antipsicóticos. Instanyl puede interactuar con estos medicamentos y usted puede presentar cambios en el estado mental (p. ej., agitación, alucinaciones, coma) y otros efectos como temperatura corporal mayor de 38°C, aumento de la frecuencia cardiaca, presión arterial inestable y exageración de los reflejos, rigidez muscular, falta de coordinación y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea). Su medico le dirá si Instanyl es adecuado para usted.
- Medicamentos denominados agonistas/antagonistas parciales, ej. buprenorfina, nalbufina y pentazocina (medicamentos para tratar el dolor). Es posible que experimente síntomas de síndrome de abstinencia (nauseas, vómitos, diarrea, ansiedad, escalofríos, temblor y sudoración).
- Otros medicamentos administrados por vía nasal, especialmente oximetazolina, xilometazolina y medicamentos similares, que se utilizan para el alivio de la congestión nasal.
Uso de Instanyl con alimentos, bebidas o alcohol
No tome bebidas alcohólicas durante el tratamiento con Instanyl, ya que pueden aumentar el riesgo de sufrir efectos adversos peligrosos.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte con su médico o farmacéutico antes de utilizar cualquier medicamento.
No se deberá utilizar Instanyl durante el embarazo, a menos que lo haya consultado con su médico.
No se deberá utilizar Instanyl durante el parto ya que fentanilo puede causar problemas respiratorios graves en el recién nacido.
El fentanilo puede pasar a la sangre materna y causar efectos adversos en el lactante. No use Instanyl si está dando el pecho a su hijo No debe iniciar la lactancia hasta transcurridos 5 diasdesde la última dosis de Instanyl.
Conducción y uso de máquinas
No deberá conducir ni usar máquinas mientras recibe tratamiento con Instanyl. Instanyl puede causar mareos y somnolencia, que pueden afectar a la capacidad para conducir o usar máquinas.
3. Cómo usar Instanyl
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis de Instanyl es independiente de su tratamiento de base para el dolor oncológico.
Cuando comience a utilizar Instanyl, su médico determinará con usted la dosis que alivie su dolor irruptivo.
La dosis inicial es una pulverización de 50 microgramos en una fosa nasal cada vez que tenga un episodio de dolor irruptivo. Durante la determinación de su dosis adecuada, su médico le puede indicar que cambie a una dosis mayor.
En caso de que el dolor irruptivo no se alivie pasados 10 minutos, puede utilizar sólo una pulverización más para este episodio.
Deberá esperar cuatro horas antes de tratar el siguiente episodio de dolor irruptivo.
Puede utilizar Instanyl para tratar un máximo de cuatro episodios de dolor irruptivo al día.
Deberá consultar con su médico si sufre más de cuatro episodios de dolor irruptivo al día, ya que puede ser necesario cambiar su tratamiento de base para el dolor oncológico.
No modifique por su cuenta la dosis de Instanyl o de sus otros medicamentos para el dolor. Los cambios en la dosis deben hacerse con su médico.
Instanyl es para via nasal.
Se deben leer las Instrucciones de Uso que se encuentran al final de este prospecto para aprender a utilizar Instanyl.
Si usa más Instanyl del que debe o si cree que alguien ha usado Instanyl de forma accidental
Si ha utilizado más Instanyl del que debe, contacte con su médico, hospital o servicio de urgencias para que valoren el riesgo e indiquen cómo actuar.
Los síntomas de sobredosis son:
Somnolencia, letargo, mareos, disminución de la temperatura corporal, disminución de la frecuencia cardiaca, dificultades en la coordinación de brazos y piernas.
En casos graves, los síntomas por un exceso en la administración de Instanyl pueden incluir coma, sedación, convulsiones o dificultades respiratorias graves (respiración muy lenta o superficial).
Si nota alguno de los síntomas anteriores debe solicitar inmediatamente asistencia médica.
Nota para las personas que cuiden al paciente:
Si observa que la persona tratada con Instanyl actúa con lentitud de forma repentina, tiene problemas para respirar o tiene dificultades para mantenerla despierta:
- Debe solicitar inmediatamente ayuda urgente.
- Mientras espera la ayuda, intentará mantener a la persona despierta hablándola o agitándola suavemente de vez en cuando.
- Si la persona tiene dificultades para respirar, debe indúcirla a respirar cada 5-10 segundos.
- Si la persona deja de respirar, debe intentar reanimarla hasta que llegue la ayuda de urgencia.
Si cree que alguien ha usado Instanyl de forma accidental, solicite inmediatamente asistencia médica. Intente mantener a la persona despierta hasta que llegue el servicio de urgencias.
Si alguien ha usado Instanyl de forma accidental, puede padecer los mismos síntomas descritos anteriormente en caso de sobredosificación.
Si olvidó usar Instanyl
Si continúa el dolor irruptivo, puede utilizar Instanyl según lo prescrito por su médico. Si el dolor irruptivo ha cesado, no utilice Instanyl hasta que se produzca el siguiente episodio de dolor irruptivo.
Si interrumpe el tratamiento con Instanyl
Debe interrumpir el tratamiento con Instanyl cuando deje de sufrir dolor irruptivo. Aun así, debe seguir usando su analgésico de base para tratar el dolor oncológico. En caso de duda, consulte con su médico para confirmar la dosis correcta de su analgésico habitual.
Puede padecer síntomas repentinos de la retirada similares a los posibles efectos adversos de Instanyl si interrumpe el uso de Instanyl. Si presenta síntomas de abstinencia debe consultar con su médico. Su médico evaluará si necesita medicamento para reducir o eliminar estos síntomas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Con frecuencia, los efectos adversos desaparecerán o se reducirán con el uso mantenido del medicamento.
Interrumpa el tratamiento y contacte inmediatamente con su médico, hospital o servicio de urgencias si:
- Experimenta dificultades graves para respirar.
- Presenta ruidos al inspirar.
- Tiene dolor convulsivo.
- Experimenta mareos extremos.
Estos efectos adversos pueden ser muy graves.
Otros efectos adversos observados tras el uso de Instanyl:
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas): Somnolencia, mareos incluso con dificultad para mantener el equilibrio, dolor de cabeza, irritación de garganta, náuseas, vómitos, sofoco, sensación de calor muy intenso, sudoración excesiva.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas). Dependencia al medicamento, insomnio, letargo, contracciones convulsivas de los músculos, sensación extraña en la piel o incluso desagradable, alteración del gusto, mareo causado por movimiento, tensión arterial baja, problemas respiratorios graves, hemorragia nasal, úlcera nasal, goteo de nariz estreñimiento, inflamación de la boca, boca seca, molestias el la piel, picor de la piel, fiebre.
Frecuencia no conocida (frecuencia que no puede estimarse a partir de los datos disponibles). Caídas, diarrea, convulsiones (crisis epiléticasepilépticas), inflamación de brazos o piernas, ver o escuchar cosas que no son reales (alucinaciones), fatiga, malestar general, síndrome de abstinencia (que se puede manifestar con la aparición de los siguientes efectos adversos. náuseas, vómitos, diarrea, ansiedad, escalofríos, temblores y sudoración).
Se han observado casos de pacientes que han desarrollado una perforación en el tabique nasal - la estructura que separa los orificios nasales.
Debe informar a su médico en caso de que sufra episodios repetidos de hemorragia nasal o molestias en la nariz.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Instanyl
El analgésico que contiene Instanyl es muy potente y puede ser mortal en niños. Instanyl debe mantenerse fuera del alcance y de la vista de los niños.
No utilice Instanyl después de la fecha de caducidad que aparece en la caja y en el envase unidosis después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar por debajo de 30°C. Conservar el blíster en el embalaje exterior. Conservar en posición vertical.
Los envases de Instanyl pueden dañar a otras personas, especialmente a los niños. Los medicamentos no se deben tirar por los desagües ni a la basura. Cualquier envase unidosis no utilizado, debe devolverse según la normativa local o devolverse a la farmacia en el blíster de seguridad para niños. Pregunte a su farmacéutico cómo deshacerse de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Instanyl
El principio activo es citrato de fentanilo. El contenido es.
50 microgramos: 1 dosis (100 microlitros) contiene citrato de fentanilo equivalente a 50 microgramos de fentanilo.
100 microgramos: 1 dosis (100 microlitros) contiene citrato de fentanilo equivalente a 100 microgramos de fentanilo.
200 microgramos: 1 dosis (100 microlitros) contiene citrato de fentanilo equivalente a 200 microgramos de fentanilo.
Los demás componentes son fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado y agua purificada.
Aspecto de Instanyl y contenido del envase
Instanyl es un pulverizador nasal en solución, en un envase de dosis unitaria. La solución es limpia e incolora.
El envase unidosis contiene 1 dosis de Instanyl y se dispensa en un blíster resistente a niños. Instanyl se presenta en diferentes tamaños de envase de 2, 6, 8 y 10 envases unidosis.
Puede que solamente estén comercializados algunos tamaños de envase.
El etiquetado de las tres concentraciones de Instanyl se diferencia por el color:
Para 50 microgramos el etiquetado es naranja.
Para 100 microgramos el etiquetado es morado.
Para 200 microgramos el etiquetado es azul verdoso.
Titular de la autorización de comercialización
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
Responsable de fabricación
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
Takeda Nycomed AS Solbaervegen 5 N-2409 Elverum Noruega
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Alemania
medicamento dirigiéndose al representante local del
Pueden solicitar más información respecto a este Titular de la Autorización de Comercialización
Lietuva
Takeda, UAB Tel.: +370 521 09 070
Magyarország
Takeda Pharma Kft.
Tel.: +361 2707030
Malta / Kúnpoq
Takeda Pharma A/S Tel./ Tnk.: +45 46 77 11 11
Nederland
Takeda Nederland bv Tel.: +31 23 56 68 777
Belgie/Belgique/Belgien/Luxembourg/
Luxemburg
Takeda Belgium Tel./Tél.: +32 2 464 06 11 takeda-belgium@takeda.com
Etarapna
TaKega Etarapua Tea.: + 359 2 958 27 36
Ceská republika
Takeda Pharmaceuticals Czech Republic s.r.o. Tel.: + 420 234 722 722
Danmark
Takeda Pharma A/S Tlf./Tel.: +45 46 77 11 11
|
Deutschland Takeda GmbH Tel.: +49 (0) 800 825 3325 |
Norge Takeda AS Tlf.: +47 6676 3030 |
|
Eesti Takeda Pharma AS Tel.: +372 6177 669 info@takeda.ee |
Osterreich Takeda Pharma Ges.m.b.H. Tel.: +43 (0) 800 20 80 50 |
|
EXláSa TAKEDA EAAAI A.E. TqA.: +30 210 6387800 gr.info@takeda.com |
Polska Takeda Polska Sp. z o.o. Tel.: +48 22 608 13 00 |
España Portugal
Takeda Farmacéutica España S.A. Takeda Farmacéuticos Portugal, Lda.
Tel.: +34 917 14 99 00 Tel.: + 351 21 120 1457
|
France Takeda France S.A.S Tel.: +33 1 46 25 16 16 |
Romania Takeda Pharmaceuticals SRL Tel.: +40 21 335 03 91 |
Hrvatska Slovenija
Takeda Pharmaceuticals Croatia d.o.o Takeda GmbH Podruznica Slovenija
|
Tel: +385 1 377 88 96 |
Tel.: +386 (0) 59 082 480 |
|
Ireland Takeda Products Ireland Ltd. Tel.: +353 (0) 1 6420021 |
Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o. Tel.: +421 (2) 20 602 600 |
|
Ísland Vistor hf. Tel.: +354 535 7000 vistor@vistor.is |
Suomi/Finland Takeda Oy Puh./Tel.: +358 20 746 5000 infoposti@takeda.com |
|
Italia Grünenthal Italia S.r.l. Tel.: +39 02 4305 1 |
Sverige Takeda Pharma AB Tel.: +46 8 731 28 00 infosweden@takeda.com |
|
Latvija Takeda Latvia SIA Tel.: +371 67840082 |
United Kingdom Takeda UK Ltd Tel.: +44 (0)1628 537 900 |
Fecha de la última revisión de este prospecto {MM/YYYY}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA) http://www.ema.europa.eu
INSTRUCCIONES DE USO PARA EL SPRAY NASAL MONODOSIFICADOR INSTANYL
Lea detenidamente las siguientes instrucciones para aprender a utilizar el spray nasal monodosificador
Instanyl:
• Cada envase unidosis está cerrado en un blíster resistente a niños. No abrir el blíster hasta estar preparado para utilizar el pulverizador. Cada envase unidosis contiene una sola dosis de Instanyl, por tanto, no probar antes de ser utilizado.
• Para abrir, cortar con las tijeras sobre la línea (sobre el símbolo de las tijeras) en el blister. Sujetar el borde de la lámina, despegar la lámina y sacar el pulverizador nasal.
• Suénese la nariz si la tiene taponada o si está resfriado.
• Con cuidado, sujetar el envase unidosis colocando el dedo pulgar en la parte inferior del pulsador y los dedos índice y corazón en cada lado de la parte superior del pulverizador (ver dibujo). No presionar todavía el pulsador.
• Tapar un orificio nasal presionando el dedo índice contra el lateral de la nariz e introducir el pulverizador en el otro orificio nasal (aproximadamente 1 cm). No importa qué orificio nasal utilice. Si pasados 10 minutos tiene que usar una segunda dosis para conseguir un alivio suficiente del dolor, esta dosis se debe administrar en el otro orificio nasal.
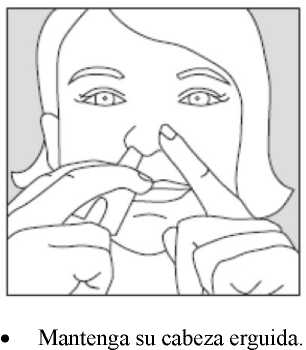
• Para liberar la dosis presione firmemente el pulsador hacia arriba con el dedo pulgar, mientras inhala con cuidado a través de la nariz. Después retire el pulverizador nasal de la nariz. Puede que no sienta la dosis en su nariz, pero ya la habrá recibido al presionar el pulsador.
• Su envase unidosis está ahora vacío.
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Instanyl 50 microgramos/dosis solución para pulverización nasal Instanyl 100 microgramos/dosis solución para pulverización nasal Instanyl 200 microgramos/dosis solución para pulverización nasal
Fentanilo
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya quede puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos signos de enfermedad que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, enfermero o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto:
1. Qué es Instanyl y para qué se utiliza.
2. Qué necesita saber antes de empezar a usar Instanyl
3. Cómo usar Instanyl
4. Posibles afectos adversos
5. Conservación de Instanyl
6. Contenido del envase e información adicional
1. Qué es Instanyl y para qué se utiliza
Instanyl contiene el principio activo fentanilo y pertenece a un grupo de analgésicos fuertes denominados opioides. Los opioides actúan bloqueando las señales del dolor que van al cerebro. Instanyl actúa con mucha rapidez y se utiliza para aliviar el dolor irruptivo en pacientes adultos con cáncer que ya tratan con opioides su dolor de base. El dolor irruptivo es un dolor adicional repentino que aparece a pesar del uso de los analgésicos opioides habituales para aliviar el dolor.
2. Qué necesita saber antes de empezar a usar Instanyl
No use Instanyl:
- si es alérgico (hipersensible) al fentanilo o cualquiera de los demás componentes de Instanyl;
- si no está usando regularmente un medicamento opioide prescrito por su médico (p. ej., codeína, fentanilo, hidromorfona, morfina, oxicodona, meperidina), todos los días a la misma hora, al menos durante una semana, para controlar el dolor persistente. Si no ha estado usando esos medicamentos, no use Instanyl dado que su uso puede aumentar el riesgo de que su respiración se vuelva más lenta y/o poco profunda, e incluso de que llegue a pararse.
- si padece dolor de corta duración distinto al dolor irruptivo.
- si tiene graves dificultades al respirar o sufre alguna enfermedad pulmonar obstructiva grave;
- si ha recibido previamente radioterapia facial;
- si sufre episodios repetidos de hemorragia nasal;
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Instanyl, especialmente
- si padece una enfermedad pulmonar obstructiva crónica, Instanyl puede alterar su ritmo respiratorio;
- si tiene problemas de corazón, especialmente frecuencia cardiaca bajapresión sanguínea baja o bajo volumen sanguíneo;
- si tiene problemas de hígado o riñones;
- si tiene problemas con su función cerebral, por ejemplo, debido a un tumor cerebral, a un traumatismo craneal o a un aumento de la presión intracraneal;
- si toma antidepresivos o antipsicóticos; consulte la sección Uso de Instanyl con otros medicamentos.
- si utiliza otros productos para pulverización nasal, por ejemplo, para el resfriado común o para la alergia;
Es importante que consulte inmediatamente con su médico u hospital si experimenta dificultades en la respiración mientras recibe tratamiento con Instanyl.
Si le sangra la nariz de forma repetida o nota molestias nasales durante el tratamiento con Instanyl, deberá consultar con su médico, que estudiará un tratamiento alternativo para tratar su dolor irruptivo.
Es importante que informe a su médico si cree que está desarrollando dependencia a Instanyl.
Niños y adolescentes
Instanyl no se debe usar en niños y adolescentes menores de 18 años.
Uso de Instanyl con otros medicamentos
Informe a su médico o farmacéutico si está utilizando,o ha utilizado recientemente, o podría tener que utilizar cualquier otro medicamento, incluso los adquiridos sin receta.
Instanyl puede afectar o verse afectado por otros medicamentos.
Se deberá tener especial cuidado si está siendo tratado con alguno de los siguientes medicamentos:
- Cualquier medicamento que pueda producirle sueño (que tenga efecto sedante) como comprimidos para dormir, medicamentos para tratar la ansiedad, antihistamínicos o tranquilizantes.
- Cualquier medicamento que pueda modificar la forma en que su cuerpo metaboliza Instanyl, como
• ritonavir, nelfinavir, amprenavir, y fosamprenavir (medicamentos que ayudan a controlar las infecciones por VIH)
• inhibidores de CYP3A4, como ketoconazol, itraconazol, o fluconazol (utilizados para el tratamiento de infecciones por hongos)
• troleandomicina, claritromicina, o eritromicina (medicamentos para el tratamiento de las infecciones por bacterias)
• aprepitant (utilizado para tratar náuseas fuertes)
• diltiazem y verapamilo (medicamentos para tratar la tensión alta o enfermedades del corazón)
- Medicamentos denominados inhibidores de la Monoamino-Oxidasa (IMAO), utilizados para la depresión grave, incluso si se le ha tratado con uno de ellos en las últimas 2 semanas.
- El riesgo de efectos adversos aumenta si está tomando medicamentos tales como ciertos antidepresivos o antipsicóticos. Instanyl puede interactuar con estos medicamentos y usted puede presentar cambios en el estado mental (p. ej., agitación, alucinaciones, coma) y otros efectos como temperatura corporal mayor de 38°C, aumento de la frecuencia cardiaca, presión arterial inestable y exageración de los reflejos, rigidez muscular, falta de coordinación y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea). Su medico le dirá si Instanyl es adecuado para usted.
- Medicamentos denominados agonistas/antagonistas parciales, ej. buprenorfina, nalbufina y pentazocina (medicamentos para tratar el dolor). Es posible que experimente síntomas de síndrome de abstinencia (náuseas, vómitos, diarrea, ansiedad, escalofríos, temblores y sudoración).
- Otros medicamentos administrados por vía nasal, especialmente oximetazolina, xilometazolina y medicamentos similares, que se utilizan para el alivio de la congestión nasal.
Uso de Instanyl con los alimentos, bebidas y alcohol
No tome bebidas alcohólicas durante el tratamiento con Instanyl, ya que pueden aumentar el riesgo de sufrir efectos adversos peligrosos.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte con su médico o farmacéutico antes de utilizar cualquier medicamento.
No se deberá utilizar Instanyl durante el embarazo, a menos que lo haya consultado con su médico.
No se deberá utilizar Instanyl durante el parto ya que fentanilo puede causar problemas respiratorios graves en el recién nacido.
El fentanilo puede pasar a la sangre materna y causar efectos adversos en el lactante. No use Instanyl si está dando el pecho a su hijo. No debe iniciar la lactancia hasta transcurridos al menos 5 días desde la última dosis de Instanyl.
Conducción y uso de máquinas
No deberá conducir ni usar máquinas mientras recibe tratamiento con Instanyl. Instanyl puede causar mareos y somnolencia, que pueden afectar a la capacidad para conducir o usar máquinas.
3. Cómo usar Instanyl
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis de Instanyl es independiente de su tratamiento de base para el dolor oncológico.
Cuando comience a utilizar Instanyl, su médico determinará con usted la dosis que alivie su dolor irruptivo.
La dosis inicial es una pulverización de 50 microgramos en una fosa nasal cada vez que tenga un episodio de dolor irruptivo. Durante la determinación de su dosis adecuada, su médico le puede indicar que cambie a una dosis mayor.
En caso de que el dolor irruptivo no se alivie pasados 10 minutos, puede utilizar sólo una pulverización más para este episodio.
Deberá esperar cuatro horas antes de tratar el siguiente episodio de dolor irruptivo.
Puede utilizar Instanyl para tratar un máximo de cuatro episodios de dolor irruptivo al día.
Deberá consultar con su médico si sufre más de cuatro episodios de dolor irruptivo al día, ya que puede ser necesario cambiar su tratamiento de base para el dolor oncológico.
No modifique por su cuenta la dosis de Instanyl o de sus otros medicamentos para el dolor. Los cambios en la dosis deben hacerse con su médico.
Instanyl incopora un contador de dosis, y un periodo de bloqueo entre dosis para reducir el riesgo de sobredosis y ayudar al paciente a utilizarlo de forma adecuada. El contador de dosis permite al paciente y a su médico controlar y adaptar su uso. Después de que se hayan recibido dos dosis en un periodo de tiempo de 60 minutos, Instanyl se bloqueará durante un periodo de 2 horas, a contar desde la primera dosis, hasta que pueda dispensarse de nuevo otra dosis.
Instanyl es para via nasal.
Se deben leer las Instrucciones de Uso que se encuentran al final de este prospecto para aprender a utilizar el spray nasal.
Si usa más Instanyl del que debe o si cree que alguien ha usado Instanyl de forma accidental
Si ha utilizado más Instanyl del que debe, contacte con su médico, hospital o servicio de urgencias para que valoren el riesgo e indiquen cómo actuar.
Los síntomas de sobredosis son:
Somnolencia, letargo, mareos, disminución de la temperatura corporal, disminución de la frecuencia cardiaca, dificultades en la coordinación de brazos y piernas.
En casos graves, los síntomas por un exceso en la administración de Instanyl pueden incluir coma, sedación, convulsiones o dificultades respiratorias graves (respiración muy lenta o superficial).
Si nota alguno de los síntomas anteriores debe solicitar inmediatamente asistencia médica.
Nota para las personas que cuiden al paciente:
Si observa que la persona tratada con Instanyl actúa con lentitud de forma repentina, tiene problemas para respirar o tiene dificultades para mantenerla despierta:
- Debe solicitar inmediatamente ayuda urgente.
- Mientras espera la ayuda, intentará mantener a la persona despierta hablándola o agitándola suavemente de vez en cuando.
- Si la persona tiene dificultades para respirar, debe indúcirla a respirar cada 5-10 segundos.
- Si la persona deja de respirar, debe intentar reanimarla hasta que llegue la ayuda de urgencia.
Si cree que alguien ha usado Instanyl de forma accidental, solicite inmediatamente asistencia médica. Intente mantener a la persona despierta hasta que llegue el servicio de urgencias.
Si alguien ha usado Instanyl de forma accidental, puede padecer los mismos síntomas descritos anteriormente en caso de sobredosificación.
Si olvidó usar Instanyl
Si continúa el dolor irruptivo, puede utilizar Instanyl según lo prescrito por su médico. Si el dolor irruptivo ha cesado, no utilice Instanyl hasta que se produzca el siguiente episodio de dolor irruptivo.
Si interrumpe el tratamiento con Instanyl
Debe interrumpir el tratamiento con Instanyl cuando deje de sufrir dolor irruptivo. Aun así, debe seguir usando su analgésico de base para tratar el dolor oncológico. En caso de duda, consulte con su médico para confirmar la dosis correcta de su analgésico habitual.
Puede padecer síntomas repentinos de la retirada similares a los posibles efectos adversos de Instanyl si interrumpe el uso de Instanyl. Si presenta síntomas de abstinencia debe consultar con su médico. Su médico evaluará si necesita medicamento para reducir o eliminar estos síntomas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Con frecuencia, los efectos adversos desaparecerán o se reducirán con el uso mantenido del medicamento.
Interrumpa el tratamiento y contacte inmediatamente con su médico, hospital o servicio de urgencias si:
- Experimenta dificultades graves para respirar.
- Presenta sonido al inspirar.
- Tiene dolor convulsivo,
- Experimenta mareos extremos.
Estos efectos adversos pueden ser muy graves.
Otros efectos adversos observados tras el uso de Instanyl:
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas). Somnolencia, mareos incluso con dificultad para mantener el equilibrio, dolor de cabeza, irritación de garganta, náuseas, vómitos, sofoco, sensación de calor muy intenso, sudoración excesiva.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas). Dependencia al medicamento, insomnio, letargo, contracciones convulsivas de los músculos, sensación extraña en la piel o incluso desagradable, alteración del gusto, mareo causado por movimiento, tensión arterial baja, problemas respiratorios graves, hemorragia nasal, úlcera nasal, goteo de nariz estreñimiento, inflamación de la boca, boca seca, molestias el la piel, picor de la piel, fiebre.
Frecuencia no conocida (frecuencia que no puede estimarse a partir de los datos disponibles): Caídas, diarrea, convulsión (crisis epiléptica), inflamación de brazos o piernas, ver o escuchar cosas que no son reales (alucinaciones), fatiga, malestar general, síndrome de abstinencia (que se puede manifestar con la aparición de los siguientes efectos adversos. náuseas, vómitos, diarrea, ansiedad, escalofríos, temblores y sudoración).
Se han observado también casos de pacientes que han desarrollado una perforación en el tabique nasal - la estructura que separa los orificios nasales.
Debe informar a su médico en caso de que sufra episodios repetidos de hemorragia nasal o molestias en la nariz.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Instanyl
El analgésico que contiene Instanyl es muy potente y puede ser mortal en niños. Instanyl debe mantenerse fuera de la vista y del alcance de los niños. Debe cerrarse siempre después de cada uso colocando de nuevo el cierre de seguridad a prueba de niños en el spray nasal.
No utilice Instanyl después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar por debajo de 30°C. No congelar. Si se congela el pulverizador nasal de Instanyl, el dispositivo se puede romper. Debe comprobar el pulsador del pulverizador antes de usarlo si no está seguro de la forma en que lo ha conservado.
Los envases de Instanyl que hayan superado la fecha de caducidad o que no se vayan a utilizar más pueden contener aún medicamento suficiente para dañar a otras personas, especialmente a los niños.

Este dispositivo está etiquetado de conformidad con la Directiva sobre Residuos de Aparatos Eléctricos y Electrónicos (WEEE). Los medicamentos no se deben tirar por los desagües ni a la basura. Todo spray nasal, utilizado o no, debe ser devueltos sistemáticamente y desecharse de acuerdo con la normativa local, o devolverse a la farmacia. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente De esta forma ayudará a proteger el medio ambiente.
C€
6. Contenido del envase e información adicional
Composición de Instanyl solución para pulverización nasal
El principio activo es citrato de fentanilo. El contenido es.
50 microgramos/dosis: 1 ml contiene citrato de fentanilo equivalente a 500 microgramos de fentanilo. Una pulverización (100 microlitros) contiene 50 microgramos de fentanilo.
100 microgramos/dosis: 1 ml contiene citrato de fentanilo equivalente a 1.000 microgramos de fentanilo. Una pulverización (100 microlitros) contiene 100 microgramos de fentanilo.
200 microgramos/dosis: 1 ml contiene citrato de fentanilo equivalente a 2.000 microgramos. Una pulverización (100 microlitros) contiene 200 microgramos de fentanilo.
Los demás componentes son fosfato de sodio dihidrogenado dihidrato, fosfato disódico dihidratado y agua purificada.
Aspecto de Instanyl y contenido del envase
Instanyl DoseGuard es una solución para pulverización nasal. La solución es transparente e incolora. Contiene un spray nasal con una bomba dosificadora, un indicador electrónico, un contador de dosis, un mecanismo de bloqueo integrado y un cierre de seguridad a prueba de niños.
El spray nasal viene en cuatro tamaños diferentes 2,0 ml (equivalente a 10 dosis), 3,2 ml (equivalente a 20 dosis), 4,3 ml (equivalente a 30 dosis) y 5,3 ml (equivalente a 40 dosis).
Puede que solamente estén comercializados algunos tamaños de envase.
El etiquetado de las tres concentraciones de Instanyl se diferencia por el color:
Para 50 microgramos/dosis el etiquetado es naranja.
Para 100 microgramos/dosis el etiquetado es morado.
Para 200 microgramos/dosis el etiquetado es azul verdoso.
Titular de la autorización de comercialización
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dinamarca
Responsable de fabricación
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Alemania
Pueden solicitar más información respecto a este Titular de la Autorización de Comercialización
Belgie/Belgique/Belgien/Luxembourg/
Luxemburg
Takeda Belgium Tel./Tél.: +32 2 464 06 11 takeda-belgium@takeda.com
Etarapna
TaKega Etarapna Tea.: + 359 2 958 27 36
Ceská republika
Takeda Pharmaceuticals Czech Republic s.r.o. Tel.: + 420 234 722 722
Danmark
Takeda Pharma A/S Tlf./Tel.: +45 46 77 11 11
medicamento dirigiéndose al representante local del
Magyarország
Takeda Pharma Kft.
Tel.: +361 2707030
Malta / Kúnpoq
Takeda Pharma A/S Tel./ Tnk.: +45 46 77 11 11
Nederland
Takeda Nederland bv Tel.: +31 23 56 68 777
|
Deutschland Takeda GmbH Tel.: +49 (0) 800 825 3325 |
Norge Takeda AS Tlf.: +47 6676 3030 |
|
Eesti Takeda Pharma AS Tel.: +372 6177 669 info@takeda.ee |
Osterreich Takeda Pharma Ges.m.b.H. Tel.: +43 (0) 800 20 80 50 |
|
EXláSa TAKEDA EAAAI A.E. TqA.: +30 210 6387800 gr.info@takeda.com |
Polska Takeda Polska Sp. z o.o. Tel.: +48 22 608 13 00 |
España Portugal
Takeda Farmacéutica España S.A. Takeda Farmacéuticos Portugal, Lda.
Tel.: +34 917 14 99 00 Tel.: + 351 21 120 1457
|
France Takeda France S.A.S Tel.: +33 1 46 25 16 16 |
Romania Takeda Pharmaceuticals SRL Tel.: +40 21 335 03 91 |
Hrvatska Slovenija
Takeda Pharmaceuticals Croatia d.o.o Takeda GmbH Podruznica Slovenija
|
Tel: +385 1 377 88 96 |
Tel.: +386 (0) 59 082 480 |
|
Ireland Takeda Products Ireland Ltd. Tel.: +353 (0) 1 6420021 |
Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o. Tel.: +421 (2) 20 602 600 |
|
Ísland Vistor hf. Tel.: +354 535 7000 vistor@vistor.is |
Suomi/Finland Takeda Oy Puh./Tel.: +358 20 746 5000 infoposti@takeda.com |
|
Italia Grünenthal Italia S.r.l. Tel.: +39 02 4305 1 |
Sverige Takeda Pharma AB Tel.: +46 8 731 28 00 infosweden@takeda.com |
|
Latvija Takeda Latvia SIA Tel.: +371 67840082 |
United Kingdom Takeda UK Ltd Tel.: +44 (0)1628 537 900 |
Fecha de la última revisión de este prospecto {MM/YYYY}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA) http://www.ema.europa.eu.
INSTRUCCIONES DE USO DE INSTANYL
Lea detenidamente las siguientes instrucciones para aprender a utilizar el spray nasal Instanyl.
El spray nasal Instanyl incluye:
- Un mecanismo de bloqueo que controla la frecuencia con que se puede utilizar el spray nasal
- Un cierre de seguridad a prueba de niños, que debe colocarse cuando no se utilice el spray nasal
- Un indicador electrónico que
° facilita información sobre el número de veces que se ha presionado el spray ° muestra el número de dosis restantes
° muestra si el spray nasal está bloqueado o listo para ser utilizado
Cómo retirar y volver a colocar el cierre de seguridad a prueba de niños
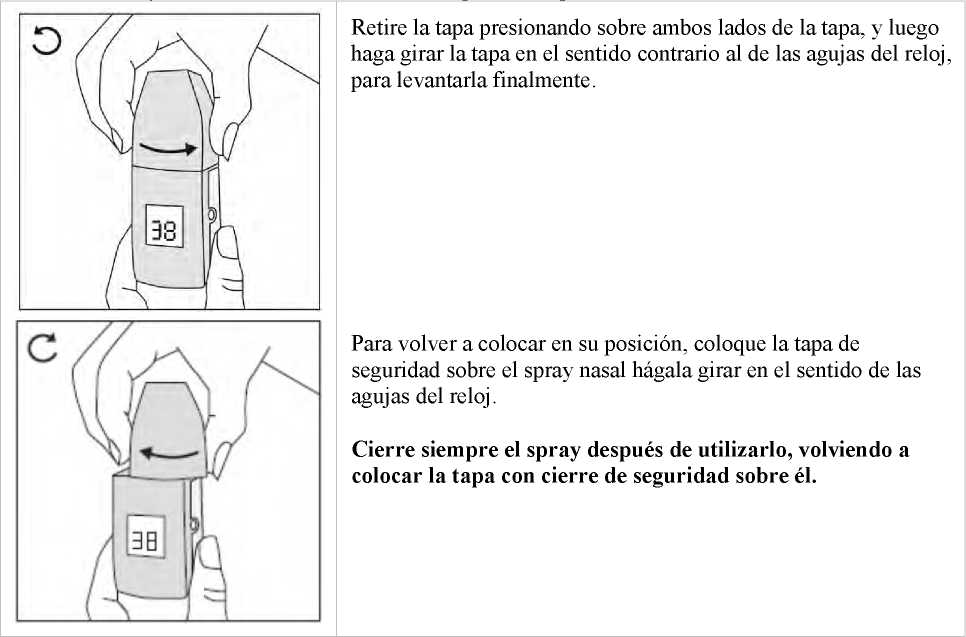
Preparar el spray nasal Instanyl

Antes de utilizar el spray nasal por primera vez, debe ser presionado 5 veces (cebado) antes de que el spray pueda dispensar una dosis completa.
Durante ese proceso de preparación o cebado, se expulsará parte del producto. En consecuencia:
El cebado debe realizarse en una zona bien ventilada.
No debe apuntarse el spray nasal en dirección al usuario ni hacia otras personas.
No debe apuntarse hacia superficies u objetos que pudieran entrar en contacto con otras personas, en especial niños.
1. Presione el botón de color blanco situado en el costado del spray nasal. El indicador se pondrá en funcionamiento y mostrará “P5”.
2. Mantenga derecho el spray una vez alzado y presione el spray nasal una vez sobre el aire. El indicador mostrará ahora “P4” y aparecerá un símbolo de bloqueo o cierre.
3. Cuando ese símbolo de bloqueo o cierre empiece a relampaguear, presione el botón lateral blanco; ese símbolo de bloqueo desaparecerá del indicador.
4. Mantenga derecho el spray nasal y hágalo bombear de nuevo sobre el aire. El indicador mostrará ahora “P3” y el símbolo de bloqueo o cierre.
5. Repita ese procedimiento para llegar a “P2” y “P1” (presione el botón blanco y haga bombear el spray) hasta que el indicador cambie y muestre el número de dosis contenidas en él (es decir, 10, 20, 30 ó 40) y el símbolo de bloqueo relampaguee.
El spray nasal estará ahora listo para su uso.
Dependiendo del modelo de spray, el número inicial será 10, 20, 30 ó 40.
El spray nasal únicamente puede utilizarse cuando el símbolo de bloqueo no aparezca en el indicador.

1.
Suénese la nariz si percibe que está congestionada o si tiene un resfriado.
Debe utilizar el spray sentado o de pie, en ese caso manteniendo una posición recta.
Mantenga derecho el spray nasal.
Presione el botón blanco del costado del spray nasal (el símbolo destellante de bloqueo desaparecerá).
Flexione la cabeza lígeramente hacia delante.
Tape una fosa nasal colocando un dedo sobre el costado de su nariz e inserte la punta del spray en la otra fosa nasal. Presione el atomizador hasta el fondo con dos dedos a la vez mientras inhala a través de la nariz.
Oirá un sonido de “clic” cuando el atomizador sea presionado y el spray nasal haya dispensado su dosis.
El indicador muestra un valor que ahora estará reducido en una unidad y en breve aparecerá el símbolo de bloqueo.
10. Si, transcurridos 10 minutos, se necesita una segunda dosis para aliviar el dolor, repita los pasos 1 a 7 en la otra fosa nasal.
Recuerde limpiar la punta del spray nasal después de su uso con un pañuelo limpio, que debe ser desechado seguidamente.
11.
Recuerde que debe presionar el botón blanco situado en el costado del spray nasal antes de hacerlo bombear.
Recuerde colocar siempre el cierre de seguridad a prueba de niños en el spray nasal y cerrarla después de cada uso.

El spray nasal permite hasta dos dosis para cada episodio de dolor.
Después de la segunda dosis en un periodo de 1 hora, el spray nasal se bloquea. Aparece el símbolo de bloqueo o cierre en el indicador, juntamente con un símbolo de reloj que muestra una cuenta atrás, que indica el tiempo que resta del periodo de bloqueo (cada marca negra equivale a 10 minutos).
Cuando ese periodo de tiempo ha transcurrido, el símbolo de bloqueo o cierre empieza a destellar.
Entonces el spray nasal vuelve a estar listo para su uso cuando ocurra el siguiente episodio de dolor.
Debe esperar 4 horas antes de tratar el siguiente episodio de dolor.
Puede utilizar Instanyl para tratar hasta 4 episodios de dolor por día. Si experimenta más de 4 episodios de dolor al día, debe ponerse en contacto con su médico, ya que su tratamiento para el dolor oncológico puede tener que ser revisado.
El Spray nasal está vacío cuando el indicador muestra “0” y aparece el símbolo de bloqueo.
No deseche Instanyl por los desagües ni con los residuos domésticos. Por sistema, todas las unidades, ya sean utilizadas o no, deben ser devueltas y desecharse de acuerdo a la normativa local o devolverse a la farmacia. Consulte con su farmacéutico.
|
O r |
Si no utiliza Instanyl durante 7 días o más, el spray nasal debe ser preparado (cebado) de nuevo haciéndolo funcionar una vez, antes de recibir la dosis siguiente. Esto viene indicado por una “P” que se muestra en el indicador. Durante ese proceso de preparación o cebado, se expulsará parte del producto. El cebado debe realizarse en una zona bien ventilada. No debe apuntarse el spray nasal en dirección al usuario ni hacia otras personas. No debe apuntarse hacia superficies u objetos que pudieran entrar en contacto con otras personas, en especial niños. Una vez cebado, el indicador mostrará el número de dosis restantes y el spray nasal estará listo para ser utilizado de nuevo. | ||
|
Q c 3 |
Si el indicador muestra un símbolo de batería, esto significa que la carga de la batería está a punto de agotarse. El número de dosis que se muestra en el indicador cambia a “5”. Ese es el número aproximado de dosis que puede dispensar el spray nasal antes de que la batería esté demasiado baja y el indicador se apague. Si el símbolo de batería aparece en el indicador, se recomienda al paciente que se ponga en contacto con su médico para recibir un nuevo spray nasal. | ||
Símbolos que se muestra Explicación en el indicadorelectrónico

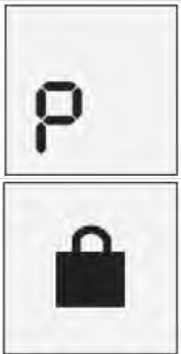

El spray nasal debe ser bombeado 5 veces (cebado) antes de poder ser utilizado (véase la sección “Preparar el spray nasal Instanyl”). El indicador muestra un valor que se va reduciendo (P5, P4, P3, P2 y P1) después de cada accionamiento. El spray nasal está listo cuando el indicador muestra el número de dosis (es decir, 10, 20, 30 ó 40).
A la hora de realizar el cebado, deberán tenerse presentes las anteriores instrucciones de seguridad.
El spray nasal no ha sido utilizado durante 7 días o más.
El símbolo “P” desaparece del indicador cuando el spray nasal es cebado de nuevo haciéndolo funcionar una vez.
A la hora de realizar el cebado, deben tenerse presentes las anteriores instrucciones de seguridad.
Símbolo de BLOQUEO
El spray nasal está bloqueado y no puede ser utilizado.
El símbolo de bloqueo empieza a destellar cuando concluye ese periodo de bloqueo. El símbolo de bloqueo desparece del indicador cuando el botón blanco situado en el costado del spray nasal es presionado.
Símbolo de RELOJ CON CUENTA ATRÁS Muestra cuánto tiempo resta del periodo de bloqueo.
El reloj con cuenta atrás muestra una cuenta atrás, descendente. Cada marca negra equivale a 10 minutos: el máximo periodo de bloqueo es 2 horas.
El símbolo de RELOJ CON CUENTA ATRÁS se muestra juntamente con el símbolo de BLOQUEO.
Número de dosis restantes que quedan en el spray nasal. Después de cada dosis, ese número se va reduciendo en el indicador. Dependiendo del modelo, el número inicial puede ser 10, 20, 30 ó 40.
Símbolo de BATERÍA
La carga de la batería está a punto de agotarse. El número de dosis que muestra el indicador cambia para pasar a ser 5. Ese es el número de dosis, aproximadamente, que puede dispensar el spray nasal antes de que el nivel de la batería sea demasiado bajo y el indicador se apague. La batería no puede recargarse y el usuario deberá conseguir un spray nasal nuevo.
Si nota que el indicador nasal no funciona según se describe en las “Instrucciones de Uso”, deberá ponerse en contacto con su médico o farmacéutico.
103