Inaspir 25 Microgramos/Inhalacion Suspension Para Inhalacion En Envase A Presion
FICHA TÉCNICA

1. NOMBRE DEL MEDICAMENTO
Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión Inaspir Accuhaler 50 microgramos/inhalación, polvo para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Por aplicación del inhalador
Por alvéolo del Accuhaler
Salmeterol (xinafoato)
25 microgramos (0,294 mg/g)
50 microgramos
3. FORMA FARMACÉUTICA
Inaspir 25 microgramos se presenta en suspensión para inhalación en envase a presión.
Inaspir Accuhaler 50 microgramos consiste en polvo para inhalación (pre-dispensado).
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Salmeterol está indicado en el tratamiento regular a largo plazo de la obstrucción reversible de vías respiratorias causada por asma y bronquitis crónica (EPOC).
En el asma, salmeterol está indicado en aquellos pacientes tratados con corticoides que requieran además un agonista beta de larga duración, atendiendo a las recomendaciones vigentes sobre el tratamiento del asma.
4.2 Posología y forma de administración
Posología
Adultos
Dos inhalaciones (2 x 25 microgramos) o 1 alvéolo del Accuhaler (1 x 50 microgramos), dos veces al día.
En pacientes con obstrucción respiratoria más grave, hasta 4 inhalaciones (4 x 25 microgramos) o hasta 2 alvéolos del Accuhaler (2 x 50 microgramos), dos veces al día.
Población pediátrica
Niños de 4 y más años
Dos inhalaciones (2 x 25 microgramos) o 1 alvéolo del Accuhaler (1 x 50 microgramos), dos veces al día. No hay todavía datos clínicos suficientes para recomendar salmeterol en niños menores de 4 años.
No es necesario ajustar las dosis en los pacientes ancianos, ni en pacientes con disfunción renal.
Agencia esparioiaóe medicamentos y proouctos san-tanos
Forma de administración
Salmeterol (suspensión para inhalación y Accuhaler) se administrará sólo por vía inhalatoria.
Proporciona una broncodilatación de larga duración (12 horas), por lo que es adecuado para el tratamiento regular a largo plazo, administrado dos veces al día, a fin de controlar los síntomas. A la vista de su lento comienzo de acción (10 a 20 minutos) no deberá usarse para aliviar los síntomas asmáticos agudos, para lo cual se administrará un broncodilatador de acción más rápida (en 5 minutos) por vía inhalatoria (por ej. salbutamol).
El inicio de una broncodilatación eficaz (>15% de mejoría en el Volumen Espiratorio Forzado en 1 segundo) sucede generalmente en unos 10-20 minutos. La eficacia completa se alcanzará tras las primeras dosis del fármaco. Los efectos broncodilatadores de salmeterol duran generalmente 12 horas. Esto es particularmente útil en el tratamiento de los síntomas nocturnos del asma y en el tratamiento del asma inducida por ejercicio.
Los pacientes que encuentren dificultad en coordinar el manejo del inhalador con la inhalación, pueden utilizar una cámara para inhalación apropiada (BABYHALER® niños de hasta 5 años).
Debido a que puede haber efectos adversos asociados a una dosis excesiva de este tipo de fármacos, el incremento de dosis o frecuencia de administración debe realizarse sólo bajo supervisión médica.
4.3 Contraindicaciones
La administración de Inaspir está contraindicada en pacientes con hipersensibilidad al salmeterol (xinafoato) o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
El tratamiento del asma normalmente debe seguir un programa escalonado.
El tratamiento con salmeterol no debe utilizarse (y no es suficiente) como tratamiento inicial del asma.
Salmeterol no es un sustituto de los corticosteroides orales o inhalados en el tratamiento del asma. Se usa de forma complementaria a ellos. Se debe advertir a los pacientes asmáticos que no deben interrumpir o reducir su tratamiento esteroideo sin consultarlo con el médico, incluso si se sienten mejor con el uso de salmeterol.
Salmeterol no debe utilizarse para el tratamiento de los síntomas agudos del asma, para los cuales se requiere la administración de un broncodilatador de inicio rápido y corta duración de acción. Debe advertir a los pacientes que dispongan en todo momento de su medicación para el alivio de los síntomas agudos del asma.
Los broncodilatadores no deben ser el único tratamiento en pacientes con asma moderada, grave o inestable. Estos pacientes requerirán tratamiento adecuado con corticoides inhalados o terapia corticosteroidea por vía oral. Junto a una terapia esteroidea óptima de fondo, Inaspir puede ofrecer un tratamiento sintomático adicional. El empeoramiento repentino de los síntomas puede requerir un aumento de la dosis de corticosteroide, que será administrado bajo supervisión médica.
Un aumento en la utilización de broncodilatadores, en especial de P2-agonistas de corta duración de acción, para aliviar los síntomas indica un deterioro del control del asma. Si los pacientes encuentran que el tratamiento con broncodilatadores de corta duración de acción para el alivio de los síntomas es cada vez menos eficaz o sienten que necesitan más inhalaciones que las habituales, se debe acudir al médico. En estos casos, los pacientes deben ser evaluados y se debe tener en cuenta la posible necesidad de aumentar el tratamiento antiinflamatorio (por ejemplo, dosis más altas de corticosteroides inhalados o corticosteroides
ÍTTI
orales). Las exacerbaciones graves del asma deben tratarse de forma habitual.
Aunque Inaspir puede administrarse como tratamiento complementario cuando los corticosteroides inhalados no proporcionan un adecuado control del asma, los pacientes no deben iniciar el tratamiento con Inaspir durante una exacerbación aguda grave del asma, o si están sufriendo un empeoramiento significativo o un deterioro agudo del asma.
Durante el tratamiento con Inaspir pueden producirse acontecimientos adversos graves relacionados con el asma y las exacerbaciones. Se debe pedir a los pacientes que continúen el tratamiento pero que acudan a su médico si los síntomas del asma siguen sin estar controlados o empeoran tras comenzar el tratamiento con Inaspir.
Un empeoramiento repentino y progresivo en el control del asma puede poner en peligro la vida del paciente, por lo que se le debe hacer una evaluación inmediata. Debe considerarse aumentar la terapia corticosteroidea. En estas circunstancias se aconseja monitorizar el flujo máximo diario. Para el tratamiento de mantenimiento del asma debe administrarse salmeterol en combinación con corticosteroides orales o inhalados. Los broncodilatadores de larga duración no deben ser el único o el principal tratamiento para el mantenimiento del asma (ver sección 4.1).
Una vez que se hayan controlado los síntomas del asma, se puede tener en cuenta la posibilidad de reducir gradualmente la dosis de Inaspir. Es importante hacer un control de forma regular de los pacientes a los que se les está disminuyendo la dosis. Debe utilizarse la dosis mínima eficaz de Inaspir.
Salmeterol debe administrarse con precaución en pacientes con tirotoxicosis.
Se ha informado de casos muy raros de aumento de los niveles de glucosa en sangre (ver sección 4.8), lo cual debe tenerse en cuenta cuando se prescriba a pacientes con antecedentes de diabetes mellitus.
Con todos los fármacos simpaticomiméticos pueden observarse, ocasionalmente, efectos cardiovasculares, como aumento de la presión sistólica y de la frecuencia cardiaca, especialmente a dosis superiores a las dosis terapéuticas. Por este motivo, salmeterol debe emplearse con precaución en pacientes con patologías cardiovasculares previas.
Como consecuencia del tratamiento con agonistas P2 se puede producir una hipocaliemia potencialmente grave. Se recomienda tener especial precaución en el asma aguda grave, ya que este efecto puede ser potenciado por la hipoxia y por el tratamiento concomitante con derivados de xantina, esteroides y diuréticos. En tales situaciones se deben vigilar los niveles séricos de potasio.
Todos los fármacos simpaticomiméticos pueden producir un descenso transitorio de los niveles de potasio en sangre a dosis superiores a las terapéuticas. Por lo tanto, salmeterol debe administrarse con precaución a pacientes con predisposición a tener niveles bajos de potasio en sangre.
Los datos de un amplio ensayo clínico (“Salmeterol Multi-Center Asthma Research Trial”, SMART) sugirieron que los pacientes afro-americanos presentaban un mayor riesgo de padecer acontecimientos graves relacionados con el sistema respiratorio o de muerte durante la utilización de salmeterol en comparación con placebo (ver sección 5.1). No se conoce si era debido a factores farmacogenéticos u otros factores. Por lo tanto, se debe pedir a los pacientes con ascendencia africana o afro-caribeña que continúen con el tratamiento pero que acudan a su médico si los síntomas del asma siguen sin estar controlados o empeoran durante el tratamiento con Inaspir.
El uso concomitante de ketoconazol por vía sistémica aumenta la exposición sistémica a salmeterol. Esto puede conducir a un aumento de la incidencia de los efectos sistémicos (como prolongación del intervalo QTc y palpitaciones). Por tanto, se debe evitar el uso concomitante de ketoconazol u otros inhibidores potentes del CYP3A con salmeterol, a menos que los beneficios superen el riesgo potencialmente aumentado de padecer efectos sistémicos (ver secciones 4.5 y 5.2).
ÍTTI
Inaspir 25 microgramos, suspensión para inhalación en envase a presión ha modificado su formulación para suprimir los propelentes CFC, lo que deberá tenerse en cuenta por si fuera necesario modificar la pauta posológica. Se deberá informar a los pacientes de que pueden notar cambios en el sabor y en el sonido del inhalador durante su utilización.
Los pacientes deben ser instruidos en el uso correcto del inhalador y debe comprobarse la técnica de inhalación de los pacientes para asegurar que el medicamento inhalado llegue de manera óptima a los pulmones.
Como la absorción sistémica se realiza mayoritariamente a través de los pulmones, el uso de una cámara de inhalación con un inhalador presurizado puede variar la cantidad de fármaco que llega a los pulmones. Por tanto, se debe tener en cuenta que esto podría producir potencialmente un aumento en el riesgo de efectos adversos sistémicos y podría requerirse un ajuste de la dosis.
La inhalación de Inaspir puede producir broncoespasmo paradójico el cual puede ser grave. Si esto ocurriese se deberá suspender inmediatamente el tratamiento e instaurar otra terapia.
Se informa a los deportistas que este medicamento contiene un componente que puede establecer un resultado analítico de control de dopaje como positivo.
Advertencias sobre excipientes:
Inaspir Accuhaler contiene lactosa. Puede provocar reacciones alérgicas en pacientes con alergia a la proteína de la leche de vaca.
Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben usar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los fármacos p-bloqueantes pueden debilitar o antagonizar el efecto de salmeterol. Debe evitarse la utilización de fármacos p-bloqueantes tanto selectivos como no selectivos a menos que existan razones que obliguen a ello.
Como consecuencia del tratamiento con agonistas P2 se puede producir una hipocaliemia potencialmente grave. Se recomienda tener especial precaución en el asma aguda grave, ya que este efecto puede ser potenciado por el tratamiento concomitante con derivados de xantina, esteroides y diuréticos.
Inhibidores potentes del CYP3A4
La administración conjunta de ketoconazol (400 mg una vez al día por vía oral) y salmeterol (50 microgramos dos veces al día por vía inhalatoria) en 15 sujetos sanos durante 7 días produjo un aumento significativo de la exposición de salmeterol en plasma (1,4 veces la Cmax y 15 veces el AUC). Esto puede conducir a un aumento de la incidencia de otros efectos sistémicos del tratamiento con salmeterol (como prolongación del intervalo QTc y palpitaciones) en comparación con el tratamiento con salmeterol o ketoconazol solo (ver secciones 4.4 y 5.2).
No se han observado efectos clínicamente significativos sobre la presión sanguínea, la frecuencia cardiaca y los niveles de potasio y glucosa en sangre. La administración concomitante con ketoconazol no aumentó la semivida de eliminación de salmeterol ni aumentó la acumulación de salmeterol con dosis repetidas.
Se debe evitar la administración concomitante de ketoconazol, a menos que los beneficios superen el riesgo potencialmente aumentado de padecer efectos sistémicos del tratamiento con salmeterol. Es probable que exista un riesgo similar de interacción con otros inhibidores potentes del CYP3A4 (como itraconazol, telitromicina, ritonavir).
Inhibidores moderados del CYP3A4
4 de 17 MINISTRO DE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia españciaóe medie amentos y proouctos san-tanos
¿ illí.g’ s
ÍTTI
La administración conjunta de eritromicina (500 mg tres veces al día por vía oral) y salmeterol (50 microgramos dos veces al día por vía inhalatoria) en 15 sujetos sanos durante 6 días produjo un aumento pequeño pero no estadísticamente significativo de la exposición de salmeterol (1.4 veces la Cmax y 1.2 veces el AUC). La administración concomitante con eritromicina no se asoció con ningún efecto adverso grave.
4.6 Fertilidad, embarazo y lactancia
Hay datos limitados (menos de 300 resultados en embarazadas) sobre el uso de salmeterol en mujeres embarazadas.
Los estudios en animales no muestran efectos perjudiciales directos o indirectos de toxicidad reproductiva con la excepción de la evidencia de algunos efectos en el feto a dosis muy elevadas (ver sección 5.3).
Como medida preventiva es preferible evitar el uso de Inaspir durante el embarazo.
Los resultados farmacodinámicos/toxicológicos disponibles en animales han mostrado que salmeterol se excreta en la leche. Por tanto, no se puede excluir el riesgo en el niño que está siendo amamantado.
Se debe decidir si interrumpir la lactancia o bien interrumpir/abstenerse de administrar Inaspir teniendo en cuenta el beneficio de la lactancia materna para el niño y el beneficio del tratamiento para la mujer.
Los estudios del efecto de HFA 134a han mostrado que no hay efectos sobre la función reproductora y la lactancia en animales adultos o sobre dos generaciones sucesivas de ratas ni sobre el desarrollo fetal en ratas o conejos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas que se relacionan han sido clasificadas por órgano, sistema y frecuencia. Las frecuencias se han definido de la siguiente forma: Muy frecuentes (>1/10), Frecuentes (> 1/100 a < 1/10), Poco frecuentes (> 1/1.000 a < 1/100), Raras (> 1/10.000 a < 1/1.000) y Muy raras (< 1/10.000) y casos aislados. Las reacciones frecuentes y poco frecuentes se han identificado a partir de los datos de ensayos clínicos. La incidencia del placebo no ha sido tenida en cuenta. Las reacciones muy raras se han identificado a través de notificación espontánea.
Las siguientes frecuencias son estimadas a la dosis estándar de 50 microgramos, dos veces al día. Las frecuencias a dosis superiores a 100 microgramos, dos veces al día también han sido tenidas en cuenta donde es apropiado.
|
Clasificación de órganos |
Reacciones adversas |
Frecuencia |
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilidad con las siguientes manifestaciones: | |
|
Erupción (picor y enrojecimiento) |
Poco frecuentes | |
|
Reacciones anafilácticas incluyendo edema y angioedema, broncoespasmo y shock anafiláctico |
Muy raras | |
|
Trastornos del |
Hipocaliemia |
Raras |
|
metabolismo y de la |
Hiperglucemia |
Muy raras |
|
Clasificación de órganos |
Reacciones adversas |
Frecuencia |
|
nutrición | ||
|
Trastornos psiquiátricos |
Nerviosismo |
Poco frecuentes |
|
Insomnio |
Raras | |
|
Trastornos del sistema nervioso |
Cefalea |
Frecuentes |
|
Temblor |
Frecuentes | |
|
Mareos |
Raras | |
|
Trastornos cardíacos |
Palpitaciones |
Frecuentes |
|
Taquicardia |
Poco frecuentes | |
|
Arritmias cardiacas (incluyendo fibrilación auricular, taquicardia supraventricular y extrasístoles). |
Muy raras | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Irritación orofaríngea |
Muy raras |
|
Broncoespasmo paradójico |
Muy raras | |
|
Trastornos gastrointestinales |
Náusea |
Muy raras |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Calambres musculares |
Frecuentes |
|
Artralgia |
Muy raras | |
|
Trastornos generales y alteraciones en el lugar de la administración |
Dolor torácico inespecífico |
Muy raras |
Se han notificado reacciones adversas farmacológicas de los P2-agonistas, tales como temblor, cefalea y palpitaciones, pero tienden a ser transitorias y a disminuir con el tratamiento regular. El temblor y la taquicardia se producen más frecuentemente cuando se administran a dosis superiores a 50 microgramos, dos veces al día.
Como con cualquier otra terapia por inhalación, debe tenerse en cuenta la posibilidad de broncoespasmo paradójico, con un aumento inmediato de las sibilancias y con una caída del pico espiratorio máximo (FEM) tras la administración. Si ello ocurriera, deberá tratarse inmediatamente con un broncodilatador inhalado de acción rápida. Debe interrumpirse inmediatamente la administración de Inaspir, evaluar al paciente y, si es necesario, instaurar una terapia alternativa (ver sección 4.4).
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
Los signos y síntomas de una sobredosis de salmeterol son mareos, aumento de la presión sistólica, temblor, cefalea y taquicardia.
Tratamiento:
El antídoto preferido para la sobredosis de salmeterol inhalado es un agente P-bloqueante cardioselectivo. Estos fármacos deben utilizarse con precaución extrema en pacientes con antecedentes de broncoespasmo.
También puede aparecer hipocaliemia y por tanto se deben monitorizar los niveles de potasio en suero. Asimismo se debe considerar la reposición de potasio.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: R03AC12 - Agonistas selectivos de receptores beta-2 adrenérgicos.
Mecanismo de acción
Salmeterol es un agonista selectivo de acción prolongada (12 horas) de los receptores P2 adrenérgicos, que posee una cadena lateral larga que se une a la zona externa del receptor. Estas propiedades farmacológicas de salmeterol confieren una protección más eficaz frente a la broncoconstricción inducida por histamina y una broncodilatación más prolongada que dura por lo menos 12 horas, en comparación con las dosis recomendadas para los agonistas de los receptores P2 adrenérgicos convencionales de corta duración de acción.
Salmeterol ha demostrado en ensayos "in vitro" ser un inhibidor, potente y de larga duración, de la liberación en el pulmón humano, de mediadores procedentes de los mastocitos, tales como histamina, leucotrienos y prostaglandina D2. En el hombre, salmeterol inhibe la respuesta al alergeno inhalado, tanto en la fase inmediata como en la tardía, persistiendo ésta última durante más de 30 horas tras una dosis única, cuando el efecto broncodilatador ya no es evidente. Salmeterol atenúa, tras dosis única, la hiperreactividad bronquial. Estas propiedades indican que Inaspir modula el proceso inflamatorio en el pulmón, pero la significación clínica global de ello no se ha esclarecido todavía. El mecanismo es distinto del efecto antiinflamatorio de los corticosteroides, que no deberán dejar de ser administrados ni reducir su administración cuando se prescriba Inaspir.
Estudios clínicos:
“Salmeterol Multi-Center Asthma Research Trial” (SMART)
El estudio SMART es un estudio multi-céntrico, randomizado, doble ciego, controlado con placebo en grupos paralelos, de 28 semanas de duración, realizado en EEUU, en el que se trataron aleatoriamente 13.176 pacientes con salmeterol (50 microgramos dos veces al día) y 13.179 pacientes con placebo, además de recibir su tratamiento habitual para el asma. Los pacientes fueron incluidos en el ensayo si tenían al menos 12 años, asma, y si actualmente estaban usando medicación para el asma (pero no LABAs). Se recogieron los datos del uso basal de corticosteroides inhalados en el momento de comenzar el estudio, aunque no era necesario para el mismo. El criterio de eficacia primario en el estudio SMART fue la determinación, de forma combinada, del número de muertes relacionadas con problemas respiratorios y de acontecimientos respiratorios con riesgo para la vida.
Hallazgos fundamentales del estudio SMART: Criterio de eficacia primario
|
Grupo de pacientes |
Número de criterios de eficacia |
Riesgo relativo (intervalo de confianza 95%) | |
|
primarios / Número de pacientes | |||
|
Salmeterol |
Placebo | ||
|
Todos los pacientes |
50/13.176 |
36/13.179 |
1,40 (0,91; 2,14) |
|
Pacientes que utilizan corticosteroides inhalados |
23/6.127 |
19/6.138 |
1,21 (0,66; 2,23) |
|
Pacientes que no utilizan corticosteroides inhalados |
27/7.049 |
17/7.041 |
1,60 (0,87; 2,93) |
|
Pacientes Afro-americanos |
20/2.366 |
5/2.319 |
4,10 (1,54; 10,90) |
(El riesgo en negrita es estadísticamente significativo con un IC del 95%)
Hallazgos fundamentales del estudio SMART en función del uso de corticosteroides inhalados en el periodo basal: Criterios de eficacia secundarios
|
Número de criterios de eficacia secundarios / Número de pacientes |
Riesgo relativo (intervalo de confianza 95%) | ||
|
Salmeterol |
Placebo | ||
|
Muertes relacionadas con problemas respiratorios | |||
|
Pacientes que utilizan corticosteroides inhalados |
10/6.127 |
5/6.138 |
2,01 (0,69: 5,86) |
|
Pacientes que no utilizan corticosteroides inhalados |
14/7.049 |
6/7.041 |
2,28 (0,88; 5,94) |
|
Combinación de muertes relacionadas con asma y acontecimientos respiratorios con riesgo | |||
|
para la vida | |||
|
Pacientes que utilizan corticosteroides inhalados |
16/6.127 |
13/6.138 |
1,24 (0,60; 2,58) |
|
Pacientes que no utilizan corticosteroides inhalados |
21/7.049 |
9/7.041 |
2,39 (1,10; 5,22) |
|
Muertes relacionadas con el asma | |||
|
Pacientes que utilizan corticosteroides inhalados |
4/6.127 |
3/6.138 |
1,35 (0,30; 6,04) |
|
Pacientes que no utilizan corticosteroides inhalados |
9/7.049 |
0/7.041 |
* |
(*= no se puede calcular porque no hay acontecimientos en el grupo tratado con placebo. El riesgo en negrita es estadísticamente significativo con un IC del 95%. Los criterios de eficacia secundarios recogidos en la tabla son estadísticamente significativos en toda la población). Los criterios de eficacia secundarios combinados de todas las causas de muerte o acontecimientos con riesgo para la vida, todas las causas de muerte, o todas las causas de hospitalización, no alcanzaron significación estadística en toda la población).
Ensayos clínicos en EPOC (estudio TORCH)
TORCH ha sido un estudio de 3 años de duración para valorar el efecto del tratamiento con salmeterol-propionato de fluticasona Accuhaler 50/500 microgramos dos veces al día, salmeterol Accuhaler 50
ÍTTI
microgramos dos veces al día, propionato de fluticasona (PF) Accuhaler 500 microgramos dos veces al día o placebo sobre mortalidad por todas las causas en pacientes con EPOC. Los pacientes con EPOC severa a moderada con valores basales (pre broncodilatador) de VEMS <60% del predicho fueron aleatorizados al tratamiento bajo doble ciego. Durante el estudio, a los pacientes se les permitió la terapia habitual de EPOC a excepción de otros corticosteroides inhalados, broncodilatadores de larga duración y corticosteroides sistémicos a largo plazo. Se determinó la supervivencia a los 3 años de todos los pacientes, con independencia de la posible retirada del estudio. El criterio de valoración primario fue la reducción de la mortalidad por todas las causas a los 3 años para salmeterol-propionato de fluticasona vs placebo.
|
Placebo N = 1.524 |
Salmeterol 50 N = 1.521 |
PF 500 N = 1.534 |
Salmeterol-propionato de fluticasona 50/500 N = 1.533 | |
|
Mortalidad por todas las causas a los 3 años | ||||
|
Número de muertes (%) |
231 (15,2%) |
205 (13,5%) |
246 (16,0%) |
193 (12,6%) |
|
Cociente de riesgos vs placebo (ICs) valor p |
N/A |
0,879 (0,73; 1,06) 0,180 |
1,060 (0,89; 1,27) 0,525 |
0,825 (0,68; 1,00 ) 0,052' |
|
Cociente de riesgos salmeterol-propionato de fluticasona 50/500 vs componentes (ICs) valor p |
N/A |
0,932 (0,77; 1,13) 0,481 |
0,774 (0,64; 0,93) 0,007 |
N/A |
1 Valor p no significativo después de ajustar para 2 análisis intermedios en la comparación de la valoración primaria de eficacia mediante un análisis log-rank, estratificado por la condición de fumador
Salmeterol-PF redujo en un 17,5% el riesgo de muerte en cualquier momento durante los 3 años, comparado con placebo (cociente de riesgos 0,825 (95% IC: 0,68; 1,00; p=0,052) todos ajustados por análisis intermedios). Hubo una reducción del 12% en el riesgo de muerte por cualquier causa en cualquier momento en los 3 años, para salmeterol comparado con placebo (p=0,180) y un incremento del 6% para PF comparado con placebo (p=0,525).
Un análisis de apoyo que utilizó el modelo de riesgos proporcional de Cox dio un cociente de riesgo de 0,811 (95% IC: 0,670; 0,982; p=0,031) para salmeterol-PF frente a placebo, que representa una reducción del 19% en el riesgo de muerte en cualquier momento durante 3 años. El modelo fue ajustado para factores importantes (condición de fumador, edad, sexo, región, VEMS basal e índice de masa corporal). No hubo evidencia de que los efectos del tratamiento variaran por estos factores.
El porcentaje de pacientes que murieron durante los 3 años debido a causas relacionadas con EPOC fue 6,0% para el placebo, 6,1% para el salmeterol, 6,9% para PF y 4,7% para salmeterol-PF.
La media de exacerbaciones moderadas a severas disminuyó con salmeterol-PF cuando se comparó con placebo en un 25% (IC 95%: 19% a 31%; p<0,001). Salmeterol-PF redujo la media de exacerbaciones en un 12% comparado con salmeterol (IC 95%: 5% a 19%; p=0,002) y en un 9% comparado con PF (IC 95%: 1% a 16%; p=0,024). Salmeterol y PF redujeron significativamente las tasas de exacerbación comparadas con placebo en un 15% (IC 95%: 7% a 22%; p<0,001) y 18% (IC 95%: 11% a 24%; p<0,001) respectivamente.
9 de 17 MINISTWIODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia españoiade medie amentos y proouctos sabíanos
ÍTTI
La Calidad de Vida Relacionada con la Salud, evaluada mediante el Cuestionario Respiratorio de St.
George (SGRQ) mejoró con todos los tratamientos activos en comparación con placebo. La mejora media a los tres años para salmeterol-PF comparado con placebo fue -3,1 unidades (IC 95%: -4,1 a -2,1; p<0,001), comparado con salmeterol fue -2,2 unidades (p<0,001) y comparado con PF fue -1,2 unidades (p=0,017).
Durante los 3 años de tratamiento, los valores de VEMS fueron más altos en sujetos tratados con salmeterol-PF que los tratados con placebo (diferencia media durante los 3 años: 92 ml, IC 95%: 75 a 108 ml; p<0,001). Salmeterol-PF fue también más efectivo en mejorar el VEMS que salmeterol o PF (diferencia media 50 ml, p<0,001 para salmeterol, y 44 ml, p<0,001 para PF).
La probabilidad estimada a 3 años de padecer neumonía, notificada como acontecimiento adverso, fue del 12,3% para el grupo placebo, 13,3% para salmeterol, 18,3% para PF y 19,6% para salmeterol-PF (cociente de riesgos para salmeterol-PF vs placebo: 1,64; IC 95%: 1,33 a 2,01, p<0,001). No hubo incremento de las muertes relacionadas con neumonía; el número de muertes atribuidas a neumonía mientras duró el tratamiento fue de 7 para el grupo placebo, 9 para salmeterol, 13 para PF y 8 para salmeterol-PF. No se produjo una diferencia significativa en la probabilidad de fractura ósea (5,1% placebo, 5,1% salmeterol,
5,4% PF y 6,3% salmeterol-PF; cociente de riesgos para salmeterol-PF vs placebo: 1,22; IC 95%: 0,87 a 1,72; p=0,248).
La incidencia de acontecimientos adversos de trastornos oculares, trastornos óseos y trastornos del eje HPA fue baja y no hubo diferencias observadas entre tratamientos. No hubo evidencia de un aumento de acontecimientos adversos cardíacos en los grupos de tratamiento con salmeterol.
5.2 Propiedades farmacocinéticas
Salmeterol actúa localmente en el pulmón, por lo que los niveles plasmáticos no son predictivos del efecto terapéutico. Además, se dispone sólo de algunos datos sobre la farmacocinética de salmeterol, a causa de la dificultad técnica de la valoración del fármaco en plasma, debido a las muy bajas concentraciones plasmáticas (unos 200 picogramos/ml o menos) alcanzadas tras la inhalación de la dosis.
En un ensayo de interacción de medicamentos cruzado, controlado con placebo, en 15 sujetos sanos, la administración conjunta de salmeterol (50 microgramos dos veces al día por vía inhalatoria) y el inhibidor de CYP3A4, ketoconazol (400 miligramos una vez al día por vía oral) durante 7 días produjo un aumento significativo de la exposición de salmeterol en plasma (1,4 veces la Cmax y 15 veces el AUC). No hubo aumento en la acumulación de salmeterol con dosis repetidas. Tres sujetos abandonaron la administración conjunta de salmeterol y ketoconazol debido a prolongaciones en el intervalo QTc o a palpitaciones con taquicardia sinusal. En los 12 sujetos restantes, la administración conjunta de salmeterol y ketoconazol no produjo un efecto clínicamente significativo sobre el ritmo cardíaco, los niveles de potasio en sangre o en la duración del intervalo QTc (ver secciones 4.4 y 4.5).
Se pudo detectar ácido hidroxinaftoico en la circulación sistémica, alcanzando concentraciones estables de unos 100 nanogramos/ml, tras la administración regular de xinafoato de salmeterol. Estas concentraciones son de hasta 1.000 veces más bajas que los niveles estables observados en los estudios de toxicidad y, en los estudios de administración regular a largo plazo (más de 12 meses) en pacientes con obstrucción reversible de las vías respiratorias, han mostrado no producir efectos perjudiciales.
Un estudio in vitro muestra que el salmeterol se metaboliza fundamentalmente a a-hidroxisalmeterol (oxidación alifática) mediante el citocromo P450 3A4 (CYP3A4). Un estudio de dosis repetidas de salmeterol y eritromicina en voluntarios sanos no mostró cambios clínicamente significativos en los efectos farmacodinámicos tras la administración de dosis de 500 miligramos de eritromicina 3 veces al día. Sin embargo, un estudio de interacción de salmeterol con ketoconazol produjo un aumento significativo de la exposición de salmeterol en plasma (ver secciones 4.4 y 4.5).
ÍTTI
5.3 Datos preclínicos sobre seguridad
Los resultados extraídos del programa de investigación toxicológica han demostrado que xinafoato de salmeterol inhalado se tolera localmente muy bien. Los animales toleraron también altos niveles sistémicos y los efectos observados se asociaron predominantemente con una actividad farmacológica exagerada. Los estudios de toxicidad reproductiva y de oncogenicidad mostraron los efectos típicos asociados a los agonistas P2.
Se ha observado que el propelente no CFC, HFA 134a, presente en Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión, no presenta efectos tóxicos a concentraciones de vapor muy elevadas, muy superiores a aquellas que se espera que reciban los pacientes, en un amplio intervalo de especies expuestas diariamente durante periodos de dos años.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión
Norflurano (HFA 134a).
Inaspir Accuhaler 50 microgramos/inhalación, polvo para inhalación
Lactosa monohidrato (contiene proteínas lácteas).
6.2 Incompatibilidades
No se han descrito.
6.3 Periodo de validez
Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión: 2 años.
Inaspir Accuhaler 50 microgramos/inhalación, polvo para inhalación: 2 años.
6.4 Precauciones especiales de conservación
Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión.
Colocar el protector de la boquilla empujando firmemente y cerrando de un golpe para que la tapa quede en su sitio.
No conservar a temperatura superior a 30°C. Conservar protegido de la luz solar directa y no congelar.
El cartucho no debe ser perforado, roto o quemado aun cuando aparentemente esté vacío.
Como ocurre con la mayoría de los inhaladores a presión, el efecto terapéutico de esta medicación puede verse reducido si el cartucho está excesivamente frío.
Inaspir Accuhaler 50 microgramos/inhalación, polvo para inhalación proporciona una buena protección del contenido de los alvéolos frente al efecto de la atmósfera; no obstante, conservar protegido de la humedad, conservar protegido del calor y de la luz solar directa y no conservar a temperatura superior a 30°C.
ÍTTI
6.5 Naturaleza y contenido del envase
Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión contiene una suspensión de salmeterol (xinafoato) en propelente norflurano (sin CFC). Esta suspensión está contenida en un inhalador dosificador presurizado con un aplicador especialmente diseñado. El envase está constituido por un cartucho de 8 ml fabricado con una aleación de aluminio y va provisto de una válvula dosificadora. Cada cartucho proporciona 120 aplicaciones.
Inaspir Accuhaler 50 microgramos/inhalación, polvo para inhalación se presenta en forma de un dispositivo de plástico que contiene una tira de doble lámina de aluminio con 60 alvéolos regularmente distribuidos.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Instrucciones de uso/ manipulación
Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión Antes de usar por primera vez el inhalador o bien si no ha sido utilizado durante una semana o más tiempo, quitar el protector del aplicador bucal o boquilla apretando suavemente por los lados, agitar bien el inhalador, y liberar al aire dos aplicaciones para asegurar, de esta manera, el funcionamiento del inhalador.
Los pacientes que hayan sido previamente tratados con Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión deben saber que en la actualidad no contiene CFCs. Debe utilizarse exactamente como le indique el médico.
El principio activo de Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión sin CFCs es exactamente el mismo que el del Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión que contenía CFCs. Las únicas diferencias que pueden notarse son el sabor y la sensación de notar el spray en la boca, además del sonido del inhalador durante la utilización. Esto se debe al cambio de propelente para eliminar los CFCs. Esta modificación no afecta al mecanismo de acción del fármaco. Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión sin CFCs se puede utilizar de la misma manera a como se utilizaba el anterior.
1. Quitar el protector de la boquilla, apretando suavemente por los lados.

2. Comprobar que no hay partículas extrañas por dentro y por fuera del inhalador, incluyendo la boquilla.
3. Agitar bien el inhalador para asegurar la eliminación de cualquier partícula extraña y que el contenido del inhalador se mezcla adecuadamente.
an

4. Sujetar el inhalador en posición vertical entre los dedos índice y pulgar, colocando el pulgar sobre la base, por debajo de la boquilla.

5. Echar tanto aire como se pueda e introducir a continuación la boquilla en la boca, entre los dientes, cerrando los labios sobre el aparato, pero sin morderlo.

6. Inmediatamente después de comenzar a tomar aire por la boca, pulsar la parte superior del inhalador para liberar el medicamento y continuar tomando aire profunda y constantemente.

7. Contener la respiración y sacar el inhalador de la boca, quitando el dedo de la parte superior del inhalador. Continuar conteniendo la respiración tanto como se pueda.

<$tj>
iml
8. Si se va a administrar otra inhalación, mantener el inhalador en posición vertical y esperar durante aproximadamente medio minuto antes de repetir los pasos 3 a 7.
9. Volver a colocar el protector de la boquilla empujando firmemente y ajustándolo hasta oír un chasquido.
IMPORTANTE
No efectuar rápidamente los pasos 5, 6 y 7. Es importante iniciar la respiración tan lentamente como se pueda, justamente antes de pulsar el inhalador.
Practicar delante de un espejo durante las primeras veces. Si se observa una "especie de niebla" saliendo de la parte superior del inhalador o de los lados de la boca, comenzar de nuevo desde el paso 2.
Los pacientes que encuentren dificultad en coordinar el manejo del inhalador con la inhalación, pueden utilizar una cámara para inhalación apropiada (BABYHALER® niños de hasta 5 años).
Los niños pequeños pueden necesitar ayuda, teniendo sus padres que manejar el inhalador por ellos. Animar al niño a echar el aire y manejar el inhalador justo después de que el niño comience a tomar aire. Practicar juntos la técnica. Los niños mayores o las personas con manos frágiles, deberán sujetar el inhalador con ambas manos para lo cual, se pondrán los dos dedos índice en la parte superior del inhalador y los dos pulgares en la base, por debajo de la boquilla.

Limpieza:
Limpiar el inhalador por lo menos una vez a la semana.
1. Quitar el protector de la boquilla.
2. No sacar el cartucho de la carcasa de plástico.
3. Limpiar la boquilla por dentro y por fuera, así como la carcasa de plástico con un paño seco, con un pañuelo de papel o con un poco de algodón.
4. Volver a colocar el protector de la boquilla.
NO SUMERGIR EN AGUA EL ENVASE METÁLICO.
Inaspir Accuhaler 50 microgramos/inhalación, polvo para inhalación El dispositivo tiene dos posiciones: cerrado y abierto.
CERRADO:
Al extraer del estuche por primera vez el dispositivo, estará cerrado.
Carcasa externa
Hueco para poner el dedo
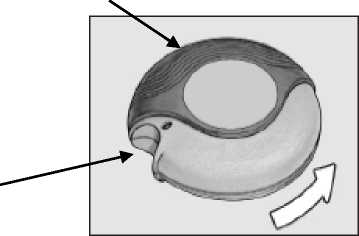
El inhalador se abre en esta dirección
i t x /
ABIERTO:
El dispositivo contiene 60 dosis individuales del medicamento en forma de polvo. El indicador de dosis señala cuántas dosis quedan.
Carcasa externa
Aplicador bucal o boquilla
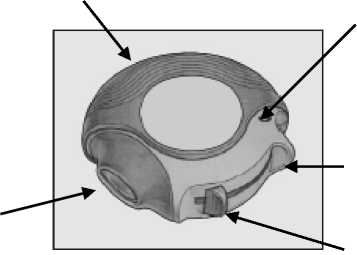
Indicador de dosis
Lleno Vacío
C60 0
Hueco para poner el dedo
Palanca
Cada dosis está precisamente medida y protegida higiénicamente. No se requiere ni mantenimiento ni rellenado.
El indicador de dosis en la parte superior del dispositivo señala cuántas dosis quedan. Los números 5 a 0 aparecerán en ROJO para así advertir que quedan pocas dosis.
El manejo del dispositivo es fácil. Cuando se necesite una dosis, seguir las cuatro sencillas instrucciones siguientes:
1. Abrir
2. Deslizar
3. Inhalar
4. Cerrar.
Funcionamiento del dispositivo
Al deslizar la palanca del dispositivo se abre un pequeño orificio en el aplicador bucal o boquilla y queda disponible una dosis ya preparada para ser inhalada. Cuando se cierra el dispositivo, la palanca automáticamente retrocede a su posición original quedando preparada para la siguiente dosis que necesite. La carcasa externa protege el dispositivo cuando no se utiliza.
1. Abrir
Para abrir el dispositivo, coger con una mano la carcasa externa y colocar el dedo pulgar de la otra mano en el hueco reservado para ello. Empujar con el dedo alejándolo de usted hasta donde llegue.
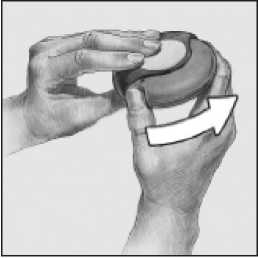
Deslizar
2.
Mantener el dispositivo con la boquilla hacia usted. Deslizar la palanca alejándola hasta donde llegue se percibirá un sonido "click". El dispositivo está preparado para su uso. Cada vez que la palanca se echa hacia atrás, queda disponible una dosis para su inhalación. Esto lo muestra el contador de dosis. No manipular la palanca pues quedarían dosis disponibles que serían desperdiciadas.
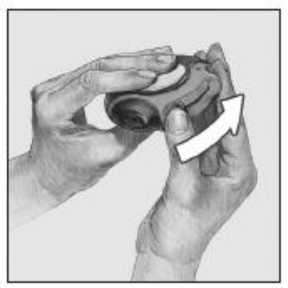
3. Inhalar
*
*
*
*
*
*
Antes de empezar a inhalar una dosis, leer atentamente todo este apartado.
Mantener el dispositivo alejado de la boca. Espirar lo que razonablemente se pueda - no hacerlo dentro del dispositivo.
Colocar la boquilla en los labios. Inspirar progresiva e intensamente - a través del dispositivo, no por la nariz.
Sacar el dispositivo de la boca.
Mantener la respiración unos 10 segundos o tanto tiempo como sea posible.
Espirar lentamente.

4. Cerrar
Para cerrar el dispositivo, poner el dedo pulgar en el hueco reservado para ello y deslizarlo hacia usted, hasta donde llegue.
16 de 17 MINISTRO DE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia es paño® de medicamentos y proouctos san-ianos
ÍTTI
Al cerrar el dispositivo, se escuchará un golpe seco. La palanca automáticamente vuelve a su posición original y queda de nuevo colocada. El dispositivo está ahora preparado para volverlo a utilizar.

Si el médico ha prescrito dos inhalaciones, cerrar el dispositivo y repetir las instrucciones 1 a 4. RECORDAR
Mantener el dispositivo seco.
Mantener el dispositivo cerrado cuando no se utilice.
No espirar dentro del dispositivo.
Deslizar la palanca únicamente cuando esté preparado para tomar una dosis.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
ALLEN FARMACEUTICA, S.A.
P.T.M. C/ Severo Ochoa, 2 28760 Tres Cantos (Madrid)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión: N° Registro 59.527 Inaspir Accuhaler 50 microgramos/inhalación, polvo para inhalación: N° Registro 59.526
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización:
Inaspir 25 microgramos/inhalación, suspensión para inhalación en envase a presión: 15 de octubre de 1992. Inaspir Accuhaler 50 microgramos/inhalación, polvo para inhalación: 9 de octubre de 1992.
Fecha de la última renovación: Julio 2007
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2013.
17 de 17