Imodium Flas 2 Mg Liofilizado Oral
¡m
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
IMODIUM Flas 2 mg liofilizado oral
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada liofilizado oral contiene 1,86 mg de loperamida, aportado por 2 mg de hidrocloruro de loperamida. Composición cualitativa y cuantitativa
Excipiente(s) con efecto conocido Aspartamo (0,75 mg por liofilizado oral)
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Liofilizado oral.
Comprimido liofilizado con forma circular de color blanco a blanquecino.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Está indicado en adultos y niños mayores de 12 años para el tratamiento sintomático de la diarrea aguda inespecífica.
4.2 Posología y forma de administración
Posología
Adultos y niños mayores de 12 años.
Iniciar el tratamiento tomando 2 liofilizados orales (4mg de Loperamida hidrocloruro) y continuarlo con 1 liofilizado oral (2mg) después de cada deposición diarreica. No tomar más de 8 liofilizados orales (16mg de loperamida hidrocloruro) al día, la duración máxima del tratamiento será de 2 días.
Población pediátrica
Imodium Flas está contraindicado en niños menores de 12 años.
Insuficiencia hepática:
Aunque no se dispone de datos farmacocinéticos en los pacientes con insuficiencia hepática, loperamida hidrocloruro debe usarse con precaución en estos pacientes dada la reducción del metabolismo de primer paso (ver sección 4.4 “Advertencias y precauciones especiales de empleo”).
Insuficiencia renal
No se requiere un reajuste de dosis para los pacientes con insuficiencia renal.
CONDICIONES DE OPERTORfi
|
¡""Y V. i-} | |
|
fyH ) S | |
|
mí: | |
Con las manos secas, rasgar el blister por la sección ranurada. No oprimir el liofilizado oral.
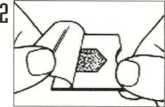
Sujetar la lámina de aluminio y despegarla girando hacia atrás de la muesca en el extremo.
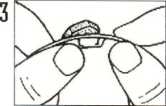
Empujar suavemente hacia fuera el liofilizado oral de IMODIUM Flas desde atrás.
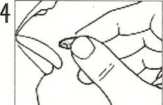
Colocar el liofilizado oral de IMODIUM Flas sobre la lengua e ingerirlo con la saliva. No necesita agua.
4.3 Contraindicaciones
- Hipersensibilidad al principio activo (Loperamida hidrocloruro) o a alguno de los excipientes incluidos en la sección 6.1.
- Niños menores de 12 años de edad.
- Disentería aguda, caracterizada por la presencia de sangre en heces y fiebre elevada (superior a 38°C)
- Colitis ulcerosa aguda.
- Colitis pseudomembranosa asociada al tratamiento con antibióticos de amplio espectro.
- Pacientes con enterocolitis bacteriana causada por organismos invasivos, como son Salmonella, Shigella y Campylobacter.
En general, Imodium Flas no debe administrarse cuando se quiera evitar la inhibición del peristaltismo, y debe suspenderse el tratamiento rápidamente si se presentara: estreñimiento, distensión abdominal o subíleo
4.4 Advertencias y precauciones especiales de empleo
Si no se observa mejoría clínica en 48 horas o si aparece fiebre, se interrumpirá el tratamiento con Imodium Flas y se evaluará la situación clínica.
Puesto que el tratamiento de la diarrea con Loperamida hidrocloruro es sólo sintomático, cuando sea posible, ésta se debe tratar a partir de su causa. En pacientes con diarrea, especialmente en ancianos y en niños menores de 12 años, se puede presentar la depleción de fluidos y electrólitos. En tales casos, la medida terapéutica más importante es la administración de fluidos apropiados y la reposición de electrólitos. La deshidratación puede influir en la variabilidad de la respuesta a la loperamida.
Los pacientes con SIDA tratados con Loperamida hidrocloruro para la diarrea deben suspender el tratamiento ante los primeros signos de la distensión abdominal. Se han reportado casos muy raros de megacolon tóxico en enfermos de SIDA tratados con Loperamida para colitis infecciosa debida a patógenos virales o bacterianos.
Aunque no se dispone de datos farmacocinéticas en los pacientes con insuficiencia hepática, la Loperamida hidrocloruro debe usarse con precaución en estos pacientes dada la reducción del metabolismo de primer paso. Se vigilará estrechamente a los pacientes con disfunción hepática en busca de signos de toxicidad del SNC. Imodium Flas se administrará bajo supervisión médica a los pacientes con disfunción hepática grave.
Este medicamento puede ser perjudicial para personas con fenilcetonuria porque contiene aspartamo que es una fuente de fenilalanina.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los datos no clínicos han mostrado que loperamida hidrocloruro es un sustrato de la glicoproteína P.
La administración concomitante de loperamida (dosis única de 16 mg) con quinidina o ritonavir, ambos inhibidores de la glicoproteína P, incrementó en 2 ó 3 veces los niveles plasmáticos de loperamida. Se desconoce la importancia clínica de esta interacción farmacocinética con los inhibidores de la glicoproteína P cuando se administran las dosis recomendadas de loperamida (2 mg, hasta una dosis máxima diaria de 8 mg).
El uso simultáneo con analgésicos opiáceos puede aumentar el riesgo de estreñimiento grave y de depresión del SNC.
La loperamida puede empeorar o prolongar la diarrea producida por antibióticos de amplio espectro.
4.6 Fertilidad, embarazo y lactancia Embarazo
Los estudios en animales son insuficientes para determinar las reacciones en el embarazo y/o desarrollo embrional/fetal y/o parto y/o desarrollo postnatal (véase 5.3). Se desconoce el riesgo en seres humanos.
No hay constancia de que la loperamida presente propiedades teratogénicas o embriotóxicas en animales. Ya que no hay experiencia en el uso de Imodium Flas durante el embarazo no debe ser administrado si no está clínicamente justificado.
Lactancia
Hay poca información sobre la excreción de loperamida en leche materna, pero se han detectado pequeñas cantidades del fármaco en la leche, por lo que no se recomienda su uso durante la lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se ha informado que en pacientes en tratamiento con loperamida, se ha producido cansancio, mareo y somnolencia. Si se viera afectado no conduzca o maneje máquinas. (Ver sección 4.8. Reacciones Adversas).
4.8 Reacciones adversas
La seguridad de Loperamida hidrocloruro en el tratamiento de la diarrea fue evaluada en 3076 adultos y niños de 12 o más años, que participaron en 31 ensayos clínicos controlados y no controlados. De éstos, 26 ensayos clínicos fueron para diarrea aguda (N= 2775), y 5 para diarrea crónica (N=321).
Las reacciones adversas mayormente notificadas (>1% incidencia) en ensayos clínicos con loperamida hidrocloruro para diarrea aguda fueron: estreñimiento (2.7%), flatulencia (1.7%), dolor de cabeza (1.2%) y nauseas (1.1%). En ensayos clínicos para diarrea crónica, las reacciones adversas mayormente notificadas (>1% incidencia) fueron: flatulencia (2.8%), estreñimiento (2.2%), nauseas (1.2%) y mareos (1.2%).
Las reacciones adversas identificadas durante el período de experiencia post-comercialización, se resumen en la siguiente tabla, de acuerdo con las siguientes frecuencias:
• Muy frecuente
• Frecuente
• Poco frecuente
• Raras
• Muy raras
>1/10
>1/100 y < 1/10
>1/1.000 y < 1/100
>1/10.000 y < 1/1.000
>1/10.000 incluyendo reportes aislados
No conocidas: no puede estimarse a partir de los datos disponibles
1 La inclusión de este término se basa en informes de post comercialización de loperamida hidrocloruro. Como el proceso para determinar las reacciones adversas de post comercialización no diferencian entre diarrea aguda y crónica, ni entre adultos y niños, la frecuencia se estima de todos los ensayos clínicos con loperamida hidrocloruro combinada, incluyendo ensayos en niños de 12 o menos años (N=3683).
2 Ver sección 4.4. Advertencias y precauciones especiales de empleo.
3 Sólo se ha notificado en el caso de uso de loperamida hidrocloruro como liofilizado oral.
Las reacciones adversas de ensayos clínicos donde no se presenta frecuencia, no se consideran para esta indicación.
|
Reacciones adversas | |
|
Trastornos del sistema inmunológico | |
|
Raras |
Reacciones de hipersensibilidad1, Reacciones anafilácticas (incluido shock anafiláctico)1 y reacciones anafilactoides1 |
|
Trastornos del sistema nervioso | |
|
Frecuente |
Dolor de cabeza, Mareos |
|
Poco frecuente |
Somnolencia1 |
|
Raras |
Coordinación anormal1, nivel de consciencia deprimido1, hipertonía1, pérdida de consciencia1, estupor1 |
|
Trastornos oculares | |
|
Raras |
Miosis1 |
|
Trastornos gastrointestinales | |
|
Frecuente |
Estreñimiento, Náuseas, Flatulencia |
|
Poco frecuente |
Dolor abdominal, molestias abdominales, boca seca. Dolor abdominal superior, Vómitos Dispepsia |
|
Raras |
Íleo1 (incluyendo íleo paralítico), megacolon1 (incluyendo megacolon tóxico2), Glosodinea1,3 Distensión abdominal |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Poco frecuente |
Erupción |
|
Raras |
Angioedema1, Erupción bullosa1 (incluido síndrome Stevens-Johnson, necrólisis epidérmica tóxica y eritema multiforme), prurito1, urticaria1 |
|
Trastornos renales y urinarios | |
|
Raras |
Retención urinaria1 |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Raras |
Fatiga1 |
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https: //www .notificaram.es.
4.9 Sobredosis
En caso de sobredosis (incluyendo sobredosis relacionada con disfunción hepática), se puede presentar: depresión del sistema nervioso central (estupor, coordinación anormal, somnolencia, miosis, hipertonía muscular, depresión respiratoria), sequedad de boca, malestar abdominal, náuseas y vómitos, estreñimiento, retención urinaria e íleo paralítico. Los niños son más sensibles a los efectos sobre el SNC que los adultos.
Si se presentaran los síntomas por sobredosis, se puede administrar naloxona como antídoto. Puesto que la duración de acción de la loperamida es mayor que la de la naloxona (1 a 3 horas) podría estar indicado un tratamiento repetitivo con naloxona. Por tanto, el paciente debe ser monitorizado durante al menos 48 horas para detectar posibles depresiones del SNC.
En caso de ingestión accidental: se debe administrar carbón activo lo antes posible después de la ingestión, seguido de lavado gástrico si no se ha producido el vómito..
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antidiarreico; antipropulsivo; loperamida Código ATC: A07DA03
La loperamida se une a los receptores opiáceos en la pared intestinal. Como consecuencia, inhibe la secreción de acetilcolina y prostaglandinas, por lo tanto reduce el peristaltismo propulsivo, incrementando el tiempo de tránsito en el intestino. Inhibe directamente la secreción de líquidos y electrolitos. La loperamida incrementa el tono del esfínter anal, y así reduce la incontinencia y urgencia.
Loperamida tiene una gran afinidad por la pared intestinal y sufre intenso metabolismo de primer paso, por lo que sólo una cantidad muy pequeña alcanza la circulación sistémica..
5.2 Propiedades farmacocinéticas
La loperamida es fácilmente absorbida por el intestino (aproximadamente un 40%), pero es extraída y metabolizada por completo en el hígado, donde se conjuga y excreta vía biliar. Debido a su alta afinidad por la pared intestinal y a su elevado metabolismo del primer paso, apenas alcanza la circulación sistémica. La vida media de loperamida en hombre es de 10,8 horas dentro de un rango de 9 a 14 horas. Se excreta principalmente a través de las heces.
Los estudios de distribución en ratas muestran una elevada afinidad por la pared intestinal con preferencia por la unión a los receptores de la capa muscular longitudinal..
5.3 Datos preclínicos sobre seguridad
Los estudios agudos y crónicos de loperamida no han mostrado toxicidad específica. Los resultados de los estudios in vivo e in vitro indicaron que loperamida no es genotóxica. En estudios de reproducción, a dosis muy elevadas (40 mg/Kg/día-240 veces la dosis máxima en humanos) la loperamida dificulta la fertilidad y la
¡m
supervivencia fetal en ratas. A dosis más bajas no hay efecto en la salud maternal o fetal y no afecta al desarrollo peri y postnatal.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Gelatina Manitol (E-421)
Aspartamo (E-951)
Aroma de menta Hidrogenocarbonato de sodio.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere ninguna temperatura especial de conservación. Conservar en el embalaje original para protegerlo de la humedad.
6.5 Naturaleza y contenido del envase
Envases en blister conteniendo 6 y 12 liofilizados.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se hará de acuerdo a la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Johnson & Johnson S.A.
Paseo de las Doce Estrellas 5-7 28042 Madrid.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
65.349
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
26/05/2003
10. FECHA DE LA REVISIÓN DEL TEXTO
Abril 2016
6 de 6