Imigran 6 Mg Inyectable
"I
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
IMIGRAN 6 mg inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
IMIGRAN 6mg inyectable
Cada jeringa precargada contiene 6,0 mg de sumatriptán (como sumatriptán succinato).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
IMIGRAN 6 mg inyectable, se suministra en jeringas precargadas que contienen6 mg de sumatriptán en una solución isotónica en un volumen de 0,5 ml. Las jeringas se utilizan con un autoinyector.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
IMIGRAN 6 mg inyectable está indicado para el alivio de ataques agudos de migraña con o sin aura y para el tratamiento de ataques agudos de cefalea acuminada (cefalea en racimos).
4.2 Posología y forma de administración
No utilizar IMIGRAN 6 mg inyectable profilácticamente.
Se aconseja que el tratamiento con IMIGRAN 6 mg inyectable comience tan pronto como sea posible tras el inicio de un ataque de cefalea migrañosa o cefalea acuminada (cefalea en racimos) o síntomas relacionados como náuseas, vómitos o fotofobia. Ha demostrado ser eficazcuando se administra en cualquier fase del ataque.
La eficacia de sumatriptán es independiente de la duración del ataque una vez que se haya iniciado el tratamiento.
La administración durante un aura migrañosa anterior a la aparición de otros síntomas puede no prevenir el desarrollo de una cefalea.
IMIGRAN 6 mg inyectable se administrará por vía subcutánea, utilizando un autoinyector.
Se advertirá a los pacientes que sigan estrictamente las INSTRUCCIONES PARA LA CORRECTA ADMINISTRACIÓN DEL PREPARADO del prospecto, en especial lo referente al modo de desechar de forma segura las jeringas y agujas utilizadas.
Se evitará que IMIGRAN 6 mg inyectable sea administrado por vía intravenosa. En caso de administrarse en el brazo, no se inyectará en la zona del codo debido a la existencia de venas superficiales.
Adultos
MIGRAÑA
La dosis recomendada es de 6 mg por vía subcutánea.
Si el paciente no responde a la primera dosis de IMIGRAN 6 mg inyectable, no se deberá administrar una segunda dosis para el mismo ataque.
Para ataques posteriores, puede administrarse IMIGRAN 6 mg inyectable.
Si el paciente ha respondido a la primera dosis pero los síntomas recurren, podrá administrarse una segunda dosis de 6 mg por vía subcutánea en las siguientes 24 horas, siempre que haya transcurrido 1 hora como mínimo desde la primera dosis.
La dosis máxima en 24 horas es de dos inyecciones de 6 mg (12 mg).
CEFALEA ACUMINADA (Cefalea en racimos)
La dosis recomendada es de 6 mg por vía subcutánea para cada ataque. La dosis máxima en 24 horas es de dos inyecciones de 6 mg (12 mg), con un intervalo mínimo de 1 hora entre las dos dosis.
Niños y adolescentes (menores de 18 años)
IMIGRAN 6 mg inyectable no está recomendado para uso en niños y adolescentes menores de 18 años debido a la escasez de datos sobre seguridad y eficacia.
Ancianos (mayores de 65 años de edad)
La experiencia de uso de sumatriptán en pacientes mayores de 65 años es limitada. La farmacocinética no difiere significativamente de la observada en la población más joven, pero hasta que pueda disponerse de datos adicionales no se recomienda el uso de sumatriptán en pacientes mayores de 65 años.
4.3 Contraindicaciones
Hipersensibilidad a sumatriptán o a alguno de los excipientes.
Sumatriptán no deberá administrarse a pacientes que han tenido un infarto de miocardio o tienen isquemia cardíaca, vasospasmo coronario (angina de Prinzmetal), enfermedad vascular periférica o pacientes que tienen síntomas o signos que concuerdan con los de una isquemia cardíaca.
No deberá administrarse sumatriptán a pacientes con una historia de accidente cerebrovascular (ACV) o ataque isquémico transitorio (AIT).
Sumatriptán no deberá administrarse a pacientes con insuficiencia hepática grave.
Está contraindicada la administración de sumatriptán a pacientes con hipertensión moderada y grave e hipertensión leve no controlada.
Está contraindicado el uso concomitante de ergotamina o derivados de ergotamina (incluyendo metisergida) o cualquier triptán/agonista del receptor 5-hidroxitriptamina (5-HT¡) (ver sección 4.5).
Está contraindicada la administración concurrente de sumatriptán e inhibidores de la monoaminooxidasa (IMAOs).
ÍTTI
No se utilizará IMIGRAN 6 mg inyectable en las dos semanas desde la finalización de un tratamiento con inhibidores de la monoaminooxidasa.
4.4 Advertencias y precauciones especiales de empleo
IMIGRAN 6 mg inyectable sólo debe utilizarse cuando se disponga de un diagnóstico claro de migraña o cefalea acuminada.
IMIGRAN 6 mg inyectable no se debe administrar vía intravenosa.
Sumatriptán no está indicado para ser utilizado en el tratamiento de la migraña hemipléjica, basilar u oftalmopléjica.
Como con otras terapias antimigrañosas, antes de tratar cefaleas en pacientes no diagnosticados previamente de migrañosos, así como en pacientes migrañosos con síntomas atípicos, se guardará la debida precaución con el fin de excluir la presencia de otras enfermedades neurológicas potencialmente graves.
Debe advertirse que, en pacientes migrañosos, hay mayor riesgo de existencia de determinadas alteraciones cerebrales (ej. ACV, AIT).
Tras la administración de sumatriptán, pueden aparecer síntomas transitorios, incluyendo dolor y opresión torácicos, que pueden ser intensos y extenderse a la garganta (ver sección 4.8). Si se considera que tales síntomas indican una enfermedad isquémica cardiaca, no deberán administrarse más dosis de sumatriptán y se realizarán los exámenes pertinentes.
No se administrará sumatriptán a pacientes con factores de riesgo de enfermedad isquémica cardiaca, incluyendo aquellos pacientes que fuman mucho o utilizan terapia sustitutiva con nicotina, sin realizar previamente una evaluación cardiovascular (ver sección 4.3). Debe prestarse especial atención a mujeres postmenopáusicas y hombres de más de 40 años de edad con estos factores de riesgo. Sin embargo, estas evaluaciones pueden no identificar a todos los pacientes que tienen una enfermedad cardiaca y, en muy raros casos, han ocurrido acontecimientos cardíacos graves en pacientes sin enfermedad cardiovascular subyacente.
Tras la comercialización, raramente se han notificado casos de pacientescon síndrome serotoninérgico (incluyendo alteraciones del estado mental, inestabilidad autonómica y anomalías neuromusculares) tras el uso de un inhibidor selectivo de la recaptación de serotonina (ISRS) y sumatriptán. Se ha informadode la aparición del síndrome serotoninérgico tras la administración concomitante con triptanes e inhibidores de la recaptación de noradrenalina y serotonina (IRNSs).
Si sejustifica clínicamente el tratamiento concomitante con sumatriptán y un ISRS/IRNS, se aconseja mantener al paciente bajo observación (ver sección 4.5).
Sumatriptán deberá administrarse con precaución a pacientes con enfermedades que puedan alterar significativamente la absorción, el metabolismo o la excreción del fármaco, por ejemplo con insuficiencia hepática o renal.
ÍTTI
Sumatriptán deberá usarse con precaución en pacientes con historial de convulsiones u otros factores de riesgo que disminuyan el umbral de convulsiones, dado que se han observado convulsiones en asociación con sumatriptán (ver sección 4.8).
Los pacientes con hipersensibilidad conocida a las sulfonamidas pueden experimentar una reacción alérgica tras la administración de sumatriptán. Las reacciones pueden variar desde hipersensibilidad cutánea a anafilaxia. Aunque la evidencia de sensibilidad cruzada es limitada, se aconseja tener precaución en estos pacientes antes de tomar sumatriptán.
Los efectos indeseables pueden ser más comunes durante la utilización concomitante de triptanos y preparados de hierbas medicinales que contengan Hierba de San Juan (Hypericum perforatum).
El uso prolongado de cualquier tipo de analgésico puede empeorar las cefaleas. Si experimenta o piensa que puede tener esta situación, debe buscar asistencia médica y suspender el tratamiento. El diagnóstico de cefalea por abuso de analgésicos es posible en pacientes que tienen cefaleas frecuentes o diarias a pesar del (o debido a) uso regular de medicamentos para la cefalea.
No deberá superarse la dosis recomendada de IMIGRAN.
4.5 Interacción con otros medicamentos y otras formas de interacción
No hay evidencia de interacciones con propranolol, flunarizina, pizotifeno o alcohol.
Son limitados los datos referentes a la existencia de una interacción con preparados que contengan ergotamina u otro triptán/agonista del receptor 5-HT1. El riesgo aumentado de vasoespasmo coronario es una posibilidad teórica, estando contraindicada la administración concomitante (ver sección 4.3).
Se desconoce el periodo de tiempo que debería transcurrir entre el uso de sumatriptán y el de preparaciones que contengan ergotamina u otro triptán/ agonista del receptor 5- HT1. Esto dependerá de las dosis y del tipo de productos utilizados. Los efectos pueden ser aditivos. Se aconseja esperar al menos 24 horas después de usar los preparados con ergotamina u otro triptán/ agonista del receptor 5- HT1, antes de administrar sumatriptán. A la inversa, se aconseja esperar al menos seis horas después de utilizar sumatriptán antes de administrar un producto que contenga ergotamina y al menos 24 horas antes de administrar otro triptán/agonista del receptor 5- HT1.
Puede haber interacción entre sumatriptán y los inhibidores de la monoaminooxidasa (IMAOs), estando contraindicada la administración concomitante de estos fármacos (ver sección 4.3).
Tras la comercialización, se han notificado casos de pacientes con síndrome serotoninérgico (incluyendo alteración del estado mental, inestabilidad autonómica y anomalías neuromusculares) tras el uso de un inhibidor selectivo de la recaptación de serotonina (ISRS) y sumatriptán. También se ha notificado la aparición de síndrome serotoninégico tras el tratamiento concomitante con triptanes e inhibidores de la recaptación de noradrenalina y serotonina (IRNSs) (ver sección 4.4).
4.6 Fertilidad, embarazo y lactancia
Se dispone de datos post-comercialización procedentes del uso de sumatriptán durante el primer trimestre en más de 1.000 mujeres. Aunque la información aportada por estos datos no es suficiente para extraer conclusiones definitivas, no indica que aumente el riesgo de aparición de defectos congénitos. Es limitada la experiencia que se tiene acerca del uso de sumatriptán en el primer y en el segundo trimestre.
ÍTTI
La evaluación de los estudios realizados con animales de experimentación no indica la existencia de efectos teratogénicos o efectos perjudiciales directos sobre el desarrollo peri- y postnatal. No obstante, la viabilidad embriofetal puede verse afectada en conejos (ver sección 5.3). La administración de sumatriptán solamente deberá considerarse si el beneficio esperado para la madre es mayor que cualquier posible riesgo para el feto.
Se ha demostrado que tras la administración por vía subcutánea, sumatriptán se excreta en leche materna.
La exposición del lactante puede minimizarse interrumpiendo la lactancia durante las 12 horas siguientes al tratamiento. La leche materna producida en ese periodo debe ser desechada.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre la capacidad para conducir y utilizar máquinas. Puede aparecer somnolencia, como consecuencia de la migraña o de su tratamiento con sumatriptán. Esto puede influir en la capacidad de conducir y utilizar máquinas.
4.8 Reacciones adversas
A continuación se presentan las reacciones adversas clasificadas por sistema corporal, órgano y frecuencia. Las frecuencias se definen como: muy frecuentes (> 1/10), frecuentes (> 1/100, < 1/10), poco frecuentes (> 1/1.000, < 1/100), raras (> 1/10.000, <1/1.000), muy raras (< 1/10.000), incluyendo notificaciones aisladas.
Trastornos del sistema inmunológico
Desconocidas: Reacciones de hipersensibilidad que incluyen desde hipersensibilidad cutánea
(como urticaria) hasta casos de anafilaxia.
Trastornos del sistema nervioso
Frecuentes: Mareos, somnolencia, perturbaciones sensoriales incluyendo parestesia e
hipoestesia.
Desconocidas: Convulsiones, aunque algunas han aparecido en pacientes con historial de
convulsiones o con predisposición a tener convulsiones. También hay casos en pacientes sin factores de predisposición aparentes; temblor, distonía, nistagmo, escotoma.
Trastornos oculares
Desconocidas: Parapadeo, diplopía, visión reducida. Incluye casos de pérdida de visión
permanente. No obstante, las alteraciones visuales también pueden aparecer durante un ataque de migraña.
Trastornos cardíacos
Desconocidas: Bradicardia, taquicardia, palpitaciones, arritmias cardíacas, alteraciones en el
electrocardiograma de naturaleza isquémico transitoria, vasoespasmo arterial coronario, angina, infarto de miocardio (ver sección 4.3 y 4.4).
Trastornos vasculares
Frecuentes:
Aumentos transitorios de la presión sanguínea poco después del tratamiento. Rubor.
Desconocidas:
Hipotensión, fenómeno de Raynaud.
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes: Disnea.
Trastornos gastrointestinales
Frecuentes: Algunos pacientes han experimentado náuseas y vómitos, pero la relación con
sumatriptán o las condiciones subyacentes no son claras.
Desconocidas: Colitis isquémica, diarrea.
Trastornos musculoesqueléticos y del tejido conjuntivo
Frecuentes: Sensación de pesadez (normalmente transitoria; puede ser intensa y afectar a
cualquier parte del cuerpo, incluyendo el pecho y la garganta). Mialgia.
Desconocidas: Rigidez de cuello, artralgia.
Trastornos generales y alteraciones en el lugar de administración
Frecuentes: Dolor, sensaciones de calor o frío, presión o tensión (estos síntomas son
normalmente transitorios; pueden ser intensos y afectar a cualquier parte del cuerpo incluyendo el pecho y la garganta); sensación de debilidad, fatiga (ambos síntomas son en su mayoría de intensidad leve a moderada y transitorios).
Exploraciones
Muy raras: Se han observado ocasionalmente alteraciones menores en las pruebas de función
hepática.
Trastornos psiquiátricos
Desconocidas: Ansiedad.
Trastornos de la piel y del tejido subcutáneo
Desconocidos: Hiperhidrosis.
Las reacciones adversas más comunes asociadas al tratamiento con sumatriptán administrado por vía subcutánea son:
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Dolor pasajero en el lugar de la inyección. También se ha notificado picazón/ardor
en el lugar de la inyección, hinchazón, eritema, cardenales y sangrado.
Aunque no están disponibles comparaciones directas, después de la administración de sumatriptán inyectable pueden ser muy frecuentes las siguientes reacciones adversas: rubefacción, parestesia y sensación de calor, presión y pesadez.
En cambio las náuseas, vómitos y fatiga parecen ser menos frecuentes con la administración subcutánea de sumatriptán inyectable que con comprimidos.
4.9 Sobredosis
Se han descrito algunos casos de sobredosis con sumatriptán inyectable.
Algunos pacientes que han recibido hasta 12 mg en dosis única por vía subcutánea, no han experimentado reacciones adversas significativas.
Dosis de hasta 16 mg por vía subcutánea no se asociaron a otras reacciones adversas además de las mencionadas.
En caso de sobredosis, se realizará un seguimiento del paciente durante al menos diez horas y se aplicará el tratamiento de soporte pertinente.
No se conoce el efecto que la hemodiálisis o la diálisis peritoneal tiene sobre la concentración plasmática de sumatriptán.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agonistas Selectivos de los receptores 5-HT1.
Códifo ATC: N02CC01
Sumatriptán ha demostrado ser un agonista selectivo del receptor vascular de la 5-hidroxitriptamina (5-HTm) que carece de efecto en otros subtipos de receptor de la 5-HT (5-HT2 a 5-HT7). El receptor vascular 5-HT1d se encuentra predominantemente en los vasos sanguíneos craneales e interviene en la vasoconstricción. En animales, sumatriptán constriñe selectivamente la circulación de la arteria carótida sin alterar el flujo sanguíneo cerebral. La circulación de la arteria carótida suministra sangre a los tejidos extracraneales e intracraneales tales como las meninges y se considera que la dilatación y/o la formación de edema en estos vasos constituyen el mecanismo subyacente de la migraña en el hombre. Además, la evidencia de los estudios realizados con animales señala que sumatriptán inhibe la actividad del nervio trigémino. Ambas acciones (vasoconstricción craneal e inhibición de la actividad del nervio trigémino) pueden contribuir a la acción antimigrañosa de sumatriptán en humanos.
La respuesta clínica comienza a los 10-15 minutos de una inyección por vía subcutánea, a los 15 minutos de la administración de una dosis de 20 mg por vía intranasal y a los 30 minutos de la administración de una dosis de 100 mg por vía oral.
Sumatriptán es efectivo en el tratamiento agudo de los ataques de migraña asociados al periodo menstrual.
5.2 Propiedades farmacocinéticas
La farmacocinética de sumatriptán no parece verse afectada de manera significativa por los ataques de migraña.
Absorción
ÍTTI
La biodisponibilidad media de sumatriptán administrado por vía subcutánea es elevada (96 %), alcanzándose concentraciones séricas máximas en los 25 minutos siguientes a la administración. La concentración sérica máxima promedio después de una inyección subcutánea de 6 mg es 72 ng/ml.
Distribución
La unión a proteínas plasmáticas es baja (14-21 %) y el volumen total de distribución medio 170 litros. Metabolismo
El principal metabolito de sumatriptán, un análogo del ácido indolacético, se excreta principalmente en orina, estando presente en forma de ácido libre y de glucurónido conjugado. Este metabolito carece de actividad conocida 5-HTj ó 5-HT2. No se han identificado metabolitos menores.
Eliminación
La vida media de eliminación es de aproximadamente 2 horas. El aclaración plasmático total es de aproximadamente 1.160 ml/min. y el aclaración renal medio es de aproximadamente 260 ml/min. El aclaramiento no renal constituye el 80% del aclaramiento total. Sumatriptán se elimina principalmente por metabolismo oxidativo mediado por la monoaminooxidasa A.
5.3 Datos preclínicos sobre seguridad
Sumatriptán careció de actividad genotóxica y carcinogénica en sistemas in vitro y en estudios con animales.
En un estudio sobre la fertilidad en ratas, se observó una reducción en el éxito de la inseminación con niveles plasmáticos 150 veces superiores a los observados en humanos tras una dosis subcutánea de 6 mg.
Este efecto no ocurrió durante un estudio por vía subcutánea, donde los niveles plasmáticos máximos alcanzados fueron 100 veces superiores a los de la vía subcutánea en humanos.
No se han observado efectos teratogénicos en ratas ni conejos. Sumatriptán no tiene efecto sobre el desarrollo post-natal de la rata.
Cuando se administró a conejos preñados durante el periodo de organogénesis, sumatriptán produjo en raras ocasiones mortalidad embrionaria a dosis lo suficientemente elevadas como para causar toxicidad materna.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
IMIGRAN 6 mg inyectable
Cloruro de sodio
Agua para preparaciones inyectables 0,5 ml
6.2 Incompatibilidades
No aplicable.
6.3 Periodo de validez
Dos años
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
IMIGRAN 6 mg inyectable, ha de protegerse de la luz.
6.5 Naturaleza y contenido del envase
IMIGRAN 6 mg inyectable se suministra en jeringas precargadas que contienen 6 mg de sumatriptán base, en forma de sal succinato, en una solución isotónica en un volumen de 0,5 ml. Estas jeringas se utilizan junto a un dispositivo para autoinyección.
El dispositivo para autoinyección consta de tres partes: estuche o petaca, cartucho y autoinyector. En la petaca se alojan el autoinyector y el cartucho. El cartucho contiene dos jeringas precargadas protegidas cada una por una tapa provista de cierre inviolable. El autoinyector es un tubo hueco que contiene un émbolo accionado por un muelle y un mecanismo disparador, que está diseñado para insertar la aguja a una profundidad reproducible y liberar la dosis con un movimiento suave.
El envase que se utilizará consta de un estuche o petaca con dos jeringas precargadas y un dispositivo para autoinyección.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con el, se realizará de acuerdo con la normativa local.
Contenido del estuche o petaca
a) Al abrir la tapa del estuche o petaca, podrá ver el autoinyector y el cartucho con las jeringas.
b) Comprobar que el cartucho está correctamente colocado, esto es, cuando se vean los botones azules a través de los orificios del estuche o petaca.

1. Abrir el estuche o petaca.
Quitar el precinto de una de las dos jeringas que contiene el cartucho.
2. Abrir la tapa de la jeringa correspondiente.

9 de 12
<jtj>


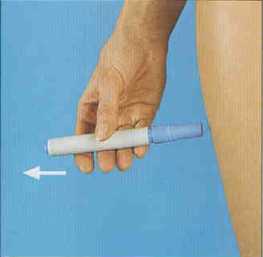
3. Sacar el autoinyector del estuche o petaca.
4. Introducir con firmeza el autoinyector en el cartucho y girar el autoinyector en el sentido de las agujas de reloj hasta no poder girar más.
5. Tirar con firmeza del autoinyector cargado hacia afuera. Es posible que le cueste un poco hacerlo. Hay un botón de seguridad que evita una inyección accidental hasta que usted esté preparado.
6. Presionar firmemente el autoinyector cargado contra la piel - preferentemente en la cara externa del muslo o en la parte superior de la cara externa del brazo (músculo deltoides) -, de forma que la parte gris se deslice justo hasta la parte azul. Para inyectar, apretar el botón azul del autoinyector y mantenerlo así fijo durante cinco segundos por lo menos (o contar hasta diez).
7. Cuidadosamente retirar el autoinyector. Tenga cuidado pues se verá la aguja.
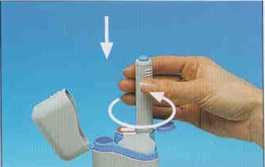
10 de 12
an
8. Inmediatamente devolver la jeringa utilizada colocándola en el cartucho, empujando el autoinyector hacia abajo en el interior del mismo hasta donde llegue. Luego, girar el autoinyector en el sentido contrario al de las agujas de reloj hasta que salga del cartucho.

9. Sacar el autoinyector del cartucho; luego, cerrar la tapa sobre la jeringa utilizada.
10. Devolver el autoinyector a su sitio en la petaca o estuche empujándolo hacia abajo. Escuchará un chasquido cuando el autoinyector esté bien colocado.
Se advertirá a los pacientes que sigan estrictamente las INSTRUCCIONES PARA LA CORRECTA ADMINISTRACIÓN DEL PREPARADO del prospecto, en especial en lo referente al modo de desechar de forma segura las jeringas y agujas utilizadas.
El manejo de agujas y jeringas puede ser peligroso y deben desecharse segura e higiénicamente.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline, S.A.
Parque Tecnológico de Madrid
C/ Severo Ochoa, 2
28760 Tres Cantos (Madrid).
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
IMIGRAN 6 mg inyectable N° de Registro 59.973
ílMt
ÍTTI
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
10. FECHA DE LA REVISIÓN DEL TEXTO
Marzo 2011.
12 de 12