Imbruvica 140Mg Capsulas Duras
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
IMBRUVICA 140 mg cápsulas duras.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene 140 mg de ibrutinib.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura (cápsula).
Cápsula dura de color blanco opaco, de 22 mm de longitud, marcada con “ibr 140 mg” en tinta negra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
IMBRUVICA en monoterapia está indicado para el tratamiento de pacientes adultos con linfoma de células del manto (LCM) en recaída o refractario.
IMBRUVICA en monoterapia está indicado para el tratamiento de pacientes adultos con leucemia linfática crónica (LLC) que no han sido previamente tratados (ver sección 5.1).
IMBRUVICA en monoterapia o en combinación con bendamustina y rituximab (BR) está indicado para el tratamiento de pacientes adultos con LLC que han recibido al menos un tratamiento previo
IMBRUVICA en monoterapia está indicado para el tratamiento de pacientes adultos con macroglobulinemia de Waldenstrom (MW) que han recibido al menos un tratamiento previo, o en tratamiento de primera línea en pacientes en los que la inmuno-quimioterapia no se considera apropiada.
4.2 Posología y forma de administración
El tratamiento con este medicamento debe ser iniciado y supervisado por un médico con experiencia en el uso de medicamentos anticancerígenos.
Posología
Linfoma de células del manto
La dosis recomendada para el tratamiento del LCM es de 560 mg (cuatro cápsulas) una vez al día.
Leucemia linfática crónica y macroglobulinemia de Waldenstrom
La dosis recomendada para el tratamiento de la LLC, tanto en monoterapia como en combinación, es de 420 mg (tres cápsulas) una vez al día (ver sección 5.1 para los detalles del tratamiento en combinación).
La dosis recomendada para el tratamiento de la MW es de 420 mg (tres cápsulas) una vez al día.
El tratamiento se debe continuar hasta la progresión de la enfermedad o hasta que deje de ser tolerado por el paciente.
Ajustes de la dosis
Los inhibidores moderados y potentes del CYP3A4 aumentan la exposición a ibrutinib (ver secciones 4.4 y 4.5).
La dosis de IMBRUVICA se debe reducir a 140 mg una vez al día (una cápsula) cuando se utilice conjuntamente con inhibidores moderados del CYP3A4.
La dosis de IMBRUVICA se debe reducir a 140 mg una vez al día (una cápsula) o interrumpir su administración hasta 7 días cuando se utilice conjuntamente con inhibidores potentes del CYP3A4.
El tratamiento con IMBRUVICA se debe interrumpir en el caso de que aparezca o empeore cualquier toxicidad no hematológica de grado > 3, neutropenia de grado 3 o mayor con infección o fiebre, o toxicidad hematológica de grado 4. Cuando hayan remitido los síntomas de toxicidad hasta grado 1 o hasta el grado basal (recuperación), se puede reanudar el tratamiento con IMBRUVICA a la dosis inicial. Si reaparece la toxicidad, la dosis diaria se debe reducir en una cápsula (140 mg). Se puede considerar una segunda reducción de la dosis en 140 mg si es necesario. Si estas toxicidades persisten o reaparecen después de dos reducciones de dosis, se debe suspender el tratamiento con este medicamento.
A continuación se recogen las modificaciones de la dosis recomendadas:
|
Episodio de toxicidad |
Modificación de la dosis para el LCM después de la recuperación |
Modificación de la dosis para la LLC/MW después de la recuperación |
|
Primero |
reanudar con 560 mg/día |
reanudar con 420 mg/día |
|
Segundo |
reanudar con 420 mg/día |
reanudar con 280 mg/día |
|
Tercero |
reanudar con 280 mg/día |
reanudar con 140 mg/día |
|
Cuarto |
suspender el tratamiento con IMBRUVICA |
suspender el tratamiento con IMBRUVICA |
Dosis omitidas
Si el paciente no toma una dosis a la hora prevista, podrá tomarla lo antes posible ese mismo día y volver al horario normal al día siguiente. El paciente no debe tomar cápsulas de más para compensar la dosis olvidada.
Poblaciones especiales
Pacientes de edad avanzada
No se requiere un ajuste de dosis específico en pacientes de edad avanzada (edad > 65 años).
Insuficiencia renal
No se han realizado estudios clínicos específicos en pacientes con insuficiencia renal. Algunos pacientes con insuficiencia renal leve o moderada recibieron tratamiento en estudios clínicos de IMBRUVICA. No es necesario ajustar la dosis en pacientes con insuficiencia renal leve o moderada (aclaramiento de creatinina mayor de 30 ml/min). Se debe mantener la hidratación y vigilar periódicamente las concentraciones séricas de creatinina. Se administrará IMBRUVICA a pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min) únicamente si el beneficio es mayor que el riesgo y se vigilará estrechamente a los pacientes por si presentaran signos de toxicidad. No se dispone de datos en pacientes con insuficiencia renal grave ni en pacientes en diálisis (ver sección 5.2).
Insuficiencia hepática
Ibrutinib se metaboliza en el hígado. En un ensayo realizado en pacientes con insuficiencia hepática, los datos mostraron un aumento de la exposición a ibrutinib (ver sección 5.2). En pacientes con insuficiencia hepática leve (clase A de Child-Pugh), la dosis recomendada es de 280 mg diarios (dos cápsulas). En pacientes con insuficiencia hepática moderada (clase B de Child-Pugh), la dosis recomendada es de 140 mg diarios (una cápsula). Se debe vigilar a los pacientes por si presentaran signos de toxicidad debida a IMBRUVICA y se deben seguir las recomendaciones para la modificación de la dosis cuando sea necesario. No se recomienda administrar IMBRUVICA a pacientes con insuficiencia hepática grave (clase C de Child-Pugh).
Cardiopatía grave
En los estudios clínicos de IMBRUVICA se excluyó a los pacientes con enfermedad cardiovascular grave.
Población pediátrica
No se ha establecido la seguridad y la eficacia de IMBRUVICA en niños de 0 a 18 años de edad. No se dispone de datos.
Forma de administración
IMBRUVICA se debe administrar por vía oral una vez al día con un vaso de agua, aproximadamente a la misma hora cada día. Las cápsulas se deben tragar enteras con agua y no se deben abrir, romper ni masticar. IMBRUVICA no se debe tomar con zumo de pomelo o naranjas amargas (ver sección 4.5).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
En los pacientes tratados con IMBRUVICA está contraindicado el uso de preparados que contengan la Hierba de San Juan o hipérico.
4.4 Advertencias y precauciones especiales de empleo
Acontecimientos hemorrágicos
Se han notificado acontecimientos hemorrágicos en pacientes tratados con IMBRUVICA, con y sin trombocitopenia. Estos incluyen acontecimientos hemorrágicos leves, como contusión, epistaxis y petequias, y acontecimientos hemorrágicos graves, algunos mortales, incluyendo hemorragia digestiva, hemorragia intracraneal, y hematuria.
Se excluyó de la participación en los estudios de fase II y III de IMBRUVICA a los pacientes que necesitaban warfarina u otros antagonistas de la vitamina K. No se debe administrar warfarina ni otros antagonistas de la vitamina K conjuntamente con IMBRUVICA. Se debe evitar el uso de suplementos como aceite de pescado y preparados de vitamina E. El uso de IMBRUVICA en pacientes que requieren otros anticoagulantes o medicamentos que inhiben la función de las plaquetas puede aumentar el riesgo de hemorragia y se debe tener especial precaución cuando se utilice un tratamiento anticoagulante. No se ha estudiado apacientes con diátesis hemorrágica congénita.
El tratamiento con IMBRUVICA se debe suspender al menos entre 3 y 7 días antes y después de una intervención quirúrgica, dependiendo del tipo de cirugía y del riesgo de hemorragia.
Leucostasis
Se han notificado casos de leucostasis en pacientes tratados con IMBRUVICA. Un número elevado de linfocitos circulantes (> 400.000/^l) puede aumentar el riesgo. Se debe considerar suspender temporalmente la administración de IMBRUVICA. Se debe vigilar estrechamente a los pacientes. Se debe administrar medidas de apoyo, incluyendo hidratación y/o citorreducción, según esté indicado.
Infecciones
En pacientes tratados con IMBRUVICA se han observado infecciones (incluyendo septicemia, septicemia neutropénica, infecciones bacterianas, víricas o fúngicas). Algunas de estas infecciones se han asociado con hospitalización y muerte. La mayor parte de los pacientes con infecciones mortales tenían también neutropenia. Se debe vigilar en los pacientes la aparición de fiebre, neutropenia e infecciones y se debe instaurar un tratamiento antiinfeccioso adecuado según esté indicado.
Citopenias
En pacientes tratados con IMBRUVICA se han notificado citopenias (neutropenia, trombocitopenia y anemia) de grado 3 ó 4 aparecidas durante el tratamiento. Se debe vigilar el hemograma completo una vez al mes.
Enfermedad pulmonar intersticial (EPI)
Se han notificado casos de EPI en pacientes tratados con IMBRUVICA. Se debe vigilar los síntomas respiratorios indicativos de EPI en los pacientes. Si se desarrollan síntomas, se debe interrumpir IMBRUVICA y manejar la EPI de forma adecuada. Si los síntomas persisten, se deben considerar los riesgos y beneficios del tratamiento con IMBRUVICA y se deben seguir las normas de modificación de la dosis.
Fibrilación auricular/flutter
Se ha notificado fibrilación auricular y flutter auricular en pacientes tratados con IMBRUVICA, especialmente en pacientes con factores de riesgo cardíaco, infecciones agudas y antecedentes de fibrilación auricular. Se vigilará clínicamente y de manera periódica a todos los pacientes por si presentaran fibrilación auricular. Los pacientes que presenten síntomas de arritmia o aparición reciente de disnea se deben someter a una evaluación clínica y si está indicado realizar un electrocardiograma (ECG).
En pacientes con fibrilación auricular preexistente que requieren terapia anticoagulante, se deben considerar opciones de tratamiento alternativas a IMBRUVICA. En pacientes que desarrollan fibrilación auricular durante el tratamiento con IMBRUVICA se debe realizar una evaluación exhaustiva del riesgo de enfermedad tromboembólica. En pacientes con alto riesgo y donde las alternativas a IMBRUVICA no son adecuadas, se debe considerar un tratamiento con anticoagulantes bajo control exhaustivo.
Síndrome de lisis tumoral
Se ha notificado síndrome de lisis tumoral con el tratamiento con IMBRUVICA. Los pacientes con riesgo de síndrome de lisis tumoral son aquellos con una carga tumoral alta antes del inicio del tratamiento. Se debe vigilar estrechamente a los pacientes y adoptar las precauciones adecuadas.
Cáncer de piel distinto del melanoma
Se notificaron de forma más frecuente cánceres de piel distinto del melanoma en los pacientes tratados con IMBRUVICA que en los pacientes tratados con comparadores en los estudios de fase III comparativos aleatorizados. Se debe monitorizar a los pacientes por la aparición de cáncer de piel distinto del melanoma.
Efectos sobre el intervalo QT
En un estudio de fase II, las evaluaciones del ECG mostraron que IMBRUVICA producía una ligera disminución del intervalo QTcF (media de 7,5 ms). Aunque no se conocen el mecanismo subyacente ni la relevancia de este hallazgo para la seguridad, los médicos deben usar su criterio clínico cuando evalúen la posibilidad de prescribir ibrutinib a pacientes con riesgo de un acortamiento adicional del intervalo QTc (p. ej., síndrome congénito del QT corto o pacientes con antecedentes familiares de ese síndrome).
Interacción con otros medicamentos
La administración conjunta de inhibidores potentes o moderados del CYP3A4 con IMBRUVICA puede aumentar la exposición a ibrutinib y en consecuencia, aumentar el riesgo de toxicidad. Por el contrario, la administración conjunta de inductores del CYP3A4 puede reducir la exposición a IMBRUVICA y en consecuencia, producir un riesgo de falta de eficacia. Por tanto, en la medida de lo posible, se debe evitar el uso concomitante de IMBRUVICA con inhibidores/inductores potentes o moderados del CYP3A4 y se debe considerar su administración conjunta únicamente cuando los posibles beneficios sean mayores que los riesgos potenciales. En el caso de que se tenga que utilizar un inhibidor del CYP3A4, se debe vigilar estrechamente a los pacientes por si presentaran signos de toxicidad debidos a IMBRUVICA (ver secciones 4.2 y 4.5). En el caso de que se tenga que utilizar un inductor del CYP3A4, se debe vigilar estrechamente al paciente por si presentara signos de falta de eficacia con IMBRUVICA.
Mujeres en edad fértil
Las mujeres en edad fértil deben utilizar un método anticonceptivo muy efectivo durante el tratamiento con IMBRUVICA (ver sección 4.6).
4.5 Interacción con otros medicamentos y otras formas de interacción
Ibrutinib se metaboliza principalmente por el enzima citocromo P450 3A4 (CYP3A4).
Sustancias que pueden aumentar las concentraciones plasmáticas de ibrutinib
Se debe evitar el uso concomitante de IMBRUVICA y medicamentos que son inhibidores potentes o
moderados del CYP3A4 ya que puede aumentar la exposición a ibrutinib.
Inhibidores potentes del CYP3A4
La administración concomitante de ketoconazol, un inhibidor potente del CYP3A4, a 18 voluntarios sanos, en ayunas, aumentó la exposición (Cmax y AUC) a ibrutinib 29 y 24 veces, respectivamente. Las simulaciones realizadas en condiciones de ayuno indicaron que la claritromicina, un inhibidor potente del CYP3A4, puede aumentar por un factor de 14 el AUC de ibrutinib. Se deben evitar los inhibidores potentes del CYP3A4 (p. ej., ketoconazol, indinavir, nelfinavir, ritonavir, saquinavir, claritromicina, telitromicina, itraconazol, nefazodona y cobicistat). Si el beneficio es mayor que el riesgo y se tiene que usar un inhibidor potente del CYP3A4, se debe reducir la dosis de IMBRUVICA a 140 mg (una cápsula) o interrumpir temporalmente el tratamiento (durante 7 días o menos). Se debe vigilar estrechamente al paciente por si presentara toxicidad y se deben seguir las normas de modificación de la dosis según sea necesario (ver secciones 4.2 y 4.4).
Inhibidores moderados del CYP3A4
Las simulaciones realizadas en condiciones de ayuno sugieren que los inhibidores moderados del CYP3A4, diltiazem, eritromicina y voriconazol, pueden aumentar el AUC de ibrutinib entre 5 y 9 veces. Se deben evitar los inhibidores moderados (p. ej., voriconazol, eritromicina, amprenavir, aprepitant, atazanavir, ciprofloxacino, crizotinib, darunavir/ritonavir, diltiazem, fluconazol, fosamprenavir, imatinib, verapamilo, amiodarona, dronedarona). Si se tiene que usar un inhibidor moderado del CYP3A4, se debe reducir el tratamiento con IMBRUVICA a 140 mg (una cápsula) durante el tiempo que se use el inhibidor. Se debe vigilar estrechamente al paciente por si presentara toxicidad y se deben seguir las normas de modificación de la dosis según sea necesario (ver secciones 4.2 y 4.4).
Inhibidores leves del CYP3A4
Las simulaciones realizadas en condiciones clínicamente relevantes de ayuno sugieren que los inhibidores leves del CYP3A4, azitromicina y fluvoxamina, pueden aumentar en <2 veces el AUC de ibrutinib. No es necesario ajustar la dosis en combinación con inhibidores leves. Se debe vigilar estrechamente al paciente por si presentara toxicidad y se deben seguir las normas de modificación de la dosis según sea necesario.
La administración conjunta de zumo de pomelo, que contiene inhibidores del CYP3A4, en ocho sujetos sanos, aumentó la exposición (Cmax y AUC) a ibrutinib en aproximadamente 4 y 2 veces, respectivamente. Se debe evitar el pomelo y las naranjas amargas durante el tratamiento con IMBRUVICA, ya que contienen inhibidores moderados del CYP3A4 (ver sección 4.2).
Sustancias que pueden reducir las concentraciones plasmáticas de ibrutinib
La administración de IMBRUVICA con inductores del CYP3A4 puede reducir las concentraciones plasmáticas de ibutrinib.
La administración conjunta de rifampicina, un inductor potente del CYP3A4, en 18 sujetos sanos en ayunas, redujo la exposición (Cmax y AUC) a ibrutinib en un 92% y un 90%, respectivamente. Se debe evitar el uso concomitante de inductores potentes o moderados del CYP3A4 (p. ej., carbamazepina, rifampicina, fenitoína). Los preparados que contienen Hierba de San Juan o hipérico están contraindicados durante el tratamiento con IMBRUVICA, ya que pueden reducir su eficacia. Se debe considerar el uso de otras alternativas terapéuticas con menor capacidad de inducción del CYP3A4. Si el beneficio es mayor que el riesgo y se tiene que usar un inductor potente o moderado del CYP3A4, se debe vigilar estrechamente al paciente por si presenta falta de eficacia (ver secciones 4.3 y 4.4). Se pueden usar inductores leves concomitantemente con IMBRUVICA, sin embargo, se deben vigilar a los pacientes ante una potencial falta de eficacia.
Como la solubilidad de ibrutinib es dependiente del pH, hay un riesgo teórico de que los medicamentos que aumentan el pH gástrico (p. ej., inhibidores de la bomba de protones) puedan disminuir la exposición a ibrutinib. Esta interacción no se ha estudiado in vivo.
Sustancias cuyas concentraciones plasmáticas se pueden ver afectadas por ibrutinib Ibrutinib es un inhibidor in vitro de la P-gp y de la proteína de resistencia de cáncer de mama (BCRP). Como no se dispone de datos clínicos sobre esta interacción, no se puede excluir que ibrutinib inhiba a la P-gp intestinal y a la BCRP después de una dosis terapéutica. Para minimizar la posibilidad de una interacción en el tracto gastrointestinal, los sustratos de la P-gp o de la BCRP con un margen terapéutico oral estrecho, como la digoxina o el metotrexato, se deben tomar al menos 6 horas antes o después de IMBRUVICA. Ibrutinib puede también inhibir a la BCRP en el hígado y aumentar la exposición a medicamentos que experimentan un flujo hepático mediado por la BCRP, como la rosuvastatina.
En base a los datos in vitro, ibrutinib es un inhibidor débil reversible del CYP3A4 a nivel intestinal y por tanto puede aumentar la exposición a los sustratos de CYP3A4 sensibles al metabolismo intestinal del CYP3A. No se dispone de datos clínicos sobre esta interacción. Se debe tener precaución si se administra ibrutinib de forma conjunta con sustratos del CYP3A4 administrados por vía oral de estrecho margen terapéutico (como la dihidroergotamina, ergotamina, fentanilo, ciclosporina, sirolimus y tacrolimus).
En base a los datos in vitro, ibrutinib es un inductor débil del CYP2B6 y puede tener el potencial de afectar a la expresión de otras enzimas y transportadores regulados por la vía del receptor constitutivo de androstano (CAR), p. ej. CYP2C9, CYP2C19, UGT1A1 y MRP2. Se desconoce la relevancia clínica, pero la exposición a sustratos del CYP2B6 (como efavirenz y bupropion) y de las enzimas co-reguladas puede reducirse después de la administración conjunta con ibrutinib.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil/Anticoncepción en mujeres
Teniendo en cuenta los hallazgos en estudios con animales, IMBRUVICA puede tener efectos perjudiciales para el feto cuando se administra a una mujer embarazada. Las mujeres no se deben quedar embarazadas mientras estén tomando IMBRUVICA y hasta 3 meses después de finalizar el tratamiento. Por tanto, las mujeres en edad fértil deben utilizar métodos anticonceptivos muy efectivos durante y hasta tres meses después de finalizar el tratamiento con IMBRUVICA. Actualmente se desconoce si ibrutinib puede reducir la eficacia de los anticonceptivos hormonales, y por lo tanto, las mujeres que utilicen anticonceptivos hormonales deben añadir un método de barrera.
Embarazo
No debe utilizarse IMBRUVICA durante el embarazo. No hay datos relativos al uso de IMBRUVICA en mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3).
Lactancia
Se desconoce si ibrutinib o sus metabolitos se excretan en la leche materna. No se puede excluir el riesgo en recién nacidos/lactantes. Debe interrumpirse la lactancia durante el tratamiento con IMBRUVICA.
Fertilidad
No se observaron efectos sobre la fertilidad o capacidad reproductiva en ratas macho o hembra hasta la máxima dosis utilizada, 100 mg/kg/día (Dosis Humana Equivalente [DHE]16 mg/kg/día (ver sección 5.3). No hay datos disponibles en humanos de los efectos de ibrutinib sobre la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se ha notificado fatiga, mareo y astenia en algunos pacientes que estaban tomando IMBRUVICA y esto se debe tener en cuenta al evaluar la capacidad de un paciente para conducir o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
El perfil de seguridad se basa en los datos conjuntos de 981 pacientes tratados con IMBRUVICA en tres estudios clínicos fase II y cuatro estudios aleatorizados fase III y durante la experiencia poscomercialización. Los pacientes tratados para el LCM en los ensayos clínicos recibieron 560 mg de IMBRUVICA una vez al día y los pacientes tratados para la LLC o MW en los ensayos clínicos recibieron 420 mg de IMBRUVICA una vez al día. Todos los pacientes en los ensayos clínicos recibieron IMBRUVICA hasta progresión de la enfermedad o hasta que dejaron de tolerarlo.
Las reacciones adversas observadas con más frecuencia (> 20%) fueron diarrea, neutropenia, hemorragia (p.ej., hematomas), dolor musculoesquelético, náuseas, exantema, y pirexia. Las reacciones adversas más frecuentes de grado 3/4 (> 5%) fueron neutropenia, neumonía, trombocitopenia y neutropenia febril.
Tabla de reacciones adversas
A continuación se enumeran las reacciones adversas en pacientes con neoplasias malignas de células B tratados con ibrutiniby las reacciones adversas durante la poscomercialización agrupadas según el sistema de clasificación de órganos y por frecuencia. Las frecuencias se definen de la siguiente forma: muy frecuentes (> 1/10); frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1000 a < 1/100), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 1: Reacciones adversas al medicamento notificadas en los ensayos clínicos o durante
el periodo de vigilancia poscomercialización en los pacientes con neoplasias malignas de célula B'_
|
Sistema de clasificación de órganos |
Frecuencia (Todos los grados) |
Reacciones adversas |
Todos los Grados (%) |
Grado > 3 (%) |
|
Infecciones e |
Muy |
Neumonía*# |
16 |
10 |
|
infestaciones |
frecuentes |
Infección de las vías |
19 |
1 |
|
respiratorias altas | ||||
|
Sinusitis* |
11 |
1 | ||
|
Infección cutánea* |
10 |
3 | ||
|
Frecuentes |
Septicemia*# |
4 |
4 | |
|
Infección de las vías |
9 |
2 | ||
|
urinarias | ||||
|
Neoplasias benignas y |
Frecuentes |
Cáncer de piel distinto del |
6 |
1 |
|
malignas (incl quistes y |
melanoma* | |||
|
pólipos) |
Carcinoma de células |
3 |
< 1 | |
|
basales | ||||
|
Carcinoma espinocelular |
2 |
< 1 |
|
Trastornos de la sangre y |
Muy |
Neutropenia |
30 |
26 |
|
del sistema linfático |
frecuentes |
Trombocitopenia |
20 |
10 |
|
Frecuentes |
Neutropenia febril |
5 |
5 | |
|
Leucocitosis |
2 |
1 | ||
|
Linfocitosis |
2 |
1 | ||
|
Poco |
Síndrome de Leucostasis |
< 1 |
< 1 | |
|
frecuentes | ||||
|
Trastornos del sistema |
Frecuentes |
Enfermedad pulmonar |
2 |
< 1 |
|
inmunológico |
intersticial*’#’3 | |||
|
Trastornos del |
Frecuentes |
Síndrome de lisis tumoral |
1 |
1 |
|
metabolismo y de la |
Hiperuricemia |
7 |
2 | |
|
nutrición | ||||
|
Trastornos del sistema |
Muy |
Cefalea |
13 |
1 |
|
nervioso |
frecuentes | |||
|
Frecuentes |
Mareo |
9 |
0 | |
|
Trastornos oculares |
Frecuentes |
Visión borrosa |
7 |
0 |
|
Trastornos cardíacos |
Frecuentes |
Fibrilación auricular |
6 |
3 |
|
Trastornos vasculares |
Muy |
Hemorragia*# |
30 |
1 |
|
frecuentes |
Hematomas* |
22 |
< 1 | |
|
Frecuentes |
Hematoma subdural# |
1 |
1 | |
|
Epistaxis |
8 |
< 1 | ||
|
Petequias |
7 |
0 | ||
|
Hipertensión* |
10 |
4 | ||
|
Trastornos |
Muy |
Diarrea |
41 |
3 |
|
gastrointestinales |
frecuentes |
Vómitos |
14 |
<1 |
|
Estomatitis* |
13 |
1 | ||
|
Náuseas |
27 |
1 | ||
|
Estreñimiento |
16 |
< 1 | ||
|
Trastornos hepatobiliares |
No conocida |
Insuficiencia hepática,a |
No |
No |
|
conocida |
conocida | |||
|
Trastornos de la piel y el |
Muy |
Exantema* |
22 |
2 |
|
tejido subcutáneo |
frecuentes | |||
|
Frecuentes |
Urticaria |
1 |
< 1 | |
|
Eritema |
2 |
0 | ||
|
Poco |
Angiodema |
< 1 |
< 1 | |
|
frecuentes | ||||
|
Trastornos |
Muy |
Artralgia |
12 |
1 |
|
musculoesqueléticos y del |
frecuentes |
Espasmos musculares |
14 |
< 1 |
|
tejido conjuntivo |
Dolor musculoesquelético* |
28 |
3 | |
|
Trastornos generales y |
Muy |
Pirexia |
20 |
2 |
|
alteraciones en el lugar de |
frecuentes |
Edema periférico |
14 |
1 |
|
administración |
^ Las frecuencias se redondean al entero más cercano.
* Incluye términos múltiples de reacciones adversas al medicamento.
Incluye acontecimientos con desenlace mortal. a Notificaciones espontáneas procedentes de la experiencia poscomercialización.
Interrupción y reducción de la dosis debido a reacciones adversas al medicamento El 5% de los 981 pacientes tratados con IMBRUVICA para neoplasias malignas de células B suspendieron el tratamiento principalmente debido a reacciones adversas. Éstas incluyeron neumonía, fibrilación auricular y hemorragia. En aproximadamente el 5% de los pacientes se produjeron reacciones adversas que obligaron a reducir la dosis.
Pacientes de edad avanzada
El 62% de los 981 pacientes tratados con IMBRUVICA eran de 65 años o mayores. Las reacciones adversas de neumonía Grado 3 o mayor se presentaron con más frecuencia en los pacientes de edad avanzada tratados con IMBRUVICA (el 13% de los pacientes de > 65 años frente al 7% de los pacientes < 65 años de edad).
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Apéndice V.
4.9 Sobredosis
Se dispone de datos limitados sobre los efectos de la sobredosis con IMBRUVICA. En el estudio de fase I en el que los pacientes recibieron hasta 12,5 mg/kg/día (1.400 mg/día) no se alcanzó la dosis máxima tolerada. En un estudio independiente, una persona sana que recibió una dosis de 1.680 mg experimentó elevación reversible de las enzimas hepáticas de grado 4 [aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT)]. No existe ningún antídoto específico para IMBRUVICA. Los pacientes que ingieran una dosis superior a la recomendada se deben vigilar estrechamente y recibir tratamiento de soporte adecuado.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antineoplásicos, inhibidores directos de la protein-quinasa, código ATC: L01XE27.
Mecanismo de acción
Ibrutinib es una molécula pequeña que actúa como un potente inhibidor de la tirosina quinasa de Bruton (BTK). Ibrutinib forma un enlace covalente con un residuo de cisteína (Cys-481) situado en el lugar activo de la BTK, lo que produce la inhibición sostenida de la actividad enzimática de la BTK. La BTK, un miembro de la familia de quinasas Tec, es una importante molécula de señalización de las vías del receptor de antígenos del linfocito B (BCR) y de las vías del receptor de citoquinas. La vía del BCR está implicada en la patogenia de varias neoplasias malignas de los linfocitos B, incluido el LCM, el linfoma difuso de células B grandes (LDCBG), el linfoma folicular y la LLC. El papel fundamental de la BTK en la transmisión de señales a través de los receptores de superficie de los linfocitos B resulta en la activación de las vías que son necesarias para el tráfico, la quimiotaxis y la adhesión de los linfocitos B. Los estudios preclínicos han demostrado que ibrutinib es un inhibidor eficaz de la proliferación y la supervivencia de los linfocitos B neoplásicos in vivo, así como de la migración celular y la adhesión a sustratos in vitro.
Linfocitosis
Después de iniciar el tratamiento, se ha observado en casi tres cuartos de los pacientes con LLC tratados con IMBRUVICA un aumento reversible del recuento de linfocitos (es decir, aumento > 50% con respecto al valor basal y recuento absoluto > 5.000/^l), a menudo asociado a una disminución de la linfadenopatía. Este efecto se ha observado también en casi un tercio de los pacientes con LCM en recaída o refractario tratados con IMBRUVICA. Esta linfocitosis es un efecto farmacodinámico y no se debe considerar como progresión de la enfermedad en ausencia de otros hallazgos clínicos. En ambos tipos de enfermedad, la linfocitosis aparece típicamente durante el primer mes del tratamiento con IMBRUVICA y generalmente remite en una mediana de 8,0 semanas en pacientes con LCM y 14 semanas en pacientes con LLC. En algunos pacientes se ha observado un aumento importante del número de linfocitos en circulación (p. ej., > 400.000/^l).
No se observó linfocitosis en pacientes con MW tratados con IMBRUVICA.
Eficacia clínica y seguridad
Linfoma de células del manto
La seguridad y la eficacia de IMBRUVICA en pacientes con LCM en recaída o refractario se evaluó en un único estudio abierto y multicéntrico de fase II (PCYC-1104-CA) realizado en 111 pacientes. La mediana de la edad era de 68 años (intervalo: de 40 a 84 años), el 77% eran varones y el 92% caucásicos. Se excluyó del estudio a los pacientes con un estado funcional del Eastern Cooperative Oncology Group (ECOG) igual o mayor que 3. La mediana del tiempo transcurrido desde el diagnóstico fue de 42 meses, y la mediana del número de tratamientos previos fue de 3 (intervalo: de 1 a 5 tratamientos), incluyendo quimioterapia previa a altas dosis en el 35%, bortezomib previo en el 43%, lenalidomida previa en el 24% y trasplante autólogo o alogénico de células madre previo en el 11%. En el momento basal, el 39% de los pacientes presentaban enfermedad voluminosa (> 5 cm), el 49% tenía una puntuación de alto riesgo según el índice internacional de pronóstico en el LCM simplificado (MIPI) y el 72% presentaba enfermedad avanzada (afectación extraganglionar y/o de la médula ósea) en la selección.
IMBRUVICA se administró por vía oral a dosis de 560 mg una vez al día hasta progresión de la enfermedad o toxicidad inaceptable. La respuesta tumoral se evaluó de acuerdo a los criterios revisados del Grupo de trabajo internacional (IWG) para el linfoma no hodgkin (LNH). El criterio de valoración principal en este estudio fue la tasa de respuesta global (TRG) evaluada por el investigador. Las respuestas a IMBRUVICA se muestran en la Tabla 2.
Tabla 2: Tasa de respuesta global (TRG) y duración de la respuesta (DR) en pacientes con
LCM en recaída o refractario (Estudio PCYC-1104-CA)
|
Total N = 111 | |
|
TRG (%) |
67,6 |
|
IC del 95% |
(58,0; 76,1) |
|
RC (%) |
20,7 |
|
RP (%) |
46,8 |
|
Mediana de la DR (RC+RP) (meses) |
17,5 (15,8; NA) |
|
Mediana del tiempo hasta la respuesta inicial, meses (intervalo) |
1,9(1,4-13,7) |
|
Mediana del tiempo hasta RC, meses (intervalo) |
5,5 (1,7-11,5) |
IC = intervalo de confianza; RC = respuesta completa; RP = respuesta parcial; NA = no alcanzado
Los datos de eficacia fueron también evaluados por un Comité de Revisión Independiente (CRI), demostrándose una TRG del 69%, con una tasa de respuesta completa (RC) del 21% y una tasa de respuesta parcial (RP) del 48%. El CRI estimó la mediana de la DR en 19,6 meses.
La respuesta global a IMBRUVICA fue independiente del tratamiento previo recibido, incluido bortezomib y lenalidomida, y también fue independiente de los factores de riesgo/pronóstico subyacentes, la presencia de enfermedad voluminosa, el género o la edad.
La eficacia y seguridad de IMBRUVICA se demostró en un estudio aleatorizado, abierto, multicéntrico de fase III, que incluía 280 pacientes con LCM que habían recibido al menos un tratamiento previo (Estudio MCL3001). Los pacientes fueron aleatorizados 1:1 para recibir 560 mg diarios vía oral durante 21 días de IMBRUVICA o 175 mg vía intravenosa de temsirolimus los Días 1, 8, 15 del primer ciclo seguido de 75 mg los Días 1, 8, 15 de cada ciclo de 21 días posterior. El tratamiento en ambos brazos continuó hasta progresión de la enfermedad o toxicidad inaceptable. La mediana de edad era de 68 años (intervalo, de 34 a 88), el 74% eran varones y el 87% caucásicos. La mediana del tiempo desde el diagnóstico era 43 meses, y la mediana del número de tratamientos previos era 2 (intervalo: de 1 a 9 tratamientos), incluyendo quimioterapia previa a altas dosis en el 51%, bortezomib previo en el 18%, lenalidomida previa en el 5% y trasplante de células madre previo en el 24%.En el momento basal, el 53% de los pacientes presentaban enfermedad voluminosa (> 5 cm), el 21% tenía una puntuación de alto riesgo según el MIPI simplificado, el 60% presentaba enfermedad extraganglionar y el 54% presentaba afectación de la médula ósea en la selección (screening).
La supervivencia libre de progresión (SLP) fue evaluada por el CRI aplicando los criterios revisados del Grupo de trabajo internacional (IWG) para el linfoma no hodgkin (LNH). Los resultados de eficacia del Estudio MCL3001 se muestran en la Tabla 3 y la curva de Kaplan-Meier para la SLP en la Figura 1.
Tabla 3: Resultados de eficacia en pacientes con LCM en recaída o refractario (Estudio
MCL3001)
|
Criterios de valoración |
IMBRUVICA N = 139 |
Temsirolimus N = 141 |
|
Supervivencia Libre de Progresión3 | ||
|
Mediana de Supervivencia Libre de Progresión (IC del 95%), (meses) |
14,6 (10,4; NE) |
6,2 (4,2, 7,9) |
|
HR = 0,43 [IC del 95%: 0,32; 0,58] | ||
|
Tasa de respuesta Global (%) |
71,9 40,4 | |
|
Valor p |
p< 0,0001 | |
Evaluado por CRI
Una proporción menor de pacientes tratados con ibrutinib experimentaron un empeoramiento clínicamente significativo de los síntomas del linfoma frente a temsirolimus (27% frente a 52%) y el tiempo hasta el empeoramiento de los síntomas ocurrió de forma más lenta con ibrutinib frente a temsirolimus (HR 0,27, p < 0,0001)
Figura 1: Curva de Kaplan-Meier para la supervivencia libre de progresión (población ITT) en el Estudio MCL3001
100-
30
40
20
4-
-e®olmbruv¡ca
p<0.0001
Temsiro hmus
12 15
Meses
Pacientes en nesgo
mbruvica
Temsiroimus
Imbruvica —A
Temsiro hmus
Leucemia linfática crónica
Pacientes sin tratamiento previo de LLC
Se realizó un estudio aleatorizado, multicéntrico, abierto fase III (PCYC-1115-CA) de IMBRUVICA frente a clorambucilo en pacientes con LLC no tratados previamente de 65 años o mayores. Se requería que los pacientes entre 65 y 70 años tuvieran al menos una comorbilidad que excluyera el uso en primera línea de inmuno-quimioterapia con fludarabina, ciclofosmamida, y rituximab.
Los pacientes (n = 269) fueron aleatorizados 1:1 para recibir 420 mg diarios de IMBRUVICA cada uno hasta progresión de la enfermedad o toxicidad inaceptable, o clorambucilo a la dosis inicial de 0,5 mg/kg los días 1 y 15 de cada ciclo de 28 días durante un máximo de 12 ciclos, con la posibilidad de incrementos de dosis intrapaciente de hasta 0,8 mg/kg en función de la tolerabilidad. Después de la confirmación de progresión de la enfermedad, a los pacientes con clorambucilo se les permitió cambiar a ibrutinib.
La mediana de edad era de 73 años (intervalo de 65 a 90 años), el 63% eran varones, y el 91% caucásicos. El 91% de los pacientes presentaban un estado funcional basal del ECOG de 0 ó 1 y el 9% presentaban un estado funcional basal del ECOG de 2. El estudio incluyó a 269 pacientes con LLC. En el momento basal, el 45% presentaban un estadio clínico avanzado (Estadio III o IV de Rai), el 35% de los pacientes presentaban al menos un tumor > 5 cm, el 39% con anemia en el momento basal, el 23% con trombocitopenia en el momento basal, el 65% presentaba elevación de la microglobulina P2 > 3500 mcg/L, el 47% presentaba ClCr < 60 ml/min y el 20% de los pacientes presentaba del11q.
La supervivencia libre de progresión (SLP) evaluada por el CRI aplicando los criterios del Grupo de trabajo internacional para el LLC (IWCLL) indicó un 84% de reducción estadísticamente significativa del riesgo de muerte o progresión en el brazo de IMBRUVICA. En la Tabla 4 se muestran los resultados de eficacia obtenidos en el Estudio PCYC-1115-CA y en las Figuras 2 y 3 se muestran las curvas de Kaplan-Meier para la SLP y SG, respectivamente.
Hubo una mejora sostenida de plaquetas o hemoglobina estadísticamente significativa en la población por intención de tratar (ITT) a favor de ibrutinib frente a clorambucilo. En los pacientes con citopenias en el momento basal, la mejora hematológica sostenida fue: plaquetas 77,1% frente a 42,9%; hemoblogina 84,3% frente al 45,5% para ibrutinib y clorambucilo respectivamente.
Tabla 4: Resultados de eficacia en el Estudio PCYC-1115-CA
|
Criterio de valoración |
IMBRUVICA N = 136 |
Clorambucilo N = 133 |
|
Supervivencia libre de progresión3 | ||
|
Número de eventos (%) |
15 (11,0) |
64 (48,1) |
|
Mediana (IC del 95%), meses |
No alcanzada |
18,9 (14.1, 22.0) |
|
HRb (IC del 95%) |
0,161 (0,091; 0,283) | |
|
Tasa de respuesta globala (RC +RP) |
82,4% |
35,3% |
|
Valor p |
<0,0001 | |
|
Supervivencia Globalc | ||
|
Número de muertes (%) |
3 (2,2) |
17 (12,8) |
|
HR (IC del 95%) |
0,163 (0,048; 0,558) | |
a
b
Evaluado por CRI, mediana de seguimiento de 18,4 meses; HR = hazard ratio;
c
Mediana de SG no alcanzada en ninguno de los brazos. p < 0,005 para SG.
Curva de Kaplan-Meier para la supervivencia libre de progresión (población ITT) en el Estudio PCYC-1115-CA
Figura 2:
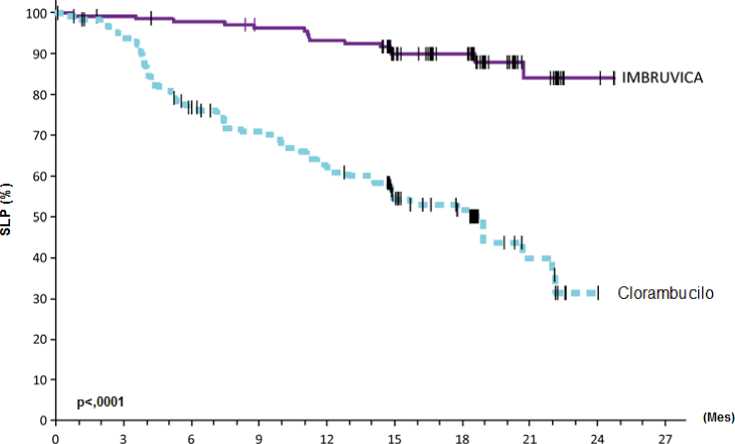
IMBRUVICA: 136 133 130 126 122 98 66 21 2 0
Clorambucilo: 133 121 95 85 74 49 34 10 0 0
N de pacientes en Riesgo
Figura 3: Curva de Kaplan-Meier para la supervivencia global (población ITT) en el Estudio PCYC-1115-CA
"|B- HH
hH! IMBRUVICA
II Clorambucilo
p=0,001Ü
|
OH-r- |
“i-1-1- |
-1-1-r— |
“i-1-r— |
“i-1-r— |
“I-1-r- |
—I-T" | ||||
|
0 |
3 |
6 |
9 |
12 |
15 |
18 |
21 |
24 |
27 | |
|
N de pacientes en Riesgo | ||||||||||
|
IMBRUVICA: |
136 |
134 |
131 |
131 |
131 |
128 |
74 |
32 |
4 |
0 |
|
Clorambucilo: |
133 |
127 |
125 |
121 |
118 |
113 |
62 |
24 |
1 |
0 |
(Mes}
Pacientes con LLC que han recibido al menos un tratamiento previo
La seguridad y eficacia de IMBRUVICA en pacientes con LLC se demostró en un estudio no controlado y en un estudio aleatorizado y controlado. El estudio multicéntrico abierto (PCYC-1102-CA) se realizó en 51 pacientes con LLC en recaída o refractario, que recibieron 420 mg una vez al día. IMBRUVICA se administró hasta progresión de la enfermedad o toxicidad inaceptable. La mediana de la edad fue de 68 años (intervalo: de 37 a 82 años), la mediana del tiempo transcurrido desde el diagnóstico fue de 80 meses y la mediana del número de tratamientos previos fue de 4 (intervalo: de 1 a 12 tratamientos), incluyendo un análogo de nucleósidos previo en el 92,2%, rituximab previo en el 98,0%, un alquilante previo en el 86,3%, bendamustina previa en el 39,2% y ofatumumab previo en el 19,6%. En el momento basal, el 39,2% de los pacientes se encontraban en el estadio IV de Rai, el 45,1% presentaba enfermedad voluminosa (> 5 cm), el 35,3% presentaba deleción del 17p y el 31,4% deleción del 11q.
La TRG fue evaluada por los investigadores y por el CRI aplicando los criterios del 2008 del IWCLL. Con una mediana de duración del tratamiento de 16,4 meses, la TRG evaluada por el CRI para los 51 pacientes en recaída o refractarios fue del 64,7% (IC del 95%: 50,1%; 77,6%), todas RP. La TRG, incluida la RP con linfocitosis fue del 70,6%. La mediana del tiempo hasta la respuesta fue de
1,9 meses. La DR varió entre 3,9 y 24,2+ meses. No se alcanzó la mediana de la DR.
Se realizó un estudio multicéntrico de fase III, aleatorizado y abierto en el que se comparó IMBRUVICA con ofatumumab (PCYC-1112-CA) en pacientes con LLC en recaída o refractario. Los pacientes (n = 391) fueron aleatorizados en una proporción de 1:1 para recibir 420 mg diarios de IMBRUVICA hasta progresión de la enfermedad o toxicidad inaceptable, o hasta 12 dosis de ofatumumab (300/2.000 mg). 57 pacientes aleatorizados a ofatumumab cambiaron de grupo de tratamiento para recibir IMBRUVICA tras presentar progresión de la enfermedad. La mediana de la edad era de 67 años (intervalo: de 30 a 88 años), el 68% eran varones y el 90% caucásicos. Todos los pacientes presentaban un estado funcional basal del ECOG de 0 ó 1. La mediana del tiempo desde el diagnóstico era de 91 meses y la mediana del número de tratamientos previos era 2 (intervalo: de 1a 13 tratamientos). En el momento basal, el 58% de los pacientes presentaban al menos un tumor > 5 cm. El 32% de los pacientes tenían una deleción del 17p y el 31% una deleción del 11q.
La supervivencia libre de progresión (SLP) evaluada por un CRI conforme a los criterios del IWCLL indicó una reducción estadísticamente significativa del 78% en el riesgo de mortalidad o progresión para los pacientes del grupo de IMBRUVICA. El análisis de la supervivencia global (SG) demostró una reducción estadísticamente significativa del 57% en el riesgo de mortalidad para los pacientes del grupo de IMBRUVICA. En la Tabla 5 se muestran los resultados de eficacia obtenidos en el Estudio PCYC-1112-CA.
Tabla 5: Resultados de eficacia en pacientes con leucemia linfocítica crónica (Estudio _PCYC-1112-CA)_
|
Criterio de valoración |
IMBRUVICA N = 195 |
Ofatumumab N = 196 |
|
Mediana de supervivencia libre de progresión |
No alcanzada |
8,1 meses |
|
HR= 0,215 [IC 95%: 0,146; 0,3171 | ||
|
Supervivencia global3 |
HR = 0,434 [IC 95%: 0,238; 0,789]b HR = 0,387 [IC 95%: 0,216; 0,6951c | |
|
Tasa de respuesta global4 e (%) |
42,6 |
4,1 |
|
Tasa de respuesta global, incluyendo RP con linfocitosisd (%) |
62,6 |
4,1 |
a
b
c
Mediana de la SG no alcanzada en ninguno de los grupos. p < 0,005 para SG.
Los pacientes aleatorizados a ofatumumab fueron censurados al iniciar el tratamiento con IMBRUVICA.
Análisis de sensibilidad en el que los pacientes que cambiaron del grupo de ofatumumab no fueron censurados en la fecha de la primera dosis de IMBRUVICA.
Conforme al CRI. Fue necesario repetir las TC para confirmar la respuesta.
Todas las respuestas alcanzadas fueron RP; p < 0,0001 para la TRG.
d
e
La eficacia fue similar en todos los subgrupos examinados, incluso en pacientes con y sin deleción de 17p, un factor de estratificación predefinido (Tabla 6).
Tabla 6: Análisis de subgrupos de la supervivencia libre de progresión (Estudio
PCYC-1112-CA)
|
N |
Razón de riesgo |
IC del 95% | |
|
Todos los individuos |
391 |
0,210 |
(0,143; 0,308) |
|
Del17P | |||
|
Sí |
127 |
0,247 |
(0,136; 0,450) |
|
No |
264 |
0,194 |
(0,117; 0,323) |
|
Enfermedad refractaria a análogo de purina Sí |
175 |
0,178 |
(0,100; 0,320) |
|
No |
216 |
0,242 |
(0,145; 0,404) |
|
Edad <65 |
152 |
0,166 |
(0,088; 0,315) |
|
>65 |
239 |
0,243 |
(0,149; 0,395) |
|
Número de líneas previas <3 |
198 |
0,189 |
(0,100; 0,358) |
|
>3 |
193 |
0,212 |
(0,130; 0,344) |
|
Enfermedad voluminosa < 5 cm |
163 |
0,237 |
(0,127; 0,442) |
|
> 5 cm |
225 |
0,191 |
(0,117; 0,311) |
Razón de riesgo basado en el análisis no estratificado
En la figura 4 se muestra la curva de Kaplan-Meier para la SLP.
Figura 4: Curva de Kaplan-Meier para la supervivencia libre de progresión (población por intención de tratar) en el estudio PCYC-1112-CA
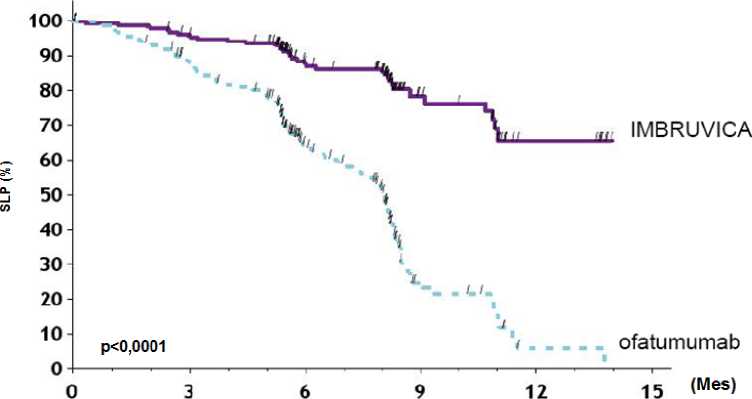
IMBRUVICA: 195 18? 116 38 7 O
Ofatumumab: 196 161 83 15 1 0
N de pacientes en Riesgo
Tratamiento en combinación
La seguridad y eficacia de IMBRUVICA en pacientes con LLC previamente tratados fueron evaluados adicionalmente en un estudio aleatorizado, multicéntrico, doble ciego de fase III de IMBRUVICA en combinación con BR frente a placebo junto con BR (Estudio CLL3001). Los pacientes (n = 578) fueron aleatorizados 1:1 para recibir 420 mg diarios de IMBRUVICA o placebo en combinación con BR hasta progresión de la enfermedad o toxicidad inaceptable. Todos los pacientes recibieron BR por un máximo de seis ciclos de 28 días. La dosis de Bendamustina era de 70 mg/m2 vía infusión IV durante 30 minutos los Días 2 y 3 del Ciclo 1, y los Días 1 y 2 los Ciclos 2-6 hasta un máximo de 6 ciclos. Rituximab se administró a dosis de 375 mg/m2 el Día 1 del primer ciclo, y a dosis de 500 mg/m2 el Día 1 de los Ciclos 2 al 6. Noventa pacientes aleatorizados a placebo + BR cambiaron de grupo de tratamiento para recibir IMBRUVICA después de la progresión confirmada por el CRI. La mediana de edad era 64 años (intervalo, 31 a 86 años), el 66% eran varones y el 91% caucásicos.
Todos los pacientes presentaban un estado funcional basal del ECOG de 0 ó 1. La mediana de tiempo desde el diagnóstico fue de 6 años, y la mediana del número de tratamientos previos fue 2 (intervalo: de 1 a 11 tratamientos). En el momento basal, el 56% de los pacientes presentaba al menos un tumor > 5 cm, el 26% tenían del11q.
La supervivencia libre de progresión (SLP) fue evaluada por el CRI conforme a los criterios del IWCLL. Los resultados de eficacia en el Estudio CLL3001 se muestran en la Tabla 7.
Tabla 7: Resultados de Eficacia en pacientes con leucemia linfática crónica (Estudio
CLL3001)
|
Criterio de valoración |
IMBRUVICA + BR N = 289 |
Placebo + BR N = 289 |
|
Supervivencia Libre de Progresión | ||
|
Mediana (IC del 95%), meses |
No alcanzada |
13,3 (11,3; 13,9) |
|
HR= 0,203 [IC del 95%: 0,150; 0,2761 | ||
|
Tasa de respuesta global3 % |
82,7 |
67,8 |
|
Supervivencia global (SG)b |
HR= 0,628 [IC del 95%: 0,385; 1,0241 | |
a
b
Evaluado por CRI, TRG (RC, RCi (Respuesta completa con recuperación medular incompleta), RPn (Respuesta nodular parcial), RP)
Mediana de SG no alcanzada en ninguno de los brazos
Macroglobulinemia de Waldenstrom
La seguridad y eficacia de IMBRUVICA en MW (linfoma linfoplasmacítico excretor de IgM) se evaluó en un ensayo abierto, multicéntrico, de un único brazo con 63 pacientes previamente tratados. La mediana de edad fue de 63 años (intervalo: de 44 a 86 años), el 76% fueron varones, y el 95% caucásicos. Todos los pacientes presentaban un estado funcional basal del ECOG de 0 ó 1. La mediana de tiempo desde el diagnóstico fue de 74 meses, y la mediana del número de tratamientos previos fue 2 (intervalo: de 1 a 11 tratamientos). En el momento basal, la mediana del valor IgM sérico fue de 3,5 g/dl, y el 60% de los pacientes presentaron anemia (hemoglobina <11 g/dl o 6,8 mmol/l).
IMBRUVICA se administró por vía oral a dosis de 420 mg una vez al día hasta progresión de la enfermedad o toxicidad inaceptable. El criterio de valoración principal en este estudio fue la TRG evaluada por el investigador. La TRG y DR fueron evaluadas aplicando los criterios adoptados por el Tercer Grupo de Trabajo Internacional de macroglobulinemia de Waldenstrom (Third International Workshop of Waldenstrom’s macroglobulinaemia). Las respuestas a IMBRUVICA se muestran en la Tabla 6.
Tabla 8: Tasa de respuesta global (TRG) y duración de la respuesta (DR) en pacientes con
MW
|
Total (N = 63) | |
|
TRG (%) |
87,3 |
|
IC del 95% (%) |
(76,5; 94,4) |
|
RPMB (%) |
14,3 |
|
RP (%) |
55,6 |
|
RM (%) |
17,5 |
|
Mediana de la DR meses (intervalo) |
NA (0,03+; 18,8+) |
IC = intervalo de confianza; NA = no alcanzada; RM = respuesta mínima; RP = respuesta parcial; RPMB = respuesta parcial muy buena; TRG = RM+RP+RPMB
La mediana de tiempo hasta la respuesta fue de 1 mes (intervalo: 0,7-13,4 meses).
Los resultados de eficacia fueron también evaluados por un Comité de Revisión Independiente (CRI) demostrando una TRG de 83%, con una tasa de RPMB del 11% y una tasa de RP del 51%.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con IMBRUVICA en los diferentes grupos de población pediátrica en LCM, LLC y linfoma linfoplasmocítico (LLP) (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
Ibrutinib se absorbe rápidamente tras su administración oral, con una mediana del Tmax de entre 1 y 2 horas. La biodisponibilidad absoluta en condiciones de ayuno (n = 8) fue del 2,9% (IC 90%:
2,1 - 3,9) y se duplicó al combinarlo con una comida. La farmacocinética de ibrutinib no difiere significativamente en pacientes con distintas neoplasias malignas de los linfocitos B. La exposición a ibrutinib aumenta con dosis de hasta 840 mg. El AUC en el estado estacionario que se observó en pacientes tratados con 560 mg es de (media ± desviación estándar) 953 ± 705 ng h/ml. La administración de ibrutinib en condiciones de ayuno tuvo como resultado una exposición de aproximadamente el 60% (AUClast) en comparación tanto con 30 minutos antes, como 30 minutos después (condiciones con alimento) o 2 horas después de un desayuno rico en grasas.
Distribución
La unión reversible de ibrutinib a proteínas plasmáticas humanas in vitro fue del 97,3% no dependiente de la concentración en el intervalo de 50 a 1.000 ng/ml. El volumen de distribución aparente en el estado estacionario (Vddss/F) fue de aproximadamente 10.000 l.
Metabolismo
Ibrutinib se metaboliza principalmente por el CYP3A4 para dar un metabolito dihidrodiólico con una actividad inhibidora de la BTK aproximadamente 15 veces menor que la de ibrutinib. La implicación del CYP2D6 en el metabolismo de ibrutinib parece ser mínima.
Por consiguiente, no es necesaria ninguna precaución en pacientes con diferentes genotipos de la CYP2D6.
Eliminación
El aclaramiento aparente (CL/F) es de aproximadamente 1.000 l/h. La semivida de ibrutinib es de 4 a 13 horas.
Después de la administración de una dosis única oral de ibrutinib radiomarcado con [14C] a personas sanas, aproximadamente el 90% de la radiactividad se eliminó en el plazo de 168 horas, excretándose la mayor parte (80%) en las heces y < 10% en la orina. El ibrutinib intacto representó aproximadamente el 1% del medicamento radiomarcado excretado en las heces y nada fue excretado en la orina.
Poblaciones especiales
Pacientes de edad avanzada
La farmacocinética poblacional indicó que la edad no influye significativamente en el aclaramiento de ibrutinib de la circulación.
Población pediátrica
No se han realizado estudios farmacocinéticos con IMBRUVICA en pacientes menores de 18 años.
Sexo
Los datos de la farmacocinética poblacional indicaron que el género no influye significativamente en el aclaramiento de ibrutinib de la circulación.
Raza
Los datos disponibles son insuficientes para evaluar el posible efecto de la raza en la farmacocinética de ibrutinib.
Peso corporal
Los datos de farmacocinética poblacional indicaron que el peso corporal (intervalo: de 41 a 146 kg; media [DE]: 83 [19 kg]) tuvo un efecto insignificante en el aclaramiento de ibrutinib.
Insuficiencia renal
La eliminación renal de ibrutinib es mínima; la eliminación urinaria de metabolitos es < 10% de la dosis. No se han realizado estudios específicos hasta la fecha en sujetos con deterioro de la función renal. No se dispone de datos en pacientes con insuficiencia renal grave o en diálisis (ver sección 4.2).
Insuficiencia hepática
Ibrutinib se metaboliza en el hígado. Se realizó un ensayo en sujetos con insuficiencia hepática sin cáncer a los que se administró una dosis única de 140 mg del medicamento en condiciones de ayuno. El efecto que tuvo la insuficiencia hepática varió considerablemente entre los individuos, pero por término medio se observó un incremento de 2,7; 8,2; y 9,8 veces en la exposición a ibrutinib (AUClast) de los sujetos con insuficiencia hepática leve (n = 6, Clase A de Child-Pugh), moderada (n = 10, Clase B de Child-Pugh) y grave (n = 8, Clase C de Child-Pugh), respectivamente. La fracción libre de ibrutinib aumentó también con el grado de deterioro, con un 3,0%, un 3,8% y un 4,8% en los sujetos con insuficiencia hepática leve, moderada y grave, respectivamente, en comparación con el 3,3% en el plasma de los controles sanos emparejados en este estudio. Se estima que el correspondiente aumento de la exposición a la fracción libre de ibrutinib (AUClibre, last) es de 4,1; 9,8 y 13 veces en los sujetos con insuficiencia hepática leve, moderada y grave, respectivamente (ver sección 4.2).
Administración conjunta con sustratos del CYP
Estudios in vitro indicaron que ibrutinib es un inhibidor débil reversible del CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, y del CYP3A4 intestinal (pero no del hepático) y no muestra una inhibición clínicamente relevante dependiente del tiempo del CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 y CYP2D6. El metabolito dihidrodiólico de ibrutinib es un inhibidor débil del CYP2B6, CYP2C8, CYP2C9, y CYP2D6. El metabolito dihidrodiólico es, como mucho, un inductor débil de los isoenzimas CYP450 in vitro. Aunque ibrutinib es un sustrato sensible al CYP3A4, no tiene un efecto clínicamente relevante sobre su propia exposición.
Administración conjunta con sustratos/inhibidores de transportadores
Estudios in vitro indicaron que ibrutinib no es un sustrato de la P-gp, ni de otros trasportadores importantes, excepto del OCT2. El metabolito dihidrodiólico y otros metabolitos son sustrato de la P-gp. Ibrutinib es un inhibidor de la P-gp y de la BCRP in vitro (ver sección 4.5).
5.3 Datos preclínicos sobre seguridad
Los siguientes efectos adversos se observaron en estudios de 13 semanas de duración realizados en ratas y perros. Se observó que ibrutinib inducía efectos gastrointestinales (heces blandas/diarrea y/o inflamación) y depleción linfoide en ratas y perros con un Nivel Sin Efecto Adverso Observado (NOAEL) de 30 mg/kg/día en ambas especies. Teniendo en cuenta la exposición media (AUC) a la dosis clínica de 560 mg/día, los cocientes de AUC fueron de 2,6 y 21 al NOAEL en ratas macho y hembra, y de 0,4 y 1,8 al NOAEL en perros macho y hembra, respectivamente. Los márgenes para el Nivel Más Bajo con Efectos Observados (LOEL) (60 mg/kg/día) en el perro son de 3,6 veces (machos) y de 2,3 veces (hembras). En ratas, se observó atrofia moderada de las células acinares pancreáticas (considerado un efecto adverso) con dosis >100 mg/kg en ratas macho (margen de exposición de AUC de 2,6 veces), pero no se observó en hembras con dosis de hasta 300 mg/kg/día (21,3 veces el margen de exposición AUC). Se observó una ligera disminución del hueso trabecular y cortical en ratas hembra a las que se administró >100 mg/kg/día (20,3 veces el margen de exposición AUC). Todos los efectos gastrointestinales, linfoides y óseos remitieron después de unos períodos de recuperación de 6 a 13 semanas. Los efectos pancreáticos remitieron parcialmente durante períodos similares de recuperación.
No se han realizado estudios de toxicidad juvenil.
Carcinogenicidad/genotoxicidad
No se han llevado a cabo estudios de carcinogenicidad con ibrutinib.
Ibrutinib no tiene propiedades genotóxicas cuando se ha probado en bacterias, células de mamíferos o en ratones.
Toxicidad para la reproducción
En ratas gestantes, ibrutinib en dosis de 80 mg/kg/día se asoció a un aumento de las pérdidas posteriores a la implantación y a un aumento de las malformaciones viscerales (corazón y grandes vasos) y a variaciones esqueléticas con un margen de exposición de 14 veces el AUC obtenido en pacientes tratados con una dosis diaria de 560 mg. En una dosis > 40 mg/kg/día, ibrutinib se asoció a una disminución de los pesos fetales (cociente de AUC > 5,6 en comparación con la dosis diaria de 560 mg en pacientes). En consecuencia, el NOAEL fetal fue de 10 mg/kg/día (aproximadamente
1,3 veces el AUC de ibrutinib a una dosis diaria de 560 mg) (ver sección 4.6).
En conejos gestantes, ibrutinib a dosis de 15 mg/kg/día o mayor se asoció a malformaciones esqueléticas (esternón fusionado) e ibrutinib a dosis de 45 mg/kg/día se asoció a un aumento de las pérdidas posteriores a la implantación. Ibrutinib causó malformaciones en conejos a dosis de 15 mg/kg/día (aproximadamente 2,0 veces la exposición (AUC) en pacientes con LCM administrado 560 mg diarios de ibrutinib y 2,8 veces la exposición en pacientes con LLC o MW que recibieron dosis de 420 mg al día). Consecuentemente, el NOAEL fetal fue de 5 mg/kg/día (aproximadamente 0,7 veces el AUC de ibrutinib a la dosis de 560 mg diarios) (ver sección 4.6).
Fertilidad
No se observaron efectos sobre la fertilidad o capacidad reproductiva en ratas macho o hembra hasta la máxima dosis ensayada, 100 mg/kg/día (Dosis Humana Equivalente [DHE]16 mg/kg/día.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula croscarmelosa sódica estearato de magnesio celulosa microcristalina lauril sulfato de sodio
Cubierta de la cápsula gelatina
dióxido de titanio (E171)
Tinta de impresión goma laca
óxido de hierro negro (E172) propilenglicol
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Frascos de HDPE con un cierre de seguridad a prueba de niños de polipropileno.
Cada caja contiene un frasco de 90 ó 120 cápsulas duras.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen Cilag International NV Turnhoutseweg 30 B-2340 Beerse Bélgica
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/945/001 (90 cápsulas duras)
EU/1/14/945/002 (120 cápsulas duras)
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 21 Octubre 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricante(s) responsable(s) de la liberación de los lotes
Janssen Pharmaceutica NV Turnhoutseweg 30 B-2340 Beerse Bélgica
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requisitos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en
cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Obligación de llevar a cabo medidas post-autorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Presentación de actualizaciones anuales de los resultados sobre progresión y supervivencia del estudio 1112 - a facilitar hasta que se alcance la madurez de los datos del brazo de ibrutinib, por ejemplo 70%, y preferentemente se incluirá la SLP2, o, al menos, el tiempo hasta el siguiente tratamiento. |
4° trimestre del 2017 |
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
IMBRUVICA 140 mg cápsulas duras ibrutinib
2. PRINCIPIO(S) ACTIVO(S)
Cada cápsula dura contiene 140 mg de ibrutinib
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
90 cápsulas duras 120 cápsulas duras
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/945/001 (90 cápsulas duras) EU/1/14/945/002 (120 cápsulas duras)
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
imbruvica
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
1. NOMBRE DEL MEDICAMENTO
IMBRUVICA 140 mg cápsulas ibrutinib
2. PRINCIPIO(S) ACTIVO(S)
Cada cápsula contiene 140 mg de ibrutinib
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
90 cápsulas 120 cápsulas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/945/001 (90 cápsulas duras) EU/1/14/945/002 (120 cápsulas duras)
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
B. PROSPECTO
Prospecto: información para el paciente
IMBRUVICA 140 mg cápsulas duras
ibrutinib
'V Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
• Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es IMBRUVICA y para qué se utiliza 2 Qué necesita saber antes de empezar a tomar IMBRUVICA
3. Cómo tomar IMBRUVICA
4. Posibles efectos adversos
5. Conservación de IMBRUVICA
6. Contenido del envase e información adicional
1. Qué es IMBRUVICA y para qué se utiliza Qué es IMBRUVICA
IMBRUVICA es un medicamento contra el cáncer que contiene el principio activo ibrutinib, que pertenece a una clase de medicamentos llamados inhibidores de las protein-quinasas.
Para qué se utiliza IMBRUVICA
Se utiliza en adultos para el tratamiento de los siguientes cánceres de la sangre:
• Linfoma de células del manto (LCM), un tipo de cáncer que afecta a los ganglios linfáticos, cuando la enfermedad ha reaparecido o no ha respondido al tratamiento.
• Leucemia linfática crónica (LLC), un tipo de cáncer que afecta a los glóbulos blancos de la sangre llamados linfocitos, que también afecta a los ganglios linfáticos. IMBRUVICA se usa en pacientes con LLC que no han sido previamente tratados o cuando la enfermedad ha reaparecido o no ha respondido al tratamiento.
• Macroglobulinemia de Waldenstrom (MW), un tipo de cáncer que afecta a los glóbulos blancos de la sangre llamados linfocitos. Se usa cuando la enfermedad ha reaparecido o no ha respondido al tratamiento o en los pacientes para los que la quimioterapia administrada junto con un anticuerpo no sea un tratamiento apropiado.
Cómo actúa IMBRUVICA
En LCM, LLC y MW, IMBRUVICA actúa bloqueando la tirosina quinasa de Bruton, una proteína del cuerpo que ayuda a las células cancerosas a crecer y sobrevivir. Bloqueando esta proteína, IMBRUVICA ayuda a destruir y reducir el número de células del cáncer. Puede ralentizar también el empeoramiento del cáncer.
2 Qué necesita saber antes de empezar a tomar IMBRUVICA No tome IMBRUVICA
• si es alérgico a ibrutinib o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
• si está tomando un medicamento a base de una planta llamada Hierba de San Juan o hipérico, utilizado para la depresión. Si no está seguro de lo anterior, consulte a su médico, farmacéutico o enfermero antes de tomar este medicamento.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a tomar IMBRUVICA:
• si ha tenido alguna vez hematomas o hemorragias atípicas o si está tomando algún medicamento o suplementos que aumentan su riesgo de sangrado (ver sección “Uso de IMBRUVICA con otros medicamentos”)
• si ha tenido un antecedente de latidos irregulares del corazón (fibrilación auricular) o insuficiencia cardíaca grave, lo que le produce dificultad para respirar y puede dar lugar a hinchazón de las piernas
• si tiene problemas hepáticos o renales
• si se ha sometido recientemente a una intervención quirúrgica, especialmente si ésta ha podido afectar a la absorción de alimentos o medicamentos en el estómago o el intestino
• si va a someterse a una intervención quirúrgica, su médico posiblemente le pida que deje de tomar IMBRUVICA durante un corto período de tiempo.
Si alguna de las situaciones anteriores le aplican a usted (o si no está seguro), consulte a su médico, farmacéutico o enfermero antes de tomar este medicamento.
Pruebas y controles antes y durante el tratamiento
Síndrome de lisis tumoral (SLT): Se han dado casos de niveles atípicos de sustancias químicas en la sangre provocado por la rotura rápida de las células del cáncer durante el tratamiento y algunas veces incluso sin tratamiento. Esto puede conducir a cambios en la función renal, latido del corazón anormal, o convulsiones. Su médico u otro personal sanitario puede hacerle análisis de sangre para comprobar SLT.
Linfocitosis: Las evaluaciones analíticas pueden mostrar un aumento de los glóbulos blancos (llamados “linfocitos”) en su sangre durante las primeras semanas del tratamiento. Este efecto es esperado y puede durar varios meses. Esto no significa necesariamente que su cáncer sanguíneo esté empeorando. El médico comprobará su analítica de sangre antes o durante el tratamiento y en casos raros puede que le tenga que administrar otro medicamento. Hable con su médico sobre el significado de los resultados de estas pruebas.
Niños y adolescentes
IMBRUVICA no se debe utilizar en niños ni adolescentes, ya que no se ha estudiado en estos grupos de edad.
Uso de IMBRUVICA con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento, incluso los medicamentos adquiridos sin receta, medicamentos a base de plantas medicinales y los suplementos. Esto es porque IMBRUVICA puede afectar a la manera en que otros medicamentos actúan. Además, otros medicamentos pueden afectar a la manera en que IMBRUVICA actúa.
IMBRUVICA puede hacer que sangre más fácilmente. Eso significa que debe informar a su médico si está tomando otros medicamentos que aumentan su riesgo de sangrado. Esto incluye:
• ácido acetilsalicílico y antiinflamatorios no esteroideos (AINE) como ibuprofeno o naproxeno
• anticoagulantes como warfarina, heparina u otros medicamentos que evitan la formación de coágulos sanguíneos
suplementos que pueden aumentar su riesgo de sangrado, como aceite de pescado, vitamina E o semillas de linaza.
Si alguna de las situaciones anteriores le aplican a usted (o si no está seguro), consulte a su médico, farmacéutico o enfermero antes de tomar IMBRUVICA.
Informe también a su médico si toma alguno de los siguientes medicamentos: Los efectos de IMBRUVICA o de otros medicamentos se pueden ver influidos si toma IMBRUVICA de forma conjunta con cualquiera de los siguientes medicamentos:
• medicamentos llamados antibióticos para tratar infecciones bacterianas: claritromicina, telitromicina, ciprofloxacino, eritromicina o rifampicina
• medicamentos para las infecciones producidas por hongos: ketoconazol, itraconazol, fluconazol o voriconazol
• medicamentos para la infección por el VIH: ritonavir, cobicistat, indinavir, nelfinavir, saquinavir, amprenavir, atazanavir, darunavir/ritonavir o fosamprenavir
• medicamentos para prevenir las naúseas y los vómitos asociados a la quimioterapia: aprepitant
• medicamentos para la depresión: nefazodona
• medicamentos llamados inhibidores de las quinasas para el tratamiento de otros cánceres: crizotinib o imatinib
• medicamentos llamados bloqueantes de los canales de calcio para la presión arterial alta o dolor en el pecho: diltiazem o verapamilo
• medicamentos llamados estatinas para tratar el colesterol alto: rosuvastatina
• medicamentos para el corazón/antiarrítmicos: amiodarona o dronedarona
• medicamentos para prevenir las convulsiones o para tratar la epilepsia, o medicamentos para tratar un trastorno doloroso de la cara llamado neuralgia del trigémino: carbamazepina o fenitoína
Si alguna de las situaciones anteriores le aplican a usted (o si no está seguro), consulte a su médico, farmacéutico o enfermero antes de tomar IMBRUVICA.
Si está tomando digoxina, un medicamento utilizado para los problemas del corazón, o metotrexato, un medicamento utilizado para tratar otros cánceres y para reducir la actividad del sistema inmunológico (p.ej., para artritis reumatoide o psoriasis), lo debe tomar al menos 6 horas antes o después de IMBRUVICA.
Uso de IMBRUVICA con alimentos
No tome IMBRUVICA con pomelo ni con naranjas amargas: esto significa que no puede comerlos, beber su zumo ni tomar un suplemento que pueda contenerlos. Esto es así porque pueden aumentar la cantidad de IMBRUVICA en su sangre.
Embarazo, lactancia y fertilidad
No se debe quedar embarazada durante el tratamiento con este medicamento. Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico, farmacéutico o enfermero antes de utilizar este medicamento.
No se debe utilizar IMBRUVICA durante el embarazo. No se dispone de información sobre la seguridad de IMBRUVICA en mujeres embarazadas.
Las mujeres en edad fértil deben utilizar un método anticonceptivo muy efectivo durante el tratamiento y hasta tres meses después de recibir IMBRUVICA, para no quedarse embarazadas durante el tratamiento con IMBRUVICA. Si usa anticonceptivos hormonales, como píldoras o dispositivos anticonceptivos, debe utilizar también un método anticonceptivo de barrera (p.ej., preservativos).
• Informe a su médico inmediatamente si se queda embarazada.
• No dé el pecho a su hijo mientras esté tomando este medicamento.
Conducción y uso de máquinas
Es posible que sienta cansancio o mareo después de tomar IMBRUVICA, lo que puede afectar a su capacidad para conducir o usar herramientas o máquinas.
3. Cómo tomar IMBRUVICA
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico, farmacéutico o enfermero. En caso de duda, consulte de nuevo a su médico, farmacéutico o enfermero.
Cuánto debe tomar
Linfoma de células del manto (LCM)
La dosis recomendada de IMBRUVICA es de cuatro cápsulas (560 mg) una vez al día.
Leucemia linfática crónica (LLC)/ macroglobulinemia de Waldenstrom (MW)
La dosis recomendada de IMBRUVICA es de tres cápsulas (420 mg) una vez al día.
Es posible que el médico tenga que ajustar su dosis.
Cómo tomar IMBRUVICA
• Tome las cápsulas por vía oral (por la boca) con un vaso de agua.
• Tome las cápsulas a la misma hora todos los días.
• Trague las cápsulas enteras. No abra, rompa ni mastique las cápsulas.
Si toma más IMBRUVICA del que debe
Si toma más IMBRUVICA del que debe, consulte a su médico o acuda inmediatamente a un hospital. Lleve consigo las cápsulas y este prospecto.
Si olvidó tomar IMBRUVICA
• Si se olvida una dosis, puede tomarla lo antes posible ese mismo día y volver al horario normal al día siguiente.
• No tome una dosis doble para compensar las dosis olvidadas.
• Si tiene dudas, hable con su médico, farmacéutico o enfermero sobre cuándo debe tomar su siguiente dosis.
Si interrumpe el tratamiento con IMBRUVICA
No deje de tomar este medicamento salvo que se lo indique su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Pueden aparecer los siguientes efectos adversos con este medicamento:
Deje de tomar IMBRUVICA y avise inmediatemente a un médico si experimenta cualquiera de los siguientes efectos adversos:
erupción cutánea con bultos y picor, dificultad para respirar, hinchazón de la cara, los labios, la lengua o la garganta: puede estar teniendo una reacción alérgica al medicamento.
Avise inmediatamente a su médico si experimenta alguno de los siguientes efectos adversos:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
• fiebre, escalofríos, dolor corporal, sensación de cansancio, síntomas de catarro o gripe, dificultad para respirar: todos estos pueden ser síntomas de una infección (por virus, bacterias u hongos). Pueden incluir infecciones de la nariz, los senos nasales o la garganta (infecciones de las vías respiratorias altas), o de los pulmones, o de la piel.
• hematomas o mayor tendencia a presentar hematomas.
Frecuentes (pueden afectar a más de 1 de cada 100 personas)
• infecciones graves diseminadas por todo el cuerpo (septicemia)
• infecciones de las vías urinarias
• sangrado de nariz, pequeños puntos de color rojo o púrpura causados por sangrado debajo de la piel
• sangre en las heces o en la orina, mayor sangrado en la menstruación, sangrado de una herida que no puede pararse, confusión, dolor de cabeza con problemas para hablar o sensación de desmayo: estos pueden ser síntomas de una hemorragia interna grave en el estómago, el intestino o el cerebro
• aumento de la frecuencia cardíaca, latidos del corazón ausentes, pulso débil o irregular (síntomas de fibrilación auricular)
• aumento del número o la proporción de glóbulos blancos en los análisis de sangre
• descenso del recuento de glóbulos blancos con fiebre (neutropenia febril)
• niveles inusuales de sustancias químicas en la sangre, producidas por una destrucción rápida de las células del cáncer durante el tratamiento y en algunas ocasiones incluso sin tratamiento (síndrome de lisis tumoral)
• cáncer de piel distinto del melanoma, con más frecuencia carcinoma de células basales y carcinoma espinocelular
• sensación de mareo
• visión borrosa
• sangrado de nariz
• pequeños puntos de color rojo o púrpura causados por sangrado debajo de la piel
• tensión arterial alta
• enrojecimiento de la piel
• falta de suficiente agua en el cuerpo (deshidratación)
• nivel alto de “ácido úrico” en la sangre (se refleja en los análisis de sangre), lo que puede causar gota
• inflamación de vías respiratorias (pulmonar) que puede conducir a un daño permanente.
Poco frecuentes (pueden afectar a más de 1 de cada 1.000 personas)
• aumento intenso del recuento de glóbulos blancos que puede causar que las células se aglomeren
• reacción alérgica, algunas veces grave, que puede incluir cara, labio, boca, lengua o garganta hinchados, dificultad para tragar o respirar, erupción cutánea con picor (urticaria).
Otros efectos adversos muy frecuentes
• llagas en la boca
• dolor de cabeza
• estreñimiento
• sentirse o estar nauseoso (náuseas o vómitos)
• diarrea, es posible que su médico tenga que administrarle un tratamiento de reposición de líquidos y sales o algún otro medicamento
• erupción cutánea
• dolor en brazos o piernas
• dolor en la espalda o en las articulaciones
• calambres musculares, dolor muscular o espasmos musculares
• número bajo de las células que ayudan a la coagulación sanguínea (plaquetas), número muy bajo de glóbulos blancos: se refleja en los análisis de sangre
• manos, tobillos o pies hinchados.
No conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• insuficiencia hepática.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de IMBRUVICA
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta del frasco después de CAD. La fecha de caducidad es el último día del mes que se indica.
No requiere condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de IMBRUVICA
• El principio activo es ibrutinib. Cada cápsula dura contiene 140 mg de ibrutinib.
• Los demás componentes son:
- contenido de la cápsula: croscarmelosa sódica, estearato de magnesio, celulosa microcristalina y lauril sulfato de sodio
- cubierta de la cápsula: gelatina y dióxido de titanio (E171)
- tinta de impresión: goma laca, óxido de hierro negro (E172), y propilenglicol.
Aspecto del producto y contenido del envase
IMBRUVICA se presenta en cápsulas duras opacas, de color blanco marcadas con “ibr 140 mg” en tinta negra en una cara.
Las cápsulas se suministran en un frasco de plástico con un cierre de seguridad a prueba de niños de polipropileno. Cada frasco contiene 90 ó 120 cápsulas. Cada envase contiene un frasco.
Titular de la autorización de comercialización
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Bélgica
Responsable de la fabricación
Janssen Pharmaceutica NV Turnhoutseweg 30 B-2340 Beerse Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Janssen-Cilag NV Antwerpseweg 15-17 B-2340 Beerse Tel/Tél: +32 14 64 94 11
Etarapna
„fl^OHCtH & fl^OHCtH Etarapna” EOOfl
^.k. MaagocT 4
EH3Hec napK Co$Ha, crpaga 4
Co$Ha 1766
Tea.: +359 2 489 94 00
Ceská republika
Janssen-Cilag s.r.o.
Karla Englise 3201/06 CZ-150 00 Praha 5 - Smíchov Tel. +420 227 012 227
Danmark
Janssen-Cilag A/S Bregner0dvej 133 DK-3460 Birker0d Tlf: +45 45 94 82 82
Deutschland
Janssen-Cilag GmbH Johnson & Johnson Platz 1 D-41470 Neuss Tel: +49 2137 955 955
Eesti
UAB "JOHNSON & JOHNSON" Eesti filiaal LSStsa 2
EE-11415 Tallinn Tel: +372 617 7410
EXXáSa
Janssen-Cilag Oap^aKeuxiKq A.E.B.E. Asro^ópog Erp^vn? 56 GR-151 21 neÚKn, A0^va T^: +30 210 80 90 000
España
Janssen-Cilag, S.A.
Paseo de las Doce Estrellas, 5-7 E-28042 Madrid Tel: +34 91 722 81 00
Lietuva
UAB "JOHNSON & JOHNSON"
Gelezinio Vilko g. 18A LT-08104 Vilnius Tel: +370 5 278 68 88
Luxembourg/Luxemburg
Janssen-Cilag NV Antwerpseweg 15-17 B-2340 Beerse Belgique/Belgien Tél/Tel: +32 14 649 411
Magyarország
Janssen-Cilag Kft.
Nagyenyed u. 8-14 H-Budapest, 1123 Tel.: +36 1 884 2858
Malta
Am Mangion Ltd.
Mangion Building, Triq Gdida fi Triq Valletta MT-Hal-Luqa LQA 6000 Tel: +356 2397 6000
Nederland
Janssen-Cilag B.V.
Dr. Paul Janssenweg 150 NL-5026 RH Tilburg Tel: +31 13 583 73 73
Norge
Janssen-Cilag AS Postboks 144 NO-1325-Lysaker Tlf: +47 24 12 65 00
Osterreich
Janssen-Cilag Pharma GmbH VorgartenstraEe 206B A-1020 Wien Tel: +43 1 610 300
Polska
Janssen-Cilag Polska Sp. z o.o. ul. Ilzecka 24 PL-02-135 Warszawa Tel.+48 22 237 60 00
|
France Janssen-Cilag 1, rue Camille Desmoulins, TSA 91003 F-92787 Issy Les Moulineaux, Cedex 9 Tél: 0 800 25 50 75 / +33 1 55 00 40 03 |
Portugal Janssen-Cilag Farmacéutica, Lda. Estrada Consiglieri Pedroso, 69 A Queluz de Baixo PT-2734-503 Barcarena Tel: +351 21 43 68 835 |
|
Hrvatska Johnson & Johnson S.E. d.o.o. Oreskoviceva 6H HR-10010 Zagreb Tel: + 385 1 66 10 700 |
Romania Johnson & Johnson Romania SRL Strada Tipografilor Nr. 11-15 Cládirea S-Park, Corp B3-B4, Etaj 3 013714 Bucure§ti, ROMANIA Tel: +40 21 207 18 00 |
|
Ireland Janssen-Cilag Ltd. 50-100 Holmers Farm Way High Wycombe Buckinghamshire HP12 4EG United Kingdom Tel: +44 1494 567 567 |
Slovenija Johnson & Johnson d.o.o. Smartinska cesta 53 SI-1000 Ljubljana Tel: +386 1 401 18 30 |
|
Ísland Janssen-Cilag AB c/o Vistor hf. Horgatúni 2 IS-210 Garóab^r Sími: +354 535 7000 |
Slovenská republika Johnson & Johnson, s.r.o. CBC III, Karadzicova 12 SK-821 08 Bratislava Tel: +421 232 408 400 |
|
Italia Janssen-Cilag SpA Via M.Buonarroti, 23 I-20093 Cologno Monzese MI Tel: +39 02 2510 1 |
Suomi/Finland Janssen-Cilag Oy Vaisalantie/Vaisalavagen 2 FI-02130 Espoo/Esbo Puh/Tel: +358 207 531 300 |
|
Kúnpoq BapváPag Xar^nnavay^g AxS Asm^ópog rráwou KpavrSrróxn 226 Aaxará CY-2234 AsuKmaía T^: ++357 22 207 700 |
Sverige Janssen-Cilag AB Box 4042 SE-16904 Solna Tel: +46 8 626 50 00 |
|
Latvija UAB "JOHNSON & JOHNSON" filíale Latvija Mükusalas iela 101 Riga, LV-1004 Tel: +371 678 93561 |
United Kingdom Janssen-Cilag Ltd. 50-100 Holmers Farm Way High Wycombe Buckinghamshire HP12 4EG - UK Tel: +44 1494 567 444. |
|
Fecha de la última revisión de este prospecto: |
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
38