Hirobriz Breezhaler 300 Microgramos Polvo Para Inhalacion (Capsula Dura)
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Hirobriz Breezhaler 150 microgramos polvo para inhalación (cápsula dura)
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula contiene maleato de indacaterol equivalente a 150 microgramos de indacaterol.
La dosis liberada por la boquilla del inhalador es maleato de indacaterol equivalente a 120 microgramos de indacaterol.
Excipiente con efecto conocido:
Cada cápsula contiene 24,8 mg de lactosa.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para inhalación (cápsula dura)
Cápsulas transparentes (incoloras) que contienen un polvo blanco, con IDL 150" impreso en negro por encima de una línea negra y el logotipo de la compañía (Ó) impreso en negro por debajo de la misma.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Hirobriz Breezhaler está indicado para el tratamiento broncodilatador de mantenimiento de la obstrucción de las vías respiratorias en pacientes adultos con enfermedad pulmonar obstructiva crónica (EPOC).
4.2 Posología y forma de administración
Posología
La dosis recomendada consiste en la inhalación del contenido de una cápsula de 150 microgramos una vez al día, utilizando el inhalador de Hirobriz Breezhaler. La dosis sólo debe aumentarse por prescripción facultativa.
Se ha demostrado que la inhalación del contenido de una cápsula de 300 microgramos una vez al día, utilizando el inhalador de Hirobriz Breezhaler ofrece beneficios clínicos adicionales por lo que respecta a la dificultad para respirar, especialmente en pacientes con EPOC grave. La dosis máxima es de 300 microgramos una vez al día.
Hirobriz Breezhaler debe administrarse a la misma hora cada día.
Si se olvida una dosis, la próxima dosis debe administrarse el día siguiente a la hora habitual.
Poblaciones especiales Población de edad avanzada
La concentración plasmática máxima y la exposición sistémica global aumentan con la edad pero no se requiere ajuste de dosis en pacientes de edad avanzada.
Insuficiencia hepática
No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve o moderada. No se dispone de datos sobre el uso de Hirobriz Breezhaler en pacientes con insuficiencia hepática grave.
Insuficiencia renal
No se requiere ajuste de dosis en pacientes con insuficiencia renal.
Población pediátrica
No existe una recomendación de uso específica para Hirobriz Breezhaler en la población pediátrica (menores de 18 años).
Forma de administración
Para vía inhalatoria exclusivamente. Las cápsulas de Hirobriz Breezhaler no deben tragarse.
Las cápsulas se deben extraer únicamente del blíster inmediatamente antes de usar.
Las cápsulas se deben administrar únicamente con la ayuda del inhalador de Hirobriz Breezhaler (ver sección 6.6). Se debe utilizar el inhalador de Hirobriz Breezhaler que se proporciona con cada nueva prescripción.
Se debe instruir a los pacientes sobre como administrar el medicamento correctamente. A los pacientes que no presenten mejoría en la respiración se les debe preguntar si están tragando el medicamento en lugar de inhalándolo.
Para consultar las instrucciones de uso del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Asma
Hirobriz Breezhaler es un agonista beta2-adrenérgico de larga duración el cual está indicado únicamente para EPOC y no debe utilizarse en asma debido a la ausencia de datos sobre resultados a largo plazo en esta indicación.
Los agonistas beta2-adrenérgicos de larga duración pueden aumentar el riesgo de acontecimientos adversos graves, incluyendo muertes, relacionados con el asma, cuando se utilizan para el tratamiento del asma.
Hipersensibilidad
Se han notificado reacciones de hipersensibilidad inmediatas tras la administración de Hirobriz Breezhaler. Si se producen signos que sugieran una reacción alérgica (en particular, dificultad para respirar o tragar, hinchazón de la lengua, labios y cara, urticaria, erupción cutánea), se debe interrumpir inmediatamente el tratamiento con Hirobriz Breezhaler e instaurar una terapia alternativa.
Broncoespasmo paradójico
Como ocurre con otros tratamientos inhalatorios, la administración de Hirobriz Breezhaler puede causar un broncoespamo paradójico que puede ser amenazante para la vida. En caso de producirse, debe interrumpirse inmediatamente la administración de Hirobriz Breezhaler y sustituirse por un tratamiento alternativo.
Empeoramiento de la enfermedad
Hirobriz Breezhaler no está indicado para el tratamiento de episodios agudos de broncoespasmo, es decir, como tratamiento de rescate. Si la EPOC empeora durante el tratamiento con Hirobriz Breezhaler, se debe evaluar de nuevo al paciente y al régimen de tratamiento de la EPOC. No es adecuado aumentar la dosis diaria de Hirobriz Breezhaler por encima de la dosis máxima de 300 microgramos.
Efectos sistémicos
Aunque no suelen observarse efectos clínicamente relevantes sobre el sistema cardiovascular después de administrar Hirobriz Breezhaler en las dosis recomendadas, tal y como ocurre con otros agonistas beta2-adrenérgicos, indacaterol debe utilizarse con precaución en pacientes con trastornos cardiovasculares (insuficiencia coronaria, infarto agudo de miocardio, arritmias cardiacas, hipertensión), con trastornos convulsivos o tirotoxicosis, y en pacientes que responden de forma inusual a los agonistas beta2-adrenérgicos.
Efectos cardiovasculares
Al igual que otros agonistas beta2-adrenérgicos, indacaterol puede producir efectos cardiovasculares clínicamente significativos en algunos pacientes, determinado por el incremento de la frecuencia del pulso, la presión sanguínea y/o los síntomas. Si aparecen estos efectos, puede ser necesario interrumpir el tratamiento. Se ha observado, asimismo, que los agonistas beta-adrenérgicos producen alteraciones en el electrocardiograma (ECG), como el aplanamiento de la onda T, prolongación del intervalo QT y depresión del segmento ST, si bien se desconoce la significación clínica de estos hallazgos. Por lo tanto, los agonistas beta2-adrenérgicos de larga duración como Hirobriz Breezhaler se deben utilizar con precaución en pacientes con conocimiento o sospecha de prolongación del intervalo QT o tratados con medicamentos que afectan al intervalo QT.
No se han observado efectos clínicamente relevantes sobre la prologación del intervalo QTc en ensayos clínicos con Hirobriz Breezhaler a las dosis terapéuticas recomendadas (ver sección 5.1).
Hipocaliemia
Los agonistas beta2-adrenérgicos pueden inducir en algunos pacientes una hipocaliemia significativa, capaz de provocar efectos adversos cardiovasculares. El descenso del potasio sérico es generalmente transitorio y no requiere administrar suplementos. En pacientes con EPOC grave, la hipocaliemia puede acentuarse por la hipoxia y por el tratamiento concomitante (ver sección 4.5), lo que puede aumentar la susceptibilidad a las arritmias cardiacas.
Hiperglucemia
La inhalación de dosis elevadas de agonistas beta2-adrenérgicos puede inducir un aumento de la glucosa plasmática. Tras el inicio del tratamiento con Hirobriz Breezhaler, deben vigilarse estrechamente los niveles de glucosa en sangre en pacientes diabéticos.
Durante los ensayos clínicos, se observó, por lo general, una mayor frecuencia (1-2%) de alteraciones clínicamente considerables de la glucemia en los pacientes tratados con Hirobriz Breezhaler a las dosis recomendadas que con placebo. No se ha investigado el uso de Hirobriz Breezhaler en pacientes con diabetes mellitus no controlada.
Excipientes
Las cápsulas contienen lactosa. Los pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Medicamentos simpaticomiméticos
La administración concomitante de otros medicamentos simpaticomiméticos (solos o como integrantes de un tratamiento de combinación) puede potenciar las reacciones adversas a Hirobriz Breezhaler.
Hirobriz Breezhaler no debe utilizarse junto con otros agonistas beta2-adrenérgicos de larga duración ni con medicamentos que los contengan.
Tratamiento hipocaliémico
La administración concomitante de tratamiento hipocaliémico con derivados de la metilxantina, corticoides o diuréticos no ahorradores de potasio pueden intensificar el posible efecto hipocaliémico de los agonistas beta2-adrenérgicos, por lo tanto se requiere precaución (ver sección 4.4).
Bloqueantes beta-adrenérgicos
Los bloqueantes beta-adrenérgicos y los agonistas beta2-adrenérgicos pueden debilitar o antagonizar el efecto del uno al otro cuando se administran de forma conjunta. Por ello, indacaterol no debe administrarse junto con bloqueantes beta-adrenérgicos (incluidos colirios) a menos que su uso esté claramente justificado. Cuando sean necesarios, es preferible utilizar bloqueantes beta-adrenérgicos cardioselectivos, aunque éstos también deben administrarse con precaución.
Interacciones asociadas al metabolismo y a transportadores
La inhibición de los agentes principales del metabolismo de indacaterol, CYP3A4 y la glicoproteína P (P-gp) aumenta hasta dos veces la exposición sistémica del fármaco. La magnitud de la exposición aumenta debido a las interacciones, si bien no afecta a la seguridad de acuerdo con la experiencia adquirida con el tratamiento con Hirobriz Breezhaler en los ensayos clínicos de hasta un año de duración y utilizando dosis de hasta el doble de la dosis máxima terapéutica recomendada.
No se han observado interacciones entre Indacaterol y medicamentos administrados conjuntamente. Los estudios in vitro indican que el indacaterol presenta una capacidad insignificante de provocar interacciones metabólicas con medicamentos en los niveles de exposición sistémica que se alcanzan en la práctica clínica.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos sobre la utilización de indacaterol en mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción a una exposición clínicamente relevante (ver sección 5.3). Al igual que otros agonistas beta2-adrenérgicos, indacaterol puede inhibir el parto debido al efecto relajante sobre el músculo liso uterino. Hirobriz Breezhaler solo debe utilizarse durante el embarazo si los beneficios esperados superan los riesgos potenciales.
Lactancia
Se desconoce si indacaterol/metabolitos se excretan en la leche materna. Los datos farmacocinéticos/toxicológicos disponibles en animales muestran que indacaterol/metabolitos se excretan en la leche (ver sección 5.3). No se puede excluir el riesgo en lactantes. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con Hirobriz Breezhaler tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
Se ha observado en ratas un descenso en la tasa de embarazos. Sin embargo, se considera improbable que la inhalación de indacaterol a las dosis máximas recomendadas afecte la reproducción o fertilidad en seres humanos (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Hirobriz Breezhaler sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes con las dosis recomendadas consistieron en rinofaringitis (14,3%), infección de las vías respiratorias altas (14,2%), tos (8,2%), cefalea (3,7%) y espasmos musculares (3,5%). La gran mayoría fueron de carácter leve o moderado y su frecuencia disminuyó al continuar el tratamiento.
A las dosis recomendadas, el perfil de seguridad de Hirobriz Breezhaler en pacientes con EPOC pone de manifiesto unos efectos sistémicos carentes de significación clínica debidos a la estimulación beta2-adrenérgica. La variación media de la frecuencia cardiaca fue inferior a un latido por minuto y la taquicardia fue infrecuente y similar a la registrada en el grupo placebo. No se detectaron prolongaciones significativas del intervalo QTcF en comparación con placebo. La frecuencia de intervalos QTcF apreciablemente prolongados [es decir, >450 ms (hombres) y >470 ms (mujeres)] y las notificaciones de hipocaliemia fueron similares a las registradas con placebo. La variación media de las alteraciones máximas de glucemia resultaron similares con Hirobriz Breezhaler y con placebo.
Resumen tabulado de las reacciones adversas
El programa de desarrollo clínico de fase III de Hirobriz Breezhaler incluyó pacientes con un diagnóstico clínico de EPOC entre moderada y grave. En él, se han tratado 4.764 pacientes con dosis de indacaterol de hasta dos veces la dosis máxima recomendada y hasta un año de tratamiento. De estos pacientes, 2.611 recibieron 150 microgramos una vez al día y 1.157 recibieron 300 microgramos una vez al día. Aproximadamente, el 41% de los pacientes padecían EPOC grave. La media de edad de los pacientes era 64 años, con un 48% de los pacientes de 65 años o mayores, y la mayoría (80%) de raza caucásica.
Las reacciones adversas de la Tabla 1 se citan según la clasificación por órganos y sistemas de MedDRA de la base de datos de seguridad de EPOC. Dentro de cada clase de órganos, las reacciones adversas se enumeran en orden decreciente de frecuencia de acuerdo con la convención siguiente : Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1 Reacciones adversas
|
Reacciones adversas |
Frecuencia |
|
Infecciones e infestaciones Infección de las vías respiratorias altas |
Frecuente |
|
Rinofaringitis |
Frecuente |
|
Sinusitis |
Frecuente |
|
Trastornos del sistema inmunológico Hipersensibilidad1 |
Poco frecuente |
|
Trastornos del metabolismo y de la nutrición Diabetes mellitus e hiperglucemia |
Poco frecuente |
|
Trastornos del sistema nervioso Cefalea |
Frecuente |
|
Mareo |
Frecuente |
|
Parestesia |
Poco frecuente |
Trastornos cardiacos
Poco frecuente Poco frecuente Poco frecuente Poco frecuente
Frecuente Frecuente Frecuente Poco frecuente
Poco frecuente
Frecuente Poco frecuente Poco frecuente
Frecuente
Frecuente
Isquemia coronaria Fibrilación auricular Palpitaciones Taquicardia
Trastornos respiratorios, torácicos y mediastínicos
Tos
Dolor orofaríngeo incluyendo irritación de garganta Rinorrea
Broncoespasmo paradójico
Trastornos de la piel y del tejido subcutáneo
Prurito/erupción cutánea
Trastornos musculoesqueléticos y del tejido conjuntivo
Espasmos musculares Mialgia
Dolor musculoesquelético
Trastornos generales y alteraciones en el lugar de administración
Está indicado prescribir tratamiento sintomático y de soporte. En los casos graves, se debe hospitalizar al paciente. Se debe considerar la posibilidad de emplear betabloqueantes cardioselectivos, pero sólo bajo la supervisión de un médico y con suma precaución ya que los bloqueantes beta-adrenérgicos pueden provocar broncoespasmo.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Medicamentos contra alteraciones obstructivas de las vías respiratorias, agonista beta-2-adrenoreceptor selectivo, código ATC: R03AC18
Mecanismo de acción
Los efectos farmacológicos de los agonistas de los adrenorreceptores beta2, son atribuibles, al menos en parte, a la estimulación de la adenil ciclasa intracelular, la enzima que cataliza la conversión del trifosfato de adenosina (ATP) en 3’,5’-monofosfato de adenosina (AMP) cíclico (monofosfato cíclico). El aumento de los niveles de AMP cíclico, causa relajación del músculo liso bronquial. Estudios in vitro han demostrado que indacaterol, un agonista beta2-adrenérgico de larga duración, tiene una actividad agonista en los receptores beta2 que es más de 24 veces superior a la observada en los receptores beta1 y 20 veces mayor que la registrada en los receptores beta3.
Cuando se inhala, el indacaterol actúa localmente en los pulmones como broncodilatador. El indacaterol es un agonista parcial del receptor beta2-adrenérgico humano con una potencia del orden nanomolar. En bronquios humanos aislados, la actividad del indaterol se inicia rápidamente y es prolongada.
Aunque los receptores beta2 son los receptores adrenérgicos predominantes en el músculo liso bronquial y los receptores betai son los predominantes en el corazón humano, en este órgano existen también receptores beta2-adrenérgicos que representan entre el 10 y el 50% del total de receptores adrenérgicos. No se conoce con exactitud la función específica de los receptores beta2-adrenérgicos en el corazón, pero su presencia plantea la posibilidad de que incluso los agonistas beta2-adrenérgicos altamente selectivos tengan efectos cardiacos.
Efectos farmacodinámicos
La administración de 150 y 300 microgramos de Hirobriz Breezhaler una vez al día, mejoró la función pulmonar de forma clínicamente significativa (medida como el volumen expiratorio forzado durante el primer segundo, FEV1) a lo largo de 24 horas en varios ensayos clínicos de eficacia y farmacodinamia. Se produjo un inicio rápido de la acción en los 5 minutos siguientes a la inhalación, con un incremento del FEV1 con respecto al valor basal de 110-160 ml, comparable al efecto de 200 microgramos de salbutamol, agonista beta2 de acción rápida, y significativamente más rápido que 50/500 microgramos de salmeterol/fluticasona. Los valores máximos promedio del FEV1 respecto al valor basal fueron de 250-330 ml en el estado estacionario.
El efecto broncodilatador no dependía de la hora de administración, mañana o tarde.
Hirobriz Breezhaler demostró que reducía la hiperinsuflación pulmonar, dando como resultado un aumento de la capacidad inspiratoria durante el ejercicio y en reposo, comparado con placebo.
Efectos sobre la efectrofisiología cardiaca
En un ensayo doble ciego controlado con placebo y fármaco activo (moxifloxacino), de dos semanas de duración en 404 voluntarios sanos, que recibieron dosis múltiples de 150 microgramos,
300 microgramos y 600 microgramos, la prolongación media máxima observada (intervalo de confianza del 90%) del intervalo QTcF (en milisegundos) fue de 2,66 (0,55, 4,77) 2,98 (1,02, 4,93) y 3,34 (0,86, 5,82), respectivamente. Ello demuestra que, a las dosis terapéuticas recomendadas o dos veces la dosis máxima recomendada, el medicamento no tiene potencial arritmogénico relacionado con la prolongación del intervalo QT. No hubo evidencia de una relación entre la concentración y el QTc delta en el intervalo de dosis estudiado.
En un ensayo de fase III, doble ciego, controlado con placebo, de 26 semanas de duración y con 605 pacientes con EPOC, se demostró que no hubo diferencias clínicamente relevantes en el desarrollo de acontecimientos arritmogénicos durante el seguimiento de 24 horas al inicio del ensayo y hasta tres veces durante el periodo de tratamiento de 26 semanas, entre los pacientes que recibieron las dosis recomendadas de Hirobriz Breezhaler y aquellos pacientes que recibieron placebo o tiotropio.
Eficacia clínica y seguridad
El programa de desarrollo clínico incluyó varios ensayos controlados y randomizados en pacientes con diagnóstico clínico de EPOC, uno de 12 semanas, dos de seis meses (uno de los cuales con fase de extensión de un año para evaluar la seguridad y tolerabilidad) y uno de un año. Los ensayos incluyeron determinaciones de la función pulmonar y resultados de salud tales como disnea, exacerbaciones y aspectos de calidad de vida relacionados con la salud.
Función _ pulmonar
La administración una vez al día de 150 microgramos y 300 microgramos de Hirobriz Breezhaler, demostró mejorías clínicamente significativas de la función pulmonar. La variable principal a las 12 semanas (FEVi valle a las 24 horas) mostró un incremento de 130-180 ml respecto a placebo (p<0,001) con la dosis de 150 microgramos y un incremento de 60 ml respecto a 50 microgramos de salmeterol dos veces al día (p<0,001). Con la dosis de 300 microgramos se produjo un incremento de 170-180 ml respecto a placebo (p<0,001) y de 100 ml respecto a 12 microgramos de formoterol administrados dos veces al día (p<0,001). Ambas dosis produjeron un incremento de 40-50 ml, en un ensayo abierto, comparado con una dosis de 18 microgramos una vez al día de tiotropio (150 microgramos, p=0,004; 300 microgramos, p=0,01). El efecto broncodilatador a las 24 horas de Hirobriz Breezhaler se mantuvo desde la primera dosis hasta un año de tratamiento sin signos de pérdida de eficacia (taquifilaxia).
Beneficios sintomáticos
Ambas dosis demostraron una mejoría estadísticamente significativa en el alivio de los síntomas (Tabla 2) frente a placebo con respecto a la disnea y estado de salud (evaluados mediante el Índice Transicional de Disnea [ITD] y el Cuestionario Respiratorio de St. George [SGRQ], respectivamente). La magnitud de la respuesta fue generalmente superior a la observada con comparadores activos (Tabla 2). Además, los pacientes tratados con Hirobriz Breezhaler necesitaron significativamente menos medicación de rescate, disfrutaron de más días sin requerir medicación de rescate comparado con placebo y presentaron un porcentaje significativamente mayor de días sin síntomas diurnos.
El análisis de eficacia conjunto de 6 meses de tratamiento demostró que la tasa de exacerbaciones de EPOC fue inferior, de forma estadísticamente significativa, respecto a la de placebo. La comparación del tratamiento con respecto a placebo mostró una relación de tasas de 0,68 (95% CI [ 0,47, 0,98]; valor-p 0,036) y 0,74 (95% CI [0,56, 0,96]; valor-p 0,026) para 150 microgramos y 300 microgramos, respectivamente.
Se dispone de experiencia limitada sobre el tratamiento en individuos de descendencia Africana.
Diseño del ensayo con a: indacaterol 150 microgramos, salmeterol y placebo; b: indacaterol 150 y 300 microgramos, tiotropio y placebo; c: indacaterol 300 microgramos, formoterol y placebo ^ DMCI = diferencia mínima clínicamente importante (cambio >1 punto en ITD, cambio >4 puntos en SGRQ)
Tabla 2 Mejoría de los síntomas a los 6 meses de tratamiento
|
Tratamiento Dosis (microgramos) |
Indacaterol 150 una vez al día |
Indacaterol 300 una vez al día |
Tiotropio 18 una vez al día |
Salmeterol 50 dos veces al día |
Formoterol 12 dos veces al día |
Placebo |
|
Porcentaje de pacientes que consiguieron DMCI en ITDf |
57 a 62 b |
71 b 59 c |
57 b |
54 a |
54 c |
45 a 47 b 41 c |
|
Porcentaje de pacientes que consiguieron DMCI en SGRQf |
53 a 58 b |
53 b 55 c |
47 b |
49 a |
51 c |
38 a 46 b 40 c |
|
Reducción del n° de pulsaciones/día de medicación de rescate respecto al periodo basal |
1,3 a 1,5 b |
1,6 b |
1,0 b |
1,2 a |
n/e |
0,3 a 0,4 b |
|
Porcentaje de días sin medicación de rescate |
60 a 57 b |
58 b |
46 b |
55 a |
n/e |
42 a 42 b |
n/e= no evaluado a los seis meses Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Hirobriz Breezhaler en los diferentes grupos de la población pediátrica en enfermedad pulmonar obstructiva crónica (EPOC) (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Indacaterol es una molécula quiral con configuración-R.
Los datos farmacocinéticos se obtuvieron de un número de ensayos clínicos realizados con voluntarios sanos y pacientes con EPOC.
Absorción
La mediana del tiempo para alcanzar las concentraciones séricas máximas de indacaterol fue de 15 minutos aproximadamente tras la inhalación de dosis únicas o repetidas. La exposición sistémica a indacaterol aumentó al aumentar la dosis (de 150 microgramos a 600 microgramos) de una manera proporcional a la misma. La biodisponibilidad absoluta de indacaterol después de una dosis inhalada fue de una media del 43% al 45%. La exposición sistémica es consecuencia de una absorción mixta, pulmonar y gastrointestinal; el 75% aproximadamente de la exposición sistémica fue por absorción pulmonar y el 25% aproximadamente por absorción gastrointestinal.
Las concentraciones séricas de indacaterol aumentaron con la administración de dosis únicas diarias repetidas. El estado estacionario se alcanzó entre los 12 y 14 días. La tasa de acumulación media de indacaterol, es decir, el AUC durante el periodo de dosificación de 24 horas en el Día 14 comparado con el Día 1, se encontró comprendido entre 2,9 y 3,5 para dosis únicas diarias inhaladas entre 150 microgramos y 600 microgramos.
Distribución
Tras la infusión intravenosa el volumen de distribución de indacaterol durante la fase de eliminación terminal fue de 2557 litros, lo cual indica una distribución muy amplia. La unión in vitro a proteínas séricas y plasmáticas humanas fue de 94,1-95,3% y de 95,1-96,2%, respectivamente.
Biotransformación
Tras la administración oral de indacaterol radiomarcado en un ensayo ADME (absorción, distribución, metabolismo, excreción) en humanos, el indacaterol inalterado fue el principal componente en el suero, y representaba aproximadamente un tercio del total del AUC de 24 horas relacionada con el fármaco. El metabolito más abundante en el suero fue un derivado hidroxilado. Otros metabolitos importantes fueron O-glucurónidos fenólicos de indacaterol e indacaterol hidroxilado. Se identificaron, asimismo, otros metabolitos, un diastereómero del derivado hidroxilado, un N-glucurónido de indacaterol, y productos C- y N-desalquilados.
Los estudios in vitro indicaron que la UGT1A1 es el único isoformo de la UGT que metabolizó el indacaterol al O-glucurónido fenólico. Se hallaron metabolitos oxidativos en incubaciones con CYP1A1, CYP2D6, y CYP3A4 recombinantes. Se concluyó que CYP3A4 es la principal isoenzima responsable de la hidroxilación del indacaterol. Otros estudios in vitro indicaron que el indacaterol es un sustrato de baja afinidad de la bomba de flujo P-gp.
Eliminación
En los ensayos clínicos en los que se recogieron muestras de orina, la cantidad de indacaterol que se excretaba inalterado en la orina fue generalmente inferior al 2% de la dosis. El aclaramiento renal de indacaterol estuvo comprendido, en promedio, entre 0,46 y 1,20 litros/hora. Comparado con el aclaramiento sérico de indacaterol de 23,3 litros/hora, es evidente que el aclaramiento renal desempeña un papel menor (aproximadamente entre el 2 y el 5% del aclaramiento sistémico) en la eliminación del indacaterol disponible sistémicamente.
En un ensayo ADME en humanos en el que indacaterol se administró vía oral, predominó la vía de excreción fecal sobre la urinaria. El indacaterol se excretó principalmente en las heces humanas como fármaco original inalterado (54% de la dosis) y, en menor grado, como metabolitos de indacaterol hidroxilado (23% de la dosis). El balance de masas fue completo con >90% de la dosis recuperada en la excreta.
Las concentraciones séricas de indacaterol descendieron de manera multifásica con una semivida terminal media comprendida entre 45,5 y 126 horas. La semivida efectiva, calculada a partir de la acumulación de indacaterol tras dosis repetidas osciló entre 40 y 52 horas lo cual es consistente con el tiempo observado para alcanzar el estado estacionario de aproximadamente 12-14 días.
Poblaciones especiales
Un análisis farmacocinético de la población mostró que no existe un efecto clínicamente relevante de la edad (adultos hasta 88 años), sexo, peso (32-168 kg) o raza sobre la farmacocinética de indacaterol. No indicó ninguna diferencia entre subgrupos étnicos en esta población.
Los pacientes con insuficiencia hepática leve o moderada no mostraron cambios relevantes en la Cmax o AUC de indacaterol, ni la unión a proteínas difirió entre dichos pacientes y sus controles sanos. No se realizaron ensayos en sujetos con insuficiencia hepática grave.
Debido a la muy escasa contribución de la vía renal a la eliminación total del organismo, no se realizó un ensayo en sujetos con insuficiencia renal.
5.3 Datos preclínicos sobre seguridad
Los efectos sobre el sistema cardiovascular atribuibles a las propiedades agonistas beta2 de indacaterol incluyeron taquicardia, arritmias y lesiones miocárdicas en perros. En roedores se observó una leve irritación de las fosas nasales y laringe. Todos estos hallazgos se observaron con exposiciones suficientemente superiores a las esperadas en humanos.
Aunque el indacaterol no afectó a la capacidad reproductora general en un estudio de fertilidad en ratas, se observó un descenso en el número de descendientes de la progenie F1 en un estudio peri y post-desarrollo a una exposición 14 veces más elevada que en humanos tratados con Hirobriz Breezhaler. Indacaterol no fue embriotóxico o teratogénico en ratas o conejos.
Los estudios de genotoxicidad no revelaron ningún poder mutagénico o clastógenico. Se evaluó la carcinogenicidad en un estudio de dos años en ratas y en un estudio transgénico de seis meses en ratones. El aumento de la incidencia de leiomiomas de ovarios benignos e hiperplasia focal del músculo liso de ovarios en ratas fue consistente con hallazgos similares observados con otros agonistas beta2-adrenérgicos. No se observó evidencia de carcinogenicidad en ratones. En estos estudios, las exposiciones sistémicas (AUC) en ratas y ratones a niveles de efecto adverso no observable fueron como mínimo 7 y 49 veces superiores, respectivamente, a las observadas en humanos tratados con Hirobriz Breezhaler una vez al día a la dosis de 300 microgramos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula Lactosa monohidrato
Cubierta de la cápsula Gelatina
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 2 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
Conservar en el blister para protegerlo de la humedad y extraer solo inmediatamente antes de usar.
6.5 Naturaleza y contenido del envase
Hirobriz Breezhaler es un dispositivo para inhalación de dosis única. El cuerpo del inhalador y el capuchón están fabricados con acrilonitrilo butadieno estireno, los pulsadores están fabricados con metil metacrilato acrilonitrilo butadieno estireno. Las agujas y muelles son de acero inoxidable.
Blister de PA/Alu/PVC - Alu, que contiene 10 cápsulas duras.
Cartonaje conteniendo 10 cápsulas y un inhalador de Hirobriz Breezhaler.
Cartonaje conteniendo 30 cápsulas y un inhalador de Hirobriz Breezhaler.
Envase múltiple que contiene 2 envases (cada uno conteniendo 30 cápsulas y 1 inhalador).
Envase múltiple que contiene 3 envases (cada uno conteniendo 30 cápsulas y 1 inhalador).
Envase múltiple que contiene 30 envases (cada uno conteniendo 10 cápsulas y 1 inhalador).
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Cada inhalador se debe desechar después de 30 días de uso.
Instrucciones de uso y manipulación
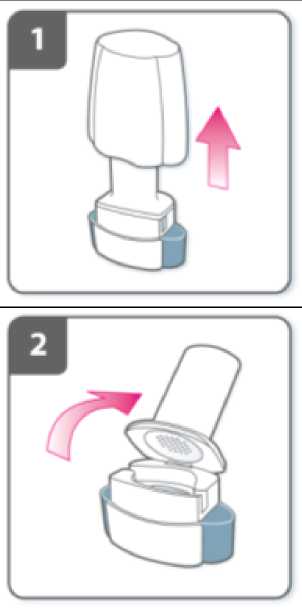
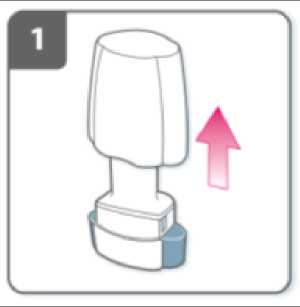
Retire el capuchón.
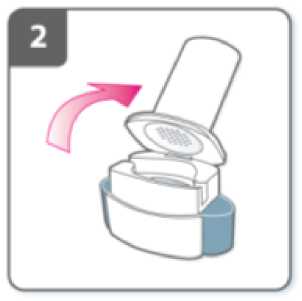
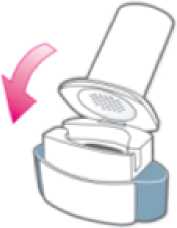
Abra el inhalador:
Sujete firmemente la base del inhalador e incline la boquilla. De esta manera se abrirá el inhalador.

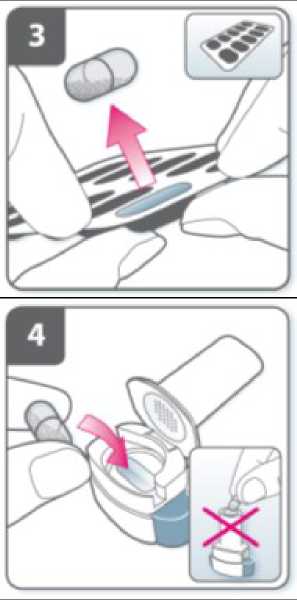
Prepare la cápsula:
Justo antes de usar, con las manos secas, extraiga una cápsula del blister.
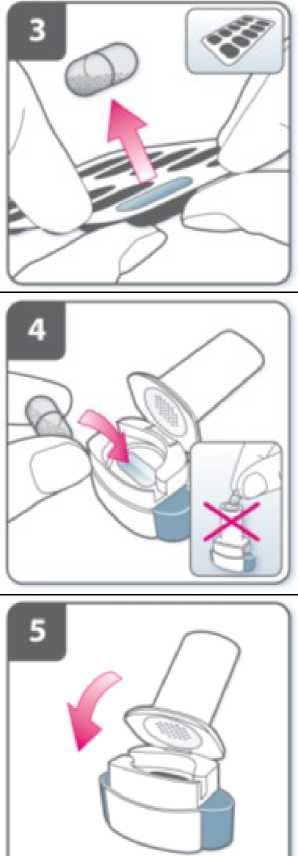
Introduzca la cápsula:
Introduzca la cápsula en el compartimiento para la cápsula.
No coloque nunca una cápsula directamente en la boquilla.
Cierre el inhalador:
Cierre el inhalador hasta que oiga un “clic”.
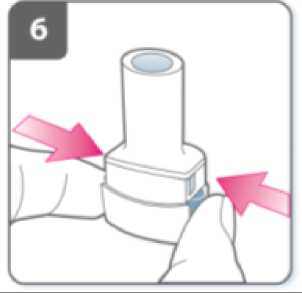
Perfore la cápsula:
• Sujete el inhalador en posición vertical con la boquilla hacia arriba.
• Perfore la cápsula presionando firmemente ambos pulsadores al mismo tiempo. Realice esta operación solo una vez.
• Deberá oír un “click” en el momento en que se perfore la cápsula.

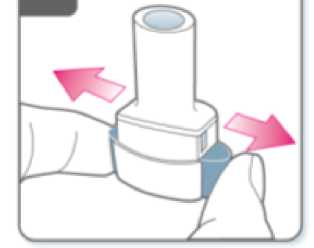
Suelte completamente los pulsadores.
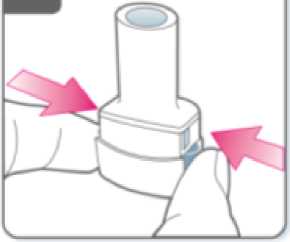
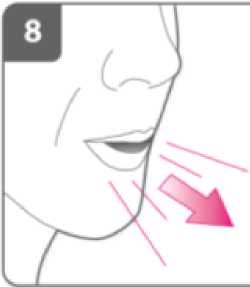
Espire:
Antes de introducir la boquilla en su boca, espire completamente.
No sople dentro de la boquilla.
Inhale el medicamento
Para inhalar el medicamento profundamente en
sus vías respiratorias:
• Sujete el inhalador como se muestra en la figura. Los pulsadores deben quedar situados a la derecha e izquierda. No presione los pulsadores.
• Introduzca la boquilla en su boca y cierre los labios firmemente en torno a ella.
• Inspire de forma rápida y constante y tan profundamente como pueda.
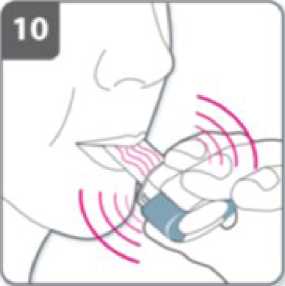
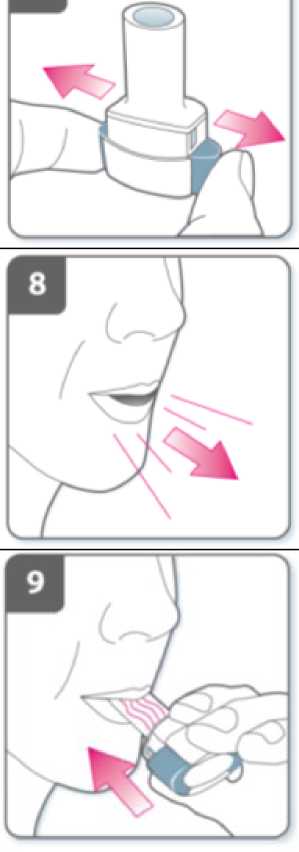
Nota:
Cuando inspire a través del inhalador, la cápsula girará en la cámara y usted deberá oír un zumbido. Notará un gusto dulce cuando el medicamento penetre en sus pulmones.
Información adicional
Ocasionalmente, fragmentos muy pequeños de la cápsula pueden atravesar el filtro e introducirse en su boca. Si esto ocurre, puede notar estos fragmentos en su lengua. No es perjudicial si estos fragmentos se tragan o inhalan. La posibilidad de que la cápsula se fragmente aumenta si la cápsula se perfora accidentalmente más de una vez (paso 6).
Si no oye un zumbido:
La cápsula puede estar atascada en el
compartimiento. Si esto ocurre:
• Abra el inhalador y libere la cápsula con cuidado dando golpecitos en la base del mismo. No presione los pulsadores.
• Inhale el medicamento de nuevo repitiendo los pasos 8 y 9.

Contenga la respiración:
Después de que haya inhalado el medicamento:
• Contenga la respiración durante un mínimo de 5-10 segundos o todo lo posible mientras no le resulte incomodo, al tiempo que extrae el inhalador de la boca.
• Seguidamente espire.
• Abra el inhalador para comprobar si queda polvo en la cápsula.
Si queda polvo en la cápsula:
• Cierre el inhalador.
• Repita los pasos 8, 9, 10 y 11.
La mayoría de las personas son capaces de vaciar la cápsula en una o dos inhalaciones.
Información adicional
Algunas personas ocasionalmente pueden toser al poco de inhalar el medicamento. En caso de que le ocurra, no se preocupe. Si la cápsula está vacía, es que ha recibido suficiente cantidad de su medicamento.
|
0 á(\ y® |
Después de que haya acabado de tomar su medicamento: • Abra de nuevo la boquilla, y elimine la cápsula vacía extrayéndola del compartimiento de la cápsula. Coloque la cápsula vacía en la basura de su casa. • Cierre el inhalador y coloque de nuevo el capuchón. No conserve las cápsulas en el inhalador de Hirobriz Breezhaler. | ||
|
□ w l_- |
Marque en el registro de dosis diaria: En el interior del envase hay un registro de dosis diaria. Coloque una marca en el recuadro de hoy si le ayuda a recordar cuando le toca la siguiente dosis. |
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/594/001-005
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 30 Noviembre 2009 Fecha de la última renovación: 02 Diciembre 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
1. NOMBRE DEL MEDICAMENTO
Hirobriz Breezhaler 300 microgramos polvo para inhalación (cápsula dura)
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula contiene maleato de indacaterol equivalente a 300 microgramos de indacaterol.
La dosis liberada por la boquilla del inhalador es maleato de indacaterol equivalente a 240 microgramos de indacaterol.
Excipiente con efecto conocido:
Cada cápsula contiene 24,6 mg de lactosa.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para inhalación (cápsula dura)
Cápsulas transparentes (incoloras) que contienen un polvo encima de una línea azul y el logotipo de la compañía (f'>)
blanco, con “IDL 300” impreso en azul por impreso en azul por debajo de la misma.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Hirobriz Breezhaler está indicado para el tratamiento broncodilatador de mantenimiento de la obstrucción de las vías respiratorias en pacientes adultos con enfermedad pulmonar obstructiva crónica (EPOC).
4.2 Posología y forma de administración
Posología
La dosis recomendada consiste en la inhalación del contenido de una cápsula de 150 microgramos una vez al día, utilizando el inhalador de Hirobriz Breezhaler. La dosis sólo debe aumentarse por prescripción facultativa.
Se ha demostrado que la inhalación del contenido de una cápsula de 300 microgramos una vez al día, utilizando el inhalador de Hirobriz Breezhaler ofrece beneficios clínicos adicionales por lo que respecta a la dificultad para respirar, especialmente en pacientes con EPOC grave. La dosis máxima es de 300 microgramos una vez al día.
Hirobriz Breezhaler debe administrarse a la misma hora cada día.
Si se olvida una dosis, la próxima dosis debe administrarse el día siguiente a la hora habitual.
Poblaciones especiales Población de edad avanzada
La concentración plasmática máxima y la exposición sistémica global aumentan con la edad pero no se requiere ajuste de dosis en pacientes de edad avanzada.
Insuficiencia hepática
No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve o moderada. No se dispone de datos sobre el uso de Hirobriz Breezhaler en pacientes con insuficiencia hepática grave.
Insuficiencia renal
No se requiere ajuste de dosis en pacientes con insuficiencia renal.
Población pediátrica
No existe una recomendación de uso específica para Hirobriz Breezhaler en la población pediátrica (menores de 18 años).
Forma de administración
Para vía inhalatoria exclusivamente. Las cápsulas de Hirobriz Breezhaler no deben tragarse.
Las cápsulas se deben extraer únicamente del blíster inmediatamente antes de usar.
Las cápsulas se deben administrar únicamente con la ayuda del inhalador de Hirobriz Breezhaler (ver sección 6.6). Se debe utilizar el inhalador de Hirobriz Breezhaler que se proporciona con cada nueva prescripción.
Se debe instruir a los pacientes sobre como administrar el medicamento correctamente. A los pacientes que no presenten mejoría en la respiración se les debe preguntar si están tragando el medicamento en lugar de inhalándolo.
Para consultar las instrucciones de uso del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Asma
Hirobriz Breezhaler es un agonista beta2-adrenérgico de larga duración el cual está indicado únicamente para EPOC y no debe utilizarse en asma debido a la ausencia de datos sobre resultados a largo plazo en esta indicación.
Los agonistas beta2-adrenérgicos de larga duración pueden aumentar el riesgo de acontecimientos adversos graves, incluyendo muertes, relacionados con el asma, cuando se utilizan para el tratamiento del asma.
Hipersensibilidad
Se han notificado reacciones de hipersensibilidad inmediatas tras la administración de Hirobriz Breezhaler. Si se producen signos que sugieran una reacción alérgica (en particular, dificultad para respirar o tragar, hinchazón de la lengua, labios y cara, urticaria, erupción cutánea), se debe interrumpir inmediatamente el tratamiento con Hirobriz Breezhaler e instaurar una terapia alternativa.
Broncoespasmo paradójico
Como ocurre con otros tratamientos inhalatorios, la administración de Hirobriz Breezhaler puede causar un broncoespamo paradójico que puede ser amenazante para la vida. En caso de producirse, debe interrumpirse inmediatamente la administración de Hirobriz Breezhaler y sustituirse por un tratamiento alternativo.
Empeoramiento de la enfermedad
Hirobriz Breezhaler no está indicado para el tratamiento de episodios agudos de broncoespasmo, es decir, como tratamiento de rescate. Si la EPOC empeora durante el tratamiento con Hirobriz Breezhaler, se debe evaluar de nuevo al paciente y al régimen de tratamiento de la EPOC. No es adecuado aumentar la dosis diaria de Hirobriz Breezhaler por encima de la dosis máxima de 300 microgramos.
Efectos sistémicos
Aunque no suelen observarse efectos clínicamente relevantes sobre el sistema cardiovascular después de administrar Hirobriz Breezhaler en las dosis recomendadas, tal y como ocurre con otros agonistas beta2-adrenérgicos, indacaterol debe utilizarse con precaución en pacientes con trastornos cardiovasculares (insuficiencia coronaria, infarto agudo de miocardio, arritmias cardiacas, hipertensión), con trastornos convulsivos o tirotoxicosis, y en pacientes que responden de forma inusual a los agonistas beta2-adrenérgicos.
Efectos cardiovasculares
Al igual que otros agonistas beta2-adrenérgicos, indacaterol puede producir efectos cardiovasculares clínicamente significativos en algunos pacientes, determinado por el incremento de la frecuencia del pulso, la presión sanguínea y/o los síntomas. Si aparecen estos efectos, puede ser necesario interrumpir el tratamiento. Se ha observado, asimismo, que los agonistas beta-adrenérgicos producen alteraciones en el electrocardiograma (ECG), como el aplanamiento de la onda T, prolongación del intervalo QT y depresión del segmento ST, si bien se desconoce la significación clínica de estos hallazgos. Por lo tanto, los agonistas beta2-adrenérgicos de larga duración como Hirobriz Breezhaler se deben utilizar con precaución en pacientes con conocimiento o sospecha de prolongación del intervalo QT o tratados con medicamentos que afectan al intervalo QT.
No se han observado efectos clínicamente relevantes sobre la prologación del intervalo QTc en ensayos clínicos con Hirobriz Breezhaler a las dosis terapéuticas recomendadas (ver sección 5.1).
Hipocaliemia
Los agonistas beta2-adrenérgicos pueden inducir en algunos pacientes una hipocaliemia significativa, capaz de provocar efectos adversos cardiovasculares. El descenso del potasio sérico es generalmente transitorio y no requiere administrar suplementos. En pacientes con EPOC grave, la hipocaliemia puede acentuarse por la hipoxia y por el tratamiento concomitante (ver sección 4.5), lo que puede aumentar la susceptibilidad a las arritmias cardiacas.
Hiperglucemia
La inhalación de dosis elevadas de agonistas beta2-adrenérgicos puede inducir un aumento de la glucosa plasmática. Tras el inicio del tratamiento con Hirobriz Breezhaler, deben vigilarse estrechamente los niveles de glucosa en sangre en pacientes diabéticos.
Durante los ensayos clínicos, se observó, por lo general, una mayor frecuencia (1-2%) de alteraciones clínicamente considerables de la glucemia en los pacientes tratados con Hirobriz Breezhaler a las dosis recomendadas que con placebo. No se ha investigado el uso de Hirobriz Breezhaler en pacientes con diabetes mellitus no controlada.
Excipientes
Las cápsulas contienen lactosa. Los pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este
medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Medicamentos simpaticomiméticos
La administración concomitante de otros medicamentos simpaticomiméticos (solos o como integrantes de un tratamiento de combinación) puede potenciar las reacciones adversas a Hirobriz Breezhaler.
Hirobriz Breezhaler no debe utilizarse junto con otros agonistas beta2-adrenérgicos de larga duración ni con medicamentos que los contengan.
Tratamiento hipocaliémico
La administración concomitante de tratamiento hipocaliémico con derivados de la metilxantina, corticoides o diuréticos no ahorradores de potasio pueden intensificar el posible efecto hipocaliémico de los agonistas beta2-adrenérgicos, por lo tanto se requiere precaución (ver sección 4.4).
Bloqueantes beta-adrenérgicos
Los bloqueantes beta-adrenérgicos y los agonistas beta2-adrenérgicos pueden debilitar o antagonizar el efecto del uno al otro cuando se administran de forma conjunta. Por ello, indacaterol no debe administrarse junto con bloqueantes beta-adrenérgicos (incluidos colirios) a menos que su uso esté claramente justificado. Cuando sean necesarios, es preferible utilizar bloqueantes beta-adrenérgicos cardioselectivos, aunque éstos también deben administrarse con precaución.
Interacciones asociadas al metabolismo y a transportadores
La inhibición de los agentes principales del metabolismo de indacaterol, CYP3A4 y la glicoproteína P (P-gp) aumenta hasta dos veces la exposición sistémica del fármaco. La magnitud de la exposición aumenta debido a las interacciones, si bien no afecta a la seguridad de acuerdo con la experiencia adquirida con el tratamiento con Hirobriz Breezhaler en los ensayos clínicos de hasta un año de duración y utilizando dosis de hasta el doble de la dosis máxima terapéutica recomendada.
No se han observado interacciones entre Indacaterol y medicamentos administrados conjuntamente. Los estudios in vitro indican que el indacaterol presenta una capacidad insignificante de provocar interacciones metabólicas con medicamentos en los niveles de exposición sistémica que se alcanzan en la práctica clínica.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos sobre la utilización de indacaterol en mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción a una exposición clínicamente relevante (ver sección 5.3). Al igual que otros agonistas beta2-adrenérgicos, indacaterol puede inhibir el parto debido al efecto relajante sobre el músculo liso uterino. Hirobriz Breezhaler solo debe utilizarse durante el embarazo si los beneficios esperados superan los riesgos potenciales.
Lactancia
Se desconoce si indacaterol/metabolitos se excretan en la leche materna. Los datos farmacocinéticos/toxicológicos disponibles en animales muestran que indacaterol/metabolitos se excretan en la leche (ver sección 5.3). No se puede excluir el riesgo en lactantes. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con Hirobriz Breezhaler tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
Se ha observado en ratas un descenso en la tasa de embarazos. Sin embargo, se considera improbable que la inhalación de indacaterol a las dosis máximas recomendadas afecte la reproducción o fertilidad en seres humanos (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Hirobriz Breezhaler sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes con las dosis recomendadas consistieron en rinofaringitis (14,3%), infección de las vías respiratorias altas (14,2%), tos (8,2%), cefalea (3,7%) y espasmos musculares (3,5%). La gran mayoría fueron de carácter leve o moderado y su frecuencia disminuyó al continuar el tratamiento.
A las dosis recomendadas, el perfil de seguridad de Hirobriz Breezhaler en pacientes con EPOC pone de manifiesto unos efectos sistémicos carentes de significación clínica debidos a la estimulación beta2-adrenérgica. La variación media de la frecuencia cardiaca fue inferior a un latido por minuto y la taquicardia fue infrecuente y similar a la registrada en el grupo placebo. No se detectaron prolongaciones significativas del intervalo QTcF en comparación con placebo. La frecuencia de intervalos QTcF apreciablemente prolongados [es decir, >450 ms (hombres) y >470 ms (mujeres)] y las notificaciones de hipocaliemia fueron similares a las registradas con placebo. La variación media de las alteraciones máximas de glucemia resultaron similares con Hirobriz Breezhaler y con placebo.
Resumen tabulado de las reacciones adversas
El programa de desarrollo clínico de fase III de Hirobriz Breezhaler incluyó pacientes con un diagnóstico clínico de EPOC entre moderada y grave. En él, se han tratado 4.764 pacientes con dosis de indacaterol de hasta dos veces la dosis máxima recomendada y hasta un año de tratamiento. De estos pacientes, 2.611 recibieron 150 microgramos una vez al día y 1.157 recibieron 300 microgramos una vez al día. Aproximadamente, el 41% de los pacientes padecían EPOC grave. La media de edad de los pacientes era 64 años, con un 48% de los pacientes de 65 años o mayores, y la mayoría (80%) de raza caucásica.
Las reacciones adversas de la Tabla 1 se citan según la clasificación por órganos y sistemas de MedDRA de la base de datos de seguridad de EPOC. Dentro de cada clase de órganos, las reacciones adversas se enumeran en orden decreciente de frecuencia de acuerdo con la convención siguiente : Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1 Reacciones adversas
|
Reacciones adversas |
Frecuencia |
|
Infecciones e infestaciones Rinofaringitis |
Muy frecuente |
|
Infección de las vías respiratorias altas |
Muy frecuente |
|
Sinusitis |
Frecuente |
|
Trastornos del sistema inmunológico Hipersensibilidad1 |
Poco frecuente |
|
Trastornos del metabolismo y de la nutrición Diabetes mellitus e hiperglucemia |
Frecuente |
|
Trastornos del sistema nervioso Cefalea |
Frecuente |
|
Mareo |
Frecuente |
|
Parestesia |
Poco frecuente |
|
Trastornos cardiacos Isquemia coronaria |
Frecuente |
|
Palpitaciones |
Frecuente |
|
Fibrilación auricular |
Poco frecuente |
|
Taquicardia |
Poco frecuente |
|
Trastornos respiratorios, torácicos y mediastínicos Tos |
Frecuente |
|
Dolor orofaríngeo incluyendo irritación de garganta |
Frecuente |
|
Rinorrea |
Frecuente |
|
Broncoespasmo paradójico |
Poco frecuente |
|
Trastornos de la piel y del tejido subcutáneo Prurito/erupción cutánea |
Frecuente |
|
Trastornos musculoesqueléticos y del tejido conjuntivo Espasmos musculares |
Frecuente |
|
Dolor musculoesquelético |
Frecuente |
|
Mialgia |
Poco frecuente |
|
Trastornos generales y alteraciones en el lugar de administración Dolor torácico |
Frecuente |
|
Edema periférico |
Frecuente |
1 Se han recibido informes de hipersensibilidad tras la experiencia de comercialización postautorización, en asociación con el uso de Hirobriz Breezhaler. Estos fueron notificados voluntariamente por una población de tamaño incierto, por lo tanto, no siempre es posible estimar la frecuencia de forma fidedigna o establecer una relación causal con el medicamento. Por lo tanto, la frecuencia se calculó a partir de la experiencia en los ensayos clínicos.
Con 600 microgramos una vez al día, el perfil de seguridad de Hirobriz Breezhaler resultó similar al de las dosis recomendadas. Una reacción adversa adicional fue temblor (frecuente).
Descripción de las reacciones adversas seleccionadas
En los ensayos clínicos fase III, los profesionales sanitarios observaron que durante las visitas, una media del 17-20% de los pacientes presentaba una tos esporádica que solía aparecer en los 15 segundos posteriores a la inhalación y duraba generalmente 5 segundos (aproximadamente 10 segundos en fumadores). Se observó con mayor frecuencia en mujeres que en hombres y en fumadores que en ex-fumadores. Esta tos que aparecía tras la inhalación no obligó a ningún paciente a discontinuar el ensayo con las dosis recomendadas (la tos es un síntoma de la EPOC y únicamente el 8,2% de los pacientes describieron la tos como reacción adversa). No existe evidencia de que la tos que aparece tras la inhalación se asocie al broncoespasmo, exacerbaciones, empeoramiento de la enfermedad o pérdida de eficacia.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
En pacientes con EPOC, dosis únicas 10 veces superiores a la dosis terapéutica máxima recomendada se asociaron con un aumento moderado de la frecuencia del pulso, la presión sanguínea sistólica y el intervalo QTc.
Es probable que una sobredosis de indacaterol cause exageradamente los efectos típicos de los estimulantes beta2-adrenérgicos, es decir, taquicardia, temblor, palpitaciones, cefalea, náuseas, vómitos, mareo, arritmias ventriculares, acidosis metabólica, hipocaliemia e hiperglucemia.
Está indicado prescribir tratamiento sintomático y de soporte. En los casos graves, se debe hospitalizar al paciente. Se debe considerar la posibilidad de emplear betabloqueantes cardioselectivos, pero sólo bajo la supervisión de un médico y con suma precaución ya que los bloqueantes beta-adrenérgicos pueden provocar broncoespasmo.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Medicamentos contra alteraciones obstructivas de las vías respiratorias, agonista beta-2-adrenoreceptor selectivo, código ATC: R03AC18
Mecanismo de acción
Los efectos farmacológicos de los agonistas de los adrenorreceptores beta2, son atribuibles, al menos en parte, a la estimulación de la adenil ciclasa intracelular, la enzima que cataliza la conversión del trifosfato de adenosina (ATP) en 3’,5’-monofosfato de adenosina (AMP) cíclico (monofosfato cíclico). El aumento de los niveles de AMP cíclico, causa relajación del músculo liso bronquial. Estudios in vitro han demostrado que indacaterol, un agonista beta2-adrenérgico de larga duración, tiene una actividad agonista en los receptores beta2 que es más de 24 veces superior a la observada en los receptores beta1 y 20 veces mayor que la registrada en los receptores beta3.
Cuando se inhala, el indacaterol actúa localmente en los pulmones como broncodilatador. El indacaterol es un agonista parcial del receptor beta2-adrenérgico humano con una potencia del orden nanomolar. En bronquios humanos aislados, la actividad del indaterol se inicia rápidamente y es prolongada.
Aunque los receptores beta2 son los receptores adrenérgicos predominantes en el músculo liso bronquial y los receptores beta1 son los predominantes en el corazón humano, en este órgano existen también receptores beta2-adrenérgicos que representan entre el 10 y el 50% del total de receptores adrenérgicos. No se conoce con exactitud la función específica de los receptores beta2-adrenérgicos en el corazón, pero su presencia plantea la posibilidad de que incluso los agonistas beta2-adrenérgicos altamente selectivos tengan efectos cardiacos.
Efectos farmacodinámicos
La administración de 150 y 300 microgramos de Hirobriz Breezhaler una vez al día, mejoró la función pulmonar de forma clínicamente significativa (medida como el volumen expiratorio forzado durante el primer segundo, FEV1) a lo largo de 24 horas en varios ensayos clínicos de eficacia y farmacodinamia. Se produjo un inicio rápido de la acción en los 5 minutos siguientes a la inhalación, con un incremento del FEV1 con respecto al valor basal de 110-160 ml, comparable al efecto de 200 microgramos de salbutamol, agonista beta2 de acción rápida, y significativamente más rápido que 50/500 microgramos de salmeterol/fluticasona. Los valores máximos promedio del FEV1 respecto al valor basal fueron de 250-330 ml en el estado estacionario.
El efecto broncodilatador no dependía de la hora de administración, mañana o tarde.
Hirobriz Breezhaler demostró que reducía la hiperinsuflación pulmonar, dando como resultado un aumento de la capacidad inspiratoria durante el ejercicio y en reposo, comparado con placebo.
Efectos sobre la efectrofisiología cardiaca
En un ensayo doble ciego controlado con placebo y fármaco activo (moxifloxacino), de dos semanas de duración en 404 voluntarios sanos, que recibieron dosis múltiples de 150 microgramos,
300 microgramos y 600 microgramos, la prolongación media máxima observada (intervalo de confianza del 90%) del intervalo QTcF (en milisegundos) fue de 2,66 (0,55, 4,77) 2,98 (1,02, 4,93) y 3,34 (0,86, 5,82), respectivamente. Ello demuestra que, a las dosis terapéuticas recomendadas o dos veces la dosis máxima recomendada, el medicamento no tiene potencial arritmogénico relacionado con la prolongación del intervalo QT. No hubo evidencia de una relación entre la concentración y el QTc delta en el intervalo de dosis estudiado.
En un ensayo de fase III, doble ciego, controlado con placebo, de 26 semanas de duración y con 605 pacientes con EPOC, se demostró que no hubo diferencias clínicamente relevantes en el desarrollo de acontecimientos arritmogénicos durante el seguimiento de 24 horas al inicio del ensayo y hasta tres veces durante el periodo de tratamiento de 26 semanas, entre los pacientes que recibieron las dosis recomendadas de Hirobriz Breezhaler y aquellos pacientes que recibieron placebo o tiotropio.
Eficacia clínica y seguridad
El programa de desarrollo clínico incluyó varios ensayos controlados y randomizados en pacientes con diagnóstico clínico de EPOC, uno de 12 semanas, dos de seis meses (uno de los cuales con fase de extensión de un año para evaluar la seguridad y tolerabilidad) y uno de un año. Los ensayos incluyeron determinaciones de la función pulmonar y resultados de salud tales como disnea, exacerbaciones y aspectos de calidad de vida relacionados con la salud.
Función _ pulmonar
La administración una vez al día de 150 microgramos y 300 microgramos de Hirobriz Breezhaler, demostró mejorías clínicamente significativas de la función pulmonar. La variable principal a las 12 semanas (FEV1 valle a las 24 horas) mostró un incremento de 130-180 ml respecto a placebo (p<0,001) con la dosis de 150 microgramos y un incremento de 60 ml respecto a 50 microgramos de salmeterol dos veces al día (p<0,001). Con la dosis de 300 microgramos se produjo un incremento de 170-180 ml respecto a placebo (p<0,001) y de 100 ml respecto a 12 microgramos de formoterol administrados dos veces al día (p<0,001). Ambas dosis produjeron un incremento de 40-50 ml, en un ensayo abierto, comparado con una dosis de 18 microgramos una vez al día de tiotropio (150 microgramos, p=0,004; 300 microgramos, p=0,01). El efecto broncodilatador a las 24 horas de
Hirobriz Breezhaler se mantuvo desde la primera dosis hasta un año de tratamiento sin signos de pérdida de eficacia (taquifilaxia).
Beneficios sintomáticos
Ambas dosis demostraron una mejoría estadísticamente significativa en el alivio de los síntomas (Tabla 2) frente a placebo con respecto a la disnea y estado de salud (evaluados mediante el Índice Transicional de Disnea [ITD] y el Cuestionario Respiratorio de St. George [SGRQ], respectivamente). La magnitud de la respuesta fue generalmente superior a la observada con comparadores activos (Tabla 2). Además, los pacientes tratados con Hirobriz Breezhaler necesitaron significativamente menos medicación de rescate, disfrutaron de más días sin requerir medicación de rescate comparado con placebo y presentaron un porcentaje significativamente mayor de días sin síntomas diurnos.
El análisis de eficacia conjunto de 6 meses de tratamiento demostró que la tasa de exacerbaciones de EPOC fue inferior, de forma estadísticamente significativa, respecto a la de placebo. La comparación del tratamiento con respecto a placebo mostró una relación de tasas de 0,68 (95% CI [ 0,47, 0,98]; valor-p 0,036) y 0,74 (95% CI [0,56, 0,96]; valor-p 0,026) para 150 microgramos y 300 microgramos, respectivamente.
Se dispone de experiencia limitada sobre el tratamiento en individuos de descendencia Africana. Tabla 2 Mejoría de los síntomas a los 6 meses de tratamiento
|
Tratamiento Dosis (microgramos) |
Indacaterol 150 una vez al día |
Indacaterol 300 una vez al día |
Tiotropio 18 una vez al día |
Salmeterol 50 dos veces al día |
Formoterol 12 dos veces al día |
Placebo |
|
Porcentaje de pacientes que consiguieron DMCI en ITDf |
57 a 62 b |
71 b 59 c |
57 b |
54 a |
54 c |
45 a 47 b 41 c |
|
Porcentaje de pacientes que consiguieron DMCI en SGRQf |
53 a 58 b |
53 b 55 c |
47 b |
49 a |
51 c |
38 a 46 b 40 c |
|
Reducción del n° de pulsaciones/día de medicación de rescate respecto al periodo basal |
1,3 a 1,5 b |
1,6 b |
1,0 b |
1,2 a |
n/e |
0,3 a 0,4 b |
|
Porcentaje de días sin medicación de rescate |
60 a 57 b |
58 b |
46 b |
55 a |
n/e |
42 a 42 b |
Diseño del ensayo con a: indacaterol 150 microgramos, salmeterol y placebo; b: indacaterol 150 y 300 microgramos, tiotropio y placebo; c: indacaterol 300 microgramos, formoterol y placebo ^ DMCI = diferencia mínima clínicamente importante (cambio > 1 punto en ITD, cambio >4 puntos en SGRQ)
n/e= no evaluado a los seis meses Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Hirobriz Breezhaler en los diferentes grupos de la población pediátrica en enfermedad pulmonar obstructiva crónica (EPOC) (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Indacaterol es una molécula quiral con configuración-R.
Los datos farmacocinéticos se obtuvieron de un número de ensayos clínicos realizados con voluntarios sanos y pacientes con EPOC.
Absorción
La mediana del tiempo para alcanzar las concentraciones séricas máximas de indacaterol fue de 15 minutos aproximadamente tras la inhalación de dosis únicas o repetidas. La exposición sistémica a indacaterol aumentó al aumentar la dosis (de 150 microgramos a 600 microgramos) de una manera proporcional a la misma. La biodisponibilidad absoluta de indacaterol después de una dosis inhalada fue de una media del 43% al 45%. La exposición sistémica es consecuencia de una absorción mixta, pulmonar y gastrointestinal; el 75% aproximadamente de la exposición sistémica fue por absorción pulmonar y el 25% aproximadamente por absorción gastrointestinal.
Las concentraciones séricas de indacaterol aumentaron con la administración de dosis únicas diarias repetidas. El estado estacionario se alcanzó entre los 12 y 14 días. La tasa de acumulación media de indacaterol, es decir, el AUC durante el periodo de dosificación de 24 horas en el Día 14 comparado con el Día 1, se encontró comprendido entre 2,9 y 3,5 para dosis únicas diarias inhaladas entre 150 microgramos y 600 microgramos.
Distribución
Tras la infusión intravenosa el volumen de distribución de indacaterol durante la fase de eliminación terminal fue de 2557 litros, lo cual indica una distribución muy amplia. La unión in vitro a proteínas séricas y plasmáticas humanas fue de 94,1-95,3% y de 95,1-96,2%, respectivamente.
Biotransformación
Tras la administración oral de indacaterol radiomarcado en un ensayo ADME (absorción, distribución, metabolismo, excreción) en humanos, el indacaterol inalterado fue el principal componente en el suero, y representaba aproximadamente un tercio del total del AUC de 24 horas relacionada con el fármaco. El metabolito más abundante en el suero fue un derivado hidroxilado. Otros metabolitos importantes fueron O-glucurónidos fenólicos de indacaterol e indacaterol hidroxilado. Se identificaron, asimismo, otros metabolitos, un diastereómero del derivado hidroxilado, un N-glucurónido de indacaterol, y productos C- y N-desalquilados.
Los estudios in vitro indicaron que la UGT1A1 es el único isoformo de la UGT que metabolizó el indacaterol al O-glucurónido fenólico. Se hallaron metabolitos oxidativos en incubaciones con CYP1A1, CYP2D6, y CYP3A4 recombinantes. Se concluyó que CYP3A4 es la principal isoenzima responsable de la hidroxilación del indacaterol. Otros estudios in vitro indicaron que el indacaterol es un sustrato de baja afinidad de la bomba de flujo P-gp.
Eliminación
En los ensayos clínicos en los que se recogieron muestras de orina, la cantidad de indacaterol que se excretaba inalterado en la orina fue generalmente inferior al 2% de la dosis. El aclaramiento renal de indacaterol estuvo comprendido, en promedio, entre 0,46 y 1,20 litros/hora. Comparado con el aclaramiento sérico de indacaterol de 23,3 litros/hora, es evidente que el aclaramiento renal desempeña un papel menor (aproximadamente entre el 2 y el 5% del aclaramiento sistémico) en la eliminación del indacaterol disponible sistémicamente.
En un ensayo ADME en humanos en el que indacaterol se administró vía oral, predominó la vía de excreción fecal sobre la urinaria. El indacaterol se excretó principalmente en las heces humanas como fármaco original inalterado (54% de la dosis) y, en menor grado, como metabolitos de indacaterol hidroxilado (23% de la dosis). El balance de masas fue completo con >90% de la dosis recuperada en la excreta.
Las concentraciones séricas de indacaterol descendieron de manera multifásica con una semivida terminal media comprendida entre 45,5 y 126 horas. La semivida efectiva, calculada a partir de la acumulación de indacaterol tras dosis repetidas osciló entre 40 y 52 horas lo cual es consistente con el tiempo observado para alcanzar el estado estacionario de aproximadamente 12-14 días.
Poblaciones especiales
Un análisis farmacocinético de la población mostró que no existe un efecto clínicamente relevante de la edad (adultos hasta 88 años), sexo, peso (32-168 kg) o raza sobre la farmacocinética de indacaterol. No indicó ninguna diferencia entre subgrupos étnicos en esta población.
Los pacientes con insuficiencia hepática leve o moderada no mostraron cambios relevantes en la Cmax o AUC de indacaterol, ni la unión a proteínas difirió entre dichos pacientes y sus controles sanos. No se realizaron ensayos en sujetos con insuficiencia hepática grave.
Debido a la muy escasa contribución de la vía renal a la eliminación total del organismo, no se realizó un ensayo en sujetos con insuficiencia renal.
5.3 Datos preclínicos sobre seguridad
Los efectos sobre el sistema cardiovascular atribuibles a las propiedades agonistas beta2 de indacaterol incluyeron taquicardia, arritmias y lesiones miocárdicas en perros. En roedores se observó una leve irritación de las fosas nasales y laringe. Todos estos hallazgos se observaron con exposiciones suficientemente superiores a las esperadas en humanos.
Aunque el indacaterol no afectó a la capacidad reproductora general en un estudio de fertilidad en ratas, se observó un descenso en el número de descendientes de la progenie F1 en un estudio peri y post-desarrollo a una exposición 14 veces más elevada que en humanos tratados con Hirobriz Breezhaler. Indacaterol no fue embriotóxico o teratogénico en ratas o conejos.
Los estudios de genotoxicidad no revelaron ningún poder mutagénico o clastógenico. Se evaluó la carcinogenicidad en un estudio de dos años en ratas y en un estudio transgénico de seis meses en ratones. El aumento de la incidencia de leiomiomas de ovarios benignos e hiperplasia focal del músculo liso de ovarios en ratas fue consistente con hallazgos similares observados con otros agonistas beta2-adrenérgicos. No se observó evidencia de carcinogenicidad en ratones. En estos estudios, las exposiciones sistémicas (AUC) en ratas y ratones a niveles de efecto adverso no observable fueron como mínimo 7 y 49 veces superiores, respectivamente, a las observadas en humanos tratados con Hirobriz Breezhaler una vez al día a la dosis de 300 microgramos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula Lactosa monohidrato
Cubierta de la cápsula Gelatina
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 2 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
Conservar en el blister para protegerlo de la humedad y extraer solo inmediatamente antes de usar.
6.5 Naturaleza y contenido del envase
Hirobriz Breezhaler es un dispositivo para inhalación de dosis única. El cuerpo del inhalador y el capuchón están fabricados con acrilonitrilo butadieno estireno, los pulsadores están fabricados con metil metacrilato acrilonitrilo butadieno estireno. Las agujas y muelles son de acero inoxidable.
Blister de PA/Alu/PVC - Alu, que contiene 10 cápsulas duras.
Cartonaje conteniendo 10 cápsulas y un inhalador de Hirobriz Breezhaler.
Cartonaje conteniendo 30 cápsulas y un inhalador de Hirobriz Breezhaler.
Envase múltiple que contiene 2 envases (cada uno conteniendo 30 cápsulas y 1 inhalador).
Envase múltiple que contiene 3 envases (cada uno conteniendo 30 cápsulas y 1 inhalador).
Envase múltiple que contiene 30 envases (cada uno conteniendo 10 cápsulas y 1 inhalador).
Puede que solamente estén comercializados algunos tamaños de envases.
Cada inhalador se debe desechar después de 30 días de uso.
Instrucciones de uso y manipulación
Retire el capuchón.
Abra el inhalador:
Sujete firmemente la base del inhalador e incline la boquilla. De esta manera se abrirá el inhalador.
Prepare la cápsula:
Justo antes de usar, con las manos secas, extraiga una cápsula del blister.
Introduzca la cápsula:
Introduzca la cápsula en el compartimiento para la cápsula.
No coloque nunca una cápsula directamente en la boquilla.
y

Cierre el inhalador:
Cierre el inhalador hasta que oiga un “clic”.
Perfore la cápsula:
• Sujete el inhalador en posición vertical con la boquilla hacia arriba.
• Perfore la cápsula presionando firmemente ambos pulsadores al mismo tiempo. Realice esta operación solo una vez.
• Deberá oír un “click” en el momento en que se perfore la cápsula.
Suelte completamente los pulsadores.
Espire:
Antes de introducir la boquilla en su boca, espire completamente.
No sople dentro de la boquilla.
|
□ 1 |
Inhale el medicamento Para inhalar el medicamento profundamente en sus vías respiratorias: • Sujete el inhalador como se muestra en la figura. Los pulsadores deben quedar situados a la derecha e izquierda. No presione los pulsadores. • Introduzca la boquilla en su boca y cierre los labios firmemente en torno a ella. • Inspire de forma rápida y constante y tan profundamente como pueda. | ||
|
0 ( 1 ' |
Nota: Cuando inspire a través del inhalador, la cápsula girará en la cámara y usted deberá oír un zumbido. Notará un gusto dulce cuando el medicamento penetre en sus pulmones. Información adicional Ocasionalmente, fragmentos muy pequeños de la cápsula pueden atravesar el filtro e introducirse en su boca. Si esto ocurre, puede notar estos fragmentos en su lengua. No es perjudicial si estos fragmentos se tragan o inhalan. La posibilidad de que la cápsula se fragmente aumenta si la cápsula se perfora accidentalmente más de una vez (paso 6). Si no oye un zumbido: La cápsula puede estar atascada en el compartimiento. Si esto ocurre: • Abra el inhalador y libere la cápsula con cuidado dando golpecitos en la base del mismo. No presione los pulsadores. • Inhale el medicamento de nuevo repitiendo los pasos 8 y 9. |
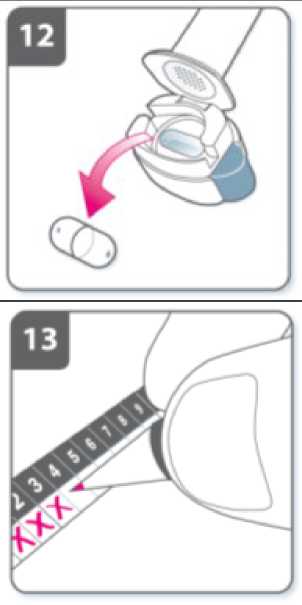
Contenga la respiración:
Después de que haya inhalado el medicamento:
• Contenga la respiración durante un mínimo de 5-10 segundos o todo lo posible mientras no le resulte incomodo, al tiempo que extrae el inhalador de la boca.
• Seguidamente espire.
• Abra el inhalador para comprobar si queda polvo en la cápsula.
Si queda polvo en la cápsula:
• Cierre el inhalador.
• Repita los pasos 8, 9, 10 y 11.
La mayoría de las personas son capaces de vaciar
la cápsula en una o dos inhalaciones.
Información adicional
Algunas personas ocasionalmente pueden toser al poco de inhalar el medicamento. En caso de que le ocurra, no se preocupe. Si la cápsula está vacía, es que ha recibido suficiente cantidad de su
medicamento._
Después de que haya acabado de tomar su medicamento:
• Abra de nuevo la boquilla, y elimine la cápsula vacía extrayéndola del compartimiento de la cápsula. Coloque la cápsula vacía en la basura de su casa.
• Cierre el inhalador y coloque de nuevo el capuchón.
No conserve las cápsulas en el inhalador de
Hirobriz Breezhaler._
Marque en el registro de dosis diaria:
En el interior del envase hay un registro de dosis diaria. Coloque una marca en el recuadro de hoy si le ayuda a recordar cuando le toca la siguiente dosis.
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/594/006-010
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 30 Noviembre 2009 Fecha de la última renovación: 02 Diciembre 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Nombre y dirección del fabricante responsable de la liberación de los lotes
Novartis Pharma GmbH Roonstrasse 25 D-90429 Nuremberg Alemania
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
• Medidas adicionales de minimización de riesgos
El Titular de la Autorización de Comercialización (TAC) debe asegurar, que en el momento del lanzamiento, a los médicos que se espera prescriban/usen Hirobriz Breezhaler y a los farmacéuticos se les proporcione una tarjeta informativa que contenga los siguientes elementos:
- Está indicado para el tratamiento broncodilatador de mantenimiento de la obstrucción de las vías respiratorias en pacientes adultos con EPOC.
- Hirobriz Breezhaler no debe utilizarse en asma debido a la ausencia de datos sobre resultados a largo plazo de Hirobriz Breezhaler en esta indicación.
- La dosis recomendada consiste en la inhalación del contenido de una cápsula de
150 microgramos una vez al día, utilizando el inhalador de Hirobriz Breezhaler. La dosis sólo debe aumentarse por prescripción facultativa.
Todos los materiales harán referencia a la ficha técnica o resumen de las características del producto para la información completa.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Hirobriz Breezhaler 150 microgramos polvo para inhalación (cápsula dura) Indacaterol
Cada cápsula contiene maleato de indacaterol equivalente a 150 microgramos de indacaterol.
Contiene lactosa (para mayor información, consultar el prospecto) y gelatina.
Polvo para inhalación (cápsula dura)
10 cápsulas + 1 inhalador 30 cápsulas + 1 inhalador
Vía inhalatoria No trague las cápsulas.
Utilizar únicamente con el inhalador que se proporciona en el envase. Leer el prospecto antes de utilizar este medicamento.
Levante aquí para abrir.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30°C.
Conservar en el blister original para protegerlo de la humedad y no extraer hasta justo antes de usar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/594/001 10 cápsulas + 1 inhalador
EU/1/09/594/002 30 cápsulas + 1 inhalador
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Hirobriz Breezhaler 150
Hirobriz Breezhaler 150 microgramos polvo para inhalación (cápsula dura) Indacaterol
Cada cápsula contiene maleato de indacaterol equivalente a 150 microgramos de indacaterol.
Contiene lactosa (para mayor información, consultar el prospecto) y gelatina.
Polvo para inhalación (cápsula dura)
Envase múltiple: 60 (2 envases de 30 cápsulas y 1 inhalador). Envase múltiple: 90 (3 envases de 30 cápsulas y 1 inhalador). Envase múltiple: 300 (30 envases de 10 cápsulas y 1 inhalador).
Vía inhalatoria No trague las cápsulas.
Utilizar únicamente con el inhalador que se proporciona en el envase. Leer el prospecto antes de utilizar este medicamento.
Levante aquí para abrir.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30°C.
Conservar en el blister original para protegerlo de la humedad y no extraer hasta justo antes de usar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
EU/1/09/594/003
EU/1/09/594/004
EU/1/09/594/005
60 cápsulas + 2 inhaladores 90 cápsulas + 3 inhaladores 300 cápsulas + 30 inhaladores
Lote
Medicamento sujeto a prescripción médica.
Hirobriz Breezhaler 150
Hirobriz Breezhaler 150 microgramos polvo para inhalación (cápsula dura) Indacaterol
Cada cápsula contiene maleato de indacaterol equivalente a 150 microgramos de indacaterol.
Contiene lactosa (para mayor información, consultar el prospecto) y gelatina.
Polvo para inhalación (cápsula dura)
10 cápsulas y 1 inhalador. Componente de un envase múltiple. Prohibida su venta por separado. 30 cápsulas y 1 inhalador. Componente de un envase múltiple. Prohibida su venta por separado.
Vía inhalatoria No trague las cápsulas.
Utilizar únicamente con el inhalador que se proporciona en el envase. Leer el prospecto antes de utilizar este medicamento.
Levante aquí para abrir.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30°C.
Conservar en el blister original para protegerlo de la humedad y no extraer hasta justo antes de usar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
EU/1/09/594/003
EU/1/09/594/004
EU/1/09/594/005
60 cápsulas + 2 inhaladores 90 cápsulas + 3 inhaladores 300 cápsulas + 30 inhaladores
Lote
Medicamento sujeto a prescripción médica.
Hirobriz Breezhaler 150
TAPA INTERIOR DEL CARTONAJE EXTERIOR DEL ENVASE UNITARIO Y DEL CARTONAJE INTERMEDIO DEL ENVASE MÚLTIPLE
1. OTROS
Hirobriz BreezhalerConsultar el prospecto para saber cómo usar este medicamento. Fecha de inicio
BLÍSTERS
1. NOMBRE DEL MEDICAMENTO
Hirobriz Breezhaler 150 microgramos polvo para inhalación (cápsula dura) Indacaterol
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
Únicamente para vía inhalatoria. No tragar.
Hirobriz Breezhaler 300 microgramos polvo para inhalación (cápsula dura) Indacaterol
Cada cápsula contiene maleato de indacaterol equivalente a 300 microgramos de indacaterol.
Contiene lactosa (para mayor información, consultar el prospecto) y gelatina.
Polvo para inhalación (cápsula dura)
10 cápsulas + 1 inhalador 30 cápsulas + 1 inhalador
Vía inhalatoria No trague las cápsulas.
Utilizar únicamente con el inhalador que se proporciona en el envase. Leer el prospecto antes de utilizar este medicamento.
Levante aquí para abrir.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30°C.
Conservar en el blister original para protegerlo de la humedad y no extraer hasta justo antes de usar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/594/006 10 cápsulas + 1 inhalador
EU/1/09/594/007 30 cápsulas + 1 inhalador
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Hirobriz Breezhaler 300
Hirobriz Breezhaler 300 microgramos polvo para inhalación (cápsula dura) Indacaterol
Cada cápsula contiene maleato de indacaterol equivalente a 300 microgramos de indacaterol.
Contiene lactosa (para mayor información, consultar el prospecto) y gelatina.
Polvo para inhalación (cápsula dura)
Envase múltiple: 60 (2 envases de 30 cápsulas y 1 inhalador). Envase múltiple: 90 (3 envases de 30 cápsulas y 1 inhalador). Envase múltiple: 300 (30 envases de 10 cápsulas y 1 inhalador).
Vía inhalatoria No trague las cápsulas.
Utilizar únicamente con el inhalador que se proporciona en el envase. Leer el prospecto antes de utilizar este medicamento.
Levante aquí para abrir.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30°C.
Conservar en el blister original para protegerlo de la humedad y no extraer hasta justo antes de usar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
EU/1/09/594/008
EU/1/09/594/009
EU/1/09/594/010
60 cápsulas + 2 inhaladores 90 cápsulas + 3 inhaladores 300 cápsulas + 30 inhaladores
Lote
Medicamento sujeto a prescripción médica.
Hirobriz Breezhaler 300
Hirobriz Breezhaler 300 microgramos polvo para inhalación (cápsula dura) Indacaterol
Cada cápsula contiene maleato de indacaterol equivalente a 300 microgramos de indacaterol.
Contiene lactosa (para mayor información, consultar el prospecto) y gelatina.
Polvo para inhalación (cápsula dura)
10 cápsulas y 1 inhalador. Componente de un envase múltiple. Prohibida su venta por separado. 30 cápsulas y 1 inhalador. Componente de un envase múltiple. Prohibida su venta por separado.
Vía inhalatoria No trague las cápsulas.
Utilizar únicamente con el inhalador que se proporciona en el envase. Leer el prospecto antes de utilizar este medicamento.
Levante aquí para abrir.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30°C.
Conservar en el blister original para protegerlo de la humedad y no extraer hasta justo antes de usar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
EU/1/09/594/008
EU/1/09/594/009
EU/1/09/594/010
60 cápsulas + 2 inhaladores 90 cápsulas + 3 inhaladores 300 cápsulas + 30 inhaladores
Lote
Medicamento sujeto a prescripción médica.
Hirobriz Breezhaler 300
TAPA INTERIOR DEL CARTONAJE EXTERIOR DEL ENVASE UNITARIO Y DEL CARTONAJE INTERMEDIO DEL ENVASE MÚLTIPLE
1. OTROS
Hirobriz BreezhalerConsultar el prospecto para saber cómo usar este medicamento. Fecha de inicio
BLÍSTERS
1. NOMBRE DEL MEDICAMENTO
Hirobriz Breezhaler 300 microgramos polvo para inhalación (cápsula dura) Indacaterol
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
Únicamente para vía inhalatoria. No tragar.
B. PROSPECTO
Hirobriz Breezhaler 150 microgramos polvo para inhalación (cápsula dura) Hirobriz Breezhaler 300 microgramos polvo para inhalación (cápsula dura)
Indacaterol
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Hirobriz Breezhaler y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Hirobriz Breezhaler
3. Cómo usar Hirobriz Breezhaler
4. Posibles efectos adversos
5. Conservación de Hirobriz Breezhaler
6. Contenido del envase e información adicional
1. Qué es Hirobriz Breezhaler y para qué se utiliza Qué es Hirobriz Breezhaler
paredes
haciendo
Hirobriz Breezhaler contiene el principio activo indacaterol el cual pertenece a un grupo de medicamentos denominados broncodilatadores. Cuando lo inhala, relaja los músculos de las de los pequeños conductos de aire de los pulmones. Esto ayuda a abrir las vías respiratorias, más fácil la entrada y salida del aire.
Para qué se utiliza Hirobriz Breezhaler
Hirobriz Breezhaler se utiliza para facilitar la respiración de los pacientes adultos que tienen dificultades para respirar debido a una enfermedad pulmonar denominada enfermedad pulmonar obstructiva crónica (EPOC). En la EPOC, los músculos que rodean a las vías respiratorias se contraen, lo cual dificulta la respiración. Este medicamento relaja dichos músculos en los pulmones, facilitando la entrada y salida de aire de los mismos.
2. Qué necesita saber antes de empezar a usar Hirobriz Breezhaler No use Hirobriz Breezhaler
- si es alérgico a indacaterol o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar Hirobriz Breezhaler
- si tiene asma (en este caso no debe utilizar Hirobriz Breezhaler).
- si tiene problemas de corazón.
- si tiene epilepsia.
- si tiene problemas de la glándula del tiroides (tirotoxicosis).
- si tiene diabetes.
Durante el tratamiento con Hirobriz Breezhaler,
- Interrumpa el uso del medicamento e informe a su médico inmediatamente si nota opresión en el pecho, tos, respiración jadeante o dificultad para respirar inmediatamente después de usar el medicamento. Estos pueden ser signos de un estado denominado broncoespasmo.
- Informe a su médico inmediatamente si sus síntomas de la EPOC (dificultad para respirar, respiración jadeante, tos) no mejoran o empeoran.
Niños y adolescentes
Hirobriz Breezhaler no se debe administrar a niños o adolescentes menores de 18 años de edad.
Uso de Hirobriz Breezhaler con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que
utilizar cualquier otro medicamento.
Especialmente, informe a su médico si está usando:
- medicamentos para problemas respiratorios que son similares a Hirobriz Breezhaler (es decir, medicamentos como salmeterol y formoterol). Puede ser más probable que tenga efectos adversos.
- medicamentos denominados betabloqueantes que se utilizan para la presión sanguínea elevada u otros problemas del corazón (como es propranolol), o para un problema de los ojos denominado glaucoma (como es timolol).
- medicamentos que disminuyen la cantidad de potasio en la sangre. Estos incluyen: o corticoides (p.ej. prednisolona),
o diuréticos utilizados para la presión sanguínea elevada, como la hidroclorotiacida, o medicamentos para problemas respiratorios como es la teofilina.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de
quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
No debe utilizar Hirobriz Breezhaler a no ser que su médico se lo indique.
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
No es probable que Hirobriz Breezhaler afecte a su capacidad para conducir y utilizar máquinas.
Hirobriz Breezhaler contiene lactosa
Este medicamento contiene lactosa (azúcar de la leche). Si su médico le ha indicado que padece una
intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo usar Hirobriz Breezhaler
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
Cantidad de Hirobriz Breezhaler que debe usar
- La dosis habitual es inhalar el contenido de una cápsula cada día. Su médico le indicará si debe usar la cápsula de 150 microgramos o la cápsula de 300 microgramos dependiendo de su estado y de como responde al tratamiento. No use más de la cantidad indicada por su médico.
- Use su inhalador en el mismo momento cada día, los efectos duran durante 24 horas. Esto asegura que siempre haya suficiente medicamento en su organismo para ayudarle a respirar más fácilmente a lo largo del día y de la noche. Asimismo, le ayudará a recordar su uso.
Cómo usar Hirobriz Breezhaler
- En este envase, encontrará un inhalador y cápsulas (en blister) que contienen el medicamento en polvo para inhalación. El inhalador de Hirobriz Breezhaler le permitirá inhalar el medicamento contenido en una cápsula.
- Utilice las cápsulas únicamente con el inhalador que se proporciona en este envase (inhalador de Hirobriz Breezhaler). Las cápsulas deben mantenerse en el blister hasta que necesite utilizarlas.
- Cuando inicie un nuevo envase, use el nuevo inhalador de Hirobriz Breezhaler que se proporciona en el envase.
- Deseche el inhalador después de 30 días de uso.
- No trague las cápsulas.
- Para más información acerca de cómo usar el inhalador, lea las instrucciones al final de este prospecto.
Si usa más Hirobriz Breezhaler del que debe
Si ha inhalado demasiado Hirobriz Breezhaler o si alguien usa sus cápsulas, informe a su médico inmediatamente o vaya al centro de urgencias más cercano. Muestre el envase de Hirobriz Breezhaler. Puede ser necesaria atención médica. Puede notar que su corazón late más deprisa de lo normal, o puede tener dolor de cabeza, sentir somnolencia, náuseas o tener vómitos.
Si olvidó usar Hirobriz Breezhaler
Si olvidó inhalar una dosis, inhale una justo a la hora habitual el día siguiente. No inhale una dosis doble para compensar las dosis olvidadas.
Cuanto tiempo debe continuar su tratamiento con Hirobriz Breezhaler
- Continúe usando su tratamiento con Hirobriz Breezhaler durante el tiempo que su médico le indique.
- La EPOC es una enfermedad de larga duración y usted debe utilizar Hirobriz Breezhaler cada día y no solo cuando tenga problemas respiratorios u otros síntomas de EPOC.
Consulte a su médico o farmacéutico, si tiene dudas acerca de cuanto tiempo debe continuar su tratamiento con Hirobriz Breezhaler.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Algunos efectos adversos pueden ser graves. Informe a su médico inmediatamente
• si tiene un dolor opresor en el pecho (frecuente).
• si tiene niveles elevados de azúcar en sangre (diabetes). Se sentirá cansado, muy sediento y hambriento (sin aumentar el peso) y orinará más de lo normal (frecuente).
• si tiene latidos del corazón irregulares (poco frecuente).
• si tiene síntomas de una reacción alérgica como son erupción cutánea, picor, urticaria, dificultad para respirar o tragar, mareo (poco frecuente).
• si tiene dificultad para respirar con silbidos o tos (poco frecuente).
Otros efectos adversos pueden incluir:
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 pacientes)
• síntomas de tipo gripal. Usted puede tener todos o la mayoría de los siguientes efectos: dolor de garganta, goteo nasal, nariz tapada, estornudos, tos, dolor de cabeza.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 pacientes)
• sensación de dolor o presión en las mejillas y frente (inflamación de los senos)
• goteo de nariz
• tos
• dolor de garganta
• dolor de cabeza
• mareo
• palpitaciones
• espasmo muscular
• manos, tobillos y pies hinchados (edema)
• picor/erupción cutánea
• dolor en el pecho
• dolor en los músculos, huesos o articulaciones
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes)
• latido rápido del corazón
• hormigueo o entumecimiento
• dolor muscular
Algunas personas ocasionalmente pueden toser al poco de inhalar el medicamento. La tos es un síntoma común en EPOC. Si usted experimenta tos poco después de inhalar el medicamento, no se preocupe. Compruebe su inhalador para ver si la cápsula está vacía y que usted haya recibido la dosis completa. Si la cápsula está vacía, no hay necesidad de preocupación. Si la cápsula no está vacía inhale de nuevo como se indica.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Hirobriz Breezhaler
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en el blister después de “EXP”. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad y no extraer hasta justo antes de usar.
No utilice este medicamento si observa que el envase está dañado o muestra indicios de deterioro.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Composición de Hirobriz Breezhaler
- Cada cápsula de 150 microgramos de Hirobriz Breezhaler contiene 150 microgramos de indacaterol como maleato de indacaterol. Los demás componentes incluyen lactosa y la cápsula de gelatina.
- Cada cápsula de 300 microgramos de Hirobriz Breezhaler contiene 300 microgramos de indacaterol como maleato de indacaterol. Los demás componentes incluyen lactosa y la cápsula de gelatina.
Aspecto de Hirobriz Breezhaler y contenido del envase
En este envase, podrá encontrar un inhalador, junto con cápsulas en blister. Las cápsulas son transparentes (incoloras) y contienen un polvo blanco.
- Las cápsulas de 150 microgramos de Hirobriz Breezhaler tienen un código de producto "IDL 150” impreso en negro por encima de una línea negra y el logotipo de la compañía (f'>) impreso en negro por debajo de la misma.
- Las cápsulas de 300 microgramos de Hirobriz Breezhaler tienen un código de producto "IDL 300” impreso en azul por encima de una línea azul y el logotipo de la compañía ({■■>) impreso en azul por debajo de la misma.
Están disponibles los siguientes tamaños de envase:
Cartonaje conteniendo 10 cápsulas y 1 inhalador.
Cartonaje conteniendo 30 cápsulas y 1 inhalador.
Envase múltiple que contiene 2 envases (cada uno conteniendo 30 cápsulas y 1 inhalador).
Envase múltiple que contiene 3 envases (cada uno conteniendo 30 cápsulas y 1 inhalador).
Envase múltiple que contiene 30 envases (cada uno conteniendo 10 cápsulas y 1 inhalador).
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
Responsable de la fabricación
Novartis Pharma GmbH RoonstraBe 25 D-90429 Nuremberg Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Lietuva Novartis Pharma Services Inc. Tel: +370 5 269 16 50 |
|
Etarapun Novartis Pharma Services Inc. Tea.: +359 2 489 98 28 |
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
|
Ceská republika Novartis s.r.o. Tel: +420 225 775 111 |
Magyarország Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00 |
|
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 |
Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
|
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 |
Nederland Novartis Pharma B.V. Tel: +31 26 37 82 111 |
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EXXáda Novartis (Hellas) A.E.B.E. Tni: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
España Laboratorios Farmacéuticos ROVI, S.A. Tel.: +34 91 375 62 30 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmacéuticos, S.A Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Romania Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
Italia
Chiesi Farmaceutici S.p.A. Tel: +39 05 21 27 91
Kúrcpog
Novartis Pharma Services Inc. Tr(k: +357 22 690 690
Latvija
Novartis Pharma Services Inc. Tel: +371 67 887 070
Suomi/Finland
Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200
Sverige
Novartis Sverige AB Tel: +46 8 732 32 00
United Kingdom
Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
INSTRUCCIONES DE USO DEL INHALADOR DE HIROBRIZ BREEZHALER
Lea detenidamente las siguientes instrucciones para aprender a usar y cuidar de su inhalador de Hirobriz Breezhaler.
• Utilice únicamente el inhalador de Hirobriz Breezhaler contenido en este envase. No
utilice las cápsulas de Hirobriz Breezhaler con ningún otro inhalador, y no utilice el inhalador de Hirobriz Breezhaler para tomar cualquier otro medicamento en cápsulas.
• Cuando inicie un nuevo envase, utilice únicamente el nuevo inhalador de Hirobriz Breezhaler que se proporciona en el envase.
• Deseche el inhalador después de 30 días de uso.
• Pregunte a su farmacéutico cómo deshacerse de los medicamentos y de los inhaladores que no necesita.
• No trague las cápsulas. El polvo de las cápsulas es para que lo inhale.
Su envase de Hirobriz Breezhaler:
Cada envase de Hirobriz Breezhaler contiene:
- Un inhalador de Hirobriz Breezhaler
- Uno o más blisters conteniendo cápsulas de Hirobriz Breezhaler para utilizar con el inhalador.
El inhalador de Hirobriz Breezhaler le permite inhalar el medicamento contenido en una cápsula de Hirobriz Breezhaler.
Capuchón
Boquilla
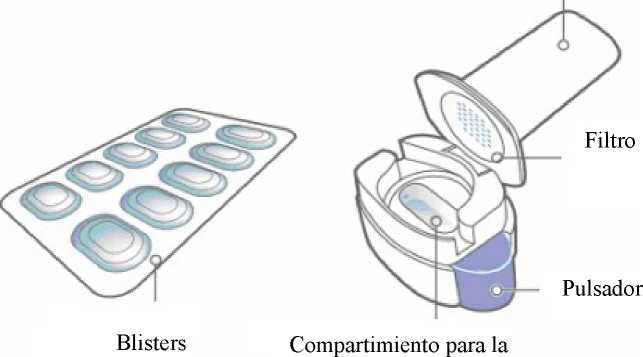
cápsula
Inhalador de Hirobriz Tira de blister Base del inhalador
Breezhaler

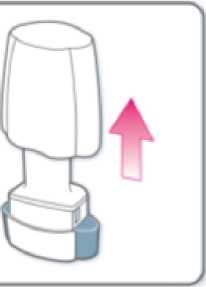
Retire el capuchón.
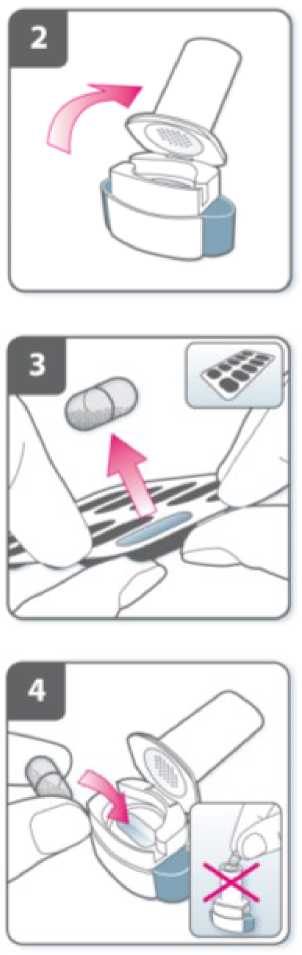
Abra el inhalador:
Sujete firmemente la base del inhalador e incline la boquilla. De esta manera se abrirá el inhalador.
Prepare la cápsula:
Justo antes de usar, con las manos secas, extraiga una cápsula del blister.
Introduzca la cápsula:
Introduzca la cápsula en el compartimiento para la cápsula.
No coloque nunca una cápsula directamente en la boquilla.

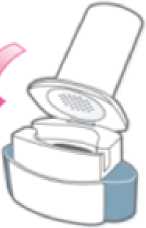
Cierre el inhalador:
Cierre el inhalador hasta que oiga un “clic”.


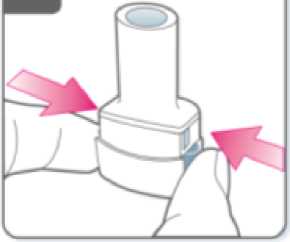
Perfore la cápsula:
• Sujete el inhalador en posición vertical con la boquilla hacia arriba.
• Perfore la cápsula presionando firmemente ambos pulsadores al mismo tiempo. Realice esta operación solo una vez.
• Deberá oír un “click” en el momento en que se perfore la cápsula.
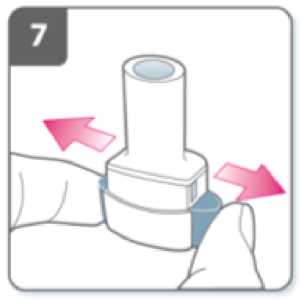
Suelte completamente los pulsadores.
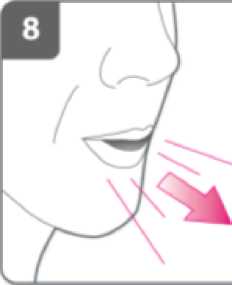

Espire:
Antes de introducir la boquilla en su boca, espire completamente.
No sople dentro de la boquilla.
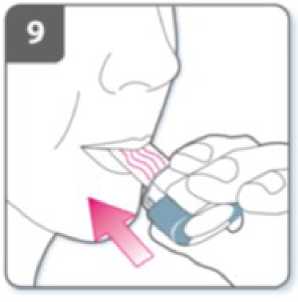
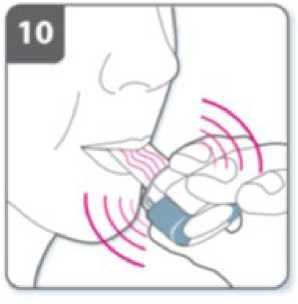
Inhale el medicamento
Para inhalar el medicamento profundamente en sus vías
respiratorias:
• Sujete el inhalador como se muestra en la figura. Los pulsadores deben quedar situados a la derecha e izquierda. No presione los pulsadores.
• Introduzca la boquilla en su boca y cierre los labios firmemente en torno a ella.
• Inspire de forma rápida y constante y tan profundamente como pueda.
Nota:
Cuando inspire a través del inhalador, la cápsula girará en la cámara y usted deberá oír un zumbido. Notará un gusto dulce cuando el medicamento penetre en sus pulmones.
Información adicional
Ocasionalmente, fragmentos muy pequeños de la cápsula pueden atravesar el filtro e introducirse en su boca. Si esto ocurre, puede notar estos fragmentos en su lengua. No es perjudicial si estos fragmentos se tragan o inhalan. La posibilidad de que la cápsula se fragmente aumenta si la cápsula se perfora accidentalmente más de una vez (paso 6).
Si no oye un zumbido:
La cápsula puede estar atascada en el compartimiento. Si esto ocurre:
• Abra el inhalador y libere la cápsula con cuidado dando golpecitos en la base del mismo. No presione los pulsadores.
• Inhale el medicamento de nuevo repitiendo los pasos 8 y 9.
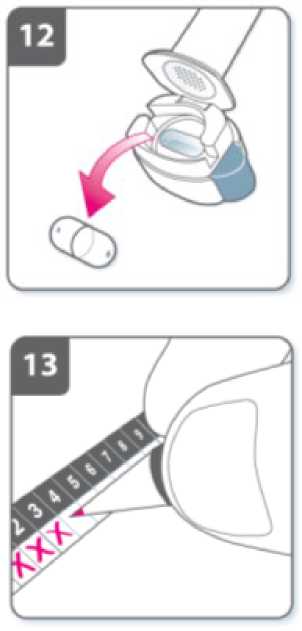
Contenga la respiración:
Después de que haya inhalado el medicamento:
• Contenga la respiración durante un mínimo de
5-10 segundos o todo lo posible mientras no le resulte incomodo, al tiempo que extrae el inhalador de la boca.
• Seguidamente espire.
• Abra el inhalador para comprobar si queda polvo en la cápsula.
Si queda polvo en la cápsula:
• Cierre el inhalador.
• Repita los pasos 8, 9, 10 y 11.
La mayoría de las personas son capaces de vaciar la cápsula en una o dos inhalaciones.
Información adicional
Algunas personas ocasionalmente pueden toser al poco de inhalar el medicamento. En caso de que le ocurra, no se preocupe. Si la cápsula está vacía, es que ha recibido suficiente cantidad de su medicamento.
Después de que haya acabado de tomar su medicamento:
• Abra de nuevo la boquilla, y elimine la cápsula vacía extrayéndola del compartimiento de la cápsula. Coloque la cápsula vacía en la basura de su casa.
• Cierre el inhalador y coloque de nuevo el capuchón.
No conserve las cápsulas en el inhalador de Hirobriz Breezhaler.
Marque en el registro de dosis diaria:
En el interior del envase hay un registro de dosis diaria. Coloque una marca en el recuadro de hoy si le ayuda a recordar cuando le toca la siguiente dosis.
RECUERDE:
- No trague las cápsulas de Hirobriz Breezhaler.
- Utilice únicamente el inhalador de Hirobriz Breezhaler contenido en este envase.
- Las cápsulas de Hirobriz Breezhaler deben conservarse siempre en el blister, y extraerlas solo inmediatamente antes de usar.
- No coloque nunca una cápsula de Hirobriz Breezhaler directamente en la boquilla del inhalador de Hirobriz Breezhaler.
- No presione los pulsadores más de una vez.
- No sople nunca en la boquilla del inhalador de Hirobriz Breezhaler.
- Suelte siempre los pulsadores antes de inhalar.
- No lave nunca el inhalador de Hirobriz Breezhaler con agua. Manténgalo seco. Ver “Cómo limpiar el inhalador”.
- No desmonte nunca el inhalador de Hirobriz Breezhaler.
- Utilice siempre el nuevo inhalador de Hirobriz Breezhaler que viene incluido en cada nuevo envaseHirobriz Breezhaler. Deseche el inhalador después de 30 días de uso.
- No conserve las cápsulas en el inhalador de Hirobriz Breezhaler.
- Mantenga siempre el inhalador y las cápsulas de Hirobriz Breezhaler en un lugar seco.
Cómo limpiar el inhalador
Limpie el inhalador una vez a la semana.
- Frote la boquilla por dentro y por fuera con un paño limpio y seco que no deje pelusa para eliminar los restos de polvo.
- No lave nunca el inhalador con agua. Manténgalo seco.
- No desmonte el inhalador.
69
Se han recibido informes de hipersensibilidad tras la experiencia de comercialización postautorización, en asociación con el uso de Hirobriz Breezhaler. Estos fueron notificados voluntariamente por una población de tamaño incierto, por lo tanto, no siempre es posible estimar la frecuencia de forma fidedigna o establecer una relación causal con el medicamento. Por lo tanto, la frecuencia se calculó a partir de la experiencia en los ensayos clínicos.
Con 600 microgramos una vez al día, el perfil de seguridad de Hirobriz Breezhaler resultó similar al de las dosis recomendadas. Una reacción adversa adicional fue temblor (frecuente).
Descripción de las reacciones adversas seleccionadas
En los ensayos clínicos fase III, los profesionales sanitarios observaron que durante las visitas, una media del 17-20% de los pacientes presentaba una tos esporádica que solía aparecer en los 15 segundos posteriores a la inhalación y duraba generalmente 5 segundos (aproximadamente 10 segundos en fumadores). Se observó con mayor frecuencia en mujeres que en hombres y en fumadores que en ex-fumadores. Esta tos que aparecía tras la inhalación no obligó a ningún paciente a discontinuar el ensayo con las dosis recomendadas (la tos es un síntoma de la EPOC y únicamente el 8,2% de los pacientes describieron la tos como reacción adversa). No existe evidencia de que la tos que aparece tras la inhalación se asocie al broncoespasmo, exacerbaciones, empeoramiento de la enfermedad o pérdida de eficacia.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
En pacientes con EPOC, dosis únicas 10 veces superiores a la dosis terapéutica máxima recomendada se asociaron con un aumento moderado de la frecuencia del pulso, la presión sanguínea sistólica y el intervalo QTc.
Es probable que una sobredosis de indacaterol cause exageradamente los efectos típicos de los estimulantes beta2-adrenérgicos, es decir, taquicardia, temblor, palpitaciones, cefalea, náuseas, vómitos, mareo, arritmias ventriculares, acidosis metabólica, hipocaliemia e hiperglucemia.
Edema periférico_