Hidrocloruro De Efedrina Aguettant 3 Mg/Ml, Solucion Inyectable En Jeringas Precargadas
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Hidrocloruro de Efedrina Aguettant 3 mg/ml solución inyectable en jeringas precargadas
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de solución para inyección contiene 3 mg de hidrocloruro de efedrina, equivalentes a 2,46 mg de efedrina.
Cada 10 ml de jeringa precargada contiene 30 mg de clorhidrato de efedrina, equivalentes a 24,6 mg de efedrina.
Excipientes con efecto conocido:
Este medicamento contiene sodio.
Cada mililitro de solución para inyección contiene 3,32 mg equivalentes a 0,144 mmol de sodio.
Cada jeringa precargada con 10 ml contiene 33,2 mg equivalentes a 1,44 mmol de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución para inyección.
Líquido transparente, incoloro pH = entre 4,5 y 5,5
Osmolaridad: entre 270 - 300 mOsm/kg
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de la hipotensión por anestesia epidural o espinal.
4.2 Posología y forma de administración
4.2.1 Posología
Adultos
Inyección lenta intravenosa de 3 a 6 mg (un máximo de 9 mg), repetida cada 3-4 minutos en función de las necesidades, hasta un máximo de 30 mg. La falta de eficacia tras 30 mg debería llevar a reconsiderar la opción del fármaco.
La dosis administrada no debe exceder los 150 mg durante 24 horas.
Población pediátrica
Hidrocloruro de Efedrina 3 mg/ml, solución inyectable en jeringa precargada no está generalmente recomendada para el uso en niños debido a datos insuficientes de eficacia, seguridad y recomendaciones de dosificación.
• Niños menores de 12 años
La seguridad y eficacia de la Efedrina en pacientes pediátricos menores de 12 años no ha sido establecida. No hay datos disponibles.
• Niños mayores de 12 años
La posología y método de administración es el mismo que en adultos.
Pacientes con disfunción renal o hepática
No hay ajuste de la dosis recomendada para pacientes con disfunción renal o hepática.
Población de edad avanzada Como en los adultos.
4.2.2 Forma de administración
Efedrina debe ser usada solamente por o bajo la supervisión de un anestesista con una inyección por vía intravenosa.
Para uso intravenoso.
4.3 Contraindicaciones
Efedrina no debería ser usada en caso de:
-Hipersensibilidad a la sustancia activa o a alguno de los excipientes incluidos en la sección 6.1.
-En combinación con otros agentes simpaticomiméticos indirectos, como la fenilpropanolamina, la fenilefrina, la pseudoefedrina y el metilfenidato.
-En combinación con alfa simpaticomiméticos.
-En combinación con inhibidores no selectivos de la MAO o en un plazo de 14 días posteriores a la suspensión de estos.
4.4 Advertencias y precauciones especiales de empleo
Advertencias
Hidrocloruro de efedrina debe utilizarse con precaución en pacientes que puedan ser especialmente susceptibles a sus efectos, sobre todo en aquellos con hipertiroidismo. También se debe tener mucho cuidado con los pacientes que padezcan enfermedades cardiovasculares, como cardiopatía isquémica, arritmia o taquicardia, enfermedades vasculares oclusivas, entre las que se incluyen la arteriosclerosis, la hipertensión o aneurismas. En pacientes con angina de pecho se puede desencadenar dolor anginoso.
También es necesario tener cuidado cuando se usa efedrina en pacientes con diabetes mellitus, glaucoma de ángulo cerrado o hipertrofia prostática.
Hidrocloruro de efedrina debería evitarse o utilizarse con precaución en pacientes a los que se suministre anestesia con ciclopropano, halotano u otros anestésicos halogenados, ya que pueden inducir fibrilación ventricular. También puede aumentar el riesgo de arritmia si la efedrina se usa en pacientes a los que se les esté administrando glucósidos cardíacos, quinidina o antidepresivos tricíclicos.
Muchos simpaticomiméticos interactúan con inhibidores de la monoaminooxidasa y no deberían administrarse a pacientes que estén recibiendo dicho tratamiento o en un plazo de 14 días posteriores a su fin. Se recomienda evitar los simpaticomiméticos al tomar inhibidores selectivos de la MAO.
El hidrocloruro efedrina aumenta la tensión arterial y por lo tanto se recomienda tener mucho cuidado en el caso de pacientes con un tratamiento antihipertensivo. Las interacciones de efedrina con fármacos alfa y beta bloqueantes pueden ser complejas. El propranolol y otros fármacos antagonistas de los receptores beta-adrenérgicos antagonizan los efectos de los estimulantes de los receptores beta-2 adrenérgicos (beta-2 agonistas) como el salbutamol.
La administración simultánea de dosis altas de corticosteroides puede exacerbar los efectos adversos metabólicos de dosis altas de beta-2 agonistas; por lo tanto, se debe supervisar cuidadosamente a los pacientes cuando se utilicen las dos formas de tratamiento simultáneamente, aunque esta precaución no es tan relevante en el caso de la corticoterapia inhalada. La hipopotasemia asociada a altas dosis de agonistas beta-2 puede favorecer una mayor predisposición a arritmia cardíaca inducida por digitálicos. La administración simultánea de aminofilina u otras xantinas, corticosteroides o la terapia diurética pueden causar un aumento de hipopotasemia.
Precauciones de uso
El Hidrocloruro de efedrina debe usarse con precaución en pacientes con antecedentes de cardiopatía.
Se debe informar a los deportistasque esta preparación contiene un principio activo que podría dar resultado positivo en pruebas antidopaje.
Compruebe que la solución es transparente y no contiene partículas visibles antes de la infusión.
Este medicamento contiene 33,2 mg de sodio por jeringa, lo que deberá tenerse en cuenta en el tratamiento de pacientes con dietas pobres en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
Combinaciones contraindicadas:
Simpaticomiméticos indirectos (fenilpropanolamina, pseudoefedrina, fenilefrina, metilfenidato)
Riesgo de vasoconstricción y/o episodios agudos de hipertensión.
Alfa simpaticomiméticos (vía de administración oral y/o nasal)
Riesgo de vasoconstricción y/o episodios de hipertensión.
Inhibidores no selectivos de la MAO
Hipertensión paroxística, hipertermia posiblemente mortal.
Combinaciones no recomendadas:
Alcaloides ergóticos (acción dopaminérgica)
Riesgo de vasoconstricción y/o episodios de hipertensión.
Alcaloides ergóticos (vasoconstrictores)
Riesgo de vasoconstricción y/o episodios de hipertensión.
Inhibidores selectivos de la MAO-A (administrados concomitantemente o durante las últimas 2 semanas) Riesgo de vasoconstricción y/o episodios de hipertensión.
Linezolid
Riesgo de vasoconstricción y/o episodios de hipertensión.
Antidepresivos tricíclicos (p. ej., imipramina)
Hipertensión arterial paroxística con posibilidad de arritmia (inhibición de entrada de adrenalina o noradrenalina en las fibras simpáticas).
Antidepresivos noradrenérgicos-serotoninérgicos (minalcipran, venlafaxina)
Hipertensión arterial paroxística con posibilidad de arritmia (inhibición de entrada de adrenalina o noradrenalina en fibras simpáticas).
Guanetidina y productos relacionados con ella
Aumento considerable de la tensión arterial (hiperreactividad ligada a la reducción del tono simpático y/o la inhibición de entrada de adrenalina o noradrenalina en fibras simpáticas).
Si la combinación no se puede evitar, utilice con precaución dosis menores de simpaticomiméticos. Sibutramina
Hipertensión arterial paroxística con posibilidad de arritmia (inhibición de entrada de adrenalina o noradrenalina en fibras simpáticas).
Anestésicos halogenados volátiles
Riesgo de crisis hipertensiva perioperatoria y arritmias ventriculares graves.
Combinaciones que requieren precauciones de uso:
Teofilina
La administración simultánea de efedrina y teofilina puede causar insomnio, nerviosismo y síntomas gastrointestinales.
Corticosteroides
La efedrina ha demostrado aumentar la eliminación de la dexametasona.
Antiepilépticos
Aumento de concentración plasmática de fenitoína y posiblemente de fenobarbital y primidona.
Doxapram
Riesgo de hipertensión.
Oxitocina
Hipertensión con simpaticomiméticos vasoconstrictores.
Agentes Hipotensivos
Reserpina y metildopa pueden reducir la acción vasopresora de la efedrina.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
Se han realizado estudios en animales que han demostrado un efecto teratógeno.
Los datos clínicos de estudios epidemiológicos realizados en un número limitado de mujeres parecen indicar que no hay efectos específicos de la efedrina con respecto a malformación.
Se han descrito casos aislados de hipertensión materna tras el abuso o uso prolongado de aminas vasoconstrictoras.
El Hidrocloruro de efedrina atraviesa la placenta y esto se ha asociado a un aumento de la frecuencia cardíaca fetal y a una variabilidad entre latidos.
Por lo tanto, la efedrina debe evitarse o usarse con precaución, y solo si es necesario, durante el embarazo.
4.6.2 Lactancia
El Hidrocloruro de efedrina se excreta en la leche materna. Se han notificados casos de irritabilidad y alteraciones del sueño en niños lactantes. Hay constancia de que la efedrina se elimina entre 21 y 42 horas tras su administración; por lo tanto, debe tomarse una decisión acerca de si debe evitarse el tratamiento con efedrina o si la lactancia debe interrumpirse durante dos días tras su administración, teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio del tratamiento para la mujer.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
Muy frecuentes: >1/10; Frecuentes: >1/100, <1/10; Poco frecuentes: >1/1.000, <1/100; Raras:
>1/10.000, <1/1.000; Muy raras: <1/10.000; Frecuencia no conocida: no pueden estimar a partir de los datos disponibles
Trastornos de la sangre y del sistema linfático:
Frecuencia no conocida: modificaciones de la hemostasia primaria
Trastornos del sistema inmunitario:
Frecuencia no conocida: hipersensibilidad
Trastornos psiquiátricos:
Frecuentes: confusión, ansiedad, depresión Frecuencia no conocida: estados psicóticos, miedo
Trastornos del sistema nervioso:
Frecuentes: nerviosismo, irritabilidad, agitación, debilidad, insomnio, cefalea, sudoración Frecuencia no conocida: temblor, exceso de salivación
Trastornos oculares:
Frecuencia no conocida: episodios glaucoma de ángulo cerrado Trastornos cardíacos:
Frecuentes: palpitaciones, hipertensión, taquicardia Raras: arritmia cardíaca
Frecuencia no conocida: dolor anginoso, bradicardia refleja, parada cardíaca, hipotensión Trastornos vasculares:
Frecuencia no conocida: hemorragia cerebral
Trastornos respiratorios, torácicos y mediastínicos:
Frecuentes: disnea
Frecuencia no conocida: edema pulmonar
Trastornos gastrointestinales:
Frecuentes: nauseas, vómitos
Frecuencia no conocida: reducción de apetito
Trastornos urinarios y renales:
Raras: retención urinaria aguda
Investigaciones:
Frecuencia no conocida: hipopotasemia, cambios de los niveles de glucosa en sangre Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es.
4.9 Sobredosis
En caso de sobredosis, se pueden observar síntomas como de nauseas, vómitos, fiebre, psicosis paranoica, arritmia ventricular y supraventricular, hipertensión, depresión respiratoria, convulsiones y coma.
La dosis letal en humanos es aproximadamente 2 g que corresponden a concentraciones sanguíneas de aproximadamente 3,5 a 20 mg/l.
Tratamiento
Para tratar la sobredosis de efedrina con este producto puede que sea necesario un tratamiento sintomático intensivo. Se puede administrar una inyección intravenosa lenta de labetalol de 50-200 mg con una monitorización electrocardiografía para el tratamiento de la taquicardia supraventricular. La hipopotasemia acusada (<2,8 mmol.l-1) debida a un cambio compartimental de potasio predispone a la arritmia cardíaca y se puede corregir mediante infusión de cloruro potásico además de propranolol y la corrección de la alcalosis respiratoria, si se da el caso.
Una benzodiacepina y/o un agente neuroléptico pueden ser requeridos para el control de los efectos estimulantes del SNC.
Para la hipertensión grave, entre las opciones antihipertensivas parenterales se incluyen nitratos intravenosos, bloqueantes de canales de calcio, nitroprusiato de sodio, labetodol o fentolamina. La elección de un medicamento antihipertensivo depende de la disponibilidad, condiciones concomitantes y el estado clínico del paciente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agonista adrenérgico y dopaminérgico.
Código ATC: C01CA26
La efedrina es una amina simpaticomimética que actúa directamente en los receptores alfa y beta adrenérgicos,e indirectamente al aumentar la liberación de noradrenalina por las terminaciones nerviosas simpáticas. Como cualquier simpaticomimético, la efedrina estimula el sistema nervioso central, el sistema cardiovascular, el sistema respiratorio y los esfínteres de los sistemas urinarios y digestivos. La efedrina es también un inhibidor de la monoaminooxidasa (MAO).
5.2 Propiedades farmacocinéticas
Tras la administración intravenosa, la biodisponibilidad de la efedrina es total y, tras la administración oral, se ha notificado que la biodisponibilidad de la efedrina es superior al 90 %.
La eliminación depende del pH de la orina:
De 73 a 99 % (media: 88 %) en orina ácida,
De 22 a 35 % (media: 27 %) en orina alcalina.
Tras su administración oral o parenteral, el 77 % de la efedrina se elimina sin cambios por la orina.
La semivida depende del pH de la orina. Cuando la orina se vuelve ácida con pH = 5, la semivida es de tres horas; cuando la orina se vuelve alcalina con pH = 6,3, la semivida es aproximadamente de seis horas.
5.3 Datos preclínicos sobre seguridad
No hay datos preclínicos relevantes para el prescriptor adicionales a los ya incluidos en otras secciones de la ficha técnica.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
3E
Monohidrato de ácido cítrico Citrato de sodio
Ácido clorhídrico (para ajuste de pH)
Hidróxido de sodio (para ajuste de pH)
Agua para inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 3 años.
Una vez abierto: el producto debe usarse inmediatamente.
6.4 Precauciones especiales de conservación
Guarde el blíster dentro de la caja para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Jeringa precargada de polipropileno de 10 ml con cierre hermético seguro y tapa de polipropileno, envasados de forma individual en blíster transparente. Las jeringas precargadas están disponibles en cajas de 1, 5, 10, 12 y 20.
Puede que solamente estén comercializados algunos tamaños de envases
6.6 Precauciones especiales de eliminación y otras manipulaciones Instrucciones de uso:
Prepare la jeringa cuidadosamente como se indica a continuación
La jeringa precargada debe usarse en un solo paciente.
Elimine la jeringa tras su uso. NO LA REUTILICE.
El contenido de un envase que no esté abierto ni estropeado es estéril y no debe abrirse hasta el momento de su utilización.
Debe inspeccionarse visualmente el producto, para comprobar que no haya partículas ni descoloración antes de su administración. Solo debe usarse la solución cuando esta sea transparente, incolora y no se observen partículas ni precipitados.
El producto no debe usarse si el cierre hermético de seguridad de la jeringa está roto.
La superficie exterior de la jeringa es estéril hasta que se abre el envase.
1) Retire la jeringa precargada del envase estéril.
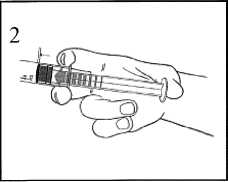
2) Empuje el émbolo para liberar el tapón.
|
3 |
IC |
|
4 4 ' |
lf ' 1 j2 y V i / 4 A |
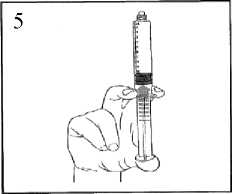
3) Desenrosque el extremo de la tapa hasta romper los cierres.
4) Compruebe que ha retirado completamente el cierre de la jeringa. Si no es así, coloque la tapa de nuevo y vuelva a desenronscarla.
5) Empuje el émbolo con suavidad para expulsar el aire sobrante.
6) Conecte la jeringa al acceso intravenoso. Empuje el émbolo lentamente para inyectar el volumen necesario.
La eliminación del producto no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratoire AGUETTANT 1, rue Alexander Fleming 69007 Lyon FRANCIA
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Octubre 2015
10. FECHA DE LA REVISIÓN DEL TEXTO
Octubre 2015
9 de 9
¡y
taños