Hiberix Polvo Y Disolvente Para Solucion Inyectable
FICHA TÉCNICA
1. Nombre del medicamento
Hiberix polvo y disolvente para solución inyectable.
Vacuna conjugada de Haemophilus influenzae tipo b.
2. Composición cualitativa y cuantitativa
Después de la reconstitución, 1 dosis (0,5 ml) contiene:
10 microgramos aprox. 25 microgramos
4,5 mg
Polisacárido de Haemophilus influenzae tipo b conjugado con toxoide tetánico como proteína transportadora
Excipientes con efecto conocido Cloruro de sodio
Para consultar la lista completa de excipientes ver sección 6.1.
3. Forma farmacéutica Polvo y disolvente para solución inyectable.
El polvo se presenta como una pastilla blanca.
El disolvente es un líquido transparente e incoloro.
4. Datos clínicos
4.1. Indicaciones terapéuticas
Hiberix está indicada para la vacunación primaria de niños a partir de 2 meses de edad incluidos en algunos de los siguientes grupos:
- Niños con asplenia, anemia falciforme o inmunodeficientes.
- Niños infectados con HIV asintomáticos o sintomáticos.
- En aquellas situaciones que determinen las Autoridades Sanitarias correspondientes.
4.2. Posología y forma de administración Posología
La pauta de vacunación primaria consiste en administrar 3 dosis de Hiberix separadas por un intervalo de 2 meses (entre 4-8 semanas) en los 6-7 primeros meses de vida, y puede comenzar a partir de los 2 meses de edad.
En caso de que la administración de una dosis no se realizase de acuerdo con el calendario previsto, se puede retrasar la administración de estas dosis, siempre que las 3 dosis se administren durante el primer año de vida manteniendo un intervalo de 2 meses (entre 4-8 semanas) entre las dosis.
De forma ocasional, puede ser necesaria la administración de una dosis de recuerdo en el segundo año de vida, como por ejemplo en aquellos niños que no hayan completado la vacunación primaria.
Forma de administración
La vacuna reconstituida debe inyectarse por vía intramuscular. Sin embargo, en pacientes con trombocitopenia o trastornos hemorrágicos se debe aplicar por vía subcutánea.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3. Contraindicaciones
Hiberix no se debe administrar a niños con hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1, ni a niños que previamente hayan mostrado signos de hipersensibilidad tras la administración de vacunas conjugadas frente a Haemophilus influenzae tipo b.
Como con otras vacunas, se debe posponer la administración de Hiberix en niños que padecen enfermedades febriles graves y agudas. Sin embargo, la presencia de una infección de poca importancia no es una contraindicación.
4.4. Advertencias y precauciones especiales de empleo
Aunque se puede producir una respuesta inmune limitada al toxoide tetánico, la vacunación con Hiberix solo, no sustituye a la vacunación rutinaria frente al tétanos.
Se ha descrito excreción en la orina del antígeno polisacárido capsular tras recibir vacunas de Hib. Por tanto, en los casos donde se sospeche enfermedad por Hib, la detección del antígeno en las 1a-2a semanas posteriores a la vacunación, puede que no tenga valor diagnóstico.
Bajo ninguna circunstancia puede administrarse Hiberix por vía intravenosa.
Cuando se administre la serie de inmunización primaria en niños muy prematuros de < 28 semanas de gestación y especialmente en aquellos con un historial previo de inmadurez respiratoria, se debe considerar tanto el riesgo potencial de apnea como la necesidad de monitorización respiratoria durante 48-72 horas. Como el beneficio de la vacunación es alto en este grupo de niños, la vacunación no se debe impedir ni retrasar.
Después de cualquier vacunación, o incluso antes, se puede producir un síncope (desfallecimiento) como una reacción psicógena a la inyección de la aguja. Durante la recuperación, éste puede ir acompañado de varios signos neurológicos tales como déficit visual transitorio, parestesia y movimientos tónico clónicos en los miembros. Es importante que se disponga de procedimientos para evitar daños causados por las pérdidas de conocimiento.
Advertencias sobre excipientes:
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por 0,5 ml, por lo que se considera esencialmente “exento de sodio”.
4.5. Interacción con otros medicamentos y otras formas de interacción
Hiberix puede administrarse en cualquier momento, simultáneamente, antes o después de una vacuna diferente inactivada o viva. Vacunas inyectables diferentes deben administrarse en lugares distintos.
Al igual que con otras vacunas, es de esperar que en pacientes que reciben terapia inmunosupresora o en pacientes con inmunodeficiencia, no llegue a alcanzarse una respuesta adecuada.
4.6. Fertilidad, embarazo y lactancia
Como Hiberix no está destinada para su uso en adultos, no se dispone de información de seguridad de la vacuna cuando se utiliza durante el embarazo o la lactancia.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas No procede.
4.8. Reacciones adversas
• Datos de ensayos clínicos
Las siguientes frecuencias están basadas en el análisis de aproximadamente 3000 lactantes incluidos en el estudio Hib-097 y de aproximadamente 1.200 lactantes incluidos en el estudio DTPa-VHB-VPI-011.
Las reacciones adversas notificadas se enumeran de acuerdo a las siguientes frecuencias:
Muy frecuentes (>1/10)
Frecuentes (>1/100 a <1/10)
Poco frecuentes (>1/1.000 a <1/100)
Raras (>1/10.000 a <1/1.000)
Muy raras (<1/10.000)
Trastornos del metabolismo y de la nutrición Muy frecuentes: pérdida de apetito.
Trastornos psiquiátricos
Muy frecuentes: llanto, irritabilidad, inquietud.
Trastornos del sistema nervioso Muy frecuentes: somnolencia.
Raras: convulsiones (incluyendo convulsiones febriles).
Trastornos gastrointestinales Muy frecuentes: diarrea.
Frecuentes: vómitos.
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: fiebre, hinchazón, dolor y enrojecimiento en el lugar de la inyección.
Datos post-comercialización
Trastornos del sistema inmunológico
Muy raras: reacciones alérgicas (incluyendo reacciones anafilácticas y anafilactoides), angioedema. Trastornos del sistema nervioso
Muy raras: episodios hipotónicos-hiporreactivos, síncopes o respuestas vasovagales a la inyección. Trastornos respiratorios, torácicos y mediastínicos
Muy raras: apnea en niños muy prematuros de < 28 semanas de gestación (ver sección 4.4).
Trastornos de la piel y del tejido subcutáneo Muy raras: urticaria, erupciones.
Trastornos generales y alteraciones en el lugar de administración
Muy raras: inflamación difusa en la extremidad donde se ha administrado la vacuna, induración de la zona de inyección.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9. Sobredosis
En general, el perfil de reacciones adversas notificadas tras una sobredosis fue similar al observado tras la administración de la dosis recomendada de Hiberix.
5. Propiedades farmacológicas
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: vacunas bacterianas, código ATC: J07AG01.
Se obtuvo un título > 0,15 pg/ml en el 95-100% de los niños, un mes después de completar la pauta de vacunación. Se obtuvo un título > 0,15 pg/ml en el 100% de los niños, un mes después de la administración de la dosis de recuerdo (94,7% con un título > 1,0 pg/ml).
5.2. Propiedades farmacocinéticas
La evaluación de las propiedades farmacocinéticas no se requiere en vacunas.
5.3. Datos preclínicos sobre seguridad No relevante.
6 . Datos farmacéuticos
¡m
6.1. Lista de excipientes
Polvo:
Lactosa
Disolvente:
Cloruro de sodio
Agua para preparaciones inyectables
6.2. Incompatibilidades
Este medicamento no debe mezclarse con otros, excepto con los mecionados en la sección 6.6.
6.3. Periodo de validez
Antes de la reconstitución:
3 años
Después de la reconstitución:
Se debe inyectar la vacuna lo antes posible. Si no se utiliza transcurridas 8 horas después de la reconstitución, deberá desecharse.
6.4. Precauciones especiales de conservación Conservar en nevera (entre 2°C y 8°C).
Conservar en el embalaje original para protegerla de la luz.
El polvo no se ve afectado por la congelación.
El disolvente no debe congelarse.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5. Naturaleza y contenido del envase
El polvo se presenta en un vial (vidrio neutro de tipo I).
El disolvente se presenta en una jeringa precargada (vidrio neutro de tipo I).
El vial y la jeringa cumplen con los requisitos de la Farmacopea Europea.
Envases de 1 vial + 1 jeringa o 10 viales + 10 jeringas.
Puede que solamente estén comercializados algunos tamaños de envases.
-*5EP.
3QB!
6.6. Precauciones especiales de eliminación y otras manipulaciones
Antes de la administración, se debe examinar visualmente el disolvente y la vacuna reconstituida, para observar si existe alguna partícula extraña y/o variación de la apariencia. Si se observa alguna de estas circunstancias, no administrar la vacuna.
Instrucciones para la reconstitución de la vacuna con el disolvente en jeringa precargada
Hiberix se debe reconstituir añadiendo todo el contenido de la jeringa precargada al vial que contiene el polvo.
Para saber cómo insertar la aguja en la jeringa, véase el dibujo explicativo. No obstante, la jeringa facilitada con Hiberix puede ser ligeramente diferente a la jeringa descrita en el dibujo.
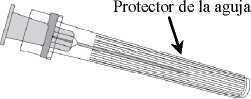
Jeringa
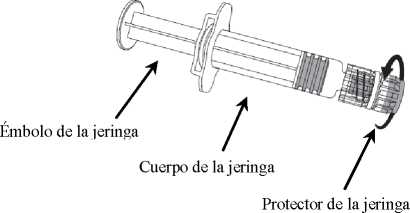
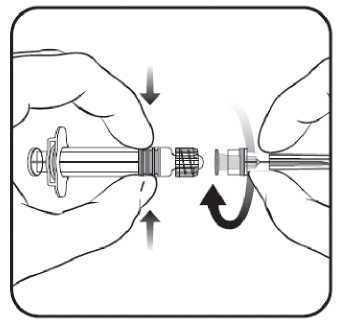
1. Sujetar el cuerpo de la jeringa con una mano (evitar sostener el émbolo de la jeringa) y con la otra, desenroscar el protector de la jeringa girándolo en sentido contrario a las agujas del reloj.
2. Insertar la aguja en la jeringa y a continuación, girar la aguja en el sentido de las agujas del reloj hasta que se bloquee (ver dibujo).
3. Retirar el protector de la aguja; en algunas ocasiones puede resultar un poco difícil.
Añadir el disolvente al polvo. Después de añadir el disolvente al polvo, debe agitarse bien la mezcla hasta que el polvo esté completamente disuelto.
La vacuna reconstituida es una solución transparente a opalescente e incolora.
Tras la reconstitución, la vacuna debe administrarse rápidamente.
Se debe utilizar una aguja nueva para administrar la vacuna.
Inyectar todo el contenido del vial.
Hiberix puede mezclarse en la misma jeringa con la vacuna monodosis Tritanrix HepB. Se debe comprobar que la vacuna que se va a mezclar con Hiberix se presente en envase monodosis. En este caso, el disolvente incluido en el embalaje de Hiberix se sustituirá por la vacuna líquida de Tritanrix HepB. La vacuna
combinada debe reconstituirse añadiendo el contenido completo del recipiente de Tritanrix HepB al vial que contiene el polvo blanco de Hib. Esta vacuna combinada extemporáneamente debería manejarse del mismo modo que la vacuna monocomponente reconstituida Hiberix.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. Titular de la autorización de comercialización
GlaxoSmithKline, S.A.
PTM - Severo Ochoa, 2 28760 Tres Cantos Madrid
Teléfono: 902 202 700 E-mail: es-ci@gsk.com
8. Número(s) de autorización de comercialización
61.834
9. Fecha de la primera autorización/ renovación de la autorización
Fecha de la primera autorización: 15/12/1997 Fecha de la última renovación: 15/12/2007
10. Fecha de la revisión del texto
10/2016
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/.
7 de 7