Haemate P 600/250 Ui Polvo Y Disolvente Para Solucion Inyectable O Perfusion.
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
HAEMATE® P 600/250 UI, polvo y disolvente para solución inyectable o perfusión. HAEMATE® P 1200/500 UI, polvo y disolvente para solución inyectable o perfusión. HAEMATE® P 2400/1000 UI, polvo y disolvente para solución inyectable o perfusión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Composición cualitativa y cuantitativa
HAEMATE P se presenta como polvo y disolvente para preparar una solución inyectable o perfusión que contiene nominalmente por vial, 600, 1200 y 2400 UI de factor de von Willebrand-cofactor de la ristocetina ((VWF:RCo) y 250, 500 ó 1000 UI de factor VIII (FVIII:C) de la coagulación humano.
Cuando se reconstituyen HAEMATE P 600/250, 1200/500 y 2400/1000 UI con los respectivos disolventes, 5, 10 y 15 mL de Agua para preparaciones inyectables, contienen aproximadamente:
HAEMATEP 600/250 UI: 120 UI de factor de von Willebrand y 50 UI de factor VIII de coagulación humano/mL.
HAEMATEP 1200/500 UI: 120 UI de factor de von Willebrand y 50 UI de factor VIII de coagulación humano/mL.
HAEMATEP 2400/1000 UI: 160 UI de factor de von Willebrand y 66,6 UI de factor VIII de coagulación humano/mL
La actividad específica es de aproximadamente, 3 a 17 UI de VWF:RCo /mg de proteína.
La actividad específica es de aproximadamente, 2-6 UI FVIII/mg de proteína.
La potencia del factor VIII (UI) se determina por el método cromogénico de la Farmacopea Europea.
La potencia del factor de von Willebrand (UI) se determina según la actividad del cofactor de ristocetina (VWF:Rco) comparado al Estándar Internacional para concentrados de factor de von Willebrand (OMS)
Excipiente(s) con efecto conocido
Haemate P contiene hasta 70 mg de sodio por 1000 UI de factor VIII.
Para lista completa de excipientes ver Apartado 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable o perfusión.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas Enfermedad de von Willebrand
Profilaxis y tratamiento de hemorragias o sangrados quirúrgicos en la Enfermedad de von Willebrand, cuando el tratamiento sólo con desmopresina es ineficaz o está contraindicado.
Hemofilia A (deficiencia congénita de factor VIII)
Tratamiento y profilaxis de hemorragias en pacientes.
Este producto puede ser útil en el manejo de la deficiencia adquirida de factor VIII.
4.2 Posología y forma de administración
4.2.1 Posología
El tratamiento de la enfermedad de von Willebrand y de la hemofilia A debe estar supervisado por un médico con experiencia en el tratamiento de trastornos de la coagulación.
Enfermedad de von Willebrand (EVW)
Por lo general, la administración de 1 UI de FVW:RCo/Kg de peso corporal incrementa los niveles circulantes de VWF:RCo en 0,02 UI/ml, lo que representa un aumento del 2%. Deben alcanzarse niveles superiores a 0,6 UI de FVW:RCo/ml (60%) y niveles superiores a 0,4 UI de FVIIEC/ml (40%).
Las dosis recomendada para conseguir la hemostasia son 40 - 80 UI de FVW:RCo/kg de peso y 20 - 40 UI de FVIII:C/kg de peso.
En ciertos casos puede requerirse una dosis inicial de 80 UI de factor de von Willebrand, especialmente en aquellos pacientes con una enfermedad de von Willebrand Tipo 3, en los que la terapia de mantenimiento de niveles adecuados puede requerir dosis superiores a las que demandan los otros tipos de enfermedad de von Willebrand.
Prevención de hemorragias en casos de cirugía o lesiones graves: Para prevenir sangrados profusos durante o después de cirugía, la administración del producto debe iniciarse de 1 a 2 horas antes de comenzar la cirugía.
Una dosis adecuada debe repetirse a intervalos de 12 a 24 horas. La dosis y la duración del tratamiento dependen del estado clínico del paciente, del tipo y gravedad del sangrado y de los niveles de FVW:RCo y FVIII:C.
Cuando se administran productos que contienen factor VIII y factor de von Willebrand, el médico responsable del tratamiento debe tener en cuenta que el tratamiento continuado puede ocasionar un incremento excesivo del FVIII:C. Después de un tratamiento de 24 - 48 horas, y a fin de evitar un incremento indeseable del FVIII:C, deberá considerarse una reducción de las dosis y/o un aumento de los intervalos entre administraciones, o el uso de productos de factor de von Willebrand que contengan bajos niveles de Factor VIII.
La posología en pediatría se basa en el peso corporal y por lo tanto sigue, generalmente, las mismas directrices que se usan para los adultos. La frecuencia de administración debe estar siempre orientada a conseguir la eficacia clínica en cada caso particular.
Hemofilia A
La dosis y duración del tratamiento dependen del grado de la deficiencia de factor VIII, de la localización y gravedad de la hemorragia y del estado clínico del paciente.
El número de unidades de factor VIII administradas se expresa en Unidades Internacionales (UI), en relación con el estándar actual de la Organización Mundial de la Salud (OMS) vigente para concentrados de factor VIII. La actividad plasmática de factor VIII se expresa como un porcentaje (en relación con el plasma humano normal) o en Unidades Internacionales (en relación con un estándar internacional para factor VIII en plasma).
La actividad de una unidad internacional de factor VIII es equivalente a la cantidad del factor VIII contenido en un ml de plasma humano normal.
El cálculo de la dosis necesaria de factor VIII se basa en la observación empírica de que 1 UI de factor VIII por kg de peso corporal eleva la actividad plasmática de factor VIII en aproximadamente entre 1,5% y el 2%. La dosis necesaria se determina mediante la fórmula siguiente:
Unidades necesarias = peso corporal (kg) x aumento deseado de FVIII (% o UI/dL) x 0,5
La dosis y la frecuencia de la administración se establecerán siempre en función de la eficacia clínica observada en cada caso.
En el caso de episodios hemorrágicos como los detallados a continuación, la actividad de factor VIII no debe ser inferior al nivel plasmático de actividad establecido (en % de plasma normal o UI/dL) en el período correspondiente. Puede emplearse la siguiente tabla como guía de dosificación en episodios hemorrágicos y cirugía:
|
Grado de hemorragia / tipo de cirugía |
Nivel de factor VIII requerido (% o U.I./dl) |
Frecuencia de dosis (horas) / duración de la terapia (días) |
|
Hemorragia | ||
|
Hemartrosis precoz, sangrado muscular o de la cavidad bucal |
20 - 40 |
Repetir cada 12 - 24 horas. Al menos 1 día, hasta que la hemorragia se haya resuelto, en función del dolor, o hasta la cicatrización adecuada de la herida. |
|
Hemartrosis más extensa, sangrado muscular o hematoma |
30 - 60 |
Repetir la perfusión cada 12 - 24 horas, durante 3 - 4 días o más hasta que el dolor y la discapacidad aguda se hayan resuelto. |
|
Hemorragias con riesgo vital |
60 - 100 |
Repetir la perfusión cada 8 - 24 horas hasta que desaparezca el riesgo. |
|
Cirugía | ||
|
Menor incluyendo la extracción dental |
30 - 60 |
Cada 24 horas, al menos 1 día, hasta la cicatrización de la herida. |
|
Mayor |
80 - 100 (pre y postoperatorio) |
Repetir la perfusión cada 8 - 24 horas hasta la adecuada cicatrización de la herida, y luego terapia durante un mínimo de 7 días para mantener una actividad de factor VIII del 30% - 60% (U.I./dl). |
Se recomienda la determinación adecuada de los niveles plasmáticos de factor VIII durante el tratamiento a fin de calcular la dosis y la frecuencia de las perfusiones a administrar.
Particularmente, en las intervenciones de cirugía mayor, es imprescindible una adecuada monitorización precisa de la terapia de sustitución, por medio de análisis de la coagulación (actividad plasmática de factor VIII).
La respuesta individual de los pacientes a la terapia con factor VIII puede variar, alcanzándose diferentes niveles de recuperación in vivo y de semivida.
En la profilaxis a largo plazo, para impedir hemorragias en pacientes con hemofilia A grave, la dosis habitual es de 20 a 40 UI de factor VIII/kg de peso corporal a intervalos de 2 a 3 días. En algunos casos, especialmente en pacientes jóvenes puede ser necesario acortar los intervalos de administración, o usar dosis más elevadas.
En los pacientes se debe controlar el desarrollo de inhibidores del factor VIII. Si no se obtienen los niveles de actividad plasmática de factor VIII esperados, o si el sangrado no se controla con la dosis adecuada, deben realizarse ensayos para determinar la presencia de inhibidores del factor VIII. En pacientes con elevados niveles de inhibidor, puede ser que la terapia con factor VIII no sea efectiva y deban considerarse otras opciones terapéuticas. Dichas terapias deberán realizarse bajo la supervisión de un médico con experiencia en el tratamiento de la hemofilia.
Ver también 4.4.
No se dispone de experiencia clínica en el tratamiento de la hemofilia A de niños con HAEMATE® P 600/250 UI, HAEMATE® P 1200/500 UI, HAEMATE® P 2400/1000.
Forma de administración
Reconstituir el preparado tal como se describe en el punto 6.6. La solución reconstituida debe atemperarse a temperatura ambiente o corporal antes de su administración.
Administrar por vía intravenosa lenta a una velocidad confortable para el paciente.
La perfusión se usa en los casos que tengan que administrarse grandes cantidades del producto. En estos casos transferir la solución reconstituida a un sistema de perfusión autorizado.
La velocidad de inyección o perfusión no debe ser superior a los 4 ml/minuto. Los pacientes deben mantenerse bajo observación por si se presenta alguna reacción inmediata. Si, se presentara alguna reacción que pudiera estar relacionada con la administración de Haemate P, debe disminuirse la velocidad de perfusión o interrumpirse la administración del producto, si así lo requiriera la condición clínica del paciente (véase también Apartado 4.4).
4.3 Contraindicaciones
Hipersensibilidad conocida al principio activo o a los excipientes del preparado.
4.4 Advertencias y precauciones especiales de empleo
Tal como sucede con cualquier otro producto proteico, que se administra por vía intravenosa, es posible que se presenten reacciones de hipersensibilidad de tipo alérgico. Los pacientes deben ser monitorizados estrechamente y vigilados atentamente ante la aparición de cualquier síntoma durante el periodo de perfusión Los pacientes deben ser informados sobre la aparición de síntomas precoces de reacciones de
hipersensibilidad incluyendo, eritema, urticaria generalizada, opresión torácica, respiración dificultosa, hipotensión y anafilaxia. Si se presentan estos síntomas, debe informárseles que debe interrumpirse inmediatamente la administración del producto y comunicarlo a su médico.
En caso de shock, se seguirán las pautas médicas estándar para el tratamiento del shock.
Para prevenir la transmisión de enfermedades infecciosas cuando se administran medicamentos derivados de la sangre o plasma humanos, se toman medidas estándar como la selección de donantes, análisis de marcadores específicos de infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar / inactivar virus. A pesar de esto, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente. Esto también se refiere a virus y agentes infecciosos emergentes o de naturaleza desconocida.
Estas medidas se consideran efectivas para virus envueltos como VIH, VHB y VHC y para virus no envueltos, como el VHA.
Las medidas tomadas pueden tener un valor limitado frente a virus no envueltos, como el parvovirus B19.
La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección fetal) y para sujetos con inmunodeficiencia o con una producción aumentada de hematíes (Ej. con anemia hemolítica).
Se recomienda la vacunación apropiada (hepatitis A y B) para los pacientes que reciban regularmente o repetidamente medicamentos derivados de plasma humano.
A fin de mantener la trazabilidad del producto y en beneficio de los pacientes se recomienda encarecidamente que, siempre que sea posible, cada vez que se les administre Haemate P se deje constancia del nombre del medicamento y número de lote administrado.
Enfermedad de von Willebrand
Existe el riesgo de aparición de eventos trombóticos, incluyendo embolismo pulmonar, especialmente en pacientes con factores de riesgo conocidos, clínicos o de laboratorio (por ejemplo, en periodos peri operatorios sin recibir profilaxis de trombosis, movilización tardía, obesidad, sobredosificación, cáncer). Por lo tanto, estos pacientes de riesgo deben ser controlados para detectar la aparición de signos precoces de trombosis. De acuerdo con las actuales recomendaciones, debe instaurarse una profilaxis para prevenir tromboembolismos venosos.
Cuando se usan medicamentos que contienen el factor de von Willebrand y factor VIII, el médico responsable del tratamiento deberá tener en cuenta que el tratamiento continuado puede causar un incremento excesivo del factor VIII:C. En los pacientes a los que se les administran medicamentos que contienen el factor de von Willebrand y el factor VIII:C, se deberán controlar los niveles de factor VIII:C, para evitar que se produzca un aumento excesivo de los niveles plasmáticos de factor VIIII:C, lo que incrementa el riesgo de eventos trombóticos.
Pacientes con la enfermedad de von Willebrand, y especialmente los pacientes con el Tipo 3 de esta enfermedad, pueden desarrollar anticuerpos neutralizantes (inhibidores) contra el factor de von Willebrand. Cuando, no se alcancen los niveles plasmáticos esperados de FVW:RCo, o si el sangrado no se controla con la dosis adecuada, deberá realizarse una prueba para determinar la presencia de inhibidores del factor de von Willebrand. En pacientes con títulos altos de inhibidores, la terapia puede ser no efectiva, por lo que deberán considerarse otras opciones terapéuticas.
Hemofilia A
La formación de anticuerpos neutralizantes (inhibidores) es una complicación bien conocida en el tratamiento de pacientes con hemofilia A. Estos inhibidores son generalmente inmunoglobulinas IgG
dirigidas contra la actividad procoagulante del factor VIII. Esta actividad se cuantifica en Unidades Bethesda (UB) por mL de plasma utilizando el método modificado. El riesgo de desarrollar inhibidores se correlaciona con la exposición a factor VIII antihemofílico, siendo este riesgo mayor en los primeros 20 días de exposición. Raramente, pueden desarrollarse inhibidores tras los primeros 100 días de exposición. En los pacientes tratados con el factor VIII humano de la coagulación se debe controlar, cuidadosamente, el desarrollo de inhibidores mediante observación clínica adecuada y pruebas de laboratorio. El tratamiento puede ser no efectivo en pacientes con un título alto de anticuerpos, en estos casos deberán considerarse otras opciones terapéuticas. Ver también “Apartado 4.8 Reacciones adversas”.
Advertencias especiales sobre excipientes: Haemate P contiene hasta 70 mg de sodio por 1000 UI de factor VIII; esto debe tenerse en cuenta para aquellos pacientes que sigan una dieta limitada en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se conocen interacciones de este producto con otros medicamentos.
4.6 Fertilidad, embarazo y lactancia
No se han realizado estudios de reproducción animal con Haemate P.
Ya que la hemofilia A es poco frecuente en mujeres, no se dispone de experiencia clínica sobre el uso de factor VIII durante el embarazo y la lactancia.
La situación es diferente en el caso de la Enfermedad de von Willebrand debido a su carácter de herencia autosómica. Basándose en la experiencia post-comercialización, puede recomendarse la terapia de substitución con el Factor de von Willebrand en el tratamiento y prevención de hemorragias graves. No se dispone de ensayos clínicos sobre la terapia de substitución en mujeres embarazadas o en periodo de lactancia.
Por lo tanto, Haemate P sólo debe ser usado en el embarazo y la lactancia, en el caso de que su uso esté claramente justificado.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han observado efectos sobre la capacidad de conducir y utilizar maquinaria.
4.8 Reacciones adversas
Las reacciones adversas siguientes se basan en la experiencia acumulada tras la comercialización. En caso de disponer de datos suficientes, se usan las siguientes categorías de frecuencia estandarizadas:
Muy frecuentes
Frecuentes
Poco frecuentes
Raras
Muy raras
Desconocida
> 1/10
> 1/100 y < 1/10
> 1/1.000 y < 1/100
> 1/10.000 y < 1/1.000 < 1/10.000
La frecuencia no se puede asignar por los datos disponibles.
|
MedDRA SOC |
Reacción adversa |
Frecuencia |
|
Trastornos de la sangre y del sistema linfático |
Hipervolemia Hemólisis Inhibición del FvW Inhibición del FVIII |
Desconocida Desconocida Muy rara Muy rara |
|
Trastornos generales y |
Fiebre |
Muy rara |
|
alteraciones en el lugar de administración | ||
|
Trastornos del sistema inmune |
Hipersensibilidad (reacciones alérgicas) |
Muy rara |
|
Trastornos vasculares |
Trombosis Eventos tromboembólicos |
Muy rara Muy rara |
Trastornos de la sangre y del sistema linfático
Cuando se necesitan dosis muy grandes o de una frecuencia de administración elevada, cuando hay presencia de inhibidores o cuando hay implicados cuidados pre o posquirúrgicos, todos los pacientes debe ser supervisados acerca de la aparición de síntomas de hipervolemia. Además, en aquellos pacientes con grupos sanguíneos A, B y AB debe controlarse si hay síntomas de hemólisis intravascular y/o disminución de los valores de hematocrito.
Trastornos generales y alteraciones en el lugar de administración En muy raras ocasiones se ha observado fiebre.
Trastornos del sistema inmunológico
Se ha observado muy raramente hipersensibilidad o reacciones alérgicas (que pueden incluir angioedema, quemazón o picor en el punto de perfusión, escalofríos, sofocos, urticaria generalizada, cefalea, ronchas, hipotensión, letargia, nausea, inquietud, taquicardia, presión en el pecho, sensación de hormigueo, vómitos o respiración dificultosa), que en algunos casos puede progresar a anafilaxis grave (shock anafiláctico).
Enfermedad de von Willebrand
Trastornos de la sangre y del sistema linfático
Los pacientes con EVW, especialmente los que padecen la enfermedad tipo 3, muy raramente pueden desarrollar anticuerpos neutralizadores (inhibidores) del FVW. Si se desarrollan estos inhibidores, el trastorno se manifestará como una respuesta clínica inadecuada. Estos anticuerpos precipitan y pueden aparecer al mismo tiempo que las reacciones anafilácticas. Por lo tanto, debe evaluarse la presencia de un inhibidor en los pacientes que experimentan reacción anafiláctica.
En todos estos casos, se recomienda ponerse en contacto con un centro especializado en hemofilia. Trastornos vasculares
Muy raramente, existe el riesgo de aparición de efectos trombóticos / tromboembólicos (incluyendo embolismo pulmonar), particularmente en pacientes con factores de riesgo conocidos por ejemplo, en periodos peri operatorios sin recibir profilaxis de trombosis, movilización tardía, obesidad.
En pacientes que reciben productos con FVW, unos niveles plasmáticos excesivos de FVIII:C pueden aumentar el riesgo de efectos trombóticos (consulte también Sección 4.4).
Hemofilia A
Trastornos de la sangre y del sistema linfático
Los pacientes con hemofilia A pueden desarrollar muy raramente anticuerpos neutralizadores (inhibidores) del factor VIII. Si se desarrollan estos inhibidores, el trastorno se manifestará como una respuesta clínica insuficiente. En tales casos, se recomienda ponerse en contacto con un centro especializado en hemofilia.
La experiencia de ensayos clínicos con Haemate P 600-250/1200-500/2400-1000 en pacientes no tratados previamente (PUPs) es muy limitada. Por eso, no se pueden facilitar cifras válidas sobre la incidencia de inhibidores específicos clínicamente relevantes.
Para información sobre seguridad respecto a agentes transmisibles, consulte la Sección 4.4.
4.9 Sobredosis
Hasta ahora no se conocen síntomas de sobredosificación por factor de von Willebrand y factor VIII. Sin embargo, no puede excluirse el riesgo de trombosis en el caso de una sobredosificación elevada, especialmente cuando se administran productos que contienen factor de von Willebrand y factor VIII, estando éste último presente en una elevada concentración.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antihemorrágico factores de la coagulación de la sangre: factor de von Willebrand y factor VIII de la coagulación, en combinación. Código ATC: B02BD06.
Enfermedad de von Willebrand
Haemate P se comporta de la misma manera que el factor de von Willebrand endógeno.
La administración del FVW permite corregir los trastornos de la hemostasia que presenta el paciente que sufre la deficiencia de este factor. Esta corrección se efectúa a 2 niveles:
- El FVW restaura la adhesión plaquetaria al subendotelio vascular en el lugar que ha sufrido el daño vascular (ya que se une al subendotelio vascular y a la membrana de la plaquetas), y recupera la hemostasia primaria, tal como lo demuestra la disminución del tiempo de sangría. Este efecto se manifiesta de inmediato y se sabe que depende de una manera muy importante del nivel de polimerización de la proteína.
- El FVW provoca una corrección del déficit asociado de factor VIII, que se manifiesta de manera tardía. Cuando el factor de von Willebrand se administra por vía intravenosa, éste se une el factor FVIII endógeno (que es producido, normalmente por el paciente), estabilizando este factor, y evitando así su rápida degradación. Por esto, la administración de productos que solo contienen el FVW (productos con FVW, con bajos niveles de FVIII) tienen como efecto secundario, el restablecimiento de los niveles factor VIII:C a valores normales, después de la primera perfusión.
La administración de productos de FVIII que contienen FVW restauran los niveles normales de factor VIII de manera inmediata, después de la primera infusión.
Hemofilia A
Haemate P se comporta de la misma manera que el factor VIII endógeno.
El complejo factor VIII/factor von Willebrand está compuesto por dos moléculas (FVIII Y FVW) con funciones fisiológicas diferentes.
Cuando se perfunde en un paciente hemofílico, el factor VIII se une al factor de von Willebrand en la circulación del paciente.
El factor VIII activado, actúa como cofactor del factor IX activado, acelerando la conversión de factor X en factor X activado. Éste convierte la protrombina en trombina. La trombina convierte a su vez el fibrinógeno en fibrina, con lo que puede formarse el coágulo sanguíneo. La hemofilia A es una alteración de la
coagulación sanguínea hereditaria ligada al sexo y se debe a una disminución de los niveles de factor VIII: C que da lugar a un sangrado profuso en las articulaciones, músculos u órganos internos, ya sea de forma espontánea o a causa de un traumatismo accidental o quirúrgico. La terapia de sustitución aumenta los niveles plasmáticos de factor VIII, obteniéndose una restauración temporal de la deficiencia de este factor y una corrección de la tendencia al sangrado.
5.2 Propiedades farmacocinéticas Enfermedad de von Willebrand
Se ha evaluado la farmacocinética de Haemate P 600-250/1200-500/2400-1000 en 28 pacientes con EVW (tipo 1 n = 10; tipo 2A n = 10; tipo 2M n = 1; tipo 3 n = 7) en estado no hemorrágico. La mediana de la vida media terminal de FVW:CoR (modelo de dos compartimentos) fue de 9,9 horas (rango: 2,8 a 51,1 horas). La mediana de la vida media inicial fue de 1,47 horas (rango: 0,28 a 13,86 horas/ La mediana de la recuperación in vivo de la actividad de FVW:CoR fue de 1,9 (U.I./dL) / (U.I./kg) [rango: 0,6 a 4,5 (U.I./dL)/(U.I./kg)]. La mediana del ABC (área bajo la curva) fue 1.664 U.I./dL*h (rango de 142 a 3.846 U.I./dL*h). La mediana del TRM (tiempo de retención medio) fue de 13,7 horas (rango 3,0 a 44,6 horas) y la mediana del aclaramiento fue 4,81 ml/kg/h (rango de 2,08 a 53,0 ml/kg/h).
Los niveles plasmáticos pico de FVW generalmente se producen unos 50 minutos después de la inyección. El nivel pico de FVIII se produce entre 1 y 1,5 h después de la inyección.
Factor VIII
Después de la administración intravenosa se produce un rápido incremento de la actividad plasmática del factor VIII (FVIII:C), seguida de un rápido descenso de la actividad y de otra fase con una disminución mas lenta de la actividad. Los ensayos en pacientes con hemofilia A han demostrado una mediana de semivida biológica media de 12,6 horas (rango: 5,0 a 27,7 horas).
La mediana global de la recuperación in vivo para la actividad del factor VIII fue de1,73 IU/dL por UI/kg (rango: 0,5 a 4,13).
La mediana del tiempo medio de residencia (TMR) fue de 19,0 horas (rango: 14,8 a 40,0) horas.
La mediana del área bajo la curva (ABC) fue de 36,1 (%*h)/(UI/kg) (rango: 14,8 a 72,4 (%*h)/(UI/kg).
La mediana del aclaramiento fue de 2,8 ml/kg/h (rango: 1,4 a 6,7 ml/kg/h).
5.3 Datos preclínicos sobre seguridad
Haemate P contiene factor FVIII y factor de von Willebrand como principios activos, derivados del plasma humano que actúan como los correspondientes factores plasmáticos endógenos.
La administración de dosis únicas de Haemate P a varias especies de animales no reveló efectos tóxicos.
Los ensayos preclínicos con dosis repetidas de Haemate P (toxicidad crónica, cancerogénesis y mutagénesis) no pueden realizarse, de manera adecuada, en los modelos animales convencionales, debido al desarrollo de anticuerpos como consecuencia de la administración de proteínas humanas heterólogas.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Albúmina humana, glicina, cloruro sódico, citrato sódico y ácido clorhídrico o hidróxido sódico (en pequeñas cantidades para ajustar el pH).
Disolvente que se suministra: 5, 10 y 15 ml de Agua para preparaciones inyectables.
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros medicamentos, disolventes o diluyentes, salvo aquellos que se citan en el Apartado 6.1.
Para la inyección/perfusión sólo deberán utilizarse equipos que hayan sido autorizados, ya que puede producirse un fallo en el tratamiento como consecuencia de adsorción del factor VIII por la superficie interna de algunos equipos de perfusión.
6.3 Periodo de validez
3 años.
Después de la reconstitución, la estabilidad físico-química ha sido demostrada para un tiempo de 48 horas a temperatura ambiente (máximo 25° C).
Desde un punto de vista microbiológico, HAEMATE P no contiene conservantes por lo que la solución reconstituida debe usarse inmediatamente. Sí ello no es posible no almacenar más de 8 horas a temperatura ambiente.
Una vez transferido a la jeringa, debe utilizarse inmediatamente.
6.4 Precauciones especiales de conservación
Conservar por debajo de + 25° C. No congelar. Conserva el vial en su embalaje exterior.
6.5 Naturaleza y contenido del envase
Envase primario:
-Viales con el polvo:
-Presentación de 600/250 UI
Vial para inyección de vidrio tubular incoloro Tipo I según Farmacopea Europea, cerrados al vacío, provisto de tapón de goma (libres de látex), disco de plástico y cápsula de aluminio.
-Presentación de 1200/500 y 2400/1.000 UI
Vial para inyección de vidrio moldeado incoloro Tipo II según Farmacopea Europea, cerrados al vacío, provisto de tapón de goma (libres de látex), disco de plástico y cápsula de aluminio.
-Viales con el disolvente
Vial para inyección de vidrio tubular incoloro Tipo I según Farmacopea Europea, con superficie interna tratada, cerrados al vacío, provisto de tapón de goma (libres de látex), disco de plástico y cápsula de aluminio.
Presentaciones:
Envase con 600 UI/250 UI:
1 vial con polvo
1 vial con 5 mL de Agua para inyección 1 trasvasador 20/20 con filtro 1 jeringa de 5 mL de un solo uso
1 equipo para venopunción
2 toallitas impregnadas de alcohol 1 apósito adhesivo
Envase con 1200/500 UI:
1 vial con polvo
1 vial con 10 mL de Agua para inyección 1 trasvasador 20/20 con filtro 1 jeringa de 10 mL de un solo uso
1 equipo de venopunción
2 toallitas impregnadas de alcohol 1 apósito adhesivo
Envase con 2400/1.000 UI:
1 vial con polvo
1 vial con 15 mL de Agua para inyección 1 trasvasador 20/20 con filtro 1 jeringa de 20 mL de un solo uso
1 equipo de venopunción
2 toallitas impregnadas de alcohol 1 apósito adhesivo.
6.6 Precauciones especiales de eliminación y otras manipulaciones Instrucciones generales
-La solución debe ser clara o ligeramente opalescente. Después de extraer y filtrar el producto reconstituido (véase más adelante) debe revisarse visualmente, antes de la administración, para detectar la presencia de partículas extrañas y decoloraciones. Incluso cuando se observan estrictamente las normas sobre la reconstitución del producto, no es inusual que quede algún flóculo o alguna partícula, pero que son totalmente eliminadas con el trasvasador Mix2Vial 20/20 que se acompaña con el producto. La filtración no tiene ninguna influencia sobre el cálculo de la dosis. No debe usarse las soluciones turbias o soluciones que presenten flóculos o partículas después de la filtración.
-La reconstitución y la extracción deben realizarse bajo condiciones asépticas.
-Tras la administración, cualquier producto no utilizado o del material empleado se eliminarán de acuerdo con los requerimientos de la legislación local.
Reconstitución
Atemperar el disolvente a temperatura ambiente. Retirar las cápsulas de los viales, desinfectar la superficie de los tapones de goma, dejándolos secar antes de proceder a abrir el envase que contiene el Mix2Vial.
A.» *4
fjHfj
am

1
1. Abra el envase del Mix2Vial desprendiendo el precinto. No retire el Mix2Vial del envase de blíster.
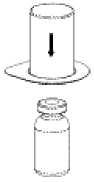
2
2. Coloque el vial del disolvente sobre una superficie limpia y plana y sujételo con firmeza. Sujete el Mix2Vial junto con el envase de blíster y empuje el terminal azul hacia abajo haciéndolo encajar en el tapón del vial del disolvente.
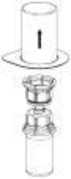
3
3. Retire con cuidado el envase de blíster del Mix2Vial sujetando el borde y tirando verticalmente hacia arriba. Asegúrese de que sólo retira el envase de blíster y no el Mix2Vial.

4
4. Coloque el vial del polvo sobre una superficie plana y firme. Invierta el vial del disolvente con el Mix2Vial acoplado y empuje el terminal del adaptador transparente hacia abajo encajándolo en el tapón del vial del polvo. El disolvente se transferirá automáticamente al vial del polvo.
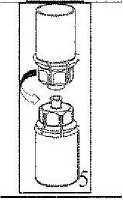
5. Con una mano, sujete el lado del vial del polvo del Mix2Vial y, con la otra mano, sujete el lado del vial del disolvente y desenrosque con cuidado el sistema de transferencia separándolo en dos piezas para evitar que se forme excesiva espuma al disolver el producto. Deseche el vial del disolvente con el adaptador del Mix2Vial azul acoplado.
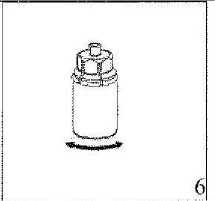
6. Someta el vial de la solución con el adaptador transparente acoplado a movimientos de rotación suaves hasta que la sustancia se haya disuelto por completo. No lo agite.
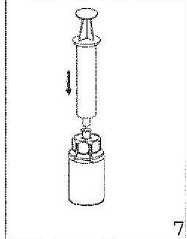
7. Llene de aire una jeringa vacía y estéril. Manteniendo el vial con la solución en posición vertical, conecte la jeringa al adaptador Luer Lock del Mix2Vial acoplado. Inyecte el aire al vial del producto.
Transvase de la solución preparada a la jeringa y administración
|
i |
J 8 |
8. Manteniendo el émbolo de la jeringa presionado, invierta el sistema (colocándolo cabeza abajo) y aspire el concentrado a la jeringa tirando del émbolo lentamente hacia atrás. | |||
|
I |
* i I |
► 3 |
9. Una vez que el concentrado se haya transferido a la jeringa, sujete con firmeza el cuerpo de la jeringa (manteniendo el émbolo abajo) y desconecte el adaptador transparente del Mix2Vial de la jeringa. | ||
Perfundir o inyectar inmediatamente por vía intravenosa lenta tomando la precaución de que no entre sangre en la jeringa (ver Forma de administración).
No utilizar después de la fecha de caducidad indicada en el estuche y en el envase.
Cualquier solución no utilizada debe desecharse de acuerdo con la legislación local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CSL Behring, S.A.
Avenida Diagonal, 601, 7° C Barcelona 08028 (España)
Responsable de la fabricación:
CSL Behring, GmbH Emil von Behring, 76 35014 Marburg. Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
HAEMATE P 600/250 UI N° de registro: 56.866.
HAEMATE P 1200/500 UI N° de registro: 56.867.
HAEMATE P 2400/1000 UI N° de registro: 56.868.
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de autorización: Enero 1986.
Fecha de revalidación: Junio 2010.
10. FECHA DE LA REVISIÓN DEL TEXTO
Octubre 2012.
13 de 13