Gonapeptyl Depot 3,75 Mg Polvo Y Disolvente Para Suspension Inyectable
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
GONAPEPTYL DEPOT 3,75 mg
Polvo y disolvente para suspensión inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Una jeringa precargada contiene 3,75 mg de triptorelina (como acetato) para ser suspendido en un ml del agente de suspensión que contiene sodio.
Tras la reconstitución, el producto contiene 3,69 mg/ml equivalente a 0,160 mmol/ml de sodio.
Para lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para suspensión inyectable.
Liberación prolongada en jeringas precargadas.
Descripción visual:
Antes del mezclado: Polvo blanco a débilmente amarillo y un líquido acuoso de color transparente.
Tras el mezclado: Suspensión homogénea blanco lechoso a débilmente amarillo.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
En el Hombre:
Tratamiento del cáncer de próstata localmente avanzado hormono-dependiente o metastásico.
En la Mujer:
Reducción pre-operatoria del tamaño del mioma para reducir los síntomas del sangrado y dolor en mujeres con miomas uterinos sintomáticos.
Endometriosis sintomática confirmada por laparoscopia, cuando por su extensión está indicada la supresión de la hormonogénesis ovárica ya que el tratamiento quirúrgico no está indicado como primera medida.
En Niños:
Tratamiento de la pubertad precoz central confirmada (niñas menores de 9 años y niños menores de 10 años).
4.2 Posología y forma de administración
El producto debe solo utilizarse bajo la supervisión de un especialista que disponga de los recursos apropiados para una monitorización regular de la respuesta.
El tratamiento de niños con triptorelina debe ser administrado bajo la supervisión general de un endocrino pediátrico o de un pediatra o endocrino con experiencia en el tratamiento de la pubertad precoz central.
Es importante que la inyección de la forma de liberación sostenida sea realizada estrictamente siguiendo las instrucciones descritas en la sección 6.6.
Una vez reconstituida la suspensión, proceder a la inyección inmediata.
Dosificación y forma de administración
La dosis de una jeringa, equivalente a 3,75 mg de triptorelina, se inyecta cada 28 días bien subcutáneamente (es decir en la piel del abdomen, de la nalga o del muslo) o por inyección intramuscular profunda. Debe variarse cada vez el lugar de inyección.
En el Hombre:
Una inyección con una jeringa cada cuatro semanas, equivalente a 3,75 mg de triptorelina. Con el fin de que la supresión de los niveles de testosterona sea continua, es importante que la administración se efectúe estrictamente cada 4 semanas.
En la Mujer:
- Miomas uterinos y endometriosis:
Una inyección con una jeringa cada 4 semanas, equivalente a 3,75 mg de triptorelina.
El tratamiento debe iniciarse dentro de los cinco primeros días del ciclo.
En Niños:
La dosificación al comienzo del tratamiento debe basarse en el peso corporal, se deberá inyectar una inyección de triptorelina en los días 0, 14, y 28. Posteriormente una inyección cada 4 semanas. Si el efecto se considera insuficiente, las inyecciones se pueden administrar cada tres semanas.
La dosificación debe basarse en el peso corporal de acuerdo con la tabla.
|
Peso corporal |
Dosificación |
|
< 20 kg |
1,875 mg (media dosis) |
|
20-30 kg |
2,5 mg (2/3 dosis) |
|
> 30 kg |
3,75 mg (dosis completa) |
Aviso a los grupos específicos de pacientes:
- No es necesario ajustar la dosis en ancianos.
- De acuerdo con los datos actuales, no es necesaria la reducción o extensión de los intervalos de dosificación para aquellos pacientes que presentan la función renal alterada.
Duración de la administración
- Carcinoma de próstata:
El tratamiento con GONAPEPTYL Depot es considerado habitualmente como tratamiento de larga duración.
- Miomas uterinos y endometriosis:
La duración del tratamiento depende de la gravedad inicial de la endometriosis y de la evolución de los síntomas clínicos (funcionales y anatómicos) así como de la evolución del tamaño de los miomas uterinos, determinado por ecografía durante el tratamiento.
Generalmente, el resultado máximo alcanzable se obtiene tras tres o cuatro inyecciones.
El tratamiento no debe superar los 6 meses por su posible efecto sobre la masa ósea. (Ver sección 4.4).
- Pubertad precoz central (PPC):
El tratamiento se debe suspender si se ha alcanzado la maduración ósea en niñas mayores de 12 años y en niños mayores de 13 años.
4.3 Contraindicaciones
En General:
Hipersensibilidad conocida a la triptorelina, poli-(d,l láctido coglicólido), dextrano, o a cualquiera de los excipientes.
Hipersensibilidad a la hormona liberadora de gonadotropinas (GnRH) o cualquier otro análogo de GnRH.
En la Mujer:
- Embarazo.
- Período de lactancia.
4.4 Advertencias y precauciones especiales de empleo
General:
El uso de agonistas de la GnRH puede causar una disminución de la densidad mineral ósea. En el hombre, los datos preliminares sugieren que el uso de un bifosfonato en combinación con un agonista de la GnRH puede reducir la pérdida mineral ósea.
Se recomienda una especial precaución en pacientes con otros factores de riesgo para la osteoporosis (como abuso crónico del alcohol, tabaquismo, tratamiento de larga duración con medicamentos que reducen la densidad mineral ósea, como antiepilépticos o corticoides, antecedentes familiares de osteoporosis, malnutrición).
Rara vez, el tratamiento con agonistas de la GnRH puede revelar la presencia de un adenoma hipofisario de células gonadotróficas desconocido hasta ese momento. Estos pacientes pueden presentar una apoplejía hipofisaria caracterizada por un cuadro súbito de cefalea, vómitos, alteraciones visuales y oftalmoplejía.
En pacientes tratados con agonistas de la GnRH, como la triptorelina, hay un riesgo aumentado de aparición de casos de depresión (que pueden ser graves). Si aparecen síntomas, los pacientes deben ser informados y tratados adecuadamente.
Se han notificado cambios de humor. Los pacientes con depresión conocida deben mantenerse bajo una estrecha vigilancia durante el tratamiento.
En el hombre:
Inicialmente, la triptorelina, al igual que otros agonistas de la GnRH, provocan un aumento transitorio de los niveles de testosterona sérica. En consecuencia, pueden darse algunos casos aislados de empeoramiento transitorio de los signos y síntomas de cáncer de próstata durante las primeras semanas de tratamiento. Durante la fase inicial de tratamiento, debe considerarse la administración adicional de un antiandrógeno adecuado o un antagonista de la GnRH para contrarrestar el aumento inicial de la concentración de testosterona sérica y el empeoramiento de los síntomas clínicos.
Un pequeño número de pacientes puede experimentar un empeoramiento temporal de los signos y síntomas de su cáncer de próstata (exacerbación tumoral) y temporalmente incrementarse el dolor asociado al cáncer (dolor metastático), que se pueden controlar con un tratamiento sintomático.
Al igual que con otros agonistas de la GnRH, se han dado casos aislados de compresión de la médula espinal u obstrucción de la uretra. Si se produce compresión de la médula espinal o insuficiencia renal, debe administrarse el tratamiento habitual para esas complicaciones y, en casos extremos, considerarse una orquiectomía inmediata (castración quirúrgica). Se recomienda una estrecha vigilancia durante las
primeras semanas de tratamiento, especialmente en pacientes con riesgo de compresión de la médula espinal por metástasis vertebrales y en pacientes con obstrucción del tracto urinario. .
Después de la castración quirúrgica, la triptorelina no consigue ninguna reducción adicional de los niveles de testosterona sérica.
La deprivación androgénica prolongada, bien sea por orquiectomía bilateral o por administración de análogos de la GnRH, se asocia a un mayor riesgo de pérdida ósea y puede dar lugar a osteoporosis y a un incremento del riesgo de fractura ósea.
El tratamiento con deprivación androgénica puede prolongar el intervalo QT.
En pacientes con antecedentes o factores de riesgo de prolongación del intervalo QT y en pacientes que reciben medicamentos concomitantes que pueden prolongar el intervalo QT (ver sección 4.5) el médico deberá evaluar la relación beneficio riesgo incluyendo el potencial de Torsade de pointes antes de iniciar el tratamiento con GONAPEPTYL.
Además, los datos epidemiológicos indican que los pacientes pueden experimentar cambios metabólicos (como intolerancia a la glucosa) o un mayor riesgo de enfermedad cardiovascular durante el tratamiento de deprivación androgénica. Sin embargo, los datos prospectivos no han confirmado la relación entre el tratamiento con análogos de la GnRH y el aumento de la mortalidad cardiovascular. Los pacientes con un alto riesgo de enfermedades metabólicas o cardiovasculares deben ser evaluados cuidadosamente antes de iniciar el tratamiento y someterse a los controles oportunos durante el tratamiento de deprivación androgénica.
La administración de triptorelina en dosis terapéuticas da lugar a la supresión del ejehipofiso-gonadal. El funcionamiento normal suele restablecerse al suspender el tratamiento. Las pruebas diagnósticas de la función hipofiso-gonadalrealizadas durante el tratamiento y una vez finalizado el mismo con análogos de la GnRH pueden, por tanto, ser equívocas.
En la Mujer:
Gonapeptyl depotsólo debe ser prescrito una vez efectuado un diagnóstico detallado (por ej. laparoscopia.)
Debe confirmarse que la paciente no esté embarazada antes de prescribir triptorelina.
Como la menstruación se retira durante el tratamiento con GONADOPEPTYL Depot, se debe indicar a la paciente que informe a su médico si sigue menstruando con regularidad.
Pérdida de densidad mineral ósea.
El uso de agonistas de la GnRH suele causar una reducción media del 1% de la densidad mineral ósea mensualmente durante un período de seis meses de tratamiento. Cada 10% de pérdida de densidad mineral ósea multiplica por dos o tres veces el riesgo de fractura. Por este motivo, el tratamiento sin medidas terapéuticas auxiliares no debe exceder más de 6 meses. Una vez retirado el tratamiento, la pérdida ósea suele revertir en el plazo de 6 a 9 meses.
En la mayoría de las mujeres, los datos actualmente disponibles sugieren una recuperación de la densidad mineral ósea tras la finalización del tratamiento.
No hay datos específicos disponibles sobre pacientes con osteoporosis confirmada o con factores de riesgo para la osteoporosis (como abuso crónico de alcohol, tabaquismo, tratamiento de larga duración con medicamentos que reducen la densidad mineral ósea, como antiepilépticos o corticoides, antecedentes familiares de osteoporosis o malnutrición, p. ej., en casos de anorexia nerviosa). La pérdida de densidad mineral ósea es probablemente más perjudicial en estas pacientes, por lo que el tratamiento con triptorelina debe considerarse en cada caso y solo debe iniciarse únicamente si los beneficios son mayores que los riesgos tras una cuidadosa evaluación. Deben considerarse además otras medidas adicionales para contrarrestar la pérdida de densidad mineral ósea.
Miomas uterinos y endometriosis:
No es normal la aparición de una metrorragia durante el curso del tratamiento (a excepción del primer mes), por lo cual deberá verificarse el nivel de estrógeno plasmático. Este nivel debe ser inferior a 50 pg/ml, deben verificarse posibles lesiones orgánicas asociadas. Finalizado el tratamiento, la función ovárica se recupera, por ejemplo: la menstruación se restablecerá después de 7-12 semanas de la inyección final.
Deben utilizarse medidas contraceptivas no hormonales durante el mes inicial del tratamiento ya que puede provocarse la ovulación mediante la liberación inicial de gonadotropinas. Deberán utilizarse, además, desde 4 semanas después de la última inyección hasta que la menstruación se restablezca o hasta que se haya establecido otro método anticonceptivo.
El tamaño del útero y de los miomas debe verificarse regularmente durante el tratamiento, por ejemplo mediante ecografía. En casos aislados una reducción rápida, desproporcionada, del tamaño del útero en comparación con la reducción del tejido del mioma ha provocado hemorragias y sepsis.
Se han notificado algunos casos de hemorragia en pacientes con miomas submucosos después del tratamiento con análogos de la GnRH. Normalmente, la hemorragia se produce entre 6 y 10 semanas tras el iniciodel tratamiento.
En Niños:
La edad cronológica al inicio del tratamiento debe ser inferior a 9 años en niñas e inferior a 10 años en niños.
En niñas, la estimulación inicial de los ovarios al inicio del tratamiento, seguida del descenso de los estrógenos inducido por el tratamiento, puede ocasionar, en el primer mes, sangrado vaginal de intensidad leve o moderada.
Una vez finalizado el tratamiento se producirá el desarrollo de las características de la pubertad. La información respecto a la fertilidad futura es limitada. En la mayoría de las niñas, la menstruación tendrá lugar transcurrido un año desde la finalización del tratamiento, la cual en la mayoría de los casos será regular.
La densidad mineral ósea puede disminuir durante el tratamiento con análogos de la GnRH para la pubertad precoz central. No obstante, tras finalizar del tratamiento se mantiene la adquisición posterior de masa ósea y el pico de masa ósea que se alcanza en la adolescencia tardía no parece verse afectado por el tratamiento.
Tras la retirada del tratamiento con GnRH puede observarse desplazamiento epifisiario de la cabeza femoral. La teoría sugerida es que las concentraciones bajas de estrógenos durante el tratamiento con agonistas GnRH debilitan la lámina epifisaria. El incremento en la velocidad de crecimiento tras la retirada del tratamiento ocasionaría una reducción de la fuerza necesaria para el desplazamiento de la epífisis.
El tratamiento de niños con tumores cerebrales progresivos deben ser seguidoscon una cuidadosa valoración individual de los riesgos y los beneficios.
Debe ser excluida la pubertad seudo-precoz (tumores gonadales o adrenales o hiperplasia) y pubertad precoz independiente de la gonadotropina (toxicosis testicular, hiperplasia familiar de las células de Leydig).
Se han comunicado reacciones alérgicas y anafilácticas en adultos y en niños. Tanto reacciones en el lugar de inyección como síntomas sistémicos. No se ha podido esclarecer su patogenia. Se ha observado una tasa elevada de casos informados.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se recomienda precaución cuando la triptorelina se administre conjuntamente con medicamentos que afecten a la secreción hipofisaria de gonadotropinas y siempre habrá que vigilar el estado hormonal del paciente.
Dado que el tratamiento de deprivación androgénica puede prolongar el intervalo QT, se debe evaluar cuidadosamente el uso concomitante de GONAPEPTYL con medicamentos que prolongan el intervalo QT o medicamentos capaces de inducir Torsade de pointes como medicamentos antiarrítmicos de clase IA (por ejemplo, quinidina, disopiramida) o clase III (por ejemplo, amiodarona, sotalol, dofetilida, ibutilida), la metadona, la moxifloxacina, antipsicóticos, etc (ver sección 4.4).
No se han realizado estudios formales de la interacción con otros medicamentos. No se puede descartar la posibilidad de interacciones con medicamentos de uso habitual, como productos liberadores de histamina.
4.6 Fertilidad, embarazo y lactancia
Antes del tratamiento se debe realizar un meticuloso examen a las mujeres en edad fértil para descartar un posible embarazo.
Los datos limitados sobre la utilización de triptorelina durante el embarazo no indican un aumento del riesgo de malformaciones congénitas. Sin embargo, los estudios de seguimiento de desarrollo embrionario a largo plazo son muy limitados. Los datos obtenidos en animales de experimentación no indican la presencia de daños directos o indirectos en relación con el embarazo o desarrollo postnatal, aunque existen indicios de toxicidad fetal y retraso del parto. Basándonos en los efectos farmacológicos, no se pueden excluir efectos deletéreos sobre el embarazo ni sobre la descendencia, y GONAPEPTYL Depot no debe ser utilizado durante el embarazo.
Las mujeres fértiles, deben utilizar métodos contraceptivos no hormonales eficaces durante el tratamiento hasta que se reanude la menstruación.
Se desconoce si la triptotrelina se excreta por la leche materna humana. Debido a las posibles reacciones adversas de la triptorelina en el lactante, se debe discontinuar la lactancia materna antes y durante su administración.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre la capacidad para conducir y utilizar máquinas. Sin embargo, la capacidad para conducir y utilizar máquinas puede verse afectada si el paciente experimenta mareo, somnolencia y alteraciones visuales como posibles efectos adversos del tratamiento o como resultado de la enfermedad subyacente.
4.8 Reacciones adversas
A continuación se muestran las reacciones adversas reportadas entre los pacientes tratados con triptorelina durante el desarrollo de los ensayos clínicos y vigilancia post-comercialización. Como consecuencia de un descenso de los niveles de tetosterona o de estrógenos, la mayoría de los pacientes son susceptibles de padecer reacciones adversas como sofocos, siendo los que se han comunicado de forma más frecuente (30% en hombres y 75-100% en mujeres). Adicionalmente, entre 30-40% de pacientes varones pueden sufrir impotencia y descenso de la líbido, mientras que sangrado/manchado, sudoración, sequedad vaginal, y/o dispareunia, descenso de la líbido, dolor de cabeza y cambios de humor son las reacciones adversas reportadas por más de un 10% de mujeres.
Debido a que normalmente se produce un aumento de los niveles de testosterona durante la primera semana de tratamiento, puede ocurrir una acentuación de los síntomas clínicos (es decir, obstrucción urinaria, dolor vertebral debido a metástasis, compresión de la médula espinal, fatiga muscular y edema linfático en las piernas.) En algunos casos la obstrucción del tracto urinario disminuye la función renal. Se ha observado compresión neurológica con astenia y parestesia en piernas.
Tolerabilidad general en el hombre (ver Advertencias y precauciones especiales de empleo)
Como ocurre con otros tratamientos de agonistas de la GnRH o tras la castración quirúrgica, las reacciones adversas observadas con más frecuencia relacionadas con el tratamiento de triptorelina, se debieron a sus efectos farmacológicos conocidos: aumento inicial de los niveles de testosterona, seguido de la supresión casi total de esa hormona. Estos efectos son sofocos (50%), disfunción eréctil y disminución de la libido.
Se han notificado las siguientes reacciones adversas, consideradas al menos como posiblemente relacionadas con el tratamiento con triptorelina. La mayoría de ellas se sabe que están relacionadas con la castración bioquímica o quirúrgica.
|
Clasificación del sistema de órganos de MedDRA |
Muy frecuentes (>1/10) |
F recuentes (>1/100 y <1/10) |
Poco frecuentes (>1/1000 y <1/100) |
Frecuencia no conocida | ||
|
En el hombre | ||||||
|
Infecciones e infestaciones |
Nasofaringitis | |||||
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
Reacción anafiláctica | ||||
|
Trastornos del metabolismo y la nutrición |
Disminución del apetito |
Aumento del apetito, gota, diabetes mellitus | ||||
|
Trastornos psiquiátricos |
Disminución de la libido |
Cambios de humor, humor depresivo, depresión, trastornos del sueño |
Insomnio, confusión, disminución de la actividad, euforia, ansiedad, pérdida de libido | |||
|
Trastornos del sistema nervioso |
Dolor de cabeza |
Mareo, parestesia, alteración de la memoria, disgeusia, somnolencia, distasia | ||||
|
Trastornos oculares |
Sensación anormal en el ojo, alteración de la visión, visión borrosa | |||||
|
Trastornos del oído y del laberinto |
Acúfenos, vértigo | |||||
|
Trastornos vasculares |
Sofocos |
Embolia, hipertensión |
Hipotensión | |||
|
Trastornos respiratorios, torácicos y mediastínicos |
Agravamiento del asma |
Disnea, ortopnea, epistaxis | ||||
|
Trastornos gastrointestinales |
Náuseas |
Dolor abdominal alto, sequedad de boca |
Dolor abdominal, estreñimiento, diarrea, vómitos, distensión abdominal, flatulencia, gastralgia | |
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis |
Hipotricosis, alopecia |
Acné, prurito, exantema, ampollas, angioedema, urticaria, púrpura | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor de huesos |
Mialgia, artralgia |
Dolor de espalda, dolor musculoesquelético, dolor en las extremidades, espasmos musculares, debilidad muscular, rigidez muscular, inflamación de las articulaciones, rigidez musculoesquelética, osteoartritis | |
|
Trastornos renales y urinarios |
Disuria | |||
|
Trastornos del aparato reproductor y de la mama |
Disfunción eréctil |
Ginecomastia |
Atrofia testicular |
Dolor de mama, dolor testicular, ausencia de eyaculación |
|
Trastornos generales y alteraciones en el lugar de administración |
Cansancio, reacción en el lugar de inyección, dolor en el lugar de inyección, irritabilidad |
Astenia, eritema en el lugar de inyección, inflamación en el lugar de inyección, edema, dolor, escalofríos, dolor torácico, enfermedad parecida a la gripe, pirexia, malestar general | ||
|
Exploraciones complementarias |
Elevación de la lactato deshidrogenasa en sangre, elevación de la gamma-glutamiltransfer asa, elevación de la aspartato aminotransferas a, elevación de la alanino aminotransferas |
Elevación de la creatinina en sangre, tensión arterial alta, elevación de la urea en sangre, elevación de la fosfatasa alcalina en sangre, aumento de la temperatura corporal Prolongación QT (ver secciones 4.4 y 4.5) |
LITTCA ALDAD ota efe
|
a, ganancia de peso, pérdida de peso |
La triptorelina causa una elevación transitoria de los niveles de testosterona sérica la primera semana tras la inyección inicial de la formulación de liberación sostenida. Con este aumento inicial de la testosterona, un pequeño porcentaje de pacientes (< 5%) pueden experimentar un empeoramiento temporal de los signos y síntomas del cáncer de próstata (exacerbación tumoral), generalmente con un aumento de las molestias urinarias (< 2%) y del dolor metastásico (5%), que se pueden controlar con un tratamiento sintomático. Estos síntomas son transitorios y suelen desaparecer en el plazo de una o dos semanas.
Se han dado casos aislados de exacerbación de los síntomas de la enfermedad, tanto obstrucción uretral como compresión de la médula espinal por metástasis. Por consiguiente, los pacientes con lesiones vertebrales metastásicas u obstrucción del tracto urinario superior o inferior deben ser vigilados de cerca durante las primeras semanas de tratamiento (ver Advertencias y precauciones especiales de empleo).
El uso de agonistas de la GnRH para el tratamiento del cáncer de próstata puede asociarse a una mayor pérdida ósea y dar lugar a osteoporosis y a un mayor riesgo de fractura.
Tolerabilidad general en la mujer (ver Advertencias y precauciones especiales de empleo)
Como consecuencia del descenso de los niveles de estrógenos, las reacciones adversas más frecuentes (observadas en el 10% o más de las mujeres) son dolor de cabeza, disminución de la líbido, trastornos del sueño, cambios de humor, dispareunia, dismenorrea, hemorragia genital, síndrome de hiperestimulación ovárica, dolor pélvico por hipertrofia ovárica, dolor abdominal, sequedad vulvovaginal, hiperhidrosis, sofocos y astenia.
Se han notificado las siguientes reacciones adversas, consideradas al menos como posiblemente relacionadas con el tratamiento con triptorelina. La mayoría de ellas se sabe que están relacionadas con la castración bioquímica o quirúrgica.
|
Clasificación del sistema de órganos de MedDRA |
Muy frecuentes (>1/10) |
F recuentes (>1/100 y <1/10) |
Poco frecuentes (>1/1000 y |
Frecuencia no conocida | ||
|
<1/100) | ||||||
|
En la mujer | ||||||
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
Reacción anafiláctica | ||||
|
Trastornos psiquiátricos |
Disminución de la líbido, cambios de humor, trastornos del |
Humor depresivo, depresión |
Confusión, ansiedad | |||
|
sueño | ||||||
|
Trastornos del sistema nervioso |
Dolor de cabeza |
Parestesia |
Mareo | |||
|
Trastornos oculares |
Alteración de la visión |
Visión borrosa | ||||
|
Trastornos del oído y del laberinto |
Vértigo | |||||
|
Trastornos vasculares |
Sofocos | |||||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea | |||||
|
Trastornos gastrointestinales |
Dolor abdominal |
Náuseas |
Molestias abdominales, diarrea, vómitos | |||
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis |
Prurito, exantema, angioedema, urticaria | ||||
|
Trastornos musculoesqueléticos y del tejido conectivo |
Dolor de huesos |
Mialgia, artralgia |
Dolor de espalda |
Trastornos esqueléticos*, espasmos musculares, debilidad muscular | ||
|
Trastornos del aparato reproductor y de la mama |
Hemorragia vaginal, sequedad vulvovaginal, dispareunia, dismenorrea, síndrome de hiperestimulaci ón ovárica, hipertrofia ovárica, dolor pélvico |
Dolor de mama, menorragia, metrorragia, amenorrea | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
Astenia |
Cansancio, reacción en el lugar de inyección, dolor en el lugar de inyección, irritabilidad |
Eritema en el lugar de inyección, inflamación en el lugar de inyección, pirexia, malestar general | |||
|
Exploraciones complementarias |
Elevación de la lactato deshidrogenasa en sangre, elevación de la gamma-glutamil transferasa, elevación de la aspartato aminotransferas |
Tensión arterial alta, ganancia de peso, pérdida de peso | ||||
LITTCA ALDAD ota efe
|
a, elevación de la alanina aminotransferas a, aumento del colesterol en sangre |
(*) Puede ocurrir una ligera pérdida de la masa ósea trabecular. Ésta es generalmente reversible a los 6 - 9 meses tras finalizar el tratamiento (ver sección 4.4).
Al inicio del tratamiento, es muy frecuente (> 10%) que empeoren los síntomas de endometriosis, incluyendo dolor pélvico, dismenorrea durante el aumento transitorio inicial de las concentraciones plasmáticas de estradiol. Estos síntomas son transitorios y normalmente desaparecen en una o dos semanas.
En el mes siguiente a la primera inyección puede producirse hemorragia genital, incluida menorragia, metrorragia.
Puede observarse hipertrofia ovárica y dolor pélvico y/o abdominal.
]£

Tolerabilidad general en niños (ver Advertencias y precauciones especiales de empleo)
|
Clasificación del sistema de órganos |
Muy frecuentes (>1/10) |
F recuentes (>1/100 y |
Poco frecuentes |
Frecuencia no conocida | ||
|
de MedDRA |
<1/10) |
(>1/1000 y | ||||
|
<1/100) | ||||||
|
En niños | ||||||
|
Trastornos del sistema inmunológico |
Reacción anafiláctica |
Reacción de hipersensibilidad | ||||
|
Trastornos psiquiátricos |
Cambios de humor, depresión |
Inestabilidad afectiva, nerviosismo | ||||
|
Trastornos del sistema nervioso |
Dolor de cabeza | |||||
|
Trastornos oculares |
Visión borrosa, alteración de la visión | |||||
|
Trastornos vasculares |
Sofocos | |||||
|
Trastornos respiratorios, torácicos y mediastínicos |
Epistaxis | |||||
|
Trastornos gastrointestinales |
Náuseas, vómitos |
Molestias abdominales, dolor abdominal | ||||
|
Trastornos de la piel y del tejido subcutáneo |
Exantema, edema angioneurótico,urticaria, alopecia, eritema | |||||
|
Trastornos musculoesqueléticos y del tejido conectivo |
Epifisiolisis*, mialgia | |||||
|
Trastornos del aparato reproductor y de la mama |
Hemorragia vaginal, flujo vaginal |
Hemorragia genital | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
Eritema en el lugar de inyección, inflamación en el lugar de inyección, malestar general, dolor, dolor en el lugar de inyección , | |||||
|
Exploraciones complementarias |
Tensión arterial alta, ganancia de peso | |||||
(*)Se han notificado pocos casos de deslizamiento epífisario de la cabeza femoral durante el uso de triptorelina.
5AN IDAD, POLITICA LITIGA SOCIAL E IGUALDAD IALDAD Agencia espanoia de cisoe
productos san-tanos taws
Se han notificado casos de incremento de los adenomas hipofisarios pre-existentes durante el tratamiento con agonistas LH-RH, sin embargo no se han observado con el tratamiento de triptorelina.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
No existen datos suficientes de sobredosis con triptorelina para establecer conclusiones acerca de posibles efectos adversos. No se espera que se produzca sobredosis en vista de la forma farmacéutica y del tipo de envase.
En caso de sobredosis, debe administrarse un tratamiento sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Análogos de la gonadorelina.
Código ATC: L02AE04.
La triptorelina es un decapéptido sintético análogo de la hormona liberadora de gonadotropina natural (GnRH). La GnRH es un decapéptido, sintetizado en el hipotálamo y regula la biosíntesis y liberación de las gonadotropinas LH (hormona luteinizante) y FSH (hormona estimuladora del folículo), por la hipófisis. La triptorelina estimula la hipófisis de forma más eficaz para la secreción de LH y FSH que una dosis similar de gonadorelina, y con una duración de actividad mayor. El aumento de los niveles de LH y FSH conduce inicialmente, a un incremento de la concentración de testosterona sérica en el hombre y de estrógenos séricos en la mujer.
La administración crónica de agonistas de la GnRH da lugar a una inhibición de la secreción hipofisaria de LH y de FSH. Esta inhibición conduce a una reducción de la esteroidogénesis, causando una caída de los niveles de estradiol sérico en la mujer y de testosterona sérica en el hombre, dentro del rango de la posmenopausia o de la castración, respectivamente. Esto es, se crea un estado de hipogonadismo hipogonadotrópico. En niños con pubertad precoz, decrece la concentración de estradiol o de testosterona a niveles dentro del rango prepuberal. Los niveles plasmáticos de DHEAS (dihidroepiandrostenodiona sulfato) no se modifican. Terapéuticamente, estos resultados conducen a una reducción en el hombre, del crecimiento de tumores prostáticos dependientes de testosterona, y a una reducción en la mujer de los focos de endometriosis y de los miomas uterinos estrógeno-dependientes. Con respecto a los miomas uterinos, el efecto terapéutico máximo se observa en mujeres con anemia (hemoglobina igual o inferior a 8g/dl ). En niños afectos de pubertad precoz, el tratamiento con triptorelina conduce a la secreción de gonadotropinas, estradiol y testosterona, a niveles prepuberales. Esto resulta en la detección e incluso regresión de los signos puberales, y a un aumento en la predicción de la estatura final prevista en pacientes con purbertad precoz.
5.2 Propiedades farmacocinéticas
Después de la inyección intramuscular de GONAPEPTYL Depot, se determinan las concentraciones plasmáticas de triptorelina por la degradación lenta del polímero poli-(d,l láctido coglicólido) . El mecanismo inherente a esta forma de administración permite esta liberación lenta de la triptorelina desde el polímero.
Después de la administración de triptorelina depot I.M. o S.C. (microcápsulas de liberación sostenida), se registra un rápido aumento en la concentración de la triptorelina plasmática, con un pico máximo en las primeras horas. Posteriormente la concentración de triptorelina desciende notablemente en 24 horas. El día 4, el valor alcanza un segundo pico máximo, cayendo por debajo del límite de detección de forma biexponencial transcurridos 44 días. Tras una inyección S.C. el aumento de la triptorelina es más gradual y en cierta forma con una menor concentración que tras una inyección I.M.. Después de una inyección S.C. el descenso de la concentración de triptorelina se prolonga, con valores por debajo del límite de detección transcurridos 65 días.
No existe evidencia de acumulación de triptorelina en ambas formas de administración durante el tratamiento superior a 6 meses y con una administración cada 28 días. Los valores de triptorelina plasmáticos disminuyeron hasta 100 pg/ml previo a la siguiente administración después de la administración I.M. o S.C. (valores medios.) Se asume que la fracción no sistémica de triptorelina se metaboliza en el lugar de inyección, es decir, por macrófagos.
En la hipófisis, la triptorelina sistémica se inactiva por la escisión del N - terminal vía piroglutamil-peptidasa y endopeptidasa neutra. La triptorelina se degrada en el hígado y riñón en péptidos biológicamente inactivos y aminoácidos.
A los 40 minutos de finalizar la infusión de 100 pg de triptorelina (sobre 1 hora) el 3-14% de la dosis administrada ya se ha eliminado por vía renal.
En pacientes con la función renal alterada, no es necesario el ajuste e individualización del tratamiento con la formulación de triptorelina depot, gracias a su marcada eliminación renal y amplio rango terapéutico de la triptorelina como componente activo.
Biodisponibilidad:
En el Hombre:
La biodisponibilidad sistémica del componente activo triptorelina desde el depot intramuscular es del 38,3% durante los primeros 13 días. Como promedio, la nueva liberación es lineal al 0,92% de la dosis diaria. La biodisponibilidad después de la administración S.C. es del 69% de la disponibilidad I.M..
En la Mujer:
Transcurridos 27 días del ensayo, se puede detectar una media del 35,7% de la dosis aplicada, donde el 25,5% se libera durante los primeros 13 días, con una liberación posterior lineal media del 0,73% de la dosis.
En General:
El cálculo de los parámetros cinéticos dependientes de un modelo (t/2, Kel, etc.) no es aplicable en presentaciones con una liberación prolongada del componente activo.
5.3 Datos preclínicos sobre seguridad
Se ha detectado un aumento de los tumores hipofisarios en ratas, no en ratones, tratadas con triptorelina durante largos periodos de tiempo. No se conoce el efecto de la triptorelina en las alteraciones hipofisarias en humanos. Esta observación no se ha considerado relevante en humanos. También se han observado tumores hipofisarios en roedores en relación con análogos de la LHRH.
Se ha observado una ligera embrio/fetotoxicidad que causa un retraso en el desarrollo embrio-fetal así como, retraso en el parto en ratas. Los datos de los estudios preclínicos no han revelado indicaciones que puedan sugerir riesgo en humanos, basados en la toxicidad a dosis repetidas y los estudios de genotoxicidad. La inyección intramuscular o subcutánea de GONAPEPTYL Depot o su agente de suspensión producen reacciones retardadas de cuerpo extraño en el lugar de inyección. En 8 semanas, estas reacciones retardadas pueden ser reversibles tras la administración intramuscaular, pero sólo ligeramente reversibles tras la inyección subcutánea. La tolerabilidad local de GONAPEPTYL Depot después de la inyección intravenosa fue limitada.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Una jeringa precargada con polvo contiene:
Poli-(d,l láctido coglicólido)
Dicaprilocaprato de Propilenglicol
Una jeringa precargada con un ml del agente de suspensión contiene:
Dextrano 70 Polisorbato 80 Cloruro sódico
Fosfato de hidrogeno sódico dihidrato Hidróxido sódico Agua para inyección.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad este producto no deberá mezclarse con otros productos.
6.3 Periodo de validez
3 años.
Suspensión reconstituida: 3 minutos.
6.4 Precauciones especiales de conservación
Conservar entre 2°C - 8°C (nevera). Conservar en el envase exterior.
6.5 Naturaleza y contenido del envase
Polvo: Jeringa precargada.
Disolvente: Jeringa precargada.
Jeringas precargadas (vidrio de borosilicato tipo I, transparente) con un conector (polipropileno), tapón de goma negro clorobutilo (tampón embolo, tipo I) y aguja de inyección.
Envases:
1 jeringa precargada (polvo) más 1 jeringa precargada (disolvente)
3 jeringas precargadas (polvo) más 3 jeringas precargadas (disolvente)
No todas las presentaciones están disponibles en España
6.6 Precauciones especiales de eliminación y otras manipulaciones
GONAPEPTYL Depot es solo para un único uso y cualquier suspensión sin utilizar deberá descartarse.
1. Preparación
Instrucciones para el médico sobre cómo preparar la suspensión.
Puesto que el éxito del tratamiento depende de la correcta preparación de la suspensión, deben seguirse estrictamente las siguientes instrucciones.
]£
- Sacar el envase de GONAPEPTYL Depot de la nevera.
- Quitar el capuchón de la jeringa desechable que contienen el polvo. Mantenerla vertical para evitar derrames.
- Abrir el envase que contiene el conector sin quitarlo.
- Enroscar la jeringa que contiene las microesferas de liberación sostenida en el conector del envase, y luego quitarlo.
- Enroscar la jeringa que contiene el disolvente para suspensión fuertemente en la parte libre del conector y asegurarse que está firmemente enroscado.

Disolvente para suspensión
o
<u
e
o
o
Microcápsulas de liberación sostenida
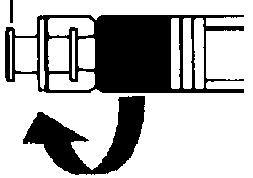
Preparación
2. Reconstitución de la suspensión
- Vaciar el disolvente sobre la jeringa con el polvo, a continuación inyectar y retirar el contenido en la primera jeringa - las dos o tres primeras veces sin empujar el vástago de la jeringa hasta el final. Repetir aprox. 10 veces la operación o hasta que se obtenga una suspensión homogénea lechosa blanca a ligeramente amarilla. Al preparar la suspensión, puede producirse espuma. Es importante disolver la espuma o retirarla de la jeringa antes de aplicar la inyección.
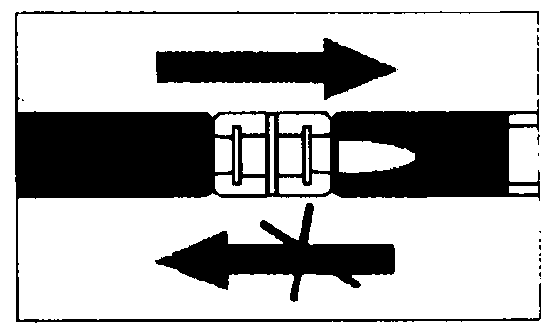
Mezclado
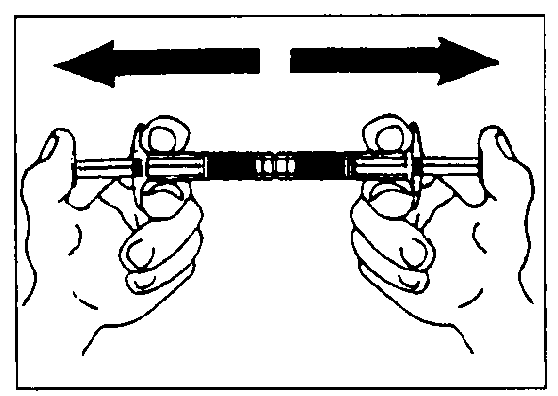
Mezclar aproximadamente 10 veces
3. Inyección
- Retirar el conector junto con la jeringa vacía.
- Colocar la aguja en la jeringa que contiene la suspensión lista para su uso.
- Inyectar inmediatamente bien subcutáneamente o profundamente en el músculo.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FERRING, S.A.U.
C/ Orense 4 - 7° derecha 28020 Madrid España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
64.530
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27 de marzo 2001.
Renovación de la autorización: marzo 2006.
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2015
SAN IDAD, POLITICA LITIGA
SOCIAL E IGUALDAD IALDAD
Agencia esparto» de cSacse-
medicamentos y ¡y
proouctcs san-íanos taws
17 de 17