Gine-Canesten 100 Mg/G Crema Vaginal
"I
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Gine-Canestén 100 mg/g crema vaginal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada gramo de crema contiene 100 mg de clotrimazol Excipientes: Alcohol cetoestearílico, 35 mg por gramo de crema.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Crema vaginal
La crema es de color blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de la candidiasis vulvovaginal no complicada (ver sección 4.4)
Deben tenerse en cuenta las recomendaciones oficiales sobre el uso adecuado de agentes antifúngicos.
4.2 Posología y forma de administración
Posología
Adultos y adolescentes mayoresde 12 años: Aplicar la crema vaginal contenida en el aplicador directamente con el aplicador preferentemente por la noche antes de acostarse. La crema debe ser introducida profundamente en la vagina (ver instrucciones de uso del aplicador), estando la paciente acostada de espaldas y con las piernas ligeramente dobladas.
En aquellas mujeres cuyos síntomas persistan al finalizar el tratamiento o en caso de recurrencia a los dos meses del primer episodio, se recomienda que el paciente acuda a su médico para evaluar posibles patologías subyacentes.
Forma de administración
Vía vaginal
El médico debe valorar, en función de la extensión y de la localización de la infección, un tratamiento adicional con antifúngicos de uso cutáneo en la zona vulvar.
Pacientes inmunocomprometidos (en tratamiento con corticoides orales, trasplantados, con infección por VIH o con diabetes mellitus)
Estos pacientes deben consultar con el médico antes de iniciar el tratamiento (ver sección 4.4).
Mujeres embarazadas
ÍTTI
En caso de tratamiento en las últimas 4 ó 6 semanas del embarazo, no se recomienda el uso del aplicador. Por lo que se recomienda el uso de comprimidos vaginales en lugar de la crema vaginal, ya que éstos pueden introducirse directamente con el dedo (ver sección 4.6)
No usar tampones, duchas intravaginales, espermicidas u otros productos vaginales mientras utilice este medicamento.
No se recomienda iniciar el tratamiento durante la menstruación. El tratamiento debe haber finalizado antes del inicio de la menstruación.
4.3 Contraindicaciones
Hipersensibilidad al clotrimazol, a cualquier otro antimicótico del grupo de los imidazoles o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
No se recomienda el uso de este medicamento en mujeres inmunocomprometidas, tales como mujeres con diabetes mellitus, con infección por VIH, SIDA, trasplantadas o en tratamiento con corticoides orales dado que este grupo de población suelen presentar infección complicada que no responde bien a pautas de tratamiento cortas.
En esta población además se ha descrito una mayor prevalencia de infecciones causadas por especies de Candida no albicans. Se han descrito casos de disminución de la sensibilidad a azoles en candidiasis vulvovaginal causada por estas especies de Candida no albicans. Este hecho debe tenerse en cuenta en el tratamiento de infecciones causadas por estas especies, por ejemplo C. glabrata.
Se debe consultar a un médico si los síntomas empeoran durante el tratamiento o se mantienen después de 3 días o se observa aumento del flujo vaginal o cambios en su aspecto u olor, o sangrado.
Si el paciente tuviera fiebre (38°C o más), dolor abdominal, dolor de lumbar o de espalda, secreciones vaginales acuosas abundantes, nauseas y/o hemorragias vaginales, deberá evaluarse su situación clínica para descartar otro tipo de patologías.
Evitar el contacto con ojos, ya que produciría escozor. Si accidentalmente se produce contacto con los ojos, lavar con agua abundante y consultar a un oftalmólogo si fuese necesario. No ingerir.
Si se produce alguna reacción de hipersensibilidad durante su utilización, deberá suspenderse el tratamiento y se aplicarán las medidas terapéuticas adecuadas.
Información importante sobre excipientes
Este medicamento puede producir reacciones locales en la piel (como dermatitis de contacto) porque contiene alcohol cetoestearílico.
4.5 Interacción con otros medicamentos y otras formas de interacción
El uso concomitante de clotrimazol vaginal junto con tacrolimus orales (FK-506; inmunosupresores) podrían producir un aumento de los niveles plasmáticos de tacrolimus y similarmente con sirolimus. Los pacientes deben ser monitorizados minuciosamente si aparecen los síntomas de sobredosis de tacrolimus o sirolimus mediante el control de los niveles plasmáticos de los mismos.
Este medicamento puede reducir la eficacia y la seguridad de los productos de látex, como condones y diafragmas, cuando se aplica en el área genital (mujeres: por vía intravaginal, labios y área adyacente de la vulva; los hombres: prepucio y glande del pene). Este efecto es temporal y aparece sólo durante el
ÍTTI
tratamiento. No obstante, Se recomienda evitar las relaciones sexuales en caso de infección vaginal y mientras se usa este medicamento para evitar que la pareja se infecte.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Los datos disponibles sobre el uso del clotrimazol en mujeres embarazadas son limitados. Los estudios realizados en animales han mostrado que dosis elevadas de clotrimazol, por vía oral, tienen efectos nocivos sobre la reproducción (ver sección 5.3). Dado que la absorción de clotrimazol por vía vaginal es limitada (3-10%), no se esperan riesgos para la madre y el niño, después del uso intravaginal de clotrimazol durante el embarazo; no obstante, el médico debe evaluar el beneficio de la utilización del medicamento frente a los posibles riesgos.
Lactancia
La información farmacodinámica/toxicológica disponible en estudios en animales ha mostrado que el clotrimazol y sus metabolitos se excretan en la leche materna (ver sección 5.3). Debido a que se desconoce si la administración intravaginal en humanos podría dar lugar a una absorción sistémica suficiente como para que el clotrimazol y sus metabolitos se hallen en cantidades detectables en la leche materna, no se puede descartar el riesgo para el lactante. Se debe tomar la decisión de interrumpir la lactancia o abstenerse del tratamiento, teniendo en cuenta el beneficio de la lactancia para el bebé y el beneficio del tratamiento para la madre.
Fertilidad
No se han realizado estudios en humanos sobre los efectos que puede producir el uso del clotrimazol en la fertilidad, sin embargo, los estudios en animales no han demostrado ningún efecto adverso en la fertilidad de los mismos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Gine-Canestén sobre la capacidad para conducir y utilizar máquinas es nula.
4.8 Reacciones adversas
Las siguientes reacciones adversas han sido identificadas durante el uso posterior a la aprobación de clotrimazol. Debido a que estas reacciones son reportados voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera fiable su frecuencia.
Las reacciones adversas más frecuentes son:
Trastornos del sistema inmunológico:
Reacciones alérgicas (sincope, hipotensión, disnea, urticaria)
Trastornos del aparato reproductor y de la mama:
Descamación vaginal, prurito, erupción, edema, eritema molestias, quemazón, irritación, dolor pélvico y hemorragia vaginal.
Trastornos gastrointestinales:
Dolor abdominal.
Estos síntomas no suelen determinar la supresión del tratamiento y son más frecuentes durante los primeros días del mismo.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales
ÍTTI
sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
El riesgo de intoxicación aguda o sobredosis es poco probable que ocurra después de una sola aplicación vaginal (aplicación sobre una gran superficie en condiciones favorables para la absorción) o la ingestión oral inadvertida. No existe un antídoto específico.
Una ingestión accidental puede provocar molestias gastrointestinales y/o vómitos.
Una administración accidental en los ojos puede causar quemazón e irritación ocular sin gravedad, en ese caso enjuagar los ojos con abundante cantidad de agua.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Derivados imidazólicos y triazólicos.
Código ATC: G01A F02
El clotrimazol es un antifúngico derivado del grupo imidazol.
El clotrimazol impide el crecimiento de hongos actuando a nivel de la síntesis del ergosterol. La inhibición de la síntesis del ergosterol provoca la alteración estructural y funcional de la membrana citoplasmática, dando lugar a un cambio en la permeabilidad de la membrana que finalmente provoca la lisis celular.
El clotrimazol es un antifúngico de amplio espectro, con actividad in vitro e in vivo, frente a dermatofitos, levaduras y mohos.
En condiciones de estudio adecuadas, los valores de la concentración mínima inhibitoria (CMI) para estas especies de hongos están entre 0,062 y -8 pg/ml de substrato. In vitro, el clotrimazol ha demostrado ser fungistático o fungicida dependiendo de la concentración. Actúa como fungistático a concentraciones iguales a las CMI, y como fungicida cuando estas concentraciones son aproximadamente 5 veces las CMI.
Resistencia
Las variantes de resistencia primaria de las especies fúngicas sensibles son poco frecuentes. Hasta el momento, el desarrollo de resistencia secundaria en cepas sensibles sólo se ha observado en casos muy aislados bajo condiciones terapéuticas.
5.2 Propiedades farmacocinéticas
Las investigaciones farmacocinéticas tras la aplicación dérmica han demostrado que sólo se absorbe una pequeña cantidad de clotrimazol en sangre. Las concentraciones séricas resultantes están siempre por debajo del límite de detección (< 10 ng/ml) y no provocan efectos sistémicos.
5.3 Datos preclínicos sobre seguridad
Los datos preclínicos obtenidos en estudios convencionales de seguridad farmacológica, toxicidad de dosis repetidas, genotoxicidad y potencial carcinogénico no muestran riesgos especiales para el tratamiento de seres humanos con clotrimazol por vía vaginal.
En un estudio de fertilidad en ratas se observó una reducción de la supervivencia neonatal en el grupo tratado con 50 mg/kg de peso corporal de clotrimazol, pero dosis de hasta 25 mg/kg de peso corporal no perjudicaron el desarrollo de las crías. Clotrimazol no afectó a la fertilidad.
No se demostraron efectos de teratogenicidad en ratones, conejos y ratas que recibieron dosis orales de hasta 200, 180, y 100 mg/kg, respectivamente.
4 de 6 MINISTERIO DE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia espanoiaóe medie amentos y productos san-lanos
.-ítp.
JPa
ÍTTI
Un estudio con ratas lactantes que recibieron clotrimazol por vía intravenosa mostró que los niveles de clotrimazol en leche son de 10 a 20 veces superiores a los plasmáticos 4 horas tras la administración y que estos disminuyen a 0.4 veces los niveles en plasma a las 24 horas.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Estearato de sorbitán,
Polisorbato 60,
Palmitato de cetilo,
Alcohol cetoestearílico,
Miristato de isopropilo Alcohol bencílico,
Agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
24 meses.
6.4 Precauciones especiales de conservación
Mantener este medicamento fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 25°C.
6.5 Naturaleza y contenido del envase
Envase con 1 aplicador desechable conteniendo 5 g de crema vaginal.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local, o se procederá a su devolución a la farmacia.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BAYER HISPANIA, S.L.
Av. Baix Llobregat, 3-5, 08970 Sant Joan Despí (Barcelona)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
59.019
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
01 Febrero 2008
alBÜPS
•m
10. FECHA DE LA REVISIÓN DEL TEXTO
05/2014
INSTRUCCIONES PARA LA PREPARACIÓN DE RADIOFÁRMACOS

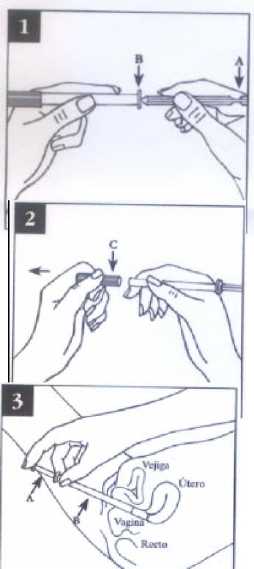
INSTRUCCIONES PARA EL USO DEL APLICADOR
1. Introducir el émbolo (A) en el aplicador.
2. Retirar el tapón (C) desenroscándolo.
3. Introducir el aplicador lo más profundamente posible en la vagina (de preferencia con la paciente acostada de espaldas y con las piernas ligeramente dobladas) vaciándolo mediante presión sobre el émbolo.
4. Retirar el aplicador y desecharlo.
6 de 6