Fycompa 10 Mg Comprimidos Recubiertos Con Pelicula
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Fycompa 2 mg comprimidos recubiertos con película Fycompa 4 mg comprimidos recubiertos con película Fycompa 6 mg comprimidos recubiertos con película Fycompa 8 mg comprimidos recubiertos con película Fycompa 10 mg comprimidos recubiertos con película Fycompa 12 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Fycompa 2 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 2 mg de perampanel.
Excipiente con efecto conocido:
Cada comprimido de 2 mg contiene 78,5 mg de lactosa (como monohidrato). Para consultar la lista completa de excipientes, ver sección 6.1.
Fycompa 4 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 4 mg de perampanel.
Excipiente con efecto conocido:
Cada comprimido de 4 mg contiene 157,0 mg de lactosa (como monohidrato). Para consultar la lista completa de excipientes, ver sección 6.1.
Fycompa 6 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 6 mg de perampanel.
Excipiente con efecto conocido:
Cada comprimido de 6 mg contiene 151,0 mg de lactosa (como monohidrato). Para consultar la lista completa de excipientes, ver sección 6.1.
Fycompa 8 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 8 mg de perampanel.
Excipiente con efecto conocido:
Cada comprimido de 8 mg contiene 149,0 mg de lactosa (como monohidrato). Para consultar la lista completa de excipientes, ver sección 6.1.
Fycompa 10 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 10 mg de perampanel. Excipiente con efecto conocido:
Cada comprimido de 10 mg contiene 147,0 mg de lactosa (como monohidrato). Para consultar la lista completa de excipientes, ver sección 6.1.
Fycompa 12 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 12 mg de perampanel.
Excipiente con efecto conocido:
Cada comprimido de 12 mg contiene 145,0 mg de lactosa (como monohidrato). Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película (comprimido)
Fycompa 2 mg comprimidos recubiertos con película
Comprimido biconvexo, redondo, de color naranja, con la inscripción E275 en una cara y ‘2’ en la otra cara
Fycompa 4 mg comprimidos recubiertos con película
Comprimido biconvexo, redondo, de color rojo, con la inscripción E277 en una cara y ‘4’ en la otra cara
Fycompa 6 mg comprimidos recubiertos con película
Comprimido biconvexo, redondo, de color rosa, con la inscripción E294 en una cara y ‘6’ en la otra cara
Fycompa 8 mg comprimidos recubiertos con película
Comprimido biconvexo, redondo, de color morado, con la inscripción E295 en una cara y ‘8’ en la otra cara
Fycompa 10 mg comprimidos recubiertos con película
Comprimido biconvexo, redondo, de color verde, con la inscripción E296 en una cara y ‘10’ en la otra cara
Fycompa 12 mg comprimidos recubiertos con película
Comprimido biconvexo, redondo, de color azul, con la inscripción E297 en una cara y ‘12’ en la otra cara
DATOS CLÍNICOS
4.
4.1 Indicaciones terapéuticas
Fycompa está indicado para el tratamiento concomitante de las crisis de inicio parcial con o sin generalización secundaria en pacientes adultos y adolescentes a partir de 12 años de edad con epilepsia.
Fycompa está indicado para el tratamiento concomitante de las crisis tonicoclónicas generalizadas primarias en pacientes adultos y adolescentes a partir de 12 años de edad con epilepsia idiopática generalizada (ver sección 5.1).
4.2 Posología y forma de administración
Posología
Adultos y adolescentes
La dosis de Fycompa se debe ajustar conforme a la respuesta individual de cada paciente para lograr el equilibrio entre la eficacia y la tolerabilidad.
Perampanel se debe tomar por vía oral una vez al día al acostarse.
Crisis de inicio parcial
Perampanel a dosis de 4 mg/día a 12 mg/día ha demostrado ser un tratamiento eficaz en las crisis de inicio parcial.
El tratamiento con Fycompa se debe iniciar con una dosis de 2 mg/día. Se puede aumentar la dosis en incrementos de 2 mg (semanalmente o cada 2 semanas de acuerdo con las consideraciones relativas a la semivida descritas más abajo) hasta una dosis de mantenimiento de 4 mg/día a 8 mg/día, conforme a la respuesta clínica y la tolerabilidad. En función de la respuesta clínica y de la tolerabilidad de cada paciente a la dosis de 8 mg al día, se puede aumentar la dosis en incrementos de 2 mg/día hasta 12 mg/día. A los pacientes que toman de forma concomitante medicamentos que no acortan la semivida del perampanel (ver sección 4.5), el aumento de la dosis se les debe realizar a intervalos de 2 semanas como mínimo. A los pacientes que toman de forma concomitante medicamentos que acortan la semivida del perampanel (ver sección 4.5), el aumento de la dosis se les debe realizar a intervalos de 1 semana como mínimo.
Crisis tonicoclónicas generalizadas primarias
Perampanel a dosis de hasta 8 mg/día ha demostrado ser un tratamiento eficaz en las crisis tonicoclónicas generalizadas primarias.
El tratamiento con Fycompa se debe iniciar con una dosis de 2 mg/día. Se puede aumentar la dosis en incrementos de 2 mg (semanalmente o cada 2 semanas de acuerdo con las consideraciones relativas a la semivida descritas más abajo) hasta una dosis de mantenimiento de 8 mg/día como máximo, conforme a la respuesta clínica y la tolerabilidad. En función de la respuesta clínica y de la tolerabilidad de cada paciente a la dosis de 8 mg al día, se puede aumentar la dosis hasta 12 mg/día, lo que puede ser eficaz para algunos pacientes (ver sección 4.4). A los pacientes que toman de forma concomitante medicamentos que no acortan la semivida del perampanel (ver sección 4.5), el aumento de la dosis se les debe realizar a intervalos de 2 semanas como mínimo. A los pacientes que toman de forma concomitante medicamentos que acortan la semivida del perampanel (ver sección 4.5), el aumento de la dosis se les debe realizar a intervalos de 1 semana como mínimo.
Suspensión
Se recomienda suspender el tratamiento de forma gradual para minimizar la posibilidad de crisis de rebote. Sin embargo, debido a su semivida prolongada y al consiguiente descenso lento en las concentraciones plasmáticas, se puede suspender el tratamiento con perampanel de forma inmediata en caso de ser absolutamente necesario.
Dosis olvidadas
Si olvidó una sola dosis: ya que perampanel tiene una semivida larga, el paciente debe esperar y tomar la siguiente dosis de la forma programada.
Si olvidó más de una dosis durante un periodo continuo de menos de 5 semividas (3 semanas en los pacientes que no toman antiepilépticos inductores del metabolismo de perampanel, 1 semana en los pacientes que toman antiepilépticos inductores del metabolismo de perampanel [ver sección 4.5]), se debe considerar la posibilidad de recomenzar el tratamiento desde el último nivel de dosis.
Si un paciente no ha tomado perampanel durante un periodo continuo de más de 5 semividas, se recomienda seguir las recomendaciones posológicas iniciales anteriormente indicadas.
Personas de edad avanzada (65 años y mayores)
Los estudios clínicos con Fycompa en epilepsia no incluyeron un número suficiente de sujetos de 65 años y mayores para determinar si responden de forma diferente a los sujetos más jóvenes. El análisis de la información de seguridad de 905 sujetos de edad avanzada tratados con perampanel (en estudios doble ciego realizados en indicaciones que no eran epilepsia) no reveló ninguna diferencia relacionada con la edad con respecto al perfil de seguridad. Los resultados, junto con la ausencia de una diferencia relacionada con la edad en la exposición a perampanel, indican que no es necesario ajustar la dosis en esta población de pacientes. Perampanel se debe utilizar con precaución en las personas de edad avanzada, teniendo en cuenta la posibilidad de interacciones medicamentosas en pacientes polimedicados (ver sección 4.4).
Insuficiencia renal
No es necesario ajustar la dosis en los pacientes con insuficiencia renal de leve. No se recomienda el uso en pacientes con insuficiencia renal moderada o grave o en pacientes que reciben hemodiálisis.
Insuficiencia hepática
El aumento de la dosis en pacientes con insuficiencia hepática de leve a moderada se debe basar en la respuesta clínica y en la tolerabilidad. En los pacientes con insuficiencia hepática de leve a moderada, se puede iniciar el tratamiento con una dosis de 2 mg. Se deberá aumentar la dosis de los pacientes en incrementos de 2 mg a intervalos de 2 semanas como mínimo en función de la tolerabilidad y la eficacia.
La dosis máxima de perampanel en pacientes con insuficiencia hepática de leve a moderada es de 8 mg.
No se recomienda el uso en pacientes con insuficiencia hepática severa.
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de perampanel en niños menores de 12 años.
No se dispone de datos.
Forma de administración
Fycompa se debe tomar como una sola dosis por vía oral al acostarse. Se puede tomar con o sin alimentos (ver sección 5.2). Se debe tragar el comprimido entero con un vaso de agua. No se debe masticar, triturar ni partir. Los comprimidos no se pueden partir de forma exacta ya que no tienen ranura para partir.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Ideación suicida
Se han notificado casos de ideación y conductas suicidas en pacientes tratados con antiepilépticos en varias indicaciones. Un metanálisis de los ensayos aleatorizados y controlados con placebo con antiepilépticos también ha mostrado un pequeño aumento del riesgo de ideación y conductas suicidas. Se desconoce el mecanismo de este riesgo y los datos disponibles no descartan la posibilidad de un aumento del riesgo con perampanel.
Por lo tanto, se deberá vigilar a los pacientes por si presentan signos de ideación y conductas suicidas, y considerar el tratamiento adecuado. Se debe advertir a los pacientes (y a los cuidadores de los pacientes) que, en el caso de que aparezcan signos de ideación o conductas suicidas, consulten al médico.
Trastornos del sistema nervioso
Perampanel puede producir mareo y somnolencia y, por lo tanto, puede afectar a la capacidad para conducir y utilizar máquinas (ver sección 4.7).
Anticonceptivos orales
Fycompa, a dosis de 12 mg/día, puede reducir la eficacia de los anticonceptivos hormonales que contienen progesterona; en esta situación, se recomienda utilizar además otros métodos anticonceptivos no hormonales cuando se utilice Fycompa (ver sección 4.5).
Caídas
Parece que hay un mayor riesgo de caídas, especialmente en las personas de edad avanzada; el motivo subyacente no está claro.
Agresividad
Se han notificado casos de conducta agresiva y hostil en pacientes que reciben tratamiento con perampanel. En los pacientes tratados con perampanel en los ensayos clínicos, se notificaron casos de agresividad, ira e irritabilidad con mayor frecuencia con dosis más altas. La mayoría de los acontecimientos notificados fueron de naturaleza leve o moderada y los pacientes se recuperaron de forma espontánea o con un ajuste de la dosis. Sin embargo, se observaron pensamientos de lesionar a los demás, agresiones físicas o conductas amenazantes en algunos pacientes (<1 % en los estudios clínicos de perampanel). Se debe aconsejar a los pacientes y cuidadores que informen al profesional sanitario inmediatamente si observan cambios significativos en el estado de ánimo o en los patrones de conducta. Si se presentan estos síntomas, se debe reducir la dosis de perampanel y si los síntomas son graves, se debe suspender inmediatamente el tratamiento.
Potencial de abuso
Se debe tener precaución en pacientes con antecedentes de abuso de sustancias y se debe vigilar al paciente por si presenta síntomas de abuso de perampanel.
Uso concomitante con antiepilépticos inductores de CYP3A
Las tasas de respuesta después de añadir perampanel a dosis fijas fueron inferiores cuando los pacientes recibieron de forma concomitante antiepilépticos inductores de la enzima CYP3A (carbamazepina, fenitoína, oxcarbazepina), en comparación con las tasas de respuesta en los pacientes que recibieron de forma concomitante antiepilépticos no inductores de la enzima. Se debe vigilar la respuesta del paciente cuando se le cambia de antiepilépticos no inductores de la enzima a antiepilépticos inductores de la enzima y viceversa, utilizados de forma concomitante. En función de la respuesta clínica y de la tolerabilidad de cada paciente, se puede aumentar o reducir la dosis 2 mg cada vez (ver sección 4.2).
Uso concomitante de otros medicamentos (no antiepilépticos) inductores o inhibidores del citocromo P450
Se debe vigilar estrechamente la respuesta clínica y la tolerabilidad de los pacientes cuando se les añada o retire inductores o inhibidores del citocromo P450, ya que los niveles plasmáticos de perampanel pueden aumentar o disminuir; puede ser necesario ajustar la dosis de perampanel.
Fycompa contiene lactosa; por lo tanto, los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Fycompa no se considera un inductor o inhibidor potente del citocromo P450 o de las enzimas de UGT (ver sección 5.2).
Anticonceptivos orales
En mujeres sanas tratadas con 12 mg (pero no con 4 u 8 mg/día) durante 21 días de forma concomitante con un anticonceptivo oral combinado, Fycompa demostró que disminuye la exposición de levonorgestrel (los valores medios en la Cmáx y el AUC disminuyeron en un 40 % cada uno). El AUC de etinilestradiol no se vio afectada con la dosis de 12 mg de Fycompa mientras que la Cmáx disminuyó en un 18 %. Por lo tanto, se debe tener en cuenta la posibilidad de una disminución de la eficacia de los anticonceptivos orales que contienen progesterona en las mujeres que necesitan 12 mg/día de Fycompa, y se debe utilizar un método fiable adicional (dispositivo intrauterino [DIU], preservativo) (ver sección 4.4).
Interacciones entre Fycompa y otros antiepilépticos:
Se evaluaron las posibles interacciones entre Fycompa (hasta 12 mg una vez al día) y otros antiepilépticos (AE) en estudios clínicos y se analizaron en el análisis farmacocinético poblacional de cuatro estudios de fase III agrupados que incluyeron a pacientes con crisis de inicio parcial y crisis tonicoclónicas generalizadas primarias. El efecto de estas interacciones en la concentración media en estadio estacionario se resume en la siguiente tabla.
|
AE coadministrado |
Influencia del AE en la concentración de Fycompa |
Influencia de Fycompa en la concentración del AE |
|
Carbamazepina |
Reducción por un factor de 2,75 |
Reducción <10 % |
|
Clobazam |
Ninguna influencia |
Reducción <10 % |
|
Clonazepam |
Ninguna influencia |
Ninguna influencia |
|
Lamotrigina |
Ninguna influencia |
Reducción <10 % |
|
Levetiracetam |
Ninguna influencia |
Ninguna influencia |
|
Oxcarbazepina |
Reducción por un factor de 1,9 |
Aumento del 35 %' |
|
Fenobarbital |
Ninguna influencia |
Ninguna influencia |
|
Fenitoína |
Reducción por un factor de 1,7 |
Ninguna influencia |
|
Topiramato |
Reducción del 19 % |
Ninguna influencia |
|
Ácido valproico |
Ninguna influencia |
Reducción <10 % |
|
Zonisamida |
Ninguna influencia |
Ninguna influencia |
1) No se evaluó el metabolito activo monohidroxicarbazepina.
Se ha demostrado que algunos antiepilépticos conocidos como inductores enzimáticos (carbamazepina, fenitoína, oxcarbazepina) aumentan el aclaramiento de perampanel y consecuentemente reducen las concentraciones plasmáticas de perampanel.
La carbamazepina, un inductor enzimático potente y conocido, redujo los niveles de perampanel en dos terceras partes en un estudio realizado en sujetos sanos.
Se observó un resultado similar en un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que recibieron hasta 12 mg/día de perampanel y de pacientes con crisis tonicoclónicas generalizadas primarias que recibieron hasta 8 mg/día de perampanel en ensayos clínicos controlados con placebo. El aclaramiento total de Fycompa aumentó cuando se administró con carbamazepina (se multiplicó por 2,75), fenitoína (se multiplicó por 1,7) y oxcarbazepina (se multiplicó por 1,9), que son inductores conocidos de las enzimas del metabolismo (ver sección 5.2). Se debe tener en cuenta y controlar este efecto al añadir o retirar estos antiepilépticos del régimen de tratamiento de un paciente.
En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que recibieron hasta 12 mg/día de Fycompa en ensayos clínicos controlados con placebo, Fycompa no afectó de forma clínicamente relevante al aclaramiento de clonazepam, levetiracetam, fenobarbital, fenitoína, topiramato, zonisamida, carbamazepina, clobazam, lamotrigina y ácido valproico, con la dosis más alta de perampanel evaluada (12 mg/día).
En el análisis farmacocinético poblacional de epilepsia, se observó que perampanel redujo el aclaramiento de oxcarbazepina en un 26 %. La enzima citosólica reductasa metaboliza rápidamente la oxcarbazepina para formar el metabolito activo, la monohidroxicarbazepina. Se desconoce el efecto de perampanel en las concentraciones de monohidroxicarbazepina.
La dosis de perampanel se ajusta conforme al efecto clínico, independientemente de otros antiepilépticos.
Efecto de perampanel en los sustratos de CYP3A
En sujetos sanos, Fycompa (6 mg una vez al día durante 20 días) disminuyó el AUC de midazolam en un 13 %. No se puede descartar una disminución mayor en la exposición de midazolam (u otros sustratos de GYP3A sensibles) a dosis más altas de Fycompa.
Efecto de los inductores del citocromo P450 en la farmacocinética de perampanel
Se espera que los inductores potentes del citocromo P450, como la rifampicina y la hierba de San Juan, reduzcan las concentraciones de perampanel y no se puede descartar la posibilidad de alcanzar concentraciones plasmáticas más altas de metabolitos reactivos en presencia de estos inductores. Se ha demostrado que felbamato reduce las concentraciones de algunos medicamentos y puede asimismo reducir las concentraciones de perampanel.
Efecto de los inhibidores del citocromo P450 en la farmacocinética de perampanel
En sujetos sanos, el inhibidor de CYP3A4 ketoconazol (400 mg una vez al día durante 10 días) aumentó el AUC de perampanel en un 20 % y prolongó la semivida de perampanel en un 15 %
(67,8 horas frente a 58,4 horas). No se pueden descartar efectos mayores cuando se combine perampanel con un inhibidor de CYP3A que tenga una semivida mayor que la de ketoconazol o cuando se administre el inhibidor durante un periodo de tratamiento más prolongado.
Levodopa
En sujetos sanos, Fycompa (4 mg una vez al día durante 19 días) no tuvo ningún efecto en la Cmáx o el AUC de la levodopa.
Alcohol
Los efectos de perampanel en las tareas que requieren un estado de alerta y vigilia, como la capacidad para conducir, fueron aditivos o supra-aditivos a los efectos del propio alcohol, como se demostró en un estudio de interacción farmacodinámica en sujetos sanos. La administración de múltiples dosis de 12 mg/día de perampanel aumentó los niveles de enfado, confusión y depresión, evaluados utilizando la escala de clasificación de 5 puntos del perfil del estado de ánimo (ver sección 5.1). Estos efectos pueden observarse asimismo cuando se utiliza Fycompa en combinación con otros depresores del sistema nervioso central (SNC).
Población pediátrica
Los estudios de interacciones se han realizado solo en adultos.
En un análisis farmacocinético poblacional de los pacientes adolescentes de los estudios clínicos de fase III no se observaron diferencias destacables entre esta población y la población global.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil y anticonceptivos en hombres y mujeres
No se recomienda utilizar Fycompa en mujeres en edad fértil que no estén utilizando métodos anticonceptivos a menos que sea claramente necesario.
Embarazo
Hay datos limitados (datos en menos de 300 embarazos) relativos al uso de perampanel en mujeres embarazadas. Los estudios en animales no indicaron efectos teratogénicos en ratas ni en conejos, aunque se observó embriotoxicidad en ratas con dosis tóxicas para la madre (ver sección 5.3). No se recomienda utilizar Fycompa durante el embarazo.
Lactancia
Los estudios en ratas lactantes muestran que perampanel y/o sus metabolitos se excretan en la leche (para mayor información ver sección 5.3). Se desconoce si perampanel se excreta en la leche materna. No se puede excluir el riesgo en recién nacidos/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con Fycompa tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
En el estudio de fertilidad en ratas se observaron ciclos estrales prolongados e irregulares en las hembras con las dosis altas (30 mg/kg); sin embargo, estos cambios no afectaron a la fertilidad ni al desarrollo embrionario temprano. No se observó ningún efecto en la fertilidad de los machos (ver sección 5.3). No se ha establecido el efecto de perampanel en la fertilidad de los seres humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Fycompa sobre la capacidad para conducir y utilizar máquinas es moderada. Perampanel puede producir mareo y somnolencia y, por lo tanto, puede tener un efecto sobre la capacidad para conducir y utilizar máquinas. Se aconseja que los pacientes no conduzcan, ni utilicen máquinas complejas ni realicen otras actividades potencialmente peligrosas hasta que sepan si perampanel afecta a su capacidad para realizar estas actividades (ver secciones 4.4 y 4.5).
4.8 Reacciones adversas
Resumen del perfil de seguridad
En todos los ensayos, tanto controlados como no controlados, en pacientes con crisis de inicio parcial, 1639 sujetos han recibido perampanel, de los cuales 1147 han recibido tratamiento durante 6 meses y 703 sujetos durante más de 12 meses.
En los ensayos controlados y no controlados en pacientes con crisis tonicoclónicas generalizadas primarias, 114 sujetos han recibido perampanel, de los cuales 68 han recibido tratamiento durante 6 meses y 36 sujetos durante más de 12 meses.
Reacciones adversas que dieron lugar a la suspensión del tratamiento:
En los ensayos clínicos de fase III controlados de crisis de inicio parcial, la tasa de suspensión debida a una reacción adversa fue del 1,7 %, 4,2 % y 13,7 % en los pacientes aleatorizados a recibir perampanel a las dosis recomendadas de 4 mg, 8 mg y 12 mg/día, respectivamente, y del 1,4 % en los pacientes aleatorizados a placebo. Las reacciones adversas más frecuentes (>1 % en todo el grupo de perampanel y más frecuentes que con placebo) que dieron lugar a la suspensión del tratamiento fueron el mareo y la somnolencia.
En el ensayo clínico de fase III controlado de crisis tonicoclónicas generalizadas primarias, la tasa de suspensión debida a una reacción adversa fue del 4,9 % en los pacientes aleatorizados a recibir 8 mg de perampanel y del 1,2 % en los pacientes aleatorizados a recibir placebo. La reacción adversa más frecuente (>2 % en el grupo de perampanel y más frecuente que con placebo) que dio lugar a la suspensión del tratamiento fue el mareo.
Tabla de reacciones adversas
En la siguiente tabla se enumeran las reacciones adversas, identificadas en base a la revisión de la base de datos completa de los estudios clínicos con Fycompa, según el sistema de clasificación de órganos y la frecuencia. Se ha utilizado la siguiente convención para clasificar las reacciones adversas: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100).
Dentro de cada categoría de frecuencia, las reacciones adversas se presentan en orden decreciente de gravedad.
|
Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetito Aumento del apetito | ||
|
Trastornos psiquiátricos |
Agresividad Enfado Ansiedad Estado de confusión |
Ideación suicida Intento de suicidio | |
|
Trastornos del sistema nervioso |
Mareo Somnolencia |
Ataxia Disartria Trastorno del equilibrio Irritabilidad | |
|
Trastornos oculares |
Diplopía Visión borrosa | ||
|
Trastornos del oído y del laberinto |
Vértigo | ||
|
Trastornos gastrointestinales |
Náuseas |
|
Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor de espalda | ||
|
Trastornos generales |
Trastorno de la marcha Fatiga | ||
|
Exploraciones complementarias |
Aumento del peso | ||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Caída |
Población pediátrica
Según la base de datos de ensayos clínicos de 196 adolescentes expuestos a perampanel elaborada a partir de estudios con doble enmascaramiento para crisis de inicio parcial y crisis tonicoclónicas generalizadas primarias, el perfil de seguridad general en los adolescentes fue similar al observado en los adultos, salvo por la agresividad, que se observó con más frecuencia en los adolescentes que en los adultos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
La experiencia clínica con respecto a sobredosis con perampanel en seres humanos es limitada. En un informe de una sobredosis intencionada que podría haber supuesto una dosis de hasta 264 mg, el paciente experimentó alteraciones del estado mental, agitación y comportamiento agresivo, y se recuperó sin secuelas. No se dispone de ningún antídoto específico para los efectos de perampanel. Está indicado el tratamiento de apoyo general del paciente que incluye la monitorización de las constantes vitales y la observación del estado clínico del paciente. En vista de su semivida prolongada, los efectos causados por perampanel podrían ser duraderos. Debido al bajo nivel de aclaramiento renal, es poco probable que intervenciones especiales como la diuresis forzada, la diálisis o la hemoperfusión resulten útiles.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antiepilépticos, otros antiepilépticos, código ATC: N03AX22 Mecanismo de acción
Perampanel es el primer antagonista en su clase no competitivo y selectivo de los receptores ionotrópicos de glutamato de tipo AMPA (ácido a-amino-3-hidroxi-5-metil-4-isoxazolepropiónico) en las neuronas postsinápticas. El glutamato es el principal neurotransmisor excitatorio del sistema nervioso central e interviene en diversos trastornos neurológicos causados por una sobreexcitación neuronal. Se cree que la activación de los receptores de AMPA por el glutamato media en la mayor parte de la transmisión sináptica excitatoria rápida en el cerebro. En los estudios in vitro, perampanel no compitió con AMPA por la unión a los receptores de AMPA, sino que la unión de perampanel fue desplazada por los antagonistas no competitivos de los receptores de AMPA, lo que indica que perampanel es un antagonista no competitivo de los receptores de AMPA. In vitro, perampanel inhibió el aumento de calcio intracelular inducido por AMPA (aunque no el inducido por NMDA).
In vivo, perampanel prolongó de forma significativa la latencia de las crisis en un modelo de crisis inducidas por AMPA.
El mecanismo exacto por el que perampanel ejerce sus efectos antiepilépticos en los seres humanos todavía no está totalmente elucidado.
Efectos farmacodinámicos
Se realizó un análisis farmacocinético y farmacodinámico (eficacia) basado en los datos agrupados de los 3 ensayos de eficacia en las crisis de inicio parcial. Además, se realizó un análisis farmacocinético y farmacodinámico (eficacia) en un ensayo de eficacia para crisis tonicoclónicas generalizadas primarias. En ambos análisis, la exposición a perampanel se correlaciona con una disminución de la frecuencia de las crisis.
Rendimiento psicomotor
Dosis únicas y múltiples de 8 mg y 12 mg produjeron un deterioro del rendimiento psicomotor en voluntarios sanos de forma dosis dependiente. Los efectos de perampanel en tareas complejas como la capacidad para conducir fueron aditivos o supra-aditivos a los efectos negativos del alcohol. Los resultados de las pruebas del rendimiento psicomotor volvieron a los valores basales en el plazo de 2 semanas tras suspender la administración de perampanel.
Función cognitiva
En un estudio en voluntarios sanos para evaluar los efectos de perampanel en el estado de alerta y la memoria utilizando una serie de pruebas estándar, no se observaron efectos de perampanel tras administrar dosis únicas y múltiples de hasta 12 mg/día de perampanel.
Estado de alerta y de ánimo
Los niveles de alerta (vigilia) se redujeron de forma dosis dependiente en los sujetos sanos que recibieron de 4 a 12 mg/día de perampanel. Hubo un deterioro del estado de ánimo únicamente tras la administración de 12 mg/día; los cambios en el estado de ánimo fueron pequeños y reflejaron una reducción general del estado de alerta. Asimismo, la administración de dosis múltiples de 12 mg/día de perampanel potenció los efectos del alcohol sobre el estado de vigilia y de alerta y aumentó los niveles de enfado, confusión y depresión, evaluados utilizando la escala de clasificación de 5 puntos del perfil del estado de ánimo.
Electrofisiología cardiaca
Perampanel no prolongó el intervalo QTc cuando se administró a dosis diarias de hasta 12 mg/día y no tuvo ningún efecto dosis dependiente o clínicamente importante en la duración del QRS.
Eficacia clínica y seguridad
Crisis de inicio parcial
La eficacia de perampanel en las crisis de inicio parcial se estableció en tres ensayos multicéntricos, controlados con placebo, doble ciego, aleatorizados, de 19 semanas de tratamiento concomitante en pacientes adultos y adolescentes. Los sujetos tenían crisis de inicio parcial con o sin generalización secundaria y no estaban adecuadamente controlados con uno a tres antiepilépticos concomitantes. Durante el periodo basal de 6 semanas, los sujetos tenían que presentar más de cinco crisis y ningún periodo de más de 25 días sin crisis. En estos tres ensayos, la duración media de la epilepsia en los sujetos era de aproximadamente 21,06 años. Entre el 85,3 % y el 89,1 % de los pacientes tomaban de dos a tres antiepilépticos concomitantes con o sin estimulación concurrente del nervio vago.
En dos estudios (estudios 304 y 305) se compararon dosis de 8 y 12 mg/día de perampanel con placebo y en el tercer estudio (estudio 306) se compararon dosis de 2, 4 y 8 mg/día de perampanel con placebo. En los tres ensayos, tras una fase basal de 6 semanas para establecer la frecuencia basal de las crisis antes de la aleatorización, se aleatorizó a los sujetos y se les ajustó la dosis a la dosis aleatorizada. Durante la fase de ajuste de la dosis en los tres ensayos, el tratamiento se inició con 2 mg/día y se aumentó en incrementos semanales de 2 mg/día hasta alcanzar la dosis diana. Los sujetos que presentaban reacciones adversas intolerables podían continuar con la misma dosis o se les podía reducir la dosis hasta la última dosis tolerada. En los tres ensayos, a la fase de ajuste de la dosis le siguió una fase de mantenimiento que duró 13 semanas. En esta fase los pacientes tenían que recibir una dosis estable de perampanel.
Las tasas de respondedores del 50 % agrupados fueron del 19 % con el placebo, 29 % con 4 mg, 35 % con 8 mg y 35 % con 12 mg. Se observó un efecto estadísticamente significativo en la disminución de la frecuencia de las crisis durante 28 días (desde la fase basal hasta la fase de tratamiento), en comparación con el grupo de placebo, con el tratamiento de perampanel a dosis de 4 mg/día (Estudio 306), 8 mg/día (Estudios 304, 305 y 306) y 12 mg/día (Estudios 304 y 305). Las tasas de respondedores del 50 % en los grupos de 4 mg, 8 mg y 12 mg fueron del 23,0 %, 31,5 % y 30,0 % respectivamente en combinación con los antiepilépticos inductores de la enzima, y del 33,3 %, 46,5 % y 50,0 % cuando se administró perampanel en combinación con antiepilépticos no inductores de la enzima. Estos estudios demuestran que la administración una vez al día de dosis de 4 mg a 12 mg de perampanel fue significativamente más eficaz que el placebo como tratamiento concomitante en esta población.
Los datos de estudios controlados con placebo demuestran que con una dosis de 4 mg de perampanel una vez al día, se observa una mejoría en el control de las crisis y este beneficio es mayor a medida que se incrementa la dosis a 8 mg/día. No se observó un beneficio en la eficacia con la dosis de 12 mg en comparación con la dosis de 8 mg en la población global. Se observó un beneficio con la dosis de 12 mg en algunos pacientes que toleran la dosis de 8 mg y cuando la respuesta clínica a esa dosis era insuficiente. Se consiguió una reducción clínicamente significativa en la frecuencia de las crisis en relación con el placebo ya en la segunda semana de administración, cuando los pacientes alcanzaron una dosis diaria de 4 mg.
Entre un 1,7 y un 5,8 % de los pacientes tratados con perampanel en los estudios clínicos dejaron de presentar crisis convulsivas durante el periodo de mantenimiento de 3 meses en comparación con el 0 %-1,0 % de los que recibieron placebo. No hay datos relativos a los efectos de la retirada de los antiepilépticos concomitantes para pasar a la monoterapia con perampanel.
Estudio de extensión abierta
El 97 % de los pacientes que completaron los ensayos aleatorizados en pacientes con crisis de inicio parcial fueron incluidos en el estudio de extensión abierta (n=1186). Los pacientes del ensayo aleatorizado se pasaron a perampanel durante 16 semanas seguidas de un periodo de mantenimiento a largo plazo (>1 año). El promedio de la dosis diaria media fue de 10,05 mg.
Crisis tonicoclónicas generalizadas primarias
El uso de perampanel como tratamiento concomitante en pacientes de 12 años y mayores con epilepsia idiopática generalizada que presentaban crisis tonicoclónicas generalizadas primarias se estableció en un estudio multicéntrico, controlado con placebo, doble ciego, aleatorizado (Estudio 332). Los pacientes elegibles tratados con una dosis estable de 1 a 3 antiepilépticos y que presentaron al menos 3 crisis tonicoclónicas generalizadas primarias durante el periodo basal de 8 semanas fueron aleatorizados a perampanel o a placebo. La población incluyó a 164 pacientes (perampanel n=82, placebo n=82). Se ajustó la dosis a los pacientes durante cuatro semanas hasta alcanzar una dosis diana de 8 mg al día o la dosis más alta tolerada. Los pacientes recibieron tratamiento durante 13 semanas más con el último nivel de dosis alcanzado al final del periodo de ajuste. El periodo total de tratamiento fue de 17 semanas. El medicamento del estudio se administró una vez al día.
La tasa de respondedores del 50 % de crisis tonicoclónicas generalizadas primarias durante el periodo de mantenimiento fue significativamente más alta en el grupo de perampanel (58,0 %) que en el grupo de placebo (35,8 %),p=0,0059. La tasa de respondedores del 50 % fue del 22,2 % en combinación con los antiepilépticos inductores de la enzima y del 69,4 % cuando se administró perampanel en combinación con antiepilépticos no inductores de la enzima. El número de sujetos tratados con perampanel que tomaron antiepilépticos inductores de la enzima fue pequeño (n=9). La mediana del cambio porcentual en la frecuencia de crisis tonicoclónicas generalizadas primarias en un periodo de 28 días durante los periodos de ajuste y de mantenimiento (combinados) en relación con los valores previos a la aleatorización fue mayor con perampanel (-76,5 %) que con placebo (-38,4 %), p<0,0001. Durante el periodo de mantenimiento de 3 meses, el 30,9 % (25/81) de los pacientes tratados con perampanel en los estudios clínicos dejaron de presentar crisis tonicoclónicas generalizadas primarias en comparación con el 12,3 % (10/81) de los pacientes tratados con placebo.
Otros subtipos de crisis idiopáticas generalizadas
No se ha establecido la eficacia y la seguridad de perampanel en pacientes con crisis mioclónicas. Los datos disponibles no son suficientes para extraer conclusiones.
No se ha demostrado la eficacia de perampanel en el tratamiento de las crisis de ausencia.
En el estudio 332, en pacientes con crisis tonicoclónicas generalizadas primarias que presentaban también crisis mioclónicas concomitantes, la ausencia de crisis se alcanzó en el 16,7 % (4/24) de los pacientes tratados con perampanel en comparación con el 13,0 % (3/23) de los pacientes tratados con placebo. En los pacientes con crisis de ausencia concomitantes, la ausencia de crisis se alcanzó en el
22,2 % (6/27) de los pacientes tratados con perampanel en comparación con el 12,1 % (4/33) de los pacientes tratados con placebo. La ausencia de todas las crisis se alcanzó en el 23,5 % (19/81) de los pacientes tratados con perampanel en comparación con el 4,9 % (4/81) de los pacientes tratados con placebo.
Fase de extensión abierta
De los 140 sujetos que finalizaron el estudio 332, 114 sujetos (81,4 %) entraron en la fase de extensión. Los pacientes del ensayo aleatorizado se pasaron a perampanel durante 6 semanas seguidas de un periodo de mantenimiento a largo plazo (>1 año). En la fase de extensión, el 73,7 % de los sujetos recibió una dosis diaria modal de perampanel superior a 4-8 mg/día y el 16,7 % recibió una dosis diaria modal superior a 8-12 mg/día. Se observó una reducción en la frecuencia de las crisis tonicoclónicas generalizadas primarias de al menos el 50 % en el 65,9 % de los sujetos tras 1 año de tratamiento durante la fase de extensión (en relación con la frecuencia basal de crisis antes de recibir perampanel). Estos datos fueron coherentes con los del cambio porcentual en la frecuencia de crisis y mostraron que la tasa de respondedores del 50 % de crisis tonicoclónicas generalizadas primarias fue por lo general estable con el tiempo desde aproximadamente la semana 26 hasta el final del año 2. Se observaron resultados similares al evaluar con el tiempo todas las crisis y las crisis de ausencia frente a las mioclónicas.
Cambio a monoterapia
No hay datos relativos a los efectos de la retirada de los antiepilépticos concomitantes para pasar a la monoterapia con perampanel.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Fycompa en uno o más grupos de la población pediátrica en epilepsias resistentes al tratamiento (síndromes epilépticos relacionados con la localización y con la edad) (ver sección 4.2 para consultar la información sobre el uso en adolescentes).
Los tres estudios pivotales, doble ciego, controlados con placebo y de fase III incluyeron a
143 adolescentes de entre 12 y 18 años. Los resultados en estos adolescentes fueron similares a los
observados en la población adulta.
El estudio 332 incluyó a 22 adolescentes de entre 12 y 18 años. Los resultados en estos adolescentes fueron similares a los observados en la población adulta.
5.2 Propiedades farmacocinéticas
Se ha estudiado la farmacocinética de perampanel en sujetos adultos sanos (intervalo de edad de 18 a 79 años), en adultos y adolescentes con crisis de inicio parcial y crisis tonicoclónicas generalizadas primarias, en adultos con enfermedad de Parkinson, en adultos con neuropatía diabética, en adultos con esclerosis múltiple y en sujetos con insuficiencia hepática.
Absorción
Perampanel se absorbe fácilmente tras la administración oral sin indicios de un metabolismo de primer paso marcado. La administración de los comprimidos de perampanel junto con alimentos ricos en grasas no afectó a la exposición plasmática máxima (Cmáx) o a la exposición total (AUC0-inf) de perampanel. El tm4x se retrasó aproximadamente 1 hora en comparación con la administración en ayunas.
Distribución
Los datos de los estudios in vitro indican que aproximadamente el 95 % de perampanel se une a las proteínas plasmáticas.
Los estudios in vitro demuestran que perampanel no es un sustrato o un inhibidor significativo de los polipéptidos transportadores de aniones orgánicos (OATP) 1B1 y 1B3, de los transportadores de aniones orgánicos (OAT) 1, 2, 3 y 4, de los transportadores de cationes orgánicos (OCT) 1, 2 y 3 y de los transportadores de eflujo, la glucoproteína P y la proteína de resistencia al cáncer de mama (BCRP).
Biotransformación
Perampanel se metaboliza de forma extensa mediante oxidación primaria y glucuronidación posterior. El metabolismo de perampanel está mediado principalmente por CYP3A según los resultados de los estudios clínicos realizados en sujetos sanos que recibieron perampanel radiomarcado y la corroboración de los estudios in vitro que utilizaron enzimas de CYP humanas recombinantes y microsomas hepáticos humanos.
Tras la administración de perampanel radiomarcado, solo se observaron cantidades mínimas de los metabolitos de perampanel en el plasma.
Eliminación
Tras la administración de una dosis de perampanel radiomarcado a 8 adultos o a sujetos de edad avanzada sanos, aproximadamente el 30 % de la radiactividad recuperada se encontró en la orina y el 70 % en las heces. La radiactividad recuperada en la orina y las heces estaba principalmente compuesta de una mezcla de metabolitos oxidativos y conjugados. En un análisis farmacocinético poblacional de los datos agrupados de 19 estudios de fase I, el ti/2 promedio de perampanel fue de 105 horas. Cuando se administró en combinación con el inhibidor potente de CYP3A, carbamazepina, el ti/2 promedio fue de 25 horas.
Linealidad/No linealidad
En los sujetos sanos, las concentraciones plasmáticas de perampanel aumentaron de forma proporcionalmente directa a las dosis administradas en el intervalo de 2 a 12 mg. En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que recibieron hasta 12 mg/día de perampanel y de pacientes con crisis tonicoclónicas generalizadas primarias que recibieron hasta 8 mg/día de perampanel en los ensayos clínicos controlados con placebo, se observó una relación lineal entre la dosis y las concentraciones plasmáticas de perampanel.
Poblaciones especiales
Insuficiencia hepática
Se evaluó la farmacocinética de perampanel tras una sola dosis de 1 mg en 12 sujetos con insuficiencia hepática leve y moderada (Child-Pugh Ay B, respectivamente) en comparación con 12 sujetos sanos y emparejados en cuanto a los datos demográficos. El aclaramiento aparente medio de perampanel no unido en los sujetos con insuficiencia leve fue de 188 ml/min frente a 338 ml/min en los controles emparejados, y en los sujetos con insuficiencia moderada fue de 120 ml/min frente a 392 ml/min en los controles emparejados. El f/2 fue mayor en los sujetos con insuficiencia leve (306 h frente a 125 h) y con insuficiencia moderada (295 h frente a 139 h) en comparación con los sujetos sanos emparejados.
Insuficiencia renal
No se ha evaluado formalmente la farmacocinética de perampanel en pacientes con insuficiencia renal. Perampanel se elimina casi exclusivamente por metabolismo, seguido de una rápida excreción de los metabolitos; solo se observan cantidades mínimas de los metabolitos de perampanel en el plasma. En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que tenían niveles de aclaramiento de la creatinina entre 39 y 160 ml/min y que recibieron hasta 12 mg/día de perampanel en los ensayos clínicos controlados con placebo, el aclaramiento de perampanel no se vio afectado por el aclaramiento de la creatinina. En un análisis farmacocinético poblacional de pacientes con crisis tonicoclónicas generalizadas primarias que recibieron hasta 8 mg/día de perampanel en un estudio clínico controlado con placebo, el aclaramiento de creatinina basal no afectó al aclaramiento de perampanel.
Sexo
En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que recibieron hasta 12 mg/día de perampanel y de pacientes con crisis tonicoclónicas generalizadas primarias que recibieron hasta 8 mg/día de perampanel en los ensayos clínicos controlados con placebo, el aclaramiento de perampanel en las mujeres fue un 18 % inferior (0,54 l/h) que en los hombres (0,66 l/h).
Pacientes de edad avanzada (65 años y mayores)
En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial (intervalo de edad de 12 a 74 años) y crisis tonicoclónicas generalizadas primarias (intervalo de edad de 12 a 58 años), y que recibieron hasta 8 o 12 mg/día de perampanel en los ensayos clínicos controlados con placebo, no se encontró ningún efecto significativo de la edad en el aclaramiento de perampanel. No se considera necesario ajustar la dosis en las personas de edad avanzada (ver sección 4.2).
Población pediátrica
En un análisis farmacocinético poblacional de los pacientes adolescentes de los estudios clínicos de fase III no se observaron diferencias destacables entre esta población y la población global.
Estudios de interacciones con otros medicamentos
Evaluación in vitro de las interacciones con otros medicamentos Inhibición de las enzimas metabolizadoras de medicamentos
En microsomas hepáticos humanos, perampanel (30 ^mol/l) tuvo un efecto inhibitorio débil en CYP2C8 y UGT1A9 entre otras enzimas de CYP y UGT hepáticas importantes.
Inducción de las enzimas metabolizadoras de medicamentos
En comparación con los controles positivos (entre ellos fenobarbital y rifampicina), se encontró que perampanel induce de forma débil el CYP2B6 (30 pmol/l) y CYP3A4/5 (>3 pmol/l) entre otras enzimas del CYP y UGT hepáticas importantes en hepatocitos humanos cultivados.
5.3 Datos preclínicos sobre seguridad
Las reacciones adversas no observadas en ensayos clínicos, pero detectadas en animales con niveles de exposición similares a los clínicos y con posible repercusión en el uso clínico fueron las siguientes:
En el estudio de fertilidad en ratas se observaron ciclos estrales prolongados e irregulares con la dosis máxima tolerada (30 mg/kg) en las hembras; sin embargo, estos cambios no afectaron a la fertilidad ni al desarrollo embrionario temprano. No se observó ningún efecto en la fertilidad de los machos.
Se determinó la excreción en la leche materna en ratas a los 10 días después del parto. Los niveles alcanzaron el máximo a la hora y fueron 3,65 veces mayores que los niveles en plasma.
En un estudio de toxicidad en el desarrollo prenatal y posnatal en ratas, se observaron anomalías en el parto y en las condiciones de lactancia a dosis tóxicas para la madre y el número de fetos muertos aumentó en las crías. No se vio afectado el desarrollo conductual y reproductor de las crías, pero algunos parámetros de desarrollo físico mostraron cierto retraso, que probablemente sea secundario a los efectos en el SNC debidos a la farmacología de perampanel. La transferencia placentaria fue relativamente baja; el 0,09 % o menos de la dosis administrada se detectó en el feto.
Los datos de los estudios no clínicos muestran que perampanel no fue genotóxico y no presentó potencial carcinogénico. La administración de las dosis máximas toleradas a ratas y monos produjo signos clínicos en el SNC debidos a la farmacología y una reducción del peso corporal terminal. No hubo cambios directamente atribuibles a perampanel en la patología o la histopatología clínicas.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo
Lactosa monohidrato Hidroxipropilcelulosa de baja sustitución Povidona K-29/32 Estearato de magnesio (E470b)
Fycompa 2 mg comprimidos recubiertos con película
Cubierta pelicular Hipromelosa 2910 Talco
Macrogol 8000 Dióxido de titanio (E171)
Óxido de hierro, amarillo (E172)
Óxido de hierro, rojo (E172)
Fycompa 4 mg comprimidos recubiertos con película
Cubierta pelicular Hipromelosa 2910 Talco
Macrogol 8000
Dióxido de titanio (E171)
Óxido de hierro, rojo (E172)
Fycompa 6 mg comprimidos recubiertos con película
Cubierta pelicular Hipromelosa 2910 Talco
Macrogol 8000 Dióxido de titanio (E171)
Óxido de hierro, rojo (E172)
Fycompa 8 mg comprimidos recubiertos con película
Cubierta pelicular Hipromelosa 2910 Talco
Macrogol 8000 Dióxido de titanio (E171)
Óxido de hierro, rojo (E172)
Óxido de hierro, negro (E172)
Fycompa 10 mg comprimidos recubiertos con película
Cubierta pelicular Hipromelosa 2910 Talco
Macrogol 8000 Dióxido de titanio (E171)
Óxido de hierro, amarillo (E172)
FD&C Azul n.° 2 Laca de aluminio índigo carmín (E132)
Fycompa 12 mg comprimidos recubiertos con película
Cubierta pelicular Hipromelosa 2910 Talco
Macrogol 8000 Dióxido de titanio (E171)
FD&C Azul n.° 2 Laca de aluminio índigo carmín (E132)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
5 años
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Blíster de PVC/aluminio
Fycompa 2 mg comprimidos recubiertos con película
Envase de 7 solo para la primera semana de administración, 28 y 98
Fycompa 4 mg comprimidos recubiertos con película 4 mg: envases de 7, 28, 84 y 98
Fycompa 6 mg comprimidos recubiertos con película 6 mg: envases de 7, 28, 84 y 98
Fycompa 8 mg comprimidos recubiertos con película 8 mg: envases de 7, 28, 84 y 98
Fycompa 10 mg comprimidos recubiertos con película 10 mg: envases de 7, 28, 84 y 98
Fycompa 12 mg comprimidos recubiertos con película 12 mg: envases de 7, 28, 84 y 98
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Reino Unido
Teléfono: +44 (0)208 600 1400 Fax: +44 (0)208 600 1401 e-mail: EUmedinfo@eisai.net
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/776/001-0023
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 23/julio/2012
10. FECHA DE LA REVISIÓN DEL TEXTO {MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Fycompa 0,5 mg/ml suspensión oral
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de suspensión oral contiene 0,5 mg de perampanel.
Cada frasco de 340 ml contiene 170 mg de perampanel. Excipiente con efecto conocido:
Cada ml de suspensión oral contiene 175 mg de sorbitol (E420). Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión oral
Suspensión de color blanco a blanquecino
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Fycompa está indicado para el tratamiento concomitante de las crisis de inicio parcial con o sin generalización secundaria en pacientes adultos y adolescentes a partir de 12 años de edad con epilepsia.
Fycompa está indicado para el tratamiento concomitante de las crisis tonicoclónicas generalizadas primarias en pacientes adultos y adolescentes a partir de 12 años de edad con epilepsia idiopática generalizada (ver sección 5.1).
4.2 Posología y forma de administración
Posología
lograr
El
La dosis de Fycompa se debe ajustar conforme a la respuesta individual de cada paciente para el equilibrio entre la eficacia y la tolerabilidad.
La suspensión de perampanel se debe tomar por vía oral una vez al día al acostarse.
Se puede tomar con o sin alimentos, pero preferiblemente siempre en las mismas condiciones. cambio de comprimidos a suspensión se debe hacer con cuidado (ver sección 5.2).
Crisis de inicio parcial
Perampanel a dosis de 4 mg/día a 12 mg/día ha demostrado ser un tratamiento eficaz en las crisis de inicio parcial.
El tratamiento con Fycompa se debe iniciar con una dosis de 2 mg/día (4 ml/día). Se puede aumentar la dosis en incrementos de 2 mg (4 ml) (semanalmente o cada 2 semanas de acuerdo con las consideraciones relativas a la semivida descritas más abajo) hasta una dosis de mantenimiento de 4 mg/día (8 ml/día) a 8 mg/día (16 ml/día), conforme a la respuesta clínica y la tolerabilidad. En función de la respuesta clínica y de la tolerabilidad de cada paciente a la dosis de 8 mg al día (16 ml/día), se puede aumentar la dosis en incrementos de 2 mg/día (4 ml/día) hasta 12 mg/día (24 ml/día). A los pacientes que toman de forma concomitante medicamentos que no acortan la semivida del perampanel (ver sección 4.5), el aumento de la dosis se les debe realizar a intervalos de 2 semanas como mínimo. A los pacientes que toman de forma concomitante medicamentos que acortan la semivida del perampanel (ver sección 4.5), el aumento de la dosis se les debe realizar a intervalos de 1 semana como mínimo.
Crisis tonicoclónicas generalizadas primarias
Perampanel a dosis de hasta 8 mg/día ha demostrado ser un tratamiento eficaz en las crisis tonicoclónicas generalizadas primarias.
El tratamiento con Fycompa se debe iniciar con una dosis de 2 mg/día (4 ml/día). Se puede aumentar la dosis en incrementos de 2 mg (4 ml) (semanalmente o cada 2 semanas de acuerdo con las consideraciones relativas a la semivida descritas más abajo) hasta una dosis de mantenimiento de 8 mg/día (16 ml/día) como máximo, conforme a la respuesta clínica y la tolerabilidad. En función de la respuesta clínica y de la tolerabilidad de cada paciente a la dosis de 8 mg al día (16 ml/día), se puede aumentar la dosis hasta 12 mg/día (24 ml/día), lo que puede ser eficaz para algunos pacientes (ver sección 4.4). A los pacientes que toman de forma concomitante medicamentos que no acortan la semivida del perampanel (ver sección 4.5), el aumento de la dosis se les debe realizar a intervalos de 2 semanas como mínimo. A los pacientes que toman de forma concomitante medicamentos que acortan la semivida del perampanel (ver sección 4.5), el aumento de la dosis se les debe realizar a intervalos de 1 semana como mínimo.
Suspensión
Se recomienda suspender el tratamiento de forma gradual para minimizar la posibilidad de crisis de rebote. Sin embargo, debido a su semivida prolongada y al consiguiente descenso lento en las concentraciones plasmáticas, se puede suspender el tratamiento con perampanel de forma inmediata en caso de ser absolutamente necesario.
Dosis olvidadas
Si olvidó una sola dosis: ya que perampanel tiene una semivida larga, el paciente debe esperar y tomar la siguiente dosis de la forma programada.
Si olvidó más de una dosis durante un periodo continuo de menos de 5 semividas (3 semanas en los pacientes que no toman antiepilépticos inductores del metabolismo de perampanel, 1 semana en los pacientes que toman antiepilépticos inductores del metabolismo de perampanel [ver sección 4.5]), se debe considerar la posibilidad de recomenzar el tratamiento desde el último nivel de dosis.
Si un paciente no ha tomado perampanel durante un periodo continuo de más de 5 semividas, se recomienda seguir las recomendaciones posológicas iniciales anteriormente indicadas.
Personas de edad avanzada (65 años y mayores)
Los estudios clínicos con Fycompa en epilepsia no incluyeron un número suficiente de sujetos de 65 años y mayores para determinar si responden de forma diferente a los sujetos más jóvenes. El análisis de la información de seguridad de 905 sujetos de edad avanzada tratados con perampanel (en estudios doble ciego realizados en indicaciones que no eran epilepsia) no reveló ninguna diferencia relacionada con la edad con respecto al perfil de seguridad. Los resultados, junto con la ausencia de una diferencia relacionada con la edad en la exposición a perampanel, indican que no es necesario ajustar la dosis en esta población de pacientes. Perampanel se debe utilizar con precaución en las personas de edad avanzada, teniendo en cuenta la posibilidad de interacciones medicamentosas en pacientes polimedicados (ver sección 4.4).
Insuficiencia renal
No es necesario ajustar la dosis en los pacientes con insuficiencia renal de leve. No se recomienda el uso en pacientes con insuficiencia renal moderada o grave o en pacientes que reciben hemodiálisis.
Insuficiencia hepática
El aumento de la dosis en pacientes con insuficiencia hepática de leve a moderada se debe basar en la respuesta clínica y en la tolerabilidad. En los pacientes con insuficiencia hepática de leve a moderada, se puede iniciar el tratamiento con una dosis de 2 mg (4 ml). Se deberá aumentar la dosis de los pacientes en incrementos de 2 mg (4 ml) a intervalos de 2 semanas como mínimo en función de la tolerabilidad y la eficacia.
La dosis máxima de perampanel en pacientes con insuficiencia hepática de leve a moderada es de 8 mg.
No se recomienda el uso en pacientes con insuficiencia hepática severa.
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de perampanel en niños menores de 12 años.
No se dispone de datos.
Forma de administración
Fycompa se administra por vía oral.
Preparación: el adaptador para el frasco a presión (PIBA) que se suministra en la caja del medicamento se debe introducir firmemente en el cuello del frasco antes de usar, y debe permanecer ahí durante el uso del frasco. La jeringa para uso oral se debe introducir en el PIBA y extraer la dosis con el frasco invertido. Después de cada uso, se debe volver a poner la cápsula de cierre. La cápsula de cierre encaja perfectamente con el PIBA colocado.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo Ideación suicida
Se han notificado casos de ideación y conductas suicidas en pacientes tratados con antiepilépticos en varias indicaciones. Un metanálisis de los ensayos aleatorizados y controlados con placebo con antiepilépticos también ha mostrado un pequeño aumento del riesgo de ideación y conductas suicidas. Se desconoce el mecanismo de este riesgo y los datos disponibles no descartan la posibilidad de un aumento del riesgo con perampanel.
Por lo tanto, se deberá vigilar a los pacientes por si presentan signos de ideación y conductas suicidas, y considerar el tratamiento adecuado. Se debe advertir a los pacientes (y a los cuidadores de los pacientes) que, en el caso de que aparezcan signos de ideación o conductas suicidas, consulten al médico.
Trastornos del sistema nervioso
Perampanel puede producir mareo y somnolencia y, por lo tanto, puede afectar a la capacidad para conducir y utilizar máquinas (ver sección 4.7).
Anticonceptivos orales
Fycompa, a dosis de 12 mg/día, puede reducir la eficacia de los anticonceptivos hormonales que contienen progesterona; en esta situación, se recomienda utilizar además otros métodos anticonceptivos no hormonales cuando se utilice Fycompa (ver sección 4.5).
Caídas
Parece que hay un mayor riesgo de caídas, especialmente en las personas de edad avanzada; el motivo subyacente no está claro.
Agresividad
Se han notificado casos de conducta agresiva y hostil en pacientes que reciben tratamiento con perampanel. En los pacientes tratados con perampanel en los ensayos clínicos, se notificaron casos de agresividad, ira e irritabilidad con mayor frecuencia con dosis más altas. La mayoría de los acontecimientos notificados fueron de naturaleza leve o moderada y los pacientes se recuperaron de forma espontánea o con un ajuste de la dosis. Sin embargo, se observaron pensamientos de lesionar a los demás, agresiones físicas o conductas amenazantes en algunos pacientes (<1 % en los estudios clínicos de perampanel). Se debe aconsejar a los pacientes y cuidadores que informen al profesional sanitario inmediatamente si observan cambios significativos en el estado de ánimo o en los patrones de conducta. Si se presentan estos síntomas, se debe reducir la dosis de perampanel y si los síntomas son graves, se debe suspender inmediatamente el tratamiento.
Potencial de abuso
Se debe tener precaución en pacientes con antecedentes de abuso de sustancias y se debe vigilar al paciente por si presenta síntomas de abuso de perampanel.
Uso concomitante con antiepilépticos inductores de CYP3A
Las tasas de respuesta después de añadir perampanel a dosis fijas fueron inferiores cuando los pacientes recibieron de forma concomitante antiepilépticos inductores de la enzima CYP3A (carbamazepina, fenitoína, oxcarbazepina), en comparación con las tasas de respuesta en los pacientes que recibieron de forma concomitante antiepilépticos no inductores de la enzima. Se debe vigilar la respuesta del paciente cuando se le cambia de antiepilépticos no inductores de la enzima a antiepilépticos inductores de la enzima y viceversa, utilizados de forma concomitante. En función de la respuesta clínica y de la tolerabilidad de cada paciente, se puede aumentar o reducir la dosis 2 mg cada vez (ver sección 4.2).
Uso concomitante de otros medicamentos (no antiepilépticos) inductores o inhibidores del citocromo P450
Se debe vigilar estrechamente la respuesta clínica y la tolerabilidad de los pacientes cuando se les añada o retire inductores o inhibidores del citocromo P450, ya que los niveles plasmáticos de perampanel pueden aumentar o disminuir; puede ser necesario ajustar la dosis de perampanel.
Sorbitol
Fycompa contiene sorbitol (E420); por lo tanto, los pacientes con intolerancia hereditaria a la fructosa no deben tomar este medicamento.
Se debe tener precaución al combinar Fycompa suspensión oral con otros antiepilépticos que contienen sorbitol, ya que una ingesta combinada de más de 1 gramo de sorbitol puede afectar a la absorción de algunos medicamentos.
4.5 Interacción con otros medicamentos y otras formas de interacción
Fycompa no se considera un inductor o inhibidor potente del citocromo P450 o de las enzimas de UGT (ver sección 5.2).
Anticonceptivos orales
En mujeres sanas tratadas con 12 mg (pero no con 4 u 8 mg/día) durante 21 días de forma concomitante con un anticonceptivo oral combinado, Fycompa demostró que disminuye la exposición de levonorgestrel (los valores medios en la Cmáx y el AUC disminuyeron en un 40 % cada uno). El AUC de etinilestradiol no se vio afectada con la dosis de 12 mg de Fycompa mientras que la Cmáx disminuyó en un 18 %. Por lo tanto, se debe tener en cuenta la posibilidad de una disminución de la eficacia de los anticonceptivos orales que contienen progesterona en las mujeres que necesitan 12 mg/día de Fycompa, y se debe utilizar un método fiable adicional (dispositivo intrauterino [DIU], preservativo) (ver sección 4.4).
Interacciones entre Fycompa y otros antiepilépticos:
Se evaluaron las posibles interacciones entre Fycompa (hasta 12 mg una vez al día) y otros antiepilépticos (AE) en estudios clínicos y se analizaron en el análisis farmacocinético poblacional de cuatro estudios de fase III agrupados que incluyeron a pacientes con crisis de inicio parcial y crisis tonicoclónicas generalizadas primarias. El efecto de estas interacciones en la concentración media en estadio estacionario se resume en la siguiente tabla.
|
AE coadministrado |
Influencia del AE en la concentración de Fycompa |
Influencia de Fycompa en la concentración del AE |
|
Carbamazepina |
Reducción por un factor de 2,75 |
Reducción <10 % |
|
Clobazam |
Ninguna influencia |
Reducción <10 % |
|
Clonazepam |
Ninguna influencia |
Ninguna influencia |
|
Lamotrigina |
Ninguna influencia |
Reducción <10 % |
|
Levetiracetam |
Ninguna influencia |
Ninguna influencia |
|
Oxcarbazepina |
Reducción por un factor de 1,9 |
Aumento del 35 %' |
|
Fenobarbital |
Ninguna influencia |
Ninguna influencia |
|
Fenitoína |
Reducción por un factor de 1,7 |
Ninguna influencia |
|
Topiramato |
Reducción del 19 % |
Ninguna influencia |
|
Ácido valproico |
Ninguna influencia |
Reducción <10 % |
|
Zonisamida |
Ninguna influencia |
Ninguna influencia |
1) No se evaluó el metabolito activo monohidroxicarbazepina.
Se ha demostrado que algunos antiepilépticos conocidos como inductores enzimáticos (carbamazepina, fenitoína, oxcarbazepina) aumentan el aclaramiento de perampanel y consecuentemente reducen las concentraciones plasmáticas de perampanel.
La carbamazepina, un inductor enzimático potente y conocido, redujo los niveles de perampanel en dos terceras partes en un estudio realizado en sujetos sanos.
Se observó un resultado similar en un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que recibieron hasta 12 mg/día de perampanel y de pacientes con crisis tonicoclónicas generalizadas primarias que recibieron hasta 8 mg/día de perampanel en ensayos clínicos controlados con placebo. El aclaramiento total de Fycompa aumentó cuando se administró con carbamazepina (se multiplicó por 2,75), fenitoína (se multiplicó por 1,7) y oxcarbazepina (se multiplicó por 1,9), que son inductores conocidos de las enzimas del metabolismo (ver sección 5.2). Se debe tener en cuenta y controlar este efecto al añadir o retirar estos antiepilépticos del régimen de tratamiento de un paciente.
En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que recibieron hasta 12 mg/día de Fycompa en ensayos clínicos controlados con placebo, Fycompa no afectó de
forma clínicamente relevante al aclaramiento de clonazepam, levetiracetam, fenobarbital, fenitoína, topiramato, zonisamida, carbamazepina, clobazam, lamotrigina y ácido valproico, con la dosis más alta de perampanel evaluada (12 mg/día).
En el análisis farmacocinético poblacional de epilepsia, se observó que perampanel redujo el aclaramiento de oxcarbazepina en un 26 %. La enzima citosólica reductasa metaboliza rápidamente la oxcarbazepina para formar el metabolito activo, la monohidroxicarbazepina. Se desconoce el efecto de perampanel en las concentraciones de monohidroxicarbazepina.
La dosis de perampanel se ajusta conforme al efecto clínico, independientemente de otros antiepilépticos.
Efecto de perampanel en los sustratos de CYP3A
En sujetos sanos, Fycompa (6 mg una vez al día durante 20 días) disminuyó el AUC de midazolam en un 13 %. No se puede descartar una disminución mayor en la exposición de midazolam (u otros sustratos de GYP3A sensibles) a dosis más altas de Fycompa.
Efecto de los inductores del citocromo P450 en la farmacocinética de perampanel
Se espera que los inductores potentes del citocromo P450, como la rifampicina y la hierba de San Juan, reduzcan las concentraciones de perampanel y no se puede descartar la posibilidad de alcanzar concentraciones plasmáticas más altas de metabolitos reactivos en presencia de estos inductores. Se ha demostrado que felbamato reduce las concentraciones de algunos medicamentos y puede asimismo reducir las concentraciones de perampanel.
Efecto de los inhibidores del citocromo P450 en la farmacocinética de perampanel
En sujetos sanos, el inhibidor de CYP3A4 ketoconazol (400 mg una vez al día durante 10 días) aumentó el AUC de perampanel en un 20 % y prolongó la semivida de perampanel en un 15 %
(67,8 horas frente a 58,4 horas). No se pueden descartar efectos mayores cuando se combine perampanel con un inhibidor de CYP3A que tenga una semivida mayor que la de ketoconazol o cuando se administre el inhibidor durante un periodo de tratamiento más prolongado.
Levodopa
En sujetos sanos, Fycompa (4 mg una vez al día durante 19 días) no tuvo ningún efecto en la Cmáx o el AUC de la levodopa.
Alcohol
Los efectos de perampanel en las tareas que requieren un estado de alerta y vigilia, como la capacidad para conducir, fueron aditivos o supra-aditivos a los efectos del propio alcohol, como se demostró en un estudio de interacción farmacodinámica en sujetos sanos. La administración de múltiples dosis de 12 mg/día de perampanel aumentó los niveles de enfado, confusión y depresión, evaluados utilizando la escala de clasificación de 5 puntos del perfil del estado de ánimo (ver sección 5.1). Estos efectos pueden observarse asimismo cuando se utiliza Fycompa en combinación con otros depresores del sistema nervioso central (SNC).
Población pediátrica
Los estudios de interacciones se han realizado solo en adultos.
En un análisis farmacocinético poblacional de los pacientes adolescentes de los estudios clínicos de fase III no se observaron diferencias destacables entre esta población y la población global.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil y anticonceptivos en hombres y mujeres
No se recomienda utilizar Fycompa en mujeres en edad fértil que no estén utilizando métodos anticonceptivos a menos que sea claramente necesario.
Embarazo
Hay datos limitados (datos en menos de 300 embarazos) relativos al uso de perampanel en mujeres embarazadas. Los estudios en animales no indicaron efectos teratogénicos en ratas ni en conejos, aunque se observó embriotoxicidad en ratas con dosis tóxicas para la madre (ver sección 5.3). No se recomienda utilizar Fycompa durante el embarazo.
Lactancia
Los estudios en ratas lactantes muestran que perampanel y/o sus metabolitos se excretan en la leche (para mayor información ver sección 5.3). Se desconoce si perampanel se excreta en la leche materna. No se puede excluir el riesgo en recién nacidos/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con Fycompa tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
En el estudio de fertilidad en ratas se observaron ciclos estrales prolongados e irregulares en las hembras con las dosis altas (30 mg/kg); sin embargo, estos cambios no afectaron a la fertilidad ni al desarrollo embrionario temprano. No se observó ningún efecto en la fertilidad de los machos (ver sección 5.3). No se ha establecido el efecto de perampanel en la fertilidad de los seres humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Fycompa sobre la capacidad para conducir y utilizar máquinas es moderada. Perampanel puede producir mareo y somnolencia y, por lo tanto, puede tener un efecto sobre la capacidad para conducir y utilizar máquinas. Se aconseja que los pacientes no conduzcan, ni utilicen máquinas complejas ni realicen otras actividades potencialmente peligrosas hasta que sepan si perampanel afecta a su capacidad para realizar estas actividades (ver secciones 4.4 y 4.5).
4.8 Reacciones adversas
Resumen del perfil de seguridad
En todos los ensayos, tanto controlados como no controlados, en pacientes con crisis de inicio parcial, 1639 sujetos han recibido perampanel, de los cuales 1147 han recibido tratamiento durante 6 meses y 703 sujetos durante más de 12 meses.
En los ensayos controlados y no controlados en pacientes con crisis tonicoclónicas generalizadas primarias, 114 sujetos han recibido perampanel, de los cuales 68 han recibido tratamiento durante 6 meses y 36 sujetos durante más de 12 meses.
Reacciones adversas que dieron lugar a la suspensión del tratamiento:
En los ensayos clínicos de fase III controlados de crisis de inicio parcial, la tasa de suspensión debida a una reacción adversa fue del 1,7 %, 4,2 % y 13,7 % en los pacientes aleatorizados a recibir perampanel a las dosis recomendadas de 4 mg, 8 mg y 12 mg/día, respectivamente, y del 1,4 % en los pacientes aleatorizados a placebo. Las reacciones adversas más frecuentes (>1 % en todo el grupo de perampanel y más frecuentes que con placebo) que dieron lugar a la suspensión del tratamiento fueron el mareo y la somnolencia.
En el ensayo clínico de fase III controlado de crisis tonicoclónicas generalizadas primarias, la tasa de suspensión debida a una reacción adversa fue del 4,9 % en los pacientes aleatorizados a recibir 8 mg de perampanel y del 1,2 % en los pacientes aleatorizados a recibir placebo. La reacción adversa más frecuente (>2 % en el grupo de perampanel y más frecuente que con placebo) que dio lugar a la suspensión del tratamiento fue el mareo.
Tabla de reacciones adversas
En la siguiente tabla se enumeran las reacciones adversas, identificadas en base a la revisión de la base de datos completa de los estudios clínicos con Fycompa, según el sistema de clasificación de órganos y la frecuencia. Se ha utilizado la siguiente convención para clasificar las reacciones adversas: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100).
Dentro de cada categoría de frecuencia, las reacciones adversas se presentan en orden decreciente de gravedad.
|
Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetito Aumento del apetito | ||
|
Trastornos psiquiátricos |
Agresividad Enfado Ansiedad Estado de confusión |
Ideación suicida Intento de suicidio | |
|
Trastornos del sistema nervioso |
Mareo Somnolencia |
Ataxia Disartria Trastorno del equilibrio Irritabilidad | |
|
Trastornos oculares |
Diplopía Visión borrosa | ||
|
Trastornos del oído y del laberinto |
Vértigo | ||
|
Trastornos gastrointestinales |
Náuseas | ||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor de espalda | ||
|
Trastornos generales |
Trastorno de la marcha Fatiga | ||
|
Exploraciones complementarias |
Aumento del peso | ||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Caída |
Población pediátrica
Según la base de datos de ensayos clínicos de 196 adolescentes expuestos a perampanel elaborada a partir de estudios con doble enmascaramiento para crisis de inicio parcial y crisis tonicoclónicas generalizadas primarias, el perfil de seguridad general en los adolescentes fue similar al observado en los adultos, salvo por la agresividad, que se observó con más frecuencia en los adolescentes que en los adultos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
La experiencia clínica con respecto a sobredosis con perampanel en seres humanos es limitada. En un informe de una sobredosis intencionada que podría haber supuesto una dosis de hasta 264 mg, el paciente experimentó alteraciones del estado mental, agitación y comportamiento agresivo, y se recuperó sin secuelas. No se dispone de ningún antídoto específico para los efectos de perampanel. Está indicado el tratamiento de apoyo general del paciente que incluye la monitorización de las constantes vitales y la observación del estado clínico del paciente. En vista de su semivida prolongada, los efectos causados por perampanel podrían ser duraderos. Debido al bajo nivel de aclaramiento renal, es poco probable que intervenciones especiales como la diuresis forzada, la diálisis o la hemoperfusión resulten útiles.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antiepilépticos, otros antiepilépticos, código ATC: N03AX22 Mecanismo de acción
Perampanel es el primer antagonista en su clase no competitivo y selectivo de los receptores ionotrópicos de glutamato de tipo AMPA (ácido a-amino-3-hidroxi-5-metil-4-isoxazolepropiónico) en las neuronas postsinápticas. El glutamato es el principal neurotransmisor excitatorio del sistema nervioso central e interviene en diversos trastornos neurológicos causados por una sobreexcitación neuronal. Se cree que la activación de los receptores de AMPA por el glutamato media en la mayor parte de la transmisión sináptica excitatoria rápida en el cerebro. En los estudios in vitro, perampanel no compitió con AMPA por la unión a los receptores de AMPA, sino que la unión de perampanel fue desplazada por los antagonistas no competitivos de los receptores de AMPA, lo que indica que perampanel es un antagonista no competitivo de los receptores de AMPA. In vitro, perampanel inhibió el aumento de calcio intracelular inducido por AMPA (aunque no el inducido por NMDA).
In vivo, perampanel prolongó de forma significativa la latencia de las crisis en un modelo de crisis inducidas por AMPA.
El mecanismo exacto por el que perampanel ejerce sus efectos antiepilépticos en los seres humanos todavía no está totalmente elucidado.
Efectos farmacodinámicos
Se realizó un análisis farmacocinético y farmacodinámico (eficacia) basado en los datos agrupados de los 3 ensayos de eficacia en las crisis de inicio parcial. Además, se realizó un análisis farmacocinético y farmacodinámico (eficacia) en un ensayo de eficacia para crisis tonicoclónicas generalizadas primarias. En ambos análisis, la exposición a perampanel se correlaciona con una disminución de la frecuencia de las crisis.
Rendimiento psicomotor
Dosis únicas y múltiples de 8 mg y 12 mg produjeron un deterioro del rendimiento psicomotor en voluntarios sanos de forma dosis dependiente. Los efectos de perampanel en tareas complejas como la capacidad para conducir fueron aditivos o supra-aditivos a los efectos negativos del alcohol. Los resultados de las pruebas del rendimiento psicomotor volvieron a los valores basales en el plazo de 2 semanas tras suspender la administración de perampanel.
Función cognitiva
En un estudio en voluntarios sanos para evaluar los efectos de perampanel en el estado de alerta y la memoria utilizando una serie de pruebas estándar, no se observaron efectos de perampanel tras administrar dosis únicas y múltiples de hasta 12 mg/día de perampanel.
Estado de alerta y de ánimo
Los niveles de alerta (vigilia) se redujeron de forma dosis dependiente en los sujetos sanos que recibieron de 4 a 12 mg/día de perampanel. Hubo un deterioro del estado de ánimo únicamente tras la administración de 12 mg/día; los cambios en el estado de ánimo fueron pequeños y reflejaron una reducción general del estado de alerta. Asimismo, la administración de dosis múltiples de 12 mg/día de perampanel potenció los efectos del alcohol sobre el estado de vigilia y de alerta y aumentó los niveles de enfado, confusión y depresión, evaluados utilizando la escala de clasificación de 5 puntos del perfil del estado de ánimo.
Electrofisiología cardiaca
Perampanel no prolongó el intervalo QTc cuando se administró a dosis diarias de hasta 12 mg/día y no tuvo ningún efecto dosis dependiente o clínicamente importante en la duración del QRS.
Eficacia clínica y seguridad
Crisis de inicio parcial
La eficacia de perampanel en las crisis de inicio parcial se estableció en tres ensayos multicéntricos, controlados con placebo, doble ciego, aleatorizados, de 19 semanas de tratamiento concomitante en pacientes adultos y adolescentes. Los sujetos tenían crisis de inicio parcial con o sin generalización secundaria y no estaban adecuadamente controlados con uno a tres antiepilépticos concomitantes. Durante el periodo basal de 6 semanas, los sujetos tenían que presentar más de cinco crisis y ningún periodo de más de 25 días sin crisis. En estos tres ensayos, la duración media de la epilepsia en los sujetos era de aproximadamente 21,06 años. Entre el 85,3 % y el 89,1 % de los pacientes tomaban de dos a tres antiepilépticos concomitantes con o sin estimulación concurrente del nervio vago.
En dos estudios (estudios 304 y 305) se compararon dosis de 8 y 12 mg/día de perampanel con placebo y en el tercer estudio (estudio 306) se compararon dosis de 2, 4 y 8 mg/día de perampanel con placebo. En los tres ensayos, tras una fase basal de 6 semanas para establecer la frecuencia basal de las crisis antes de la aleatorización, se aleatorizó a los sujetos y se les ajustó la dosis a la dosis aleatorizada. Durante la fase de ajuste de la dosis en los tres ensayos, el tratamiento se inició con 2 mg/día y se aumentó en incrementos semanales de 2 mg/día hasta alcanzar la dosis diana. Los sujetos que presentaban reacciones adversas intolerables podían continuar con la misma dosis o se les podía reducir la dosis hasta la última dosis tolerada. En los tres ensayos, a la fase de ajuste de la dosis le siguió una fase de mantenimiento que duró 13 semanas. En esta fase los pacientes tenían que recibir una dosis estable de perampanel.
Las tasas de respondedores del 50 % agrupados fueron del 19 % con el placebo, 29 % con 4 mg, 35 % con 8 mg y 35 % con 12 mg. Se observó un efecto estadísticamente significativo en la disminución de la frecuencia de las crisis durante 28 días (desde la fase basal hasta la fase de tratamiento), en comparación con el grupo de placebo, con el tratamiento de perampanel a dosis de 4 mg/día (Estudio 306), 8 mg/día (Estudios 304, 305 y 306) y 12 mg/día (Estudios 304 y 305). Las tasas de respondedores del 50 % en los grupos de 4 mg, 8 mg y 12 mg fueron del 23,0 %, 31,5 % y 30,0 % respectivamente en combinación con los antiepilépticos inductores de la enzima, y del 33,3 %, 46,5 % y 50,0 % cuando se administró perampanel en combinación con antiepilépticos no inductores de la
enzima. Estos estudios demuestran que la administración una vez al día de dosis de 4 mg a 12 mg de perampanel fue significativamente más eficaz que el placebo como tratamiento concomitante en esta población.
Los datos de estudios controlados con placebo demuestran que con una dosis de 4 mg de perampanel una vez al día, se observa una mejoría en el control de las crisis y este beneficio es mayor a medida que se incrementa la dosis a 8 mg/día. No se observó un beneficio en la eficacia con la dosis de 12 mg en comparación con la dosis de 8 mg en la población global. Se observó un beneficio con la dosis de 12 mg en algunos pacientes que toleran la dosis de 8 mg y cuando la respuesta clínica a esa dosis era insuficiente. Se consiguió una reducción clínicamente significativa en la frecuencia de las crisis en relación con el placebo ya en la segunda semana de administración, cuando los pacientes alcanzaron una dosis diaria de 4 mg.
Entre un 1,7 y un 5,8 % de los pacientes tratados con perampanel en los estudios clínicos dejaron de presentar crisis convulsivas durante el periodo de mantenimiento de 3 meses en comparación con el 0 %-1,0 % de los que recibieron placebo. No hay datos relativos a los efectos de la retirada de los antiepilépticos concomitantes para pasar a la monoterapia con perampanel.
Estudio de extensión abierta
El 97 % de los pacientes que completaron los ensayos aleatorizados en pacientes con crisis de inicio parcial fueron incluidos en el estudio de extensión abierta (n=1186). Los pacientes del ensayo aleatorizado se pasaron a perampanel durante 16 semanas seguidas de un periodo de mantenimiento a largo plazo (>1 año). El promedio de la dosis diaria media fue de 10,05 mg.
Crisis tonicoclónicas generalizadas primarias
El uso de perampanel como tratamiento concomitante en pacientes de 12 años y mayores con epilepsia idiopática generalizada que presentaban crisis tonicoclónicas generalizadas primarias se estableció en un estudio multicéntrico, controlado con placebo, doble ciego, aleatorizado (Estudio 332). Los pacientes elegibles tratados con una dosis estable de 1 a 3 antiepilépticos y que presentaron al menos 3 crisis tonicoclónicas generalizadas primarias durante el periodo basal de 8 semanas fueron aleatorizados a perampanel o a placebo. La población incluyó a 164 pacientes (perampanel n=82, placebo n=82). Se ajustó la dosis a los pacientes durante cuatro semanas hasta alcanzar una dosis diana de 8 mg al día o la dosis más alta tolerada. Los pacientes recibieron tratamiento durante 13 semanas más con el último nivel de dosis alcanzado al final del periodo de ajuste. El periodo total de tratamiento fue de 17 semanas. El medicamento del estudio se administró una vez al día.
La tasa de respondedores del 50 % de crisis tonicoclónicas generalizadas primarias durante el periodo de mantenimiento fue significativamente más alta en el grupo de perampanel (58,0 %) que en el grupo de placebo (35,8 %), p=0,0059. La tasa de respondedores del 50 % fue del 22,2 % en combinación con los antiepilépticos inductores de la enzima y del 69,4 % cuando se administró perampanel en combinación con antiepilépticos no inductores de la enzima. El número de sujetos tratados con perampanel que tomaron antiepilépticos inductores de la enzima fue pequeño (n=9). La mediana del cambio porcentual en la frecuencia de crisis tonicoclónicas generalizadas primarias en un periodo de 28 días durante los periodos de ajuste y de mantenimiento (combinados) en relación con los valores previos a la aleatorización fue mayor con perampanel (-76,5 %) que con placebo (-38,4 %), p<0,0001. Durante el periodo de mantenimiento de 3 meses, el 30,9 % (25/81) de los pacientes tratados con perampanel en los estudios clínicos dejaron de presentar crisis tonicoclónicas generalizadas primarias en comparación con el 12,3 % (10/81) de los pacientes tratados con placebo.
Otros subtipos de crisis idiopáticas generalizadas
No se ha establecido la eficacia y la seguridad de perampanel en pacientes con crisis mioclónicas. Los datos disponibles no son suficientes para extraer conclusiones.
No se ha demostrado la eficacia de perampanel en el tratamiento de las crisis de ausencia.
En el estudio 332, en pacientes con crisis tonicoclónicas generalizadas primarias que presentaban también crisis mioclónicas concomitantes, la ausencia de crisis se alcanzó en el 16,7 % (4/24) de los pacientes tratados con perampanel en comparación con el 13,0 % (3/23) de los pacientes tratados con placebo. En los pacientes con crisis de ausencia concomitantes, la ausencia de crisis se alcanzó en el
22.2 % (6/27) de los pacientes tratados con perampanel en comparación con el 12,1 % (4/33) de los pacientes tratados con placebo. La ausencia de todas las crisis se alcanzó en el 23,5 % (19/81) de los pacientes tratados con perampanel en comparación con el 4,9 % (4/81) de los pacientes tratados con placebo.
Fase de extensión abierta
De los 140 sujetos que finalizaron el estudio 332, 114 sujetos (81,4 %) entraron en la fase de extensión. Los pacientes del ensayo aleatorizado se pasaron a perampanel durante 6 semanas seguidas de un periodo de mantenimiento a largo plazo (>1 año). En la fase de extensión, el 73,7 % de los sujetos recibió una dosis diaria modal de perampanel superior a 4-8 mg/día y el 16,7 % recibió una dosis diaria modal superior a 8-12 mg/día. Se observó una reducción en la frecuencia de las crisis tonicoclónicas generalizadas primarias de al menos el 50 % en el 65,9 % de los sujetos tras 1 año de tratamiento durante la fase de extensión (en relación con la frecuencia basal de crisis antes de recibir perampanel). Estos datos fueron coherentes con los del cambio porcentual en la frecuencia de crisis y mostraron que la tasa de respondedores del 50 % de crisis tonicoclónicas generalizadas primarias fue por lo general estable con el tiempo desde aproximadamente la semana 26 hasta el final del año 2. Se observaron resultados similares al evaluar con el tiempo todas las crisis y las crisis de ausencia frente a las mioclónicas.
Cambio a monoterapia
No hay datos relativos a los efectos de la retirada de los antiepilépticos concomitantes para pasar a la monoterapia con perampanel.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Fycompa en uno o más grupos de la población pediátrica en epilepsias resistentes al tratamiento (síndromes epilépticos relacionados con la localización y con la edad) (ver sección 4.2 para consultar la información sobre el uso en adolescentes).
Los tres estudios pivotales, doble ciego, controlados con placebo y de fase III incluyeron a
143 adolescentes de entre 12 y 18 años. Los resultados en estos adolescentes fueron similares a los
observados en la población adulta.
El estudio 332 incluyó a 22 adolescentes de entre 12 y 18 años. Los resultados en estos adolescentes fueron similares a los observados en la población adulta.
5.2 Propiedades farmacocinéticas
Se ha estudiado la farmacocinética de perampanel en sujetos adultos sanos (intervalo de edad de 18 a 79 años), en adultos y adolescentes con crisis de inicio parcial y crisis tonicoclónicas generalizadas primarias, en adultos con enfermedad de Parkinson, en adultos con neuropatía diabética, en adultos con esclerosis múltiple y en sujetos con insuficiencia hepática.
Absorción
Perampanel se absorbe fácilmente tras la administración oral sin indicios de un metabolismo de primer paso marcado.
La suspensión oral de perampanel es bioequivalente en mg por mg a los comprimidos de perampanel en ayunas. Cuando se administró una dosis única de 12 mg de las dos formulaciones con alimentos ricos en grasas, la suspensión oral de perampanel alcanzó un AUC0_inf equivalente, una Cmáx aproximadamente un 23 % menor y un retraso de 2 horas en el tiempo hasta la exposición máxima (tmáx) en comparación con la formulación en comprimidos. Sin embargo, un análisis farmacocinético
poblacional demostró que, en condiciones simuladas de exposición en estado estacionario, la Cmáx y el AUC de la suspensión oral de perampanel eran bioequivalentes a los de la formulación en comprimidos, tanto en ayunas como con alimentos.
Cuando se administró con alimentos ricos en grasas, la Cmáx y el AUC0-inf de una dosis única de 12 mg de la suspensión oral de perampanel fueron aproximadamente un 22 % y un 13 % menores, respectivamente, en comparación con la administración en ayunas.
Distribución
Los datos de los estudios in vitro indican que aproximadamente el 95 % de perampanel se une a las proteínas plasmáticas.
Los estudios in vitro demuestran que perampanel no es un sustrato o un inhibidor significativo de los polipéptidos transportadores de aniones orgánicos (OATP) 1B1 y 1B3, de los transportadores de aniones orgánicos (OAT) 1, 2, 3 y 4, de los transportadores de cationes orgánicos (OCT) 1, 2 y 3 y de los transportadores de eflujo, la glucoproteína P y la proteína de resistencia al cáncer de mama (BCRP).
Biotransformación
Perampanel se metaboliza de forma extensa mediante oxidación primaria y glucuronidación posterior. El metabolismo de perampanel está mediado principalmente por CYP3A según los resultados de los estudios clínicos realizados en sujetos sanos que recibieron perampanel radiomarcado y la corroboración de los estudios in vitro que utilizaron enzimas de CYP humanas recombinantes y microsomas hepáticos humanos.
Tras la administración de perampanel radiomarcado, solo se observaron cantidades mínimas de los metabolitos de perampanel en el plasma.
Eliminación
Tras la administración de una dosis de perampanel radiomarcado a 8 adultos o a sujetos de edad avanzada sanos, aproximadamente el 30 % de la radiactividad recuperada se encontró en la orina y el 70 % en las heces. La radiactividad recuperada en la orina y las heces estaba principalmente compuesta de una mezcla de metabolitos oxidativos y conjugados. En un análisis farmacocinético poblacional de los datos agrupados de 19 estudios de fase I, el ti/2 promedio de perampanel fue de 105 horas. Cuando se administró en combinación con el inhibidor potente de CYP3A, carbamazepina, el ti/2 promedio fue de 25 horas.
Linealidad/No linealidad
En los sujetos sanos, las concentraciones plasmáticas de perampanel aumentaron de forma proporcionalmente directa a las dosis administradas en el intervalo de 2 a 12 mg. En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que recibieron hasta 12 mg/día de perampanel y de pacientes con crisis tonicoclónicas generalizadas primarias que recibieron hasta 8 mg/día de perampanel en los ensayos clínicos controlados con placebo, se observó una relación lineal entre la dosis y las concentraciones plasmáticas de perampanel.
Poblaciones especiales
Insuficiencia hepática
Se evaluó la farmacocinética de perampanel tras una sola dosis de 1 mg en 12 sujetos con insuficiencia hepática leve y moderada (Child-Pugh A y B, respectivamente) en comparación con 12 sujetos sanos y emparejados en cuanto a los datos demográficos. El aclaramiento aparente medio de perampanel no unido en los sujetos con insuficiencia leve fue de 188 ml/min frente a 338 ml/min en los controles emparejados, y en los sujetos con insuficiencia moderada fue de 120 ml/min frente a 392 ml/min en los controles emparejados. El ti/2 fue mayor en los sujetos con insuficiencia leve (306 h frente a 125 h) y con insuficiencia moderada (295 h frente a 139 h) en comparación con los sujetos sanos emparejados.
Insuficiencia renal
No se ha evaluado formalmente la farmacocinética de perampanel en pacientes con insuficiencia renal. Perampanel se elimina casi exclusivamente por metabolismo, seguido de una rápida excreción de los metabolitos; solo se observan cantidades mínimas de los metabolitos de perampanel en el plasma. En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que tenían niveles de aclaramiento de la creatinina entre 39 y 160 ml/min y que recibieron hasta 12 mg/día de perampanel en los ensayos clínicos controlados con placebo, el aclaramiento de perampanel no se vio afectado por el aclaramiento de la creatinina. En un análisis farmacocinético poblacional de pacientes con crisis tonicoclónicas generalizadas primarias que recibieron hasta 8 mg/día de perampanel en un estudio clínico controlado con placebo, el aclaramiento de creatinina basal no afectó al aclaramiento de perampanel.
Sexo
En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial que recibieron hasta 12 mg/día de perampanel y de pacientes con crisis tonicoclónicas generalizadas primarias que recibieron hasta 8 mg/día de perampanel en los ensayos clínicos controlados con placebo, el aclaramiento de perampanel en las mujeres fue un 18 % inferior (0,54 l/h) que en los hombres (0,66 l/h).
Pacientes de edad avanzada (65 años y mayores)
En un análisis farmacocinético poblacional de pacientes con crisis de inicio parcial (intervalo de edad de 12 a 74 años) y crisis tonicoclónicas generalizadas primarias (intervalo de edad de 12 a 58 años), y que recibieron hasta 8 o 12 mg/día de perampanel en los ensayos clínicos controlados con placebo, no se encontró ningún efecto significativo de la edad en el aclaramiento de perampanel. No se considera necesario ajustar la dosis en las personas de edad avanzada (ver sección 4.2).
Población pediátrica
En un análisis farmacocinético poblacional de los pacientes adolescentes de los estudios clínicos de fase III no se observaron diferencias destacables entre esta población y la población global.
Estudios de interacciones con otros medicamentos
Evaluación in vitro de las interacciones con otros medicamentos Inhibición de las enzimas metabolizadoras de medicamentos
En microsomas hepáticos humanos, perampanel (30 ^mol/l) tuvo un efecto inhibitorio débil en CYP2C8 y UGT1A9 entre otras enzimas de CYP y UGT hepáticas importantes.
Inducción de las enzimas metabolizadoras de medicamentos
En comparación con los controles positivos (entre ellos fenobarbital y rifampicina), se encontró que perampanel induce de forma débil el CYP2B6 (30 ^mol/l) y CYP3A4/5 (>3 ^mol/l) entre otras enzimas del CYP y UGT hepáticas importantes en hepatocitos humanos cultivados.
5.3 Datos preclínicos sobre seguridad
Las reacciones adversas no observadas en ensayos clínicos, pero detectadas en animales con niveles de exposición similares a los clínicos y con posible repercusión en el uso clínico fueron las siguientes:
En el estudio de fertilidad en ratas se observaron ciclos estrales prolongados e irregulares con la dosis máxima tolerada (30 mg/kg) en las hembras; sin embargo, estos cambios no afectaron a la fertilidad ni al desarrollo embrionario temprano. No se observó ningún efecto en la fertilidad de los machos.
Se determinó la excreción en la leche materna en ratas a los 10 días después del parto. Los niveles alcanzaron el máximo a la hora y fueron 3,65 veces mayores que los niveles en plasma.
En un estudio de toxicidad en el desarrollo prenatal y posnatal en ratas, se observaron anomalías en el parto y en las condiciones de lactancia a dosis tóxicas para la madre y el número de fetos muertos aumentó en las crías. No se vio afectado el desarrollo conductual y reproductor de las crías, pero algunos parámetros de desarrollo físico mostraron cierto retraso, que probablemente sea secundario a los efectos en el SNC debidos a la farmacología de perampanel. La transferencia placentaria fue relativamente baja; el 0,09 % o menos de la dosis administrada se detectó en el feto.
Los datos de los estudios no clínicos muestran que perampanel no fue genotóxico y no presentó potencial carcinogénico. La administración de las dosis máximas toleradas a ratas y monos produjo signos clínicos en el SNC debidos a la farmacología y una reducción del peso corporal terminal. No hubo cambios directamente atribuibles a perampanel en la patología o la histopatología clínicas.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Sorbitol (E420) líquido (cristalizante)
Celulosa microcristalina (E460)
Carmelosa sódica (E466)
Poloxámero 188
Simeticona emulsión al 30 % que contiene agua purificada, aceite de silicona, polisorbato 65, metilcelulosa, gel de sílice, estearato de macrogol, ácido sórbico, ácido benzoico y ácido sulfúrico Ácido cítrico, anhidro (E330)
Benzoato de sodio (E211)
Agua purificada
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años
Tras la primera apertura: 90 días.
6.4 Precauciones especiales de conservación No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Frasco de tereftalato de polietileno (PET) con un cierre de seguridad a prueba de niños de polipropileno (PP); cada frasco contiene 340 ml de suspensión y viene envasado en una caja de cartón.
Cada caja contiene un frasco, dos jeringas para uso oral graduadas de 20 ml y un adaptador para el frasco a presión (PIBA) de LDPE. Las jeringas para uso oral están graduadas en incrementos de 0,5 ml.
6.6 Precauciones especiales de eliminación
Ninguna especial para su eliminación.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Reino Unido
Teléfono: +44 (0)208 600 1400 Fax: +44 (0)208 600 1401 e-mail: EUmedinfo@eisai.net
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/776/024
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 23/julio/2012
10. FECHA DE LA REVISIÓN DEL TEXTO
{MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Eisai Manufacturing Ltd.
European Knowledge Centre Mosquito Way Hatfield, Herts AL10 9SN Reino Unido
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Fycompa 2 mg comprimidos recubiertos con película Perampanel
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 2 mg de perampanel.
3. LISTA DE EXCIPIENTES
Contiene lactosa: para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
7 comprimidos recubiertos con película 28 comprimidos recubiertos con película 98 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/776/001
EU/1/12/776/017
EU/1/12/776/018
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Fycompa 2 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
1. NOMBRE DEL MEDICAMENTO
Fycompa 2 mg comprimidos Perampanel
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Fycompa 4 mg comprimidos recubiertos con película Perampanel
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 4 mg de perampanel.
3. LISTA DE EXCIPIENTES
Contiene lactosa: para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
7 comprimidos recubiertos con película 28 comprimidos recubiertos con película 84 comprimidos recubiertos con película 98 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/776/002
EU/1/12/776/003
EU/1/12/776/004
EU/1/12/776/019
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Fycompa 4 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
1. NOMBRE DEL MEDICAMENTO
Fycompa 4 mg comprimidos Perampanel
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Fycompa 6 mg comprimidos recubiertos con película Perampanel
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 6 mg de perampanel.
3. LISTA DE EXCIPIENTES
Contiene lactosa: para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
7 comprimidos recubiertos con película 28 comprimidos recubiertos con película 84 comprimidos recubiertos con película 98 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/776/005
EU/1/12/776/006
EU/1/12/776/007
EU/1/12/776/020
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Fycompa 6 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
1. NOMBRE DEL MEDICAMENTO
Fycompa 6 mg comprimidos Perampanel
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Fycompa 8 mg comprimidos recubiertos con película Perampanel
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 8 mg de perampanel.
3. LISTA DE EXCIPIENTES
Contiene lactosa: para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
7 comprimidos recubiertos con película 28 comprimidos recubiertos con película 84 comprimidos recubiertos con película 98 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/776/008
EU/1/12/776/009
EU/1/12/776/010
EU/1/12/776/021
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Fycompa 8 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
1. NOMBRE DEL MEDICAMENTO
Fycompa 8 mg comprimidos Perampanel
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Fycompa 10 mg comprimidos recubiertos con película Perampanel
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 10 mg de perampanel.
3. LISTA DE EXCIPIENTES
Contiene lactosa: para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
7 comprimidos recubiertos con película 28 comprimidos recubiertos con película 84 comprimidos recubiertos con película 98 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/776/011
EU/1/12/776/012
EU/1/12/776/013
EU/1/12/776/022
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Fycompa 10 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
1. NOMBRE DEL MEDICAMENTO
Fycompa 10 mg comprimidos Perampanel
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Fycompa 12 mg comprimidos recubiertos con película Perampanel
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 12 mg de perampanel.
3. LISTA DE EXCIPIENTES
Contiene lactosa: para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
7 comprimidos recubiertos con película 28 comprimidos recubiertos con película 84 comprimidos recubiertos con película 98 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/776/014
EU/1/12/776/015
EU/1/12/776/016
EU/1/12/776/023
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Fycompa 12 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
1. NOMBRE DEL MEDICAMENTO
Fycompa 12 mg comprimidos Perampanel
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR Y EL ACONDICIONAMIENTO PRIMARIO
1. NOMBRE DEL MEDICAMENTO
Fycompa 0,5 mg/ml suspensión oral perampanel
2. PRINCIPIO(S) ACTIVO(S)
Cada ml contiene 0,5 mg de perampanel.
1 frasco (340 ml) contiene 170 mg de perampanel.
3. LISTA DE EXCIPIENTES
Contiene sorbitol: para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión oral 340 ml
1 frasco
2 jeringas para uso oral
1 adaptador para el frasco a presión (PIBA)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Agitar durante al menos 5 segundos antes de usar. Vía oral
Fecha de apertura:
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
8. FECHA DE CADUCIDAD
CAD
Tras la primera apertura: utilizar en un plazo de 90 días.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/776/024
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Fycompa 0,5 mg/ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
B. PROSPECTO
Prospecto: información para el paciente
Fycompa 2 mg, 4 mg, 6 mg, 8 mg, 10 mg y 12 mg comprimidos recubiertos con película
Perampanel
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Fycompa y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Fycompa
3. Cómo tomar Fycompa
4. Posibles efectos adversos
5. Conservación de Fycompa
6. Contenido del envase e información adicional
1. Qué es Fycompa y para qué se utiliza
Fycompa contiene un medicamento llamado perampanel. Pertenece a un grupo de medicamentos llamados antiepilépticos. Estos medicamentos se utilizan para tratar la epilepsia, cuando una persona tiene ataques epilépticos repetidos (crisis convulsivas). Su médico se lo ha recetado para reducir el número de ataques epilépticos que tiene.
Fycompa se utiliza junto con otros antiepilépticos para tratar formas concretas de epilepsia en personas de 12 años de edad y mayores.
- Se utiliza para tratar los ataques epilépticos que afectan a una parte del cerebro (“crisis parcial”).
- Estas crisis parciales pueden o no ir seguidas de un ataque que afecta a todo el cerebro (“generalización secundaria”).
- También se utiliza para tratar los ataques epilépticos que afectan a todo el cerebro desde el inicio (“crisis generalizada”) y que causan convulsiones.
2. Qué necesita saber antes de empezar a tomar Fycompa No tome Fycompa:
- si es alérgico al perampanel o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Fycompa si tiene problemas de hígado o problemas de riñón moderados o graves.
No debe tomar Fycompa si tiene problemas de hígado graves o problemas de riñón moderados o graves.
Antes de empezar a tomar este medicamento, debe informar a su médico si tiene antecedentes de alcoholismo o drogodependencia.
- Fycompa puede hacer que se sienta mareado o somnoliento, especialmente al comienzo del tratamiento.
- Fycompa puede hacer que sea más propenso a las caídas, especialmente si es una persona mayor; esto podría deberse a su enfermedad.
- Fycompa puede hacer que se vuelva agresivo, furioso o violento. También puede producirle cambios en su comportamiento o estado de ánimo inusuales o extremos.
Si le ocurre alguna de estas cosas, consulte a su médico o farmacéutico.
Un número reducido de personas en tratamiento con antiepilépticos han tenido pensamientos de autolesionarse o suicidarse. Si, en algún momento, tiene estos pensamientos, consulte a su médico inmediamente.
Si experimenta alguno de los problemas anteriores después de tomar Fycompa (o no está seguro), consulte a su médico o farmacéutico.
Niños
No se recomienda utilizar Fycompa en niños menores de 12 años. Todavía no se conoce la seguridad y eficacia en este grupo de edad.
Otros medicamentos y Fycompa
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento. Esto incluye los medicamentos adquiridos sin receta y los medicamentos a base de plantas. La toma de Fycompa con algunos otros medicamentos puede causar efectos adversos o afectar al modo en que funcionan. No comience ni deje de tomar otros medicamentos sin consultar a su médico o farmacéutico.
- Otros antiepilépticos, tales como la carbamazepina, oxcarbazepina y fenitoína que se utilizan para tratar los ataques, pueden afectar a Fycompa. Informe a su médico si está tomando o ha tomado recientemente estos medicamentos ya que podría ser necesario ajustarle la dosis.
- El felbamato (un medicamento que se utiliza para tratar la epilepsia) puede afectar también a Fycompa. Informe a su médico si está tomando o ha tomado recientemente este medicamento ya que podría ser necesario ajustarle la dosis.
- Midazolam (un medicamento que se utiliza para detener las crisis convulsivas agudas [repentinas] y prolongadas, para la sedación y los problemas del sueño) puede verse afectado por Fycompa. Informe a su médico si está tomando midazolam ya que podría ser necesario ajustarle la dosis.
- Otros medicamentos, tales como la rifampicina (un medicamento que se utiliza para tratar las infecciones bacterianas), hypericum (hierba de San Juan) (un medicamento que se utiliza para tratar la ansiedad leve) y ketoconazol (un medicamento que se utiliza para tratar las infecciones por hongos) pueden afectar a Fycompa. Informe a su médico si está tomando o ha tomado recientemente estos medicamentos ya que podría ser necesario ajustarle la dosis.
- Anticonceptivos orales (también llamados “anticonceptivos hormonales”).
Informe a su médico si está tomando anticonceptivos hormonales. Fycompa puede hacer que ciertos anticonceptivos hormonales, como levonorgestrel, sean menos eficaces. Debe utilizar otros métodos anticonceptivos seguros y eficaces (como preservativos o un dispositivo intrauterino) cuando tome Fycompa. Debe continuar haciéndolo durante un mes después de dejar el tratamiento. Consulte a su médico cuál puede ser el método anticonceptivo adecuado para usted.
Toma de Fycompa con alcohol
Hable con su médico antes de tomar alcohol. Tenga cuidado con el consumo de alcohol y los medicamentos para la epilepsia, entre ellos Fycompa.
- El beber alcohol mientras toma Fycompa puede hacer que su nivel de alerta disminuya y afectar a su capacidad para conducir o utilizar herramientas y máquinas.
- El beber alcohol mientras toma Fycompa puede hacer también que cualquier sensación de enfado, confusión o tristeza empeoren.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. No interrumpa el tratamiento sin consultar primero a su médico.
- No se recomienda utilizar Fycompa durante el embarazo.
- Debe utilizar un método anticonceptivo fiable para prevenir el embarazo mientras reciba tratamiento con Fycompa. Debe continuar haciéndolo durante un mes después de dejar el tratamiento. Informe a su médico si está tomando anticonceptivos hormonales. Fycompa puede hacer que ciertos anticonceptivos hormonales, como levonorgestrel, sean menos eficaces. Debe utilizar otros métodos anticonceptivos seguros y eficaces (como preservativos o un dispositivo intrauterino) cuando tome Fycompa. También debe hacerlo durante un mes después de dejar el tratamiento. Consulte a su médico cuál puede ser el método anticonceptivo adecuado para usted
Se desconoce si los componentes de Fycompa pueden pasar a la leche materna.
El médico sopesará los beneficios del tratamiento con Fycompa para la madre y los riesgos para el bebé mientras esté en periodo de lactancia.
Conducción y uso de máquinas
No conduzca ni utilice máquinas hasta que sepa cómo le afecta Fycompa.
Debe hablar con su médico sobre el efecto de la epilepsia en la conducción y el uso de máquinas.
- Fycompa puede hacer que se sienta mareado o somnoliento, especialmente al comienzo del tratamiento. Si le ocurre esto, no conduzca ni utilice herramientas o máquinas.
- El beber alcohol mientras toma Fycompa puede hacer que estos efectos empeoren.
Fycompa contiene lactosa
Fycompa contiene lactosa (un tipo de azúcar). Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo tomar Fycompa
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
Cuánto debe tomar
La dosis inicial recomendada es 2 mg una vez al día antes de acostarse.
- Su médico puede aumentar esta dosis en incrementos de 2 mg hasta una dosis de mantenimiento entre 4 mg y 12 mg, dependiendo de su respuesta.
- Si tiene problemas de hígado (hepáticos) leves o moderados, su dosis no debe ser mayor de 8 mg al día y los aumentos en la dosis se deben hacer con un intervalo de al menos 2 semanas.
- No tome más Fycompa de lo recomendado por su médico. Puede llevar algunas semanas hasta dar con la dosis de Fycompa adecuada para usted.
Cómo tomar
Trague el comprimido entero con un vaso de agua. Fycompa se puede tomar con o sin alimentos. No
mastique, triture ni parta el comprimido. Los comprimidos no se pueden partir de forma exacta ya que
no tienen ranura.
Si toma más Fycompa del que debe
Si ha tomado más Fycompa del que debe, consulte a su médico inmediatamente. Puede presentar aturdimiento, agitación y conducta agresiva.
Si olvidó tomar Fycompa
- Si olvidó tomar un comprimido, espere hasta que le toque tomar la siguiente dosis y, después, continúe de la forma habitual.
- No tome una dosis doble para compensar las dosis olvidadas.
- Si se ha saltado menos de 7 días de tratamiento con Fycompa, continúe tomando el comprimido diario según las indicaciones originales de su médico.
- Si se ha saltado más de 7 días de tratamiento con Fycompa, consulte a su médico inmediatamente.
Si interrumpe el tratamiento con Fycompa
Tome Fycompa durante el tiempo recomendado por su médico. No interrumpa el tratamiento a menos que su médico se lo aconseje. Su médico puede reducirle la dosis paulatinamente para evitar que los ataques epilépticos (crisis convulsivas) vuelvan o empeoren.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Un número reducido de personas en tratamiento con antiepilépticos han tenido pensamientos de autolesionarse o suicidarse. Si, en algún momento, tiene estos pensamientos, consulte a su médico inmediamente
Muy frecuentes (pueden afectar a más de 1 de cada 10 usuarios):
- sensación de mareo
- sensación de sueño (adormecimiento o somnolencia)
Frecuentes (pueden afectar hasta 1 de cada 10 usuarios):
- aumento o disminución del apetito, aumento de peso
- sensación de agresividad, enfado, irritabilidad, ansiedad o confusión
- dificultad para andar u otros problemas del equilibrio (ataxia, trastorno de la marcha, trastorno del equilibrio)
- habla lenta (disartria)
- visión borrosa o visión doble (diplopía)
- sensación de que todo da vueltas (vértigo)
- ganas de vomitar (náuseas)
- dolor de espalda
- sensación de mucho cansancio (fatiga)
- caídas
Poco frecuentes (pueden afectar hasta 1 de cada 100 usuarios):
- pensamientos de autoagresión o de poner fin a su vida (pensamientos suicidas), intento de poner fin a su vida (intento de suicidio)
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Fycompa
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en el blíster. La fecha de caducidad es el último día del mes que se indica.
No requiere condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Fycompa
El principio activo es perampanel. Cada comprimido recubierto con película contiene 2 mg, 4 mg,
6 mg, 8 mg, 10 mg o 12 mg de perampanel.
Los demás componentes son:
Núcleo del comprimido (comprimidos de 2 mg y 4 mg):
Lactosa monohidrato, hidroxipropilcelulosa de baja sustitución, povidona, estearato de magnesio (E470b)
Núcleo del comprimido (comprimidos de 6 mg, 8 mg, 10 mg y 12 mg)
Lactosa monohidrato, hidroxipropilcelulosa de baja sustitución, povidona, celulosa microcristalina, estearato de magnesio (E470b)
Cubierta pelicular (comprimidos de 2 mg, 4 mg, 6 mg, 8 mg, 10 mg y 12 mg)
Hipromelosa2910, talco, Macrogol 8000, dióxido de titanio (E171), colorantes*
*Los colorantes son:
Comprimido de 2 mg: Óxido de hierro, Amarillo (E172), Óxido de hierro, Rojo (E172)
Comprimido de 4 mg: Óxido de hierro, Rojo (E172)
Comprimido de 6 mg: Óxido de hierro, Rojo (E172)
Comprimido de 8 mg: Óxido de hierro, Rojo (E172), Óxido de hierro, Negro (E172)
Comprimido de 10 mg: Óxido de hierro, Amarillo (E172), FD&C Azul n.° 2 Laca de aluminio índigo carmín (E132)
Comprimido de 12 mg: FD&C Azul n.° 2 Laca de aluminio índigo carmín (E132)
Aspecto del producto y contenido del envase
Todas las concentraciones de Fycompa son comprimidos recubiertos, redondos y biconvexos.
2 mg: de color naranja, con la marca E275 en una cara y 2 en la otra cara 4 mg: de color rojo, con la marca E277 en una cara y 4 en la otra cara 6 mg: de color rosa, con la marca E294 en una cara y 6 en la otra cara 8 mg: de color morado, con la marca E295 en una cara y 8 en la otra cara 10 mg: de color verde, con la marca E296 en una cara y 10 en la otra cara 12 mg: color azul, con la marca E297 en una cara y 12 en la otra cara
Fycompa se presenta en envases de:
Comprimido de 2 mg - envase de 7, 28 y 98
Comprimidos de 4 mg, 6 mg, 8 mg, 10 mg y 12 mg - envases de 7, 28, 84 y 98 Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Eisai Europe Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire, AL10
9SN, Reino Unido
e-mail: EUmedinfo@eisai.net
Responsable de la fabricación
Eisai Manufacturing Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire, AL10 9SN, Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Eisai SA/NV Tél/Tel: + 32 (0) 2 502 58 04 |
Luxembourg/Luxemburg Eisai SA/NV Tél/Tel: + 32 (0) 2 502 58 04 (Belgique/Belgien) |
|
Etarapna Eisai Ltd. Tea.: + 44 (0) 20 8600 1400 (06egHHeHO KpaacTBo) |
Magyarország Eisai Ltd. Tel.: +44 (0) 20 8600 1400 Egyesült Királyság |
|
Ceská republika Eisai GesmbH organizacni slozka Tel.: + 420 242 485 839 |
Malta Associated Drug Co. Ltd Tel: + 356 2277 8000 |
|
Danmark Eisai AB Tlf: + 46 (0) 8 501 01 600 (Sverige) |
Nederland Eisai B.V. Tél/Tel: + 31 (0) 900 575 3340 |
|
Deutschland Eisai GmbH Tel: + 49 (0) 69 66 58 50 |
Norge Eisai AB Tlf: + 46 (0) 8 501 01 600 (Sverige) |
|
Eesti Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Ühendkuningriik) |
Osterreich Eisai GesmbH Tel: + 43 (0) 1 535 1980-0 |
|
EXXáSa Arriani Pharmaceuticals S.A. T^: +30 210 668 3000 |
Polska Eisai Ltd. Tel.: + 44 (0) 20 8600 1400 (Wielka Brytania) |
|
España Eisai Farmacéutica, S.A. Tel: + (34) 91 455 94 55 |
Portugal Eisai Farmacéutica, Unipessoal Lda Tel: + 351 214 875 540 |
|
France Eisai SAS Tél: + (33) 1 47 67 00 05 |
Romania Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Marea Britanie) |
|
Hrvatska Eisai Ltd. Tel: + 44 (0) 20 8600 1400 (Velika Britanija) |
Slovenija Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Velika Britanija) |
|
Ireland Eisai Ltd. Tel: + 44 (0)20 8600 1400 (United Kingdom) |
Slovenská republika Eisai GesmbH organizacni slozka Tel.: + 420 242 485 839 (Ceská republika) |
|
Ísland Eisai AB Sími: + 46 (0)8 501 01 600 (Svífejóó) |
Suomi/Finland Eisai AB Puh/Tel: + 46 (0) 8 501 01 600 (Ruotsi) |
|
Italia Eisai S.r.l. Tel: + 39 02 5181401 |
Sverige Eisai AB Tel: + 46 (0) 8 501 01 600 |
|
Kúnpoq Arriani Pharmaceuticals S.A. T^: + 30 210 668 3000 (EAláSa) Latvija Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Liebritanija) Lietuva Eisai Ltd. Tel. +44 (0) 20 8600 1400 (Jungtiné Karalysté) |
United Kingdom Eisai Ltd. Tel: + 44 (0)20 8600 1400 |
Fecha de la última revisión de este prospecto: {MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu/.
Prospecto: información para el usuario
Fycompa 0,5 mg/ml suspensión oral
Perampanel
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Fycompa y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Fycompa
3. Cómo usar Fycompa
4. Posibles efectos adversos
5. Conservación de Fycompa
6. Contenido del envase e información adicional
1. Qué es Fycompa y para qué se utiliza
Fycompa contiene un medicamento llamado perampanel. Pertenece a un grupo de medicamentos llamados antiepilépticos. Estos medicamentos se utilizan para tratar la epilepsia, cuando una persona tiene ataques epilépticos repetidos (crisis convulsivas). Su médico se lo ha recetado para reducir el número de ataques epilépticos que tiene.
Fycompa se utiliza junto con otros antiepilépticos para tratar formas concretas de epilepsia en personas de 12 años de edad y mayores.
- Se utiliza para tratar los ataques epilépticos que afectan a una parte del cerebro (“crisis parcial”).
- Estas crisis parciales pueden o no ir seguidas de un ataque que afecta a todo el cerebro (“generalización secundaria”).
- También se utiliza para tratar los ataques epilépticos que afectan a todo el cerebro desde el inicio (“crisis generalizada”) y que causan convulsiones.
2. Qué necesita saber antes de empezar a tomar Fycompa No tome Fycompa:
- si es alérgico al perampanel o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Fycompa si tiene problemas de hígado o problemas de riñón moderados o graves.
No debe tomar Fycompa si tiene problemas de hígado graves o problemas de riñón moderados o graves.
Antes de empezar a tomar este medicamento, debe informar a su médico si tiene antecedentes de alcoholismo o drogodependencia.
- Fycompa puede hacer que se sienta mareado o somnoliento, especialmente al comienzo del tratamiento.
- Fycompa puede hacer que sea más propenso a las caídas, especialmente si es una persona mayor; esto podría deberse a su enfermedad.
- Fycompa puede hacer que se vuelva agresivo, furioso o violento. También puede producirle cambios en su comportamiento o estado de ánimo inusuales o extremos.
Si le ocurre alguna de estas cosas, consulte a su médico o farmacéutico.
Un número reducido de personas en tratamiento con antiepilépticos han tenido pensamientos de autolesionarse o suicidarse. Si, en algún momento, tiene estos pensamientos, consulte a su médico inmediamente.
Si experimenta alguno de los problemas anteriores después de tomar Fycompa (o no está seguro), consulte a su médico o farmacéutico.
Niños
No se recomienda utilizar Fycompa en niños menores de 12 años. Todavía no se conoce la seguridad y eficacia en este grupo de edad.
Otros medicamentos y Fycompa
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento. Esto incluye los medicamentos adquiridos sin receta y los medicamentos a base de plantas. La toma de Fycompa con algunos otros medicamentos puede causar efectos adversos o afectar al modo en que funcionan. No comience ni deje de tomar otros medicamentos sin consultar a su médico o farmacéutico.
- Otros antiepilépticos, tales como la carbamazepina, oxcarbazepina y fenitoína que se utilizan para tratar los ataques, pueden afectar a Fycompa. Informe a su médico si está tomando o ha tomado recientemente estos medicamentos ya que podría ser necesario ajustarle la dosis.
- El felbamato (un medicamento que se utiliza para tratar la epilepsia) puede afectar también a Fycompa. Informe a su médico si está tomando o ha tomado recientemente este medicamento ya que podría ser necesario ajustarle la dosis.
- Midazolam (un medicamento que se utiliza para detener las crisis convulsivas agudas [repentinas] y prolongadas, para la sedación y los problemas del sueño) puede verse afectado por Fycompa. Informe a su médico si está tomando midazolam ya que podría ser necesario ajustarle la dosis.
- Otros medicamentos, tales como la rifampicina (un medicamento que se utiliza para tratar las infecciones bacterianas), hypericum (hierba de San Juan) (un medicamento que se utiliza para tratar la ansiedad leve) y ketoconazol (un medicamento que se utiliza para tratar las infecciones por hongos) pueden afectar a Fycompa. Informe a su médico si está tomando o ha tomado recientemente estos medicamentos ya que podría ser necesario ajustarle la dosis.
- Anticonceptivos orales (también llamados “anticonceptivos hormonales”).
Informe a su médico si está tomando anticonceptivos hormonales. Fycompa puede hacer que ciertos anticonceptivos hormonales, como levonorgestrel, sean menos eficaces. Debe utilizar otros métodos anticonceptivos seguros y eficaces (como preservativos o un dispositivo intrauterino) cuando tome Fycompa. Debe continuar haciéndolo durante un mes después de dejar el tratamiento. Consulte a su médico cuál puede ser el método anticonceptivo adecuado para usted.
Toma de Fycompa con alcohol
Hable con su médico antes de tomar alcohol. Tenga cuidado con el consumo de alcohol y los medicamentos para la epilepsia, entre ellos Fycompa.
- El beber alcohol mientras toma Fycompa puede hacer que su nivel de alerta disminuya y afectar a su capacidad para conducir o utilizar herramientas y máquinas.
- El beber alcohol mientras toma Fycompa puede hacer también que cualquier sensación de enfado, confusión o tristeza empeoren.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. No interrumpa el tratamiento sin consultar primero a su médico.
- No se recomienda utilizar Fycompa durante el embarazo.
- Debe utilizar un método anticonceptivo fiable para prevenir el embarazo mientras reciba tratamiento con Fycompa. Debe continuar haciéndolo durante un mes después de dejar el tratamiento. Informe a su médico si está tomando anticonceptivos hormonales. Fycompa puede hacer que ciertos anticonceptivos hormonales, como levonorgestrel, sean menos eficaces. Debe utilizar otros métodos anticonceptivos seguros y eficaces (como preservativos o un dispositivo intrauterino) cuando tome Fycompa. También debe hacerlo durante un mes después de dejar el tratamiento. Consulte a su médico cuál puede ser el método anticonceptivo adecuado para usted
Se desconoce si los componentes de Fycompa pueden pasar a la leche materna.
El médico sopesará los beneficios del tratamiento con Fycompa para la madre y los riesgos para el bebé mientras esté en periodo de lactancia.
Conducción y uso de máquinas
No conduzca ni utilice máquinas hasta que sepa cómo le afecta Fycompa.
Debe hablar con su médico sobre el efecto de la epilepsia en la conducción y el uso de máquinas.
- Fycompa puede hacer que se sienta mareado o somnoliento, especialmente al comienzo del tratamiento. Si le ocurre esto, no conduzca ni utilice herramientas o máquinas.
- El beber alcohol mientras toma Fycompa puede hacer que estos efectos empeoren.
Fycompa contiene sorbitol
Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar Fycompa.
La toma de Fycompa con otros antiepilépticos que contienen sorbitol puede afectar a la forma en la que estos funcionan. Informe a su médico o farmacéutico si está tomando cualquier otro antiepiléptico que contiene sorbitol.
3. Cómo usar Fycompa
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
Cuánto debe tomar
La dosis inicial recomendada es 2 mg (4 ml) una vez al día antes de acostarse.
- Su médico puede aumentar esta dosis en incrementos de 2 mg (4 ml) hasta una dosis de mantenimiento entre 4 mg (8 ml) y 12 mg (24 ml), dependiendo de su respuesta.
- Si tiene problemas de hígado (hepáticos) leves o moderados, su dosis no debe ser mayor de 8 mg al día y los aumentos en la dosis se deben hacer con un intervalo de al menos 2 semanas.
- No tome más Fycompa de lo recomendado por su médico. Puede llevar algunas semanas hasta dar con la dosis de Fycompa adecuada para usted.
Cómo tomar
Fycompa se administra por vía oral. Fycompa se puede tomar con o sin alimentos y se debe tomar siempre de la misma manera. Por ejemplo, si decide tomar Fycompa con alimentos, tómelo siempre con alimentos.
Utilice la jeringa para uso oral y el adaptador proporcionados para la administración.
A continuación se facilitan las instrucciones de uso de la jeringa para uso oral y del adaptador:
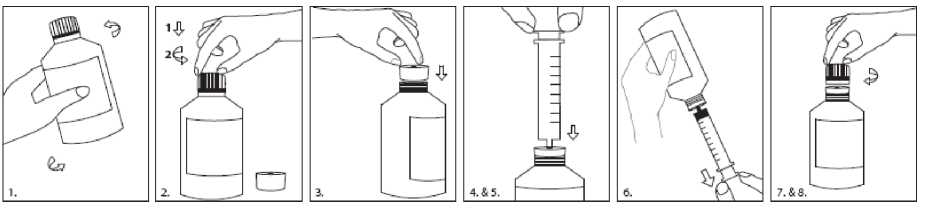
1. Agite durante al menos 5 segundos antes de usar.
2. Presione y gire la cápsula de cierre para abrir el frasco.
3. Introduzca el adaptador en el cuello del frasco hasta que quede herméticamente cerrado.
4. Meta totalmente el émbolo de la jeringa para uso oral.
5. Introduzca la jeringa para uso oral en la apertura del adaptador el máximo posible.
6. Ponga el frasco boca abajo y extraiga la cantidad prescrita de Fycompa.
7. Ponga el frasco boca arriba y saque la jeringa para uso oral.
8. Deje el adaptador colocado y vuelva a poner la cápsula de cierre en el frasco. Lave la jeringa para uso oral con agua limpia y séquela bien.
Si toma más Fycompa del que debe
Si ha tomado más Fycompa del que debe, consulte a su médico inmediatamente. Puede presentar aturdimiento, agitación y conducta agresiva.
Si olvidó tomar Fycompa
- Si olvidó tomar Fycompa, espere hasta que le toque tomar la siguiente dosis y, después, continúe de la forma habitual.
- No tome una dosis doble para compensar las dosis olvidadas.
- Si se ha saltado menos de 7 días de tratamiento con Fycompa, continúe tomando la dosis diaria según las indicaciones originales de su médico.
- Si se ha saltado más de 7 días de tratamiento con Fycompa, consulte a su médico inmediatamente. Si interrumpe el tratamiento con Fycompa
Tome Fycompa durante el tiempo recomendado por su médico. No interrumpa el tratamiento a menos que su médico se lo aconseje. Su médico puede reducirle la dosis paulatinamente para evitar que los ataques epilépticos (crisis convulsivas) vuelvan o empeoren.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Un número reducido de personas en tratamiento con antiepilépticos han tenido pensamientos de autolesionarse o suicidarse. Si, en algún momento, tiene estos pensamientos, consulte a su médico inmediamente
Muy frecuentes (pueden afectar a más de 1 de cada 10 usuarios):
- sensación de mareo
- sensación de sueño (adormecimiento o somnolencia)
Frecuentes (pueden afectar hasta 1 de cada 10 usuarios):
- aumento o disminución del apetito, aumento de peso
- sensación de agresividad, enfado, irritabilidad, ansiedad o confusión
- dificultad para andar u otros problemas del equilibrio (ataxia, trastorno de la marcha, trastorno del equilibrio)
- habla lenta (disartria)
- visión borrosa o visión doble (diplopía)
- sensación de que todo da vueltas (vértigo)
- ganas de vomitar (náuseas)
- dolor de espalda
- sensación de mucho cansancio (fatiga)
- caídas
Poco frecuentes (pueden afectar hasta 1 de cada 100 usuarios):
- pensamientos de autoagresión o de poner fin a su vida (pensamientos suicidas), intento de poner fin a su vida (intento de suicidio)
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Fycompa
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del frasco y en la caja. La fecha de caducidad es el último día del mes que se indica.
No requiere condiciones especiales de conservación.
Si transcurren más de 90 días tras la primera apertura, no debe utilizar la suspensión que quede en el frasco.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de Fycompa
El principio activo es perampanel. Cada mililitro contiene 0,5 mg de perampanel.
- Los demás componentes son sorbitol (E420) líquido (cristalizante), celulosa microcristalina (E460), carmelosa sódica (E466), poloxámero 188, simeticona emulsión al 30 % (contiene agua purificada, aceite de silicona, polisorbato 65, metilcelulosa, gel de sílice, estearato de macrogol, ácido sórbico, ácido benzoico y ácido sulfúrico), ácido cítrico, anhidro (E330), benzoato de sodio (E211) y agua purificada.
Aspecto del producto y contenido del envase
Fycompa 0,5 mg/ml suspensión oral es una suspensión de color blanco a blanquecino. Se presenta en un frasco de 340 ml con 2 jeringas para uso oral graduadas y un adaptador para el frasco a presión (PIBA).
Titular de la autorización de comercialización
Eisai Europe Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire, AL10
9SN, Reino Unido
e-mail: EUmedinfo@eisai.net
Responsable de la fabricación
Eisai Manufacturing Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire, AL10 9SN, Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Eisai SA/NV
Tél/Tel: + 32 (0) 2 502 58 04
Btnrapnn
Eisai Ltd.
Ten.: + 44 (0) 20 8600 1400 (06egHHeHO KpancTBo)
Luxembourg/Luxemburg
Eisai SA/NV
Tél/Tel: + 32 (0) 2 502 58 04 (Belgique/Belgien)
Magyarország Eisai Ltd.
Tel.: +44 (0) 20 8600 1400 Egyesült Királyság
Ceská republika
Eisai GesmbH organizacni slozka
Tel.: + 420 242 485 839
Malta
Associated Drug Co. Ltd Tel: + 356 2277 8000
Nederland
Eisai B.V.
Tél/Tel: + 31 (0) 900 575 3340
Danmark
Eisai AB
Tlf: + 46 (0) 8 501 01 600 (Sverige)
Deutschland
Eisai GmbH
Tel: + 49 (0) 69 66 58 50
Norge
Eisai AB
Tlf: + 46 (0) 8 501 01 600 (Sverige)
|
Eesti Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Ühendkuningriik) |
Osterreich Eisai GesmbH Tel: + 43 (0) 1 535 1980-0 |
|
EXXáSa Arriani Pharmaceuticals S.A. Tn^: + 30 210 668 3000 |
Polska Eisai Ltd. Tel.: + 44 (0) 20 8600 1400 (Wielka Brytania) |
|
España Eisai Farmacéutica, S.A. Tel: + (34) 91 455 94 55 |
Portugal Eisai Farmacéutica, Unipessoal Lda Tel: + 351 214 875 540 |
|
France Eisai SAS Tél: + (33) 1 47 67 00 05 |
Romania Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Marea Britanie) |
|
Hrvatska Eisai Ltd. Tel: + 44 (0) 20 8600 1400 (Velika Britanija) |
Slovenija Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Velika Britanija) |
|
Ireland Eisai Ltd. Tel: + 44 (0)20 8600 1400 (United Kingdom) |
Slovenská republika Eisai GesmbH organizacni slozka Tel.: + 420 242 485 839 (Ceská republika) |
|
Ísland Eisai AB Sími: + 46 (0)8 501 01 600 (Svífejóó) |
Suomi/Finland Eisai AB Puh/Tel: + 46 (0) 8 501 01 600 (Ruotsi) |
|
Italia Eisai S.r.l. Tel: + 39 02 5181401 |
Sverige Eisai AB Tel: + 46 (0) 8 501 01 600 |
|
Kúnpoq Arriani Pharmaceuticals S.A. Tn^: + 30 210 668 3000 (EAláSa) Latvija Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Liebritanija) Lietuva Eisai Ltd. Tel. +44 (0) 20 8600 1400 (Jungtiné Karalysté) |
United Kingdom Eisai Ltd. Tel: + 44 (0)20 8600 1400 |
Fecha de la última revisión de este prospecto: {MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu/.
77