Frenasal 1Mg/Ml Solucion Para Pulverizacion Nasal
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
FRENASAL 1mg/ml solución para pulverización nasal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene:
Xilometazolina, hidrocloruro.................................1 mg
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución para pulverización nasal.
Solución clara, incolora, ligeramente amarillenta.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Alivio local y temporal de la congestión nasal.
4.2 Posología y forma de administración
Adultos y adolescentes mayores de 12 años:
1 pulverización en cada fosal nasal, pero no más de 3 veces al día. Este medicamento debe ser utilizado durante un máximo de 3 días, a menos que su médico le haya dado otras indicaciones distintas.
Población pediátrica
Frenasal 1 mg/ml spray nasal no se debe administrar en niños menores de 12 años (Ver sección 4.3).
Mayores de 65 años La misma dosis que en adultos.
Forma de administración.
Este medicamento se administra por vía nasal
Antes de la aplicación de este medicamento, debe eliminar los fluidos nasales existentes, sonándose bien la nariz.
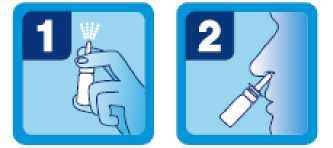
1. Retire la tapa protectora. Antes de utilizarlo pulse el spray varias veces hasta conseguir una pulverización constante (ver Figura 1). El spray ahora está listo para su uso.
2. Mantenga el frasco en posición vertical. Inserte la punta del spray dentro del orificio nasal (no pulverice por debajo de la fosa nasal) (ver Figura 2)
3. Presione el spray una vez. En ese momento de la pulverización respire a través de la nariz. Repita por el otro orificio nasal.
4. Después de la utilización, coloque la tapa protectora sobre el spray
Para evitar contagios, después de cada uso y antes de cerrar el envase, se debe limpiar el extremo del aplicador con un paño limpio y húmedo. Además, cada envase debe ser utilizado sólo por una persona.
Si los síntomas empeoran o si persisten después de 3 días de tratamiento, se deberá suprimir el tratamiento y evaluar la situación clínica.
4.3 Contraindicaciones
- Hipersensibilidad al principio activo xilometazolina, a otros descongestivos adrenérgicos, o a algunos de los excipientes incluidos en la sección 6.1.
- Pacientes con aumento de la presión intraocular, particularmente en pacientes con glaucoma de ángulo estrecho
- Pacientes a los que se la ha practicado una hiperfisectomía transesfenoidal o algún tipo de cirugía con exposición a la duramadre.
- Pacientes con inflamación seca de la mucosa nasal (rinitis seca)
- Niños menores de 12 años
- Pacientes con rinitis atrófica o vasomotora
- Pacientes que están siendo tratados con inhibidores de la monoaminooxidasa (IMAO) o hayan sido tratados en las 2 semanas previas, o con otros medicamentos con efecto antihipertensivo.
4.4 Advertencias y precauciones especiales de empleo
En pacientes con enfermedades cardiovasculares, hipertensión, diabetes, enfermedades del tiroides, feocromocitoma o hipertrofia prostática, se debe realizar una evaluación clínica antes de utilizar este medicamento.
No se debería administra a pacientes que reaccionan fuertemente a los simpaticomiméticos ya que les puede causar, por ejemplo insomnio, vértigo, temblor, arritmia o aumento de la presión arterial.
En casos raros, el medicamento puede aumentar los síntomas de congestión nasal en lugar de disminuirlos; esto es debido a que los efectos de xilometazolina son temporales y a que el uso prolongado puede dar como resultado un efecto rebote con vasodilatación, congestión y rinitis medicamentosa.
Raramente puede aparecer insomnio tras la administración del medicamento, en esos casos se deberá evitar su administración a última hora de la tarde o por la noche.
Uso en mayores de 65 años: las personas mayores de esta edad son más sensibles a los efectos adversos de este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
El uso concomitante con los siguientes medicamentos puede incrementar la presión sanguínea, por lo que se deberá espaciar 2 semanas entre la toma de estos medicamentos y el uso de xilometazolina:
- Antidepresivos tricíclicos
- inhibidores de la monoaminooxidasa (IMAO)
- Metildopa.
Tampoco se debe utilizar en caso de estar en tratamiento con fenotiazinas o con broncodilatoadores adrenérgicos.
4.6 Fertilidad, embarazo y lactancia Embarazo
Aunque la posibilidad de que se produzca una absorción sistémica de la xilometazolina por parte de la madre es pequeña, con los datos disponibles no es posible descartar riesgo fetal. Por tanto, este medicamento no se debe utilizar durante el embarazo.
Lactancia
Se desconoce si la xilometazolina se excreta a la leche materna. Aunque no se han descrito casos perjudiciales para el recién nacido, no está recomendado el uso de xilometazolina durante la lactancia ya que no se puede descartar la existencia de riesgo para el recién nacido.
Fertilidad
No hay datos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Aunque no son de esperar efectos en este sentido, si el paciente nota somnolencia o mareos es preferible que no conduzca ni use máquinas.
4.8 Reacciones adversas
Los efectos adversos que se han notificado con más Xilometazolina son:
Sensación de picor y ardor en nariz y garganta, así como frecuencia durante el periodo de utilización de irritación o sequedad de la mucosa nasal,
La frecuencia de los efectos no deseados se ha definido como sigue: Muy frecuente >1/10
Frecuente > 1/100 a<1/10
Poco frecuente >1/1.000 a <1/100
Rara >1/10.000 a <1/1.000
Muy rara <1/10.000
No conocida No puede ser estimada a partir de los datos existentes.
|
Frecuente |
Rara |
No conocida | |
|
Trastornos en el sistema inmune |
Reacciones alergicas sistemicas | ||
|
Trastornos psiquiatricos |
Nerviosismo, insomnio | ||
|
Trastornos nerviosos |
Dolor de cabeza, mareos | ||
|
Trastornos oculares |
Trastornos visuales transitorios | ||
|
Trastornos cardiacos |
Taquicardia | ||
|
Trastornos vasculares |
Subida de la tensión arterial | ||
|
Trastornos respiratorios |
Escozor o quemazon de la nariz y garganta y sequedad de la membrana de la nariz |
Efecto rebote | |
|
Trastornos gastrointestinales |
Nauseas |
El uso excesivo o continuado puede dar lugar a una congestión nasal por efecto rebote.
En caso de observar la aparición de reacciones adversas debe suspenderse el tratamiento.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
Por aplicación de dosis excesivas o muy continuadas o por ingestión accidental se puede producir: absorción sistémica. En este caso se produce una excesiva estimulación del SNC incluso una depresión del SNC paradógica, colapso cardiovascular, shock y coma.
Estos efectos pueden incluir la siguiente sintomatología: Cefalea, temblores, alteraciones del sueño, sudoración excesiva, palpitaciones y nerviosismo, temblores, alucinaciones. Midriasis, nauseas, cianosis, fiebre, espasmos, taquicardias, arritmia cardiaca, paro cardiaco, hipertensión, edema pulmonar, disnea, alteraciones psíquicas. También es posible que haya una inhibición de las funciones del sistema nervioso central, tales como somnolencia, disminución de la temperatura corporal, bradicardia, hipotensión similar a shock, apnea y pérdida de la conciencia.
En el caso de los niños, estos síntomas incluyen: alucinaciones, excitabilidad, urticaria, nauseas y vómitos, histeria, sopor o letargo, alteraciones en la forma de caminar, edema facial.
En casos de ingestión por vía oral de grandes cantidades (dosis letal media en niños menores de 2 años, 10 mg, en adultos al menos 10 veces más), se realizará evacuación gástrica mediante emesis o lavado gástrico seguido de carbón activado en dosis repetidas (cada 4-6 horas) más un purgante salino o laxante (sulfato de sodio).
Se controlará la tensión arterial, pulso, convulsiones, y agitación, así como los efectos simpaticomiméticos. Están contraindicados los fármacos vasopresores.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Preparados nasales, simpaticomiméticos solos para administración nasal. Código ATC: R01A A07
Mecanismo de acción
Este efecto se puede deber a la estimulación directa de los receptores alfa postsinápticos.
Es conocido que la xilometazolina no tiene efecto sobre los receptores beta adrenérgicos.
Efectos farmacodinámicos
Xilometazolina es un derivado de imidazol con efecto simpaticomimético. La xilometazolina pulverizada en la mucosa nasal causa una vasoconstricción prolongada, como resultado de la cual, la congestión nasal se reduce en la mucosa nasal y la región nasofaríngea.
Eficacia clínica y seguridad
En el tratamiento de la rinitis alérgica, la xilometazolina pulverizada en el interior de la nariz es apropiada para uso temporal o para facilicitar la adminstración de otro medicamento que tiene efecto tópico sobre la membrana de la mucosa nasal.
Los síntomas del “efecto rebote” (inflamación y congestión de la mucosa nasal) que a veces se produce como resultado de una utilización prolongada, pueden ser causados porque el medicamento estimula los receptores presinápticos alfa-2 y reduce la liberación de noradrenalina. Normalmente, los síntomas del efecto rebote aparecen después de 2-3 semanas de tratamiento continuo. Sin embargo, la xilometazolina ha sido administrada en individuos sanos, incluso durante 6 semanas, sin la aparición en ellos de inflamación de la mucosa nasal o taquifilaxia.
En estudios in vitro, se ha descrito que la xilometazolina empeora la función ciliar, pero este efecto no es permanente.
En pacientes con sinusitis o catarro tubárico se podrá tratar la congestión con este medicamento después de descartar cualquier otra complicación como pueda ser una sinusitis bacteriana.
5.2 Propiedades farmacocinéticas
Las concentraciones plasmáticas de xilometazolina en humanos, después de su aplicación nasal, son muy bajas. Sin embargo es de esperar que a la pauta propuesta, 3 veces al día; se produzca acumulación de xilometazolina.
En altas dosis y cuando se ingiere, debido a su consecuente absorción, se pueden producir efectos sistémicos. Se dispone de poca información sobre la distribución, metabolismo o secreción de la xilometazolina en el organismo humano.
El efecto de Frenasal se inicia en unos 5 minutos y puede durar de 10 a 12 horas.
5.3 Datos preclínicos sobre seguridad
La xilometazolina no tiene efectos mutágénicos. En un estudio en el que se administró xilometazolina por vía subcutánea a ratones y ratas, no se observaron efectos teratogénicos.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Hialuronato de sodio Sorbitol (E420)
Glicerol (E422)
Dihidrogenofosfato de sódio dihidrato Hidrogenofosfato de disodio dihidrato Cloruro de sodio
Agua para preparaciones inyectables
6.2 Incompatibilidades No procede.
6.3 Periodo de validez
2 años
Una vez abierto, no utilice FRENASAL 1mg/ml solución para pulverización nasal durante más de 12 meses.
No utilizar este medicamento después de la fecha de caducidad que aparece en el envase.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30 °C.
6.5 Naturaleza y contenido del envase
Botella blanca de polietileno de lata densidad, con un sistema de bomba 3K, cubierta de plástico y caja de cartón.
6.6 Precauciones especiales de eliminación
Ninguna especial
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Johnson & Johnson S.A.
Paseo de las Doce Estrellas, 5-7 28042 Madrid
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
08 / Septiembre /2011
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2014
7 de 7