Foster Nexthaler 100 Microgramos/6 Microgramos/Inhalacion Polvo Para Inhalacion
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Foster Nexthaler 100 microgramos/6 microgramos / inhalación polvo para inhalación.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis emitida de 10 mg de polvo para inhalación contiene:
100 microgramos de dipropionato de beclometasona anhidra y 6 microgramos de fumarato de formoterol dihidrato.
Esto equivale a una dosis liberada de 81,9 microgramos de dipropionato de beclometasona anhidra y 5,0 microgramos de fumarato de formoterol dihidrato.
Excipientes con efecto conocido:
Cada inhalación contiene 9,9 mg de lactosa monohidrato.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Polvo para inhalación.
El inhalador multidosis contiene un polvo blanco o casi blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Asma
Foster Nexthaler está indicado para el tratamiento habitual del asma cuando la administración de una combinación (un corticosteroide y un agonista p2 de acción prolongada por vía inhalatoria) sea apropiada:
- pacientes insuficientemente controlados con corticosteroides inhalados y agonistas p2 de acción corta administrados "a demanda"
- pacientes adecuadamente controlados con corticosteroides inhalados y agonistas p2 de acción prolongada
Foster Nexthaler está indicado en pacientes adultos.
Nota: No hay datos clínicos relevantes en el uso de Foster Nexthaler para el tratamiento de ataques agudos de asma.
EPOC
Tratamiento sintomático de pacientes con EPOC grave (FEV1 < 50% del valor teórico) y un historial de exacerbaciones repetidas, que presentan síntomas significativos a pesar del tratamiento habitual con broncodilatadores de acción prolongada.
4.2 Posología y forma de administración
4.2.1 Posología
Foster Nexthaler es para uso inhalatorio.
ASMA
La dosis de Foster Nexthaler debe ser individualizada y ajustarse a la gravedad de la enfermedad. Esto debe tenerse en cuenta no sólo cuando se inicie el tratamiento con una combinación de fármacos, sino también cuando se ajuste la dosis. Es decir, si un paciente precisa una combinación de dosis distintas a las contenidas en este inhalador combinado, deben prescribírsele dosis apropiadas de agonistas p2 y/o corticosteroides en inhaladores separados.
Debido a su distribución de tamaño de partículas extrafinas, se requiere ajuste de dosis cuando los pacientes cambian de una formulación de distribución de tamaño de partículas no-extrafinas a Foster Nexthaler polvo para inhalación. En pacientes a los que se les cambie de tratamientos previos, se debe tener en cuenta que la dosis total diaria recomendada de dipropionato de beclometasona para Foster Nexthaler es inferior al contenido actual de dipropionato de beclometasona de los productos no-extrafinos y se debe ajustar a las necesidades de cada paciente individualmente. Sin embargo, los pacientes que cambian de Foster solución para inhalación en envase a presión a Foster Nexthaler polvo para inhalación no necesitan ajuste de dosis.
Recomendaciones posológicas para adultos a partir de los 18 años:
1-2 inhalaciones, dos veces al día.
La dosis diaria máxima es de 4 inhalaciones al día.
Recomendaciones posológicas para niños y adolescentes de menos de 18 años:
La seguridad y eficacia de Foster Nexthaler en niños y adolescentes menores de 18 años no ha sido evaluada todavía. No hay datos disponibles en niños de hasta 11 años de edad. Los datos actualmente disponibles en adolescentes de entre 12 y 17 años de edad se resumen en las secciones 4.8 y 5.1 pero no se puede hacer una recomendación posológica.
El médico debe evaluar periódicamente a los pacientes para que la dosis administrada de Foster Nexthaler sea la óptima y sólo se modifique por prescripción médica. Deberá ajustarse la dosis a la mínima necesaria para mantener un control eficaz de los síntomas. Cuando el control de los síntomas se mantenga con la dosis mínima recomendada, el siguiente paso sería probar con un corticosteroide inhalado solo.
Debe advertirse a los pacientes que se administren Foster Nexthaler cada día, incluso en períodos asintomáticos.
EPOC
Recomendaciones posológicas para adultos a partir de los 18 años:
Dos inhalaciones dos veces al día.
Grupos especiales de pacientes
No es necesario ajustar la dosis en ancianos.
No se dispone de datos sobre el empleo de Foster Nexthaler en pacientes con insuficiencia renal o hepática (ver sección 5.2).
4.2.2 Forma de administración
Nexthaler es un inhalador respiratorio. Los pacientes con asma moderada y grave y pacientes con EPOC han demostrado producir un flujo inspiratorio suficiente para desencadenar la liberación de dosis del Nexthaler (ver sección 5.1). La liberación de Foster Nexthaler es flujo-independiente del rango de flujo de inspiración que esta población de pacientes pueda conseguir a través del inhalador.
El uso correcto del inhalador Nexthaler es necesario para que el tratamiento sea exitoso. Se debe aconsejar al paciente que lea el prospecto cuidadosamente y que siga las instrucciones de uso como se indican en el prospecto. Para la comodidad del prescriptor estas instrucciones se adjuntan en la sección 6.6.
Cuando sea posible los pacientes deben estar de pie o sentados en posición vertical mientras utilicen el inhalador.
Con Nexthaler, la dosis para inhalación está disponible solo cuando la tapa está totalmente abierta. Abrir la tapa, inhalar y cerrarla secuencialmente activa el mecanismo del contador de dosis. El paciente debe ser instruido para cerrar siempre totalmente la tapa. El número de dosis mostrado en la ventana del dispositivo no disminuye al cerrar la tapa si el paciente no ha inhalado a través del inhalador.
Se debe instruir al paciente que solo abra la tapa del inhalador cuando lo necesite. En el caso de que el paciente abriera el inhalador pero no inhalara, y cerrara la tapa, la dosis retrocedería al reservorio del polvo dentro del inhalador, y la siguiente dosis puede ser inhalada de una manera segura.
La liberación pulmonar óptima se obtiene si el paciente inhala respirando de una manera rápida y profunda a través del inhalador. Se aconseja una respiración contenida durante 5-10 segundos (o tan larga como el paciente pueda) antes de espirar.
Debe advertirse al paciente que evite espirar a través del Nexthaler, antes o después de la inhalación de la dosis, ya que esto afecta a su funcionamiento.
Los pacientes deben enjuagarse la boca o hacer gárgaras con agua o bien cepillarse los dientes después de realizar la inhalación (ver sección 4.4).
4.3 Contraindicaciones
Hipersensibilidad al dipropionato de beclometasona, al fumarato de formoterol dihidrato o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda reducir gradualmente la dosis cuando se interrumpa el tratamiento, no debiendo interrumpirse éste bruscamente.
El control del asma debe normalmente seguir un programa escalonado y la respuesta del paciente debe ser controlada clínicamente y mediante pruebas de la función pulmonar.
Los pacientes deben consultar con su médico si consideran que el tratamiento no es eficaz. El incremento del uso de broncodilatadores de rescate indica un empeoramiento de la enfermedad subyacente y obliga a reevaluar el tratamiento del asma. Un deterioro repentino y progresivo en el control del asma supone una amenaza potencial para la vida, por lo que el paciente debe buscar atención médica urgente. En estos casos debe considerarse la necesidad de aumentar el tratamiento con corticosteroides, ya sean inhalados o por vía oral, o de administrar un tratamiento antibiótico en caso de que se sospeche una infección.
Los pacientes no deben iniciar el tratamiento con FosterNexthaler durante una exacerbación o un empeoramiento significativo o agudo del asma. Durante el tratamiento con FosterNexthaler pueden producirse acontecimientos adversos graves relacionados con el asma y exacerbaciones. Los pacientes deben continuar con el tratamiento, si bien deben solicitar asistencia médica en caso de que los síntomas del asma sigan incontrolados o empeoren tras iniciar el tratamiento con Foster Nexthaler.
Tal como sucede con otros tratamientos por vía inhalatoria, se puede producir un broncoespasmo paradójico con aumento de las sibilancias y disnea inmediatamente después de la inhalación. Estos síntomas deben tratarse de inmediato con un broncodilatador inhalado de acción rápida. En tal caso, debe interrumpirse el tratamiento con Foster Nexthaler, examinar al paciente e instaurar, si es necesario, un tratamiento alternativo.
FosterNexthaler no debe utilizarse como tratamiento de primera elección para el asma.
Para el tratamiento de los ataques agudos de asma, debe aconsejarse a los pacientes que tengan siempre disponible su broncodilatador de acción corta.
Debe recordarse a los pacientes que utilicen FosterNexthaler a diario a las dosis prescritas, incluso en períodos asintomáticos.
Una vez los síntomas del asma estén controlados, debe considerarse la reducción gradual de la dosis de Foster Nexthaler. Es importante que los pacientes se sometan a revisiones periódicas conforme vayan reduciendo el tratamiento. Debe utilizarse la dosis mínima eficaz de FosterNexthaler (ver sección 4.2).
Cualquier corticosteroide inhalado puede producir efectos sistémicos, especialmente si se prescriben dosis elevadas durante largos períodos de tiempo. La probabilidad de que estos efectos aparezcan es mucho menor con los corticosteroides inhalados que con los corticosteroides orales. Los posibles efectos sistémicos incluyen síndrome de Cushing, rasgos cushingoides, supresión de la función suprarrenal, retraso del crecimiento en niños y adolescentes, disminución de la densidad mineral ósea, cataratas, glaucoma y más raramente, distintos efectos psicológicos o de comportamiento incluyendo hiperactividad psicomotora, desórdenes del sueño, ansiedad, depresión o agresión (especialmente en niños). Por lo tanto, es importante que se reduzca la dosis de corticosteroides inhalados a la dosis mínima que permita mantener un control eficaz del asma.
El tratamiento prolongado de pacientes con dosis elevadas de corticosteroides inhalados puede dar lugar a supresión de la función suprarrenal y crisis suprarrenales agudas. Los niños y adolescentes menores de 16 años que usen dosis de dipropionato de beclometasona superiores a las recomendadas pueden ser especialmente vulnerables. Los traumatismos, las intervenciones quirúrgicas, las infecciones o cualquier reducción brusca de la dosis constituyen situaciones que potencialmente podrían desencadenar una crisis suprarrenal aguda. Los síntomas que aparecen son normalmente imprecisos y pueden incluir anorexia, dolor abdominal, pérdida de peso, cansancio, dolor de cabeza, náuseas, vómitos, hipotensión, nivel bajo de consciencia, hipoglucemia y convulsiones. Durante períodos de estrés o cirugía programada debe considerarse la administración adicional de corticosteroides por vía sistémica.
Los pacientes que han recibido corticosteroides orales y pasan a la pauta por inhalación continúan en riesgo de sufrir insuficiencia suprarrenal durante un tiempo considerable. En una situación similar de riesgo se encuentran los pacientes que en el pasado hayan recibido dosis elevadas de corticosteroides como medicación de urgencia, o que hayan recibido tratamiento prolongado con dosis elevadas de corticosteroides inhalados. Esta posibilidad residual de insuficiencia deberá tenerse siempre en cuenta en situaciones de emergencia y programadas con probabilidad de producir estrés, por lo que se considerará la
instauración de un tratamiento con corticosteroides apropiado. El grado de insuficiencia suprarrenal puede requerir el consejo de un especialista antes de programar una intervención quirúrgica.
FosterNexthaler debe administrarse con precaución en pacientes con tuberculosis pulmonar activa o latente, infecciones fúngicas o infecciones víricas de las vías respiratorias.
FosterNexthaler debe utilizarse con precaución (lo que puede incluir un seguimiento estricto) en pacientes con arritmias cardíacas, especialmente con bloqueo auriculoventricular de tercer grado y taquiarritmias, estenosis aórtica subvalvular idiopática, miocardiopatía hipertrófica obstructiva, cardiopatía grave, insuficiencia cardíaca grave, hipertensión arterial grave y aneurisma.
También debe tenerse precaución al tratar a pacientes con prolongación del intervalo QTc conocida o sospechada, ya sea ésta congénita o inducida por fármacos (QTc > 0,44 segundos). El propio formoterol puede inducir la prolongación del intervalo QTc.
También se requiere precaución al utilizar FosterNexthaler en pacientes con tirotoxicosis, diabetes mellitus, feocromocitoma e hipopotasemia no tratada.
El tratamiento con agonistas p2 puede producir una hipopotasemia potencialmente grave. Se recomienda especial precaución en casos de asma grave, ya que este efecto puede potenciarse con la hipoxia.La hipopotasemia también puede verse potenciada por el tratamiento concomitante con otros medicamentos que pueden inducir hipopotasemia, como derivados de xantina, esteroides y diuréticos (ver sección 4.5). También se recomienda precaución en caso de asma inestable cuando se utilicen varios broncodilatadores como medicación de rescate. En estos casos se recomienda controlar los niveles séricos de potasio.
La inhalación de formoterol puede provocar un aumento de la glucemia. Por lo tanto, en pacientes con diabetes este parámetro debe controlarse de forma estricta.
Si se planea aplicar anestesia con agentes halogenados, es preciso garantizar que FosterNexthaler no se haya administrado durante por lo menos las 12 horas previas al inicio de la anestesia, ya que existe riesgo de arritmias cardíacas.
Debe indicarse a los pacientes que se enjuaguen la boca o hagan gárgaras con agua o bien que se cepillen los dientes después de cada inhalación a fin de minimizar el riesgo de infección orofaríngea por hongos y disfonía.
La lactosa puede contener proteínas de la leche, lo que puede provocar reacciones alérgicas.
4.5 Interacción con otros medicamentos y otras formas de interacción Interacciones farmacocinéticas
El dipropionato de beclometasona experimenta un metabolismo muy rápido, mediado por las enzimas esterasas, sin la implicación del sistema del citocromo P450.
Interacciones farmacodinámicas
Debe evitarse el uso de beta-bloqueantes (incluidos colirios) en pacientes asmáticos. Si por motivos imperativos es necesario administrar beta-bloqueantes, el efecto del formoterol se reducirá o se suprimirá.
El uso de otros fármacos P-adrenérgicos puede tener efectos potencialmente aditivos, por lo que se requiere precaución al prescribir teofilina u otros fármacos P-adrenérgicos de forma concomitante con el formoterol.
El tratamiento concomitante con quinidina, disopiramida, procainamida, fenotiazinas, algunos antihistamínicos (p.e. terfenadina), inhibidores de la monoaminooxidasa y antidepresivos tricíclicos pueden prolongar el intervalo QTc y aumentar el riesgo de arritmias ventriculares.
Asimismo, la L-dopa, la L-tiroxina, la oxitocina y el alcohol pueden reducir la tolerancia cardíaca a los fármacos p2-simpaticomiméticos.
La administración simultánea de inhibidores de la monoaminooxidasa, incluidos los agentes con propiedades similares como la furazolidona y la procarbazina, pueden provocar reacciones de hipertensión. Existe un riesgo elevado de arritmias en pacientes que sean anestesiados con hidrocarburos halogenados.
El tratamiento concomitante con derivados de xantina, esteroides o diuréticos puede potenciar un posible efecto hipopotasémico de los agonistas p2 (ver sección 4.4.). La hipopotasemia puede aumentar el riesgo de arritmias en pacientes tratados con glucósidos digitálicos.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
No se dispone de datos clínicos relevantes sobre el uso de Foster en mujeres embarazadas. Los estudios realizados con animales, en los que se administró una combinación de dipropionato de beclometasona y formoterol, mostraron indicios de toxicidad en la reproducción y en los fetos después de una elevada exposición sistémica (ver sección 5.3). Altas dosis de corticosteroides administrados a animales embarazados han mostrado que causan anormalidades al desarrollo fetal incluyendo paladar hendido y retraso en el crecimiento intra-uterino. Debido a las acciones tocolíticas de los agentes p2-simpaticomiméticos, se requiere un especial cuidado en la fase previa al parto.
No se recomienda la administración de formoterol durante el embarazo y particularmente al finaldel embarazo o durante el parto, salvo que no exista otra alternativa establecida (más segura).
La administración de FosterNexthaler durante el embarazo sólo debería tenerse en cuenta cuando los beneficios previstos superen los riesgos potenciales.
4.6.2 Lactancia
No se dispone de datos clínicos relevantes sobre el uso de FosterNexthaler durante la lactancia en humanos. Aunque no se dispone de estudios en animales, parece razonable asumir que el dipropionato de beclometasona se excreta en la leche, como sucede con otros corticosteroides.
Se desconoce si el formoterol pasa a la leche materna en humanos, aunque se ha detectado en la leche de animales en período de lactancia.
La administración de FosterNexthaler en mujeres en período de lactancia sólo debe considerarse cuando los beneficios previstos superen los riesgos potenciales. Se debe decidir entre discontinuar la lactancia o discontinuar/abstenerse de la terapia con Foster Nexthaler, teniendo en cuenta el beneficio de la lactancia materna para el niño y el beneficio de la terapia para la mujer.
4.6.3 Fertilidad
No hay datos en humanos. En estudios animales en ratas, la presencia de dipropionato de beclometasona a altas dosis en la combinaciónfue asociada con reducción en la fertilidadfemenina y embriotoxicidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de FosterNexthaler sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
La reacción adversa más frecuente es el temblor. En un ensayo clínico de 12 semanas con Foster Nexthaler, el temblor se observó solo cuando se utilizaba el régimen posológico más alto (2 inhalaciones dos veces al día), apareciendo más frecuentemente al inicio del tratamiento y de intensidad media. Ningún paciente fue retirado del ensayo como resultado de los temblores.
Experiencia en Ensayos Clínicos en pacientes con asma
La seguridad de Foster Nexthaler fue evaluada en ensayos clínicos con tratamiento activo y controlados con placebo en los que se expuso al fármaco a 719 pacientes mayores de 12 años con asma de diferente gravedad. La incidencia de reacciones adversas de la tabla inferior se refiere a pacientes mayores de 12 años y se basa en los hallazgos de seguridad de dos ensayos clínicos pivotales en los que Foster Nexthaler fue administrado a las dosis recomendadas en esta ficha técnica durante un periodo de 8-12 semanas. No se observaron desórdenes psiquiátricos en los ensayos clínicos con Foster Nexthaler pero se incluyen en la tabla como un efecto potencial del grupo de los corticosteroides inhalados.
Las reacciones adversas que se han asociado con la combinación en dosis fijas de dipropionato de beclometasona y formoterol (Foster Nexthaler) se indican a continuación, según la clasificación por órganos y sistemas de MedDRA. Las diferentes frecuencias se definen como: muy frecuentes (1/10), frecuentes 1/100 y < 1/10), poco frecuentes ( ^ 1/1.000 y < 1/100), raras 1/10.000 y < 1/1.000), muy raras (< 1/10.000) y desconocidas (no puede estimarse con los datos disponibles).
|
Clasificación por órganos y sistemas |
Reacción adversa |
Frecuencias |
|
Infecciones e infestaciones |
Nasofaringitis |
Poco frecuentes |
|
Candidiasis oral |
Poco frecuentes | |
|
Trastornos del metabolismo y de la nutrición |
Hipertrigliceridemia |
Poco frecuentes |
|
Trastornos psiquiátricos |
Hiperactividad psicomotora, alteraciones del sueño, ansiedad, depresión, agresión, cambios del comportamiento (predominantemente en niños) |
Frecuencia desconocida |
|
Trastornos del sistema nervioso |
Temblores |
Frecuentes |
|
Cefalea |
Poco frecuentes | |
|
Trastornos cardíacos |
Taquicardia |
Poco frecuentes |
|
Bradicardia sinusal |
Poco frecuentes | |
|
Angina de pecho |
Poco frecuentes |
|
Isquemia miocárdica |
Poco frecuentes | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Irritación de garganta, exacerbación del asma |
Poco frecuentes |
|
Disnea |
Poco frecuentes | |
|
Dolor orofaríngeo |
Poco frecuentes | |
|
Disfonía |
Poco frecuentes | |
|
Tos |
Poco frecuentes | |
|
Trastornos gastrointestinales |
Náuseas |
Poco frecuentes |
|
Trastornos generales y alteraciones en el lugar de administración |
Fatiga |
Poco frecuentes |
|
Irritabilidad |
Poco frecuentes | |
|
Exploraciones complementarias |
Prolongación del intervalo QT en el electrocardiograma |
Poco frecuentes |
|
Disminución del cortisol libre en orina |
Poco frecuentes | |
|
Disminución del cortisol en sangre |
Poco frecuentes | |
|
Aumento delpotasio en sangre |
Poco frecuentes | |
|
Aumento glucosa en sangre |
Poco frecuentes | |
|
Electrocardiograma con pobre progresión de la onda R |
Poco frecuentes |
De entre las reacciones adversas observadas, las típicamente asociadas a formoterol son: temblores, cefalea, taquicardia, bradicardia sinusal, angina de pecho, isquemia miocárdica, prolongación del intervalo QT.
De entre las reacciones adversas observadas, las típicamente asociadas a dipropionato de beclometasona son: nasofaringitis, candidiasis oral, disfonía, irritación de garganta, irritabilidad, disminución del cortisol libre en orina, disminución del cortisol en sangre, aumento glucosa en sangre.
Otras reacciones adversas no observadas en la experiencia clínica con Foster Nexthaler pero que están típicamente asociadas con la administración inhalada de dipropionato de beclometasona son otras infecciones orales fúngicas y neumonía. Durante el tratamiento con corticosteroides inhalados ocasionalmente se han notificado casos de alteraciones en el sabor.
Ver sección 4.4 donde aparecen medidas para minimizar la aparición de infecciones orales fúngicas, candidiasis oral y disfonía.
Los corticosteroides inhalados (p. ej., dipropionato de beclometasona) pueden producir efectos sistémicos, sobre todo si se administran a dosis elevadas durante períodos de tiempo prolongados. Dichos efectos pueden incluir síndrome de Cushing, características Cushingoides, supresión de la función suprarrenal,
disminución de la densidad mineral ósea, retraso del crecimiento en niños y adolescentes, cataratas y glaucoma (ver también 4.4).
Otras reacciones adversas no observadas en la experiencia clínica con dosis terapéuticas de Foster Nexthaler pero que están típicamente asociadas con la administración de agonistas P2 como el formoterol son: palpitaciones, fibrilación auricular, extrasístole ventricular, taquiarritmia, potencialmente hipopotasemia grave y aumento/descenso de la presión arterial. Durante el uso de terapia con formoterol inhalado ocasionalmente se han notificado casos de insomnio, mareos, agitación y ansiedad. El formoterol también puede inducir rampas musculares, mialgia.
También pueden producirse reacciones de hipersensibilidad como exantema, urticaria, prurito, eritema y edema ocular, facial, labial y faríngeo (angioedema).
Al igual que sucede con otros tratamientos administrados por vía inhalatoria, puede aparecer broncoespasmo paradójico produciéndose un aumento inmediato de sibilancias, tos y dificultad para respirar después de la administración (ver sección 4.4).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano http s: //www .notificaram .es.
4.8.1 Población pediátrica
No hay información de seguridad de Foster Nexthaler en niños de hasta 11 años, y solo hay información limitada en adolescentes de 12 a 17 años. En un ensayo clínico randomizado de 12 semanas en adultos y adolescentes, 162 adolescentes de 12 a 17 años con asma de moderada a grave recibieron Foster Nexthaler o la formulación correspondiente de solución para inhalación en envase a presión, 1 ó 2 pulsaciones dos veces al día; la frecuencia, tipo y gravedad de las reacciones adversas no fueron diferentes al comparar adolescentes con adultos.
4.9 Sobredosis
La dosis más alta recomendada de Foster Nexthaler en una única toma es 2 pulsaciones. Se han estudiado dosis inhaladas de FosterNexthaler de hasta cuatro pulsaciones acumuladas (total dipropionato de beclometasona 400 microgramos, formoterol 24 microgramosadministrados en una toma única) en pacientes asmáticos. Los tratamientos acumulados no causaron un efecto anormal en las constantes vitales, y tampoco se observaron acontecimientos adversos serios ni graves (ver también sección 4.8).
Para la presentación de solución para inhalación en envase a presión, se han estudiado dosis inhaladas de FosterNexthaler de hasta doce pulsaciones acumuladas (total dipropionato de beclometasona 1.200 microgramos, formoterol 72 microgramos) en pacientes asmáticos. Los tratamientos acumulados no causaron un efecto anormal en las constantes vitales, y tampoco se observaron acontecimientos adversos serios ni graves.
Las dosis excesivas de formoterol pueden dar lugar a efectos típicos de los agonistas p2-adrenérgicos: náuseas, vómitos, dolor de cabeza, temblores, somnolencia, palpitaciones, taquicardia, arritmias ventriculares, prolongación del intervalo QTc, acidosis metabólica, hipopotasemia, hiperglucemia.
En caso de sobredosis de formoterol, se recomienda un tratamiento de soporte y sintomático. Los casos graves deben ser hospitalizados. Puede considerarse el uso de bloqueantes P-adrenérgicos cardioselectivos, pero únicamente bajo extrema vigilancia ya que el uso de estos fármacos puede provocar broncoespasmo.Deben controlarse los niveles de potasio en suero.
La inhalación aguda de dipropionato de beclometasona en dosis superiores a las recomendadas puede dar lugar a una supresión temporal de la función suprarrenal. Esto no requiere ninguna acción de emergencia, ya que la función suprarrenal se recupera en unos días, según se verifica en las mediciones de cortisol plasmático. En estos pacientes, debe continuarse el tratamiento a una dosis suficiente para controlar el asma.
La sobredosis crónica de dipropionato de beclometasona por vía inhalatoria conlleva riesgo de supresión de la función suprarrenal (ver sección 4.4.). Puede ser necesario realizar un seguimiento de la reserva suprarrenal. Debe continuarse el tratamiento a una dosis suficiente para controlar el asma.
Dosis únicas supra-terapéuticas de hasta 800 microgramos de dipropionato de beclometasona, 48 microgramos de formoterol, administrados vía Foster Nexthaler son generalmente seguras y bien toleradas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Adrenérgicos, inhalados: formoterol y otros fármacos para enfermedades obstructivas de las vías respiratorias.
Código ATC: R03 AK08.
Mecanismo de acción y efectos farmacodinámicos
Foster Nexthaler contiene dipropionato de beclometasona y formoterol formulados en polvo seco resultando un aerosol extrafino con una masa media de diámetro aerodinámico (MMAD) de 1,4-1,5 micrómetros y co-deposición de ambos componentes. Las partículas de aerosol de Foster Nexthaler son de media mucho más pequeñas que las partículas liberadas en las formulaciones no-extrafinas.
Un estudio de deposición de fármaco radiomarcado en pacientes asmáticos adultos demostró que una alta proporción de fármaco (42% estimado de la dosis nominal) se deposita en pulmón, con una deposición homogénea a través de las vías respiratorias. Estas características de liberación confirman el uso de bajas dosis de corticosteroides con efectos farmacodinámicos locales destacados, los cuales demostraron ser equivalentes con la correspondiente solución para inhalación en envase a presión (ver Experiencia clínica).
Los dos principios activos de Foster Nexthaler presentan mecanismos de acción diferentes. Al igual que con otras combinaciones de corticosteroides y agonistas p2, se observan efectos aditivos en cuanto a la reducción de las exacerbaciones asmáticas.
Dipropionato de beclometasona
El dipropionato de beclometasona administrado por vía inhalatoria a las dosis recomendadas tiene una acción antiinflamatoria glucocorticoidea en los pulmones que se traduce en una reducción de los síntomas y de las exacerbaciones del asma, con menos efectos adversos que cuando se administran corticosteroides por vía sistémica.
Formoterol
El formoterol es un agonista selectivo p2-adrenérgico que relaja el músculo liso bronquial en pacientes con obstrucción reversible de las vías respiratorias. El efecto broncodilatador se inicia rápidamente (1-3 minutos tras la inhalación) y se mantiene hasta 12 horas después de la administración de la dosis.
Experiencia clínica
La eficacia de los dos componentes de Foster Nexthaler polvo para inhalación ha sido evaluada en tres estudios diferentes comparando con la formulación de 100 microgramos/6 microgramos solución para inhalación en envase a presión en pacientes con asma persistente de moderada a grave. Ante todo, se espera que la eficacia de ambos inhaladores sea equivalente en la práctica clínica a 1 y 2 inhalaciones dos veces al día.
En un estudio, el objetivo principal era la evaluación de la eficacia del corticoide inhalado medido en broncodilatación (FEVi pre-dosis). Se observó una mejora clínicamente significativa en FEVi pre-dosis en 696 pacientes con asma sintomática de moderada a grave al final del periodo de tratamiento de 3 meses en comparación con los valores basales, con 1 inhalación y 2 inhalaciones dos veces al día con ambas formulaciones. Se observó un incremento medio de al menos 250 ml. No hubo diferencia clínicamente relevante en FEV1 pre-dosis entre Foster Nexthaler polvo para inhalación y la solución para inhalación en envase a presión a la misma dosis. Se observó una dosis-respuesta significativa para el PEF matinal. No se consiguió significancia estadística para la dosis-respuesta en FEV1 predosis. Las medidas de control de asma como resultados de los síntomas asmáticos por la mañana y por la tarde y porcentaje de días sin síntomas mejoraron significativamente desde el inicio hasta el final del periodo de tratamiento, particularmente para las dos dosis altas de ambas formulaciones.
En el segundo estudio, el objetivo principal era la evaluación de la eficacia del componente P2-agonista de acción prolongada de Foster Nexthaler. En este estudio se midieron una serie de evaluaciones espirométricas de FEV1 (FEV1 AUC durante al menos el 80% de la duración de acción del formoterol) para evaluar la broncodilatación al inicio y a las 12 horas tras la administración de una dosis única. Comparado con placebo, Foster Nexthaler, una inhalación y cuatro inhalaciones de ambas sustancias activas mejoraron significativamente el FEV1 AUC0-12. Ambas dosis de Foster Nexthaler polvo para inhalación fueron no-inferiores a la dosis correspondiente en solución para inhalación en envase a presión. Se demostró una dosis-respuesta estadísticamente significativa con ambas formulaciones entre la dosis baja y la alta.
En el tercer estudio, tras un periodo de ensayo de 4 semanas con dipropionato de beclometasona/formoterol combinación fija en solución para inhalación en envase a presión, 1 inhalación dos veces al día, 755 pacientes asmáticos controlados fueron randomizados a un tratamiento de 8 semanas con el mismo inhalador, con Foster Nexthaler polvo para inhalación o con dipropionato de beclometasona 100 microgramos polvo para inhalación, todos tomando 1 inhalación dos veces al día. El objetivo principal era el cambio en la media del flujo espiratorio matinal (PEF) del tratamiento basal al final del periodo completo de tratamiento. Tras 8 semanas de tratamiento no se observaron diferencias en la evaluación principal entre las dos combinaciones inhaladas, ambas eran significativamente mejores que la monoterapia con dipropionato de beclometasona en monoterapia. No se observaron diferencias entre las dos combinaciones inhaladas en medidas de síntomas como con la prueba del cuestionario de control de asma y el número de días libres de rescate.
Se llevó a cabo un estudio abierto con placebo para verificar que el flujo inspiratorio generado a través del inhalador Nexthaler no es influenciado por la edad del paciente, enfermedad y gravedad de la misma, y además que la activación de la liberación del fármaco del dispositivo puede conseguirse por todos los pacientes. La primera evaluación era el porcentaje de pacientes en cada grupo de edad y enfermedad capaz
de activar el inhalador. Ochenta y nueve pacientes, de entre 5-84 años, incluyendo asmáticos de moderados a graves (FEV1 > 60% y < 60% pronosticado, respectivamente), y pacientes con EPOC de moderada a grave (FEV1 > 50% y < 50% pronosticado, respectivamente) participaron en el estudio. Todos los pacientes, independientemente de la edad, enfermedad o gravedad de la enfermedad, fueron capaces de generar un flujo inspiratorio suficiente para activar el inhalador Nexthaler.
En un estudio adicional abierto con placebo se demostró evaluando el perfil de inspiración a través de Foster Nexthaler que pacientes con EPOC de leve a grave, sin tener en cuenta su limitación funcional, fueron capaces de activar correctamente y usar el dispositivo.
5.1.4 Población pediátrica
La Agencia Europea del Medicamento ha prorrogado la obligación de presentar los resultados de los estudios en asma con Foster Nexthaler en los subconjuntos de población pediátrica de 5-11 y 12-17 años.
En el momento de preparación de esta ficha técnica, no hay experiencia clínica de Foster Nexthaler en niños de 5-11 años, y tan solo hay información limitada en adolescentes de 12-17 años.
En un estudio clínico randomizado de 3 meses, 162 adolescentes de 12-17 años con un diagnóstico de asma de moderada a grave recibieron tanto Foster Nexthaler como la correspondiente solución para inhalación en envase a presión, 1 ó 2 inhalaciones dos veces al día. El cambio en FEVi pre-dosis al final del tratamiento fue superior en los adolescentes que en los adultos.
Ver también secciones 4.2 y 4.8 para información en uso pediátrico.
5.2 Propiedades farmacocinéticas Dipropionato de beclometasona
El dipropionato de beclometasona es un profármaco con una débil afinidad de unión por receptores de glucocorticoides, siendo hidrolizado por enzimas esterasas en el metabolito activo beclometasona-17-monopropionato. Dicho metabolito presenta una acción antiinflamatoria tópica más potente que el profármaco dipropionato de beclometasona.
Absorción, distribución y metabolismo
El dipropionato de beclometasona inhalado es absorbido rápidamente por los pulmones; si bien, antes de la absorción, se produce una amplia conversión al metabolito activo beclometasona-17-monopropionato por acción de las enzimas esterasas que se encuentran en la mayoría de los tejidos. La disponibilidad sistémica del metabolito activo se deriva de la absorción pulmonar y gastrointestinal de la dosis tragada. La biodisponibilidad del dipropionato de beclometasona tragado es insignificante, sin embargo la conversión pre-sistémica a beclometasona-17-monopropionato comporta que parte de la dosis se absorba como metabolito activo.
Se produce un aumento aproximadamente lineal en la exposición sistémica con el aumento de la dosis inhalada.
La biodisponibilidad absoluta tras la inhalación desde un inhalador presurizado de dosis medida es de aproximadamente 2% y 62% de la dosis nominal para dipropionato de beclometasona inalterado y beclometasona-17 -monopropionato, respectivamente.
Después de una dosis intravenosa, la disposición del dipropionato de beclometasona y de su metabolito activo se caracteriza por un aclaramiento plasmático elevado (150 y 120 l/h, respectivamente), con un volumen de distribución reducido en estado de equilibrio para el dipropionato de beclometasona (20 l) y
una distribución tisular mayor para su metabolito activo (424 l). La disposición metabólica del dipropionato de beclometasona principalmente (82%) se debe a su metabolito activo beclometasona-17-monopropionato. La unión a proteínas plasmáticas es moderadamente elevada (87%).
Excreción
La excreción fecal es la vía preferente de eliminación del dipropionato de beclometasona, principalmente en forma de metabolitos polares. La excreción renal del dipropionato de beclometasona y de sus metabolitos es insignificante. Las semividas de eliminación final son 0,5 h y 2,7 h para dipropionato de beclometasona y beclometasona-17-monopropionato, respectivamente.
Poblaciones especiales
La farmacocinética del dipropionato de beclometasona en pacientes con insuficiencia renal o hepática no ha sido estudiada; sin embargo, dado que el dipropionato de beclometasona experimenta un metabolismo muy rápido, mediado por las enzimas esterasas presentes en el líquido intestinal, el suero, los pulmones y el hígado, para originar los productos más polares beclometasona-21-monopropionato, beclometasona-17-monopropionato y beclometasona, no se prevé que la insuficiencia hepática modifique la farmacocinética ni el perfil de seguridad del dipropionato de beclometasona.
Como no se encontró el dipropionato de beclometasona ni sus metabolitos en la orina, no se prevé ningún aumento de la exposición sistémica en pacientes con insuficiencia renal.
Formoterol
Absorción y distribución
Tras la inhalación, el formoterol se absorbe a través de los pulmones y del tubo digestivo. La fracción de una dosis inhalada que se traga tras la administración con un inhalador dosificador puede oscilar entre el 60% y el 90%. Como mínimo el 65% de la fracción tragada se absorbe a través del tubo digestivo. Las concentraciones plasmáticas máximas del fármaco inalterado se alcanzan entre media hora y una hora después de la administración oral. La unión a proteínas plasmáticas de formoterol es de 61% a 64%, con un 34% unido a albúmina. No se produjo saturación de la unión en el intervalo de concentraciones alcanzado con las dosis terapéuticas. La semivida de eliminación establecida después de la administración oral es de 2-3 horas. La absorción de formoterol es lineal tras la inhalación de 12 a 96 pg de fumarato de formoterol.
Metabolismo
El formoterol se metaboliza de forma extensa, siendo la vía más importante la conjugación directa en el grupo hidróxilo fenólico. El ácido glucurónido conjugado es inactivo. La segunda vía principal es la O-desmetilación seguida de conjugación en el grupo 2’-hidróxilo fenólico. Las isoenzimas CYP2D6, CYP2C19 y CYP2C9 del citocromo P450 intervienen en la O-desmetilación del formoterol. El hígado parece ser el lugar principal de metabolismo. El formoterol no inhibe las enzimas CYP450 a concentraciones terapéuticamente habituales.
Excreción
La excreción urinaria acumulada de formoterol tras una sola inhalación de polvo seco aumentó linealmente en el margen de dosis de 12-96 pg. De promedio, un 8% y un 25% de la dosis se excretó en forma de formoterol inalterado y total, respectivamente. Basándose en las concentraciones plasmáticas medidas tras la inhalación de una sola dosis de 120 pg por parte de 12 voluntarios sanos, la semivida de eliminación final media se estableció en 10 horas. Los enantiómeros (R,R) y (S,S) representaron aproximadamente un 40% y un 60% del fármaco inalterado excretado en la orina, respectivamente. La proporción relativa de los dos enantiómeros se mantuvo constante en todo el margen de dosis estudiado, y no hubo indicios de acumulación relativa de un enantiómero por encima del otro tras dosis repetidas.
Tras la administración oral (40-80 gg), se recuperó entre un 6% y un 10% de la dosis en la orina en forma de fármaco inalterado en voluntarios sanos y hasta un 8% de la dosis en forma de glucurónido.
Un total de 67% de una dosis oral de formoterol se excreta en la orina (principalmente en forma de metabolitos) y el resto en las heces. El aclaramiento renal de formoterol es de 150 ml/min.
Poblaciones especiales
Insuficiencia hepática/renal: no se ha estudiado la farmacocinética de formoterol en pacientes con insuficiencia hepática o renal.
Experiencia clínica
Se ha comparado la exposición sistémica de dipropionato de beclometasona y formoterol en combinación con la exposición a los componentes por separado. No se evidenciaron interacciones farmacocinéticas o farmacodinámicas (sistémicas) entre el dipropionato de beclometasona y el formoterol.
La farmacocinética de Foster Nexthaler polvo para inhalación se ha comparado con la correspondiente formulación en solución para inhalación en envase a presión. Se focalizó en el análisis del componente esteroideo, la beclometasona-17-monopropionato, principal metabolito activo del dipropionato de beclometasona.
La absorción sistémica y el metabolismo del dipropionato de beclometasona fue rápido y la Cmax se alcanzó a los 5 minutos tras la dosis para ambos tratamientos pero fue mayor (+68%) con Foster Nexthaler comparado con la solución para inhalación en envase a presión. La Cmax para la beclometasona-17-monopropionato, principal metabolito activo, representando alrededor del 82% del total a nivel sanguineo, se alcanzó de media tras 30 minutos y 15 minutos con Nexthaler y con la solución para inhalación en envase a presión, respectivamente. La concentración plasmática de beclometasona-17-monopropionato fue inferior (Cmax -49% y AUC -29%), tras la inhalación del polvo para inhalación que vía solución para inhalación en envase a presión. Tras la inhalación de Foster Nexthaler, el pico de concentración (Cmax) de formoterol se alcanzó a los 5 minutos y fue mayor (+47%) que en el polvo para inhalación, mientras que la exposición total (AUC) fue comparable en ambos tratamientos.
En un estudio, se investigó la deposición pulmonar relativa usando carbón activo para excluir la absorción del fármaco por el tracto gastrointestinal, y adoptando un espaciador aprobado, AeroChamber Plus® para el producto de referencia (la solución para inhalación en envase a presión). En este contexto, Nexthaler y la solución para inhalación en envase a presión se mostraron equivalentes en el AUCt tanto para la beclometasona-17-monopropionato como para formoterol (el ratio polvo para inhalación/solución para inhalación en envase a presión y los intervalos de confianza estaban entre 80-125%); sin embargo, la Cmax de beclometasona-17-monopropionato fue inferior (-38%) tras la inhalación a través del Nexthaler.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no-clínicos de los componentes por separado de Foster Nexthaler no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad y toxicidad a dosis repetidas. El perfil de seguridad de la combinación en relación a los componentes por separado no muestra incremento en la toxicidad ni hallazgos inesperados.
Los estudios de reproducción en ratas mostraron efectos dependientes de la dosis. La presencia de dipropionato de beclometasona a altas dosis se asoció con una fertilidad reducida en hembras, reducción del número de implantes embrionarios y toxicidad embriofetal. Se sabe que la administración de dosis elevadas de corticosteroides a hembras preñadas provoca anomalías en el desarrollo fetal, como paladar hendido y retraso del crecimiento intrauterino, y es probable que los efectos observados con la combinación
14 de 19 MINISTKODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agenca esparto» de medie ámenlos y efoouctos saltaros
de dipropionato de beclometasona/formoterol se deban al dipropionato de beclometasona. Estos efectos sólo se detectaron tras una elevada exposición sistémica al metabolito activo beclometasona-17-monopropionato (más de 200 veces los niveles plasmáticos previstos en pacientes). Asimismo, en los estudios en animales se observó una mayor duración de la gestación y del parto, un hecho atribuible a los conocidos efectos tocolíticos de los agentes p2-simpaticomiméticos. Estos efectos se detectaron cuando los niveles plasmáticos de formoterol en la madre estaban por debajo de los niveles previstos en pacientes tratados con Foster Nexthaler.
Los estudios de genotoxicidad realizados con una combinación de dipropionato de beclometasona/formoterol no indican potencial mutagénico. No se han realizado estudios de carcinogenicidad con la combinación propuesta. Sin embargo, los datos obtenidos con animales para cada uno de los componentes no sugieren ningún riesgo potencial de carcinogenicidad para los humanos..
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Lactosa monohidrato (que contiene pequeñas cantidades de proteínas de la leche)
Estearato de magnesio.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
Tras la primera apertura de la bolsa protectora, el medicamento debe usarse en 6 meses.
6.4 Precauciones especiales de conservación
Conservar en el envase original para proteger de la humedad.
Solo saque el inhalador de su envase de aluminio inmediatamente antes del primer uso.
Antes de la primera apertura de la bolsa protectora:
Este medicamento no requiere ninguna condición especial de temperatura para su conservación.
Tras la primera apertura de la bolsa protectora: No conservar a una temperatura superior a 25°C.
6.5 Naturaleza y contenido del envase
Cada caja contiene 1, 2 ó 3 inhaladoresNexthaler que contienen 1,5 g de polvo para inhalación y proporciona 120 inhalaciones cada uno. Cada inhalador se encuentra en una bolsa protectora termosellada (envase de aluminio) de PET/al/PE (Polietileno Tereftalato/Aluminio/Polietileno)o PA/Al/PE (Poliamida/Aluminio/Polietileno).
Puede que solamente estén comercializados algunos tamaños de envases.
Foster Nexthaler es un dispositivo de inhalación multidosis. El dispositivo consiste en un aparato compuesto por un inhalador con una ventana inferior que muestra el número de dosis restantes y una tapa protectora. Cuando se abre la tapa, la cual activa el mecanismo del contador de dosis, aparece una boquilla
]£

a través de la cual se inhala el fármaco. El inhalador y la boquilla están hechos de acrilonitrilo butadieno estireno y la tapa está hecha de polipropileno.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
A continuación, se adjuntan las instrucciones de uso del inhalador Nexthaler para beneficio de los profesionales sanitarios.
INSTRUCCIONES PARA EL USO DEL INHALADOR NEXTHALER
A. Contenido del estuche
Este envase contiene:
• 1 prospecto de instrucciones
• 1 inhalador Nexthaler dentro de una bolsa protectora termosellada.
Si los contenidos del envase no son los listados aquí, devuelva el inhalador a la persona que se lo ha suministrado y obtenga uno nuevo.
B. Advertencias generales & Precauciones
• No saque el inhalador de la bolsa protectora si no va a utilizarlo inmediatamente.
• Utilice solo su inhalador como le han indicado.
• Si no está seguro de que el contador de dosis ha descontado una tras su inhalación, espere hasta la próxima dosis programada y tómela normalmente. No tome una dosis extra.
• Mantenga la tapa del inhalador cerrada hasta que necesite tomar una dosis.
• Cuando no utilice el inhalador manténgalo en un lugar limpio y seco.
• Bajo ningún motivo intente desmontar su inhalador Nexthaler.
• No use su inhalador Nexthaler:
o Tras la fecha de caducidad
o Si hace más de 6 meses que abrió la bolsa protectora o Si está roto
o Si la ventana del contador de dosis muestra “0” o Si no puede leer la ventana del contador de dosis.
En estos casos, deshágase de su inhalador, o devuélvalo a la persona que lo suministró y obtenga uno nuevo. Pregunte a su farmacéutico cómo deshacerse de los inhaladores que ya no necesite.
C. Características principales del inhalador Nexthaler
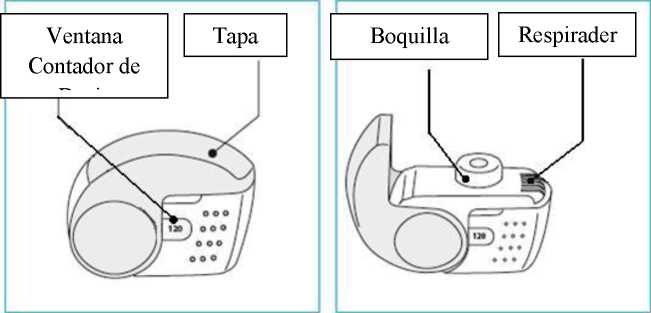
Tomar una dosis del inhalador Nexthaler requiere seguir tres pasos sencillos: Abrir, Inhalar, Cerrar
D. Antes de usar un nuevo inhalador Nexthaler
1. Abra la bolsa protectora y saque su inhalador.
o No use su inhalador si la bolsa protectora no está sellada o está dañada - devuélvalo a la persona que se lo suministró y obtenga uno nuevo.
2. Revise su inhalador.
o Si su inhalador parece roto o estropeado, devuélvalo a la persona que se lo suministró y obtenga uno nuevo.
3. Compruebe la Ventana Contador de Dosis. Si su inhalador es nuevo verá “120” en la Ventana Contador de Dosis.
o No use un inhalador nuevo si el número mostrado es inferior a “120” - devuélvalo a la
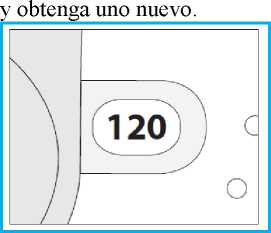
E. Como usar su inhalador Nexthaler E.1. Revisión visual
1. Compruebe el número de dosis restantes: cualquier número entre “1” y “120” muestra que quedan dosis.
o Si la Ventana Contador de Dosis muestra “0” no quedan dosis disponibles -deseche el inhalador y adquiera uno nuevo.
2. Asegúrese que la tapa protectora está totalmente cerrada antes de utilizarlo.
E.2. Apertura
1. Mantenga el inhalador firmemente en posición vertical.
2. Abra completamente la tapa protectora.
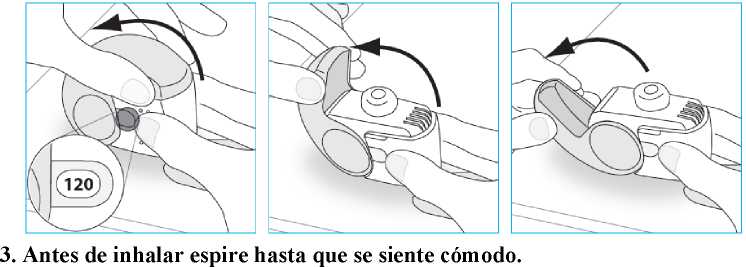
o No espire a través del inhalador.
E.3. Inhalación
Cuando sea posible, al inhalar colóquese de pie o sentado en posición vertical.
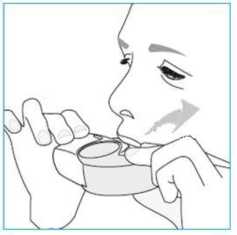
1. Acerque el inhalador a su boca y ponga sus labios alrededor de la boquilla.
o No tape el respiradero cuando aguante el inhalador. o No inhale a través del respiradero.
2. Respire súbita y profundamente por la boca.
o Puede notar sabor mientras está tomando la dosis. o Puede oir o sentir un click cuando esté tomando la dosis. o No inhale por la nariz.
o No retire el inhalador de sus labios durante la inhalación.
3. Retire el inhalador de su boca.
4. Contenga la respiración durante 5 a 10 segundos o tanto como le sea posible.
5. Espire lentamente.
• No espire a través del inhalador.
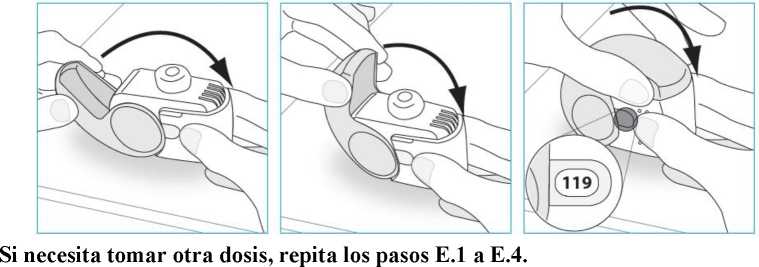
E.4. Cierre
1. Vuelva a colocar el inhalador en posición vertical y cierre la tapa protectora completamente.
2. Compruebe que el contador de dosis haya descontado una unidad.
F. Limpieza
• Normalmente, no es necesario limpiar su inhalador.
• Si fuera necesario, puede limpiar el inhalador tras su uso con un paño de ropa o de papel secos.
o No limpie su inhalador con agua u otros líquidos. Manténgalo seco.
G. Conservación
• Cuando no esté usando su inhalador manténgalo en un lugar limpio y seco. Puede guardarlo en la bolsa protectora tras el uso.
o No exponga su inhalador al calor o a la luz directa del sol.
o No exponga su inhalador a ambientes húmedos o mojados.
• Mantenga fuera de la vista y del alcance de los niños.
• Si su inhalador tiene más de 6 meses desde que abrió la bolsa protectora, deséchelo y adquiera uno nuevo.
H. Eliminación
• Deseche su inhalador Nexthaler si el número que muestra la ventana contador de dosis es
• Pregunte a su farmacéutico qué hacer con los medicamentos terminados o que ya no necesita.
o No deseche los medicamentos con sus residuos domésticos.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Chiesi España S.A.
Pla?a d’Europa, 41-43, Planta 10
08908 L'Hospitalet de Llobregat - Barcelona (España))
¡m
MINISTER10DE )E SANIDAD, POLITICA LITIGA SOCIAL E IGUALDAD IALDAD Agencia esparto» de cSacse-medicamentos y ¡y proouctcs san-íanos taws
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
76.713
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 22/Junio/2012
10. FECHA DE LA REVISIÓN DEL TEXTO
Octubre 2015
19 de 19