Forsteo 20 Microgramos/80 Microlitros, Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
FORSTEO 20 microgramos/80 microlitros solución inyectable en pluma precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada dosis de 80 microlitros contiene 20 microgramos de teriparatida*.
Una pluma precargada con 2,4 ml contiene 600 microgramos de teriparatida (correspondientes a 250 microgramos por ml).
*Teriparatida, rhPTH(1-34) producida en E. coli, mediante tecnología del ADN recombinante, es idéntica a la secuencia N-terminal de 34 aminoácidos de la hormona paratiroidea humana endógena.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable.
Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
FORSTEO está indicado en adultos.
Tratamiento de la osteoporosis en mujeres posmenopáusicas y en varones con un aumento del riesgo de fractura (ver sección 5.1). En mujeres posmenopáusicas, se ha demostrado una disminución significativa en la incidencia de fracturas vertebrales y no vertebrales pero no en fracturas de cadera.
Tratamiento de la osteoporosis asociada a terapia sistémica mantenida con glucocorticoides en mujeres y hombres con un incremento del riesgo de fractura (ver sección 5.1).
4.2 Posología y forma de administración
Posología
La dosis recomendada de FORSTEO es de 20 microgramos administrados una vez al día.
Se recomienda que la duración máxima del tratamiento con FORSTEO sea de 24 meses (ver sección 4.4). El ciclo de 24 meses de tratamiento con FORSTEO no debe repetirse a lo largo de la vida del paciente.
Los pacientes deben recibir suplementos de calcio y vitamina D si el aporte dietético no es suficiente.
Después de suspender el tratamiento con FORSTEO los pacientes pueden continuar con otros tratamientos para la osteoporosis.
Poblaciones especiales
Pacientes con insuficiencia renal
FORSTEO no puede usarse en pacientes con insuficiencia renal grave (ver sección 4.3.). FORSTEO debe usarse con precaución en pacientes con insuficiencia renal moderada. No se requieren precauciones especiales en pacientes con insuficiencia renal leve.
Pacientes con insuficiencia hepática
No se dispone de datos en pacientes con disfunción hepática (ver sección 5.3.). Por lo que FORSTEO se debe usar con precaución.
Población _pediátrica y adultos _jóvenes con epífisis abiertas
No se ha establecido la seguridad y eficacia de FORSTEO en niños y adolescentes menores de 18 años. FORSTEO no debe usarse en pacientes pediátricos (menores de 18 años) o adultos jóvenes con epífisis abiertas.
Pacientes de edad avanzada
No se requiere ajuste de dosis basado en la edad (ver sección 5.2.).
Forma de administración
FORSTEO se debe administrar una vez al día mediante inyección subcutánea en el muslo o abdomen.
Los pacientes deben estar entrenados en el uso de una técnica de inyección adecuada (ver sección 6.6). También hay disponible un manual de usuario, para formar a los pacientes en el uso correcto de la pluma.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Embarazo y lactancia (ver secciones 4.4 y 4.6)
• Hipercalcemia preexistente.
• Insuficiencia renal severa.
• Pacientes con enfermedades metabólicas óseas (incluyendo el hiperparatiroidismo y la enfermedad
de Paget del hueso) distintas a la osteoporosis primaria u osteoporosis inducida por glucocorticoides.
• Elevaciones inexplicadas de la fosfatasa alcalina.
• Pacientes que hayan recibido anteriormente radiación externa o radioterapia localizada sobre el esqueleto.
• Pacientes con tumores óseos o metástasis óseas deben ser excluidos del tratamiento con teriparatida.
4.4 Advertencias y precauciones especiales de empleo Calcio sérico y urinario
En pacientes normocalcémicos se han observado elevaciones ligeras y transitorias de las concentraciones séricas de calcio después de la inyección de teriparatida. Las concentraciones séricas del calcio alcanzan su máximo entre las 4 y las 6 horas siguientes a la inyección y vuelven a los valores basales entre las 16 y 24 horas siguientes a la administración de cada dosis de teriparatida. Por lo que si se toman muestras para medir el calcio sérico, se debe hacer al menos 16 horas después de la última inyección de FORSTEO. Durante el tratamiento no es necesario realizar una monitorización rutinaria del calcio.
FORSTEO puede producir pequeños incrementos en la excreción urinaria del calcio, sin embargo, en ensayos clínicos la hipercalciuria no fue diferente de la de los pacientes tratados con placebo.
Urolitiasis
FORSTEO no se ha estudiado en pacientes con urolitiasis activa. FORSTEO se debe utilizar con precaución en pacientes con urolitiasis activa o reciente por el riesgo potencial de empeoramiento.
Hipotensión ortostática
En los ensayos clínicos a corto plazo realizados con FORSTEO se han observado episodios aislados de hipotensión ortostática. Dichos episodios típicamente comenzaron dentro de las 4 horas siguientes a la administración de la dosis y se resolvieron espontáneamente entre unos minutos y unas pocas horas. En los casos en los que se produjo una hipotensión ortostática transitoria, ésta ocurrió con las primeras dosis, se alivió colocando a los sujetos en decúbito, y no impidió continuar el tratamiento.
Insuficiencia renal
Se debe tener precaución en pacientes con insuficiencia renal moderada.
Población adulta más joven
La experiencia en la población adulta más joven, incluyendo mujeres premenopáusicas, es limitada (ver sección 5.1) En esta población el tratamiento únicamente debe iniciarse cuando el beneficio supere claramente los riesgos.
Las mujeres en edad fértil deben utilizar métodos anticonceptivos eficaces durante el tratamiento con FORSTEO. Si el embarazo llegara a producirse, el tratamiento con FORSTEO debe interrumpirse.
Duración del tratamiento
Los estudios en ratas indican un aumento en la incidencia de osteosarcoma con la administración a largo plazo de teriparatida (ver sección 5.3.). Hasta que se disponga de más datos clínicos, no se debe exceder el tiempo recomendado de tratamiento de 24 meses.
4.5 Interacción con otros medicamentos y otras formas de interacción
En un ensayo en 15 voluntarios sanos a los que se administró digoxina diariamente hasta alcanzar el estado estacionario, una dosis única de FORSTEO, no alteró el efecto cardíaco de la digoxina. Sin embargo, notificaciones de casos esporádicas, han sugerido que la hipercalcemia puede predisponer a los pacientes a una toxicidad digitálica. Debido a que FORSTEO incrementa de forma transitoria el calcio sérico, FORSTEO se debe utilizar con precaución en pacientes que estén tomando digitálicos.
FORSTEO se ha evaluado en estudios de interacción farmacodinámica con hidroclorotiazida. No se observó ninguna interacción clínicamente significativa.
La coadministración de raloxifeno o terapia hormonal sustitutiva y FORSTEO no modificó los efectos de FORSTEO sobre el calcio en suero y orina ni las reacciones adversas clínicas.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil/Anticoncepción en mujeres
Las mujeres en edad fértil, deben utilizar métodos anticonceptivos eficaces durante el tratamiento con FORSTEO. Si el embarazo llegase a producirse, se debe interrumpir el tratamiento con FORSTEO.
Embarazo
El uso de FORSTEO está contraindicado durante el embarazo (ver sección 4.3).
Lactancia
El uso de FORSTEO está contraindicado durante la lactancia. Se desconoce si teriparatida se excreta en la leche materna.
Fertilidad
Los estudios realizados en conejos han mostrado toxicidad para la reproducción (ver sección 5.3). No se ha estudiado el efecto de teriparatida sobre el desarrollo fetal humano. Se desconoce el riesgo potencial en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de FORSTEO sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. En algunos pacientes se observó hipotensión ortostática o mareo transitorios. Estos pacientes deben evitar conducir o utilizar máquinas hasta que los síntomas hayan remitido.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas que se notificaron más frecuentemente en pacientes tratados con FORSTEO fueron náuseas, dolor en las extremidades, cefalea y mareo.
Tabla de reacciones adversas
Entre los pacientes incluidos en los ensayos con teriparatida, el 82,8% de los pacientes tratados con FORSTEO y el 84,5% de los pacientes que recibieron placebo, notificaron al menos 1 acontecimiento adverso.
La siguiente tabla resume las reacciones adversas asociadas al uso de teriparatida observadas en los ensayos clínicos de osteoporosis y después de la comercialización. La clasificación de las reacciones adversas se ha llevado a cabo de acuerdo al siguiente convenio: Muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a<1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000).
Trastornos de la sangre y del sistema linfático
Frecuentes: Anemia_
Trastornos del sistema inmunológico
Raras: Anafilaxia_
Trastornos del metabolismo y de la nutrición
Frecuentes: Hipercolesterolemia
Poco frecuentes: Hipercalcemia superior a 2,76 mmol/l, hiperuricemia
Raras: Hipercalcemia superior a 3,25mmol/l_
Trastornos psiquiátricos
Frecuentes: Depresión_
Trastornos del sistema nervioso
Frecuentes: Mareo, cefalea, ciática, síncope_
Trastornos del oído y del laberinto
Frecuentes: Vértigo_
Trastornos cardiacos
Frecuentes: Palpitaciones
Poco ffrecuentes: Taquicardia_
Trastornos vasculares
Frecuentes: Hipotensión_
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes: Disnea
Poco ^frecuentes: Enfisema Trastornos gastrointestinales
Frecuentes: Náuseas, vómito, hernia de hiato, reflujo gastroesofágico
Pocof frecuentes: Hemorroides
Trastornos de la piel y del tejido subcutáneo
Frecuentes: Aumento de la sudoración
Trastornos musculoesqueléticos y del tejido conjuntivo
Muy frecuentes: Dolor en las extremidades
Frecuentes: Calambres musculares
Pocoffrecuentes: Mialgia, artralgia, calambres/ dolor de espalda1 2
Trastornos renales y urinarios
Poco frecuentes: Incontinencia urinaria, poliuria, urgencia miccional, nefrolitiasis Raras: fallo/insuficiencia renal
Trastornos generales y alteraciones en el lugar de administración
Frecuentes: Fatiga, dolor torácico, astenia, acontecimientos leves y transitorios en el lugar de la inyección, incluyendo dolor, hinchazón, eritema, hematoma localizado, prurito y ligero sangrado en el lugar de la inyección
Poco frecuentes: Eritema en el lugar de inyección, reacción en el lugar de inyección
Raras: Posibles acontecimientos alérgicos inmediatamente después de la inyección: disnea aguda,
edema oro/facial, urticaria generalizada, dolor torácico, edema (principalmente periférico)
Los efectos que se pueden producir en caso de sobredosis incluyen hipercalcemia tardía y riesgo de hipotensión ortostática. También se pueden producir náuseas, vómitos, mareos y cefaleas.
Experiencia en sobredosis basada en las notificaciones espontáneas después de la comercialización En las notificaciones espontáneas después de la comercialización se han producido casos en los que por error se administró la totalidad del contenido de la pluma de teriparatida como única dosis (hasta 800 pg). Se notificaron efectos transitorios, que incluyen náuseas, debilidad/letargo e hipotensión. En algunos casos, no se han producido reacciones adversas como resultado de la sobredosis. No se ha notificado ningún desenlace fatal asociado con la sobredosis.
Tratamiento de la sobredosis
No existe un antídoto específico para FORSTEO. Si se sospecha de una sobredosis, el tratamiento debe incluir la suspensión transitoria de FORSTEO, monitorización del calcio sérico y la instauración de medidas de soporte adecuadas, como la hidratación.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Homeostasis del calcio, hormonas paratiroideas y análogos, código ATC: H05 AA02.
Mecanismo de acción
La hormona paratiroidea endógena de 84 aminoácidos (PTH) es la reguladora principal del metabolismo del calcio y del fósforo en el hueso y el riñón. FORSTEO (rhPTH(1-34)) es el fragmento activo (1-34) de la hormona paratiroidea humana endógena. Las acciones fisiológicas de la PTH incluyen la estimulación de la formación de hueso por efecto directo sobre las células formadoras de hueso (osteoblastos) aumentando indirectamente la absorción intestinal de calcio y aumentando en el riñón la reabsorción tubular de calcio y la excreción de fosfato.
Efectos farmacodinámicos
FORSTEO es un agente formador de hueso que se utiliza para el tratamiento de la osteoporosis. Los efectos de FORSTEO sobre el esqueleto dependen del patrón de exposición sistémica. La administración una vez al día de FORSTEO produce un aumento de la aposición de hueso nuevo en las superficies óseas trabecular y cortical al estimular en mayor medida la actividad osteoblástica sobre la actividad osteoclástica.
Eficacia clínica
Factores de riesgo
Se deben considerar los factores de riesgo independientes, como por ejemplo, densidad mineral ósea (DMO) baja, edad, existencia de fracturas previas, historial familiar de fracturas de cadera, remodelado óseo alto e índice de masa corporal bajo con el fin de identificar a las mujeres y a los hombres con riesgo incrementado de fracturas osteoporóticas y que se podrían beneficiar de este tratamiento.
Las mujeres premenopáusicas con osteoporosis inducida por glucocorticoides deben considerarse con un riesgo elevado de sufrir fracturas si tienen fracturas prevalentes o una combinación de factores de riesgo que confieran un riesgo elevado de sufrir fracturas (e.g., baja densidad ósea, [e.g., T score < -2], terapia con una dosis alta de glucocorticoides mantenida en el tiempo [e.g, > 7,5 mg/día durante al menos 6 meses], alta actividad de la enfermedad de base, niveles bajos de esteroides sexuales).
. Se invita a los sistema nacional de
El ensayo pivotal incluyó 1.637 mujeres posmenopáusicas (edad media 69,5 años). Al principio del ensayo el noventa por ciento de las pacientes tenían una o más fracturas vertebrales y de media, la DMO vertebral fue 0,82g/cm2 (equivalente a una T.score de - 2,6). A todas las pacientes se les administraron
1.000 mg de calcio al día y al menos 400 UI de vitamina D al día. Después de 24 meses de tratamiento con FORSTEO (mediana: 19 meses) se demostró una reducción de las fracturas estadísticamente significativa (Tabla 1). El número necesario de pacientes que se necesita tratar para prevenir una o más fracturas vertebrales nuevas fue de 11 mujeres en una mediana de 19 meses.
Tabla 1
|
Placebo (N = 544) (%) |
FORSTEO (N = 541) (%) |
Riesgo relativo (95 % IC) vs. placebo | |
|
Nueva fractura vertebral (> 1)a |
14,3 |
5,0b |
0,35 (0,22 - 0,55) |
|
Fracturas vertebrales múltiples (> 2)a |
4,9 |
1,1b |
0,23 (0,09 - 0,60) |
|
Fracturas no vertebrales por fragilidad0 |
5,5 |
2,6d |
0,47 (0,25 - 0,87) |
|
Fracturas mayores no vertebrales por fragilidadc (cadera, radio, húmero, costillas y pelvis) |
3,9 |
1,5d |
0,38 (0,17 - 0,86) |
Abreviaturas: N = número de pacientes asignados aleatoriamente a cada grupo de tratamiento;JC = intervalo de confianza
La incidencia de fracturas vertebrales fue evaluada en 448 pacientes tratados con placebo y en 444 pacientes tratados con Forsteo quienes tenían radiografías de columna iniciales y de seguimiento. b p < 0,001 comparado con placebo
c No se ha demostrado una reducción significativa en la incidencia de fracturas de cadera d p < 0,025 comparado con placebo
Incidencia de Fracturas en Mujeres Posmenopáusicas
La densidad mineral ósea (DMO) aumentó significativamente después de 19 meses de tratamiento (mediana) en la columna lumbar y en cadera total, en un 9% y 4% respectivamente, en comparación con placebo (p < 0,001).
Post-tratamiento: después del tratamiento con FORSTEO, 1.262 mujeres posmenopáusicas del ensayo principal participaron en un ensayo de seguimiento post-tratamiento. El objetivo principal del ensayo fue recoger datos de seguridad de FORSTEO. Durante este periodo observacional se permitieron otros tratamientos para la osteoporosis y se realizó una evaluación adicional de fracturas vertebrales.
Durante una mediana de 18 meses después de la discontinuación de FORSTEO, el número de pacientes con al menos una nueva fractura vertebral fue un 41 % menor (p = 0,004) en el grupo tratado con FORSTEO que en el grupo tratado con placebo.
En un ensayo abierto, 503 mujeres posmenopáusicas con osteoporosis grave y una fractura por fragilidad en los 3 años anteriores (83 % habían recibido una terapia previa para la osteoporosis), fueron tratadas con FORSTEO durante un máximo de 24 meses. A los 24 meses, el incremento medio de la DMO en la columna lumbar, cadera total y cuello femoral, con respecto al inicio del tratamiento, fue del 10,5 %,
2,6 % y 3,9 % respectivamente. El incremento medio de la DMO desde 18 hasta 24 meses fue del 1,4 %,
1,2 %, y 1,6 % en la columna lumbar, cadera total y cuello femoral, respectivamente.
Osteoporosis en varones
Se incluyeron 437 pacientes (edad media 58,7 años) en un ensayo clínico para varones con osteoporosis hipogonadal (definida por niveles bajos de testosterona libre por la mañana o niveles elevados de FSH o LH) o idiopática. Los valores medios de T.score de densidad mineral ósea en columna y cuello femoral al inicio del ensayo fueron -2,2 y -2,1, respectivamente. El 35 % de los pacientes tenían una fractura vertebral y un 59 % tenían una fractura no vertebral en el momento de entrar en el ensayo.
A todos los pacientes se les dio 1.000 mg de calcio y al menos 400 UI de vitamina D al día. La DMO en columna lumbar aumentó significativamente a los 3 meses. Después de 12 meses de tratamiento, la DMO aumentó en la columna lumbar y en cadera total en un 5 % y 1 % respectivamente, en comparación con placebo. Sin embargo, no se ha demostrado un efecto significativo en la incidencia de fracturas.
Osteoporosis inducida por glucocorticoides
En la primera fase de 18 meses del ensayo doble ciego, aleatorizado, con comparador activo (alendronato 10 mg/día) y de 36 meses de duración, se ha demostrado la eficacia de FORSTEO en hombres y mujeres (N=428) tratados con una terapia sistémica mantenida con glucocorticoides (equivalente a una dosis de 5 mg o mayor de prednisona durante al menos 3 meses). Al inicio del ensayo, el 28 % de los pacientes tenían una o más fracturas vertebrales diagnosticadas radiológicamente. A todos los pacientes se les administraron 1.000 mg de calcio al día y 800 UI de vitamina D al día.
Este ensayo incluyó mujeres posmenopáusicas (N=277), mujeres premenopáusicas (N=67), y hombres (N=83). Al inicio del ensayo, las mujeres posmenopáusicas tenían una media de edad 61 años, valor medio de T score de DMO en la columna lumbar de -2,7, una mediana de 7,5 mg/día de dosis equivalente de prednisona, y un 34 % tenían una o más fracturas vertebrales diagnosticadas radiológicamente; las mujeres premenopáusicas tenían una media de edad de 37 años, valor medio de T score de DMO en la columna lumbar de -2,5, una mediana de 10 mg/día de dosis equivalente de prednisona, y un 9 % tenían una o más fracturas vertebrales diagnosticadas radiológicamente; y los hombres tenían una media de edad de 57 años, valor medio de T score de DMO en la columna lumbar de -2,2, una mediana de 10 mg/día de dosis equivalente de prednisona y el 24 % de los pacientes tenia una o más fracturas vertebrales diagnosticadas radiológicamente.
El 69 % de los pacientes completó la primera fase de 18 meses. Al final de los 18 meses, FORSTEO había incrementado de forma significativa la DMO en la columna lumbar (7,2 %) en comparación con alendronato (3,4 %) (p<0,001). FORSTEO incrementó también la DMO en cadera total (3,6 %) comparado con alendronato (2,2 %) (p<0,01) así como la del cuello femoral (3,7 %) en comparación con alendronato (2,1 %) (p<0,05). En pacientes tratados con teriparatida, desde los 18 a 24 meses se produjo un incremento adicional de la DMO en la columna lumbar, cadera total y cuello femoral de 1,7 %, 0,9 % y 0,4 %, respectivamente.
A los 36 meses, el análisis de las radiografías de columna de 169 pacientes tratados con alendronato y de 173 pacientes tratados con FORSTEO, mostraron que 13 pacientes del grupo tratado con alendronato (7,7 %) habían experimentado una nueva fractura vertebral frente a 3 pacientes del grupo tratado con FORSTEO (1,7 %) (p=0,01). Asimismo se vio que 15 de los 214 pacientes del grupo tratado con alendronato (7,0 %) habían experimentado una fractura no vertebral frente a los 16 de los 214 pacientes del grupo tratado con FORSTEO (7,5 %) (p=0,84).
En mujeres premenopáusicas, el incremento de la DMO desde el inicio del ensayo a los 18 meses, fue significativamente mayor en el grupo tratado con FORSTEO en comparación con el de alendronato en columna lumbar (4,2 % frente a -1,9 %; p<0,001) y en cadera total (3,8 % frente a 0,9 %; p=0,005). De cualquier modo, no se ha demostrado un efecto significativo sobre la tasa de fracturas.
5.2 Propiedades farmacocinéticas
Distribución
El volumen de distribución es de aproximadamente 1,7 l/kg. La semivida de FORSTEO es de aproximadamente 1 hora cuando se administra por vía subcutánea, lo que refleja el tiempo requerido para la absorción desde el lugar de inyección.
Biotransformación
No se han realizado estudios de metabolismo o de excreción con FORSTEO, pero se cree que el metabolismo periférico de la hormona paratiroidea se produce predominantemente en el hígado y riñón.
Eliminación
FORSTEO se elimina mediante aclaramiento hepático y extra-hepático (aproximadamente 62 l/h en mujeres y 94 l/h en hombres).
Pacientes de edad avanzada
No se han detectado diferencias en la farmacocinética de FORSTEO con la edad (rango 31 a 85 años). No es necesario realizar un ajuste de la dosis en función de la edad.
5.3 Datos preclínicos sobre seguridad
Teriparatida no fue genotóxica en ninguno de los ensayos de una batería estándar. No produjo efectos teratógenos en ratas, ratones ni conejos. No se observaron efectos importantes en ratas o ratones preñados a los que se les administró teriparatida a dosis diarias de 30 a 1.000 pg/kg. No obstante, las conejas preñadas a las que se les administró teriparatida a dosis diarias de 3 a 100 pg/kg experimentaron resorción fetal y una reducción en el tamaño de la camada. La embriotoxicidad observada en las conejas puede estar relacionada con su mayor sensibilidad a los efectos que tiene la PTH sobre el ión calcio en sangre en comparación con los roedores.
Las ratas tratadas durante casi toda su vida con inyecciones diarias presentaron formación de hueso exagerada, dependiente de la dosis y aumento en la incidencia de osteosarcomas debido probablemente a un mecanismo epigenético. Teriparatida no aumentó la incidencia de ningún otro tipo de neoplasia en ratas. Debido a las diferencias en la fisiología del hueso en ratas y en humanos, la relevancia clínica de estos hallazgos es probablemente poco relevante. No se han observado tumores óseos en las monas ovariectomizadas tratadas durante 18 meses o durante un periodo de seguimiento de 3 años después de suspender el tratamiento. Además, no se han observado osteosarcomas en ensayos clínicos o durante el estudio de seguimiento post tratamiento.
En los estudios en animales se ha demostrado que una reducción marcada en el flujo sanguíneo hepático disminuye la exposición de la PTH al principal sistema de eliminación (células de Kupffer) y, en consecuencia, del aclaramiento de la PTH(1-84).
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Ácido acético glacial Acetato de sodio (anhidro)
Manitol
Metacresol
Ácido clorhídrico (para ajustar el pH)
Hidróxido de sodio (para ajustar el pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Período de validez 2 años.
Se ha demostrado una estabilidad química, física y microbiológica en uso durante 28 días a 2 °C-8 °C. Una vez abierto, el producto se puede conservar durante un máximo de 28 días a 2 °C-8 °C. Otros tiempos y condiciones de conservación en uso son responsabilidad del usuario.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C) siempre. La pluma debe devolverse a la nevera inmediatamente después de su uso. No congelar.
No conservar el dispositivo de inyección con la aguja colocada.
6.5 Naturaleza y contenido del envase
Cartucho con 2,4 ml de solución (vidrio Tipo I tratado con silicona) con un émbolo (goma de halobutilo), un disco hermético (goma laminada de poliisopropeno/bromobutilo) / aluminio, ensamblado en una pluma desechable.
FORSTEO está disponible en envases de 1 ó 3 plumas. Cada pluma contiene 28 dosis de 20 microgramos (por 80 microlitros).
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
FORSTEO se presenta en una pluma precargada. Cada pluma debe ser utilizada por un único paciente.
Con cada inyección debe emplearse una nueva aguja, estéril. Cada envase de FORSTEO contiene un manual del usuario que describe completamente el uso de la pluma. No se proporcionan agujas con el producto. El dispositivo puede usarse con agujas de inyección de la pluma de insulina. Después de cada inyección, la pluma de FORSTEO debe devolverse a la nevera.
FORSTEO no debe usarse si la solución está turbia, presenta color o contiene partículas.
Ver el manual de usuario para las instrucciones sobre cómo usar la pluma.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con las normativas locales.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Países Bajos
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/03/247/001-002
9. FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 10 de Junio de 2003.
Fecha de la última renovación: 10 de Junio de 2013.
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
Boehringer-Ingelheim RCV GmbH & Co KG, Dr.-Boehringer-Gasse 5-11, 1121 Viena, Austria Nombre y dirección del fabricante responsable de la liberación de los lotes Lilly France S.A.S., rue du colonel Lilly, 67640 Fegersheim, Francia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes Periódicos de Seguridad
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
Se debe presentar un PGR actualizado cada tres años.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR, TEXTO DEL ESTUCHE
1. NOMBRE DEL MEDICAMENTO
FORSTEO 20 microgramos/80 microlitros solución inyectable en pluma precargada. Teriparatida
2. PRINCIPIO(S) ACTIVO(S)
Cada ml contiene 250 microgramos de teriparatida.
3. LISTA DE EXCIPIENTES
Ácido acético glacial, acetato de sodio (anhidro), manitol, metacresol, agua para preparaciones inyectables. Solución de ácido clorhídrico y/o solución de hidróxido de sodio (para ajustar el pH).
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable.
1 pluma con 2,4 ml de solución.
3 plumas con 2,4 ml de solución cada una.
Cada pluma contiene 28 dosis de 20 microgramos (por 80 microlitros).
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Para abrir, levante aquí y tire.
8. FECHA DE CADUCIDAD
CAD
La pluma debe ser desechada a los 28 días de su primera utilización. Fecha de su primera utilización:
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/03/247/001
O
EU/1/03/247/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
forsteo
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
TEXTO DE LA ETIQUETA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
FORSTEO 20 microgramos/80 microlitros, inyectable
Teriparatida
Vía subcutánea.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE DEL FABRICANTE
Lot
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
2,4 ml
6. OTROS
Conservar en nevera
B. PROSPECTO
Prospecto: información para el usuario
FORSTEO 20 microgramos/80 microlitros solución inyectable en pluma precargada
Teriparatida
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento porque contiene información importante para usted.
- Conserve este prospecto ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es FORSTEO y para qué se utiliza
2. Qué necesita saber antes de empezar a usar FORSTEO
3. Cómo usar FORSTEO
4. Posibles efectos adversos
5. Conservación de FORSTEO
6. Contenido del envase e información adicional
1. Qué es FORSTEO y para qué se utiliza
FORSTEO contiene el principio activo teriparatida, que es empleado para aumentar la fortaleza del hueso y reducir el riesgo de fracturas mediante la estimulación de la formación de hueso.
FORSTEO se usa para el tratamiento de la osteoporosis en adultos. La osteoporosis es una enfermedad que hace que sus huesos se desgasten y se vuelvan frágiles. Esta enfermedad es especialmente frecuente en las mujeres después de la menopausia, pero también puede ocurrir en varones. La osteoporosis también es frecuente en pacientes tratados con corticosteroides.
2. Qué necesita saber antes de empezar a usar FORSTEO
Su profesional sanitario le enseñará cómo utilizar la pluma de FORSTEO.
No use FORSTEO
• si es alérgico a teriparatida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
• si tiene niveles de calcio elevados (hipercalcemia preexistente).
• si padece problemas graves de riñón.
• si alguna vez le han diagnosticado cáncer de huesos u otros tipos de cáncer que se hayan extendido (metastatizado) a sus huesos.
• si tiene determinadas enfermedades de los huesos. Si tiene una enfermedad de los huesos consulte a su médico.
• si tiene niveles elevados de fosfatasa alcalina en sangre sin explicación aparente, lo cual podría indicar que padece la enfermedad de Paget en el hueso (enfermedad con cambios anormales del hueso). Si no está seguro, consulte a su médico.
• si ha recibido radioterapia que haya podido afectar a sus huesos.
• si está embarazada o en la lactancia.
Advertencias y precauciones
FORSTEO puede causar un aumento de la cantidad de calcio en su sangre u orina.
Consulte a su médico o farmacéutico antes o mientras esté utilizando FORSTEO:
• Si usted tiene continuamente náuseas, vómitos, estreñimiento, baja energía o debilidad muscular dígaselo a su médico. Estos pueden ser síntomas de que hay demasiado calcio en su sangre.
• Si usted sufre de piedras en el riñón o presenta una historia previa de piedras en el riñón.
• Si usted sufre de problemas de riñón (insuficiencia renal moderada) debe decírselo a su médico.
Algunos pacientes, tras las primeras dosis, sufren mareos o aumento de la frecuencia cardiaca. Para las primeras dosis, utilice FORSTEO en un lugar donde pueda sentarse o tumbarse inmediatamente si se marea.
El tiempo de tratamiento recomendado de 24 meses no debe ser excedido.
FORSTEO no debe utilizarse en adultos en crecimiento.
Niños y adolescentes
FORSTEO no debe utilizarse en niños y adolescentes (menores de 18 años).
Uso de FORSTEO con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento, porque ocasionalmente se pueden producir interacciones (p. ej. digoxina/digitálicos, un medicamento empleado para tratar enfermedades cardiacas).
Embarazo y lactancia
No utilice FORSTEO si está embarazada o en periodo de lactancia. Si usted es una mujer en edad fértil, debe utilizar métodos anticonceptivos eficaces durante el tratamiento con FORSTEO. Si se queda embarazada, debe interrumpirse el tratamiento con FORSTEO. Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
Algunos pacientes pueden sentir mareos después de la inyección de FORSTEO. Si usted siente mareo no debe conducir o usar máquinas hasta que se encuentre mejor.
Información importante sobre algunos de los componentes de FORSTEO
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
3. Cómo usar FORSTEO
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es de 20 microgramos administrados una vez al día mediante una inyección debajo de la piel (inyección subcutánea) en el muslo o en el abdomen. Para ayudarle a recordar inyectarse su medicamento, inyéctese sobre la misma hora cada día.
Inyéctese FORSTEO cada día durante tanto tiempo como su médico se lo prescriba. La duración total del tratamiento con FORSTEO no debe exceder 24 meses. Usted no debe recibir más de un ciclo de 24 meses de tratamiento con FORSTEO a lo largo de su vida.
FORSTEO puede inyectarse a la hora de las comidas.
Consulte el Manual del Usuario que está incluido en el estuche con las instrucciones sobre cómo utilizar la pluma FORSTEO.
No se incluyen agujas con la pluma. Se pueden utilizar las agujas Becton, Dickinson and Company de calibre 29 a 31 (diámetro 0,25-0,33 mm) y de 12,7; 8 ó 5 mm de longitud.
La inyección de FORSTEO se debe realizar poco después de sacar la pluma de la nevera, tal y como se indica en el Manual de Usuario. Vuelva a guardar la pluma en la nevera inmediatamente después de utilizarla. Debe utilizar una aguja nueva para cada inyección y tirarla después de cada uso. No guarde la pluma con la aguja puesta. Nunca comparta con otros su pluma de FORSTEO.
Su médico puede recomendarle tomar FORSTEO con calcio y vitamina D. Su médico le indicará cuánto debe tomar cada día.
FORSTEO puede ser utilizado con o sin alimentos.
Si usa más FORSTEO del que debiera
Si por error se ha administrado más cantidad de FORSTEO de la prescrita, consulte a su médico o farmacéutico.
Los efectos que podrían esperarse de una sobredosis incluyen náuseas, vómitos, mareos y dolor de cabeza.
Si olvida o no puede inyectarse FORSTEO a la hora habitual, hágalo tan pronto como pueda ese mismo día. No tome una dosis doble para compensar las dosis olvidadas. No se inyecte más de una vez en el mismo día. No intente compensar la dosis olvidada.
Si interrumpe el tratamiento con FORSTEO
Si está pensando interrumpir el tratamiento con FORSTEO, por favor consulte con su médico. Su médico le aconsejará y decidirá sobre cuánto tiempo debe ser tratado con FORSTEO.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede tener efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos más frecuentes son dolor en las extremidades (muy frecuentes, pueden afectar a más de 1 de cada 10 pacientes), malestar, dolor de cabeza y mareo (frecuentes). Si se marea después de una inyección, siéntese o túmbese hasta que se encuentre mejor. En caso de no mejorar, consulte a su médico antes de continuar con el tratamiento. Se han notificado casos de desmayo asociados al uso de teriparatida. Si experimenta molestias como enrojecimiento de la piel, dolor, hinchazón, picor, hematomas o ligero sangrado alrededor de la zona de inyección (frecuente), éstas deberían desaparecer en unos días o semanas. Si no es así, dígaselo a su médico tan pronto como sea posible.
Algunos pacientes, pueden haber experimentado reacciones alérgicas justo después de la inyección, que consisten en dificultad para respirar, hinchazón de la cara, erupción cutánea y dolor en el pecho (frecuencia rara). En raras ocasiones, pueden producirse reacciones alérgicas graves y potencialmente mortales, incluyendo anafilaxia.
Otros efectos adversos son:
Frecuentes: pueden afectar hasta 1de cada 10 pacientes
• aumento de los niveles de colesterol en sangre
• depresión
• dolor neurálgico en la pierna
• sensación de desvanecimiento
• palpitaciones irregulares
• dificultad para respirar
• aumento de la sudoración
• calambres musculares
• pérdida de energía
• cansancio
• dolor de pecho
• tensión arterial baja
• acidez de estómago (dolor o sensación de ardor justo debajo del esternón)
• vómitos
• hernia del tubo que lleva la comida hasta su estómago
• hemoglobina baja o bajo recuento de glóbulos rojos (anemia)
Poco frecuentes: pueden afectar hasta 1de cada 100 pacientes
• aumento de la frecuencia cardiaca
• sonido anormal del corazón
• falta de aliento
• hemorroides (almorranas)
• pérdida accidental o escape de orina
• aumento de la necesidad de orinar
• aumento de peso
• piedras en el riñón
• dolor en los músculos y en las articulaciones. Algunos pacientes han experimentado calambres en la espalda graves o dolor y tuvieron que ser hospitalizados
• aumento en los niveles de calcio en sangre
• aumento de los niveles de ácido úrico en sangre
• aumento en los niveles de una enzima llamada fosfatasa alcalina.
Raros: pueden afectar hasta1 de cada 1.000 pacientes
• reducción de la función del riñón, incluyendo insuficiencia renal
• hinchazón, principalmente en las manos, pies y piernas
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de FORSTEO
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y la pluma después de CAD y EXP respectivamente. La fecha de caducidad es el último día del mes que se indica.
FORSTEO debe conservarse siempre en nevera (entre 2°C y 8°C). Puede utilizar FORSTEO durante 28 días después de realizar la primera inyección mientras la pluma se conserve en nevera (entre 2°C y 8°C).
No congele FORSTEO. Evite colocar las plumas cerca del congelador de la nevera para prevenir su congelación. No use FORSTEO si está o ha estado congelado.
Cada pluma debe desecharse de forma adecuada después de 28 días, aunque no esté vacía del todo.
FORSTEO contiene una solución transparente e incolora. No utilice FORSTEO si tiene partículas sólidas o si la solución está turbia o presenta color.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de FORSTEO
- El principio activo es teriparatida. Cada mililitro de solución inyectable contiene 250 microgramos de teriparatida.
- Los demás componentes son ácido acético glacial, acetato de sodio (anhidro), manitol, metacresol y agua para preparaciones inyectables. Además, se puede haber añadido una solución de ácido clorhídrico y/o de hidróxido de sodio para ajustar el pH.
Aspecto del producto y contenido del envase
FORSTEO es una solución transparente e incolora. Se presenta en un cartucho incluido en una pluma precargada desechable. Cada pluma contiene 2,4 ml de solución suficiente para 28 dosis. Las plumas están disponibles en envases que contienen una o tres plumas. Puede que solamente estén disponibles algunos tamaños de envases.
Titular de la autorización de comercialización
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Países Bajos Responsable de la fabricación
Lilly France S.A.S, Rue du Colonel Lilly, F-67640 Fegersheim, Francia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
Lietuva Eli Lilly Holdings Limited atstovybé Tel. + 370 (5) 2649600 |
|
Etarapun Tn "Enu Runu HegepnaHg" E.B. - Etarapua Tea. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Ceská republika ELI LILLY CR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: + 45 45 26 60 00 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: + 3726817280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EXXáda OAPMAIEPB-AIAAY A.E.B.E. Tp^: + 30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
España Elanco Valquímica, S.A. Tel: + 34-91 623 1732 |
Polska Eli Lilly Polska Sp. z o.o. Tel.: + 48 (0) 22 440 33 00 |
|
France Lilly France SAS Tél: + 33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmacéuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Romania Eli Lilly Romania S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited. Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska druzba, d.o.o Tel: +386 (0)1 580 00 10 |
|
Ísland Icepharma hf. Sími: + 354 540 80 00 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúnpoq Phadisco Ltd Tni: + 357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited párstávnieciba Latvija Tel: + 371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http: //www.ema. europa. eu/
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
MANUAL DEL USUARIO DE LA PLUMA
Forsteo
FORSTEO 20 microgramos (pg)/ 80 microlitros solución inyectable en pluma precargada. Instrucciones de uso
Antes de usar su nueva pluma, por favor lea toda la sección Instrucciones de Uso. Siga cuidadosamente las indicaciones cuando use la pluma.
Lea también el prospecto incluido en el envase.
No comparta su pluma o sus agujas ya que puede suponer un riesgo de transmisión de infecciones. Su pluma contiene medicamento para 28 días.
Partes de Forsteo *
Cilindro amarillo

Botón de inyección
negro.
Banda Cuerpo Cartucho de Capuchón blanco
roja azul medicamento
Lengüeta de papel
y
Aguja
Capucha externa de la aguja

Protector interno

de la aguja
* Las agujas no están incluidas. Se pueden usar agujas para pluma Becton Dickinson and Company de calibre 29 a 31 (diámetro 0,25-0,33 mm) y de 12,7; 8 ó 5 mm de longitud. Consulte a su médico o farmacéutico qué calibre y longitud de aguja son los más adecuados para usted.
Lávese siempre las manos antes de cada inyección. Prepare el lugar de inyección tal como le haya indicado su médico o farmacéutico.
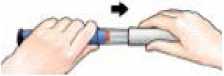
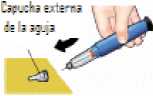
Coloque la aguja
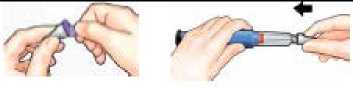
Retire la capucha externa de la aguja y
consérvela.
Retire la lengüeta de papel.
Coloque la aguja presionándola directamente sobre el cartucho del medicamento.
Enrosque la aguja hasta que quede perfectamente fijada.
3
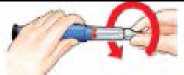
Ajuste
la
dosis
Banda
roja
Protector interno de la aguja

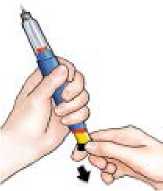
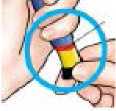
Tire del botón de inyección negro hasta que se detenga.
Si no puede tirar del botón de inyección negro vea la sección Localización y Resolución de Problemas, Problema E.
Retire el protector interno de la aguja y deséchelo.
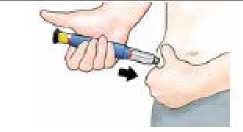
Pellizque suavemente su piel del muslo o el abdomen e introduzca la aguja directamente bajo su piel.
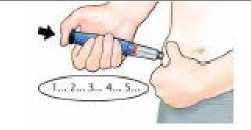
Presione el botón de inyección negro hasta que se detenga. Manténgalo presionado y cuente despacio hasta 5. A continuación, retire la aguja de la piel._
Confirme la dosis
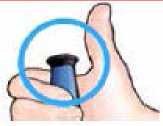

Después de completar la inyección:
Una vez retirada la aguja de la piel, asegúrese de que el botón de inyección negro ha sido introducido hasta
IMPORTANTE
No debería ver ninguna parte del cilindro amarillo. En caso contrario y si ya se ha inyectado, no vuelva a inyectarse una segunda vez en el mismo día. En lugar de eso, reajuste su pluma de FORSTEO (ver sección Localización y Resolución de Problemas, Problema A).
el final. Si no se muestra el cilindro amarillo habrá
completado correctamente los pasos de la inyección.
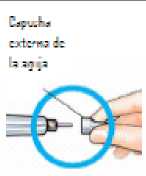
Coloque la capucha externa de la aguja.

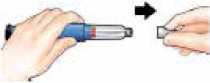

Desenrosque totalmente la aguja dándole de 3 a 5 vueltas completas a la capucha externa de la aguja.
Retire la aguja y deséchela tal como le ha indicado su médico o farmacéutico.
Vuelva a colocar el capuchón blanco. Guarde la pluma de FORSTEO en la
nevera
inmediatamente después de su uso.
Las instrucciones sobre el manejo de la aguja, no pretenden sustituir las instrucciones locales, sanitarias o institucionales.

Problema
A. El cilindro amarillo sigue viéndose después de haber presionado el botón de inyección negro. ¿Cómo reajusto mi pluma de FORSTEO?

B. ¿Cómo puedo saber si mi pluma de FORSTEO funciona?

Forsteo®
FORSTEO, 20 microgramos (pg) 80 microlitros solución inyectable, pluma precargada.
Localización y Resolución de Problemas
Solución
Siga los siguientes pasos para reajustar la pluma de FORSTEO.
1) Si ya se ha inyectado, NO vuelva a inyectarse una segunda vez en el mismo día.
2) Retire la aguja.
3) Fije una nueva aguja, retire la capucha externa de la aguja y consérvela.
4) Tire del botón de inyección negro hasta que se detenga. Asegúrese de que se ve la banda roja.
5) Retire el protector interno de la aguja y deséchelo.
6) Apunte con la aguja hacia abajo sobre un recipiente vacío. Presione el botón de inyección negro hasta que se detenga. Manténgalo presionado y cuente despacio hasta 5. Puede que observe un pequeño chorro o gota de fluido. Cuando haya terminado, el botón de inyección negro debería estar introducido hasta el final.
7) Si sigue viendo el cilindro amarillo, por favor, póngase en contacto con su médico o farmacéutico.
8) Coloque la capucha externa de la aguja en la aguja. Desenrosque totalmente la aguja dándole de 3 a 5 vueltas completas a la capucha externa de la aguja. Retire la aguja y deséchela tal como le ha indicado su médico o farmacéutico. Vuelva a colocar el capuchón blanco y guarde la pluma de FORSTEO en la nevera.
Puede evitar este problema utilizando siempre una aguja NUEVA para cada inyección, y presionando el botón de inyección negro hasta el final mientras cuenta hasta 5 despacio.
La pluma de FORSTEO está diseñada para inyectar una dosis completa cada vez que se utiliza siguiendo las instrucciones de la sección Instrucciones de Uso. El botón de inyección negro deberá estar introducido hasta el final para confirmar que la pluma de FORSTEO ha inyectado la dosis completa.
Recuerde utilizar una aguja nueva para cada inyección para asegurarse de que su pluma de FORSTEO funciona correctamente.
|
C. Veo una burbuja de |
Una pequeña burbuja de aire no afectará a su dosis ni le | |
|
aire en mi pluma de |
hará daño. Puede proceder a la administración de su | |
|
FORSTEO. |
dosis de la forma habitual. | |
|
D. No puedo retirar la |
1) Coloque la capucha externa de la aguja en la | |
|
aguja |
aguja. 2) Utilice la capucha externa de la aguja para desenroscar la aguja. 3) Desenrosque totalmente la aguja dándole de 3 a 5 vueltas completas a la capucha externa de la aguja. 4) Si sigue sin poder retirar la aguja, pídale ayuda a alguien. |
|
E. ¿Qué debería hacer si no puedo tirar del botón de inyección negro? |
Cambie a una nueva pluma de FORSTEO para administrase su dosis tal como le ha indicado su médico o farmacéutico. |
|
Esto significa que usted ya ha utilizado todo el medicamento que podía ser inyectado con precisión, a pesar de que usted pueda ver que aún queda algo del medicamento en el cartucho. |
Limpieza y Conservación
Limpieza de su pluma de FORSTEO
• Limpie el exterior de su pluma de FORSTEO con un paño húmedo.
• No introduzca su pluma de FORSTEO en agua, ni la lave o limpie con ningún líquido.
Conservación de su pluma de FORSTEO
• Guarde su pluma de FORSTEO en la nevera inmediatamente después de cada uso. Lea y siga las instrucciones de cómo conservar su pluma del Prospecto: Información Para El Usuario.
• No guarde su pluma de FORSTEO con la aguja puesta ya que esto podría causar la formación de burbujas de aire en el cartucho.
• Guarde la pluma de FORSTEO con el capuchón blanco puesto.
• No guarde nunca la pluma de FORSTEO en el congelador.
• Si el medicamento se ha congelado, deseche el dispositivo y utilice una nueva pluma de FORSTEO.
• Si se ha dejado la pluma de FORSTEO fuera de la nevera, no la deseche. Vuelva a introducirla en
_la nevera y contacte con su médico o farmacéutico._
Eliminación de las Agujas y de la Pluma
Eliminación de las Agujas y de la Pluma de FORSTEO
• Antes de desechar la pluma de FORSTEO, asegúrese de haber retirado la aguja de la pluma.
• Deseche la pluma y las agujas usadas tal y como le ha indicado su médico o farmacéutico.
• Deseche su pluma 28 días después del primer uso._
Otros Puntos de Interés
• La pluma de FORSTEO contiene medicamento para 28 días.
• No traspase el medicamento a una jeringa.
• Anote en un calendario la fecha de su primera inyección.
• Lea y siga las instrucciones del Prospecto: Información Para El Usuario sobre cómo usar el medicamento.
• Compruebe la etiqueta de la pluma de FORSTEO para asegurarse de que tiene el medicamento correcto y que no ha caducado.
• Contacte con su médico o farmacéutico si ha observado cualquiera de las siguientes situaciones:
- La pluma de FORSTEO parece dañada.
- La solución NO es transparente e incolora y sin partículas.
• Utilice una aguja nueva para cada inyección.
• Durante la inyección, puede que oiga uno o más clicks, esto es el funcionamiento normal del dispositivo.
• No se recomienda que los invidentes o las personas con dificultades de visión utilicen la pluma de FORSTEO sin la ayuda de una persona entrenada en el uso adecuado del dispositivo.
• Mantenga la pluma de FORSTEO fuera de la vista y del alcance de los niños._
Fabricado por: Lilly France, F-67640 Fegersheim, Francia para Eli Lilly and Company.
Este manual del usuario ha sido revisado en {Mes/año}
33
Exploraciones complementarias
Pocof frecuentes: Aumento de peso, soplo cardíaco, incremento de la fosfatasa alcalina
Se han notificado casos graves de calambres/dolor de espalda transcurridos unos minutos después de la
inyección.
Descripción de las reacciones adversas
En los ensayos clínicos las siguientes reacciones adversas fueron notificadas con una diferencia de frecuencia > 1% comparado con placebo: vértigo, náuseas, dolor en las extremidades, mareo, depresión, disnea.
FORSTEO aumenta las concentraciones séricas de ácido úrico. En ensayos clínicos, 2,8% de los pacientes tratados con FORSTEO tuvieron concentraciones séricas de ácido úrico por encima del límite superior de la normalidad en comparación con el 0,7% para los pacientes tratados con placebo. Sin embargo, la hiperuricemia no produjo un aumento de gota, artralgia o urolitiasis.
En un ensayo clínico grande, se detectaron anticuerpos que producían una reacción cruzada con teriparatida en un 2,8% de las mujeres que recibieron FORSTEO. Generalmente, los anticuerpos se detectaron por primera vez después de 12 meses de tratamiento y disminuyeron después de la retirada del tratamiento. No hubo evidencia de reacciones de hipersensibilidad, reacciones alérgicas, efectos sobre el calcio sérico o efectos en la respuesta de la Densidad Mineral Ósea (DMO).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del notificación incluido en el Anexo V.
4.9 Sobredosis
Signos y síntomas
FORSTEO se ha administrado en dosis únicas de hasta 100 microgramos y en dosis repetidas de hasta 60 microgramos/día durante 6 semanas.