Formoterol Stada 12 Mcg Polvo Para Inhalacion
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
FORMOTEROL STADA 12 pg polvo para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula contiene:
Formoterol fumarato dihidrato......... 12 pg
3. FORMA FARMACÉUTICA Polvo para inhalación (cápsula dura).
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
- Profilaxis y tratamiento de la broncoconstricción en pacientes con enfermedad obstructiva reversible de las vías respiratorias, con asma bronquial y bronquitis crónica, con o sin enfisema.
- Profilaxis del broncospasmo inducido por alergenos inhalados, aire frío o ejercicio.
4.2 Posología y forma de administración
Formoterol STADA 12 pg polvo para inhalación está indicado en adultos, incluidos pacientes de edad, y niños mayores de 6 años.
Dado que el efecto broncodilatador de formoterol persiste todavía de forma significativa a las 12 horas, la terapia de mantenimiento de dos inhalaciones al día permite controlar, en la mayoría de los casos, la broncoconstricción asociada a afecciones crónicas, tanto durante el día como durante la noche.
Terapia de mantenimiento:
Adultos y niños mayores de 6 años: una cápsula para inhalación (12 pg) dos veces al día. En casos más graves pueden administrarse dos cápsulas dos veces al día.
Si es necesario, pueden administrarse para aliviar los síntomas una o dos cápsulas diarias adicionales, respecto a la dosis prescrita como dosis de mantenimiento. Sin embargo, si la necesidad de aumentar la dosis es más que ocasional (es decir, con una frecuencia superior a dos días por semana), deberá consultarse con el médico y reajustar la dosis, ya que ello puede ser indicativo de empeoramiento de la afección subyacente.
Profilaxis frente al broncospasmo inducido por el ejercicio o por exposición inevitable a un alérgeno conocido: una cápsula para inhalación (12 pg) aproximadamente 15 minutos antes. En pacientes con asma grave pueden ser necesarias dos cápsulas para inhalación (24 pg).
Niños mayores de 6 años: una cápsula para inhalación (12 pg) aproximadamente 15 minutos antes. Formoterol STADA 12 pg polvo para inhalación no está recomendado en niños menores de 6 años.
4.3 Contraindicaciones
Hipersensibilidad a formoterol o a cualquiera de los componentes de otros estimulantes n2-adrenérgicos. No administrar a niños menores de 6 años.
Taquiarritmia, bloqueo atrioventricular de tercer grado, estenosis aórtica subvalvular idiopática, cardiomiopatía obstructiva hipertrófica, tirotoxicosis.
A dosis superiores a las recomendadas, los p agonistas han mostrado prolongar el intervalo QT en el ECG, aumentando el riesgo de alteraciones del ritmo ventricular.
Por tanto, formoterol no deberá utilizarse en pacientes con intervalo QT prolongado, sospechado o conocido (QTc > 0,44 segundos; ver también “Interacción con otros medicamentos y otras formas de interacción”).
4.4 Advertencias y precauciones especiales de empleo Tratamiento antiinflamatorio:
Los agonistas P2 de larga duración no deben ser utilizados (y no son suficientes) como tratamiento principal para el asma. En general, con el tratamiento regular con agonistas P2, el paciente asmático debería recibir de forma concomitante un tratamiento regular de un agente antiinflamatorio inhalado (p. ej. corticosteroides y/o cromoglicato sódico en niños) o corticosteroides orales.
Cuando se prescriba formoterol, los pacientes deberán ser evaluados para determinar si la terapia antiinflamatoria que reciben es la adecuada. Una vez que los síntomas del asma estén controlados, se debe considerar la reducción gradual de la dosis de Formoterol STADA 12 pg polvo para inhalación. Se debe realizar un control gradual del paciente durante la reducción de la dosis. Se debe utilizar la dosis efectiva más baja de Formoterol STADA 12 pg polvo para inhalación.
Aunque Formoterol STADA 12 pg polvo para inhalación puede ser introducido como terapia concomitante cuando los corticosteroides inhalados no proporcionan un control adecuado de los síntomas del asma, los pacientes no deben iniciar el tratamiento con Formoterol STADA 12 pg polvo para inhalación durante una exacerbación severa del asma, o en caso de un empeoramiento significativo o un deterioramiento agudo del asma.
Los datos de los estudios clínicos sugieren que los pacientes pueden encontrarse al inicio del tratamiento con Formoterol STADA 12 pg polvo para inhalación ante un riesgo de sufrir efectos adversos relacionados con el asma así como exacerbaciones. Los pacientes deberán consultar al médico la necesidad de continuar el tratamiento en caso de que los síntomas del asma permanezcan incontrolados o empeoren tras la inhalación de Formoterol STADA 12 pg polvo para inhalación.
Los pacientes no deberán interrumpir la terapia antiinflamatoria tras la introducción de formoterol, aunque mejoren los síntomas. La persistencia de síntomas o la necesidad de aumentar la dosis de formoterol para controlarlos suelen ser indicativos de un empeoramiento de la afección subyacente y justifica un replanteamiento de la terapia.
Condiciones concomitantes:
Se han comunicado casos mortales con el uso excesivo de preparados que contenían estimulantes P-adrenérgicos, aunque se desconoce su causa exacta. En varios casos se registró paro cardíaco.
Por este motivo se hará saber al paciente la importancia de seguir estrictamente las recomendaciones posológicas, sin sobrepasar la dosis máxima tolerada.
Los pacientes que reciban formoterol serán vigilados estrechamente, sobre todo en lo relativo al rango de dosis, en los siguientes casos (ver también “Contraindicaciones”):
- Cardiopatía isquémica,
- Infarto de miocardio,
- Hipertensión grave,
- Arritmias cardíacas,
- Insuficiencia cardíaca grave.
Hipopotasemia:
El tratamiento con agonistas P2 puede originar una hipopotasemia potencialmente grave. Se recomienda especial precaución en caso de asma grave, ya que este efecto puede ser potenciado por tratamientos concomitantes (ver “Interacción con otros medicamentos y otras formas de interacción”) y por hipoxia. En tales situaciones se recomienda controlar los niveles de potasio sérico.
Broncospasmo paradójico:
Al igual que con otros tratamientos por inhalación, se tendrá presente la posibilidad de un broncospasmo paradójico; en tal caso, se retirará inmediatamente el preparado y se instituirá una medicación alternativa. Debido al efecto hiperglucémico de los estimulantes P2, en pacientes diabéticos se recomiendan controles de glucosa en sangre.
Uso en niños:
Formoterol no está recomendado en niños menores de 6 años, debido a la limitada experiencia en este grupo de edad.
Esta especialidad contiene lactosa y aunque se han descrito casos de intolerancia en niños y adolescentes, la cantidad presente en el preparado no es probablemente suficiente para provocarla.
Información importante sobre algunos de los componentes de este medicamento
Los pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Fármacos tales como quinidina, disopiramida, procainamida, fenotiazinas, antihistamínicos y antidepresivos tricíclicos pueden estar asociados a una prolongación del intervalo QT y a un aumento del riesgo de arritmias ventriculares (ver “Advertencias y precauciones especiales de empleo”).
La administración adicional de agentes simpaticomiméticos puede potenciar las reacciones cardiovasculares.
Formoterol se administrará con precaución a los pacientes que estén siendo tratados con inhibidores de la MAO o con antidepresivos tricíclicos, ya que puede potenciarse la acción de los estimulantes P2-adrenérgicos sobre el sistema cardiovascular.
El tratamiento concomitante con derivados de la xantina, esteroides o diuréticos puede potenciar un posible efecto hipopotasémico de los agonistas P2. La hipopotasemia puede incrementar la susceptibilidad a las arritmias cardíacas en pacientes tratados con digital (ver “Advertencias y precauciones especiales de empleo”). Los bloqueantes P-adrenérgicos pueden debilitar o antagonizar el efecto de formoterol, por lo que no deberían darse P-bloqueantes (incluidos colirios) con formoterol a no ser que no exista otra alternativa.
4.6 Fertilidad, embarazo y lactancia Uso en el embarazo:
No se ha establecido todavía la seguridad de formoterol durante el embarazo y la lactancia. No se utilizará durante la gestación a menos que no se disponga de otra alternativa más segura. Al igual que con otros
estimulantes p2-adrenérgicos, puede verse inhibido el parto debido al efecto relajante sobre la musculatura lisa uterina.
Lactancia
Se desconoce si el formoterol pasa a la leche materna. Se ha detectado sustancia activa en ratas lactantes. Por este motivo se valorarán cuidadosamente en cada caso los beneficios frente a los riesgos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
El paciente deberá ser informado sobre la posibilidad de que pueda verse limitada su capacidad para conducir vehículos o manejar máquinas debido a la aparición de efectos indeseables como temblor o agitación.
4.8 Reacciones adversas
Sistema musculoesquelético:
Ocasionales: temblor.
Raros: calambres musculares, mialgia.
Sistema cardiovascular:
Ocasionales: palpitaciones.
Raros: taquicardia.
Sistema nervioso central:
Ocasionales: cefalea.
Raros: agitación, mareo, ansiedad, nerviosismo, insomnio, vértigo.
Tracto respiratorio:
Raros: empeoramiento del broncospasmo (ver “Advertencias y precauciones especiales de empleo”), sequedad de boca.
Irritación local:
Raros: irritación orofaríngea.
Otros:
Casos aislados: reacciones de hipersensibilidad, como hipotensión severa, urticaria, angioedema, prurito, exantema. Edema periférico, alteraciones del gusto, náuseas, irritación de la conjuntiva y edema del párpado.
4.9 Sobredosis Síntomas:
La sobredosificación probablemente producirá los efectos típicos de los estimulantes P2- adrenérgicos: náuseas, vómitos, cefalea, temblor, somnolencia, palpitaciones, taquicardia, arritmias ventriculares, acidosis metabólica, hipopotasemia, hiperglucemia.
Tratamiento:
En caso de sobredosificación con formoterol se suspenderá inmediatamente el tratamiento y se efectuará una terapia de apoyo y sintomática. En casos graves deberá procederse a la hospitalización.
Puede considerarse la posibilidad de utilizar el P-bloqueante cardioselectivo con extrema precaución, ya que existe el riesgo de provocar un broncospasmo.
En caso de sobredosis o ingestión accidental, consultar al Servicio de Información Toxicológica.
Teléfono 91 562 04 20.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Formoterol fumarato es un estimulante selectivo ®2-adrenérgico. En pacientes con obstrucción reversible de las vías respiratorias, ejerce un efecto broncodilatador de rápida instauración (1 - 3 min) que perdura de forma todavía significativa a las 12 horas de la inhalación. A dosis terapéuticas los efectos cardiovasculares son mínimos y ocurren sólo ocasionalmente.
Formoterol inhibe la liberación de histamina y leucotrienos del pulmón humano sensibilizado pasivamente. En experimentación animal se han observado algunas propiedades antiinflamatorias tales como la inhibición del edema y de la acumulación celular inflamatoria.
En el hombre, formoterol ha demostrado ser eficaz en la prevención del broncospasmo inducido por los alergenos inhalados, ejercicio, aire frío, histamina o estimulación con metacolina.
5.2 Propiedades farmacocinéticas
Absorción
Tal como se ha descrito para otros fármacos administrados por inhalación, aproximadamente un 90% del formoterol administrado mediante inhalador es ingerido y más tarde absorbido a partir del tracto gastrointestinal. Por tanto, las características farmacocinéticas de la formulación oral de formoterol son en gran parte aplicables a la formulación en polvo.
Dosis orales de hasta 300 pg de formoterol fumarato se absorben rápidamente desde el tracto gastrointestinal. La sustancia inalterada alcanza la Cmáx en plasma en 0,5 - 1 horas. El grado de absorción de una dosis oral de 80 pg es igual o superior al 65%.
La farmacocinética de formoterol parece ser lineal en el margen de dosis orales investigado, es decir, de 20 a 300 pg. La administración oral repetida de 40 a 160 pg por día no da lugar a acumulación significativa del fármaco en el organismo. Tras la inhalación de dosis terapéuticas, formoterol no puede detectarse en plasma utilizando los métodos analíticos actualmente disponibles. Sin embargo, de las velocidades de excreción urinaria se deduce una rápida absorción tras la inhalación. La velocidad máxima de excreción tras la administración de 12 - 96 pg se alcanza como máximo al cabo de 1 - 2 horas.
La excreción urinaria acumulativa de formoterol tras la administración del polvo para inhalación (12 - 24 pg) y de dos formulaciones en aerosol (12 - 96 pg) mostró que la cantidad de formoterol disponible en la circulación aumenta proporcionalmente con la dosis.
Distribución
La fijación a proteínas plasmáticas asciende al 61 - 64% (34% principalmente a albúmina) y no se produce saturación de los lugares de unión en el rango de concentraciones alcanzado con dosis terapéuticas.
Metabolismo o Biotransformación
Formoterol se elimina principalmente por metabolismo, siendo la glucuronización directa de la molécula la principal vía. Otra vía metabólica es la O-desmetilación seguida de glucuronización.
Excreción:
La eliminación del formoterol parece ser polifásica, la semivida aparente depende del intervalo de tiempo considerado. En base a las concentraciones plasmáticas o sanguíneas a las 6, 8 o 12 horas tras administración oral, se determinó una semivida de unas 2 - 3 horas. De las velocidades de excreción urinaria entre 3 y 16 horas tras la inhalación, se calculó una semivida de aproximadamente 5 horas.
Tanto el principio activo como sus metabolitos se excretan completamente del organismo, aproximadamente dos tercios de una dosis oral aparecen en orina y un tercio en heces. Tras la inhalación, aproximadamente un 6 - 9% de la dosis en promedio se excreta inalterada en orina.
El aclaramiento renal del formoterol es de 150 ml/min.
5.3 Datos preclínicos sobre seguridad Mutagénesis:
Se han llevado a cabo ensayos de mutagenicidad que cubrían un amplio número de variables finales experimentales. No se encontraron efectos genotóxicos en ninguno de los ensayos in vitro e in vivo efectuados.
Cancerogénesis:
De los resultados de los estudios de dos años de duración en ratas y ratones se concluye que formoterol no tiene potencial cancerogénico.
Si bien ratones macho tratados con dosis muy elevadas mostraron una incidencia ligeramente superior de tumores benignos de las células subcapsulares adrenales, estos tumores se consideran resultado de alteraciones en el proceso fisiológico de envejecimiento.
Los dos estudios en ratas cubrían diferentes rangos de dosis y mostraron un aumento de leiomiomas mesováricos. Estos neoplasmas benignos están típicamente asociados a tratamientos de larga duración en ratas con dosis elevadas de fármacos p2-adrenérgicos. También se observó un aumento en la incidencia de quistes ováricos y tumores benignos de las células de la granulosa/teca; sin embargo, los efectos de los agonistas P sobre el ovario de ratas son también conocidos y muy probablemente específicos de roedores. En uno de los estudios se observaron otros tipos de tumores con las dosis más altas, aunque con la misma incidencia que la de la población histórica de control. Estos tumores no aparecieron con dosis más bajas.
En el otro estudio, el aumento en la incidencia de tumores no fue estadísticamente significativo en ningún caso en el grupo de dosis más baja, dosis que daba lugar a una exposición sistémica unas 10 veces superior a la esperada con la dosis máxima de formoterol recomendada en el hombre.
En vista de ello y de la ausencia de efecto mutagénico, se considera que el uso terapéutico de formoterol no presenta riesgo cancerogénico.
Estudios de reproducción:
Las pruebas con animales no han mostrado efectos teratógenos; después de la administración oral, formoterol se excretó en la leche de ratas lactantes.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Lactosa monohidrato semi-micronizada, lactosa monohidrato micronizada, gelatina.
6.2 Incompatibilidades No se conocen.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C Proteger del calor y de la humedad.
6.5 Naturaleza y contenido del envase
Blíster de PVC+PVDC/Aluminio.
Blíster con 60 cápsulas + dispositivo para inhalación. Inhalador CE.
El dispositivo para inhalación se halla en conformidad con la Directiva 93/42/CEE.
6.6 Precauciones especiales de eliminación
Para asegurar la administración correcta del fármaco, el paciente debe ser instruido por el médico u otro profesional sanitario en el manejo del inhalador.
Las cápsulas deben ser retiradas del blíster sólo inmediatamente antes de su uso.
Manejo del inhalador:
1. Quitar el capuchón protector.
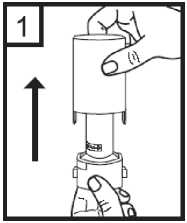
2. Para abrir, sujetar firmemente la base del inhalador y girar la boquilla en la dirección de la flecha.
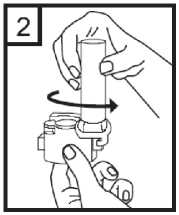
3. Colocar la cápsula en el compartimento en la base del inhalador. Es importante retirar la cápsula del envase blíster sólo antes de su utilización.
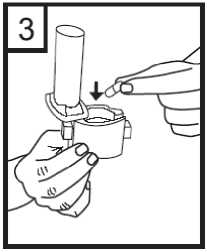
4. Girar la boquilla hasta la posición de cierre.
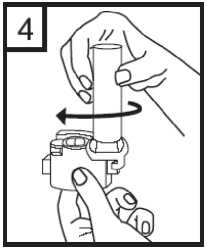
5. Apretar los botones rojos manteniendo el inhalador en posición vertical. Soltar los botones.
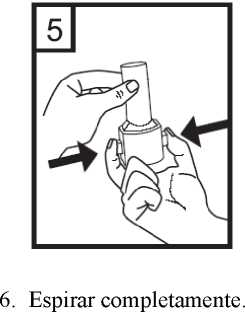
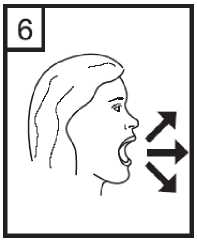
7. Colocar la boquilla en la boca e inclinar ligeramente la cabeza hacia atrás. Apretar los labios sobre la boquilla y respirar de manera rápida pero constante con la mayor profundidad posible.
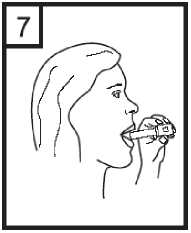
8. Retener la respiración tanto como se pueda sin sentir molestia mientras se extrae el inhalador de la boca. Seguidamente espirar el aire. Abrir el inhalador para ver si queda polvo en la cápsula. Si es así, se repetirán los pasos 6 a 8.
9. Después del uso, extraer la cápsula vacía, cerrar la boquilla y volver a colocar el capuchón.
Limpieza del inhalador:
Para eliminar el polvillo residual, limpiar la boquilla y el compartimento de la cápsula con un paño seco. También puede usarse un cepillo blando limpio.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratorio STADA, S.L.
Frederic Mompou, 5
08960 Sant Just Desvern (Barcelona)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
FORMOTEROL STADA 12 fg polvo para inhalación. N° Registro: 66.573
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
10. FECHA DE LA REVISIÓN DEL TEXTO
Julio de 2007
9 de 9