Formatris Novolizer 12 Microgramos/Dosis, Polvo Para Inhalacion
•4^
sm
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Formatris Novolizer 12 microgramos/dosis polvo para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Composición cualitativa y cuantitativa
Cada dosis medida contiene 12 microgramos de fumarato de formoterol dihidrato (lo que se corresponde con una dosis liberada por la boquilla de 10,2 microgramos de fumarato de formoterol dihidrato, equivalente a 8,36 microgramos de formoterol).
Excipiente(s) con efecto conocido
Para consultar la lista completa de excipientes, ver sección 6.1
3. FORMA FARMACÉUTICA
Polvo para inhalación.
Polvo blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Formatris Novolizer 12 microgramos está indicado en adultos, adolescentes y niños de 6 a 12 años.
Formatris Novolizer 12 microgramos está indicado para el tratamiento sintomático a largo plazo del asma persistente, de moderado a severo, en pacientes que requieren terapia regular con agonistas P2 de larga acción en combinación con terapia antiinflamatoria inhalada (con o sin glucocorticoides orales). La terapia con glucocorticoides se debe continuar de forma regular.
Formatris Novolizer 12 microgramos está indicado también para el alivio de los síntomas de obstrucción bronquial en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) que requiere terapia de broncodilatación de acción prolongada.
4.2 Posología y forma de administración
Vía inhalatoria.
El uso de dosis superiores a las que normalmente necesita un paciente, en más de 2 días por semana, indica un control insuficiente de la enfermedad y se deberá reevaluar el tratamiento de mantenimiento.
Asma
Adultos (incluidas personas de edad avanzada) y adolescentes mayores de 12 años de edad
Terapia de Mantenimiento Regular:
rj$k
1 inhalación (12 microgramos) administrada dos veces al día. En caso de una enfermedad más grave, este régimen de dosificación se puede incrementar a 2 inhalaciones (24 microgramos) administradas dos veces al día.
La dosis diaria máxima es de 4 inhalaciones (2 inhalaciones administradas dos veces al día) correspondientes a 48 microgramos.
Población pediátrica
Niños de 6 o más años de edad
Terapia de Mantenimiento Regular:
1 inhalación (12 microgramos) administrada dos veces al día. En caso de una enfermedad más grave, este régimen de dosificación se puede incrementar a 2 inhalaciones (24 microgramos) administradas dos veces al día, pero sólo tras la evaluación de un médico.
La dosis diaria habitual no debe exceder de 2 inhalaciones (24 microgramos), si bien en ocasiones se puede permitir un máximo de 4 inhalaciones (correspondientes a 48 microgramos) en un periodo de 24 horas.
Niños menores de 6 años
Formatris Novolizer no está recomendado para niños menores de 6 años, dado que no se dispone de experiencia suficiente para este grupo de edad.
EPOC
Adultos (incluidas personas de edad avanzada) y adolescentes mayores de 12 años de edad
Dosis habitual: 1 inhalación (12 microgramos) dos veces al día.
La dosis diaria habitual no debe exceder de 2 inhalaciones (24 microgramos).
Si es necesario, se pueden utilizar inhalaciones adicionales a las prescritas en la terapia habitual para el alivio de los síntomas, hasta una dosis diaria total máxima de 4 inhalaciones, correspondientes a 48 microgramos (habitual más inhalaciones necesarias). No deben realizarse más de 2 inhalaciones por sesión.
El uso de formoterol está indicado en aquellos pacientes que están recibiendo corticosteroides inhalados y necesitan un tratamiento sintomático adicional del asma además de los corticosteroides inhalados.
Aunque formoterol presenta un rápido inicio de acción, los broncodilatadores inhalados de acción prolongada (como formoterol) se deben utilizar sólo para la terapia broncodilatadora de mantenimiento.
.<3f.
" lili ~ ~~
sm
Formoterol no está destinado para el alivio de ataques agudos de asma. En caso de un ataque agudo, se debe utilizar un agonista P2 de acción corta.
Se debe advertir a los pacientes de que no interrumpan o cambien su terapia con esteroides cuando se introduzca el uso de Formatris Novolizer.
Personas de edad avanzada y pacientes con insuficiencia renal o hepática
A las dosis normales recomendadas, no debe ser necesario ajustar la dosis en pacientes de edad avanzada, o en pacientes con trastornos renales o hepáticos. (Ver sección 4.4)
Forma de administración
Con el fin de garantizar que la sustancia activa alcance de forma óptima el lugar previsto de acción, es necesario realizar una inhalación constante, profunda y lo más rápida posible (hasta la inhalación máxima). Un “clic” claramente audible y un cambio de color en la ventana de control indican que la inhalación se ha realizado correctamente. Si no se escucha un “clic” y no se produce un cambio de color en la ventana de control, la inhalación se debe repetir. El inhalador permanece bloqueado hasta que la inhalación se efectúe de manera correcta.
USO Y MANEJO DE NOVOLIZER
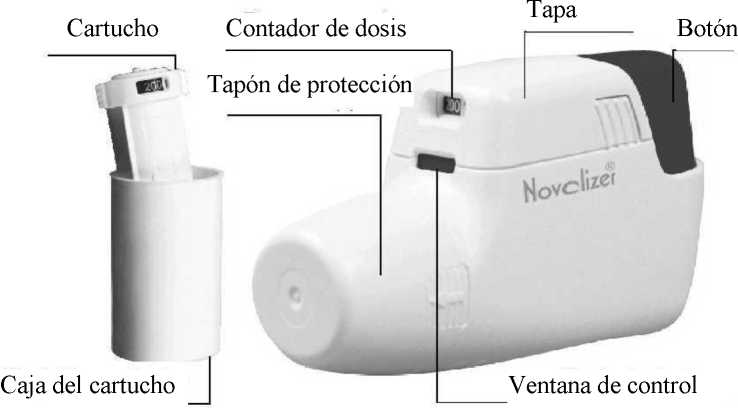
Recambio
1. Presione ligeramente las superficies onduladas a ambos lados de la tapa deslizante, desplácela hacia adelante y levántela.
2. Retire la lámina protectora de aluminio de la caja del cartucho y extraiga el nuevo cartucho.
•4^
am
3. Inserte el cartucho en el Novolizer con el contador de dosis orientado hacia la boquilla.
4. Vuelva a colocar la tapa entre las guías laterales desde arriba y presione hacia abajo, hacia el botón dosificador hasta que encaje en su sitio. El cartucho se puede dejar en el Novolizer hasta su consumo total, o hasta 6 meses después de su inserción.
Nota: Los cartuchos de Formatris Novolizer 12 microgramos sólo se deben utilizar con el inhalador de polvo Novolizer.
Utilización
1. Siempre que sea posible, permanezca sentado o de pie mientras inhala. Cuando utilice el Novolizer, manténgalo siempre en posición horizontal. En primer lugar, retire el tapón protector.
2. Presione por completo el botón dosificador coloreado. Se oirá un sonoro doble “clic” y el color de la ventana de control (inferior) cambiará de rojo a verde. Entonces, suelte el botón coloreado. El color verde en la ventana indica que el Novolizer está listo para ser utilizado.
3. Exhale lo máximo posible (pero no en el inhalador de polvo).
4. Coloque los labios alrededor de la boquilla, inhale el polvo con una profunda inspiración. Durante esta inspiración, se deberá oír un sonoro “clic”, que indica una inhalación correcta. Contenga la respiración durante algunos segundos y, a continuación, continúe respirando normalmente.
Nota: Si el paciente necesita más de 1 inhalación cada vez, se deberán repetir los pasos 2-4.
5. Vuelva a colocar el tapón de protección en la boquilla - el procedimiento de inhalación ha finalizado.
6. El número que aparece en la ventana superior indica el número de inhalaciones que quedan.
Nota: El botón dosificador de color sólo se debe presionar inmediatamente antes de la inhalación.
Con el Novolizer no es posible que se produzca una doble inhalación por error. El sonido del “clic” y el cambio de color en la ventana de control indican que la inhalación se ha realizado correctamente. Si el color de la ventana de control no cambia, se deberá repetir la inhalación. Si la inhalación no se realiza correctamente después de varios intentos, el paciente deberá consultar a su médico.
Limpieza
El Novolizer se debe limpiar a intervalos regulares, pero al menos, cada vez que se cambie el cartucho. En el prospecto se incluyen las instrucciones de limpieza del dispositivo.
Nota: Con el fin de garantizar el uso correcto del inhalador, los pacientes deben recibir instrucciones detalladas sobre la forma de utilizar el dispositivo. Los niños sólo deben utilizar este producto bajo la supervisión de un adulto.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, formoterol, o al excipiente lactosa.
4.4 Advertencias y precauciones especiales de empleo
Formatris Novolizer 12 microgramos no se debe usar (y tampoco resulta suficiente) como primer tratamiento del asma.
Los pacientes asmáticos que requieren tratamiento con agonistas P2 de larga acción, deberán recibir también terapia antiinflamatoria de mantenimiento óptima con corticosteroides. Se debe recomendar a los pacientes que continúen tomando su terapia antiinflamatoria y se les debe decir que no disminuyan, sin prescripción médica, la dosis de la terapia antiinflamatoria tras la introducción de formoterol, incluso cuando los síntomas mejoren. Si los síntomas persisten, empeoran o aumenta el número de dosis de agonistas P2 necesario para controlar los síntomas, significa un empeoramiento del trastorno subyacente, y se debe aconsejar al paciente que se ponga en contacto con su médico para una reevaluación del asma y su tratamiento.
Aunque Formatris Novolizer 12 microgramos se puede introducir como terapia adicional cuando los corticosteroides inhalados no produzcan un control adecuado de los síntomas del asma, el inicio del tratamiento con Formatris Novolizer 12 microgramos no debe llevarse a cabo durante una exacerbación aguda del asma, ni si el paciente sufre un agravamiento importante o un deterioro agudo de su asma.
Durante el tratamiento con Formatris Novolizer 12 microgramos pueden producirse graves acontecimientos adversos y exacerbaciones relacionados con el asma. Se debe pedir a los pacientes que continúen el tratamiento, pero que soliciten ayuda médica si los síntomas de asma permanecen sin control o se agravan tras el inicio de la administración de Formatris Novolizer 12 microgramos.
Una vez controlados los síntomas del asma, se debe considerar la posibilidad de reducir gradualmente la dosis de Formatris Novolizer 12 microgramos. Durante la readaptación del tratamiento, es importante mantener un control regular del estado de los pacientes. Se deberá utilizar la dosis eficaz mínima de Formatris Novolizer 12 microgramos.
Formoterol se debe utilizar únicamente en pacientes que requieran tratamiento con broncodilatadores de larga acción (ver sección 4.1) y no debe ser utilizado, en caso de un ataque agudo, como alternativa a los agonistas P2 de corta acción. En el caso de un ataque agudo, se debe utilizar un agonista P2 de corta acción.
No se debe superar la dosis diaria máxima. No se ha establecido la seguridad a largo plazo del tratamiento regular con dosis superiores a 4 inhalaciones al día en adultos con asma, 2 inhalaciones diarias en niños con asma y 2 inhalaciones al día en pacientes con EPOC.
La necesidad frecuente de medicación para la prevención de la broncoconstricción inducida por el ejercicio (BIE) puede ser signo de un control insuficiente del asma, lo que requiere una reevaluación del tratamiento del asma y una valoración del cumplimiento. Si el paciente requiere tratamiento preventivo de la BIE varias veces a la semana, a pesar de un adecuado tratamiento de mantenimiento (por ejemplo, corticosteroides y agonistas P2 de acción prolongada), el especialista deberá reevaluar el tratamiento total del asma.
Se debe tener precaución con el tratamiento de pacientes con tirotoxicosis, feocromocitoma, cardiomiopatía obstructiva hipertrófica, estenosis subvalvular aórtica idiopática, hipertensión grave, aneurisma u otros trastornos cardiovasculares graves tales como cardiopatía isquémica, taquiarritmias, especialmente, bloqueo aurículo-ventricular de tercer grado, o insuficiencia cardiaca grave. Se puede considerar un ajuste de la dosis de formoterol.
Formoterol puede inducir una prolongación del intervalo QTc. Se debe tener precaución durante el tratamiento de pacientes con una prolongación del intervalo QTc (ver sección 4.5).
Debido al efecto hiperglucémico de los agonistas P2, se recomienda inicialmente la realización de una monitorización adicional de glucosa en sangre en pacientes diabéticos.
La terapia con agonistas P2 puede dar como resultado una hipopotasemia potencialmente grave. Se recomienda especial precaución en el asma grave aguda, ya que el riesgo asociado puede verse aumentado por la hipoxia. El efecto hipopotasémico puede estar potenciado por el tratamiento concomitante con derivados de xantina, esteroides y diuréticos. Por consiguiente, se deben monitorizar los niveles séricos de potasio. Se recomienda especial precaución si se utilizan conjuntamente teofilina y formoterol en pacientes con una cardiopatía preexistente.
Al igual que con otras terapias de inhalación existe un riesgo de broncoespasmo paradójico, Si éste se produce, el paciente experimentará un incremento inmediato de las sibilancias y de la falta de aliento después de la administración, que se debe tratar de inmediato con un broncodilatador inhalado de acción rápida. Se debe interrumpir inmediatamente el uso de Formatris Novolizer, el paciente debe ser evaluado y, en caso necesario, iniciar una terapia alternativa.
Formatris Novolizer 12 microgramos contiene 11,488 mg de lactosa por dosis unitaria. Normalmente, esta cantidad no provoca problemas en personas con intolerancia a la lactosa. La lactosa puede contener pequeñas cantidades de proteínas de la leche.
Los niños menores de 6 años de edad no se deben tratar con formoterol, puesto que no se dispone de experiencia suficiente para este grupo de edad.
Se desconoce el efecto de una disminución de la función hepática o renal sobre la farmacocinética de formoterol, así como la farmacocinética en el anciano. Dado que formoterol se elimina principalmente por vía metabólica, cabe esperar un incremento de la exposición en pacientes con cirrosis hepática grave.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción con Formatris Novolizer.
El tratamiento concomitante con otras sustancias simpaticomiméticas, tales como otros agonistas P2 o efedrina, puede potenciar los efectos adversos de formoterol, y puede ser necesario ajustar la dosis.
El tratamiento concomitante con derivados de xantina, esteroides o diuréticos, tales como tiazidas y diuréticos de asa, puede potenciar un posible efecto hipopotasémico de los agonistas P2. La hipopotasemia puede aumentar la predisposición a sufrir arritmias en pacientes tratados con glucósidos de digital.
El uso concomitante con corticosteroides orales podría aumentar los efectos hiperglucémicos.
Existe un riesgo teórico de que el tratamiento concomitante con otros medicamentos que prolongan el intervalo QTc pueda dar lugar a una interacción farmacodinámica con formoterol y aumente el posible riesgo de arritmias ventriculares. Ejemplos de estos medicamentos incluyen ciertos antihistamínicos (por ejemplo, terfenadina, astemizol, mizolastina), ciertos antiarrítmicos (por ejemplo, quinidina, disopiramida, procainamida), fenotiazidas, eritromicina y antidepresivos tricíclicos.
La administración de formoterol a pacientes bajo tratamiento con inhibidores de la monoamino oxidasa (o que hayan sido tratados con ellos durante los 14 días anteriores), o antidepresivos tricíclicos se debe efectuar con precaución, dado que se puede potenciar la acción de los estimulantes P2-adrenérgicos sobre el sistema cardiovascular.
Adicionalmente, L-Dopa, L-tiroxina, oxitocina y el alcohol pueden alterar la tolerancia cardiaca frente a los simpaticomiméticos P2.
Existe un elevado riesgo de arritmias en pacientes que reciben anestesia concomitante con hidrocarburos halogenados.
Los bloqueantes beta-adrenérgicos pueden reducir o inhibir el efecto de formoterol. Por lo tanto, no se debe administrar formoterol junto con bloqueantes beta-adrenérgicos (incluyendo colirios), a menos que existan razones convincentes.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de formoterol en mujeres embarazadas. En estudios con animales formoterol ha causado pérdidas de implantación, así como disminución de la supervivencia posnatal temprana y del peso al nacer. Los efectos aparecieron con exposiciones sistémicas mucho más elevadas que las alcanzadas durante el uso clínico de formoterol. El tratamiento con formoterol puede ser considerado en todas las etapas del embarazo, si es necesario obtener el control del asma, y si el beneficio esperado para la madre es mayor que cualquier posible riesgo para el feto. El riesgo potencial en humanos es desconocido.
•4^
sm
Lactancia
No se sabe si el formoterol pasa a la leche materna. En ratas, pequeñas cantidades de formoterol se han detectado en la leche materna. La administración de formoterol a mujeres en periodo de lactancia sólo debe considerarse si el beneficio esperado para la madre es mayor que cualquier posible riesgo para el niño.
Fertilidad
Sólo hay datos limitados con respecto a la fertilidad (ver sección 5.3). Los estudios de reproducción en ratas no revelaron ninguna alteración de la fertilidad con dosis orales de hasta 3 mg / kg (aproximadamente
1.000 veces la dosis de inhalación diaria recomendada en humanos de 24 pg sobre una base de mg/m2).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Formoterol tiene una influencia nula o insignificante sobre la capacidad para conducir o utilizar máquinas.
4.8 Reacciones adversas
Los efectos adversos más frecuentemente comunicados de la terapia con agonistas P2, tales como temblor y palpitaciones, tienden a ser leves y desaparecen al cabo de pocos días de tratamiento.
Las reacciones adversas que han sido asociadas con formoterol se indican a continuación clasificadas por órganos del sistema y frecuencia. Las frecuencias se definen como:
Muy frecuentes (> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (> 1/10.000 a < 1/1.000); Muy raras (< 1/10.000); Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
|
Órganos del sistema |
Frecuencia |
Reacción adversa |
|
Trastornos del sistema inmunológico |
Raras |
Reacciones de hipersensibilidad, por ejemplo, broncoespasmo, exantema, urticaria, prurito, angioedema |
|
Trastornos del metabolismo y de la nutrición |
Raras |
Hipopotasemia/hiperpotasemia |
|
Muy raras |
Hiperglucemia | |
|
Trastornos psiquiátricos |
Poco frecuentes |
Agitación, inquietud, alteraciones del sueño |
|
Trastornos del sistema nervioso |
Frecuentes |
Cefaleas, temblores |
|
Raras |
Nerviosismo | |
|
Muy raras |
Alteraciones del gusto, mareos | |
|
Trastornos cardíacos |
Frecuentes |
Palpitaciones |
|
Poco f frecuentes |
Taquicardia | |
|
Raras |
Arritmias cardíacas, por ejemplo, fibrilación auricular, taquicardia supraventricular, extrasístoles | |
|
Muy raras |
Angina de pecho, prolongación del intervalo QTc | |
|
Trastornos vasculares |
Muy raras |
Variaciones de la tensión arterial |
|
Trastornos respiratorios, torácicos y mediastínicos |
Poco frecuentes |
Irritación orofaríngea |
'p'
sm
|
Órganos del sistema |
Frecuencia |
Reacción adversa |
|
Trastornos gastrointestinales |
Raras |
Náuseas |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes |
Calambres musculares |
Al igual que con todas las terapias de inhalación, puede producirse broncoespasmo paradójico en casos aislados.
El tratamiento con agonistas P2 puede tener como consecuencia un incremento de los niveles en sangre de insulina, ácidos grasos libres, glicerol y cuerpos cetónicos.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
La experiencia clínica en el tratamiento de la sobredosis es limitada. Probablemente, una sobredosis daría lugar a los efectos característicos de los agonistas P2: temblor, cefalea, palpitaciones. Los síntomas comunicados de casos aislados son taquicardia, hiperglucemia, hipopotasemia, prolongación del intervalo QTc, arritmia, náuseas y vómitos. Está indicado tratamiento de apoyo y sintomático.
Se puede considerar el uso de beta-bloqueantes cardio-selectivos, pero sólo bajo estrictas precauciones, puesto que el uso de medicación bloqueadora p-adrenérgica puede provocar broncoespasmo. Se deben monitorizar los niveles de potasio en suero.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: agonista P2 selectivo, formoterol Código ATC: R03AC13
Formoterol es un agonista selectivo P2-adrenérgico, que produce relajación del músculo liso bronquial. Por lo tanto, formoterol ejerce un efecto broncodilatador en pacientes con obstrucción reversible de las vías respiratorias. El efecto broncodilatador se establece rápidamente, entre 1 y 3 minutos después de la inhalación, y tiene una duración media de 12 horas tras una dosis unitaria.
.<gp.
5.2 Propiedades farmacocinéticas
Absorción
Formoterol inhalado se absorbe rápidamente. El pico de concentración plasmático se alcanza aproximadamente 10 minutos después de la inhalación.
Estudios clínicos han señalado que el depósito pulmonar de formoterol tras la inhalación a través de Novolizer se encuentra dentro del rango de otros productos inhaladores que contienen formoterol.
Distribución
La fijación a proteínas plasmáticas es de aproximadamente 50%.
Formoterol se metaboliza por glucuronización directa y O-demetilación. No se ha identificado la enzima responsable de la O-demetilación. No se han determinado el aclaramiento plasmático total ni el volumen de distribución.
Eliminación
La mayor parte de la dosis de formoterol se elimina a través del metabolismo. Tras la inhalación con un dispositivo similar para la inhalación de polvo, se excretó 8-13% de la dosis liberada de formoterol sin metabolizar en la orina. Alrededor del 20% de una dosis intravenosa se excreta inalterado en la orina. La semivida terminal tras la inhalación se ha estimado en 8 horas.
5.3 Datos preclínicos sobre seguridad
Los efectos de formoterol observados en los estudios de toxicidad en ratas y perros afectaron principalmente al sistema cardiovascular, y consistieron en hiperemia, taquicardia, arritmias y lesiones del miocardio. Estos efectos son manifestaciones farmacológicas conocidas, observadas tras la administración de dosis elevadas de agonistas P2.
En estudios animales, formoterol ha provocado pérdidas de implantación, así como una reducción de la supervivencia postnatal precoz y del peso al nacer. Los efectos aparecieron con exposiciones sistémicas considerablemente superiores a las que se alcanzan durante el uso clínico de formoterol. Tras una exposición sistémica alta a formoterol, se registró una fertilidad algo reducida en ratas machos.
No se han registrado efectos genotóxicos del formoterol en ensayos in vitro o in vivo. En ratas y ratones se ha observado un ligero aumento de la incidencia de leiomiomas uterinos benignos. Este efecto se considera efecto de clase, observado en roedores tras una exposición prolongada a dosis altas de agonistas P2.
6 . DATOS FARMACÉUTICOS 6.1 Lista de excipientes
Lactosa monohidrato
.<gp.
6.2 Incompatibilidades No aplicable.
6.3 Periodo de validez
• Formatris Novolizer 12 microgramos
Período de validez del medicamento envasado para su venta: 3 años
Período de validez después de la primera apertura del envase del cartucho: 6 meses
• Dispositivo Novolizer
Período de validez antes de la primera utilización: 4 años Período de validez durante la utilización: 1 año
Nota: Se ha demostrado el funcionamiento del dispositivo Novolizer en ensayos para 2000 dosis medidas. No se espera que se supere esta cantidad de dosis medidas durante un año con la dosificación normal.
6.4 Precauciones especiales de conservación
Conservar en el embalaje original.
Después de la primera apertura del cilindro del cartucho: Conservar por debajo de 25°C. Conservar protegido de la humedad.
6.5 Naturaleza y contenido del envase
El inhalador (boquilla) está fabricado de polietileno y el cartucho es de poliestirol.
Tamaños de envase:
1 inhalador de polvo y 1 cartucho (poliestireno / polipropileno) con al menos 60 inhalaciones.
1 inhalador de polvo y 2 cartuchos (poliestireno / polipropileno) con al menos 60 inhalaciones.
Envases de recambio:
1 cartucho (poliestireno / polipropileno) con al menos 60 inhalaciones
2 cartuchos (poliestireno / polipropileno) con al menos 60 inhalaciones cada uno
3 cartuchos (poliestireno / polipropileno) con al menos 60 inhalaciones cada uno
Envases para el hospital:
Envase con 10 unidades de (1 inhalador de polvo y 1 cartucho (poliestireno / polipropileno) con al menos 60 inhalaciones)
“Puede que sólo estén comercializados algunos tamaños de envase”
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna en especial
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
MEDA Pharma, S.L.
rj$k
an
Avda. de Castilla, 2 , Edif. Berlín 2a planta 28830 San Fernando de Henares (Madrid)-España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
68063
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Octubre 2006
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2014
12 de 12