Fluticasona Cipla 125 Microgramos/Inhalacion Suspension Para Inhalacion En Envase A Presion
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Fluticasona Cipla 125 microgramos/inhalación suspensión para inhalación en envase a presión.
Fluticasona Cipla 250 microgramos/inhalación suspensión para inhalación en envase a presión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada dosis medida contiene 125 ó 250 microgramos de propionato de fluticasona, lo que equivale a una dosis emitida de 110 microgramos ó 227 microgramos de propionato de fluticasona respectivamente.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión para inhalación en envase a presión.
El inhalador está compuesto por un cartucho de aleación de aluminio, sellado con una válvula dosificadora, un aplicador y una capucha para la boquilla.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Fluticasona Cipla está indicado en el tratamiento de mantenimiento del asma persistente como tratamiento preventivo.
Fluticasona Cipla no debe emplearse en el alivio rápido del broncoespasmo.
Fluticasona Cipla está indicado en adultos y adolescentes mayores de 16 años.
4.2 Posología y forma de administración
Fluticasona Cipla está indicado únicamente para inhalación por vía oral.
con Fluticasona y de la
Se debe advertir a los pacientes de la naturaleza profiláctica del tratamiento necesidad de que lo usen de forma regular, aun cuando no tengan síntomas.
de acción corta se vuelve deben buscar la atención
Si los pacientes notan que el alivio sintomático con el tratamiento broncodilatador menos eficaz o que necesitan un mayor número de inhalaciones de las habituales, médica necesaria.
se puede disminuir hasta
La dosis se puede ajustar hasta que se consiga el control eficaz de los síntomas o la dosis eficaz mínima, en función de la respuesta de cada paciente. Cuando el control de los síntomas se mantenga con la concentración más baja de Fluticasona Cipla (125 microgramos/pulsación), después se podría sustituir por otro inhalador de fluticasona con una concentración inferior (50 microgramos/pulsación). El efecto terapéutico se manifiesta a los 4-7 días.
Los facultativos deben tener conocimiento de que propionato de fluticasona es tan eficaz como otros corticoesteroides inhalados a la mitad aproximadamente de la dosis diaria en microgramos. Por ejemplo, 100 microgramos de propionato de fluticasona equivalen aproximadamente a una dosis de 200 microgramos de dipropionato de beclometasona (con CFC) o budesónida.
Adultos y adolescentes mayores de 16 años
La dosis recomendada es de 50 a 500 microgramos dos veces al día.
Como alternativa a los corticoesteroides orales en el tratamiento de pacientes con asma grave y durante las exacerbaciones del asma, puede ser necesario un aumento temporal de la dosis (hasta un máximo de 2.000 microgramos al día en pacientes adultos). Se debe hacer un seguimiento del efecto terapéutico y para el tratamiento de mantenimiento se debe emplear la dosis eficaz más baja.
Fluticasona Cipla se puede utilizar con una cámara de inhalación Volumatic, en el caso de pacientes que tengan dificultad para sincronizar la inspiración con la pulsación del aerosol.
Grupos especiales de pacientes:
No se precisa el ajuste de la dosis en pacientes de edad avanzada o en pacientes con insuficiencia renal. No existen datos en pacientes con insuficiencia hepática.
Forma de administración:
Se debe enseñar a los pacientes el manejo adecuado del inhalador (ver el prospecto y las instrucciones de uso).
Comprobación del inhalador
1. Antes de usar por primera vez el inhalador, compruebe que funciona adecuadamente. Quite el protector de la boquilla apretando suavemente los laterales con el pulgar y el índice y retírelo.
2. Para comprobar que el inhalador funciona correctamente, agítelo bien, dirija la boquilla lejos de usted y pulse el cartucho para liberar al aire cuatro pulsaciones. Cuando no haya utilizado el inhalador durante una semana o durante un período más prolongado, libere dos pulsaciones al aire.
Utilización del inhalador
Justo antes de usar el inhalador, debe empezar a respirar lo más lentamente posible que pueda.
1. Puede hacerlo tanto de pie como sentado.
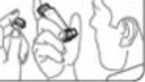
2. Retire el protector de la boquilla. Inspeccione el interior y el exterior de la boquilla, para comprobar que está limpia y que no contiene partículas (figura A).
O

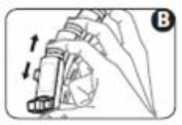
3. Agite el inhalador 4 o 5 veces para asegurar la eliminación de cualquier partícula extraña y que el contenido del inhalador se mezcla adecuadamente (figura B).
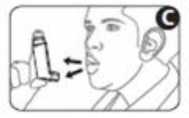
4. Sujete el inhalador en posición vertical con el pulgar situado en la base, por debajo de la boquilla. Espire todo el aire que pueda (figura C). No inspire todavía.
5. Coloque la boquilla del inhalador entre los dientes y cierre los labios alrededor de la boquilla. No la muerda (figura D).
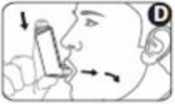
6. Inspire por la boca y, justo después de empezar a tomar aire, pulse la parte superior del cartucho para liberar una dosis de medicamento. Siga inspirando profundamente y de forma constante (figura D).
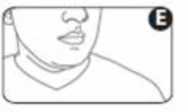
7. Contenga la respiración, retire el inhalador de la boca y retire el dedo de la parte superior del inhalador. Siga aguantando la respiración durante unos segundos o tanto como le sea posible (figura E).
8. Si el médico le ha indicado que se administre dos inhalaciones, espere medio minuto antes de aplicar otra inhalación y repita los pasos del 3 al 7.
9. Enjuáguese la boca con agua y no se la trague.
10. Justo después de su uso, vuelva a colocar el protector de la boquilla para que no coja polvo, empujando el protector firmemente hasta que oiga un clic al colocarlo en su posición.
11. Es aconsejable que practique delante del espejo las primeras veces. Si observa la salida de una especie de «neblina» de la parte superior del inhalador o por las comisuras de la boca, debe comenzar de nuevo.
12. Puede ser de utilidad, para los niños más mayores o las personas que tengan poca fuerza en las manos, sujetar el inhalador con las dos manos. Coloque los dos índices en la parte superior del inhalador y los dos pulgares en la parte inferior, por debajo de la boquilla. Si aun así tampoco puede, le será de ayuda usar una cámara de inhalación Volumatic. Su médico, enfermero o farmacéutico le aconsejarán.
Limpieza del inhalador:
Para evitar la obturación del inhalador, debe limpiarlo una vez a la semana como mínimo.
Paradlo:
• Retire el protector de la boquilla.
• No saque el cartucho metálico de la carcasa de plástico.
• Limpie el interior y el exterior de la boquilla y de la carcasa de plástico con un paño seco o un pañuelo de papel.
• Vuelva a colocar el protector de la boquilla.
No sumerja el cartucho metálico en agua.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
El tratamiento del asma debe seguir un programa escalonado, y se debe controlar la respuesta del paciente clínicamente y mediante pruebas de la función pulmonar.
Antes de empezar el tratamiento, se debe tratar cualquier broncoconstricción existente, ya que, de otro modo, la eficacia podría ser inferior a la deseada. Se debe revisar con regularidad la técnica de inhalación del paciente, para asegurarse de que la pulsación está sincronizada con la inspiración para garantizar la administración óptima en los pulmones. Durante la inhalación, el paciente debe permanecer preferiblemente en posición sentada o de pie. El inhalador se ha diseñado para usarse en posición vertical.
El inhalador de fluticasona con HFA no debe utilizarse para el tratamiento de los síntomas agudos del asma para los que se requiere el uso de un broncodilatador de acción corta. Se debe advertir a los pacientes de que deben disponer de dicho medicamento de rescate.
El uso creciente de agonistas P 2 inhalados de acción corta para aliviar los síntomas indica un empeoramiento del control del asma. En este caso se debe evaluar de nuevo el plan terapéutico del paciente.
El deterioro repentino y progresivo del control del asma puede poner en riesgo la vida del paciente y se debe considerar el aumento de la dosis de corticoesteroides. En el caso de los pacientes que se consideren que tiene este riesgo, se podrá instaurar un control diario del flujo espiratorio máximo.
La ausencia de respuesta o la exacerbación grave del asma se debe tratar con un aumento de la dosis inhalada de propionato de fluticasona y, en caso necesario, con la administración de corticoesteroides sistémicos y/o antibiótico, si hay infección.
Pueden aparecer efectos sistémicos de los corticoesteroides inhalados, especialmente cuando se prescriben dosis elevadas durante períodos de tiempo prolongados. La probabilidad de que aparezcan estos efectos es mucho menor que con los corticoesteroides orales (ver sección 4.9). Los efectos sistémicos que pueden darse incluyen: síndrome de Cushing, signos y síntomas cushingoides, supresión suprarrenal, retraso del crecimiento en niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma y, con una frecuencia más rara, diversos efectos psicológicos y conductuales, entre los que se incluye la hiperactividad psicomotora, alteraciones del sueño, ansiedad, depresión o agresividad (especialmente en niños). Por lo tanto, se debe revisar con regularidad la dosis del corticoesteroide inhalado y disminuirla hasta la dosis más baja con la que se pueda mantener el control eficaz del asma (ver sección 4.8).
Algunas personas pueden presentar una susceptibilidad mayor a los efectos del corticoesteroide inhalado que la que presenta la mayoría de pacientes.
El tratamiento prolongado con dosis altas de corticoesteroides inhalados puede provocar supresión suprarrenal y crisis suprarrenales agudas. En casos muy raros se han producido casos de supresión suprarrenal y crisis suprarrenales agudas con dosis de 500 a 1.000 microgramos de propionato de fluticasona. Las situaciones que pueden desencadenar una crisis suprarrenal aguda incluyen traumatismos, intervenciones quirúrgicas, infecciones o una disminución rápida de la posología. Los síntomas suelen ser imprecisos y pueden incluir anorexia, dolor abdominal, pérdida de peso, cansancio, cefalea, náuseas, vómitos, disminución del nivel de consciencia, hipoglucemia y convulsiones. En situación de urgencias (médica o quirúrgica) y en situaciones programadas que puedan ser estresantes, siempre se debe tener en cuenta la posibilidad de que la respuesta suprarrenal siga estando disminuida y se deberá considerar el tratamiento adecuado con corticoesteroides (ver sección 4.9).
Puesto que la absorción sistémica se produce principalmente a través de los pulmones, el uso de cámaras de inhalación junto con el inhalador con válvula dosificadora puede aumentar la llegada del medicamento a los pulmones, por lo que debe tenerse en cuenta el posible aumento del riesgo de efectos adversos sistémicos.
El tratamiento con el inhalador HFA de fluticasona no debe suspenderse bruscamente por el riesgo de que se produzcan exacerbaciones. La reducción de la dosis se debe realizar bajo supervisión médica.
Al igual que en el caso de todos los corticoesteroides administrados por vía inhalatoria, se debe tener precaución con los pacientes con tuberculosis pulmonar activa o latente.
Se han notificado casos muy raros de aumento de las concentraciones de glucosa en sangre (ver sección 4.8 «Reacciones adversas»), lo cual debe tenerse en cuenta cuando se prescriba a pacientes con antecedentes de diabetes mellitus.
Al igual que con otros tratamientos de administración por vía inhalatoria, puede aparecer broncoespasmo paradójico, acompañado de un aumento inmediato de sibilancias tras la administración. En este caso, se interrumpirá de inmediato la administración del inhalador de Fluticasona, se examinará al paciente y se instaurará un tratamiento alternativo si fuera necesario.
Se han notificado casos de interacciones medicamentosas clínicamente significativas durante el uso del medicamento en su fase poscomercialización en pacientes que estaban en tratamiento con propionato de fluticasona y ritonavir, lo que provocó efectos sistémicos de los corticoesteroides, incluyendo síndrome de Cushing y supresión suprarrenal. Por lo tanto, se debe evitar el uso concomitante de propionato de fluticasona y ritonavir, a menos que el beneficio potencial para el paciente sea mayor que el riesgo de aparición de efectos secundarios sistémicos de los corticosteroides. También aumenta el riesgo de que aparezcan efectos adversos sistémicos cuando se combina el propionato de fluticasona con otros inhibidores potentes del CYP3A (ver sección 4.5 «Interacción con otros medicamentos y otras formas de interacción»).
Cambio de tratamiento de pacientes tratados con corticoesteroides orales:
La función suprarrenal y la reserva suprarrenal suelen mantenerse dentro del intervalo de normalidad para las dosis recomendadas del tratamiento con propionato de fluticasona. Los beneficios del propionato de fluticasona administrados mediante inhalación deben disminuir al mínimo la necesidad de emplear corticoesteroides por vía oral. No obstante, el riesgo de padecer efectos adversos puede perdurar durante un tiempo en pacientes a los que se les haya administrado previamente corticoesteroides por vía oral o en tratamiento intermitente. El grado de insuficiencia suprarrenal puede requerir el consejo de un especialista antes de los procedimientos programados. En situación de urgencia (médica o quirúrgica) y en situaciones programadas que puedan ser estresantes, siempre se debe tener en cuenta la posibilidad de una respuesta suprarrenal insuficiente y se debe considerar el tratamiento adecuado con corticoesteroides (ver sección 4.9 «Sobredosis»).
Debido a la posibilidad de una insuficiencia de la respuesta suprarrenal, se debe prestar una atención especial a los pacientes que hayan estado en tratamiento con corticoesteroides orales y se les cambie a un tratamiento con propionato de fluticasona inhalado y se deberá evaluar la función corticosuprarrenal de forma periódica.
Tras la introducción del propionato de fluticasona inhalado, se debe retirar gradualmente el tratamiento sistémico y se debe indicar a los pacientes que lleven consigo una tarjeta de advertencias sobre corticoesteroides donde se indique la posible necesidad de un tratamiento adicional en épocas de estrés.
En el caso de los pacientes que dependan de los corticoesteroides orales, el propionato de fluticasona se debe administrar simultáneamente con el tratamiento sistémico con corticoesteroides durante 10 días. Transcurrido este tiempo, se comenzará con la retirada gradual del corticoesteroide sistémico, con un ritmo de 2,5 mg de prednisolona (o equivalente) al mes, hasta alcanzar la concentración mínima posible.
Durante la fase de retirada, algunos pacientes sienten malestar de forma inespecífica, a pesar del mantenimiento o incluso de la mejoría de la función respiratoria. Se debe recomendarles que sigan con el propionato de fluticasona inhalado y seguir con la retirada del corticoesteroide sistémico, a menos que existan signos objetivos de insuficiencia suprarrenal.
En algunas ocasiones, la sustitución del tratamiento con corticoesteroides sistémicos por el tratamiento inhalado desenmascara alergias como la rinitis o el eccema alérgicos, que estaban siendo controlados previamente con el medicamento sistémico. Estas alergias se deben tratar sintomáticamente con antihistamínicos y/o preparados tópicos, incluyendo corticoesteroides tópicos.
Se produjo un aumento en la notificación de casos de neumonía en pacientes con EPOC que estaban recibiendo 500 pg de propionato de fluticasona (ver sección 4.8). Los facultativos deberán continuar vigilando a los pacientes con EPOC por si desarrollan una neumonía, ya que las características clínicas de estas infecciones y las exacerbaciones suelen solaparse.
4.5 Interacción con otros medicamentos y otras formas de interacción
En circunstancias normales, después de la inhalación se alcanzan concentraciones plasmáticas bajas de propionato de fluticasona, debido al amplio metabolismo de primer paso y a un aclaramiento sistémico elevado, mediado por el citocromo P450 3A4 en el intestino y el hígado. Por lo tanto, es improbable que se produzcan interacciones medicamentosas clínicamente significativas en las que intervenga el propionato de fluticasona.
En un estudio realizado sobre interacciones con propionato de fluticasona intranasal en personas sanas, 100 mg de ritonavir dos veces al día (un inhibidor potente del citocromo P450 3A4) aumentó varios cientos de veces las concentraciones plasmáticas del propionato de fluticasona, lo que produjo una reducción muy marcada de las concentraciones séricas de cortisol. No se dispone de información relativa a esta interacción para el propionato de fluticasona inhalado, pero se prevé un aumento importante en las concentraciones plasmáticas del propionato de fluticasona. Se han notificado casos de síndrome de Cushing y de supresión suprarrenal. Se debe evitar el uso combinado, a menos que el beneficio para el paciente supere con creces el riesgo de aparición de efectos secundarios sistémicos de tipo glucocorticoide.
En un pequeño estudio realizado en voluntarios sanos, ketoconazol —un inhibidor algo menos potente del CYP3A— produjo un aumento de la exposición de propionato de fluticasona tras una única inhalación del 150 %. Esto produjo una mayor disminución de las concentraciones plasmáticas de cortisol, en comparación con el propionato de fluticasona en monoterapia. También se prevé que el tratamiento concomitante con otros inhibidores potentes del CYP3A, como itraconazol, claritromicina, telitromicina, atazanavir, indinavir, el nelfinavir o saquinavir, aumente la exposición sistémica de propionato de fluticasona y el riesgo de aparición de efectos adversos sistémicos. Se recomienda tener precaución y evitar, en la medida de lo posible, el tratamiento prolongado con estos medicamentos.
4.6 Fertilidad, embarazo y lactancia
Fertilidad
No hay datos clínicos relativos al efecto de propionato de fluticasona en la fertilidad. Los estudios realizados en animales no han identificado ningún efecto sobre la fertilidad. Como medida de precaución, es preferible evitar el uso de fluticasona en mujeres que estén pensando quedarse embarazadas.
Embarazo
No hay datos o estos son limitados relativos al uso de propionato de fluticasona en mujeres embarazadas. Existen algunos datos en mujeres embarazadas (datos en 200 embarazos) que no indican que propionato de fluticasona administrado con un inhalador presurizado produzca efectos adversos en el embarazo o en la salud del feto/recién nacido. Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3). Puesto que el inhalador HFA de fluticasona dispensa propionato de fluticasona directamente en los pulmones por vía inhalatoria, con esta vía se evita la exposición elevada
que se produce cuando se administran corticoesteroides por vías sistémicas. Únicamente se debe considerar la administración de propionato de fluticasona durante el embarazo si el beneficio esperado para la madre supera cualquier posible riesgo para el feto.
Lactancia
Se desconoce si el propionato de fluticasona/metabolitos se excretan en la leche materna. La administración subcutánea de propionato de fluticasona a ratas de laboratorio dio como resultado unas concentraciones plasmáticas cuantificables y evidencia de la presencia de propionato de fluticasona en la leche. No obstante, se prevé que las concentraciones plasmáticas en humanos tras la inhalación con las dosis recomendadas sean bajas. Se debe considerar los beneficios del tratamiento para la madre y los posibles riesgos para la madre y el niño a la hora de decidir si se utiliza propionato de fluticasona en madres en periodo de lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de fluticasona sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
A continuación se indican los efectos adversos, clasificados por órganos y por frecuencia. Las frecuencias se definen com Muy frecuentes (> 1/10); frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1000 a < 1/100); raras (> 1/10.000 a < 1/1000); muy raras (< 1/10.000) incluyendo casos aislados; y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones muy frecuentes, frecuentes y poco frecuentes se han determinado generalmente a partir de los datos de los ensayos clínicos. Los acontecimientos raros y muy raros proceden por lo general de los datos notificados de forma espontánea.
|
Clasificación por órganos y sistemas |
Reacción adversa |
Frecuencia |
|
Infecciones e infestaciones |
Candidiasis en la boca y la garganta |
Muy frecuente |
|
Neumonía (en pacientes con EPOC) |
Frecuente | |
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilidad con las siguientes manifestaciones: | |
|
Reacciones de hipersensibilidad cutánea |
Poco frecuente | |
|
Angioedema (principalmente edema facial y orofaríngeo) |
Muy rara | |
|
Síntomas respiratorios (disnea y/o broncoespasmo) |
Muy rara |
|
Reacciones anafilácticas |
Muy rara | |
|
Trastornos endocrinos |
Síndrome de Cushing, síntomas y signos cushingoide, supresión suprarrenal, retraso en el crecimiento en niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma |
Muy rara |
|
Trastornos del metabolismo y de la nutrición |
Hiperglucemia (ver sección 4.4 «Advertencias y precauciones especiales de empleo») |
Muy rara |
|
Trastornos psiquiátricos |
Ansiedad, trastornos del sueño, cambios en el comportamiento, incluidos hiperactividad e irritabilidad (predominantemente en niños) |
Muy rara |
|
Depresión, agresividad (predominantemente en niños) |
Frecuencia no conocida | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Ronquera/disfonía |
Frecuente |
|
Trastornos de la piel y del tejido subcutáneo |
Contusiones |
Frecuente |
En algunos pacientes se han dado casos de ronquera y candidiasis en la boca y la garganta (muguet). En estos pacientes puede ser útil enjuagarse la boca con agua tras la inhalación. La candidiasis sintomática puede tratarse con un tratamiento antifúngico tópico mientras se siga con el tratamiento con el inhalador de Fluticasona.
Los posibles efectos sistémicos incluyen síndrome de Cushing, síntomas y signos cushingoides, supresión suprarrenal, retraso en el crecimiento, disminución de la densidad mineral ósea, cataratas y glaucoma (ver sección 4.4 «Advertencias y precauciones especiales de empleo»).
Al igual que con otros tratamientos inhalados, pueden darse casos de broncoespasmo paradójico (ver sección 4.4 «Advertencias y precauciones especiales de empleo»).
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los
profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano http://www.notificaram.es/.
4.9 Sobredosis
Aguda: la inhalación de dosis de propionato de fluticasona superiores a las indicadas, puede causar una supresión temporal de la función suprarrenal. No es necesario tomar ninguna medida de urgencia. En estos pacientes se debe seguir el tratamiento con propionato de fluticasona inhalado, con una dosis suficiente para controlar el asma; la función suprarrenal se recupera en pocos días y puede comprobarse mediante determinaciones plasmáticas de cortisol.
Crónica: las dosis superiores a las indicadas y continuadas a lo largo del tiempo pueden provocar una supresión corticosuprarrenal importante. Se han notificado casos muy raros de crisis suprarrenales agudas en niños expuestos a dosis superiores a las recomendadas (por lo general, 1.000 microgramos al día o una dosis superior), durante períodos de tiempo prolongados (varios meses o años). Los signos y síntomas observados incluyeron hipoglucemia y secuelas de disminución de la consciencia y/o convulsiones. Las situaciones que podrían desencadenar una crisis suprarrenal aguda incluyen traumatismos, intervenciones quirúrgicas, infecciones o una disminución rápida de la posología. En estos casos está indicada la vigilancia de la reserva suprarrenal. Debe continuarse el tratamiento con propionato de fluticasona inhalado con una dosis adecuada para el control del asma.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: glucocorticoides, código ATC: R03BA05
Propionato de fluticasona es un glucocorticoide con efecto antinflamatorio. La administración de propionato de fluticasona por vía inhalatoria, a las dosis recomendadas, posee una acción antinflamatoria potente en los pulmones, lo que se traduce en una disminución de los síntomas y de la exacerbación del asma y una incidencia e intensidad menores de las reacciones adversas que las observadas cuando se administran corticoesteroides sistémicos. El tratamiento con propionato de fluticasona es un tratamiento profiláctico. El efecto completo se consigue a los 4-7 días de empezar el tratamiento. La mayoría de las partículas poseen un tamaño inferior a 5 micrómetros.
5.2 Propiedades farmacocinéticas
Absorción
La biodisponibilidad media sistémica de fluticasona inhalado en personas sanas es del 5-11 % de la dosis nominal, dependiendo del dispositivo de inhalación utilizado.En los pacientes con asma (FEV i < 75 % del valor teórico de referencia), la biodisponibilidad absoluta media sistémica se ve reducida si se la compara con la de los voluntarios sanos. La absorción sistémica se produce principalmente a través de los pulmones y se ha observado que está relacionada linealmente con la dosis a lo largo del intervalo de dosificación de 500-2000 microgramos. Al principio, la absorción es rápida y, posteriormente, se prolonga.
La biodisponibilidad absoluta oral es nula (< 1 %), debido a la combinación de una absorción incompleta en el tubo digestivo y un amplio metabolismo de primer paso.
Distribución
Tras una dosis intravenosa, propionato de fluticasona se distribuye ampliamente en el organismo. El aclaramiento plasmático es elevado (unos 1150 ml/min) y el volumen de distribución en situación de equilibrio es grande (unos 300 l). La unión de fluticasona a las proteínas plasmáticas es del 91 %.
Biotransformación
Fluticasona es metabolizada por la enzima CYP3A4 a un metabolito carboxílico inactivo principal. Eliminación
El 87-100 % de una dosis oral se excreta en las heces, siendo hasta el 75 % en forma de compuesto original. También se han hallado en las heces otros metabolitos con estructuras no identificadas. La semivida en fase terminal es de unas 8 horas.
5.3 Datos preclínicos sobre seguridad
La administración de corticoesteroides a hembras preñadas de animales puede provocar anomalías en el desarrollo fetal, lo que incluye fisura palatina y retraso del crecimiento intrauterino. Por tanto, existe un riesgo muy pequeño de que estos efectos se produzcan en fetos humanos, aunque cabe destacar que las malformaciones observadas en animales se producen tras la exposición sistémica relativamente elevada.
La toxicidad observada ha sido únicamente la de los efectos típicos de los corticoesteroides potentes y únicamente con dosis muy superiores a las indicadas para su uso terapéutico. No se ha identificado ningún efecto nuevo ni ningún efecto en la fertilidad en los estudios sobre toxicidad a dosis repetidas, toxicidad para la reproducción o teratología. El propionato de fluticasona carece de actividad mutagénica in vitro e in vivo y no ha mostrado ningún potencial carcinogénico en roedores. En los modelos animales no es irritante ni produce sensibilidad.
Se ha demostrado que el propelente sin CFC —el HFA 134a— carece de efecto tóxico en concentraciones de vapor muy elevadas que superan ampliamente las concentraciones a las que probablemente estén expuestos los pacientes, en una amplia variedad de especies animales expuestas a diario, durante períodos de dos años.
El uso de HFA 134a como propelente no ha alterado el perfil de toxicidad de propionato de fluticasona, en comparación con los que emplean el propelente convencional CFC.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Norflurano (HFA 134a)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
El cartucho contiene un líquido a presión. No conservar a temperatura superior a 50 °C. No perforar el cartucho. No refrigerar o congelar. Proteger de las temperaturas muy bajas y de la luz directa del sol.
Al igual que en la mayoría de los medicamentos envasados en cartuchos presurizados, el efecto terapéutico de este medicamento puede disminuir cuando el cartucho está frío.
Si el inhalador está muy frío, saque el cartucho metálico de la carcasa de plástico y atempérelo con las manos durante unos minutos antes de usarlo. No emplee nunca otros métodos para calentarlo.
No se debe perforar, romper o quemar el cartucho, aun cuando aparentemente esté vacío.
Coloque el protector de la boquilla firmemente hasta que oiga un clic al colocarlo en su posición.
6.5 Naturaleza y contenido del envase
Un inhalador compuesto por un cartucho de aleación de aluminio, sellado con una válvula dosificadora, un aplicador y una capucha para la boquilla. Cada cartucho contiene 120 dosis medidas de 125 ó 250 microgramos de propionato de fluticasona.
Tamaños de envase: Envase único-cada envase contiene un frasco con 120 pulsaciones Multipack-enfajado con 2 o 3 envases Envase hospitalario-enfajado con 10 envases. Puede que solamente estén comercializados algunos tamaños de envase.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La pulverización se inhala a través de la boca hasta los pulmones. Después de agitar el inhalador, el paciente debe exhalar, colocar la boquilla en la boca y cerrar los labios alrededor de la boquilla. Para liberar la pulverización se debe presionar el aplicador, de manera que se haga simultáneamente con la inspiración.
Consulte el prospecto del medicamento para consultar las instrucciones detalladas.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Titular
Cipla Europe NV
Uitbreidingstraat 80, 2600 Antwerp, Bélgica
Representante Local: Cipla Europe NV
Ayala, 66
Madrid 28001
¡m
MINISTER10DE )E SANIDAD, POLITICA LITIGA SOCIAL E IGUALDAD IALDAD Agencia esparto» de cSacse-medicamentos y ¡y Sfoouctos san-tanos [finos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Marzo 2015
10. FECHA DE LA REVISIÓN DEL TEXTO
Septiembre 2014
12 de 12