Fluinol 50 Microgramos/Pulverizacion,Suspension Para Pulverizacion Nasal
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Fluinol 50 microgramos/pulverización, suspensión para pulverización nasal.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada pulverización libera 50 microgramos de propionato de fluticasona.
Excipiente(s) con efecto conocido
Este medicamento contiene 5 mg de glucosa y 20 microgramos de cloruro de benzalconio por pulverización.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión para pulverización nasal.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
El propionato de fluticasona en spray nasal acuoso está indicado en la profilaxis y tratamiento de la rinitis alérgica estacional, incluyendo la fiebre del heno, y en el tratamiento de la rinitis perenne.
4.2 Posología y forma de administración
Posología
La dosis se titulará a la dosis más baja con la que se consiga un control efectivo de los síntomas.
Adultos y niños mayores de 12 años: profilaxis y el tratamiento de la rinitis alérgica estacional y el tratamiento de la rinitis perenne, dos pulverizaciones en cada fosa nasal una vez al día (200 microgramos/día), preferiblemente por la mañana. En algunos casos, pueden requerirse dos pulverizaciones en cada fosa nasal dos veces al día. La dosis máxima diaria no debe exceder de cuatro pulverizaciones en cada fosa nasal.
Pacientes de edad avanzada: debe usarse la dosis normal para adultos.
Población pediátrica
Niños menores de 12 años: profilaxis y tratamiento de la rinitis alérgica estacional y el tratamiento de la rinitis perenne en niños de 4 -11 años, se recomienda una pulverización en cada fosa nasal una vez al día (100 microgramos/día), preferiblemente por la mañana. En algunos casos, puede requerirse una pulverización en cada fosa nasal dos veces al día. La dosis máxima diaria no debe exceder de dos pulverizaciones en cada fosa nasal.
No se ha establecido la eficacia de Fluinol en niños menores de 4 años.
Forma de administración
El propionato de fluticasona en spray nasal acuoso se administra por vía nasal únicamente. Se debe evitar el contacto con los ojos.
Es necesario utilizar el propionato de fluticasona en spray nasal acuoso con regularidad para alcanzar el beneficio terapéutico completo. Se debe explicar al paciente que este medicamento no produce un efecto inmediato ya que el alivio máximo no se obtendrá hasta después de tres o cuatro días de tratamiento.
No administrar Fluinol durante más de tres semanas si no se obtiene respuesta.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.
4.4 Advertencias y precauciones especiales de empleo
Infección local: Las infecciones de las fosas nasales deben tratarse adecuadamente, pero no constituyen una contraindicación específica al tratamiento con propionato de fluticasona en spray nasal acuoso.
Se debe tener cuidado cuando los pacientes pasen de recibir un tratamiento con esteroides sistémicos a recibir propionato de fluticasona en spray nasal acuoso, especialmente si hubiera alguna razón para suponer que su función suprarrenal está alterada.
Durante su uso postcomercialización se han notificado interacciones medicamentosas clínicamente significativas en pacientes tratados con propionato de fluticasona y ritonavir, dando lugar a efectos sistémicos de tipo corticosteroide incluyendo síndrome de Cushing y supresión suprarrenal. Por lo tanto, debería evitarse el uso concomitante de propionato de fluticasona y ritonavir, a menos que el beneficio potencial para el paciente sea mayor que el riesgo de aparición de efectos secundarios sistémicos de tipo corticosteroide (ver sección 4.5).
Pueden aparecer efectos sistémicos con cualquier corticoide administrado por vía nasal, especialmente a dosis elevadas prescritas durante periodos prolongados. La probabilidad de que estos efectos aparezcan es mucho menor que con corticosteroides administrados por vía oral y puede variar en función del paciente y entre las diferentes preparaciones de corticosteroides. Los potenciales efectos sistémicos pueden incluir Síndrome de Cushing, aspecto Cushingoideo, supresión suprarrenal, retraso en el crecimiento de niños y adolescentes, cataratas, glaucoma y, más raramente, una serie de efectos psicológicos o del comportamiento incluyendo hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresividad (especialmente en niños).
Es posible que el tratamiento a largo plazo con dosis de corticosteroides nasales más elevadas que las recomendadas pudiera originar una supresión suprarrenal clínicamente significativa. Si se sabe con certeza que se están utilizando dosis más elevadas que las recomendadas, debe considerarse la necesidad de administrar corticosteroides sistémicos adicionales en periodos de estrés o en caso de cirugía electiva.
El beneficio completo del propionato de fluticasona en spray nasal acuoso puede no alcanzarse hasta que el tratamiento se haya administrado durante varios días.
Aunque en la mayoría de los casos el propionato de fluticasona en spray nasal acuoso controla la rinitis alérgica estacional, una carga anormalmente superior de alérgenos en verano puede, en algunos casos, requerir tratamiento adicional.
Se han notificado casos de retraso en el crecimiento en niños tratados con corticosteroides nasales a las dosis autorizadas. Se recomienda vigilar regularmente la altura de los niños que reciben un tratamiento prolongado con corticosteroides por vía nasal. Si se detecta un enlentecimiento del crecimiento se debe revisar el tratamiento con objeto de reducir la dosis administrada de corticosteroide nasal, si es posible, a la dosis mínima con la que se consiga un control efectivo de los síntomas. Además se recomienda al paciente que consulte a su pediatra.
Aunque no existe evidencia de supresión del eje hipotálamo-hipofisario-suprarrenal en los estudios clínicos realizados con Fluinol, deberá tenerse en cuenta que la absorción sistémica de corticosteroides tópicos puede causar supresión reversible del mencionado eje.
Se han comunicado casos extremadamente raros de perforación del tabique nasal con el uso de corticosteroides por vía nasal, generalmente en pacientes que han sido sometidos a cirugía nasal.
Advertencia sobre excipientes:
Este medicamento contiene 5 mg de glucosa por pulverización, lo que deberá ser tenido en cuenta por los enfermos diabéticos.
También contiene 20 microgramos de cloruro de benzalconio por pulverización. Puede producir inflamación de la mucosa nasal, especialmente con tratamientos de larga duración. Si se sospecha tal reacción (congestión nasal persistente), siempre que sea posible, se debería utilizar un medicamento de uso nasal que no contenga este excipiente.
Se informa a los deportistas que este medicamento contiene un componente que puede establecer un resultado analítico positivo de control de dopaje.
4.5 Interacción con otros medicamentos y otras formas de interacción
En circunstancias normales, se obtienen bajas concentraciones plasmáticas de propionato de fluticasona después de la administración intranasal, debido a un intenso metabolismo de primer paso y a un alto aclaramiento sistémico producido por el citocromo P450 3A4 en el intestino e hígado. Por tanto, es improbable que se produzcan interacciones medicamentosas clínicamente significativas en las que intervenga el propionato de fluticasona.
En un estudio sobre la interacción del fármaco llevado a cabo en sujetos sanos, se ha demostrado que ritonavir (potente inhibidor del citocromo P450 3A4) puede aumentar de manera considerable las concentraciones de propionato de fluticasona en plasma, dando lugar a una notable disminución de las concentraciones de cortisol en suero. Durante su uso postcomercialización se han notificado interacciones medicamentosas clínicamente significativas en pacientes tratados con propionato de fluticasona intranasal o inhalado y ritonavir, dando lugar a efectos sistémicos de tipo corticosteroide incluyendo síndrome de Cushing y supresión suprarrenal.
Por lo tanto, debe evitarse el uso concomitante de propionato de fluticasona y ritonavir, a menos que el beneficio potencial para el paciente sea mayor que el riesgo de aparición de efectos sistémicos de tipo corticosteroide.
En varios estudios realizados se ha demostrado que otros inhibidores del citocromo P450 3A4 producen incrementos insignificantes (eritromicina) y menores (ketoconazol) de la exposición sistémica al propionato de fluticasona, sin reducción notable de las concentraciones de cortisol en suero. No obstante se aconseja tener precaución si se administran conjuntamente inhibidores potentes del citocromo P450 3A4 (p.ej. ketoconazol) ya que pueden aumentar la exposición sistémica al propionato de fluticasona.
4.6 Fertilidad, embarazo y lactancia
Al igual que con otros medicamentos, el uso de propionato de fluticasona por vía intranasal durante el embarazo y la lactancia requiere que los beneficios sean sopesados frente a los posibles riesgos asociados con el medicamento o con cualquier tratamiento alternativo.
Embarazo
No hay evidencia suficiente acerca de la seguridad de propionato de fluticasona en mujeres embarazadas. En los estudios de reproducción en animales sólo se han observado los efectos característicos de los glucocorticoides a exposiciones sistémicas altas; la aplicación directa intranasal asegura una exposición sistémica mínima.
Lactancia
No se ha investigado la excreción de propionato de fluticasona en la leche humana. Hubo evidencia de propionato de fluticasona en la leche materna cuando se obtenían niveles plasmáticos medibles en ratas de laboratorio lactantes tras la administración subcutánea. Sin embargo, se espera que los niveles plasmáticos en pacientes a los que se administra propionato de fluticasona intranasal a las dosis recomendadas sean muy bajos.
Fertilidad
No hay datos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No es probable que el propionato de fluticasona produzca ningún efecto sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas que se relacionan a continuación han sido clasificadas por órgano, sistemas y frecuencia. Las frecuencias se han definido de la siguiente forma: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000) y muy raras (<1/10.000) incluyendo informes aislados. Las reacciones muy frecuentes, frecuentes y poco frecuentes se han identificado a partir de los datos de ensayos clínicos. Los acontecimientos raros y muy raros proceden de datos notificados espontáneamente. Al asignar las frecuencias de acontecimientos adversos, no se tuvo en cuenta la incidencia en los grupos placebo ya que estas incidencias fueron generalmente comparables a las del grupo con tratamiento activo.
Los efectos sistémicos de los corticoides nasales pueden presentarse sobre todo al utilizar dosis elevadas durante periodos prolongados.
Trastornos del sistema inmunológico
Muy raras: reacciones de hipersensibilidad, anafilaxis/reacciones anafilácticas, broncoespasmo, erupción (rash) cutánea y edema en cara o lengua.
Trastornos del sistema nervioso
Frecuentes: dolor de cabeza, sabor desagradable y olor desagradable.
Como sucede con otros pulverizadores nasales se han descrito sabor y olores desagradables y dolor de cabeza.
Trastornos oculares
Muy raras: glaucoma, aumento de la presión intraocular y cataratas.
Trastornos respiratorios, torácicos y mediastínicos
Muy frecuentes: epistaxis.
Frecuentes: sequedad nasal, irritación nasal, sequedad de garganta e irritación de garganta.
Muy raras: perforación del tabique nasal.
Como sucede con otros pulverizadores nasales se han descrito sequedad e irritación de nariz y garganta y epistaxis.
Se ha descrito también perforación del tabique nasal tras el uso de corticosteroides intranasales. Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaRAM.es.
4.9 Sobredosis
No hay datos disponibles sobre los efectos de sobredosis aguda o crónica con el propionato de fluticasona en spray nasal acuoso. La administración nasal de 2 mg de propionato de fluticasona dos veces al día, durante siete días a voluntarios sanos, no tuvo efecto alguno sobre la función del eje hipotálamo-hipofisario-suprarrenal.
Tratamiento
La administración de dosis más elevadas que las recomendadas durante un periodo prolongado de tiempo puede conducir a la supresión temporal de la función suprarrenal.
En estos pacientes, se debe continuar el tratamiento con propionato de fluticasona a una dosis suficiente para controlar los síntomas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: glucocorticoide para uso nasal; código ATC: R01AD08.
El propionato de fluticasona es un glucocorticoide sistémico que presenta actividad antiinflamatoria administrado por vía intranasal pero sin inducir los efectos sistémicos característicos de este tipo de esteroides.
Después de la administración nasal de propionato de fluticasona (200 microgramos/día) no se encontró ningún cambio significativo del cortisol sérico en el AUC a las 24 horas comparado con placebo (cociente 1,01; IC 90% 0,9 - 1,14).
Sólo se ha observado supresión del eje hipotálamo-hipofisario-suprarrenal tras administración intranasal de dosis muy elevadas. Por lo tanto, el propionato de fluticasona no presenta efectos sistémicos clínicamente significativos a las dosis recomendadas habitualmente.
Ensayos clínicos controlados frente a placebo han mostrado que el propionato de fluticasona reduce de manera significativa los síntomas de la rinitis alérgica en pacientes de 4 años y mayores. Dos estudios clínicos comparativos con placebo, que han evaluado de manera específica el dolor asociado con la sensación de presión sinusal, mostraron un alivio significativo en pacientes de 18 años y mayores que padecían rinitis alérgica.
En un ensayo clínico sobre el crecimiento, de un año de duración, randomizado, doble ciego controlado con placebo y grupos paralelos, en niños preadolescentes de edades entre 3 y 9 años (donde 56 pacientes recibieron propionato de fluticasona intranasal y 52 recibieron placebo), no se observaron diferencias estadísticamente significativas en la velocidad de crecimiento de los pacientes que recibieron propionato de fluticasona intranasal (200 microgramos al día en spray nasal), en comparación con el grupo tratado con placebo.
La velocidad de crecimiento estimada, tras un año de tratamiento, fue de 6,20 cm/año (ES=0,23) en el grupo placebo y 5,99 cm/año en el grupo tratado con propionato de fluticasona; la diferencia media de velocidad de crecimiento entre ambos tratamientos después de un año fue de 0,20 cm/año (ES= 0,28; IC 95%= -0,35; 0,76).
No se observaron evidencias de cambios clínicamente relevantes en la función del eje hipotálamo-hipofisario-suprarrenal ni en la densidad mineral del hueso, según la determinación de la excreción urinaria de cortisol en 12 horas y la densitometría de rayos X, respectivamente.
5.2 Propiedades farmacocinéticas
Después de administrar dosis de hasta 1 mg por vía nasal, los niveles plasmáticos de propionato de fluticasona son bajos, estando cercanos al límite de cuantificación del ensayo (0,05 ng/ml).
Tras administración oral, el 87-100% de la dosis se excreta en heces, siendo hasta el 75% en forma de compuesto original inalterado dependiendo de la dosis. Después de administrar 6 mg por vía oral, el 64% se excreta en forma inalterada. Hay un metabolito principal inactivo. Tras administración intravenosa hay un aclaramiento plasmático rápido que sugiere una amplia extracción hepática. A partir de datos iniciales limitados, se ha estimado que la vida media plasmática de eliminación es de 3 horas y que el volumen de distribución asociado supera en más de tres veces el peso corporal. Esto conlleva una amplia distribución tisular y una rápida eliminación.
5.3 Datos preclínicos sobre seguridad
Los estudios toxicológicos sólo han mostrado la clase de efectos típicos de un corticosteroide potente, a dosis que exceden bastante las propuestas para el uso terapéutico.
El propionato de fluticasona no fue mutagénico en las pruebas estándar de Ames, de fluctuación de E. coli, mutación génica de S. cerevisiae o en el ensayo con células ováricas de hámster chino. No fue clastogénico en los ensayos de micronúcleo con ratón y de linfocitos humanos cultivados.
En un estudio acerca de la fertilidad y de la función reproductora general realizado con ratas, la administración por vía subcutánea de 50 pg/kg/día a hembras y de 100 pg/kg/día (la dosis se redujo posteriormente a 50 pg/kg/día) a machos de propionato de fluticasona no tuvo efecto alguno sobre el apareamiento o la fertilidad.
Se han realizado estudios con animales para evaluar la actividad del propionato de fluticasona sobre el desarrollo embrionario de ratones, ratas y conejos. La administración subcutánea de propionato de fluticasona a ratones preñados causó los efectos típicos de esta clase de fármaco. La administración de una dosis maternalmente tóxica de 150 pg/kg originó reducción en la ganancia de peso en las madres y, como era de esperar, indujo paladar hendido en algunos fetos. En ratas, la administración de una dosis elevada de 100 pg/kg fue tóxica para las madres al observarse reducción en la ganancia de peso y causó retraso en el desarrollo embrionario que se hizo evidente por la aparición de retraso en la osificación y una pequeña incidencia de onfalocele. Los estudios con conejos demostraron la particular sensibilidad de esta especie a esta clase de fármaco. Dosis de 30 pg/kg y superiores no fueron compatibles con el sostenimiento de un embarazo y dosis de 0,57 y 4,0 pg/kg causaron reducción en el peso fetal y paladar hendido con la dosis más elevada. Sin embargo, la administración por vía oral de dosis de hasta 300 pg/kg no causó maternotoxicidad ni embriotoxicidad. En estudios de fertilidad realizados con ratas, dosis de hasta 50 pg/kg afectaron el peso corporal de las madres y efectos asociados a la dosis sobre el crecimiento en las generaciones F0 y F1. No obstante, no hubo efecto alguno sobre la fertilidad o el apareamiento.
Dosis de hasta 50 pg/kg de propionato de fluticasona no tuvieron efectos perceptibles sobre el desarrollo peri- y postnatal en ratas.
No se dispone de estudios suficientes y bien controlados con mujeres embarazadas. Se desconoce si tras administración por vía nasal, el propionato de fluticasona pasa a leche materna. Pequeñas cantidades de glucocorticosteroides administradas por vía sistémica se excretan en leche materna. Actualmente no hay evidencia de acción teratogénica en humanos.
Datos preclínicos sugieren que el cloruro de benzalconio puede producir un efecto ciliar tóxico, incluyendo inmovilidad irreversible, dependiente de la concentración y del tiempo de exposición, y que puede producir cambios histopatológicos en la mucosa nasal.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Glucosa (anhidra) (5 mg/pulverización)
Celulosa microcristalina y carboximetilcelulosa de sodio Alcohol feniletílico Cloruro de benzalconio
Polisorbato 80
Ácido clorhídrico diluido
Agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
Tres años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
El propionato de fluticasona en spray nasal acuoso se presenta en frascos de polipropileno, conteniendo un volumen de suspensión suficiente para 120 pulverizaciones. Cada frasco va provisto de una válvula atomizadora dosificadora, un aplicador nasal y una tapa que protege contra la entrada de polvo.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial para su eliminación.
Instrucciones de uso:
Preparación del pulverizador nasal
Debe preparar el pulverizador nasal:
• Antes de usarlo por primera vez
• Si no lo ha utilizado durante unos días
• Si acaba de limpiarlo siguiendo las instrucciones de la sección “Limpieza del pulverizador nasal”
La preparación del pulverizador nasal ayuda a asegurarse de que siempre recibe la dosis completa de medicamento. Siga estos pasos:
• Agitar el pulverizador nasal y quitar la tapa (ver dibujo 1).
• Sujetar el pulverizador en posición vertical y oriente el aplicador nasal alejado de usted.
• Coloque el dedo índice y el corazón a cada lado del aplicador nasal y el pulgar debajo del frasco (ver dibujo 2).
DIBUJO 1
DIBUJO 2
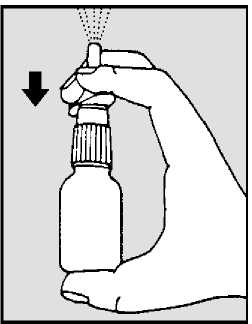
Mantenga su pulgar, y presione firmemente hacia abajo con los dedos para liberar una fina niebla de pulverización al aire (ver dibujo 2).
El pulverizador nasal está ahora listo para su uso.
Si piensa que el aplicador nasal puede estar obstruido, no use un alfiler o cualquier otro objeto punzante para desatascarla.
Trate de limpiar el pulverizador siguiendo las instrucciones de “Limpieza del pulverizador nasal”.
Uso del pulverizador nasal
1. Agitar el pulverizador nasal y quitar la tapa.
2. Sonarse la nariz para limpiar los orificios nasales.
3. Cierre un orificio nasal con el dedo y coloque cuidadosamente el aplicador nasal en el otro orificio nasal. Incline la cabeza ligeramente hacia delante y mantenga el pulverizador nasal en posición vertical (ver dibujos 3a y 3b).
DIBUJO 3a DIBUJO 3b
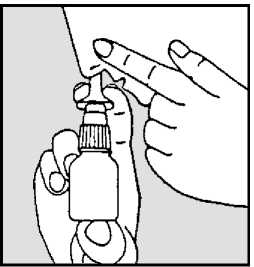
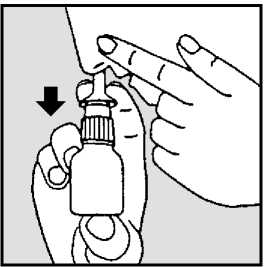
4. Presione firmemente con los dedos hacia abajo mientras aspira por la nariz (ver dibujos 3a y 3b).
5. Saque el aplicador nasal y exhale por la boca.
6. Repita los pasos 3 a 4 en el otro orificio nasal.
7. Después de usar el pulverizador, limpie el aplicador nasal cuidadosamente con un pañuelo limpio.
8. Vuelva a colocar la tapa.
Limpieza del pulverizador nasal
Se debe limpiar el pulverizador nasal por lo menos una vez a la semana para evitar la obstrucción del aplicador nasal. Siga estos pasos:
• Quitar la tapa protectora.
• Poner en remojo el aplicador nasal y la tapa en agua caliente durante unos minutos.
• A continuación, enjuagar bajo el grifo.
• Eliminar el exceso de agua sacudiéndolo y dejar que se seque en un lugar templado.
• Colocar el aplicador nasal de nuevo en el pulverizador.
• Preparar el pulverizador nasal siguiendo las instrucciones de “Preparación del pulverización nasal” de modo que está listo para su uso.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline, S.A.
P.T.M. C/Severo Ochoa, 2 28760 Tres Cantos (Madrid).
Tel: 902 202 700 Mail: es-ci@gsk.com
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
60.542
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
11 de diciembre de 1997. Última revalidación quinquenal presentada en junio de 2007.
10. FECHA DE LA REVISIÓN DEL TEXTO
Marzo 2016
10 de 10