Fluenz Suspension Para Pulverizacion Nasal

ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
sy
4?


Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
FLUENZ suspensión para pulverización nasal Vacuna contra el virus influenza (viva atenuada, nasal)
2. COMPOSICION CUALITATIVA Y CUANTITATIVA
&
Virus influenza reagrupado* (vivo atenuado) de las siguientes cepas**:
A/California/7/2009 cepa similar a (H1N1)pdm09 (A/California/7/2009, MEDI 228029)
A/Victoria/361/2011 cepa similar a (H3N2) (A/Texas/50/2012, MEDI 237514)
B/Massachusetts/2/2012 cepa similar a (B/Massachusetts/2/2012, MEDI 237751)
107.0 ± °,5 UFF***
107.0 ± 0,5 UFF***
c>0
107.0 ± 0,5 UFF*** ...........por dosis de 0,2 ml
* multiplicado en huevos de gallina fertilizados de gallineros sanos.
** producidas en células VERO por tecnología genética inversa. Este producto contiene
organismos modificados genéticamente (OMG).
*** unidades de focos fluorescentes
Esta vacuna cumple con la recomendación de la OMS (hemisferio norte) y la decisión de la UE para la temporada 2013/2014.
La vacuna puede contener residuos de las siguientes sustancias: proteínas del huevo (p. ej., ovoalbúmina) y gentamicina.
/$>
Para consultar la lista, completa de excipientes ver sección 6.1.
IMA FA
Suspensión para pulverización nasal
La suspensión es incolora a amarilla clara, transparente a opalescente. Puede presentar pequeñas partículas blancas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Profilaxis de la gripe en individuos mayores de 24 meses y menores de 18 años. El uso de FLUENZ debe basarse en recomendaciones oficiales.
4.2 Posología y forma de administración
Posología
Niños y adolescentes a partir de los 24 meses:
0,2 ml (administrados a razón de 0,1 ml en cada fosa nasal).
Para niños que no han sido vacunados antes contra la gripe estacional, debe administrarse una segunda dosis tras un intervalo mínimo de 4 semanas.
FLUENZ no debe usarse en bebés ni a niños de menos de 24 meses por motivos de seguridad (ver sección 4.4).

Forma de administración
La inmunización debe llevarse a cabo por administración nasal. NO INYECTAR FLUENZ.
Ver sección 6.6 para conocer las instrucciones de administración.
4.3 Contraindicaciones xcf
tigia )
Hipersensibilidad a los principios activos, a alguno de los excipientes incluidos en la sección 6.1 (p. ej., la gelatina), a la gentamicina (un posible residuo vestigia’), a los huevos o a las proteínas del huevo (p. ej., la ovoalbúmina).
Niños y adolescentes clínicamente inmunodeficiente s por afecciones o por tratamientos inmunosupresores como: leucemias agudas y crónicas, linfoma, infección sintomática por el VIH, deficiencias inmunitarias celulares y dosis encadas de corticoesteroides. FLUENZ no está contraindicado para su empleo en personas con infección asintomática por el VIH ni en personas que reciben corticoesteroides tópicos/inha^dos o corticoesteroides sistémicos a dosis bajas, ni en quienes reciben corticoesteroides como tratamiento sustitutivo, p. ej. en la insuficiencia suprarrenal.
Niños y adolescentes menores de 18 años que reciben tratamiento con salicilato, debido a la asociación del síndrome de Reye con los salicilatos y la infección por cepas salvajes del virus influenza.
4.4 Advertencias y

uciones especiales de empleo
Como ocurre con la mayoría de las vacunas, se debe disponer siempre de supervisión y tratamiento médico adecuados por si se produce un episodio anafiláctico tras la administración de FLUENZ.
No se debe administrar FLUENZ a niños y adolescentes con asma grave o sibilancias activas porque estas personas no han sido estudiadas adecuadamente en los estudios clínicos.
No administrar FLUENZ a bebés ni a niños menores de 12 meses. En un estudio clínico, se observó un aumento de las hospitalizaciones en bebés y en niños menores de 12 meses después de su vacunación (ver sección 4.8). No se recomienda administrar FLUENZ a bebés ni a niños de 12-23 meses. En un estudio clínico, se observó un aumento de la tasa de sibilancias en bebés y en niños de 12-23 meses después de su vacunación (ver sección 4.8).
Se debe comunicar a los receptores de la vacuna que FLUENZ es una vacuna de virus vivos atenuados y tiene potencial de transmisión a contactos inmunodeprimidos. Los receptores de la vacuna deben intentar evitar, en lo posible, el contacto estrecho con personas gravemente inmunodeprimidas (p. ej., receptores de transplantes de médula ósea que requieren aislamiento) durante 1-2 semanas después de la vacunación. La incidencia máxima de recuperación del virus vacunal tuvo lugar 2-3 días después de la vacunación en los estudios clínicos. En circunstancias en las que sea inevitable el contacto con personas gravemente inmunodeprimidas, el posible riesgo de transmisión del virus vacunal contra la gripe debe evaluarse frente al riesgo de adquirir y transmitir cepas salvajes del virus influenza.
FLUENZ no debe inyectarse en ningún caso.
No existen datos acerca de la seguridad de la administración intranasal de FLUENZ a niños con malformaciones craneofaciales sin reparar.
4.5 Interacción con otros medicamentos y otras formas de interacción
No administrar FLUENZ a niños ni a adolescentes menores de 18 años que estén recibiendo tratamiento con salicilato (ver sección 4.3). No utilizar salicilatos en niños ni en adolescentes menores de 18 años durante las 4 semanas posteriores a la vacunación a menos que esté médicamente indicado ya que se ha registrado el síndrome de Reye tras el uso de salicilatos durante la infección por cepas salvajes del virus influenza.
éola. inact
Se ha estudiado la coadministración de FLUENZ con las vacunas vivas atenuadas contra el sarampión, las paperas, la rubéola, la varicela y el poliovirus de administración oral. No se han observado cambios clínicamente relevantes en la respuesta inmunitaria al sarampión, las paperas, la varicela, al poliovirus de administración oral o a FLUENZ. La respuesta inmunitaria a la vacuna de la rubéola se vio alterada de forma significativa. No obstante, esta alteración podría carecer de relevancia clínica con el programa de inmunización con dos dosis de la vacuna contra la rubéola.
No se ha estudiado la coadministración de FLUENZ con vacunas nactivadas.
./I?
No se ha evaluado el uso concurrente de FLUENZ con agentes antivíricos activos contra los virus influenza A y/o B. No obstante, basándose en el potencial de los agentes antivíricos contra la gripe para reducir la efectividad de FLUENZ, se recomienda no administrar la vacuna hasta 48 horas después de la interrupción del tratamiento antivírico contra la gripe. La administración de agentes antivíricos contra la gripe en el plazo de dos semanas después de la vacunación puede afectar a la respuesta de la vacuna.
Si se administran simultáneamente agentes antivíricos contra la gripe y FLUENZ, debe contemplarse la revacunación cuando corresponda.
4.6 Fertilidad, embarazo
Embarazo
Hay datos limitados

ancia
os al uso de FLUENZ en mujeres embarazadas.
Aunque los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción, no se recomienda utilizar FLUENZ durante el embarazo.
Lactancia
Se desconoce si FLUENZ se excreta en la leche materna. Por tanto, como algunos virus se excretan en la lecha materna, FLUENZ no debe utilizarse durante la lactancia.
Fertilidad
No existen datos acerca de los posibles efectos de FLUENZ sobre la fertilidad masculina y femenina.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Es improbable que la vacuna tenga efecto alguno sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Los datos de seguridad acerca del uso de FLUENZ se compilaron a partir de más de 28.500 niños y adolescentes de 2 a 17 años en estudios clínicos y de más de 52.500 niños y adolescentes en estudios de seguridad posteriores a su autorización. Se ha obtenido experiencia adicional con el uso de esta vacuna durante su comercialización.
Aunque se ha establecido la seguridad en niños y adolescentes con asma leve o moderada, los datos en niños con otras enfermedades pulmonares o con enfermedades cardiovasculares, metabólicas o renales crónicas son limitados. En estudios de adultos en los que un porcentaje elevado de las personas padecía afecciones crónicas subyacentes, el perfil de seguridad de FLUENZ fue comparable al perfil de seguridad observado en personas sin estas afecciones.
Resumen de reacciones adversas
congest
La reacción adversa observada con más frecuencia en los estudios clínicos fue la congestión nasal/rinorrea.
Las frecuencias de las reacciones adversas se definen como: Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a < 1/10)
Poco frecuentes (> 1/1.000 a < 1/100)
Muy raras (< 1/10.000)
/
Trastornos del sistema inmunológico
Poco frecuentes: reacciones de hipersensibilidad (incluyendo edema facial, urticaria y reacciones anafilácticas muy raras)
Trastornos del metabolismo y de la nutrición Muy frecuentes: disminución del apetito -On
O
Trastornos del sistema nervioso Muy frecuentes: cefalea
Trastornos respiratorios, torácicos y mediastínicos Muy frecuentes: congestión nasal/rinorrea Poco frecuentes: epistaxis
Trastornos de la piel y del tejido subcutáneo Poco frecuentes: exantema
Trastornos musculoesqueléticos y del tejido conjuntivo Frecuentes: mialgia
Trastornos generales y alteraciones en el lugar de administración Muy frecuentes: malestar Frecuentes: pirexia
En un estudio clínico controlado con tratamiento activo (MI-CP111) se observó un aumento de la tasa de hospitalización (por cualquier causa) hasta 180 días después de la dosis final de vacunación en bebés y niños de 6-11 meses (FLUENZ 6,1% frente a vacuna inyectable contra la gripe 2,6%).
La tasa de hospitalización no se vio incrementada en los receptores de FLUENZ mayores de 12 meses. En el mismo estudio se observó un aumento de la tasa de sibilancias hasta 42 días en bebés y niños de 6-23 meses (FLUENZ 5,9% frente a vacuna inyectable contra la gripe 3,8%). La tasa de sibilancias no se vio incrementada en los receptores de FLUENZ mayores de 24 meses. FLUENZ no está indicado para uso en bebés ni en niños menores de 24 meses (ver sección 4.4).
Se han observado también casos muy raros del síndrome de Guillain-Barré y de exacerbación de los síntomas del síndrome de Leigh (encefalomiopatía mitocondrial) durante el período de comercialización.
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Anexo V.
4.9 Sobredosis
/X

NZ
es a las
Ha habido casos ocasionales de administración del doble de la dosis recomendada de FL durante el período de comercialización. Las reacciones adversas registradas fueron observadas con la dosis única recomendada de FLUENZ.
5. PROPIEDADES FARMACOLOGICAS 5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: vacunas contra la gripe, influenza viva atenuada, código ATC: J07BB03
XV
Las cepas del virus influenza de FLUENZ están (a) adaptadas al frío (af); son (b) sensibles a la temperatura (st); y están (c) atenuadas (at). Como consecuencia, se multiplican en la nasofaringe e inducen una inmunidad protectora.
A.
Eficacia
FLUENZ ha sido administrado a más de 3 0.000 personas en estudios clínicos controlados a lo largo de varios años, en diversas regiones y utilizando distintas cepas de vacuna.
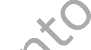
Estudios pediátricos
Los datos de eficacia de FLUENZ en la población pediátrica consisten en 9 estudios controlados que incluyeron a más de 20.000 bebés, niños y adolescentes, realizados durante 7 temporadas de gripe. Cuatro estudios controlados con placebo incluyeron revacunación en la segunda temporada. FLUENZ ha demostrado superioridad en 3 estudios controlados con tratamiento activo con vacuna inyectable contra la gripe. Vei en las Tablas 1 y 2 un resumen de los resultados de eficacia en la población pediátrica.
Tabla 1 Eficacia de FLUENZ en estudios pediátricos controlados con placebo
|
Número del estudio |
Región |
Intervalo de edada |
Número de participantes en el estudio |
Temporada de gripe |
Eficacia (IC al 95%)b Cepas coincidentes |
Eficacia (IC al 95%)b Todas las cepas independientemente de la coincidencia |
|
D153-P502 |
Europa |
6 a 35 M |
1.616 |
2000-2001 |
85,4% (74,3; 92,2) |
85,9% (76,3; 92,0) |
|
2001-2002 |
88,7% (82,0; 93,2) |
85,8% (78,6; 90,9) | ||||
|
D153-P504 |
África, Latinoamé-rica |
6 a 35 M |
1.886 |
2001 |
73,5% (63,6; 81,0) |
72,0% (61,9; 79,8)c |
|
2002 |
73,6% (33,3; 91,2) |
46,6% (14,9; 67,2) |
|
Número del estudio |
Región |
Intervalo de edada |
Número de participantes en el estudio |
Temporada de gripe |
Eficacia (IC al 95%)b Cepas coincidentes |
Eficacia (IC al 95%)b Todas las cepas independientemente de la coincidencia |
|
D153-P513 |
Asia/Oceanía |
6 a 35 M |
2.107 |
2002 |
62,2% (43,6; 75,2) |
48,6% (28,8; 63,3) |
|
D153-P522 |
Europa, Asia/Oceanía, Latinoamé-rica |
11 a 24 M |
1.150 |
2002-2003 |
78,4% (50,9; 91,3) |
63,8% (36,2; 79,8) |
|
D153-P501 |
Asia/Oceanía |
12 a 35 M |
2.764 |
2000-2001 |
72,9% (62,8; 80,5) |
70,1% (60,9; 77,3) |
|
2001-2002 |
84,3% (70,1; 92,4)d |
64,2% (44,2; 77,3)d | ||||
|
AV006 |
EE. UU. |
15 a 71 M |
1.259 |
1996-1997 |
93,4% (87,5; 96,5) |
93,4% (87,5; 96,5) |
|
1997-1998 |
100% (63,1; 100) |
87,1% (77,7; 92,6)e |
a M = meses.
b Reducción de la enfermedad de gripe confirmada por cultivo con respecto al placebo.
Los datos presentados para el ensayo clínico D153-P504 son de participantes en el esutbo que recibieron dos dosis de la vacuna en estudio. En los participantes en el estudio sin vacunación antera que recibieron una dosis en el año 1, la eficacia fue del 57,7% (IC al 95%: 44,7; 67,9) y del 56,3% (IC al 95%: 43,1; 66,7), respectivamente, lo cual respalda la necesidad de dos dosis de vacuna en niños sin vacunación anterior. d En los participantes en el estudio que recibieron 2 dosis en el año 1 y placebo en el año 2, la eficacia en el año 2 fue del 56,2% (IC al 95%: 30,5; 72,7) y del 44,8% (IC al 95%: 18,2; 62,9), respectivamente, en D153-P501, respaldando así la necesidad de la revacunación en la segunda temporada.
e La principal cepa circulante era antigénicamente diferente de la cepa H3N2 vacunal; la eficacia contra la cepa no coincidente A/H3N2 fue del 85,9% (IC al 95%: 75,3; 91,9).
Tabla 2 Eficacia relativa de FLUENZ en estudios pediátricos controlados con tratamiento activo con vacuna inyectable contra 'a gripe
|
Número del estudio |
Región |
Intervalo de edada |
Número de participantes en el estudio |
Temporada de gripe |
Eficacia mejorada (IC al 95%)b Cepas coincidentes |
Eficacia mejorada (IC al 95%)b Todas las cepas independientemente de la coincidencia |
|
MI-CP111 |
EE. UU., Europa, Asia/Oceanía aO |
6 a 59 M |
7.852 |
2004-2005 |
44,5% (22,4; 60,0) menos casos que el inyectable |
54,9% (45,4; 62,9)c menos casos que el inyectable |
|
D153-P514 |
E Europa |
6 a 71 M |
2.085 |
2002-2003 |
52,7% (21,6; 72,2) menos casos que el inyectable |
52,4% (24,6; 70,5)d menos casos que el inyectable |
|
D153-P515 |
Europa |
6 a 17 A |
2.211 |
2002-2003 |
34,7% (3,9; 56,0) menos casos que el inyectable |
31,9% (1,1; 53,5) menos casos que el inyectable |
a M = meses. A = años. Intervalo de edad como se describió en el protocolo del estudio. b Reducción de la enfermedad de gripe confirmada por cultivo con respecto a la vacuna inyectable contra la gripe.
c FLUENZ demostró un 55,7% (39,9; 67,6) menos de casos que la vacuna inyectable contra la gripe en 3.659 bebés y niños de 6-23 meses y un 54,4% (41,8; 64,5) menos de casos en 4.166 niños de 24-59 meses.
d FLUENZ demostró un 64,4% (1,4; 88,8) menos de casos que la vacuna inyectable contra la gripe en 476 bebés y niños de 6-23 meses y un 48,2% (12,7; 70,0) menos casos en 1.579 niños de 24-71 meses.
Estudios en adultos
Varios estudios frente a placebo han mostrado que FLUENZ puede tener cierta eficacia en adultos. No obstante, no se pudo alcanzar una conclusión acerca del beneficio clínico de esta vacuna en adultos dado que los resultados observados en algunos estudios frente a vacunas inyectables contra la influenza insinuaron una menor eficacia de FLUENZ.
5.2 Propiedades farmacocinéticas
No procede.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos con FLUENZ no muestran riesgos especiales para los seres humanos según los estudios convencionales no clínicos de toxicidad a dosis repetidas, toxicidad para la reproducción y el desarrollo, tolerancia local y neurovirulencia.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Sacarosa
Fosfato potásico dibásico Fosfato potásico monobásico Gelatina (porcina, Tipo A)
Clorhidrato de arginina Monohidrato de glutamato monosódico Agua para inyección
6.2 Incompatibilidades
ste m
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
spec
c
es de conservación
Conservar en nevera (entre 2°C y 8°C). No congelar.
de la lu
Proteger de la luz.
Antes del uso, la vacuna puede sacarse de la nevera, sin volver a guardarla en la nevera, durante un periodo máximo de 12 horas a una temperatura de hasta 25 °C. Si no se ha utilizado tras este periodo de 12 horas, la vacuna debe desecharse.
6.5 Naturaleza y contenido del envase
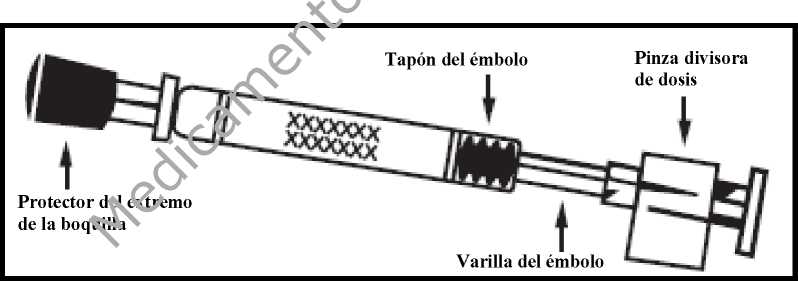
FLUENZ se suministra como una suspensión de 0,2 ml en un aplicador nasal de un solo uso (de vidrio Tipo 1) con boquilla (de polipropileno con válvula de transferencia de polietileno), cápsula protectora del extremo de la boquilla (goma sintética), varilla del émbolo, tapón del émbolo (goma de butilo) y una pinza divisora de dosis.
Tamaño del envase de 10 unidades.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Administración
FLUENZ DEBE UTILIZARSE POR VÍA NASAL ÚNICAMENTE. • NO UTILIZAR CON UNA AGUJA. No inyectar.

• FLUENZ se administra como dosis dividida en ambas fosas nasales.
• Tras administrar la mitad de la dosis en una fosa nasal, administrar la otra mitad de la dosis en la otra fosa nasal inmediatamente o poco después.
• El paciente puede respirar normalmente mientras se administra la vacuna; no hace falta inhalar ni aspirar activamente por la nariz.
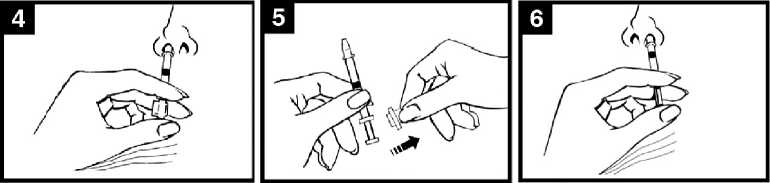
• Consultar el diagrama de administración de FLUENZ (Figura 1) para conocer las instrucciones de administración paso a paso.
Figura 1 Administración de FLUENZ
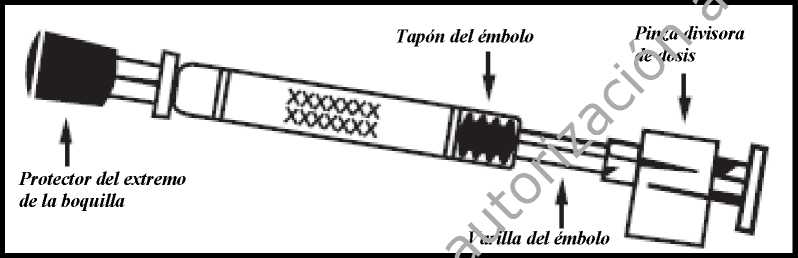
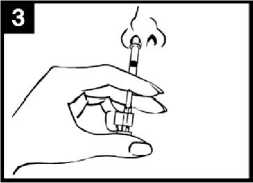
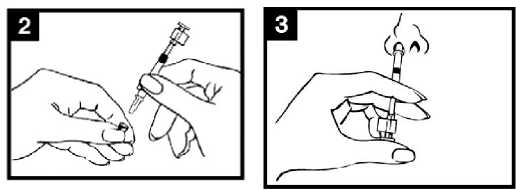
Preparar el aplicador
Retirar la cápsula de goma protectora del extremo. No retirar la pinza divisora de dosis que hay en el otro extremo del aplicador.
Comprobar la fecha de caducidad
El producto debe utilizarse antes de la fecha indicada en la etiqueta del aplicador.
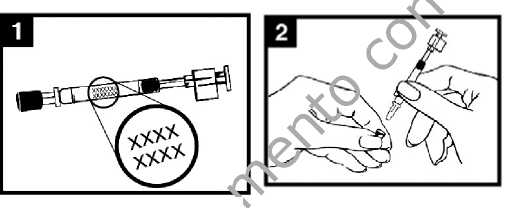
Colocar el aplicador
Con el paciente en posición vertical, colocar el extremo dentro de la fosa nasal para garantizar que FLUENZ se administra en la nariz.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN

La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local para desechos médicos.
Presionar el émbolo
Con un solo movimiento, presionar el émbolo lo más rápidamente posible hasta que la pinza divisora de dosis impida continuar.
Retirar la pinza divisora de dosis
Para administrar en la otra fosa nasal, pinzar y retirar la pinza divisora de dosis del émbolo.
Pulverizar en la otra fosa nasal
Colocar el extremo inmediatamente dentro de la otra fosa nasal y, con un solo movimiento, presionar el émbolo
lo más rápidamente posible para administrar el resto de la vacuna.
MedImmune, LLC Lagelandseweg 78 6545 CG Nimega Países Bajos (Tel) +31 24 371 7310
r\
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
cr
EU/1/10/661/002
N" . .
9. FECHA DE LA PRIM ERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
'a
Fecha de la primei? autorización: 27 de enero 2011
cH.€T ,
10. FECHA de la revisión del texto
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.

ANEXO II
A.
B.
FABRICANTES DEL (DE LOS) PRJNC'IPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D.
CONDICIO
UTILIZACI
. O RESTRICCIONES EN RELACIÓN CON LA SEGURA Y EFICAZ DEL MEDICAMENTO

A. FABRICANTES DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes del (de los) principio(s) activo(s) biológico(s).
MedImmune, LLC 297 North Bernardo Avenue, Mountain View California, 94043 EE. UU.
MedImmune, LLC 3055 Patrick Henry Drive Santa Clara California, 95054 EE. UU.
MedImmune, UK Limited
Plot 6, Renaissance Way, Boulevard Industry Park, Speke
Liverpool
L24 9JW
O
Reino Unido
Nombre y dirección del fabricante responsable de la liberación de los lotes
p
MedImmune, UK Limited
Plot 6, Renaissance Way, Boulevard Industry Park, Speke Liverpool L24 9JW Reino Unido
eke
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
*S>
ICCIONES DE SUMINISTRO Y USO
B. CONDICIONES O RESTRI
Medicamento sujeto a prescripción médica.
• Liberación oficial de lotes
De conformidad con el artículo 114 de la Directiva 2001/83/CE modificada, la liberación oficial de los lotes será realizada por un laboratorio estatal o uno designado a tal efecto.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado anualmente hasta la renovación.
Cuando coincida la presentación de un informe periódico de seguridad con la actualización del PGR, ambos documentos deberán presentarse conjuntamente.
o res
'b
Además, se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado
de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos). V




ANEXO III
ETIQUETADO Y PROSPECTO


INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
ENVASE DE 10 APLICADORES NASALES DE UN SOLO USO
(2 X 5 APLICADORES NASALES)_
1. NOMBRE DEL MEDICAMENTO
FLUENZ suspensión para pulverización nasal Vacuna contra el virus influenza (viva atenuada, nasal) Temporada 2013/2014
2. PRINCIPIO(S) ACTIVO(S)
Virus influenza reagrupado* (vivo atenuado) de las siguientes cepas**: A/California/7/2009 cepa similar a (H1N1)pdm09
(A/California/7/2009, MEDI 228029) 107,0 ± 0,5 UFF***
A/Victoria/361/2011 cepa similar a (H3N2) (A/Texas/50/2012, MEDI 237514)
107,0 ± °,5 uff***
por dosis de 0,2 ml
B/Massachusetts/2/2012 cepa similar a (B/Massachusetts/2/2012, MEDI 237751)
* multiplicado en huevos de gallina fertilizados de gallineros sanos.
** producidas en células VERO por tecnología genética inversa.
** *
unidades de focos fluorescentes.
es d
O'
Esta vacuna cumple las recomendaciones de la OMS (Hemisferio Norte) y la decisión de la UE para la temporada 2013/2014.
__
3. LISTA DE EXCI
PIEN
TES
Contiene también: sacarosa, fosfato potásico dibásico, fosfato potásico monobásico, gelatina (porcina, Tipo A), clorhidrato de arginina, monohidrato de glutamato monosódico, agua para inyección.
4
RMA
FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión para pulverización nasal
10 aplicadores nasales de un solo uso (0,2 ml cada uno)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Solamente para uso por vía nasal. No inyectar.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN

Leer el prospecto para obtener instrucciones acerca de la eliminación de los medicamentos que ya no son necesarios. 'O*
__
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE
COMERCIALIZACIÓN
-sV
MedImmune, LLC Lagelandseweg 78 6545 CG Nimega Países Bajos
12. N

(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/661/002 < 10 pulverizadores >
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille

INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS ENVASE DE 5 APLICADORES NASALES DE UN SOLO USO
1. NOMBRE DEL MEDICAMENTO
FLUENZ suspensión para pulverización nasal Vacuna contra el virus influenza (viva atenuada, nasal) Temporada 2013/2014

Solamente para uso por vía nasal. No inye ctar.
5 aplicadores nasales de un solo uso (0,2 ml cada uno)
vO
Conservar en nevera. No congelar.

INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
APLICADOR NASAL DE UN SOLO USO
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
FLUENZ
Vacuna contra el virus influenza Temporada 2013/2014
|
2. |
FORMA DE ADMINISTRACIÓN | |
|
Solamente para uso por vía nasal. | ||
|
3. |
FECHA DE CADUCIDAD | |
|
EXP |
O | |
|
4. |
NÚMERO DE LOTE | |
|
Lot |
;<e | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES | |
|
0,2 ml | ||
|
6. |
OTROS | |

Prospecto: información para el usuario
Fluenz suspensión para pulverización nasal
Vacuna contra el virus influenza (viva atenuada, nasal)
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de administrar la vacuna, porque contiene información importante para usted o para su hijo.
Conserve este prospecto, ya que puede tener que volver a leerlo.
Si tiene alguna duda, consulte a su médico, enfermero o farmacéutico.
Esta vacuna se le ha recetado solamente a usted o a su hijo y no debe dársela a otras personas. Si considera que alguno de los efectos adversos que sufre es grave, consulte a su médico, enfermero o farmacéutico. Esto incluye cualquier efecto adverso posible no mencionado en este prospecto. Ver sección 4.
Contenido del prospecto:
oN
1. Qué es Fluenz y para qué se utiliza
2. Qué necesita saber antes de administrar Fluenz
3. Cómo se administra Fluenz
4. Posibles efectos adversos
5. Conservación de Fluenz
6. Contenido del envase e información adicional
1. Qué es Fluenz y para qué se utiliza
Fluenz es una vacuna para prevenir la gripe. Se utiliza en niños y adolescentes de más de 24 meses
y menos de 18 años.
vO
Cuando se administra la vacuna a una persona, el sistema inmunitario (el sistema de defensa natural del organismo) produce su propia protección contra el virus de la gripe. Ninguno de los componentes de la vacuna puede provocar la gripe.
Los virus de la vacuna Fluenz se cultivan en huevos de gallina. La vacuna actúa contra tres cepas del virus de la gripe cada año, siguiendo las recomendaciones anuales de la Organización Mundial de la Salud.
2. Qué necesita saber antes de administrar Fluenz
No se le administrará Fluenz
• si es alérgico a los huevos, a las proteínas del huevo, a la gentamicina, a la gelatina o a cualquiera de los demás componentes de Fluenz (estos se enumeran en la sección 6 “Contenido del envase e información adicional”). Para conocer los signos de las reacciones alérgicas, ver la sección 4 “Posibles efectos adversos”.
• si padece un trastorno de la sangre o un cáncer que afecte al sistema inmunitario.
• si su médico le ha dicho que tiene usted el sistema inmunitario debilitado a consecuencia de una enfermedad, medicamento u otro tratamiento.
• si tiene menos de 18 años y ya está tomando ácido acetilsalicílico (una sustancia presente en muchos medicamentos utilizados para aliviar el dolor y bajar la fiebre). Esto se debe al riesgo de una enfermedad muy rara pero grave (el síndrome de Reye).
Si se cumple alguna de estas condiciones, informe a su médico, enfermero o farmacéutico.
Advertencias y precauciones
Informe a su médico, enfermero o farmacéutico antes de la vacunación:
• si el niño tiene menos de 24 meses. No se debe vacunar a los niños menores de 24 meses debido al riesgo de los efectos adversos.
• si padece asma grave o actualmente sibilancias.
• si está en contacto estrecho con alguien que tiene el sistema inmunitario fuertemente debilitado (por ejemplo, un paciente trasplantado de médula ósea que necesita aislamiento).
Si se cumple alguna de estas condiciones, informe a su médico, enfermero o farmacéutico antes de la vacunación. Él o ella decidirá si Fluenz es adecuado para usted.
&
ao, ha
Otros medicamentos, otras vacunas y Fluenz
Informe a su médico, enfermero o farmacéutico si la persona vacunada está utilizando, ha utilizado
recientemente o podría tener que utilizar cualquier otro medicamento.
• No administre ácido acetilsalicílico a los menores de 18 años durante 4 semanas después de la vacunación con Fluenz a menos que su médico, enfermero o farmacéutico le indique lo contrario. Esto se debe al riesgo de sufrir síndrome de Reye, una enfermedad muy rara, pero grave, que puede perjudicar al cerebro y al hígado.
• Se recomienda no administrar Fluenz al mismo tiempo que medicamentos antivíricos específicos contra la gripe. Esto se debe a que la vacuna podría perder eficacia.
Su médico, enfermero o farmacéutico decidirán si se puede administrar Fluenz al mismo tiempo que
otras vacunas.
Embarazo y lactancia
• Si está embarazada, cree que podría estar embarazada, tiene intención de quedarse embarazada o está en periodo de lactancia, consulte a su médico, enfermero o farmacéutico antes de utilizar esta vacuna. Fluenz no se recomienda para mujeres embarazadas o en periodo de lactancia.
vO
3. Cómo se administra Fluenz
Fluenz solo debe utilizarse en pulverización nasal. Fluenz no , debe ,,
n o dete
Fluenz se administrará como una pulverización en cada fosa nasal. Puede respirar con normalidad mientras se le administra Fluenz. No hace falta que inhale ni aspire activamente.
Posología
• La dosis recomendada para niños y adolescentes es de 0,2 ml de Fluenz, administrados a razón de 0,1 ml en cada fosa nasal.
• Los niños que no han sido vacunados antes contra la gripe recibirán una segunda dosis de seguimiento tras un intervalo mínimo de 4 semanas. Siga las instrucciones de su médico, enfermero o farmacéutico acerca de cuándo debe acudir su hijo para la segunda dosis.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Fluenz puede producir efectos adversos, aunque no todas las personas los sufran.
Consulte a su médico, enfermero o farmacéutico si desea más información acerca de los posibles efectos adversos de Fluenz.
Algunos efectos adversos pueden ser graves.
Muy raros
(pueden afectar hasta a 1 de cada 1.000.000 personas)
• reacciones alérgicas graves: entre los signos de reacción alérgica pueden figurar dificultad para respirar e hinchazón de la cara o de la lengua.
Informe a su médico de inmediato o busque atención sanitaria urgente si nota alguno de estos síntomas.
O
&
Otros posibles efectos adversos de Fluenz Muy frecuentes
(pueden afectar a más de 1 de cada 10personas):
• nariz congestionada o con mocos
• disminución del apetito
• debilidad
• dolor de cabeza
Frecuentes
(pueden afectar hasta a 1 de cada 10personas):
• fiebre
o°
• dolores musculares -S>
Poco frecuentes
(pueden afectar hasta a 1 de cada 100personas):
• erupción cutánea
• hemorragia nasal
• reacciones alérgicas
siy
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicados directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento. 1
Antes del uso, la vacuna puede sacarse de la nevera, sin volver a guardarla en la nevera, durante un periodo máximo de 12 horas a una temperatura de hasta 25 °C. Si no se ha utilizado tras este periodo de 12 horas, la vacuna debe desecharse.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local para desechos médicos. Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Fluenz
Los principios activos son:
Virus influenza reagrupado* (vivo atenuado) de las siguientes cepas**:
A/California/7/2009 cepa similar a (H1N1)pdm09 (A/California/7/2009, MEDI 228029)
A/Victoria/361/2011 cepa similar a (H3N2) (A/Texas/50/2012, MEDI 237514)
B/Massachusetts/2/2012 cepa similar a (B/Massachusetts/2/2012, MEDI 237751)
107,0 ± 0,' UFF***
7,0 ± 0,5
107,0 ± 0,1 uff***
.......
......
.por dosis de 0,2 ml
* multiplicado en huevos de gallina fertilizados de gallineros sanos.
** producidas en células VERO por tecnología genética inversa. Este producto contiene
organismos modificados genéticamente (OMG). unidades de focos fluorescentes cr
ón d
Esta vacuna cumple con la recomendación de la OMS (Organización Mundial de la Salud, Hemisferio Norte) y la decisión de la UE para la temporada 2013/2014.
Los demás componentes son sacarosa, fosfato potásico dibásico, fosfato potásico monobásico, gelatina (porcina, Tipo A), clorhidrato de arginina, monohidrato de glutamato monosódico y agua para inyección.
Aspecto del producto y contenido del envase
Esta vacuna se presenta en suspensión para pulverización nasal en un aplicador nasal de un solo uso (0,2 ml) en un tamaño de envase de 10 unidades.
La suspensión es un líquido incoloro a amarillo claro, transparente a ligeramente turbio.
Puede presentar pequeñas partículas blancas.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización: MedImmune, LLC, Lagelandseweg 78, 6545 CG Nijmegen, Países Bajos, (Tel) +31 24 371 7310
Responsable de la fabricación: MedImmune, UK Limited, Plot 6, Renaissance Way, Boulevard Industry Park, Speke, Liverpool, L24 9JW, Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
NV AstraZeneca SA Tel: +32 2 370 48 11
Etarapun
Tn AstraZeneca UK Limited Tea.: +359 2 971 25 33
Lietuva
UAB ,,AstraZeneca Lietuva“ Tel: +370 5 2660550
Luxembourg/Luxemburg
NV AstraZeneca SA Belgique/Belgien Tél/Tel: +32 2 370 48 11
Ceská republika
AstraZeneca Czech Republic s.r.o. Tel: +420222807111
Danmark
AstraZeneca A/S Tlf: +45 43 66 64 62
Deutschland
AstraZeneca GmbH Tel: +49 41 03 7080
Eesti
AstraZeneca Eesti OÜ Tel: +372 6549 600
EXlába
AstraZeneca A.E.
T^k: +302 106871500
G°
España
AstraZeneca Farmacéutica Spain, S.A. Tel: +34 91 301 91 00
France
AstraZeneca
Tél: +33 1 41 29 40 00
Hrvatska AstraZenecr ; d o.o.
Tel: +385 ■ 4628 000
Magyarország
AstraZeneca Kft Tel.: +36 1 883 6500
Malta
Associated Drug Co. Ltd Tel: +356 2277 8000
/V
Nederland
AstraZeneca BV Tel: +31 79 363 2222
Norge
AstraZeneca AS Tlf: +47 21 00 64 00
¿y
Csterreich
AstraZeneca Osterreich GmbH Tel: +43 1 711 31 0
Polska
AstraZeneca Pharma Poland Sp. z o.o. Tel.: +48 22 874 35 00
Portugal
AstraZeneca Produtos Farmacéuticos, Lda. Tel: +351 21 434 61 00
Romania
AstraZeneca Pharma SRL Tel: +40 21 317 60 41
Slovenija
AstraZeneca UK Limited Tel: +386 1 51 35 600
Ireland
AstraZeneca Pharmaceuticals (Ireland) Ltd Tel: +353 1609 7100
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika
AstraZeneca AB o.z. Tel: +421 2 5737 7777
Italia
AstraZeneca S.p.A. Tel: +39 02 98011
Suomi/Finland
AstraZeneca Oy Puh/Tel: +358 10 23 010
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema. europa.eu.
Fluenz es una marca comercial de MedImmune, LLC.
Esta información está destinada únicamente a médicos o profesionales del sector sanitario:
Fluenz debe utilizarse por vía nasal únicamente.
No utilizar con una aguja. No inyectar.

amba
c>'
• Fluenz se administra como dosis dividida en ambas fosas nasales tal y como se describe a continuación. (Ver también Cómo se administra Fluenz, en la sección 3).
• Tras administrar la mitad de la dosis en una fosa nasal, administrar la otra mitad de la dosis en la otra fosa nasal inmediatamente o poco después.
• El paciente puede respirar normalmente mientras se administra la vacuna; no hace falta inhalar ni aspirar activamente por la nariz.
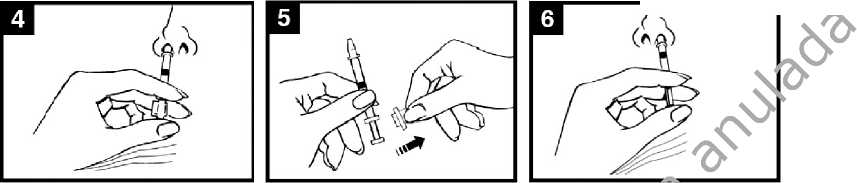
Pulveriza^ en la i sal
otra
Retirar la pinza divisora de dosis
Para administrar en la otra fosa nasal, pinzar y retirar la pinza divisora de l de dosis del émbolo. con
pres
Comprobar la fecha de caducidad
El producto debe utilizarse antes de la fecha indicada en la etiqueta del aplicador.
Presionar el émbolo
Con un solo movimiento, presionar el émbolo lo más rápidamente posible hasta que la pinza divisora de dosis impida continuar.
Preparar el aplicador
Retirar la cápsula de goma protectora del extremo. No retirar la pinza divisora de dosis que hay en el otro extremo del aplicador.
Colocar el aplicador
Con el paciente en posición vertical, colocar el extremo dentro de la fosa nasal para garantizar que Fluenz se administra en la nariz.
fosa nasal
Colocar el extremo inmediatamente dentro la otra fosa nasal y, un solo movimiento, presionar el émbolo lo más rápidamente posible para administrar el resto de la vacuna.
O
Ver la sección 5 para obtener información acerca de la conservación y eliminación

28
Conservación de Fluenz
Mantener esta vacuna fuera de la vista y del alcance de los niños.
No utilice Fluenz después de la fecha de caducidad que aparece en la etiqueta del aplicador después de las letras EXP.
Conservar en nevera (entre 2°C y 8°C). No congelar.
Proteger de la luz.