Fluarix Suspension Inyectable En Jeringa Precargada
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Fluarix suspensión inyectable en jeringa precargada Vacuna antigripal (de virus fraccionados e inactivados)
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Virus de la gripe (fraccionados, inactivados) de las siguientes cepas*:
Cepa similar a A/California/7/2009 (H1N1)pdm09: (NIB-74xp)
derivada de A/Christchurch/16/2010 15 microgramos de HA**
Cepa similar a A/Hong Kong/4801/2014 (H3N2): (NYMC X-263B)
derivada de A/Hong Kong/4801/2014 15 microgramos de HA**
Cepa similar a B/Brisbane/60/2008: (salvaje)
derivada de B/Brisbane/60/2008 15 microgramos de HA**
por dosis de 0,5 ml
* propagados en huevos embrionados de gallina procedentes de grupos de pollos sanos ** hemaglutinina
Esta vacuna cumple con la recomendación de la Organización Mundial de la Salud (OMS) para el hemisferio Norte y con la recomendación de la Unión Europea para la campaña 2016/2017.
Excipientes con efecto conocido
Este medicamento contiene aproximadamente 3,75 mg de cloruro de sodio y aproximadamente 1,3 mg de hidrógeno fosfato de sodio dodecahidrato por dosis (ver sección 4.4).
Este medicamento contiene aproximadamente 0,2 mg de dihidrogenofosfato de potasio y aproximadamente 0,1 mg de cloruro de potasio por dosis (ver sección 4.4).
Fluarix puede contener trazas de huevos (tales como ovoalbúmina y proteínas de pollo), de formaldehído, de sulfato de gentamicina y de desoxicolato de sodio puesto que son empleados durante el proceso de fabricación (ver sección 4.3).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión inyectable en jeringa precargada.
La suspensión es de incolora a ligeramente opalescente.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Profilaxis de la gripe, especialmente en los sujetos que tengan un mayor riesgo de complicaciones asociadas a la gripe.
Fluarix está indicado en adultos y niños a partir de los 6 meses de edad.
El uso de Fluarix debe estar basado en las recomendaciones oficiales.
4.2 Posología y forma de administración
4.2.1 Posología Adultos: 0,5 ml
Población pediátrica
Niños de 36 meses en adelante: 0,5 ml.
Niños entre 6 meses y 35 meses: los datos clínicos son limitados. Se pueden administrar dosis de 0,25 ml o 0,5 ml. Para consultar las instrucciones sobre cómo administrar una dosis de 0,25 ml o 0,5 ml, ver sección
6.6. La dosis administrada debe estar de acuerdo con las recomendaciones nacionales vigentes.
En los niños menores de 9 años que no hayan sido previamente vacunados frente a la gripe debe administrarse una segunda dosis después de un intervalo de al menos 4 semanas.
Niños menores de 6 meses: no se ha establecido la eficacia ni la seguridad de Fluarix en niños menores de 6 meses. No se dispone de datos.
4.2.2 Forma de administración
La inmunización se debe realizar por inyección intramuscular o subcutánea profunda.
Precauciones que deben tomarse antes de manipular o administrar este medicamento.
Para consultar las instrucciones de preparación del medicamento antes de la administración, ver sección
6.6.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1 o a cualquier componente que pueda estar presente en cantidades trazas, tales como los huevos (ovoalbúmina, proteínas de pollo), el formaldehído, el sulfato de gentamicina y el desoxicolato de sodio.
La inmunización se pospondrá en sujetos que padezcan una enfermedad febril o una infección aguda.
4.4 Advertencias y precauciones especiales de empleo
Como sucede con todas las vacunas inyectables, se debe disponer de un acceso fácil a la supervisión y tratamiento médico apropiados en el caso de que se presente una reacción anafiláctica tras la administración de la vacuna.
En ningún caso se debe administrar Fluarix por vía intravascular.
La respuesta de anticuerpos en pacientes con inmunosupresión endógena o yatrogénica puede ser insuficiente.
Después de cualquier vacunación, o incluso antes, se puede producir, especialmente en adolescentes, un síncope (desfallecimiento) como una reacción psicógena a la inyección de la aguja. Durante la recuperación, éste puede ir acompañado de varios signos neurológicos tales como déficit visual transitorio, parestesia y movimientos tónico clónicos en los miembros. Es importante que se disponga de procedimientos para evitar daños causados por las pérdidas de conocimiento.
Interferencia con pruebas serológicas Ver sección 4.5.
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente "exento de sodio".
Este medicamento contiene menos de 1 mmol (39 mg) de potasio por dosis, por lo que se considera esencialmente "exento de potasio".
4.5 Interacción con otros medicamentos y otras formas de interacción
Fluarix se puede administrar al mismo tiempo que otras vacunas. La inmunización se debe realizar en diferentes extremidades. Se debe tener en cuenta que la administración simultánea con otras vacunas puede intensificar las reacciones adversas.
La respuesta inmunológica puede verse disminuida si el paciente está bajo tratamiento inmunosupresor.
Tras la vacunación antigripal, pueden observarse resultados falsos positivos en las pruebas serológicas de ELISA para detectar anticuerpos frente a VIH-1, virus de la Hepatitis C y especialmente HTLV-1.
La técnica de Western Blot se utilizará para refutar los resultados falsos positivos del ensayo de ELISA.
Los falsos positivos temporales pueden deberse a la respuesta de IgM a la vacuna.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
Las vacunas antigripales inactivadas se pueden usar en todos los estadios del embarazo. Se dispone de más datos de seguridad en el segundo y tercer trimestre, en comparación con el primer trimestre; no obstante, los datos recogidos sobre el uso de vacunas antigripales inactivadas a nivel mundial no indican que haya ningún resultado adverso fetal ni maternal atribuible a la vacuna.
4.6.2 Lactancia
Fluarix puede usarse durante la lactancia.
4.6.3 Fertilidad
No se dispone de datos sobre fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
¡m
La influencia de Fluarix sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas Resumen del perfil de seguridad
Las siguientes reacciones adversas han sido observadas durante los ensayos clínicos con las siguientes frecuencias:
Muy frecuentes (>1/10)
Frecuentes (>1/100 a <1/10)
Poco frecuentes (>1/1.000 a <1/100)
Listado tabular de reacciones adversas
|
Sistema de clasificación de órganos |
Muy frecuentes >1/10 |
Frecuentes >1/100 a <1/10 |
Poco frecuentes >1/1.000 a <1/100 |
|
Trastornos del sistema nervioso |
Cefalea* | ||
|
Trastornos de la piel y del tejido subcutáneo |
Sudoración* | ||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Mialgia, artralgia* | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Fiebre, cansancio, escalofríos, malestar | ||
|
Reacciones locales: dolor, enrojecimiento, induración, inflamación, equimosis* | |||
|
*Estas reacciones normalmente desaparecen en 1 |
-2 días sin tratamiento. | ||
Población pediátrica
Se administró Fluarix a niños sanos de 6 meses a 17 años de edad en ensayos clínicos (más de 3.500 niños). Las siguientes reacciones adversas se han notificado también en este rango de edad.
La reacción adversa local notificada con mayor frecuencia en todos los grupos de edad después de la vacunación fue el dolor, que ocurrió con una frecuencia entre el 31,9% y el 52,7% del total de dosis.
La reacción adversa general notificada con mayor frecuencia en niños de hasta 6 años de edad fue la irritabilidad, entre el 8,1% y el 23,2% del total de dosis.
La reacción adversa general más frecuente en el grupo de edad de 6 años y mayores fue el dolor muscular, entre el 10,7% y el 24,6% del total de dosis.
Se han notificado las siguientes reacciones adversas en este grupo de edad.
|
Sistema de clasificación de órganos |
Muy frecuentes >1/10 |
Frecuentes >1/100 a <1/10 |
Poco frecuentes >1/1.000 a <1/100 |
|
Trastornos del metabolismo y de la nutrición |
Pérdida de apetito2 | ||
|
Trastornos psiquiátricos |
Irritabilidad2 | ||
|
Trastornos del sistema nervioso |
Somnolencia2, cefalea3 | ||
|
Trastornos gastrointestinales |
Síntomas gastrointestinales3 | ||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolores musculares3, dolor en las articulaciones3 | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Fiebre2, cansancio3 Reacciones locales: dolor1 , enrojecimiento1, inflamación1 |
Fiebre3, escalofríos3 | |
|
1notificado en niños de 6 meses a 17 años de edad | |||
2notificado en niños de 6 meses a <6 años de edad 3notificado en niños de 6 años a 17 años de edad
Datos post-comercialización
Además de las reacciones observadas durante los ensayos clínicos, también se notificaron las siguientes reacciones adversas a partir de la vigilancia post-comercialización:
Trastornos de la sangre y del sistema linfático:
Trombocitopenia transitoria, linfadenopatía transitoria.
Trastornos del sistema inmunológico:
Reacciones alérgicas (síntomas incluyendo conjuntivitis), que en casos raros evolucionaron a shock, angioedema.
Trastornos del sistema nervioso:
Neuralgia, parestesia, convulsiones febriles, trastornos neurológicos, como encefalomielitis, neuritis y síndrome de Guillain-Barré.
Trastornos vasculares:
Vasculitis asociada en casos muy raros con afectación renal transitoria.
Trastornos de la piel y del tejido subcutáneo:
Reacciones generalizadas de la piel incluyendo prurito, urticaria o erupción no específicas.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, https://www.notificaram.es
4.9 Sobredosis
Es improbable que la sobredosificación produzca algún efecto adverso.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: vacunas antigripales, código ATC: J07BB02
La seroprotección se obtiene generalmente a las 2 ó 3 semanas. La duración de la inmunidad tras la vacunación frente a cepas homólogas o frente a cepas estrechamente relacionadas con las cepas de la vacuna varía, pero generalmente es de 6 a 12 meses.
5.2 Propiedades farmacocinéticas
No procede.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de toxicidad aguda, tolerancia local, toxicidad a dosis repetidas, toxicidad para la reproducción y el desarrollo y farmacología de seguridad.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de sodio, hidrógeno fosfato de sodio dodecahidrato, dihidrogenofosfato de potasio, cloruro de potasio, cloruro de magnesio hexahidrato, hidrógeno succinato de a-tocoferilo, polisorbato 80, octoxinol 10 y agua para preparaciones inyectables.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, esta vacuna no debe mezclarse con otros medicamentos.
6.3 Periodo de validez 1 año
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C). No congelar.
Conservar la jeringa en el embalaje exterior para protegerla de la luz.
6.5 Naturaleza y contenido del envase
0,5 ml de suspensión inyectable en jeringa precargada (vidrio de tipo I) con un tapón del émbolo (butilo) con aguja fija, con agujas separadas o sin agujas, en los siguientes tamaños de envases:
- con aguja fija: envases de 1, 10 o 20 jeringas
- con 1 aguja separada: envases de 1, 10 o 20 jeringas
- con 2 agujas separadas: envase de 1 jeringa
- sin agujas: envases de 1, 10 o 20 jeringas
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Permitir que la vacuna alcance la temperatura ambiente antes de su utilización.
Agitar antes de usar. Inspeccionar visualmente antes de la administración.
En el caso de que se vaya a administrar una dosis de 0,5 ml, se debe inyectar todo el contenido de la jeringa.
Instrucciones para la administración de 0,25 ml de la vacuna para su uso en niños de 6 a 35 meses
Para administrar una dosis de 0,25 ml, mantener la jeringa precargada en posición vertical hacia arriba y eliminar la mitad del volumen hasta que el tapón del émbolo alcance la línea de marcado impresa en la jeringa. Inyectar el volumen restante de 0,25 ml.
Instrucciones para la administración de la vacuna presentada en jeringa precargada sin aguja fija Para saber cómo insertar la aguja en la jeringa, véase el dibujo 1.
Dibujo 1
-*5EP.
3QB!
Aguja
Protector de la aguja
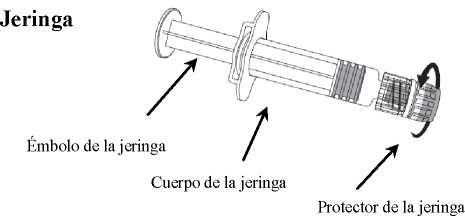
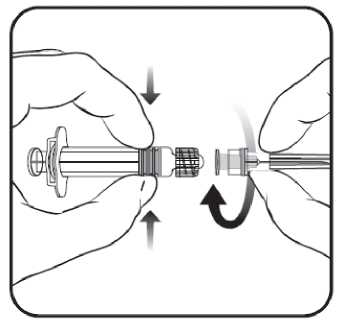
1. Sujetar el cuerpo de la jeringa con una mano (evitar sostener el émbolo de la jeringa) y con la otra, desenroscar el protector de la jeringa girándolo en sentido contrario a las agujas del reloj.
2. Insertar la aguja en la jeringa y a continuación, girar la aguja en el sentido de las agujas del reloj hasta que se bloquee (ver dibujo 1).
3. Retirar el protector de la aguja; en algunas ocasiones puede resultar un poco difícil.
4. Administrar la vacuna.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline, S.A.
PTM - C/ Severo Ochoa, 2 28760 Tres Cantos Madrid
Tel.: 902 202 700 Fax: 91 807 03 10 E-mail: es-ci@gsk.com
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
60.772
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 31/mayo/1995 Fecha de la última renovación: 30/diciembre/2007
10. FECHA DE LA REVISIÓN DEL TEXTO
07/2016
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
9 de 9