Firazyr 30 Mg Solucion Inyectable En Jeringa Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Firazyr 30 mg solución inyectable en jeringa precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada jeringa precargada de 3 ml contiene acetato de icatibant que equivale a 30 mg de icatibant. Cada mililitro de solución contiene 10 mg de icatibant.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable.
La solución es un líquido transparente e incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Firazyr está indicado para el tratamiento sintomático de crisis agudas de angioedema hereditario (AEH) en adultos (con deficiencia del inhibidor de la esterasa C1.)
4.2 Posología y forma de administración
Firazyr está previsto para ser utilizado bajo la dirección de un profesional sanitario.
Posología
La dosis recomendada es una única inyección subcutánea de Firazyr 30 mg.
En la mayoría de los casos, una sola inyección de Firazyr es suficiente para el tratamiento de una crisis. En caso de alivio insuficiente o reaparición de los síntomas, se puede administrar una segunda inyección de Firazyr después de 6 horas. Si la segunda inyección no produce un alivio suficiente o si reaparecen los síntomas, se puede administrar una tercera inyección de Firazyr después de otras 6 horas. No se deben administrar más de 3 inyecciones de Firazyr en un período de 24 horas.
En los ensayos clínicos, no se han administrado más de 8 inyecciones de Firazyr al mes.
Poblaciones especiales
Pacientes de edad avanzada
Se dispone de poca información sobre el uso en pacientes mayores de 65 años.
Se ha demostrado que la exposición sistémica al icatibant es mayor en los pacientes de edad avanzada. Se desconoce la relevancia que pueden tener estos datos para la seguridad de Firazyr (ver sección 5.2).
Insuficiencia hepática
No es necesario ajustar la dosis en pacientes con insuficiencia hepática.
Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal.
Población pediátrica
No se ha establecido la seguridad ni la eficacia de Firazyr en niños de 0 a 18 años de edad.
No se dispone de datos.
Forma de administración
Firazyr está previsto para administración subcutánea, preferiblemente en la zona abdominal.
Firazyr podrá ser administrado por el propio paciente o por la persona que lo atiende únicamente tras haber sido entrenados en la técnica para inyecciones subcutáneas por un profesional sanitario.
La decisión de comenzar la autoadministración de Firazyr debe ser tomada únicamente por un médico experimentado en el diagnóstico y tratamiento del angioedema hereditario (ver sección 4.4).
Cada jeringa de Firazyr está prevista exclusivamente para un solo uso.
Firazyr solución inyectable se debe administrar lentamente, dado el volumen que hay que administrar (3 ml).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Crisis laríngeas
Los pacientes con crisis laríngeas deben recibir tratamiento en una institución médica adecuada tras la inyección, hasta que el médico considere que su alta es segura.
Cardiopatía isquémica
En condiciones isquémicas, teóricamente puede producirse un deterioro de la función cardiaca y una disminución del flujo sanguíneo coronario debido al antagonismo del receptor de la bradicinina de tipo 2. Por consiguiente, Firazyr debe administrarse con precaución a los pacientes con cardiopatía isquémica aguda o angina de pecho inestable (ver sección 5.3).
Ictus
Aunque existen datos que avalan un efecto beneficioso del bloqueo de los receptores B2 inmediatamente después de un ictus, existe la posibilidad teórica de que el icatibant pueda atenuar los efectos neuroprotectores positivos de fase retardada de la bradicinina. En consecuencia, se extremará la precaución cuando se administre el icatibant a pacientes que hayan sufrido un ictus en las semanas anteriores.
Autoadministración
Para los pacientes que nunca han recibido Firazyr previamente, el primer tratamiento debe ser administrado en una institución médica o bajo la dirección de un médico.
En caso de alivio insuficiente o de recurrencia de los síntomas tras el tratamiento autoadministrado, se recomienda que el paciente procure asesoramiento médico y que las dosis posteriores sean administradas en una institución médica (ver sección 4.2).
Los pacientes que experimenten una crisis laríngea deben procurar siempre asesoramiento médico, y se los observará en una institución médica incluso tras haber recibido la inyección en casa.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se espera que se produzcan interacciones farmacocinéticas relacionadas con el CYP450 (ver sección 5.2).
No se ha estudiado la administración conjunta de Firazyr con inhibidores de la enzima convertidora de la angiotensina (IECA). Los IECA están contraindicados en pacientes con AEH debido al posible aumento de las concentraciones de bradicinina.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos clínicos de embarazos expuestos al icatibant. Los estudios en animales han mostrado efectos sobre la implantación uterina y el parto (ver sección 5.3), pero se desconoce el riesgo potencial para el ser humano.
Firazyr sólo debe administrarse durante el embarazo si el beneficio potencial justifica el posible riesgo para el feto (por ejemplo, para el tratamiento de crisis laríngeas potencialmente mortales).
Lactancia
El icatibant se excreta en la leche materna de la rata en concentraciones similares a las detectadas en la sangre materna. No se han observado efectos en el desarrollo posnatal de las crías.
Se ignora si el icatibant se excreta en la leche materna humana, pero se recomienda que las mujeres que se encuentren en periodo de lactancia, que deseen tomar Firazyr, no amamanten a sus hijos en las 12 horas siguientes al tratamiento.
Fertilidad
Tanto en ratas como en perros, el uso repetido de icatibant provocó efectos sobre los órganos reproductivos. El icatibant no tuvo ningún efecto sobre la fertilidad de ratones y ratas macho (ver sección 5.3). En un estudio de 39 adultos sanos de ambos sexos tratados con 30 mg cada 6 horas, por 3 dosis cada 3 días hasta un total de 9 dosis, no hubo cambios clínicamente significativos con respecto al inicio en la concentración de hormonas reproductivas basal y estimulada con GnRH ni en mujeres ni en hombres. No se observaron efectos significativos del icatibant sobre la concentración de progesterona en fase lútea y la función lútea ni sobre la duración del ciclo menstrual en las mujeres, ni se observaron efectos significativos del icatibant sobre el recuento espermático, la motilidad ni la morfología de los espermatozoides en los hombres. Es improbable que el régimen de administración utilizado en este estudio pueda sostenerse en el entorno clínico.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Firazyr sobre la capacidad para conducir y utilizar máquinas es pequeña. Se han notificado casos de fatiga, letargo, cansancio, somnolencia y mareo después de la administración de Firazyr. Estos síntomas pueden producirse como consecuencia de una crisis de AEH. Se debe recomendar a los pacientes que no conduzcan ni utilicen máquinas si sienten cansancio o mareo.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En estudios clínicos utilizados para el registro, un total de 999 crisis de AEH se han tratado con Firazyr 30 mg administrado por vía subcutánea (S.C) por un profesional sanitario. Se ha administrado Firazyr 30 mg S.C. por un profesional sanitario a 129 sujetos sanos y a 236 pacientes con AEH.
Casi todos los sujetos que recibieron tratamiento con icatibant subcutáneo en ensayos clínicos sufrieron reacciones en el lugar de la inyección (caracterizadas por irritación cutánea, hinchazón, dolor, prurito, eritema, ardor). Esas reacciones fueron en general de intensidad leve a moderada, transitorias, y remitieron sin necesidad de intervención.
Tabla de reacciones adversas
La frecuencia de las reacciones adversas enumeradas en la Tabla 1 se define utilizando la siguiente convención: Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000).
Tabla 1: Reacciones adversas notificadas con icatibant.
|
Sistema de Clasificación de Órganos |
Término preferido |
|
(categoría de la frecuencia) | |
|
Trastornos del sistema nervioso | |
|
(Frecuentes, >1/100 a <1/10) |
Mareo |
|
Cefalea | |
|
Trastornos gastrointestinales (Frecuentes, >1/100 a <1/10) |
Náuseas |
|
Trastornos de la piel y del tejido subcutáneo (Frecuentes, >1/100 a <1/10) |
Erupción Eritema Prurito |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
(Muy frecuentes, >1/10) |
Reacciones en la zona de inyección* |
|
(Frecuentes, >1/100 a <1/10) |
Pirexia |
|
Exploraciones complementarias (Frecuentes, >1/100 a <1/10) |
Transaminasas elevadas |
|
* Cardenales en la zona de inyección, hematoma en la zona de inyección, ardor en la zona de inyección, eritema en la zona de inyección, hipoestesia en la zona de inyección, irritación de la zona de inyección, entumecimiento de la zona de inyección, edema en la zona de inyección, dolor en la zona de inyección, sensación de presión en la zona de inyección, prurito en la zona de inyección, hinchazón en la zona de inyección, urticaria en la zona de inyección y calor en el lugar de inyección. | |
Descripción las reacciones adversas seleccionadas Inmunogenicidad
En los tratamientos repetidos de los ensayos de fase III controlados, se observó positividad transitoria a los anticuerpos contra el icatibant en muy pocos casos. Todos los pacientes mantuvieron la eficacia. Un paciente tratado con Firazyr resultó positivo para anticuerpos contra el icatibant antes y después del tratamiento contra Firazyr. Se hizo un seguimiento de este paciente durante 5 meses, y otras muestras posteriores fueron negativas para anticuerpos contra el icatibant. No se notificó ninguna reacción anafiláctica ni hipersensibilidad con Firazyr.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
No existe información clínica sobre casos de sobredosificación.
Una dosis de 3,2 mg/kg intravenosa (aproximadamente 8 veces la dosis terapéutica) provocó en sujetos sanos eritema transitorio, prurito o hipotensión. No fue necesario realizar ninguna intervención terapéutica.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: otros agentes hematológicos, fármacos usados en el angioedema hereditario, código ATC: B06AC02.
Mecanismo de acción
El AEH (una enfermedad autosómica dominante) está causado por la ausencia o la disfunción del inhibidor de la esterasa C1. Las crisis de AEH se acompañan de un aumento de la liberación de bradicinina, que es el mediador clave en la aparición de los síntomas clínicos.
El AEH se manifiesta con crisis intermitentes de edema subcutáneo y/o submucoso que afectan a las vías respiratorias altas, la piel y el tracto gastrointestinal. Por lo general, una crisis suele durar entre 2 y 5 días.
El icatibant es un antagonista competitivo selectivo del receptor de la bradicinina de tipo 2 (B2). Es un decapéptido sintético que tiene una estructura similar a la de la bradicinina, pero con 5 aminoácidos no proteinógenos. En el AEH, las concentraciones elevadas de bradicinina son el mediador clave en la aparición de los síntomas clínicos.
Efectos farmacodinámicos
En sujetos jóvenes sanos, el icatibant administrado a dosis de 0,8 mg/kg durante 4 horas, 1,5 mg/kg al día o 0,15 mg/kg al día durante 3 días permitió prevenir la aparición de hipotensión inducida por la bradicinina, vasodilatación y taquicardia refleja. Se demostró que el icatibant es un antagonista competitivo cuando la dosis de provocación de la bradicinina se multiplicó por cuatro.
Eficacia clínica y seguridad
Los datos de eficacia se obtuvieron de un ensayo clínico inicial fase II abierto y de tres ensayos en fase III controlados.
Los estudios clínicos de fase III (FAST-1 y FAST-2) eran ensayos aleatorizados, doble ciego y controlados, y tenían diseños idénticos a excepción del comparador (uno con ácido tranexámico por vía oral como comparador activo y otro controlado con placebo). Un total de 130 pacientes fueron asignados aleatoriamente a recibir una dosis de 30 mg de icatibant (63 pacientes) o del comparador (ácido tranexámico en 38 pacientes o placebo en 29). Los episodios posteriores de AEH recibieron tratamiento en un estudio de extensión abierto. Los pacientes con síntomas de angioedema laríngeo recibieron tratamiento abierto con icatibant. En los ensayos fase III, la variable principal de eficacia fue el tiempo transcurrido hasta el inicio del alivio de los síntomas utilizando una escala analógica visual (EAV). La Tabla 2 muestra los resultados de eficacia de estos estudios.
El FAST-3 era un estudio aleatorizado, controlado con placebo, de grupos paralelos de 98 pacientes adultos con una mediana de edad de 36 años. Los pacientes fueron aleatorizados a recibir o icatibant 30 mg o placebo mediante una inyección subcutánea. Un subgrupo de pacientes de este estudio sufrió crisis agudas de AEH mientras recibía andrógenos, antifibrinolíticos o Cl inhibidores. La variable principal fue el tiempo hasta el inicio del alivio de los síntomas evaluado mediante una escala analógica visual (EAV) compuesta por 3 elementos que consiste en evaluaciones de la hinchazón cutánea, dolor cutáneo y dolor abdominal. La Tabla 3 muestra los resultados de eficacia del estudio FAST-3.
En estos ensayos, la mediana del tiempo hasta el inicio del alivio de los síntomas fue menor en los pacientes tratados con icatibant (2,0, 2,5 y 2,0 horas, respectivamente) que en los tratados con ácido tranexámico (12,0 horas) y con placebo (4,6 y 19,8 horas). Las variables secundarias de eficacia confirmaron el efecto terapéutico del icatibant.
En un análisis integrado de estos estudios de fase III controlados, el tiempo hasta el inicio del alivio de los síntomas y el tiempo hasta el inicio del alivio del síntoma primario fue similar independientemente del grupo de edad, el sexo, la raza, el peso o de si el paciente utilizó o no andrógenos o antifibrinolíticos.
La respuesta también fue uniforme en las crisis repetidas en los ensayos de fase III controlados. Un total de 237 pacientes fueron tratados con 1.386 dosis de 30 mg de icatibant para 1.278 crisis agudas de AEH. En las primeras 15 crisis tratadas con Firazyr (1.114 dosis para 1.030 crisis), la mediana de los tiempos hasta el inicio del alivio de los síntomas fue similar para todas las crisis (2,0 a 2,5 horas). El 92,4% de estas crisis de AEH se trató con una única dosis de Firazyr.
Tabla 2. Resultados de eficacia para FAST-1 y FAST-2
|
Ensayo clínico controlado de FIRAZYR comparado con ácido tranexámico/placebo: Resultados de eficacia | |||||
|
FAST-2 |
FAST-1 | ||||
|
Icatibant |
Ácido tranexámico |
Icatibant |
Placebo | ||
|
Número de sujetos en la población por intención de tratar (ITT) |
36 |
38 |
Número de sujetos en la población por intención de tratar (ITT) |
27 |
29 |
|
Valores iniciales en la escala analógica visual (mm) |
63,7 |
61,5 |
Valores iniciales en la escala analógica visual (mm) |
69,3 |
67,7 |
|
Cambio respecto de los valores iniciales tras 4 horas |
-41,6 |
-14,6 |
Cambio respecto de los valores iniciales tras 4 horas |
-44,8 |
-23,5 |
|
Diferencia entre tratamientos (95% IC, valor p) |
-27,8 (-39,4, -16,2) p < 0,001 |
Diferencia entre tratamientos (95% IC, valor p) |
-23,3 (-37,1, -9,4) p = 0,002 | ||
|
Cambio respecto de los valores iniciales tras 12 horas |
-54,0 |
-30,3 |
Cambio respecto de los valores iniciales tras 12 horas |
-54,2 |
-42,4 |
|
Diferencia entre tratamientos (95% IC, valor p) |
-24,1 (-33,6, -14,6) p < 0,001 |
Diferencia entre tratamientos (95% IC, valor p) |
-15,2 (-28,6, -1,7) p = 0,028 | ||
|
Mediana del tiempo hasta el inicio del alivio de los síntomas (horas) |
Mediana del tiempo hasta el inicio del alivio de los síntomas (horas) | ||||
|
Todos los episodios (N = 74) |
2,0 |
12,0 |
Todos los episodios (N = 56) |
2,5 |
4,6 |
|
Ensayo clínico controlado de FIRAZYR comparado con ácido tranexámico/placebo: | |||||
|
Resultados de eficacia | |||||
|
FAST-2 |
FAST-1 | ||||
|
Icatibant |
Ácido tranexámico |
Icatibant |
Placebo | ||
|
Tasa de respuesta (%, IC) 4 horas después del comienzo del tratamiento |
Tasa de respuesta (%, IC) 4 horas después del comienzo del tratamiento | ||||
|
Todos los episodios |
80,0 |
30,6 |
Todos los episodios |
66,7 |
46,4 |
|
(N = 74) |
(63,1, 91,6) |
(16,3, 48,1) |
(N = 56) |
(46,0, 83,5) |
(27,5, 66,1) |
|
Mediana del tiempo |
Mediana del tiempo | ||||
|
hasta el inicio del |
hasta el inicio del | ||||
|
alivio de los |
alivio de los | ||||
|
síntomas: todos los |
síntomas: todos los | ||||
|
síntomas (h): |
síntomas (h): | ||||
|
Dolor abdominal |
1,6 |
3,5 |
Dolor abdominal |
2,0 |
3,3 |
|
Edema cutáneo |
2,6 |
18,1 |
Edema cutáneo |
3,1 |
10,2 |
|
Dolor cutáneo |
1,5 |
12,0 |
Dolor cutáneo |
1,6 |
9,0 |
|
Mediana del tiempo |
Mediana del tiempo | ||||
|
hasta el alivio casi |
hasta el alivio casi | ||||
|
completo de los |
completo de los | ||||
|
síntomas (horas) |
síntomas (horas) | ||||
|
Todos los episodios |
10,0 |
51,0 |
Todos los episodios |
8,5 |
19,4 |
|
(N = 74) |
(N = 56) | ||||
|
Mediana del tiempo |
Mediana del tiempo | ||||
|
hasta la remisión de |
hasta la remisión de | ||||
|
los síntomas, según el |
los síntomas, según | ||||
|
paciente (horas) |
el paciente (horas) | ||||
|
Todos los episodios |
0,8 |
7,9 |
Todos los episodios |
0,8 |
16,9 |
|
(N = 74) |
(N = 56) | ||||
|
Mediana del tiempo hasta la mejora global del paciente, según el médico (horas) |
Mediana del tiempo hasta la mejora global del paciente, según el médico (horas) | ||||
|
Todos los episodios |
1,5 |
6,9 |
Todos los episodios |
1,0 |
5,7 |
|
(N = 74) |
(N = 56) | ||||
Tabla 3. Resultados de eficacia para FAST-3
|
Resultados de eficacia: FAST-3; Fase controlada -- Población por intención de tratar (ITT) | ||||
|
Variable |
Estadístico |
Firazyr |
Placebo |
Valor de p |
|
en II |
(n = 45) | |||
|
Variable principal | ||||
|
Tiempo hasta el inicio del alivio de los síntomas-- EAV compuesta (horas) |
Mediana |
2,0 |
19,8 |
<0,001 |
|
Otras variables | ||||
|
Resultados de eficacia: FAST-3; Fase controlada -- Población por intención de tratar (ITT) | ||||
|
Variable |
Estadístico |
Firazyr |
Placebo |
Valor de p |
|
en II |
(n = 45) | |||
|
Tiempo hasta el inicio del alivio del síntoma primario (horas) |
Mediana |
1,5 |
18,5 |
< 0,001 |
|
Cambio en la EAV compuesta a las 2 horas posteriores al tratamiento |
Media |
-19,74 |
-7,49 |
< 0,001 |
|
Cambio en la escala compuesta de los síntomas a las 2 horas, según el sujeto |
Media |
-0,53 |
-0,22 |
< 0,001 |
|
Cambio en la escala compuesta de los síntomas a las 2 horas, según el investigador |
Media |
-0,44 |
-0,19 |
< 0,001 |
|
Tiempo hasta el alivio casi completo de los síntomas (horas) |
Mediana |
8,0 |
36,0 |
0,012 |
|
Tiempo hasta la mejoría inicial de los síntomas, según el sujeto (horas) |
Mediana |
0,8 |
3,5 |
< 0,001 |
|
Tiempo hasta la mejoría visual inicial de los síntomas, según el investigador (horas) |
Mediana |
0,8 |
3,4 |
< 0,001 |
Un total de 66 pacientes con crisis de AEH que afectaron a la laringe fueron tratados en estos ensayos clínicos de fase III controlados. Los resultados fueron similares a los obtenidos en pacientes con crisis no laríngeas de AEH en relación con el tiempo hasta el inicio del alivio de los síntomas.
5.2 Propiedades farmacocinéticas
La farmacocinética del icatibant se ha descrito con detalle mediante ensayos con voluntarios sanos y pacientes, en los que la administración se realizó por vía intravenosa y por vía subcutánea. El perfil farmacocinético del icatibant en pacientes con AEH es parecido al observado en los voluntarios sanos.
Absorción
Tras la administración subcutánea, la biodisponibilidad absoluta del icatibant es del 97%. El tiempo hasta alcanzar la concentración máxima es de aproximadamente 30 minutos.
Distribución
El volumen de distribución del icatibant (Vss) es de unos 20-25 litros. La unión a las proteínas plasmáticas es del 44%.
Eliminación
El icatibant se elimina principalmente mediante metabolismo y menos del 10% de la dosis se excreta en la orina como fármaco inalterado. El aclaramiento es de unos 15-20 l/h y es independiente de la dosis. La semivida terminal plasmática es de 1-2 horas aproximadamente.
Biotransformación
El icatibant se metaboliza extensamente por enzimas proteolíticas en metabolitos inactivos que se excretan mayoritariamente en la orina.
Los estudios in vitro han confirmado que el icatibant no se degrada por vías metabólicas oxidativas.
No es inhibidor de las principales isoenzimas del citocromo P450 (CYP) (CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, y 3A4), ni es tampoco inductor de CYP 1A2 y 3A4.
Poblaciones especiales
Los datos sugieren una reducción del aclaramiento dependiente de la edad, que produce una exposición de, aproximadamente, más del 50-60% en las personas de edad avanzada (75-80 años) que en pacientes de 40 años. Los datos sugieren que ni el sexo ni el peso parecen afectar significativamente la farmacocinética del icatibant.
Los escasos datos disponibles indican que la exposición al icatibant no resulta afectada por la insuficiencia hepática o renal. No se ha evaluado la influencia de la raza en la farmacocinética del icatibant. No se dispone de datos farmacocinéticos en niños.
5.3 Datos preclínicos sobre seguridad
Se han realizado estudios a dosis repetidas de hasta 6 meses de duración en ratas y de 9 meses en perros. Tanto en ratas como en perros, se observó una reducción relacionada con la dosis en los niveles de hormonas sexuales en circulación, y el uso repetido de icatibant retrasó la maduración sexual, con carácter reversible.
Las exposiciones diarias máximas definidas por el área bajo la curva (AUC) obtenidas con las concentraciones de fármaco sin efectos adversos observados (NOAEL) en el estudio de 9 meses en perros fueron 2,3 veces mayores que el AUC en seres humanos después de una dosis subcutánea de 30 mg. No fue posible medir un NOAEL en el estudio en ratas; no obstante, todos los resultados de ese estudio mostraron efectos total o parcialmente reversibles en las ratas tratadas. En ratas se observó hipertrofia de las glándulas suprarrenales con todas las dosis probadas; dicha hipertrofia se revirtió tras la suspensión del tratamiento con icatibant. Se desconoce la relevancia clínica de los hallazgos referentes a las glándulas suprarrenales.
El icatibant no produjo efecto alguno sobre la fertilidad de los ratones (dosis máxima 80,8 mg/kg/día) y ratas macho (dosis máxima 10 mg/kg/día).
En un estudio de 2 años para evaluar el potencial carcinogénico de icatibant en ratas, dosis diarias que se traducían en niveles de exposición de hasta aproximadamente 2 veces más que los obtenidos tras una dosis terapéutica en humanos, no tuvieron efecto en la incidencia o la morfología de los tumores. Los resultados no indican un potencial carcinogénico de icatibant.
El icatibant no resultó genotóxico en una serie estandarizada de pruebas in vitro e in vivo.
El icatibant no resultó teratógeno cuando se administró mediante inyección subcutánea en las primeras fases del desarrollo embrionario y fetal a ratas (dosis máxima de 25 mg/kg al día) y conejas (dosis máxima de 10 mg/kg al día). El icatibant es un potente antagonista de la bradicinina y, por consiguiente, cuando se administra en dosis altas, el tratamiento puede afectar el proceso de implantación uterina y la posterior estabilidad uterina al comienzo de la gestación. Estos efectos uterinos se manifiestan también en las últimas fases de la gestación, cuando el icatibant tiene un efecto tocolítico que retrasa el parto en la rata, con un aumento tanto del sufrimiento fetal como de la muerte perinatal a dosis altas (10 mg/kg al día).
En un estudio de toxicidad juvenil en el que se trató a ratas sexualmente inmaduras, a diario, con 3 mg/kg durante 7 semanas, se observó atrofia de testículos y epidídimos. Se observaron efectos similares del icatibant sobre el tejido reproductivo en ratas y perros sexualmente maduros. Estos resultados en los tejidos fueron coincidentes con los efectos comunicados con gonadotrofinas, y durante el periodo posterior sin tratamiento parecen ser reversibles.
El icatibant no produjo cambios en la conducción cardiaca in vitro (canal hERG) ni en la conducción in vivo en perros normales ni en distintos modelos caninos (marcapasos ventricular, esfuerzo físico y derivación coronaria), en lo que tampoco se observaron cambios hemodinámicos relacionados. Se ha demostrado que el icatibant agrava la isquemia cardiaca inducida en algunos modelos no clínicos, aunque no se ha demostrado de forma consistente que produzca un efecto perjudicial en la isquemia aguda.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro sódico
Ácido acético glacial (para el ajuste del pH)
Hidróxido sódico (para el ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede.
6.3 Período de validez
2 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25 °C.
No congelar.
6.5 Naturaleza y contenido del envase
3 ml de solución en una jeringa precargada de 3 ml (vidrio de tipo I) con tapón del émbolo (bromobutilo recubierto con polímero de fluorocarbono). En la caja se suministra una aguja hipodérmica (25 G; 16 mm).
Tamaños de envase: envase de una jeringa precargada con una aguja, o envase múltiple con tres jeringas precargadas con tres agujas.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
La solución debe ser transparente e incolora y no debe contener partículas visibles. Está destinada a un solo uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Shire Orphan Therapies GmbH Friedrichstrasse 149 D-10117 Berlín Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/461/001
EU/1/08/461/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 11 de julio de 2008 Fecha de la primera renovación: 13 de marzo de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Nombre y dirección del fabricante responsable de la liberación de los lotes
Shire Pharmaceuticals Ireland Limited 5 Riverwalk
Citywest Business Campus
Dublin 24
Irlanda
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y US
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Firazyr 30 mg solución inyectable en jeringa precargada. Icatibant
Cada jeringa precargada de 3 ml contiene acetato de icatibant que equivale a 30 mg de icatibant Cada mililitro de solución contiene 10 mg de icatibant.
Contiene: ácido acético glacial, hidróxido sódico, cloruro sódico, agua para preparaciones inyectables.
Solución inyectable Una jeringa precargada Una aguja de 25G
Vía subcutánea.
Leer el prospecto antes de utilizar este medicamento. Para un solo uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Titular de la autorización de comercialización Shire Orphan Therapies GmbH Friedrichstrasse 149 D-10117 Berlín Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/461/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Firazyr 30 mg
Firazyr 30 mg solución inyectable en jeringa precargada Icatibant
Cada jeringa precargada de 3 ml contiene acetato de icatibant que equivale a 30 mg de icatibant. Cada mililitro de solución contiene 10 mg de icatibant.
Contiene: ácido acético glacial, hidróxido sódico, cloruro sódico, agua para preparaciones inyectables.
Solución inyectable
Envase múltiple con tres jeringas precargadas y tres agujas de 25G
Vía subcutánea
Leer el prospecto antes de utilizar este medicamento Para un solo uso
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Titular de la autorización de comercialización Shire Orphan Therapies GmbH Friedrichstrasse 149 D-10117 Berlín Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/461/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Firazyr 30 mg
Firazyr 30 mg solución inyectable en jeringa precargada Icatibant
Cada jeringa precargada de 3 ml contiene acetato de icatibant que equivale a 30 mg de icatibant. Cada mililitro de solución contiene 10 mg de icatibant.
Contiene: ácido acético glacial, hidróxido sódico, cloruro sódico, agua para preparaciones inyectables.
Solución inyectable
Una jeringa precargada y una aguja de 25G.
Componente de envase múltiple, no se puede vender por separado.
Vía subcutánea
Leer el prospecto antes de utilizar este medicamento Para un solo uso
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Titular de la autorización de comercialización Shire Orphan Therapies GmbH Friedrichstrasse 149 D-10117 Berlín Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/461/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Firazyr 30 mg
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS {Lámina del blíster}
1. NOMBRE DEL MEDICAMENTO
Firazyr 30 mg solución inyectable en jeringa precargada.
Icatibant
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Shire Orphan Therapies GmbH
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
Vía subcutánea
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Etiqueta de la jeringa
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Firazyr 30 mg
Icatibant
sc
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
30 mg/3 ml
6. OTROS
Shire Orphan Therapies GmbH
B. PROSPECTO
Prospecto: Información para el usuario
Firazyr 30 mg solución inyectable en jeringa precargada
Icatibant
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Firazyr y para qué se utiliza
2. Qué necesita saber antes de usar Firazyr
3. Cómo usar Firazyr
4. Posibles efectos adversos
5. Conservación de Firazyr
6. Contenido del envase e información adicional
1. Qué es Firazyr y para qué se utiliza
Firazyr contiene el principio activo icatibant.
Firazyr se utiliza para el tratamiento de los síntomas del angioedema hereditario (AEH) en pacientes adultos.
En el AEH aumentan las concentraciones de una sustancia presente en la sangre llamada bradicinina, lo que produce síntomas como hinchazón, dolor, náuseas y diarrea.
Firazyr bloquea la actividad de la bradicinina y, por tanto, frena la progresión de los síntomas de una crisis de AEH.
2. Qué necesita saber antes de usar Firazyr No use Firazyr
- Si es alérgico al icatibant o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Firazyr:
Los efectos adversos relacionados con Firazyr son similares a los síntomas de su propia enfermedad. Consulte inmediatamente con su médico si nota que los síntomas de la crisis se agravan después de que le administren Firazyr.
- Si sufre angina de pecho (disminución del flujo de sangre que llega al corazón).
- Si ha sufrido recientemente un ictus.
Además:
- Deberá aprender la técnica para inyecciones subcutáneas (bajo la piel) antes de autoadministrarse Firazyr.
- Inmediatamente después de autoadministrarse Firazyr o de que se lo administre la persona que lo atiende mientras experimenta una crisis laríngea (obstrucción de la vía aérea superior), deberá procurar atención médica en una institución médica.
- Si sus síntomas no se resuelven tras una inyección autoadministrada de Firazyr, debe consultar al médico sobre la administración de inyecciones adicionales de Firazyr. Se pueden administrar hasta 2 inyecciones adicionales en el plazo de 24 horas.
Niños y adolescentes
No se recomienda el uso de Firazyr en niños y adolescentes menores de 18 años porque no se ha estudiado todavía en este grupo de edad.
Uso de Firazyr con otros medicamentos
Informe a su médico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
No se conocen interacciones de Firazyr con otros medicamentos. Si está tomando algún medicamento que sea un inhibidor de la enzima de conversión de la angiotensina (IECA) (por ejemplo: captopril, enalapril, ramipril, quinapril, lisinopril) para reducir la presión arterial o por cualquier otro motivo, informe a su médico antes de utilizar Firazyr.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de empezar a usar Firazyr.
Si se encuentra en período de lactancia, no debe amamantar a su hijo durante las 12 horas siguientes a la última administración de Firazyr.
Conducción y uso de máquinas
No conduzca ni maneje máquinas si se siente cansado o mareado como consecuencia de la crisis de AEH o después de utilizar Firazyr.
Firazyr contiene una pequeña cantidad de sodio
Este medicamento contiene menos de 23 miligramos (1 mmol) de sodio por jeringa, por lo que se considera esencialmente “exento de sodio”.
3. Cómo usar Firazyr
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico.
Si nunca se le ha administrado Firazyr previamente, la primera dosis siempre deberá ser inyectada por personal médico o de enfermería. El médico le dará el alta cuando considere seguro que se marche a casa. Tras analizarlo con su médico o enfermero, y tras aprender la técnica para inyecciones subcutáneas (bajo la piel), usted mismo o la persona que lo atiende pueden administrarle Firazyr si tiene una crisis de AEH. Es importante inyectar Firazyr por vía subcutánea (bajo la piel) tan pronto como advierta la crisis de angioedema hereditario. El personal sanitario les enseñará a usted y a quien lo atiende el modo de inyectar Firazyr en forma segura, siguiendo las instrucciones del prospecto.
Cuándo y con qué frecuencia debe usar Firazyr?
- Su médico ha determinado la dosis exacta de Firazyr y le dirá con qué frecuencia debe utilizarse. La dosis recomendada de Firazyr es de una inyección (3 ml, 30 mg) que se aplica por vía subcutánea (debajo de la piel) tan pronto como usted advierta la crisis de angioedema hereditario (por ejemplo, con aumento de la hinchazón cutánea, sobre todo en la cara y el cuello, o aumento del dolor abdominal).
Si no nota una mejoría de los síntomas, después de seis horas, debe procurar asesoramiento médico sobre la administración de inyecciones adicionales de Firazyr. Se pueden administrar hasta 2 inyecciones adicionales en el plazo de 24 horas.
No debe recibir más de 3 inyecciones en un período de 24 horas y si necesita más de 8 inyecciones en un mes, debe procurar asesoramiento médico.
Cómo debe administrarse Firazyr?
Firazyr se administra mediante inyección subcutánea (debajo de la piel). Cada jeringa debe utilizarse sólo una vez.
Firazyr se inyecta con una aguja corta en el tejido graso situado debajo de la piel del abdomen (tripa).
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
Las siguientes instrucciones paso a paso están previstas exclusivamente para la autoadministración.
Las instrucciones incluyen los siguientes pasos principales:
1) Información general importante
2) Preparación de la jeringa y la aguja para la inyección
3) Preparación del lugar de la inyección
4) Inyección de la solución
5) Desecho de los materiales de la inyección
Instrucciones paso a paso para la inyección 1) Información general importante
• Lávese las manos con agua y jabón antes de iniciar el proceso
• Abra el blíster retirando el sello
• Retire la jeringa precargada del blíster
• Desenrosque y retire la tapa del extremo de la jeringa precargada
• Dej e la jeringa precargada una vez desenroscada la tapa
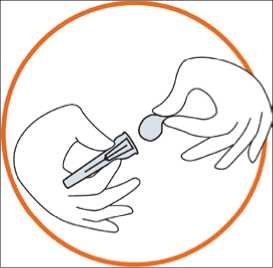
• Retire
• Retire
del blister la tapa de la aguja
el sello de la tapa de la aguja (la aguja debe permanecer dentro de la tapa)
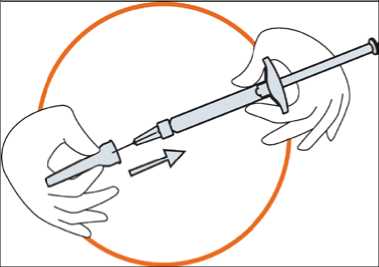
• Sostenga firmemente la jeringa. Conecte con cuidado la aguja a la jeringa precargada con la solución incolora.
• Atornille la jeringa precargada a la aguja, todavía fija en la tapa
• Tire de la jeringa para retirar la aguja de la tapa. No tire del émbolo.
• La jeringa ya está lista para aplicar la inyección
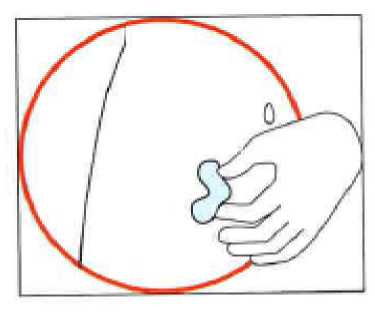
• Seleccione el lugar para la inyección. El lugar de la inyección deberá ser un pliegue del abdomen, a una distancia aproximada de 5-10 cm (2-4 pulgadas) por debajo del ombligo, hacia uno u otro lado. El área deberá estar como mínimo a 5 cm (2 pulgadas) de cualquier cicatriz. No escoja un área con hematomas, inflamada o dolorida.
• Limpie el lugar de la inyección frotando con un apósito con alcohol, y déjelo secar.
4) Inyección de la solución
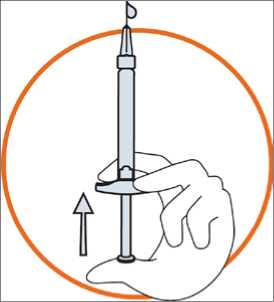
• Sostenga la jeringa entre dos dedos, con el pulgar en el extremo del émbolo
• Verifique que no haya aire en la jeringa, presionando el émbolo hasta que aparezca la primera gota en la punta de la aguja
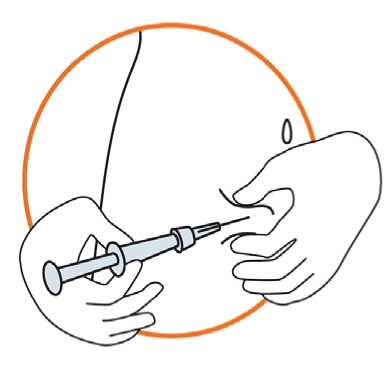
Sostenga la jeringa con la aguja apuntando a la piel en un ángulo entre 45 a 90 grados
Manteniendo la jeringa en una mano, con la otra tome suavemente un pliegue de piel entre el pulgar y los dedos, en el lugar previamente desinfectado
Sostenga el pliegue de piel, acerque la jeringa e inserte rápidamente la aguja en el pliegue
Presione lentamente el émbolo con el pulso firme, hasta que todo el fluido se haya inyectado en la piel y no quede líquido en la jeringa
Presione lentamente, de modo que el proceso demore aproximadamente 30 segundos Suelte el pliegue de piel y retire la aguja con suavidad
5) Desecho de los materiales de la inyección
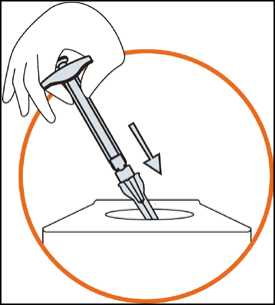
• Tire la jeringa, la aguja y la tapa de ésta en el recipiente para elementos cortantes destinado al desecho de residuos que pueden lesionar a terceros si no se manipulan correctamente.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Firazyr puede producir efectos adversos, aunque no todas las personas los sufran. Casi todos los pacientes que reciben Firazyr notan una reacción en el lugar de la inyección (como irritación cutánea, inflamación, dolor, prurito, enrojecimiento de la piel y ardor). Estos efectos suelen ser leves y mejoran sin necesidad de ningún tratamiento adicional.
Los efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas) son: Reacciones adicionales en el lugar de la inyección (sensación de presión, moratón, disminución de la sensibilidad y/o entumecimiento, aumento de la erupción cutánea con picazón y calor).
Los efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas) son:
Nauseas
Dolor de cabeza
Mareo
Fiebre
Picor
Erupción
Enrojecimiento de la piel
Pruebas de función hepática anormales
Informe a su médico inmediatamente si observa que los síntomas de la crisis empeoran después de haber recibido Firazyr.
Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Firazyr
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25 °C. No congelar.
No utilice este medicamento si observa que el envase de la jeringa o de la aguja está dañado o si observa signos visibles de deterioro; por ejemplo, si la solución está turbia, si contiene partículas flotantes o si ha cambiado el color de la solución.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de Firazyr
El principio activo es icatibant. Cada jeringa precargada contiene 30 miligramos de icatibant (en forma de acetato). Los demás componentes son cloruro sódico, ácido acético glacial, hidróxido sódico y agua para preparaciones inyectables.
Aspecto de Firazyr y contenido del envase
Firazyr se presenta como solución inyectable transparente e incolora en una jeringa de vidrio precargada de 3 ml.
El envase contiene una aguja hipodérmica.
Firazyr está disponible en envase unitario de una jeringa precargada con una aguja o en envase múltiple de tres jeringas precargadas con tres agujas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Shire Orphan Therapies GmbH Friedrichstrasse 149 D-10117 Berlín Alemania
Responsable de la fabricación
Shire Pharmaceuticals Ireland Limited 5 Riverwalk
Citywest Business Campus
Dublin 24
Irlanda
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu. También presenta enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
33