Fentanilo Matrix Aristo 75 Microgramos/Hora Parche Transdermicos Efg
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Fentanilo Matrix Aristo 12 microgramos/hora parche transdérmico EFG Fentanilo Matrix Aristo 25 microgramos/hora parche transdérmico EFG Fentanilo Matrix Aristo 50 microgramos/hora parche transdérmico EFG Fentanilo Matrix Aristo 75 microgramos/hora parche transdérmico EFG Fentanilo Matrix Aristo 100 microgramos/hora parche transdérmico.EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
2.2 Composición cualitativa y cuantitativa
Cada parche de Fentanilo Matrix Aristo 12 microgramos/hora parche transdérmico contiene 2,55 mg de fentanilo en una superficie 4,25 cm2 y libera 12,5 microgramos de fentanilo por hora.
Cada parche de Fentanilo Matrix Aristo 25 microgramos/hora parche transdérmico contiene 5,1 mg de fentanilo en una superficie 8,5 cm2 y libera 25 microgramos de fentanilo por hora.
Cada parche de Fentanilo Matrix Aristo 50 microgramos/hora parche transdérmico contiene 10,2 mg de fentanilo en una superficie 17 cm2 y libera 50 microgramos de fentanilo por hora.
Cada parche de Fentanilo Matrix Aristo 75 microgramos/hora parche transdérmico contiene 15,3 mg de fentanilo en una superficie 25,5 cm2 y libera 75 microgramos de fentanilo por hora.
Cada parche de Fentanilo Matrix Aristo 100 microgramos/hora parche transdérmico contiene 20,4 mg de fentanilo en una superficie 34 cm2 y libera 100 microgramos de fentanilo por hora
2.2.1 Excipiente(s) con efecto conocido
aceite de soja
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Parche transdérmico.
Fentanilo Matrix Aristo es un parche opaco, incoloro, de forma rectangular con esquinas redondeadas e impreso en el soporte de aluminio:
"Fentanyl 12 pg/h" para Fentanilo Matrix Aristo 12 pg/h
"Fentanyl 25 pg/h" para Fentanilo Matrix Aristo 25 pg/h
"Fentanyl 50 pg/h" para Fentanilo Matrix Aristo 50 pg/h
"Fentanyl 75 pg/h" para Fentanilo Matrix Aristo 75 pg/h
"Fentanyl 100 pg/h" para Fentanilo Matrix Aristo 100 pg/h
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Adultos
Control a largo plazo del dolor crónico intenso que solo puede ser tratado adecuadamente con analgésicos opioides.
Niños:
Control a largo plazo del dolor crónico intenso que solo puede ser tratado adecuadamente con analgésicos opioides en niños a partir de 2 años de edad que estén recibiendo tratamiento con opioides y sean tolerantes a los opioides (ver sección 4.2)
4.2 Posología y forma de administración
Se debe evaluar a intervalos regulares la dosis adecuada de Fentanilo Matrix Aristo y la necesidad de continuar con el tratamiento.
Los parches transdérmicos de Fentanilo Matrix Aristo liberan fentanilo durante 72 horas (correspondiente a una velocidad de liberación de 12,5, 25, 50, 75 y 100 microgramos/hora con una superficie de liberación de 4.25, 8.5, 17, 25.5 y 34 cm2 respectivamente).
4.2.1 Posología
Adultos
Selección de la dosis inicial
Se debe tener en cuenta el analgésico administrado hasta el momento, especialmente los analgésicos opioides, para la determinación de la dosis adecuada para el tratamiento del dolor crónico. La dosis, la eficacia y la posible tolerancia desarrollada son consideradas para el cálculo de la cantidad requerida de fentanilo. Otros factores a tener en cuenta son el estado general actual y el estado médico del paciente, incluido el peso, la edad y el grado de debilitamiento, así como el grado de tolerancia a los opioides.
Ajuste inicial en pacientes sin experiencia con opiodes
La experiencia clínica con Fentanilo Matrix Aristo en pacientes sin experiencia con opioides es limitada. En las circunstancias en las que se considera apropiada la terapia con Fentanilo Matrix Aristo en pacientes sin experiencia con opioides, se recomienda la administración de dosis bajas de opioides de corta duración de acción en estos pacientes. Solo entonces los pacientes pueden ser cambiados a parches transdérmicos de fentanilo. Se dispone de parches con una velocidad de liberación de 12,5 microgramos/h, y deben usarse para el ajuste inicial. Tras un periodo de evaluación inicial, los pacientes pueden ser cambiados a parches transdérmicos de fentanilo con una velocidad de liberación de 25 microgramos/h. Posteriormente la dosis se puede ajustar aumentándola o disminuyéndola, si fuese necesario, en incrementos de 12 o 25 microgramos/hora, para alcanzar la dosis apropiada más baja de Fentanilo Matrix Aristo dependiendo de la respuesta y necesidades analgésicas suplementarias (ver también sección 4.4).
En pacientes sin experiencia con opioides de edad avanzada o debilitados, los cuales son particularmente susceptibles al tratamiento con opioides, no se recomienda iniciar un tratamiento opioide con Fentanilo Matrix Aristo. En estos casos, sería preferible iniciar el tratamiento con dosis bajas de morfina de liberación inmediata y prescribir Fentanilo Matrix Aristo tras la determinación de la dosis óptima.
Cambio desde otros tratamientos con opioides intensamente activos
Al cambiar de opiodes orales o parenterales a Fentanilo Matrix Aristo, la dosis inicial debe calcularse como sigue:
1. Determinar la cantidad de analgésicos requerida durante las últimas 24 horas y convertir estas cantidades a la dosis de morfina oral equianalgésica.
2. La dosis correspondiente de fentanilo debe determinarse de la siguiente forma:
a) usando la Tabla 1 para pacientes que necesitan rotación de opioides (tasa de conversión de morfina oral a fentanilo transdérmico igual a 150:1)
b) usando la Tabla 2 para pacientes en terapia estable o bien tolerada de opioides (tasa de conversión de morfina oral a fentanilo transdérmico igual a 100:1)
Tabla 1: Dosis inicial recomendada de Fentanilo Matrix Aristo en base a la dosis diaria de morfina
(para pacientes que necesitan rotación de opioides debido a los efectos adversos) /tasa de conversión 150:1
|
Dosis de morfina oral (mg/día) |
Fentanilo Matrix Aristo (microgramos/h) |
|
< 90 |
12 |
|
90-134 (para adultos) |
25 |
|
135-224 |
50 |
|
225-314 |
75 |
|
315-404 |
100 |
|
405-494 |
125 |
|
495-584 |
150 |
|
585-674 |
175 |
|
675-764 |
200 |
|
765-854 |
225 |
|
855-944 |
250 |
|
945-1034 |
275 |
|
1035-1124 |
300 |
Tabla 2: Dosis inicial recomendada de Fentanilo Matrix Aristo en base a la dosis diaria de morfina
(para pacientes en terapia estable o bien tolerada de opioides) / tasa de conversión 100:1
|
Dosis de morfina oral (mg/ día) |
Fentanilo Matrix Aristo (microgramos/h) |
|
< 60 |
12 |
|
60-89 |
25 |
|
90-149 |
50 |
|
150-209 |
75 |
|
210-269 |
100 |
|
270-329 |
125 |
|
330-389 |
150 |
|
390-449 |
175 |
|
450-509 |
200 |
|
510-569 |
225 |
|
570-629 |
250 |
|
630-689 |
275 |
|
690-749 |
300 |
En los casos de ajuste inicial y cambio a otros analgésicos, no se debe evaluar el máximo efecto analgésico hasta aproximadamente las 24 horas de que el parche haya sido aplicado, debido al incremento gradual de la concentración sérica de fentanilo hasta ese momento.
El tratamiento analgésico previo debe ser eliminado gradualmente desde la primera aplicación de los parches hasta que se alcance la eficacia analgésica con Fentanilo Matrix Aristo.
Combinando varios parches transdérmicos, puede lograrse una velocidad de liberación de fentanilo de más de 100 microgramos/h.
Ajuste de la dosis y tratamiento de mantenimiento
Para ajustar la dosis se dispone de la dosis más baja de Fentanilo Matrix Aristo 12 microgramos/h.
El parche de Fentanilo Matrix Aristo debe sustituirse cada 72 horas. La dosis debe ajustarse individualmente hasta que se obtenga eficacia analgésica. Si la analgesia es insuficiente al final del periodo de aplicación inicial, la dosis puede aumentarse después de 3 días. Posteriormente, se puede ajustar la dosis cada tres días. Tras el inicio del tratamiento, algunos pacientes pueden necesitar sustituir el parche tras las 48 horas en vez de a las 72 horas ya que el efecto analgésico puede ser insuficiente en el día 3. La sustitución del parche antes de las 72 horas puede resultar en un aumento de la concentración sérica de fentanilo (ver sección 5.2). Cuando sea necesario, debe realizarse un ajuste de la dosis, normalmente en incrementos de 12 microgramos/hora a 25 microgramos/hora, aunque deben tenerse en cuenta los requisitos analgésicos complementarios (45/90 mg morfina oral/día ~ Fentanilo Matrix Aristo 12/25 microgramos/h)
.<ítp.
y el estado de dolor del paciente. Se puede utilizar más de un parche de Fentanilo Matrix Aristo para conseguir la dosis deseada. Los pacientes pueden requerir dosis complementarias periódicas de un analgésico de acción corta para el “dolor irruptivo”. Debe considerarse la utilización de métodos adicionales o alternativos de analgesia cuando la dosis de Fentanilo Matrix Aristo supera los 300 microgramos/hora.
Cambio o terminación del tratamiento
Si es necesaria la interrupción de Fentanilo Matrix Aristo, cualquier sustitución por otros opioides debe ser gradual, comenzando con una dosis baja y aumentándola lentamente. Esto se debe a que los niveles de fentanilo disminuyen gradualmente tras la retirada del parche. Se necesitan al menos 17 horas para que la concentración sérica de fentanilo disminuya en un 50%. Como regla general, la interrupción de la analgesia opioide debe ser gradual, con el fin de prevenir los síntomas de abstinencia.
Algunos pacientes pueden presentar síntomas de abstinencia de opioides después de una conversión o ajuste de dosis (ver sección 4.8). No deben usarse las Tablas 1 y 2 para calcular el cambio de Fentanilo Matrix Aristo a otros tratamientos con el fin de evitar una sobreestimación de la nueva dosis analgésica y una sobredosis potencial.
Pacientes de edad avanzada
Los pacientes de edad avanzada deben ser observados cuidadosamente y reducir la dosis si fuese necesario (ver secciones 4.4 y 5.2).
Insuficiencia hepática y renal
Los pacientes con insuficiencia hepática o renal deben ser observados cuidadosamente y reducir la dosis si fuese necesario (ver secciones 4.4).
Población pediátrica
Adolescentes de 16 años de edad en adelante: Seguir la posología de adultos.
Niños y adolescentes entre 2 y 16 años de edad:
Fentanilo Matrix Aristo debe administrarse solamente a pacientes pediátricos tolerantes a los opioides (edades de 2 a 16 años) que ya estén recibiendo por lo menos equivalentes de 30 mg de morfina oral por día.
Iniciación / conversión del tratamiento a Fentanilo Matrix Aristo
Para la conversión de opioides orales o parenterales a Fentanilo Matrix Aristo, la dosis inicial se debe determinar acorde a las necesidades previas y al estado de dolor (ver tabla 3).
Tabla 3: Dosis recomendada de Fentanilo Matrix Aristo - en base a las necesidades diarias de morfina oral1
|
Morfina Oral (mg/día) |
Fentanilo Matrix Aristo (microgramos/hora) |
|
Para pacientes pediátricos2 | |
|
30-44 |
12 |
|
45-134 |
25 |
1 En ensayos clínicos, los rangos de dosis de morfina oral diaria se utilizaron como base para la conversión a Fentanilo Matrix Aristo.
2 La conversión a Fentanilo Matrix Aristo de dosis superiores a 25 microgramos/h es similar para pacientes adultos y pediátricos.
Para niños que reciben más de 90 mg de morfina oral equivalente al día, solamente se dispone de información limitada a partir de los ensayos clínicos con fentanilo transdérmico. En los estudios pediátricos, la dosis necesaria de parches transdérmicos de fentanilo se calculó de manera conservadora: 30 mg a 44 mg de morfina oral por día o su dosis equivalente de opioide se reemplazó por un parche de Fentanilo Matrix Aristo 12 microgramos/h. Cabe señalar que este programa de conversión para los niños sólo se aplica a la sustitución de morfina oral (o su equivalente) a Fentanilo Matrix Aristo. El programa de conversión no se debe utilizar para convertir de Fentanilo Matrix Aristo a otros analgésicos, pues podría ocurrir una sobredosis.
El efecto analgésico de la primera dosis de Fentanilo Matrix Aristo no será óptimo durante las primeras 24 horas. Por consiguiente, durante las primeras 12 horas después de cambiar a Fentanilo Matrix Aristo se debe dar al paciente la dosis normal del analgésico previo. En las siguientes 12 horas, estos analgésicos previos deben ser administrados en base a la necesidad clínica.
Los niveles más altos de fentanilo se dan tras 12-24 horas posteriores al tratamiento, por lo que se recomienda la monitorización del paciente de cara a reacciones adversas, por ejemplo hipoventilación,, durante al menos 48 horas tras el inicio del tratamiento con fentanilo o el ajuste de dosis (ver también sección 4.4).
Ajuste y mantenimiento de dosis
Si el efecto analgésico de Fentanilo Matrix Aristo es insuficiente, se debería administrar un suplemento de morfina u otro opioide de corta duración en pacientes pediátricos. Dependiendo de las necesidades de analgésicos adicionales y del estado de dolor del niño, se podrá decidir aumentar la dosis. Los ajustes de la dosis deben hacerse gradualmente en pasos de 12 microgramos de fentanilo/hora.
4.2.2 Forma de administración
Para uso trandérmico
Inmediatamente después de que el parche transdérmico se ha sacado del paquete y las dos secciones se han separado por la línea de liberación, el parche transdérmico se pega a un zona de la piel sin pelo o si es posible, en una parte en la que el pelo se haya suprimido (con tijeras, no se deben utilizar maquinillas de afeitar) antes de la aplicación a la parte superior del cuerpo (pecho, espalda, parte superior del brazo). En niños pequeños, la mejor localización para aplicar el parche es la parte superior de la espalda, a fin de minimizar el riesgo de que el niño se quite el parche.
La piel debe limpiarse cuidadosamente con agua limpia y completamente seca antes de aplicar el parche transdérmico (¡no se deben usar agentes de limpieza!). Se adhiere el parche a la piel con una ligera presión con la palma de la mano sobre él (durante aproximadamente 30 segundos). Hay que asegurarse que la zona de aplicación no presenta microlesiones (como por ejemplo debidas a radiación o afeitado) o irritaciones. Dado que el parche transdérmico está protegido exteriormente por una lámina impermeable, puede llevarse mientras se ducha.
No deben aplicarse cremas, aceites, lociones o polvos en la zona de aplicación, ya que pueden afectar a la adhesión efectiva del parche transdérmico en la piel.
Duración de la administración
El parche transdérmico se debe cambiar después de 72 horas. En casos individuales si fuera necesario, el parche transdérmico puede ser cambiado antes pero no antes de 48 horas después de su aplicación ya que podría producirse un aumento de la concentración media de fentanilo en suero. Para cada aplicación se debe seleccionar una nueva zona de la piel. Sin embargo, una zona de la piel puede ser utilizada de nuevo si han transcurrido 7 días desde que se retiró el último parche transdérmico. El efecto analgésico puede persistir durante algún tiempo después de que el parche transdérmico haya sido retirado.
Si tras la retirada del parche quedan residuos sobre la piel, pueden limpiarse con jabón y agua. La limpieza no debe realizarse con alcohol u otros disolventes, dado que podrían penetrar en la piel debido al efecto del parche.
Si se realizan aumentos progresivos de la dosis, el área superficial activa requerida, puede alcanzar un punto en el que no sea posible un aumento adicional.
4.3 Contraindicaciones
-Hipersensibilidad al principio activo, a la soja, al cacahuete o a alguno de los excipientes incluidos en la sección 6.1. Fentanilo Matrix Aristo no se debe usar en caso de:
- Dolor agudo o postoperatorio, ya que no es posible ajustar la dosis durante un tratamiento a corto plazo y pueden darse casos serios o peligrosos de hipoventilación
- Deterioro grave del sistema nervioso central
- Depresión respiratoria grave
Este medicamento contiene aceite de soja. No debe utilizarse en caso de alergia al cacahuete o a la soja.
4.4 Advertencias y precauciones especiales de empleo Exposición accidental al parche
La transferencia accidental de un parche de fentanilo a la piel de una persona sin parche (especialmente un niño), mientras que comparte una cama o al estar en contacto con un paciente con parche, puede dar lugar a una sobredosis de opioide para la persona sin parche. Los pacientes deben ser advertidos de que si se produce la transferencia accidental de un parche de fentanilo, debe ser retirado inmediatamente (ver sección 4.9. Sobredosis).
Los pacientes que hayan experimentado efectos adversos graves deben ser monitorizados durante al menos 24 horas después de la retirada de Fentanilo Matrix Aristo, o durante más tiempo, según los síntomas clínicos, debido a que las concentraciones séricas de fentanilo disminuyen gradualmente y son reducidas en un 50% dentro de las 17 horas siguientes (rango 13-22 horas).
Fentanilo Matrix Aristo debe mantenerse fuera del alcance y de la vista de los niños antes y después de su uso.
No corte Fentanilo Matrix Aristo. Un parche que ha sido dividido, cortado o dañado de alguna manera no debe ser utilizado.
Este medicamento sólo debe ser usado bajo la supervisión de médicos con experiencia en la farmacocinética de los parches transdérmicos de fentanilo y en el riesgo de hipoventilación grave.
En caso de cambio de los sistemas que contienen fentanilo, se aconseja supervisión médica adicional e información del paciente para mantener una continua reducción del dolor (si es necesario del mismo modo que en el ajuste inicial).
Pacientes sin tratamiento previo con opioides y pacientes no tolerantes a los opioides En casos muy raros, en pacientes sin tratamiento previo con opioides, el uso de parches transdérmicos de fentanilo se ha asociado a depresión respiratoria significativa y/o mortal cuando se usó como tratamiento opioide inicial. En estos pacientes, al inicio del tratamiento exixte la posibilidad de sufrir hipoventilación grave o que pongan en riesgo su vida incluso utilizando la dosis más baja de parches transdérmicos de fentanilo. Por lo general, se recomienda el uso de parches transdérmicos de fentanilo en pacientes que hayan demostrado ser tolerantes a los opioides (ver sección 4.2).
Depresión respiratoria
Como con todos los opioides potentes, algunos pacientes pueden experimentar una depresión respiratoria significativa con Fentanilo Matrix Aristo, y se deben vigilar a los pacientes para estos efectos. La depresión respiratoria puede persistir tras la retirada del parche. La incidencia de depresión respiratoria incrementa al aumentar la dosis de fentanilo (ver sección 4.9). Los fármacos que actúan a nivel del SNC pueden empeorar la depresión respiratoria (ver sección 4.5).
Enfermedad pulmonar crónica:
En pacientes con enfermedades obstructivas crónicas u otras enfermedades pulmonares, Fentanilo Matrix Aristo puede tener efectos adversos más graves. En estos pacientes, los opioides pueden reducir la actividad respiratoria y aumentar la resistencia de las vías respiratorias.
Dependencia farmacológica y abuso potencial:
Se puede desarrollar tolerancia, dependencia física y dependencia psicológica tras la administración repetida de opioides (ver sección 4.8). La adicción iatrogénica tras la administración de opioides es rara. Se puede abusar de Fentanilo de un modo similar al de otros agonistas opioides. El abuso o el mal uso intencionado de Fentanilo Matrix Aristo puede resultar en sobredosis y/o muerte.
Los pacientes con un antecedente previo de drogodependencia/abuso de alcohol tienen más riesgo de desarrollar dependencia y abuso en el tratamiento opioide. Los pacientes con un mayor riesgo de abuso de opioides pueden ser tratados adecuadamente con formulaciones opioides de liberación modificada; sin embargo, estos pacientes requerirán monitorización para buscar signos de mal uso, abuso o adicción.
Aumento de la presión intracraneal:
Fentanilo Matrix Aristo debe utilizarse con precaución en pacientes que puedan ser especialmente susceptibles a los efectos intracraneales de retención de CO2, tales como aquellos con evidencia de aumento de la presión intracraneal, deterioro de la consciencia o coma. Fentanilo Matrix Aristo debe utilizarse con precaución en pacientes con tumores cerebrales.
Enfermedad cardíaca
Fentanilo puede producir bradicardia y por tanto, Fentanilo Matrix Aristo se debe administrar con precaución en pacientes con bradiarritmias.
Los opioides pueden causar hipotensión, especialmente en pacientes con hipovolemia aguda. La hipotensión sintomática y/o la hipovolemia deben corregirse antes de comenzar el tratamiento con los parches transdérmicos de Fentanilo.
Insuficiencia hepática
Debido a que fentanilo se metaboliza a metabolitos inactivos en el hígado, la insuficiencia hepática puede retrasar su eliminación. Si los pacientes con insuficiencia hepática reciben Fentanilo Matrix Aristo deben ser observados cuidadosamente en busca de signos de toxicidad por fentanilo, y la dosis de Fentanilo Matrix Aristo debe reducirse si fuera necesario (ver sección 5.2).
Insuficiencia renal:
Menos del 10% de fentanilo se excreta inalterado por los riñones y, a diferencia de la morfina, no se conocen metabolitos activos que se eliminen por los riñones. Si los pacientes con insuficiencia renal reciben Fentanilo Matrix Aristo, deben ser observados cuidadosamente por si aparecen signos de toxicidad por fentanilo y la dosis debe ser reducida si fuera necesario.
Pacientes con fiebre/aplicación de calor externo
Un modelo farmacocinético sugiere que las concentraciones de fentanilo en sangre pueden aumentar posiblemente un tercio cuando la temperatura de la piel aumenta a 40°C. Por esta razón, los pacientes con fiebre deben ser monitorizados en cuanto a efectos secundarios y se ajustará la dosis de Fentanilo Matrix Aristo si es necesario. Existe un potencial aumento en la liberación de fentanilo del parche dependiente de la temperatura, resultando en posible sobredosis y muerte. Un ensayo clínico farmacológico llevado a cabo en sujetos adultos sanos, ha mostrado que la aplicación de calor sobre el parche transdérmico de fentanilo aumentó los valores medios del AUC de fentanilo en un 120% y los valores medios de Cmax en un 61%. Se debe advertir a todos los pacientes que eviten la exposición de la zona de aplicación de Fentanilo Matrix Aristo a fuentes directas de calor externo como cojines calientes, mantas eléctricas, camas de agua calientes, calefactores o lámparas de infrarrojos, baños intensos de sol, botellas de agua caliente, saunas, baños de agua caliente prolongados o baños de hidromasaje con agua caliente, ya que existe la posibilidad de que el aumento de la temperatura corporal cause un aumento de liberación de fentanilo desde el parche transdérmico.
Síndrome serotoninérgico
Se recomienda precaución cuando Fentanilo Matrix Aristo es coadministrado con medicamentos que actúan en los sistemas de neurotransmisores serotoninérgicos.
El desarrollo de un síndrome serotoninérgico potencialmente mortal puede ocurrir con el uso concomitante de fármacos serotoninérgicos tales como los Inhibidores Selectivos de la Recaptación de Serotonina (ISRS), Inhibidores de la Recaptación de Serotonina y Norepinefrina (IRSN) y fármacos que afectan al metabolismo de la serotonina (incluyendo los Inhibidores de la Monoaminooxidasa [IMAOs]). Esto puede ocurrir dentro de la dosis recomendada.
El síndrome serotoninérgico puede incluir uno o más de los siguientes: cambios en el estado mental (por ejemplo, agitación, alucinaciones, coma), inestabilidad autonómica (por ejemplo, taquicardia, presión arterial lábil, hipertermia), anormalidades neuromusculares (por ejemplo, hiperreflexia, incoordinación, rigidez) y / o síntomas gastrointesinal (por ejemplo, náuseas, vómitos, diarrea).
Si se sospecha de síndrome serotoninérgico, se debe considerar una rápida interrupción del parche transdérmico Fentanilo Matrix Aristo.
Interacciones con inhibidores CYP3A4
El uso concomitante del fentanilo transdérmico con inhibidores del citocromo P450 (CYP) 3A4 (ej. ritonavir, ketoconazol, , itraconazol, fluconazol, voriconazol, troleandomicina, claritomicina, nelfinavir, nefazodone, verapamil, Diltiazem y amiodarone) pueden resultar en un incremento de la concentración de fentanil en plasma, el cual podría incrementar o prolongar los efectos adversos y terapéuticos, y puede
causar depresión respiratoria grave. En esta situación es apropiada la atención al paciente y la observación.
Por lo tanto, el ucos concomitante del fentanilo transdérmico y los inhibidores del CYP3A4 no son recomendados a menos que los pacientes estén monitorizados. Los pacientes, especialmente aquellos que están recibiendo parches transdérmicos de fentanilo e inhibidores del CYP3A4, deben ser monitorizados para los signos de depresión respiratoria y la dosis debe ser ajustada si es justificado.
Exposición accidental debido a la transferencia del parche
La transferencia accidentalde un parche de fentanilo a la piel de otra persona (particularmente un niño), por ejemplo, mientras se comparte la cama o por un contacto físico cercano con una persona que lleva el parche, puede resultar en una sobredosis de opioides en la persona que normalmente no utiliza los parches de fentanilo. Los pacientes deben ser advertidos de que los parches transferidos accidentalmente deben ser retirados inmediatamente de la piel de la persona que no usa parches de fentanilo (ver sección 4.9 Sobredosis).
Dolor irruptivo
Los estudios han demostrado que la mayoría de los pacientes, a pesar del tratamiento con parches transdérmicos de fentanilo, necesitan ser tratados adicionalmente con medicamentos fuertes y de liberación rápida para detener el dolor irruptivo.
Población pediátrica
Fentanilo Matrix Aristo no debe administrarse a pacientes pediátricos sin experiencia con opioides (ver sección 4.2). Existe la posibilidad de producirse hipoventilación grave o con riesgo para la vida sin tener en cuenta la dosis de Fentanilo Matrix Aristo administrada.
Fentanilo Matrix Aristo no se ha estudiado en niños menores de 2 años. Fentanilo Matrix Aristo solo debe ser administrado a niños a partir de 2 años de edad tolerantes a opioides (ver sección 4.2). Fentanilo Matrix Aristo no debe ser usado en niños menores de 2 años de edad.
Para prevenir una ingestión accidental por parte del niño, se debe tener cuidado al escoger el lugar de aplicación de Fentanilo Matrix Aristo (ver sección 4.2) y la adhesión del parche debe estar estrechamente vigilada.
Para evitar la ingestión accidental por niños, elija con precaución el lugar de la aplicación de Fentanilo Matrix Aristo (véase la sección 6.6. Instrucciones de uso/Manipulación) y controle cuidadosamente la adhesión del parche.
Pacientes de edad avanzada
Los datos de estudios con fentanilo intravenoso sugieren que los pacientes de edad avanzada pueden ser más sensibles al medicamento que los pacientes más jóvenes, con un aclaramiento reducido y una prolongación de la semivida del fentanilo. Si pacientes de edad avanzada reciben Fentanilo Matrix Aristo, deben ser observados cuidadosamente por si aparecen signos de toxicidad por fentanilo y la dosis debe ser reducida si fuese necesario (ver sección 5.2).
Tracto gastrointestinal
Los opioides aumentan el tono y disminuyen las contracciones propulsivas del músculo liso del tracto gastrointestinal. La prolongación del tiempo del tránsito gastrointestinal puede ser responsable del efecto de estreñimiento del fentanilo. Se debe aconsejar a los pacientes la toma de medidas para prevenir el estreñimiento, y puede considerarse en algunas situaciones el uso de un laxante como profilaxis. Se debe
10 de 20 MINISTKODE
SANIDAD, POLITICA SOCIALE IGUALDAD Agencia esparto» de medie amentos y Ofoouctos saltaros
utilizar precaución extra en pacientes con estreñimiento crónico. Si hay presencia o sospecha de íleo paralítico, se debe interrumpir el tratamiento con Fentanilo Matrix Aristo.
Pacientes con miastenia gravis
Pueden ocurrir reacciones (mio)clónicas no epilépticas. Se debe tener precaución cuando se trata a pacientes con miastenia gravis.
Uso indebido con propósitos de dopaje
El uso de Fentanilo Matrix Aristo puede dar lugar a un resultado positivo en la prueba de dopaje. El uso de Fentanilo Matrix Aristo como agente dopante puede ser peligroso para la salud.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los efectos de la sedación pueden ser favorecidos por la administración simultánea de otros depresores del sistema nervioso central, tales como los opioides, los ansiolíticos y tranquilizantes, los hipnóticos y los anestésicos generales, las fenotiazinas, los relajantes musculares, los antihistamínicos sedantes y bebidas alcohólicas. Puede producirse hipoventilación, hipotensión y sedación profunda, coma o muerte. Por lo tanto, el uso concomitante de cualquiera de estos medicamentos mencionados requiere observación y cuidado especial y debería reducirse la dosis de uno o ambos medicamentos.
Inhibidores CYP3A4
Fentanilo, un fármaco de aclaramiento elevado, es metabolizado de forma rápida y extensa principalmente por el CYP 3A4.
El uso concomitante de fentanilo transdérmico con inhibidores del citocromo P450 3A4 (CYP3A4) podría dar lugar a un aumento de la concentración plasmática de fentanilo, lo que podría aumentar o prolongar tanto los efectos terapéuticos como los efectos adversos, y puede causar depresión respiratoria grave.
En esta situación, es apropiado la observación y el cuidado especial del paciente. No se recomienda el uso concomitante de inhibidores del CYP3A4 y fentanilo transdérmico, a menos que el paciente esté estrechamente monitorizado (ver sección 4.4).
Inductores CYP3A4
El uso concomitante con inductores CYP3A4 (por ejemplo rifampicina, carbamazepina, fenobarbital, fenitoina) puede resultar en una disminución de las concentraciones plasmáticas de fentanilo y una disminución del eficto terapéutico. Esto puede requerir un ajuste de la dosis de fentanilo transdérmico. Después de interrumpir el tratamiento con un inductor del CYP3A4, los efectos del inductor disminuyen gradualmente y puede resultar en un aumento de la concentración plasmática de fentanilo, la cual puede aumentar o prolongar los efectos terapéuticos y adversos, y puede causar una depresión respiratoria grave. En esta situación, se debe realizar una monitorización cuidadosa y un ajuste de la dosis si se requiere.
Inhibidores de la Monoaminooxidasa (IMAO):
No se recomienda el uso de Fentanilo Matrix Aristo en pacientes que requieren la administración concomitante de un IMAO. Se han descrito interacciones graves e imprevisibles con IMAOs, que implican la potenciación de efectos opiáceos o la potenciación de efectos serotoninérgicos. Por tanto, Fentanilo Matrix Aristo no se debe utilizar en los 14 días posteriores a la interrupción del tratamiento con IMAOs.
Medicamentos serotoninérgicos
La administración conjunta de fentanilo con otros fármacos serotoninérgicos, tales como los Inhibidores Selectivos de la Recaptación de Serotonina (ISRS), o un Inhibidor de la Recaptación de Serotonina
Norepinefrina (IRSN) o un Inhibidor de la Monoamino Oxidasa (IMAO) puede aumentar el riesgo de síndrome serotoninérgico, una condición potencialmente mortal.
Uso concomitante de agonistas/antagonistas
No se recomienda el uso concomitante de buprenorfina, nalbufina o pentazocina. Éstos tienen una alta afinidad por los receptores opioides con relativamente baja actividad intrínseca y por consiguiente antagonizan parcialmente el efecto analgésico de fentanilo y pueden inducir síntomas de retirada en pacientes dependientes de opioides.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
No hay datos adecuados sobre el uso de Fentanilo en mujeres embarazadas. Los estudios en animales han mostrado cierta toxicidad reproductiva (ver sección 5.3). El riesgo potencial para los seres humanos es desconocido. Fentanilo atraviesa la placenta. Se ha notificado síndrome de abstinencia neonatal en bebés recién nacidos cuyas madres utilizaron de forma crónica Fentanilo transdérmico durante el embarazo. Fentanilo Matrix Aristo no se debe utilizar durante el embarazo a menos que sea claramente necesario.
No se recomienda el uso de parches transdérmicosAristo durante el parto (incluyendo cesárea), ya que no se debe utilizar para el tratamiento del dolor agudo o postoperatorio (ver sección 4.3). Además, puesto que fentanilo atraviesa la placenta, el uso de Fentanilo Matrix Aristo durante el parto podría provocar depresión respiratoria al niño recién nacido.
4.6.2 Lactancia
Fentanilo es excretado en la leche humana y puede causar sedación y/o depresión respiratoria en el bebé. Por tanto, debe interrumpirse la lactancia materna durante el tratamiento con Fentanilo Matrix Aristo durante al menos 72 horas tras la eliminación del parche.
4.6.3 Fertilidad
En estudios con animales se observó trastornos de la ferilidad a dosis altas (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Fentanilo Matrix Aristo puede afectar a la capacidad mental y/o física necesaria para realizar tareas potencialmente peligrosas, tales como conducir un coche o utilizar máquinas.
En los pacientes estabilizados con el ajuste de la dosis de fentanilo (sin influencia adicional de otros principios activos), no se espera un deterioro significativo de la capacidad para conducir y utilizar máquinas. Sin embargo, al inicio del tratamiento, al aumentar la dosis o al combinarlos con otros medicamentos, la reactividad puede ser afectada en casos individuales, lo que lleva a un deterioro considerable de la capacidad para conducir o utilizar máquinas. Estas situaciones deben manejarse con precaución.
4.8 Reacciones adversas
Se evaluó la seguridad de los parches de fentanilo en 1854 sujetos adultos y pediátricos que participaron en 11 ensayos clínicos (doble ciego de parches transdérmicos de fentanilo [placebo o control activo] y/o abierto de Fentanilo Matrix Aristo [no controlado o control activo]) llevado a cabo para mejorar el manejo del dolor crónico maligno o no maligno. Todos los sujetos recibieron al menos 1 dosis de parche transdérmico de fentanilo y proporcionaron datos de seguridad.
a) Resumen del perfil de seguridad
En base a los datos de seguridad de estos ensayos clínicos, las reacciones adversas al medicamento (RAM) notificadas más frecuentemente (>10% de incidencia) fueron (incidencia expresada en %): náuseas (35,7%), vómitos (23,2%), estreñimiento (23,1%), somnolencia (15,0%), mareo (13,1%), y cefalea (11,8%).
La reacción adversa más grave de fentanilo es la depresión respiratoria.
b) Tabla resumen de las reacciones adversas
Las RAM notificadas con el uso de los parches de fentanilo de estos ensayos clínicos, incluyendo las RAM mencionadas anteriormente, y las procedentes de la experiencia post-comercialización se describen la tabla 4.
La clasificación de frecuencias mostradas utiliza la siguiente convención:
Muy frecuentes: Frecuentes:
Poco frecuentes: Raras:
Muy raras:
(> 1/10)
(> 1/100 a < 1/10)
(> 1/1.000 a < 1/100)
(> 1/10.000 a < 1/1.000) (< 1/10.000)
Frecuencia no conocida: (no puede estimarse a partir de los datos disponibles)
Tabla 4: Efectos adversos de los parches de fentanilo de los ensayos clínicos y la experiencia postcomercialización
|
Sistema de clasificación por órganos |
Reacciones Adversas al Medicamento | |||||
|
Categoría de frecuencias | ||||||
|
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Muy raras |
Frecuencia no conocida | |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
Shock anafiláctico, Reacción Anafiláctica, Reacción anafilactoide | ||||
|
Trastornos del metabolismo y de la nutrición |
Anorexia | |||||
|
Trastornos psiquiátricos |
Insomnio, Depresión, Ansiedad, Estado de confusión, Alucinación |
Agitación, Desorientación, Estado de ánimo eufórico | ||||
|
Trastornos del sistema nervioso |
Somnolencia, Mareo, Dolor de cabeza1 |
Temblor, Parestesia |
Hipoestesia, Convulsiones (incluyendo convulsiones clónicas y gran mal), | |||
|
Amnesia, Alteración en el habla Depresión en el nivel de consciencia. Pérdida de consciencia. | ||||||
|
Trastornos oculares |
Conjunctivitis |
Visión borrosa |
Miosis | |||
|
Trastornos del oído y del laberinto |
Vértigo | |||||
|
Trastornos cardiacos |
Palpitaciones, Taquicardia |
Bradicardia, Cianosis |
Arritmia | |||
|
Trastornos vasculares |
Hipertensión |
Hipotensión |
Vasodilatación | |||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea |
Depresión respiratoria, Dificultad respiratoria |
Apnea, Hipoventilación |
Bradipnea | ||
|
Trastornos gastrointestinales |
Náuseas1, Vómitos1, Estreñimiento1 |
Diarrea1, Sequedad de boca, Dolor abdominal, Dolor en la parte superior del abdomen , Dispepsia |
Íleo |
Subíleo |
Flatulencias dolorosas | |
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis, Prurito1, Rash, Eritema |
Eczema, Dermatitis alérgica, Trastorno de la piel, Dermatitis, Dermatitis de contacto | ||||
|
Trastornos musculoesqueléti cos y del tejido conjuntivo |
Espasmos musculares |
Contracciones musculares | ||||
|
Trastornos renales y urinarios |
Retención urinaria |
Oliguria cistalgia | ||||
|
Trastornos del aparato reproductor y de la mama |
Disfunción eréctil, Disfunción sexual | |||||
|
Trastornos generales y alteraciones en el lugar de administración |
Fatiga, Edema periférico, Astenia, Malestar general, Sensación de frío |
Reacción en el lugar de aplicación, Síntomas parecidos a la gripe, Sensación de cambio de la temperatura corporal, Hipersensibilidad en el lugar de |
Dermatitis en el lugar de aplicación, Eczema en el lugar de aplicación |
|
aplicación, Síndrome de abstinencia2, Fiebre |
1 Ver sección 4.8 d)
2 ver sección 4.8 c)
En casos muy raros el aceite de soja puede causar reacciones alérgicas.
c) Descripción de los efectos adversos seleccionados
Al igual que con otros analgésicos opioides, se puede desarrollar tolerancia y dependencia física y dependencia psicológica con el uso repetido de Fentanilo Matrix Aristo (ver sección 4.4).
Es posible que algunos pacientes presenten síntomas de retirada por opioides (como náuseas, vómitos, diarrea, ansiedad y temblores) tras el cambio de sus analgésicos opioides previos a Fentanilo Matrix Aristo o tras la discontinuación repentina del tratamiento (ver sección 4.2).
Se han notificado casos de niños recién nacidos que han experimentado síndrome de abstinencia neonatal cuando las madres utilizaron Fentanilo Matrix Aristo de forma crónica durante el embarazo (ver sección 4.6).
d) Población pediátrica
El perfil de reacciones adversas en niños y adolescentes tratados con Fentanilo parches transdérmicos fue similar al observado en los adultos. No se identificaron riesgos en la población pediátrica fuera de los esperados con el uso de los opioides para el alivio del dolor asociado con enfermedades graves. No parece que haya un riesgo específico pediátrico asociado con el uso de Fentanilo Matrix Aristo en niños de una edad de 2 años cuando se administra como está indicado. Las reacciones adversas muy frecuentes comunicadas en los estudios clínicos pediátricos fueron fiebre, dolor de cabeza, vómitos, náuseas, estreñimiento, diarrea y prurito.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es
4.9 Sobredosis
Síntomas
Las manifestaciones de la sobredosis por fentanilo son una ampliación de sus acciones farmacológicas, siendo el efecto más grave la depresión respiratoria.
Tratamiento
En el caso de una depresión respiratoria se debe retirar inmediatamente Fentanilo Matrix Aristo y se debe animar al paciente a que respire mediante estimulación física o verbal. Se puede administrar entonces un antagonista específico como la Naloxona, pero la depresión respiratoria puede persistir más tiempo que el efecto del antagonista. El intervalo entre las administraciones intravenosas del antagonista debe escogerse con cuidado debido a la posibilidad de una nueva aparición del efecto narcótico tras la retirada del parche; puede ser necesaria la administración repetida o infusión continua de Naloxona. La aparición repentina de dolor y la liberación de catecolaminas puede ser consecuencia de la antagonización.
Si la situación clínica lo requiere, se debe establecer y mantener una vía aérea, posiblemente con una vía orofaríngea o un tubo endotraqueal. Se debe administrar oxígeno y controlar y mantener la respiración, según se precise. Debe mantenerse una temperatura corporal adecuada y una ingesta suficiente de líquidos. Si se produce hipotensión grave o persistente, se debe considerar la posibilidad de hipovolemia, y se debe tratar la condición con una terapia parenteral adecuada de fluidos.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: analgésicos, opioides; Derivados de la fenilpiperidina. Código ATC: N02AB03.
Fentanilo es un analgésico opioide que interacciona fundamentalmente con el receptor opioide-p. Sus principales acciones terapéuticas son la analgesia y la sedación. Las concentraciones analgésicas séricas mínimas de fentanilo en pacientes que no han recibido opioides varían desde 0,3 hasta 1,5 ng/ml y los efectos secundarios aumentan su frecuencia en este grupo de pacientes a partir de los 2 ng/ml.
La concentración que produce efectos indeseables inducidos por opioides aumenta con la duración de la exposición del paciente a fentanilo. La predisposición a desarrollar tolerancia varía ampliamente entre los diferentes individuos.
5.2 Propiedades farmacocinéticas
5.2.1 Absorción
El fentanilo se absorbe continuamente a través de la piel durante un período de 72 horas tras la aplicación de Fentanilo Matrix Aristo. Debido a la matriz polimérica y la difusión de fentanilo a través de las capas de la piel, la tasa de liberación permanece relativamente constante. El gradiente de concentración que existe entre la matriz y la concentración más baja en la piel genera la liberación del medicamento. Tras la aplicación inicial de Fentanilo Matrix Aristo, las concentraciones séricas de fentanilo aumentan gradualmente, alcanzando niveles constantes entre las 12 y las 24 horas tras la aplicación y permaneciendo relativamente constantes durante el resto de las 72 horas del período de aplicación. Las concentraciones séricas alcanzadas son proporcionales al tamaño del parche transdérmico de fentanilo. Tras aplicaciones repetidas de 72 horas, la concentración sérica alcanza niveles estables que se mantiene durante aplicaciones sucesivas de un parche del mismo tamaño.
Un modelo farmacocinético sugiere que la concentración sérica de fentanilo puede incrementar en un 14% (intervalo 0%-26%) si se aplica un nuevo parche tras 24 horas en lugar de tras las 72 horas recomendadas.
5.2.2 Distribución
La unión de fentanilo a proteínas plasmáticas es de alrededor del 84%.
5.2.3 Metabolismo o Biotransformación
Fentanilo es un principio activo con un aclaramiento elevado y es metabolizado de forma rápida y extensa principalmente por el citocromo CYP3A4 en el hígado. El metabolito principal, norfentanilo, es inactivo. No parece que la piel metabolice el fentanilo liberado por vía transdérmica. Esto fue determinado en un ensayo celular con queratocitos humanos y en estudios clínicos, en los que el 92% de la dosis liberada por el sistema fue contabilizada como fentanilo no modificado hallado en la circulación sistémica.
16 de 20 WINISTWIODE
SANIDAD, POLITICA SOCIALE IGUALDAD Agencia es parto» de medicamentos y Sfoouctos sarttanos
5.2.4 Eliminación
Tras eliminar el parche transdérmico que contiene fentanilo, las concentraciones séricas de fentanilo disminuyen gradualmente, reduciendo el tiempo de semi-vida en adultos a 17 horas (13-22) y en niños a 22-25 horas tras una aplicación de 24 horas. En otro estudio, tras una aplicación de 72 horas, la semivida media varía entre 20 -27 horas. La absorción continuada de fentanilo a través de la piel es la responsable de la desaparición más lenta del fármaco en el suero, en comparación con la que se observa tras la perfusión intravenosa, en la que la semivida aparente es de aproximadamente 7 horas (rango 3-12). En las 72 horas después de la administración intravenosa de fentanilo, aproximadamente el 75% de la dosis de fentanilo se excreta por la orina, la mayoría en forma de metabolitos, y menos de un 10% como principio activo inalterado. Alrededor del 9% de la dosis se recupera en las heces, principalmente en forma de metabolitos.
Poblaciones especiales:
Población de edad avanzada
Los datos de estudios con fentanilo administrado por vía intravenosa sugieren que los pacientes de edad avanzada pueden tener el aclaramiento reducido, una semivida prolongada y pueden ser más sensibles al medicamento que pacientes más jóvenes. En un estudio llevado a cabo con parches transdérmicos de fentanilo, los pacientes sanos de edad avanzada demostraron una farmacocinética de fentanilo que no se diferenciaba significativamente de pacientes sanos jóvenes, aunque las concentraciones en suero tendieron a ser más bajas y los valores de semivida media se prolongaron aproximadamente a 34 horas. Los pacientes de edad avanzada deben ser observados cuidadosamente por si aparecen signos de toxicidad por fentanilo y la dosis será reducida si fuera necesario (ver sección 4.4).
Pacientes pediátricos
Se evaluó la seguridad de los parches transdérmicos de fentanilo en 289 sujetos pediátricos (< 18 años) que participaron en 3 ensayos clínicos para el manejo del dolor crónico o continuo de origen maligno o no maligno. Estos sujetos recibieron al menos una dosis de Fentanilo y proporcionaron datos de seguridad. Aunque uno de los criterios para participar en los estudios pediátricos era tener una edad mínima de 2 años de edad, hubo 2 sujetos en estos estudios que recibieron su primera dosis de fentanilo a la edad de 23 meses.
Fentanilo Matrix Aristo no se ha estudiado en niños menores de 2 años de edad. Las investigaciones con niños mayores con ajuste de dosis de acuerdo al peso corporal demostraron que el aclaramiento en pacientes pediátricos es aproximadamente un 20% superior en comparación con los adultos. Estos hallazgos se han tenido en cuenta para determinar las dosis recomendadas para pacientes pediátricos. Fentanilo Matrix Aristo sólo debe ser utilizado en pacientes pediátricos (entre 2 y 16 años) con tolerancia a opioides (ver secciones 4.2 y 4.4).
Insuficiencia hepática
Un estudio llevado a cabo en pacientes con cirrosis hepática, evaluó la farmacocinética de una aplicación única de 50 microgramos/h. Aunque la tnax y tJ/2 no se vieron alterados, los valores de Cmax media plasmática y de AUC aumentaron en aproximadamente un 35% y 73%, respectivamente, en estos pacientes. Los pacientes con insuficiencia hepática deben ser cuidadosamente observados por si aparecen signos de toxicidad por fentanilo y reducir la dosis si es necesario (ver sección 4.4).
Insuficiencia renal
Los datos obtenidos de un estudio con fentanilo administrado por vía intravenosa en pacientes sometidos a trasplante renal sugieren que el aclaramiento de fentanilo puede verse reducido en esta población de pacientes. Los pacientes con insuficiencia renal que reciben parches transdérmicos de fentanilo, deben ser
cuidadosamente observados por si aparecen signos de toxicidad por fentanilo y reducir la dosis si es necesario (ver sección 4.4).
El parche transdérmico es una forma de aplicación para la administración sistémica de fentanilo, que asegura que se mantenga un nivel sérico adecuado de fentanilo durante un período de 72 horas con una velocidad de liberación constante.
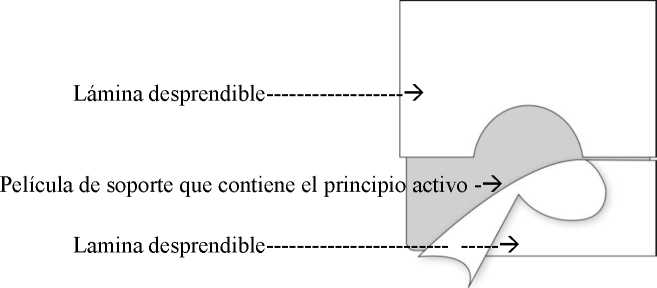
El parche transdérmico consiste de dos láminas funcionales:
La parte superior consiste en una película de soporte impermeable con una matriz autoadhesiva que contiene fentanilo. Esta matriz está cubierta por una lámina desprendible que, debido a las aberturas, puede quitarse fácilmente antes de su uso.
Según los diferentes tamaños de la superficie de absorción de los cinco sistemas de 4.25, 8.5, 17, 25.5 y 34 cm2, se liberan en la piel aproximadamente 12, 25, 50, 75 o 100 mg/hora de fentanilo. Esto se consigue mediante la matriz de polímero: se crea un gradiente de concentración entre la matriz polimérica, con altas concentraciones de principio activo fentanilo, y la piel, con baja concentración de fentanilo. Durante un periodo de 72 horas el fentanilo difunde hacía la concentración más baja, es decir, hacia la piel.
La biodisponibilidad relativa del parche de fentanilo es un 92%. La concentración sérica de fentanilo conseguida es proporcional al tamaño del parche.
5.3 Datos preclínicos sobre seguridad
Los estudios convencionales basados en la seguridad farmacológica, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, datos preclinicos no indican riesgos especiales para los humanos.
En un estudio realizado en ratas no se observó influencia sobre la fertilidad masculina. En otro estudio sobre la fertilidad y el desarrollo embrionario temprano en ratas con altas dosis (300 microgramos/kg/día s.c.) se observó un efecto mediado por los machos relacionado probablemente con los efectos sedantes de fentanilo en experimentos con animales. Investigaciones en ratas hembras mostraron una disminución de la fertilidad y mortalidad embrionaria. Los estudios más recientes demostraron que los efectos embriotóxicos están inducidos indirectamente por la toxicidad materna y no se basan en un efecto directo del principio activo sobre el desarrollo del embrión. Investigaciones realizadas en dos especies no mostraron efectos teratogénicos. En un estudio pre y postnatal, la tasa de supervivencia de las crías fue significativamente menor en el día 4 del período de lactancia, cuando se administraban dosis que inducían una reducción leve en el peso corporal de la madre. En un estudio en el cual se investigó la toxicidad en el desarrollo y la toxicidad reproductiva en ratas que recibieron maternalmente dosis tóxicas de fentanilo, se observó en las crías un retraso en el desarrollo físico, funciones sensoriales, reflejos y comportamiento. Estos efectos pueden deberse a cambios en el cuidado de la cría o a un efecto indirecto del fentanilo sobre las crías.
En un estudio de carcinogénesis de dos años realizado en ratas con dosis subcutáneas de hasta 33 microgramos /kg/día en machos o 100 microgramos/kg/día en hembras (correspondiente a 0,16 y 0,39 veces la dosis diaria humana alcanzada con un parche de 100 microgramos/h, en base a una comparación de AUC0-24h) el fentanilo no estaba asociado con el aumento de la incidencia de tumores.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Componentes de la matriz:
Extracto de aceite de Aloe vera (sobre la base de aceite de soja tocoferol acetato)
Resina de colofonia
Poli(2-etilhexil acrilato, vinil acetato) (50:50)
Revestimiento desprendible:
Polietileno tereftalato, poliéster, siliconizada
Película de soporte impresa:
Lámina de polietileno tereftalato,
Tinta de imprenta
6.2 Incompatibilidades
Para prevenir las interferencias con las propiedades adhesivas del parche no se deben aplicar cremas, aceites, lociones o polvos en el lugar de aplicación del parche.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Cada parche transdérmico se envasa individualmente en un sobre sellado a prueba de niños. El sobre se compone de diferentes capas, por ejemplo, papel, lámina de polietileno y aluminio y está cerrado herméticamente.
Envases con 5, 10, 20 parches transdérmicos.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Para su manipulación:
Ver sección 4.2
Para su eliminación:
Los parches usados se deben doblar de manera que el lado adhesivo del parche no se adhiera a sí mismo y luego se deben desechar de forma segura. Los parches no utilizados deben ser devueltos a la farmacia.
Otras consideraciones:
Fentanilo Matrix Aristo debe utilizarse exclusivamente en la piel de las personas para las que ha sido recetado. En raras ocasiones, el parche se ha podido adherir a otra persona tras un contacto físico cercano. En este caso, se debe retirar el parche inmediatamente.
Por favor, lávese las manos después de la aplicación o retirada de un parche (no utilice productos de limpieza o productos tipo jabón).
Los parches usados
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
ARISTO PHARMA IBERIA, S.L. c/ Solana, 26
28850 - Torrejon de Ardoz España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Febrero 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
Junio de 2016
20 de 20