Fenilefrina Aguettant 50 Microgramos/Ml Solucion Inyectable En Jeringa Precargada
•4^
sm
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Fenilefrina Aguettant 50 microgramos/ml solución inyectable en jeringa precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de solución inyectable contiene hidrocloruro de fenilefrina equivalente a 50 microgramos (0,05 mg) de fenilefrina.
Cada jeringa precargada de 10 ml contiene hidrocloruro de fenilefrina equivalente a 500 microgramos (0,5 mg) de fenilefrina.
Excipientes con efecto conocido:
Este medicamento contiene sodio.
Cada ml de solución inyectable contiene 3,68 mg, equivalentes a 0,160 mmol de sodio.
Cada jeringa precargada con 10 ml contiene 36,8 mg, equivalentes a 1,60 mmol de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en jeringa precargada. (Inyectable)
Solución transparente incolora. pH: 4.7 - 5.3
Osmolalidad: 270-300 mOsm/Kg
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de la hipotensión durante la anestesia espinal, epidural o general.
4.2 Posología y forma de administración
Posología
Adultos
Inyección en bolo intravenoso:
La dosis normal es de 50 a 100 microgramos, que puede repetirse hasta que se consiga el efecto deseado. Una dosis en bolo no debería exceder los 100 microgramos.
Perfusión continua:
La dosis inicial es de 25 a 50 microgramos/min. Las dosis se pueden aumentar o reducir para mantener la presión sanguínea sistólica cercana al valor normal. Las dosis de entre 25 y 100 microgramos/min se han determinado como efectivas.
Insuficiencia renal
Los pacientes con insuficiencia renal pueden necesitar dosis de fenilefrina reducidas.
Insuficiencia hepática
Los pacientes con cirrosis hepática pueden necesitar dosis más elevadas de fenilefrina.
Pacientes de edad avanzada:
El tratamiento se debe aplicar con cuidado en personas de edad avanzada.
Población pediátrica
La seguridad y la eficacia de la fenilefrina en niños aún no se han establecido. No hay datos disponibles. Forma de administración
Administración parenteral. Inyección en bolo intravenoso o perfusión intravenosa.
La administración de fenilefrina, 50 microgramos/ml, solución inyectable debe ser realizada solo por profesionales sanitarios con la formación adecuada y experiencia relevante.
4.3 Contraindicaciones
No se debe usar la fenilefrina en los siguientes casos:
- Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1;
- En pacientes con hipertensión grave o enfermedad vascular periférica, debido al riesgo de gangrena isquémica o trombosis vascular;
- En combinación con inhibidores no selectivos de la monoaminooxidasa (IMAO) (o en las 2 semanas siguientes a su retirada), debido al riesgo de hipertensión paroxística e hipertermia posiblemente mortal (ver sección 4.5);
- En pacientes con hipertiroidismo grave.
4.4 Advertencias y precauciones especiales de empleo
Se debe monitorizar la presión arterial durante el tratamiento.
Se debe administrar la fenilefrina con cuidado a pacientes con:
- diabetes mellitus;
- hipertensión arterial;
- hipertiroidismo no controlado;
- enfermedades coronarias y afecciones cardíacas crónicas;
- insuficiencia vascular periférica no grave;
- bradicardia;
- bloqueo cardíaco parcial;
- taquicardia;
- arritmias;
- angina de pecho (la fenilefrina puede precipitar o exacerbar la angina en pacientes con enfermedad arterial coronaria e historial de angina de pecho);
- aneurisma;
- glaucoma de ángulo cerrado.
La fenilefrina puede causar una reducción del gasto cardíaco. Por lo tanto, se debe administrar con cuidado a pacientes con arteriosclerosis, pacientes de edad avanzada y pacientes con insuficiencia circulatoria cerebral o coronaria.
En pacientes con gasto cardíaco reducido o enfermedad coronaria vascular, se debe monitorizar atentamente las funciones de los órganos vitales y se debe considerar una reducción de dosis cuando la presión arterial sistémica se acerque al extremo inferior del rango objetivo.
En pacientes con insuficiencia cardíaca grave o shock cardiogénico, la fenilefrina puede causar el empeoramiento de la insuficiencia cardíaca como consecuencia de la vasoconstricción inducida (aumento de la poscarga).
Se debe prestar especial atención a la inyección de fenilefrina para evitar la extravasación ya que podría causar necrosis del tejido.
Este medicamento contiene sodio. Cada jeringa precargada con 10 ml contiene 36,8 mg (equivalentes a 1,60 mmol de sodio). Esto debe tenerse en cuenta con los pacientes con una dieta baja en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
Combinaciones contraindicadas (ver sección 4.3)
• Inhibidores no selectivos de la monoaminooxidasa (IMAO) (iproniazida, nialamida)
Hipertensión paroxística, hipertermia posiblemente mortal. Debido a la larga duración de la acción de los IMAO, esta interacción es aún posible 15 días después de la retirada del IMAO.
Combinaciones desaconsejadas
• Alcaloides del cornezuelo dopaminérgicos (bromocriptina, cabergolina, lisurida, pergolida):
Riesgo de vasoconstricción y/o crisis hipertensiva.
• Alcaloides del cornezuelo vasoconstrictores (dihidroergotamina, ergotamina, metilergometrina, metisergida):
Riesgo de vasoconstricción y/o crisis hipertensiva.
• Antidepresivos tricíclicos (p. ej., imipramina):
Hipertensión arterial paroxística con posibilidad de arritmia (inhibición de entrada de adrenalina o noradrenalina en fibras simpáticas).
• Antidepresivos noradrenérgicos-serotoninérgicos (milnaciprán, venlafaxina):
Hipertensión arterial paroxística con posibilidad de arritmia (inhibición de entrada de adrenalina o noradrenalina en fibras simpáticas).
• Inhibidores selectivos de la monoaminooxidasa (IMAO) tipo A (moclobemida, toloxatona)
Riesgo de vasoconstricción y/o crisis hipertensiva.
• Linezolid:
Riesgo de vasoconstricción y/o crisis hipertensiva.
• Guanetidina y productos relacionados:
Aumento considerable de la presión arterial (hiperreactividad ligada a la reducción del tono simpático y/o la inhibición de entrada de adrenalina o noradrenalina en fibras simpáticas). Si la combinación no se puede evitar, utilice con precaución dosis menores de agentes simpaticomiméticos.
• Glucósidos cardíacos, quinidina:
Aumento del riesgo de arritmias.
• Sibutramina:
Hipertensión arterial paroxística con posibilidad de arritmia (inhibición de entrada de adrenalina o noradrenalina en fibras simpáticas).
rj$k
• Anestésicos volátiles halogenados (desflurano. enflurano. halotano, isoflurano. metoxiflurano. sevoflurano):
Riesgo de crisis hipertensiva perioperatoria y arritmias.
Combinaciones que requieren precauciones de uso
• Agentes oxitócicos:
El efecto de las aminas simpaticomiméticas presoactivas está potenciado. De este modo. algunos agentes oxitócicos pueden causar hipertensión persistente grave y pueden ocurrir accidentes cerebrovasculares durante el período de postparto.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Los estudios en animales son insuficientes para determinar la toxicidad reproductiva y teratogenicidad (ver sección 5.3).
La administración de fenilefrina al final del embarazo o en el parto puede potencialmente causar hipoxia fetal y bradicardia. Es posible el uso de fenilefrina inyectable durante el embarazo de acuerdo con las indicaciones.
La combinación con algunos agentes oxitócicos puede causar hipertensión grave (ver sección 4.5).
Lactancia
Pequeñas cantidades de fenilefrina se excretan en la leche materna humana y la biodisponibilidad oral puede ser baja.
La administración de vasoconstrictores a la madre expone al bebé a un riesgo teórico de efectos cardiovasculares y neurológicos. Sin embargo. si se administra un solo bolo durante el parto. la lactancia materna es posible.
Fertilidad
No hay datos disponibles sobre fertilidad tras la exposición a la fenilefrina (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
Resumen del_perfil de seguridad
Las reacciones adversas más comunes de la fenilefrina son bradicardia. episodios de hipertensión. náuseas y vómitos. La hipertensión es más frecuente con dosis altas.
La reacción adversa cardiovascular más comúnmente reportada parece ser la bradicardia. posiblemente debido a la estimulación vagal mediada por barorreceptores y consistente con el efecto farmacológico de la fenilefrina.
Lista de reacciones adversas
Frecuencia: No conocida (no puede estimarse a partir de los datos disponibles)
Trastornos del sistema inmunológico:
No conocida: hipersensibilidad
Trastornos psiquiátricos:
No conocida: ansiedad, excitabilidad, agitación, estados psicóticos, confusión.
Trastornos del sistema nervioso
No conocida: dolor de cabeza, nerviosismo, insomnio, parestesia, temblores.
Trastornos oculares:
No conocida: midriasis, empeoramiento de glaucoma de ángulo cerrado preexistente.
Trastornos cardiacos:
No conocida: bradicardia refleja, taquicardia, palpitaciones, hipertensión, arritmia, angina de pecho, isquemia miocárdica.
Trastornos vasculares:
No conocida: hemorragia cerebral, crisis hipertensiva.
Trastornos respiratorios, torácicos y mediastínicos:
No conocida: disnea, edema pulmonar.
Trastornos gastrointestinales:
No conocida: náuseas, vómitos.
Trastornos de la piel y del tejido subcutáneo:
No conocida: sudoración, palidez o blanqueo de la piel, piloerección, necrosis de la piel con extravasación.
Trastornos musculoesqueléticos y del tejido conjuntivo:
No conocida: debilidad muscular.
Trastornos renales y urinarios:
No conocida: dificultad en la micción y retención de orina Descripción de reacciones adversas seleccionadas
Como la fenilefrina se ha utilizado con frecuencia en el ámbito de la atención crítica en pacientes con hipotensión y shock, algunas de las reacciones adversas graves y muertes están probablemente relacionadas con la enfermedad subyacente y no con el uso de fenilefrina.
Otras poblaciones especiales
Ancianos: el riesgo de toxicidad de la fenilefrina se incrementa en pacientes de edad avanzada (ver sección 4.4).
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https: //www .notificaram.es.
4.9 Sobredosis
Los síntomas de una sobredosis incluyen dolores de cabeza, náuseas, vómitos, psicosis paranoica, alucinaciones, hipertensión y bradicardia refleja. Se pueden producir arritmias cardíacas tales como extrasístoles ventriculares y episodios paroxísticos breves de taquicardia ventricular.
El tratamiento debería consistir en medidas sintomáticas y de apoyo. Los efectos hipertensivos pueden ser tratados con un fármaco bloqueante del alfa-adrenoceptor, tales como la fentolamina.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes adrenérgicos y dopaminérgicos, código ATC: C01CA06
La fenilefrina es un potente vasoconstrictor que actúa casi exclusivamente mediante la estimulación de los receptores alfa-1-adrenérgicos. Esta vasoconstricción arterial también va acompañada de vasoconstricción venosa. Esto proporciona un aumento de la presión sanguínea y bradicardia refleja. La potente vasoconstricción arterial proporciona un aumento de la resistencia vascular sistémica (aumento en la poscarga). El resultado general es una reducción en el gasto cardíaco. Esto es menos pronunciado en las personas sanas, pero puede empeorar en casos de insuficiencia cardíaca previa. Como los efectos de la fenilefrina están relacionados con sus propiedades farmacológicas, pueden controlarse con antídotos conocidos.
5.2 Propiedades farmacocinéticas
El volumen de distribución tras una dosis única es de 340 litros.
La fenilefrina se metaboliza en el hígado mediante la monoaminooxidasa.
La fenilefrina es principalmente excretada a través de los riñones como ácido m-hidroximandélico y conjugados de fenol.
La duración del efecto es de 20 minutos tras la administración intravenosa.
La vida media terminal de la fenilefrina inyectable es de aproximadamente 3 horas.
No se conoce la unión a proteínas plasmáticas.
No hay datos disponibles relativos a la farmacocinética de grupos especiales de pacientes.
5.3 Datos preclínicos sobre seguridad
No hay evidencias de genotoxicidad o carcinogenicidad de fenilefrina. Los estudios en animales son insuficientes para evaluar los efectos en la fertilidad y la reproducción.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de sodio
Citrato de sodio dihidratado
Ácido cítrico monohidrato
Hidróxido de sodio
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 3 años.
6.4 Precauciones especiales de conservación
Mantenga la jeringa en el blister cerrado hasta su uso. Guarde el blister dentro de la caja para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Jeringa precargada de polipropileno de 10 ml. Las jeringas precargadas están disponibles en cajas de 1 y 10 jeringas.
Puede que solamente estén comercializados algunos tamaños de envase.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado o de los materiales de desecho, se realizará de acuerdo con la normativa local.
Instrucciones de uso:
Prepare la jeringa cuidadosamente como se indica a continuación
La jeringa precargada es para un único paciente. Elimine la jeringa después de su uso. NO LA REUTILICE.
El contenido de un blister que no esté abierto ni estropeado es estéril, y no debe ser abierto hasta su uso.
Debe inspeccionarse visualmente el producto, para comprobar que no haya partículas ni cambio de color antes de su administración. Solo debe usarse la solución cuando sea transparente, incolora y no se observen partículas o precipitados.
El producto no debe usarse si el precinto hermético de seguridad de la jeringa está roto.
La superficie exterior de la jeringa es estéril hasta que se abre el blister.
Cuando se utiliza usando un método aséptico, la solución de Fenilefrina Aguettant 50 microgramos/ml solución inyectable en jeringa precargada puede colocarse en un campo estéril.
1) Saque la jeringa precargada del blister estéril.
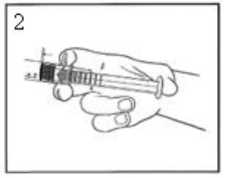
2) Empuje el émbolo para liberar el tapón. El proceso de esterilización puede haber causado la adhesión del tapón al cuerpo de la jeringa.
'p'
sm
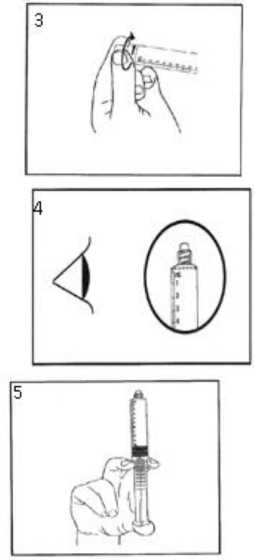
3) Desenrosque la tapa del extremo hasta romper el precinto. No toque la conexión Luer expuesta para evitar la contaminación.
4) Compruebe que se ha retirado completamente el precinto de la jeringa. Si no es así, vuelva a colocar la tapa y desenrósquela de nuevo.
5) Empuje el émbolo con suavidad para expulsar el aire sobrante.
6) Conecte la jeringa al acceso intravenoso. Empuje el émbolo lentamente para inyectar el volumen necesario.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
LABORATOIRE AGUETTANT 1 rue Alexander Fleming, Parc Scientifique Tony Garnier 69007 Lyon -Francia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Febrero 2016
10. FECHA DE LA REVISIÓN DEL TEXTO
Septiembre 2015
8 de 8