Eylea 40Mg/Ml Solucion Inyectable En Vial
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Eylea 40 mg/ml solución inyectable en jeringa precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución inyectable contiene 40 mg de aflibercept*.
Una jeringa precargada contiene 90 microlitros, equivalentes a 3,6 mg de aflibercept. Esto proporciona una cantidad utilizable que proporciona una dosis única de 50 microlitros que contiene 2 mg de aflibercept.
* Proteína de fusión que consiste en porciones de los dominios extracelulares de los receptores 1 y 2 del factor de crecimiento endotelial vascular (VEGF) humano fusionados con la porción Fc de la IgG1 humana, y obtenida en células K1 de ovario de hámster chino (CHO) mediante tecnología de DNA recombinante.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
Solución transparente, de incolora a amarillo pálido e isosmótica.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Eylea está indicado en adultos para el tratamiento de:
• la degeneración macular asociada a la edad (DMAE) neovascular (exudativa) (ver sección 5.1).
• la alteración visual debida al edema macular secundario a la oclusión de la vena retiniana (oclusión de la rama venosa retiniana (ORVR) u oclusión de la vena central retiniana (OVCR) (ver sección 5.1).
• la alteración visual debida al edema macular diabético (EMD) (ver sección 5.1).
• la alteración visual debida a la neovascularización coroidea miópica (NVC miópica) (ver sección 5.1).
4.2 Posología y forma de administración
Eylea se administra exclusivamente por inyección intravítrea.
Eylea debe ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas.
Posología
DMAE exudativa
La dosis recomendada de Eylea es 2 mg de aflibercept, equivalente a 50 microlitros.
El tratamiento con Eylea se inicia con una inyección mensual para las tres primeras dosis, seguido de una inyección cada dos meses. No es necesario realizar una monitorización entre inyecciones.
Tras los primeros 12 meses de tratamiento con Eylea, en función de los resultados visuales y/o anatómicos, el intervalo entre tratamientos puede ampliarse, como en una pauta posológica de “tratar y extender”, aumentando gradualmente los intervalos entre tratamientos para mantener unos resultados visuales y/o anatómicos estables, aunque no se dispone de datos suficientes para concretar la duración de estos intervalos. Si se observa un deterioro de los resultados visuales y/o anatómicos, se debe reducir el intervalo entre dosis según corresponda.
Por tanto, el programa de monitorización se determinará según criterio médico y puede ser más frecuente que el programa de administración de las inyecciones.
Edema macular secundario a OVR (OVR de rama o central)
La dosis recomendada de Eylea es 2 mg de aflibercept, equivalente a 50 microlitros.
Después de la inyección inicial, el tratamiento se administra mensualmente. El intervalo entre dos dosis no debe ser inferior a un mes.
Si los parámetros visuales y anatómicos indican que el paciente no se está beneficiando del tratamiento continuado, se debe interrumpir el tratamiento con Eylea.
El tratamiento se administra mensualmente y de forma continuada hasta que se observa una agudeza visual máxima y/o no hay signos de actividad de la enfermedad. Pueden ser necesarias tres o más inyecciones mensuales consecutivas.
El tratamiento se puede entonces continuar con una pauta de “tratar y extender”, aumentando gradualmente los intervalos para mantener unos resultados visuales y/o anatómicos estables, aunque no se dispone de datos suficientes para concretar la duración de estos intervalos. Si se observa un deterioro de los resultados visuales y/o anatómicos, se debe reducir el intervalo entre dosis según corresponda.
El médico responsable debe determinar el programa de monitorización y tratamiento en base a la respuesta individual de cada paciente.
La monitorización de la actividad de la enfermedad puede incluir examen clínico, técnicas de análisis funcional o de imagen (por ejemplo, tomografía de coherencia óptica o angiografía con fluoresceína).
Edema macular diabético
La dosis recomendada de Eylea es 2 mg de aflibercept, equivalente a 50 microlitros.
El tratamiento con Eylea se inicia con una inyección mensual para las cinco primeras dosis consecutivas, seguido de una inyección cada dos meses. No es necesario realizar una monitorización entre inyecciones.
Tras los primeros 12 meses de tratamiento con Eylea, en función de los resultados visuales y/o anatómicos, el intervalo entre tratamientos puede ampliarse, como en una pauta posológica de “tratar y extender”, aumentando gradualmente los intervalos entre tratamientos para mantener unos resultados visuales y/o anatómicos estables, aunque no se dispone de datos suficientes para concretar la duración de estos intervalos. Si se observa un deterioro de los resultados visuales y/o anatómicos, se debe reducir el intervalo entre dosis según corresponda.
Por tanto, el programa de monitorización se determinará según criterio médico y puede ser más frecuente que el programa de administración de las inyecciones.
Si los resultados visuales y anatómicos indican que el paciente no se beneficia del tratamiento continuado, se debe interrumpir el tratamiento con Eylea.
Neovascularización coroidea miópica
La dosis recomendada de Eylea es una única inyección intravítrea de 2 mg de aflibercept equivalente a 50 microlitros.
Se pueden administrar dosis adicionales si los resultados visuales y/o anatómicos indican que la enfermedad persiste. Las recurrencias se deben tratar como una nueva manifestación de la enfermedad.
El programa de monitorización se determinará según criterio médico.
El intervalo entre dos dosis no debe ser inferior a un mes.
Poblaciones especiales
Insuficiencia hepática y/o renal
No se han realizado estudios específicos con Eylea en pacientes con insuficiencia hepática y/o renal.
Los datos disponibles no sugieren que sea necesario ajustar la dosis de Eylea en estos pacientes (ver sección 5.2).
Pacientes de edad avanzada
No se necesitan consideraciones especiales. La experiencia en pacientes mayores de 75 años con EMD es limitada.
Población pediátrica
No se ha establecido la seguridad y eficacia de Eylea en niños ni adolescentes. No existe una recomendación de uso específica para Eylea en las indicaciones de DMAE exudativa, OVCR, ORVR, EMD y NVC miópica en la población pediátrica.
Forma de administración
Las inyecciones intravítreas deben realizarse teniendo en cuenta los estándares médicos y las directrices pertinentes, por un médico cualificado que tenga experiencia en la administración de inyecciones intravítreas. En general, deben asegurarse unas medidas de anestesia y de asepsia adecuadas, que incluyan el uso de un microbicida tópico de amplio espectro (p. ej., povidona yodada aplicada en la piel de la zona periocular, párpado y superficie ocular). Se recomienda el lavado quirúrgico de las manos, uso de guantes estériles, un campo estéril y un blefarostato estéril para los párpados (o equivalente).
La aguja de inyección se debe introducir 3,5 - 4,0 mm por detrás del limbo en la cavidad vítrea, evitando el meridiano horizontal y en dirección al centro del globo. Seguidamente debe liberarse el volumen de inyección de 0,05 ml; las inyecciones siguientes se deben aplicar cada vez en un punto escleral distinto.
Inmediatamente después de la inyección intravítrea, se debe monitorizar a los pacientes a fin de detectar una elevación de la presión intraocular. Una monitorización adecuada puede consistir en la comprobación de la perfusión de la cabeza del nervio óptico o en la realización de una tonometría. En caso necesario, debe estar disponible un equipo de paracentesis estéril.
Tras la inyección intravítrea, se debe instruir a los pacientes sobre la necesidad de notificar inmediatamente cualquier síntoma que sugiera endoftalmitis (p. ej., dolor ocular, enrojecimiento del ojo, fotofobia o visión borrosa).
Cada jeringa precargada debe usarse exclusivamente para el tratamiento de un solo ojo.
La jeringa precargada contiene más cantidad que la dosis recomendada de 2 mg de aflibercept. El volumen extraíble de la jeringa (90 microlitros) no se administrará en su totalidad. El exceso de volumen debe eliminarse antes de administrar el medicamento.
Si se inyecta todo el volumen de la jeringa precargada puede dar lugar a una sobredosis. Para eliminar las burbujas y el exceso de medicamento, apriete lentamente el émbolo hasta alinear la base cilíndrica de la parte en forma de cúpula del émbolo con la línea de dosificación negra de la jeringa (equivalente a 50 microlitros, es decir, 2 mg de aflibercept).
Tras la inyección, debe desecharse todo resto de producto no utilizado.
Para la manipulación del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo aflibercept o a alguno de los excipientes incluidos en la sección 6.1.
Infección ocular o periocular activa o sospecha de éstas.
Inflamación intraocular activa grave.
4.4 Advertencias y precauciones especiales de empleo
Reacciones relacionadas con la inyección intravítrea
Las inyecciones intravítreas, incluidas las de Eylea, se han asociado a endoftalmitis, inflamación intraocular, desprendimiento retiniano regmatógeno, desgarro retiniano y catarata traumática iatrogénica (ver sección 4.8). Siempre que se administre Eylea, se deben emplear técnicas de inyección asépticas adecuadas. Además, se deben monitorizar los pacientes durante la semana siguiente a la inyección para, en caso de infección, poder instaurar inmediatamente el tratamiento. Se debe instruir a los pacientes sobre la necesidad de notificar inmediatamente cualquier síntoma que sugiera endoftalmitis o cualquiera de los acontecimientos indicados anteriormente.
Se han observado aumentos de la presión intraocular en los 60 minutos siguientes a la administración de una inyección intravítrea, incluidas las de Eylea (ver sección 4.8). Es necesario tener especial precaución en los pacientes con glaucoma mal controlado (no inyectar Eylea cuando la presión intraocular sea > 30 mmHg). Por consiguiente, en todos los casos, se debe monitorizar y tratar adecuadamente tanto la presión intraocular como la perfusión de la cabeza del nervio óptico.
Inmunogenicidad
Dado que se trata de una proteína terapéutica, hay un potencial de inmunogenicidad con Eylea (ver sección 4.8). Se debe instruir a los pacientes sobre la necesidad de notificar cualquier signo o síntoma de inflamación intraocular, p. ej., dolor, fotofobia o enrojecimiento, ya que puede ser un signo clínico atribuible a hipersensibilidad.
Efectos sistémicos
Se han notificado acontecimientos adversos sistémicos, incluyendo hemorragias no oculares y acontecimientos tromboembólicos arteriales tras la inyección intravítrea de inhibidores del VEGF, existiendo un riesgo teórico de que puedan relacionarse con la inhibición del VEGF. Los datos sobre seguridad del tratamiento de pacientes con OVCR, ORVR, EMD o NVC miópica con antecedentes de ictus, de ataques isquémicos transitorios o de infarto de miocardio en los últimos 6 meses son limitados. Se debe tener precaución cuando se traten tales pacientes.
Otros
Al igual que ocurre con otros tratamientos anti-VEGF intravítreos para la DMAE, OVCR, ORVR, EMD y NVC miópica son pertinentes las siguientes afirmaciones:
- No se ha estudiado sistemáticamente la seguridad y eficacia del tratamiento con Eylea aplicado en los dos ojos a la vez (ver sección 5.1). Si se realiza el tratamiento bilateral a la vez, se podría producir un incremento de la exposición sistémica que podría aumentar el riesgo de acontecimientos adversos sistémicos.
- Uso concomitante de otros anti-VEGF
No hay datos disponibles sobre el uso concomitante de Eylea con otros medicamentos anti-VEGF (por vía sístémica u ocular).
- Entre los factores de riesgo asociados con el desarrollo de un desgarro del epitelio pigmentario de la retina tras la terapia con anti-VEGF para la DMAE exudativa, se incluye el desprendimiento amplio y/o importante del epitelio pigmentario de la retina. Cuando se inicie un tratamiento con Eylea se debe tener precaución en pacientes con estos factores de riesgo de desarrollar desgarros del epitelio pigmentario de la retina.
- El tratamiento se debe aplazar en pacientes con desprendimiento de retina regmatógeno o con agujeros maculares en estadio 3 ó 4.
- En caso de rotura retiniana, se debe aplazar la dosis y el tratamiento no se debe reanudar hasta que se haya reparado la rotura.
- La dosis se debe aplazar y el tratamiento no se debe reanudar antes del siguiente tratamiento programado en caso de:
• Una disminución en la agudeza visual mejor corregida (AVMC) de >30 letras comparado con la
última evaluación de la agudeza visual.
• Una hemorragia subretiniana que afecte al centro de la fóvea o, si el tamaño de la hemorragia es
de >50% del área total de la lesión.
- La dosis se debe aplazar en los 28 días previos o posteriores a una cirugía intraocular planificada o realizada.
- No se debe usar Eylea durante el embarazo salvo que el beneficio esperado supere el riesgo potencial para el feto (ver sección 4.6).
- Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento y durante al menos 3 meses después de la última inyección intravítrea de aflibercept (ver sección 4.6).
- La experiencia en el tratamiento de pacientes con OVCR y ORVR isquémicas es limitada. No se recomienda el tratamiento en pacientes que presenten signos clínicos de pérdida irreversible de la función visual isquémica.
Poblaciones con datos limitados
Solo existe experiencia limitada en el tratamiento de sujetos con EMD debido a diabetes de tipo I, de pacientes diabéticos con una hemoglobina glicosilada (en inglés, HbA1c) superior al 12% o con retinopatía diabética proliferativa.
Eylea no ha sido estudiado en pacientes con infecciones sistémicas activas ni en pacientes con enfermedades oculares concurrentes, tales como desprendimiento de retina o agujero macular. Tampoco existe experiencia en el tratamiento con Eylea de pacientes diabéticos con hipertensión no controlada. El médico debe tener en cuenta esta falta de información a la hora de tratar a dichos pacientes.
Para la NVC miópica no existe experiencia con Eylea en el tratamiento de pacientes no asiáticos, en pacientes que se han sometido a tratamiento para la NVC miópica con anterioridad, ni en pacientes con lesiones extrafoveales.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
No se ha estudiado el uso conjunto de terapia fotodinámica (TFD) con verteporfina y Eylea, por lo que no se ha establecido un perfil de seguridad.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento y durante al menos 3 meses después de la última inyección intravítrea de aflibercept (ver sección 4.4).
Embarazo
No hay datos relativos al uso de aflibercept en mujeres embarazadas.
Los estudios realizados en animales han mostrado toxicidad fetoembrionaria (ver sección 5.3).
Aunque la exposición sistémica tras la administración ocular es muy baja, no se debe usar Eylea durante el embarazo a menos que el beneficio potencial supere al riesgo potencial para el feto.
Lactancia
Se desconoce si aflibercept se excreta en la leche materna. No se puede excluir el riesgo en el lactante.
No se recomienda utilizar Eylea durante la lactancia. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
Los resultados de los estudios en animales con elevada exposición sistémica indican que aflibercept puede alterar la fertilidad masculina y femenina (ver sección 5.3). No se prevé que se produzcan estos efectos tras una administración ocular con una exposición sistémica muy baja.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La inyección de Eylea tiene una influencia leve en la capacidad para conducir y utilizar máquinas debido a las posibles alteraciones visuales transitorias asociadas o bien a la inyección o al examen ocular. Los pacientes no deben conducir ni utilizar máquinas hasta que su función visual se haya recuperado lo suficiente.
4.8 Reacciones adversas
Resumen del perfil de seguridad
La población total de seguridad en los ocho estudios de fase III estuvo constituida por 3.102 pacientes. De ellos, 2.501 fueron tratados con la dosis recomendada de 2 mg.
Se produjeron reacciones adversas oculares graves en el ojo en estudio relacionadas con el procedimiento de inyección en menos de 1 de cada 1.900 inyecciones intravítreas de Eylea, que incluyeron ceguera, endoftalmitis, desprendimiento de retina, catarata traumática, catarata, hemorragia vítrea, desprendimiento de vítreo y aumento de la presión intraocular (ver sección 4.4).
Las reacciones adversas observadas más frecuentemente (en al menos 5% de los pacientes tratados con Eylea) fueron hemorragia conjuntival (25%), agudeza visual reducida (11%), dolor ocular (10%), catarata (8%), aumento de la presión intraocular (8%), desprendimiento de vítreo (7%) y partículas flotantes en el vítreo (7%).
Tabla de reacciones adversas
Los datos de seguridad descritos a continuación incluyen todas las reacciones adversas de los ocho estudios de fase III en las indicaciones de DMAE exudativa, OVCR, ORVR, EMD y NVC miópica con una posibilidad razonable de relación causal con el procedimiento de inyección o con el medicamento.
Las reacciones adversas se listan según un sistema de clasificación de órganos y sistemas y por frecuencia, utilizando el criterio siguiente:
Muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000).
En cada grupo de frecuencia, las reacciones adversas se presentan en orden de gravedad decreciente.
Tabla 1: Todas las reacciones adversas relacionadas con el tratamiento, notificadas en pacientes de los estudios de fase III (datos agrupados de los estudios de fase III para las indicaciones de DMAE exudativa, OVCR, ORVR, EMD y NVC miópica) o durante la vigilancia poscomercialización
|
Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
|
Trastornos del sistema inmunológico |
Hipersensibilidad*** | |||
|
Trastornos oculares |
Agudeza visual reducida, Hemorragia conjuntival, Dolor ocular |
Desgarro del epitelio pigmentario retiniano*, Desprendimiento del epitelio pigmentario retiniano, Degeneración retiniana, Hemorragia vitrea, Catarata, Catarata cortical, Catarata nuclear, Catarata subcapsular, Erosión corneal, Abrasión corneal, Aumento de la presión intraocular, Visión borrosa, Partículas flotantes en el vítreo, Desprendimiento de vítreo, Dolor en el lugar de inyección, Sensación de cuerpo extraño en los ojos, Aumento del lagrimeo, Edema palpebral, Hemorragia en el lugar de inyección, Queratitis punteada, Hiperemia conjuntival, Hiperemia ocular |
Endoftalmitis**, Desprendimiento de retina, Desgarro retiniano, Iritis, Uveítis, Iridociclitis, Opacidad lenticular, Defecto en el epitelio corneal, Irritación en el lugar de inyección, Sensación anormal en el ojo, Irritación palpebral, Células flotantes en la cámara anterior, Edema corneal. |
Ceguera, Catarata traumática, Vitritis, Hipopion |
* Asociadas a DMAE exudativa. Observadas únicamente en los estudios de DMAE exudativa.
** Endoftalmitis en cultivo positivo y cultivo negativo.
*** Durante el periodo poscomercialización, las notificaciones de hipersensibilidad incluyeron
erupción, prurito, urticaria y casos aislados de reacciones anafilácticas/anafilactoides graves. Descripción de reacciones adversas seleccionadas
En los ensayos de fase III en DMAE exudativa se observó un aumento de la incidencia de hemorragia conjuntival en los pacientes en tratamiento con medicamentos antitrombóticos. Este aumento de la incidencia fue comparable entre los pacientes tratados con ranibizumab o con Eylea.
Los acontecimientos tromboembólicos arteriales (ATA) son acontecimientos adversos potencialmente relacionados con la inhibición sistémica del VEGF. Tras el uso intravítreo de inhibidores del VEGF existe un riesgo teórico de acontecimientos tromboembólicos arteriales, incluidos ictus e infarto de miocardio.
Se observó una tasa de incidencia baja de eventos tromboembólicos arteriales en los ensayos clínicos con Eylea en pacientes con DMAE, EMD, OVR y NVC miópica. No se observaron diferencias notables entre los grupos tratados con aflibercept y los respectivos grupos comparadores en todas las indicaciones.
Al igual que con todas las proteínas terapéuticas, Eylea presenta un potencial de inmunogenicidad. Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
En los ensayos clínicos, se han usado dosis de hasta 4 mg en intervalos mensuales y en casos aislados se produjeron sobredosis con 8 mg.
La sobredosificación con un volumen de inyección elevado puede aumentar la presión intraocular. Por lo tanto, en caso de sobredosis se debe monitorizar la presión intraocular e iniciarse el tratamiento adecuado, si el médico responsable del tratamiento lo considera necesario.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: agentes oftalmológicos, agentes antineovascularización. Código ATC: S01LA05.
Aflibercept es una proteína de fusión recombinante que consta de porciones de los dominios extracelulares de los receptores 1 y 2 del VEGF humano fusionados con la porción Fc de la IgG1 humana.
Aflibercept se produce en células K1 de ovario de hámster chino (CHO) mediante tecnología de DNA recombinante.
Aflibercept actúa como un receptor anzuelo soluble que se une al VEGF-A y al PlGF con mayor afinidad que sus receptores naturales, por lo que es capaz de inhibir la unión y activación de estos receptores habituales para el VEGF.
Mecanismo de acción
El factor de crecimiento endotelial vascular-A (VEGF-A) y el factor de crecimiento placentario (PlGF) son miembros de la familia VEGF de factores angiogénicos que pueden actuar como potentes factores mitógenos, quimiotácticos y de permeabilización vascular para las células endoteliales. El VEGF actúa a través de dos receptores tirosina quinasas, VEGFR-1 y VEGFR-2, presentes en la superficie de las células endoteliales. El PlGF se une solamente a VEGFR-1, que también se encuentra en la superficie de los leucocitos. La activación excesiva de estos receptores por el VEGF-A puede provocar una neovascularización patológica y una permeabilidad vascular excesiva. El PlGF puede actuar sinérgicamente con el VEGF-A en estos procesos y se sabe que también favorece la infiltración leucocitaria y la inflamación vascular.
Efectos farmacodinámicos
DMAE exudativa
La DMAE exudativa se caracteriza por una neovascularización coroidea (NVC) patológica. La fuga de sangre y fluido de la NVC puede causar un engrasamiento o edema retiniano y/o hemorragias sub/intrarretinianas, con la consiguiente pérdida de agudeza visual.
En los pacientes tratados con Eylea (una inyección mensual durante tres meses consecutivos, seguida de una inyección cada 2 meses), el grosor central de la retina (GCR) disminuyó poco tiempo después del inicio del tratamiento y el tamaño medio de las lesiones de NVC se redujo, de forma concordante con los resultados observados con la pauta de administración mensual de ranibizumab en dosis de 0,5 mg.
En el ensayo VIEW1, se produjeron reducciones medias del GCR en la tomografía de coherencia óptica (OCT) (de -130 y -129 micras en la semana 52 para los grupos tratados con Eylea 2 mg cada dos meses y con ranibizumab 0,5 mg cada mes, respectivamente). Asimismo, en la semana 52 del ensayo VIEW2 se observaron reducciones medias del GCR en la OCT
(de -149 y -139 micras para los grupos tratados con Eylea, 2 mg cada dos meses, y con ranibizumab, 0,5 mg cada mes, respectivamente).
En general, las reducciones del tamaño de la NVC y del GCR se mantuvieron en el segundo año de los ensayos.
Edema macular secundario a OVCR y ORVR
En la OVCR y la ORVR, se produce isquemia retiniana lo que activa la liberación de VEGF, lo cual a su vez desestabiliza las uniones estrechas y promueve la proliferación de células endoteliales. La sobre-regulación de VEGF se asocia a la ruptura de la barrera hematoretiniana, aumento de permeabilidad vascular, edema retiniano y complicaciones de la neovascularización.
En los pacientes tratados con 6 inyecciones mensuales consecutivas de Eylea 2 mg, se observó una respuesta morfológica uniforme, rápida y robusta (medida por las mejorías en el GCR medio). En la semana 24, la reducción en el GCR fue estadísticamente superior frente al control en los 3 estudios (COPERNICUS en OVCR: -457 frente a -145 micras; GALILEO en OVCR: -449 frente a -169 micras; VIBRANT en ORVR: -280 frente a -128 micras). Esta reducción con respecto al valor basal de GCR se mantuvo hasta el final de cada estudio, semana 100 en el estudio COPERNICUS, semana 76 en el estudio GALILEO y semana 52 en el estudio VIBRANT.
Edema macular diabético
El edema macular diabético es una consecuencia de la retinopatía diabética y se caracteriza por el aumento de la vasopermeabilidad y lesiones de los capilares retinianos que pueden ocasionar pérdida de la agudeza visual.
En los pacientes tratados con Eylea, la mayoría de los cuales padecían diabetes tipo II, se observó una respuesta rápida y robusta en la morfología (GCR, escala DRSS).
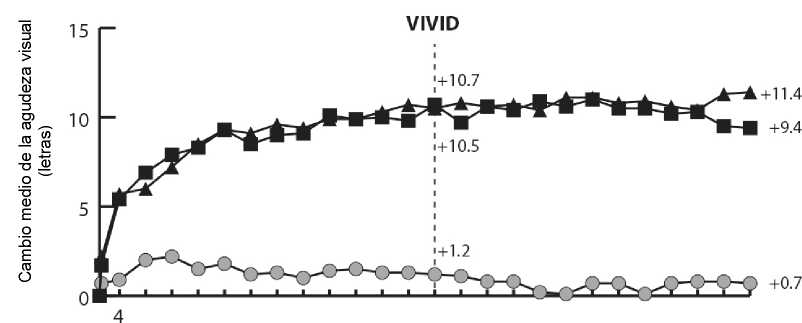
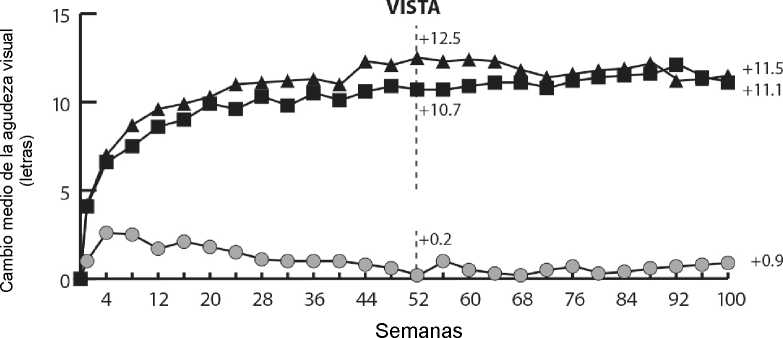
En los ensayos VIVIDDME y VISTADME, se observó una mayor reducción media del GCR estadísticamente significativa desde el valor basal hasta la semana 52 en pacientes tratados con Eylea respecto al grupo de control con láser, de -192,4 y -183,1 micras para los grupos tratados con Eylea 2Q8 y de -66,2 y -73,3 micras para los grupos de control, respectivamente. En la semana 100 las reducciones continuaron, siendo de -195,8 y -191,1 micras para los grupos tratados con Eylea 2Q8 y de -85,7 y -83,9 micras para los grupos de control en los ensayos VIVIDDME y VISTADME, respectivamente.
Se evaluó de forma preespecificada una mejoría de > 2 niveles según la puntuación de la escala DRSS de gravedad de la retinopatía diabética en los ensayos VIVIDDME y VISTADME. La puntuación DRSS fue graduable en el 73,7% de los pacientes en VIVIDDME y en el 98,3% de los pacientes en VISTADME En la semana 52, el 27,7% y el 29,1% de los grupos tratados con Eylea 2Q8, y el 7,5% y el 14,3% de los grupos de control experimentaron una mejoría de > 2 niveles en la DRSS. En la semana 100, los porcentajes respectivos fueron del 32,6% y el 37,1% en los grupos tratados con Eylea 2Q8 y del 8,2% y el 15,6% de los grupos de control.
Neovascularización coroidea miópica
La neovascularización coroidea miópica (NVC miópica) es una causa frecuente de ceguera en adultos con miopía patológica. Se desarrolla como mecanismo de cicatrización subsiguiente a rupturas de la membrana de Bruch y constituye el acontecimiento de la miopía patológica que más pone en riesgo la visión.
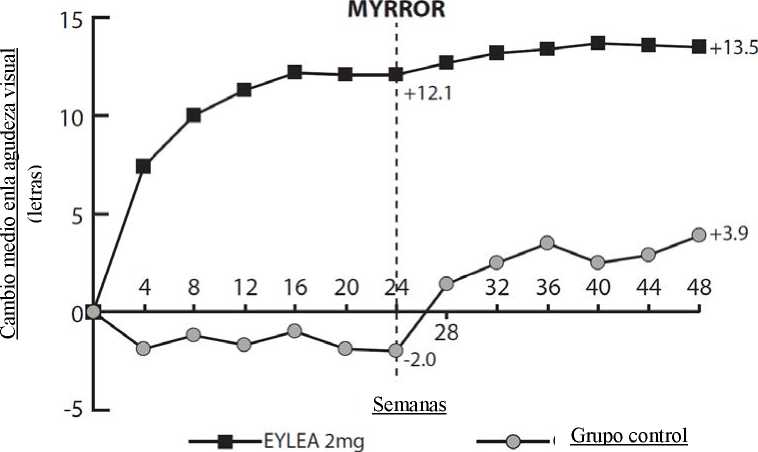
En los pacientes tratados con Eylea en el ensayo MYRROR (una inyección administrada al inicio del tratamiento e inyecciones adicionales administradas en caso de persistencia o recurrencia de la enfermedad), el GCR se redujo poco después de iniciar el tratamiento, favoreciendo a Eylea en la semana 24 (-79 micras y -4 micras para el grupo de tratamiento con Eylea 2 mg y el grupo control, respectivamente), manteniéndose desde el inicio hasta la semana 48. Adicionalmente, se redujo el tamaño medio de la lesión de NVC.
Eficacia clínica y seguridad
DMAE exudativa
La seguridad y la eficacia de Eylea se evaluaron en dos ensayos multicéntricos, aleatorizados, doble ciego y controlados con comparador activo en pacientes con DMAE exudativa (VIEW1 y VIEW2) con un total de 2.412 pacientes tratados y evaluables para la eficacia (1.817 con Eylea). La edad de los pacientes estuvo comprendida entre 49 y 99 años, con una media de 76 años. En estos ensayos clínicos, aproximadamente el 89 % (1.616/1.817) de los pacientes randomizados al tratamiento con Eylea tenían 65 años de edad o más y aproximadamente el 63% (1.139/1.817) tenían 75 años o más.
En cada ensayo, los pacientes se asignaron aleatoriamente en una proporción de 1:1:1:1 a 1 de las 4 pautas siguientes de administración:
1) Eylea administrado a la dosis de 2 mg cada 8 semanas tras recibir 3 dosis mensuales (1 dosis cada mes) iniciales (Eylea 2Q8);
2) Eylea administrado a la dosis de 2 mg cada 4 semanas (Eylea 2Q4);
3) Eylea administrado a la dosis de 0,5 mg cada 4 semanas (Eylea 0,5Q4); y
4) ranibizumab administrado a dosis de 0,5 mg cada 4 semanas (ranibizumab 0,5Q4).
En el segundo año de los ensayos, los pacientes continuaron recibiendo la dosis inicialmente asignada, pero con una pauta de dosificación modificada basada en la evaluación de los resultados visuales y anatómicos, con un intervalo de dosificación máximo de 12 semanas definido en el protocolo.
En ambos ensayos, el criterio principal de valoración de la eficacia fue la proporción de pacientes del conjunto por protocolo que mantuvieron la visión, es decir, la pérdida de menos de 15 letras de agudeza visual en la semana 52 desde el valor basal.
En la semana 52 del estudio VIEW1, el 95,1% de los pacientes del grupo con Eylea 2Q8 conservaba la visión frente a un 94,4% de los pacientes del grupo tratado con ranibizumab 0,5Q4.
En la semana 52 del estudio VIEW2, el 95,6% de los pacientes del grupo con Eylea 2Q8 conservaba la visión frente a un 94,4% de los pacientes del grupo tratado con ranibizumab 0,5Q4. En ambos estudios, se constató que el tratamiento con Eylea era no inferior y clínicamente equivalente al del grupo tratado con ranibizumab 0,5Q4.
En la tabla 2 y la figura 1 siguientes se muestran los resultados detallados del análisis combinado de ambos ensayos.
|
Resultado de eficacia |
(Eylea 2 mg cada 8 semanas tras 3 dosis iniciales mensuales) (N = 607) |
Ranibizumab 0,5Q4 (ranibizumab 0,5 mg cada 4 semanas) (N = 595) | ||
|
Semana 52 |
Semana 96 |
Semana 52 |
Semana 96 | |
|
Número medio de inyecciones desde el inicio de los estudios |
7,6 |
11,2 |
12,3 |
16,5 |
|
Número medio de inyecciones desde la Semana 52 a la 96 |
4,2 |
4,7 | ||
|
Porcentaje de pacientes con < 15 letras de pérdida desde el valor basal (CPPA)) |
95,33%B) |
92,42% |
94,42%B) |
91,60% |
|
DiferenciaC) (IC del 95%)D) |
0,9% (-1,7; 3,5)6 |
0,8% (-2,3; 3,8)6 | ||
|
Cambio medio en la MAVC medida mediante la puntuación de letras del ETDRSa) desde el inicio de los estudios |
8,40 |
7,62 |
8,74 |
7,89 |
|
Diferencia en el cambio medio de MCA) (letras del ETDRS)C) (IC del 95%)D) |
-0,32 (-1,87; 1,23) |
-0,25 (-1,98; 1,49) | ||
|
Porcentaje de pacientes con >15 letras de ganancia de visión con respecto al inicio de los estudios |
30,97% |
33,44% |
32,44% |
31,60% |
|
DiferenciaC) (IC del 95%)D) |
-1,5% (-6,8; 3,8) |
1,8% (-3,5; 7,1) | ||
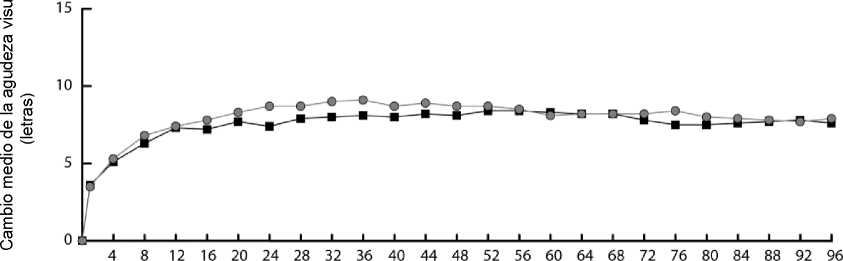
Figura 1. Cambio medio de la agudeza visual desde el inicio hasta la semana 96 para los datos combinados de los estudios VIEW1 y VIEW2
Semanas
* EYLEA 2 mg Q8 ..... ........ Ranibizumab 0,5 mg Q4
semanas semanas
En el análisis de datos combinados de VIEW1 y VIEW2, Eylea demostró cambios clínicamente significativos con respecto al valor basal en el criterio secundario preespecificado de valoración de la eficacia correspondiente al NEI VFQ-25 (National Eye Institute Visual Function Questionnaire: cuestionario de función visual del Instituto Oftalmológico Nacional), sin diferencias clínicamente relevantes respecto a ranibizumab. La magnitud de estos cambios fue similar a la observada en los estudios publicados, lo que corresponde a una ganancia de 15 letras en la agudeza visual mejor corregida (AVMC).
En el segundo año de los ensayos, generalmente se mantuvo la eficacia hasta la última evaluación en la semana 96 y un 2-4% de los pacientes necesitaron todas las inyecciones con una periodicidad mensual y una tercera parte de los paciente necesitaron como mínimo una inyección con intervalo de tratamiento mensual.
En todos los grupos tratados en ambos ensayos se produjeron reducciones evidentes en el área media de NVC.
Los resultados de eficacia en todos los subgrupos evaluables (p. ej., edad, sexo, raza, agudeza visual basal, tipo de lesión, tamaño de la lesión) de cada ensayo y en el análisis combinado fueron concordantes con los resultados de las poblaciones globales.
Edema macular secundario a OVCR
Se evaluó la seguridad y eficacia de Eylea en dos estudios aleatorizados, multicéntricos, doble ciego, controlados con tratamiento simulado en pacientes con edema macular secundario a OVCR (COPERNICUS y GALILEO) con un total de 358 pacientes tratados y evaluables en cuanto a eficacia (217 con Eylea). La edad de los pacientes estuvo comprendida entre 22 y 89 años, con una media de 64 años. En los ensayos de OVCR, aproximadamente el 52% (112/217) de los pacientes asignados a tratamiento con Eylea tenían 65 años o más y aproximadamente el 18% (38/217) tenían 75 años o más. En ambos estudios, los pacientes fueron asignados al azar en una relación de 3:2, o bien a Eylea 2 mg administrado cada 4 semanas (2Q4) o al grupo control que recibió inyecciones simuladas, cada 4 semanas hasta un un total de 6 inyecciones.
Después de 6 inyecciones mensuales consecutivas, los pacientes recibieron tratamiento sólo si cumplían con los criterios pre-definidos de retratamiento, excepto para los pacientes en el grupo de control en el estudio GALILEO que continuaron recibiendo tratamiento simulado (de control a control) hasta la semana 52. A partir de este momento, se trataron a todos los pacientes que cumplían criterios predefinidos.
En ambos estudios, la variable principal de eficacia fue el porcentaje de pacientes que ganaron al menos 15 letras en MAVC en la semana 24, en comparación con el valor basal. Una variable secundaria de eficacia fue el cambio en la agudeza visual en la semana 24, comparado con el valor basal.
La diferencia entre los grupos de tratamiento fue favorable a Eylea en ambos estudios, de forma estadísticamente significativa. La mejoría máxima de la agudeza visual se obtuvo a los 3 meses con la posterior estabilización de la agudeza visual y el GCR hasta los 6 meses. La diferencia estadísticamente significativa se mantuvo hasta la semana 52.
En la tabla 3 y figura 2 siguientes se muestran los resultados detallados de los análisis de ambos estudios.
|
Resultados de eficacia |
COPERNICUS |
GALILEO | ||||||||||
|
24 Semanas |
52 Semanas |
100 Semanas |
24 Semanas |
52 Semanas |
76 Semanas | |||||||
|
Eylea |
Control |
Eylea |
ControlE) |
Eylea F) |
Control E,F) |
Eylea |
Control |
Eylea |
Control |
Eylea G) |
Control G) | |
|
2 mg Q4 (N=114) |
(N=73) |
2 mg (N=114) |
(N=73) |
2 mg (N=114) |
(N=73) |
2 mg Q4 (N=103) |
(N=68) |
2 mg (N=103) |
(N=68) |
2 mg (N=103) |
(N=68) | |
|
Porcentaje de pacientes con una ganancia de >15 letras frente al inicio de los estudios |
56% |
12% |
55% |
30% |
49,1% |
23,3% |
60% |
22% |
60% |
32% |
57,3% |
29,4% |
|
Diferencia ponderadaA,B,E) (95% IC) |
44,8% (33,0; 56,6) |
25,9% (11,8; 40,1) |
26,7% (13,1; 40,3) |
38,3% (24,4; 52,1) |
27,9% (13,0; 42,7) |
28,0% (13,3; 42,6) | ||||||
|
Valor-p |
p < 0,0001 |
p = 0,0006 |
p=0,0003 |
p < 0,0001 |
p = 0,0004 |
p=0,0004 | ||||||
|
Cambio medio en la MAVCC) medida mediante la puntuación |
17,3 |
-4,0 |
16,2 |
3,8 |
13,0 |
1,5 |
18,0 |
3,3 |
16,9 |
3,8 |
13,7 |
6,2 |
|
de letras del ETDRSC) desde el inicio de los estudios (DE) |
(12,8) |
(18,0) |
(17,4) |
(17,1) |
(17,7) |
(17,7) |
(12,2) |
(14,1) |
(14,8) |
(18,1) |
(17,8) |
(17,7) |
|
Diferencia del cambio medio de MCAC,D,E) (95% IC) |
21,7 (17,4; 26,0) |
12,7 (7,7; 17,7) |
11,8 (6,7; 17,0) |
14,7 (10,8; 18,7) |
13,2 (8,2; 18,2) |
7,6 (2,1; 13,1) | ||||||
|
Valor-p |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p=0,0070 | ||||||
A) La diferencia es Eylea 2 mg Q4 semanas menos control.
B) La diferencia y el intervalo de confianza (IC) se calculan con el test Cochran-Mantel-Haenszel (CMH) ajustado a cada región (America vs. otros países para COPERNICUS y Europa vs. Asia/Pacífico para GALILEO) y la categoría del valor basal de la MAVC (> 20/200 y < 20/200).
C) MAVC: Mejor Agudeza Visual Corregida.
ETDRS: Early Treatment Diabetic Retinopathy Study (Estudio sobre el tratamiento precoz de la retinopatía diabética).
TUOD: traslación de la última observación disponible.
DE: Desviación estándar.
MC: media de los mínimos cuadrados derivados del análisis de la covarianza (ANCOVA).
D) Diferencia en el cambio medio de MC e intervalo de confianza en base a un modelo ANCOVA con los factores grupo de tratamiento, región (America vs. otros países para COPERNICUS y Europa vs. Asia/Pacifico para GALILEO) y la categoría del valor basal de la MAVC (> 20/200 y < 20/200).
E) En el estudio COPERNICUS, los pacientes del grupo control podían recibir Eylea según necesidad, cada 4 semanas desde la semana 24 hasta la semana 52; los pacientes tenían
visitas cada 4 semanas.
F) En el estudio COPERNICUS, los pacientes del grupo control y de Eylea recibieron Eylea 2 mg según necesidad, cada 4 semanas desde la semana 52 hasta la semana 96; los pacientes tenían visitas trimestrales obligatorias, pero si era necesario podían acudir a la consulta con una frecuencia de hasta cada 4 semanas.
G) En el estudio GALILEO, los pacientes del grupo control y de Eylea 2 mg recibieron Eylea 2 mg según necesidad cada 8 semanas desde la semana 52 hasta la semana 68; los pacientes tenían visitas obligatorias cada 8 semanas.
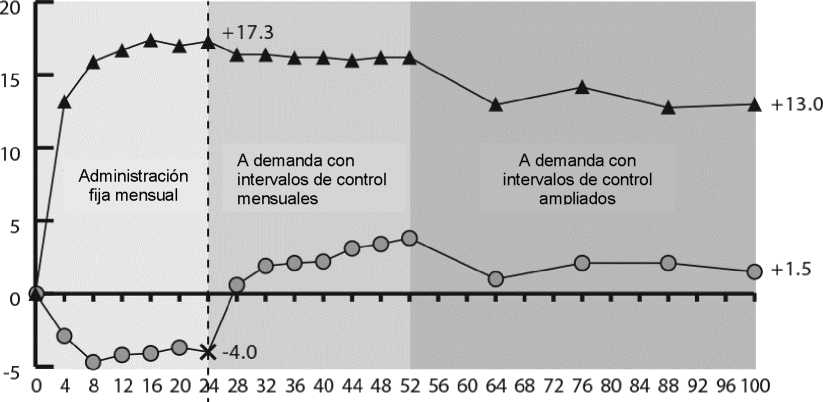
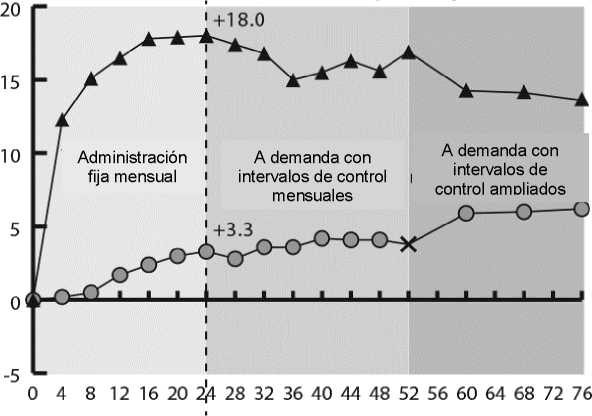
Figura 2:
Cambio medio de la agudeza visual Cambio medio de la agudeza visual
(letras) (letras)
Cambio medio de la agudeza visual desde el inicio hasta la semana 76/100 por grupo de tratamiento para los ensayos COPERNICUS y GALILEO (conjunto de análisis completo)
COPERNICUS
Semanas
GALILEO
Semanas
-A- I VI i A rn<j -O- Grupo de control
X Indica el cambio del grupo de control al tratamiento a demanda con EYLEA 2 mg.
En GALILEO, el 86,4% (n=89) del grupo Eylea y el 79,4% (n=54) del grupo de tratamiento simulado tenían OVCR con perfusión en el momento basal. En la semana 24, este porcentaje fue del 91,8% (n=89) en el grupo Eylea y el 85,5% (n=47) en el grupo de tratamiento simulado. Se mantuvieron estas proporciones en la semana 76, con el 84,3% (n=75) en el grupo Eylea y el 84,0% (n=42) en el grupo de tratamiento simulado.
En COPERNICUS, el 67,5% (n = 77) del grupo Eylea y el 68,5% (n = 50) del grupo de tratamiento simulado tenían OVCR con perfusión en el momento basal. En la semana 24, este porcentaje fue del 87,4% (n = 90) en el grupo Eylea y el 58,6% (n = 34) en el grupo de tratamiento simulado. Se mantuvieron estas proporciones en la semana 100 con el 76,8 % (n = 76) en el grupo Eylea y el 78% (n = 39) en el grupo con terapia simulada. Los pacientes del grupo de tratamiento simulado fueron considerados idóneos para recibir Eylea a partir de la semana 24.
El efecto beneficioso del tratamiento con Eylea sobre la función visual fue similar en los subgrupos de pacientes perfundidos y no perfundidos al inicio del estudio. Los efectos del tratamiento en otros subgrupos evaluables (por ejemplo, edad, sexo, raza, agudeza visual basal, duración de la OVCR) en cada estudio fueron en general coherentes con los resultados en las poblaciones generales.
En el análisis de los datos combinados de GALILEO y COPERNICUS, Eylea demostró cambios clínicamente significativos desde el inicio en la variable secundaria predefinida de eficacia, según el Cuestionario de Función Visual del National Eye Institute (NEI VFQ-25). La magnitud de estos cambios fue similar a la observada en los estudios publicados, lo que correspondía a un aumento de 15 letras en la mejor agudeza visual corregida (MAVC).
Edema macular secundario a ORVR
Se evaluó la seguridad y eficacia de Eylea en un estudio aleatorizado, multicéntrico, doble ciego y controlado con tratamiento activo en pacientes con edema macular secundario a ORVR (VIBRANT), que incluye oclusión venosa hemirretiniana. Un total de 181 pacientes fueron tratados y evaluables en cuanto a eficacia (91 con Eylea). La edad de los pacientes estuvo comprendida entre 42 y 94 años, con una media de 65 años. En el estudio ORVR, aproximadamente el 58% (53/91) de los pacientes asignados al tratamiento con Eylea tenían 65 años de edad o más y aproximadamente el 23% (21/91) tenían 75 años o más. En este estudio, los pacientes fueron aleatorizados en una relación 1:1, o bien a Eylea 2 mg, administrado cada 8 semanas después de 6 inyecciones mensuales iniciales, o bien a fotocoagulación con láser administrada en el periodo basal (grupo de control con láser). Los pacientes en el grupo de control con láser podían recibir fotocoagulación con láser adicional (denominada “tratamiento de rescate con láser”) comenzando en la semana 12, con un intervalo mínimo de 12 semanas. En base a criterios previamente establecidos, los pacientes en el grupo con láser podían recibir tratamiento de rescate con Eylea 2 mg a partir de la semana 24, administrado cada 4 semanas durante 3 meses, y a continuación cada 8 semanas.
En el estudio VIBRANT, la variable principal de eficacia fue el porcentaje de pacientes que ganaron al menos 15 letras en la MAVC en la semana 24, en comparación con el valor basal, y el grupo tratado con Eylea fue superior al grupo de control con láser.
Un criterio secundario de eficacia fue el cambio en la agudeza visual en la semana 24, comparado con el valor basal, que fue estadísticamente significativo favorable a Eylea en el estudio VIBRANT. La evolución de la mejoría visual fue rápida y se alcanzó el pico a los 3 meses, con un mantenimiento del efecto hasta el 12° mes.
En el grupo tratado con láser, 67 pacientes recibieron tratamiento de rescate con Eylea a partir de la semana 24 (grupo controlado con tratamiento activo/grupo de Eylea 2 mg), lo que dio lugar a una mejora de la agudeza visual en aproximadamente 5 letras de las semana 24 a la 52.
En la tabla 4 y la figura 3 siguientes se muestran los resultados detallados del análisis del estudio VIBRANT.
Tabla 4: Resultados de eficacia en las semanas 24 y 52 (Conjunto de análisis completo con TUOD) en el estudio VIBRANT
|
Resultados de eficacia |
VIBRANT | |||
|
24 Semanas |
52 Semanas | |||
|
Eylea 2 mg Q4 (N = 91) |
Control con tratamiento activo (láser) (N = 90) |
Eylea 2 mg Q8 (N = 91) |
Control con tratamiento activo (láser)/Eylea 2 mgE) (N = 90) | |
|
Porcentaje de pacientes con una mejoría de >15 letras con respecto al valor basal (%) |
52,7 % |
26,7 % |
57,1 % |
41,1 % |
|
Diferencia ponderadaA,B) (%) IC del 95 %) Valor-p |
26,6 % (13,0; 40,1) p = 0,0003 |
16,2 % (2,0; 30,5) p = 0,0296 | ||
|
Cambio medio en la MAVC medida mediante la puntuación de letras del ETDRS con respecto al valor basal (DE) |
17,0 (11,9) |
6,9 (12,9) |
17,1 (13,1) |
12,2 (11,9) |
|
Diferencia del cambio medio de MCAC) (IC del 95 %) Valor-p |
10,5 (7,1; 14,0) p < 0,0001 |
5,2 (1,7; 8,7) p = 0,0035F) | ||
A) La diferencia es Eylea 2 mg Q4 semanas menos control con láser.
B) La diferencia y el IC del 95 % se calculan con la prueba de Cochran-Mantel-Haenszel ajustado a cada región (Norteamérica frente a Japón) y el valor basal de la MAVC (> 20/200 y < 20/200).
C) Diferencia en la media de MC e IC del 95% basados en un modelo ANCOVA con los factores grupo de tratamiento, la categoría del valor basal de la MAVC (> 20/200 y < 20/200) y la región (Norteamérica frente a Japón) como efectos fijos y el valor basal de la MAVC como covariable.
D) A partir de la semana 24, se amplió el intervalo de tratamiento del grupo de tratamiento con Eylea de 4 semanas a 8 semanas hasta la semana 48.
E) A partir de la semana 24, los pacientes en el grupo de láser podían recibir tratamiento de rescate con Eylea, si cumplían al menos uno de los criterios de elegibilidad predefinidos. Un total de 67 pacientes recibieron tratamiento de rescate con Eylea. La pauta posológica fija fue de Eylea 2 mg tres veces cada 4 semanas, seguido de inyecciones cada 8 semanas.
F) Valor nominal de p.
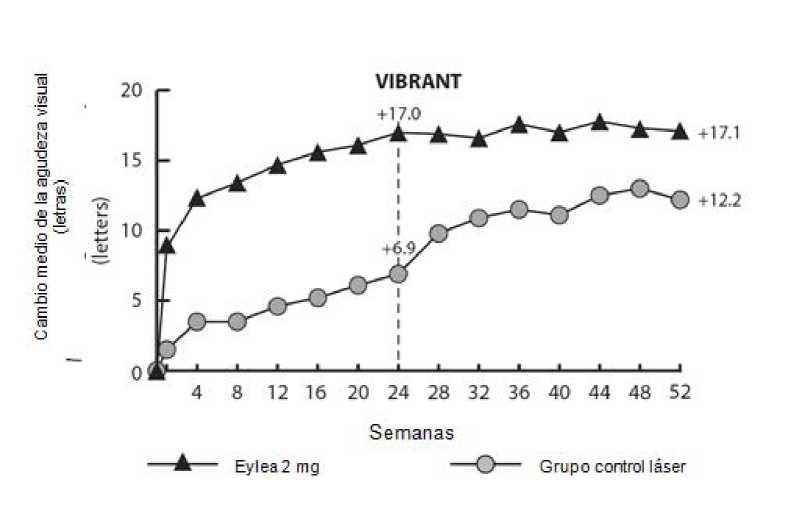
Al inicio, el porcentaje de pacientes perfundidos en los grupos de Eylea y de láser fue del 60% y 68%, respectivamente. En la semana 24 estos porcentajes eran del 80% y 67%, respectivamente. En el grupo de Eylea, el porcentaje de pacientes perfundidos se mantuvo hasta la semana 52. En el grupo tratado con láser, en el que los pacientes fueron aptos para el tratamiento de rescate con Eylea a partir de la semana 24, el porcentaje de pacientes perfundidos aumentó al 78% en la semana 52.
Edema macular diabético
La seguridad y la eficacia de Eylea se evaluaron en dos ensayos multicéntricos, aleatorizados, doble ciego y controlados con comparador activo en pacientes con EMD (VIVIDDME y VISTADME). Un total de 862 pacientes fueron tratados y evaluables en cuanto a eficacia, 576 con Eylea. La edad de los pacientes estuvo comprendida entre 23 y 87 años, con una media de 63 años. En los ensayos en EMD, aproximadamente el 47% (268/576) de los pacientes aleatorizados al tratamiento con Eylea tenían 65 años de edad o más y aproximadamente el 9% (52/576) tenían 75 años o más. La mayoría de los pacientes en ambos ensayos tenían diabetes tipo II. En ambos ensayos, los pacientes se asignaron aleatoriamente en una proporción de 1:1:1 a 1 de las 3 pautas siguientes de administración:
1) Eylea administrado a la dosis de 2 mg cada 8 semanas tras recibir 5 inyecciones mensuales iniciales (Eylea 2Q8);
2) Eylea administrado a la dosis de 2 mg cada 4 semanas (Eylea 2Q4); y
3) fotocoagulación macular con láser (control activo).
A partir de la semana 24, los pacientes que cumplían un umbral predefinido de pérdida de visión eran considerados idóneos para recibir tratamiento adicional: los pacientes de los grupos de Eylea podían recibir láser y los pacientes del grupo de control podían recibir Eylea.
En ambos ensayos, el criterio principal de valoración de la eficacia fue el cambio medio en la MAVC de la semana 52 y tanto el grupo de Eylea 2Q8 como el de Eylea 2Q4 demostraron significación estadística y fueron superioresal grupo de control. Este beneficio se mantuvo hasta la semana 100.
Los resultados detallados del análisis de los ensayos VIVIDDME y VISTADME se muestran en la tabla 5 y en la figura 4 siguientes.
|
Resultados de eficacia |
VIVIDDME |
VISTADME | ||||||||||
|
52 semanas |
100 semanas |
52 semanas |
100 semanas | |||||||||
|
Eylea |
Eylea |
Control activo |
Eylea |
Eylea |
Control activo |
Eylea |
Eylea |
Control activo |
Eylea |
Eylea |
Control activo | |
|
2 mg Q8 A |
2 mg Q4 |
(láser) |
2 mg Q8 A |
2 mg Q4 |
(láser) |
2 mg Q8 A |
2 mg Q4 |
(láser) |
2 mg Q8 A |
2 mg Q4 |
(láser) | |
|
(N = 135) |
(N = 136) |
(N = 132) |
(N = 135) |
(N = 136) |
(N = 132) |
(N = 151) |
(N = 154) |
(N = 154) |
(N=151) |
(N=154) |
(N=154) | |
|
Cambio medio en la MAVC medida mediante la puntuación de letras del ETDRSE respecto al valor basal |
10,7 |
10,5 |
1,2 |
9,4 |
11,4 |
0,7 |
10,7 |
12,5 |
0,2 |
11,1 |
11,5 |
0,9 |
|
Diferencia en la media de MCB-C-E (IC del 97,5%) |
9,1 (6,4; 11,8) |
9,3 (6,5; 12,0) |
8,2 (5,2; 11,3) |
10,7 (7,6; 13,8) |
10,45 (7,7; 13,2) |
12,19 (9,4; 15,0) |
10,1 (7,0; 13,3) |
10,6 (7,1; 14,2) | ||||
|
Porcentaje de pacientes con ganancia de >15 letras respecto al valor basal |
33% |
32% |
9% |
31,1% |
38,2% |
12,1% |
31% |
42% |
8% |
33,1% |
38,3% |
13,0% |
|
Diferencia ajustada D,C,E (IC del 97,5%) |
24% (13,5; 34,9) |
23% (12,6; 33,9) |
19,0% (8,0; 29,9) |
26,1% (14,8; 37,5) |
23% (13,5; 33,1) |
34% (24,1; 44,4) |
20,1% (9,6; 30,6) |
25,8% (15,1; 36,6) | ||||
A Después del inicio del tratamiento con 5 inyecciones mensuales.
B Media de MC e IC en base a un modelo ANCOVA con una medición de MAVC basal como covarianza y un grupo de tratamiento por factor. Además, la región (Europa/Australia frente a Japón) se ha incluido como factor para VIVIDDME, y los antecedentes de IM o AVC como factor para VISTADME.
C La diferencia es el grupo de Eylea menos el grupo de control activo (láser).
D La diferencia con el intervalo de confianza (IC) y la prueba estadística se calculan con el esquema de ponderación de Mantel-Haenszel ajustado a cada región (Europa/Australia frente a Japón) para VIVIDDME y los antecedentes médicos de IM o AVC para VISTADME.
E MAVC: Mejor Agudeza Visual Corregida.
ETDRS: Early Treatment Diabetic Retinopathy Study (Estudio sobre el tratamiento precoz de la retinopatía diabética).
TUOD: Traslación de la última observación disponible.
MC: Media de los mínimos cuadrados derivada de ANCOVA. IC: Intervalo de confianza.
12 20 28 36 44 52 60 68 76 84 92 100
Semanas
EYLEA 2mg Q8 semanas
EYLEA 2mg Q4 semanas Control activo (laser)
Los efectos del tratamiento en los subgrupos evaluables (es decir, edad, sexo, raza, HbA1c basal, agudeza visual basal, terapia anterior con anti-VEGF) en cada ensayo y en el análisis combinado fueron por lo general acordes con los resultados en las poblaciones generales.
En los ensayos VIVIDDME y VISTADME, 36 (9%) y 197 (43%) pacientes recibieron terapia anterior con anti-VEGF, respectivamente, con un período de lavado de 3 meses o más. Los efectos del tratamiento en los subgrupos de pacientes que habían sido tratados previamente con un inhibidor del VEGF fueron similares a los observados en pacientes sin tratamiento previo con inhibidores del VEGF.
Los pacientes con enfermedad bilateral se consideraron idóneos para recibir tratamiento con anti-VEGF en el otro ojo si el médico lo consideraba necesario. En el ensayo VISTADME, 217 (70,7%) de los pacientes tratados con Eylea recibieron inyecciones bilaterales de Eylea hasta la semana 100; en el ensayo VIVIDDME, 97 (35,8%) de los pacientes tratados con Eylea recibieron tratamiento con un anti-VEGF diferente en el otro ojo.
Un ensayo comparativo independiente (DRCR.net Protocol T) utilizó una pauta posológica basada en criterios estrictos de retratamiento según OCT y visión. En el grupo de tratamiento con aflibercept (n = 224) en la semana 52, esta pauta de tratamiento dio lugar a pacientes que recibían una media de 9,2 inyecciones, similar al número de dosis administradas en el grupo de Eylea 2Q8 en VIVIDDME y VISTADME, mientras que la eficacia global en el grupo de tratamiento con aflibercept en el Protocol T fue comparable al grupo de Eylea 2Q8 en VIVIDDME y VISTADME En el Protocol T se observó una ganancia media de 13,3 letras, con el 42% de pacientes que ganaron al menos 15 letras de visión desde el valor basal. Los perfiles de seguridad ocular y sistémica (incluidos los ATA) fueron similares a VIVIDDME y VISTADME.
Neovascularización coroidea miópica
La seguridad y la eficacia de Eylea se evaluaron en un ensayo aleatorizado, multicéntrico, doble ciego, controlado con tratamiento simulado en pacientes asiáticos con NVC miópica que nunca habían recibido tratamiento. En total se trataron y evaluaron en cuanto a la eficacia 121 pacientes (90 con Eylea). La edad de los pacientes estuvo comprendida entre 27 y 83 años, con una media de 58 años. En el estudio de NVC miópica, aproximadamente el 36% (33/91) de los pacientes aleatorizados al tratamiento con Eylea tenían 65 años o más y aproximadamente el 10% (9/91) tenían 75 años o más.
Los pacientes fueron asignados aleatoriamente en una proporción 3:1 para recibir o bien 2 mg de Eylea en inyección intravítrea o inyección simulada, administrada una vez al inicio del ensayo, e inyecciones adicionales administradas mensualmente, en el caso de persistencia o recurrencia de la enfermedad, hasta la semana 24, momento en el que se evaluó el criterio principal de valoración. En la semana 24, los pacientes inicialmente asignados de forma aleatoria al grupo de tratamiento simulado, podían recibir la primera dosis de Eylea. Después, los pacientes de ambos grupos podían seguir recibiendo inyecciones adicionales en caso de persistencia o recurrencia de la enfermedad.
La diferencia entre los grupos de tratamiento fue estadísticamente significativa y favorable a Eylea para el criterio principal de valoración (cambio en la MAVC) y el segundo criterio de valoración confirmatorio (proporción de pacientes que ganaron 15 letras de visión en la MAVC) en la semana 24 con respecto al momento inicial. Las diferencias en ambos criterios de valoración se mantuvieron hasta la semana 48.
Los resultados detallados del análisis del ensayo MYRROR se muestran en la tabla 6 y la figura 5 siguientes.
Tabla 6:
|
Resultados de eficacia |
MYRROR | |||
|
24 semanas |
48 semanas | |||
|
Eylea 2mg (N = 90) |
Simulado (N = 31) |
Eylea 2mg (N = 90) |
Simulado/ Eylea 2mgD) (N = 31) | |
|
Cambio medio en la MAVCB) medida mediante la puntuación de letras del ETDRS respecto al valor basal (SD) B) |
12,1 (8,3) |
-2,0 (9,7) |
13,5 (8,8) |
3,9 (14,3) |
|
Diferencia en la media de MCC,D,E) (IC del 95%) |
14,1 (10,8; 17,4) |
9,5 (5,4; 13.7) | ||
|
Porcentaje de pacientes con una ganancia de >15 letras respecto al valor basal |
38,9% |
9,7% |
50,0% |
29,0% |
|
Diferencia ponderada D,F) (IC del 95%) |
29,2% (14,4; 44,0) |
21,0% (1,9; 40,1) | ||
A) TUOD: Traslación de la última observación disponible.
B) MAVC: Mejor Agudeza Visual Corregida
ETDRS: Early Treatment Diabetic Retinopathy Study (Estudio sobre el tratamiento precoz de la retinopatía diabética)
SD: desviación estándar
C) Media MC: medias de mínimos cuadrados obtenidas del modelo ANCOVA
D) IC: Intervalo de confianza
E) Diferencia en la media de MC e IC del 95% basada en un modelo ANCOVA con el grupo de tratamiento y el país (designaciones de país) como efectos fijos, y MAVC como covariable
F) La diferencia y el IC del 95% se calculan utilizando la prueba Cochran-Mantel-Haenszel (CMH) ajustada para el país (designaciones de país)
Figura 5: Cambio medio desde el inicio hasta la semana 48 en la agudeza visual por grupo de
tratamiento en el ensayo MYRROR (conjunto de análisis completo, TUOD)
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Eylea en los diferentes grupos de la población pediátrica en la DMAE exudativa,
OVCR, ORVR, EMD y poblaciones de NVC miópica (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Eylea se administra directamente en el vítreo para ejercer efectos locales en el ojo.
Absorción / Distribución
Tras su administración intravítrea, aflibercept se absorbe lentamente desde el ojo a la circulación sistémica, en la que generalmente se observa formando un complejo estable e inactivo con el VEGF; sin embargo, solamente el “aflibercept libre” es capaz de unirse al VEGF endógeno.
En un sub-estudio farmacocinético realizado en 6 pacientes con DMAE neovascular exudativa con toma de muestras frecuente, las concentraciones plasmáticas máximas de aflibercept libre (Cmax sistémica) fueron bajas, con una media de aproximadamente 0,02 microgramos/ml (intervalo de 0 a 0,054) en el plazo de 1 a 3 días tras la inyección intravítrea de 2 mg, y fueron indetectables dos semanas después de la administración en casi todos los pacientes. Aflibercept no se acumula en el plasma cuando se administra por vía intravítrea cada 4 semanas.
La concentración plasmática máxima media de aflibercept libre es aproximadamente de 50 a 500 veces menor que la concentración de aflibercept necesaria para inhibir la actividad biológica del VEGF sistémico en un 50% en los modelos animales, en los que se observaron cambios en la presión arterial cuando se alcanzaron niveles de aflibercept libre circulantes de alrededor de 10 microgramos/ml, que regresaron a los valores basales cuando los niveles cayeron por debajo de aproximadamente 1 microgramo/ml. En un estudio con voluntarios sanos se estimó que tras la administración intravítrea de 2 mg a los pacientes, la concentración plasmática máxima media de aflibercept libre es más de 100 veces inferior que la concentración de aflibercept necesaria para unirse al VEGF sistémico en niveles equivalentes a la mitad de los máximos (2,91 microgramos/ml). Por lo tanto, son improbables los efectos farmacodinámicos sistémicos, como por ejemplo cambios en la presión arterial.
En sub-estudios de farmacocinética en pacientes con OVCR, ORVR, EMD o NVC miópica, los valores de Cmax media de aflibercept libre en plasma fueron similares en el intervalo de 0,03 a 0,05 microgramos/ml y los valores individuales no fueron superiores a 0,14 microgramos/ml. Posteriormente, las concentraciones plasmáticas de aflibercept libre se redujeron a valores inferiores o cercanos al límite inferior de cuantificación, generalmente en una semana; antes de la siguiente administración, después de 4 semanas, las concentraciones fueron indetectables en todos los pacientes.
Eliminación
Dado que Eylea es un agente terapéutico de tipo proteico, no se han realizado estudios de su metabolismo.
Aflibercept libre se une al VEGF formando un complejo estable e inerte. Como ocurre con otras proteínas de gran tamaño, es de esperar que tanto el aflibercept libre como el fijado se eliminen mediante catabolismo proteolítico.
Insuficiencia renal
No se han realizado estudios especiales con Eylea en pacientes con insuficiencia renal.
El análisis farmacocinético de los pacientes del ensayo VIEW2, de los cuales el 40% presentaba insuficiencia renal (24% leve, 15% moderada y 1% grave), no reveló diferencias con respecto a las concentraciones plasmáticas del medicamento activo tras la administración intravítrea cada 4 u 8 semanas.
Se observaron resultados similares en pacientes con OVCR en el estudio GALILEO, en pacientes con EMD en el ensayo VIVIDDME, y en pacientes con NVC miópica en el ensayo MYRROR.
5.3 Datos preclínicos sobre seguridad
En los estudios no clínicos de toxicidad a dosis repetidas solamente se observaron efectos con exposiciones sistémicas consideradas notablemente superiores a la exposición humana máxima tras la administración intravítrea de la dosis clínica prevista, lo que indica su escasa relevancia con respecto al uso clínico.
Se observaron erosiones y ulceraciones en el epitelio respiratorio de los cornetes nasales en los monos tratados con aflibercept por vía intravítrea con exposiciones sistémicas superiores a la exposición humana máxima. Los valores de exposición sistémica para la Cmax y el AUC del aflibercept libre fueron unas 200 y 700 veces mayores, respectivamente, que los valores correspondientes observados en humanos tras una dosis intravítrea de 2 mg. En el Nivel sin Efecto Adverso Observado (NOAEL) de 0,5 mg/ojo en monos, la exposición sistémica fue 42 y 56 veces superior según los valores de Cmax y AUC, respectivamente.
No se han realizado estudios sobre el potencial mutagénico o carcinogénico de aflibercept.
Se observó un efecto de aflibercept en el desarrollo intrauterino en los estudios de desarrollo embrio-fetal en conejas gestantes con administración intravenosa (3 a 60 mg/kg) así como con administración subcutánea (0,1 a 1 mg/kg). El NOAEL materno fue a la dosis de 3 mg/kg ó 1 mg/kg, respectivamente. No se identificó un NOAEL para el desarrollo. Con la dosis de 0,1 mg/kg, los valores de exposición sistémica para la Cmax y acumulativo de AUC de aflibercept libre fueron unas 17 y 10 veces superiores, respectivamente, que los valores correspondientes observados en humanos tras la administración de una dosis intravítrea de 2 mg.
Los efectos sobre la fertilidad masculina y femenina se evaluaron como parte integral de un estudio de 6 meses de duración en monos, con administración intravenosa de aflibercept en dosis de 3 a 30 mg/kg. En todos los niveles de dosis se observaron menstruaciones ausentes o irregulares asociadas a alteraciones en los niveles de las hormonas reproductivas femeninas y cambios en la morfología y la motilidad del esperma. Los valores de exposición sistémica para la Cmax y el AUC de aflibercept libre observados con la dosis intravenosa de 3 mg/kg fueron, respectivamente, unas 4.900 y 1.500 veces superiores a los valores de exposición observados en humanos tras la administración de una dosis intravítrea de 2 mg. Todos los cambios fueron reversibles.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polisorbato 20
Dihidrógeno fosfato de sodio monohidrato (para ajuste del pH)
Hidrogenofosfato de disodio heptahidrato (para ajuste del pH)
Cloruro de sodio Sacarosa
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez 2 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar la jeringa precargada en su blíster y en el embalaje exterior para protegerla de la luz.
Antes del uso, el blíster sin abrir de Eylea puede conservarse a temperatura ambiente (por debajo de 25°C) durante un máximo de 24 horas. Tras la apertura del blíster, se procederá empleando condiciones asépticas.
6.5 Naturaleza y contenido del envase
90 microlitros de solución en jeringa precargada (vidrio tipo I) marcada con una línea de dosificación negra, con un tapón de émbolo (goma elastomérica) y un adaptador Luer Lock con cápsula de cierre en el extremo (goma elastomérica). Tamaño de envase: 1 jeringa precargada.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La jeringa precargada es para un solo uso.
No abra el blíster de la jeringa precargada estéril fuera de la sala limpia.
Dado que la jeringa precargada contiene más volumen (90 microlitros) que la dosis recomendada (50 microlitros), antes de la administración se desechará una parte del volumen contenido en la jeringa.
Antes de su administración, la solución debe inspeccionarse visualmente para detectar la presencia de partículas y/o cambio de color o cualquier otro cambio del aspecto físico. En caso de observar alguna alteración, no utilizar el medicamento.
Para la inyección intravítrea debe usarse una aguja de inyección de 30 G x pulgada (1,27 cm).
Cuando esté preparado para administrar Eylea, abra la caja y extraiga el blíster esterilizado. Despegue cuidadosamente la lámina del blíster, asegurando la esterilidad de su contenido. Mantenga la jeringa en la bandeja estéril hasta que esté preparado para el ensamblaje. Utilizando una técnica aséptica, extraer la jeringa del blíster esterilizado.
1.
2.
3.
4.
5.
Para retirar la cápsula de cierre de la jeringa, mantener la jeringa con una mano mientras se utiliza la otra para coger la cápsula de cierre entre el índice y el pulgar. Nota importante: debe tirar y desprender la cápsula de cierre (no la gire ni la retuerza).
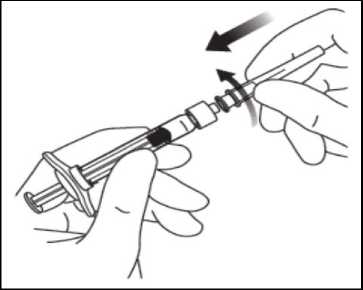
Para no poner en peligro la esterilidad del medicamento, no tirar del émbolo hacia atrás. Utilizando una técnica aséptica, encajar firmemente la aguja de inyección en la punta de la jeringa con el adaptador Luer Lock realizando un movimiento giratorio.
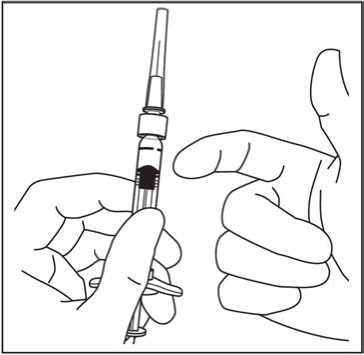
6. Mantener la jeringa con la aguj a apuntando hacia
arriba, comprobar que no hay burbujas en su interior. Si hubiera burbujas, golpear suavemente la jeringa con el dedo hasta que éstas asciendan a su parte superior.
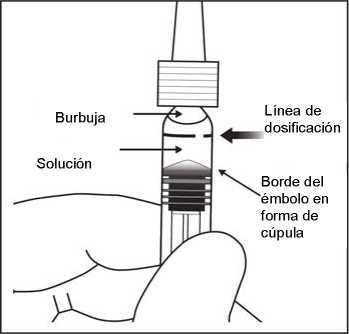
7. Para eliminar todas las burbujas y expulsar el exceso de medicamento, apretar lentamente el
émbolo hasta alinear la base cilíndrica de la parte en forma de cúpula del émbolo con la línea de dosificación negra de la jeringa (equivalente a 50 microlitros).
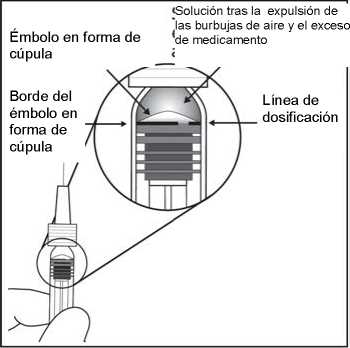
8. La jeringa precargada es para un solo uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Bayer Pharma AG D-13342 Berlin Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/797/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 22 Noviembre 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Eylea 40 mg/ml solución inyectable en vial.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución inyectable contiene 40 mg de aflibercept*.
Cada vial contiene 100 microlitros, equivalentes a 4 mg de aflibercept. Esto proporciona una cantidad utilizable que proporciona una dosis única de 50 microlitros que contiene 2 mg de aflibercept.
* Proteína de fusión que consiste en porciones de los dominios extracelulares de los receptores 1 y 2 del factor de crecimiento endotelial vascular (VEGF) humano fusionados con la porción Fc de la IgG1 humana, y obtenida en células K1 de ovario de hámster chino (CHO) mediante tecnología de DNA recombinante.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
Solución transparente, de incolora a amarillo pálido e isosmótica.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Eylea está indicado en adultos para el tratamiento de:
• la degeneración macular asociada a la edad (DMAE) neovascular (exudativa) (ver sección 5.1).
• la alteración visual debida al edema macular secundario a la oclusión de la vena retiniana (oclusión de la rama venosa retiniana (ORVR) u oclusión de la vena central retiniana (OVCR) (ver sección 5.1).
• la alteración visual debida al edema macular diabético (EMD) (ver sección 5.1).
• la alteración visual debida a la neovascularización coroidea miópica (NVC miópica) (ver sección 5.1).
4.2 Posología y forma de administración
Eylea se administra exclusivamente por inyección intravítrea.
Eylea debe ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas.
Posología
DMAE exudativa
La dosis recomendada de Eylea es 2 mg de aflibercept, equivalente a 50 microlitros.
El tratamiento con Eylea se inicia con una inyección mensual para las tres primeras dosis, seguido de una inyección cada dos meses. No es necesario realizar una monitorización entre inyecciones.
Tras los primeros 12 meses de tratamiento con Eylea, en función de los resultados visuales y/o anatómicos, el intervalo entre tratamientos puede ampliarse, como en una pauta posológica de “tratar y extender”, aumentando gradualmente los intervalos entre tratamientos para mantener unos resultados visuales y/o anatómicos estables, aunque no se dispone de datos suficientes para concretar la duración de estos intervalos. Si se observa un deterioro de los resultados visuales y/o anatómicos, se debe reducir el intervalo entre dosis según corresponda.
Por tanto, el programa de monitorización se determinará según criterio médico y puede ser más frecuente que el programa de administración de las inyecciones.
Edema macular secundario a OVR (OVR de rama o central)
La dosis recomendada de Eylea es 2 mg de aflibercept, equivalente a 50 microlitros.
Después de la inyección inicial, el tratamiento se administra mensualmente. El intervalo entre dos dosis no debe ser inferior a un mes.
Si los parámetros visuales y anatómicos indican que el paciente no se está beneficiando del tratamiento continuado, se debe interrumpir el tratamiento con Eylea.
El tratamiento se administra mensualmente y de forma continuada hasta que se observa una agudeza visual máxima y/o no hay signos de actividad de la enfermedad. Pueden ser necesarias tres o más inyecciones mensuales consecutivas.
El tratamiento se puede entonces continuar con una pauta de “tratar y extender”, aumentando gradualmente los intervalos para mantener unos resultados visuales y/o anatómicos estables, aunque no se dispone de datos suficientes para concretar la duración de estos intervalos. Si se observa un deterioro de los resultados visuales y/o anatómicos, se debe reducir el intervalo entre dosis según corresponda.
El médico responsable debe determinar el programa de monitorización y tratamiento en base a la respuesta individual de cada paciente.
La monitorización de la actividad de la enfermedad puede incluir examen clínico, técnicas de análisis funcional o de imagen (por ejemplo, tomografía de coherencia óptica o angiografía con fluoresceína).
Edema macular diabético
La dosis recomendada de Eylea es 2 mg de aflibercept, equivalente a 50 microlitros.
El tratamiento con Eylea se inicia con una inyección mensual para las cinco primeras dosis consecutivas, seguido de una inyección cada dos meses. No es necesario realizar una monitorización entre inyecciones.
Tras los primeros 12 meses de tratamiento con Eylea, en función de los resultados visuales y/o anatómicos, el intervalo entre tratamientos puede ampliarse, como en una pauta posológica de “tratar y extender”, aumentando gradualmente los intervalos entre tratamientos para mantener unos resultados visuales y/o anatómicos estables, aunque no se dispone de datos suficientes para concretar la duración de estos intervalos. Si se observa un deterioro de los resultados visuales y/o anatómicos, se debe reducir el intervalo entre dosis según corresponda.
Por tanto, el programa de monitorización se determinará según criterio médico y puede ser más frecuente que el programa de administración de las inyecciones.
Si los resultados visuales y anatómicos indican que el paciente no se beneficia del tratamiento continuado, se debe interrumpir el tratamiento con Eylea.
Neovascularización coroidea miópica
La dosis recomendada de Eylea es una única inyección intravítrea de 2 mg de aflibercept equivalente a 50 microlitros.
Se pueden administrar dosis adicionales si los resultados visuales y/o anatómicos indican que la enfermedad persiste. Las recurrencias se deben tratar como una nueva manifestación de la enfermedad.
El programa de monitorización se determinará según criterio médico.
El intervalo entre dos dosis no debe ser inferior a un mes.
Poblaciones especiales
Insuficiencia hepática y/o renal
No se han realizado estudios específicos con Eylea en pacientes con insuficiencia hepática y/o renal.
Los datos disponibles no sugieren que sea necesario ajustar la dosis de Eylea en estos pacientes (ver sección 5.2).
Pacientes de edad avanzada
No se necesitan consideraciones especiales. La experiencia en pacientes mayores de 75 años con EMD es limitada.
Población pediátrica
No se ha establecido la seguridad y eficacia de Eylea en niños ni adolescentes. No existe una recomendación de uso específica para Eylea en las indicaciones de DMAE exudativa, OVCR, ORVR, EMD y NVC miópica en la población pediátrica.
Forma de administración
Las inyecciones intravítreas deben realizarse teniendo en cuenta los estándares médicos y las directrices pertinentes, por un médico cualificado que tenga experiencia en la administración de inyecciones intravítreas. En general, deben asegurarse unas medidas de anestesia y de asepsia adecuadas, que incluyan el uso de un microbicida tópico de amplio espectro (p. ej., povidona yodada aplicada en la piel de la zona periocular, párpado y superficie ocular). Se recomienda el lavado quirúrgico de las manos, uso de guantes estériles, un campo estéril y un blefarostato estéril para los párpados (o equivalente).
La aguja de inyección se debe introducir 3,5 - 4,0 mm por detrás del limbo en la cavidad vitrea, evitando el meridiano horizontal y en dirección al centro del globo. Seguidamente debe liberarse el volumen de inyección de 0,05 ml; las inyecciones siguientes se deben aplicar cada vez en un punto escleral distinto.
Inmediatamente después de la inyección intravítrea, se debe monitorizar a los pacientes a fin de detectar una elevación de la presión intraocular. Una monitorización adecuada puede consistir en la comprobación de la perfusión de la cabeza del nervio óptico o en la realización de una tonometría. En caso necesario, debe estar disponible un equipo de paracentesis estéril.
Tras la inyección intravítrea, se debe instruir a los pacientes sobre la necesidad de notificar inmediatamente cualquier síntoma que sugiera endoftalmitis (p. ej., dolor ocular, enrojecimiento del ojo, fotofobia o visión borrosa).
Cada vial debe usarse exclusivamente para el tratamiento de un solo ojo.
El vial contiene más cantidad que la dosis recomendada de 2 mg de aflibercept. El volumen extraíble del vial (100 microlitros) no se administrará en su totalidad. El exceso de volumen debe eliminarse antes de administrar el medicamento. Si se inyecta todo el volumen del vial puede dar lugar a una sobredosis. Para eliminar las burbujas y el exceso de medicamento, apriete lentamente el émbolo hasta alinear la base cilindrica de la parte en forma de cúpula del émbolo con la línea de dosificación negra de la jeringa (equivalente a 50 microlitros, es decir, 2 mg de aflibercept).
Tras la inyección, debe desecharse todo resto de producto no utilizado.
Para la manipulación del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo aflibercept o a alguno de los excipientes incluidos en la sección 6.1. Infección ocular o periocular activa o sospecha de éstas.
Inflamación intraocular activa grave.
4.4 Advertencias y precauciones especiales de empleo
Reacciones relacionadas con la inyección intravítrea
Las inyecciones intravítreas, incluidas las de Eylea, se han asociado a endoftalmitis, inflamación intraocular, desprendimiento retiniano regmatógeno, desgarro retiniano y catarata traumática iatrogénica (ver sección 4.8). Siempre que se administre Eylea, se deben emplear técnicas de inyección asépticas adecuadas. Además, se deben monitorizar los pacientes durante la semana siguiente a la inyección para, en caso de infección, poder instaurar inmediatamente el tratamiento. Se debe instruir a los pacientes sobre la necesidad de notificar inmediatamente cualquier síntoma que sugiera endoftalmitis o cualquiera de los acontecimientos indicados anteriormente.
Se han observado aumentos de la presión intraocular en los 60 minutos siguientes a la administración de una inyección intravítrea, incluidas las de Eylea (ver sección 4.8). Es necesario tener especial precaución en los pacientes con glaucoma mal controlado (no inyectar Eylea cuando la presión intraocular sea > 30 mmHg). Por consiguiente, en todos los casos, se debe monitorizar y tratar adecuadamente tanto la presión intraocular como la perfusión de la cabeza del nervio óptico.
Inmunogenicidad
Dado que se trata de una proteína terapéutica, hay un potencial de inmunogenicidad con Eylea (ver sección 4.8). Se debe instruir a los pacientes sobre la necesidad de notificar cualquier signo o síntoma de inflamación intraocular, p. ej., dolor, fotofobia o enrojecimiento, ya que puede ser un signo clínico atribuible a hipersensibilidad.
Efectos sistémicos
Se han notificado acontecimientos adversos sistémicos, incluyendo hemorragias no oculares y acontecimientos tromboembólicos arteriales tras la inyección intravítrea de inhibidores del VEGF, existiendo un riesgo teórico de que puedan relacionarse con la inhibición del VEGF. Los datos sobre seguridad del tratamiento de pacientes con OVCR, ORVR, EMD o NVC miópica con antecedentes de ictus, de ataques isquémicos transitorios o de infarto de miocardio en los últimos 6 meses son limitados. Se debe tener precaución cuando se traten tales pacientes.
Otros
Al igual que ocurre con otros tratamientos anti-VEGF intravítreos para la DMAE, OVCR, ORVR, EMD y
NVC miópica son pertinentes las siguientes afirmaciones:
- No se ha estudiado sistemáticamente la seguridad y eficacia del tratamiento con Eylea aplicado en los dos ojos a la vez (ver sección 5.1). Si se realiza el tratamiento bilateral a la vez, se podría producir un incremento de la exposición sistémica que podría aumentar el riesgo de acontecimientos adversos sistémicos.
- Uso concomitante de otros anti-VEGF
No hay datos disponibles sobre el uso concomitante de Eylea con otros medicamentos anti-VEGF (por vía sístémica u ocular).
- Entre los factores de riesgo asociados con el desarrollo de un desgarro del epitelio pigmentario de la retina tras la terapia con anti-VEGF para la DMAE exudativa, se incluye el desprendimiento amplio y/o importante del epitelio pigmentario de la retina. Cuando se inicie un tratamiento con Eylea se debe tener precaución en pacientes con estos factores de riesgo de desarrollar desgarros del epitelio pigmentario de la retina.
- El tratamiento se debe aplazar en pacientes con desprendimiento de retina regmatógeno o con agujeros maculares en estadio 3 ó 4.
- En caso de rotura retiniana, se debe aplazar la dosis y el tratamiento no se debe reanudar hasta que se haya reparado la rotura.
- La dosis se debe aplazar y el tratamiento no se debe reanudar antes del siguiente tratamiento programado en caso de:
o Una disminución en la agudeza visual mejor corregida (AVMC) de >30 letras comparado con la última evaluación de la agudeza visual.
o Una hemorragia subretiniana que afecte al centro de la fóvea o, si el tamaño de la hemorragia es de >50% del área total de la lesión.
- La dosis se debe aplazar en los 28 días previos o posteriores a una cirugía intraocular planificada o realizada.
- No se debe usar Eylea durante el embarazo salvo que el beneficio esperado supere el riesgo potencial para el feto (ver sección 4.6).
- Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento y durante al menos 3 meses después de la última inyección intravítrea de aflibercept (ver sección 4.6).
- La experiencia en el tratamiento de pacientes con OVCR y ORVR isquémicas es limitada. No se recomienda el tratamiento en pacientes que presenten signos clínicos de pérdida irreversible de la función visual isquémica.
Poblaciones con datos limitados
Solo existe experiencia limitada en el tratamiento de sujetos con EMD debido a diabetes de tipo I, de pacientes diabéticos con una hemoglobina glicosilada (en inglés, HbAlc) superior al 12% o con retinopatía diabética proliferativa.
Eylea no ha sido estudiado en pacientes con infecciones sistémicas activas ni en pacientes con enfermedades oculares concurrentes, tales como desprendimiento de retina o agujero macular. Tampoco existe experiencia en el tratamiento con Eylea de pacientes diabéticos con hipertensión no controlada. El médico debe tener en cuenta esta falta de información a la hora de tratar a dichos pacientes.
Para la NVC miópica no existe experiencia con Eylea en el tratamiento de pacientes no asiáticos, en pacientes que se han sometido a tratamiento para la NVC miópica con anterioridad, ni en pacientes con lesiones extrafoveales.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
No se ha estudiado el uso conjunto de terapia fotodinámica (TFD) con verteporfina y Eylea, por lo que no se ha establecido un perfil de seguridad.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento y durante al menos 3 meses después de la última inyección intravítrea de aflibercept (ver sección 4.4).
Embarazo
No hay datos relativos al uso de aflibercept en mujeres embarazadas.
Los estudios realizados en animales han mostrado toxicidad fetoembrionaria (ver sección 5.3).
Aunque la exposición sistémica tras la administración ocular es muy baja, no se debe usar Eylea durante el embarazo a menos que el beneficio potencial supere al riesgo potencial para el feto.
Lactancia
Se desconoce si aflibercept se excreta en la leche materna. No se puede excluir el riesgo en el lactante.
No se recomienda utilizar Eylea durante la lactancia. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
Los resultados de los estudios en animales con elevada exposición sistémica indican que aflibercept puede alterar la fertilidad masculina y femenina (ver sección 5.3). No se prevé que se produzcan estos efectos tras una administración ocular con una exposición sistémica muy baja.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La inyección de Eylea tiene una influencia leve en la capacidad para conducir y utilizar máquinas debido a las posibles alteraciones visuales transitorias asociadas o bien a la inyección o al examen ocular. Los pacientes no deben conducir ni utilizar máquinas hasta que su función visual se haya recuperado lo suficiente.
4.8 Reacciones adversas
Resumen del perfil de seguridad
La población total de seguridad en los ocho estudios de fase III estuvo constituida por 3.102 pacientes. De ellos, 2.501 fueron tratados con la dosis recomendada de 2 mg.
Se produjeron reacciones adversas oculares graves en el ojo en estudio relacionadas con el procedimiento de inyección en menos de 1 de cada 1.900 inyecciones intravítreas de Eylea, que incluyeron ceguera, endoftalmitis, desprendimiento de retina, catarata traumática, catarata, hemorragia vítrea, desprendimiento de vítreo, y aumento de la presión intraocular (ver sección 4.4).
Las reacciones adversas observadas más frecuentemente (en al menos 5% de los pacientes tratados con Eylea) fueron hemorragia conjuntival (25%), agudeza visual reducida (11%), dolor ocular (10%), catarata (8%), aumento de la presión intraocular (8%), desprendimiento de vítreo (7%) y partículas flotantes en el vítreo (7%).
Tabla de reacciones adversas
Los datos de seguridad descritos a continuación incluyen todas las reacciones adversas de los ocho estudios de fase III en las indicaciones de DMAE exudativa, OVCR, ORVR, EMD y NVC miópica con una posibilidad razonable de relación causal con el procedimiento de inyección o con el medicamento.
Las reacciones adversas se listan según un sistema de clasificación de órganos y sistemas y por frecuencia, utilizando el criterio siguiente:
Muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000).
En cada grupo de frecuencia, las reacciones adversas se presentan en orden de gravedad decreciente.
Tabla 1: Todas las reacciones adversas relacionadas con el tratamiento, notificadas en pacientes de los estudios de fase III (datos agrupados de los estudios de fase III para las indicaciones de DMAE exudativa, OVCR, ORVR, EMD y NVC miópica) durante la vigilancia poscomercialización
|
Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
|
Trastornos del sistema inmunológico |
Hipersensibilidad*** | |||
|
Trastornos oculares |
Agudeza visual reducida, Hemorragia conjuntival, Dolor ocular |
Desgarro del epitelio pigmentario retiniano*, Desprendimiento del epitelio pigmentario retiniano, Degeneración retiniana, Hemorragia vítrea, Catarata, Catarata cortical, Catarata nuclear, Catarata subcapsular, Erosión corneal, Abrasión corneal, Aumento de la presión intraocular, Visión borrosa, Partículas flotantes en el vítreo, Desprendimiento de vítreo, Dolor en el lugar de inyección, Sensación de cuerpo extraño en los ojos, Aumento del lagrimeo, Edema palpebral, Hemorragia en el lugar de inyección, Queratitis punteada, Hiperemia conjuntival, Hiperemia ocular |
Endoftalmitis**, Desprendimiento de retina, Desgarro retiniano, Iritis, Uveítis, Iridociclitis, Opacidad lenticular, Defecto en el epitelio corneal, Irritación en el lugar de inyección, Sensación anormal en el ojo, Irritación palpebral, Células flotantes en la cámara anterior, Edema corneal. |
Ceguera, Catarata traumática, Vitritis, Hipopion |
* Asociadas a DMAE exudativa. Observadas únicamente en los estudios de DMAE exudativa.
** Endoftalmitis en cultivo positivo y cultivo negativo.
*** Durante el periodo poscomercialización, las notificaciones de hipersensibilidad incluyeron erupción,
prurito, urticaria y casos aislados de reacciones anafilácticas/anafilactoides graves.
Descripción de reacciones adversas seleccionadas
En los ensayos de fase III en DMAE exudativa se observó un aumento de la incidencia de hemorragia conjuntival en los pacientes en tratamiento con medicamentos antitrombóticos. Este aumento de la incidencia fue comparable entre los pacientes tratados con ranibizumab o con Eylea.
Los acontecimientos tromboembólicos arteriales (ATA) son acontecimientos adversos potencialmente relacionados con la inhibición sistémica del VEGF. Tras el uso intravítreo de inhibidores del VEGF existe un riesgo teórico de acontecimientos tromboembólicos arteriales, incluidos ictus e infarto de miocardio.
Se observó una tasa de incidencia baja de eventos tromboembólicos arteriales en los ensayos clínicos con Eylea en pacientes con DMAE, EMD, OVR y NVC miópica. No se observaron diferencias notables entre los grupos tratados con aflibercept y los respectivos grupos comparadores en todas las indicaciones.
Al igual que con todas las proteínas terapéuticas, Eylea presenta un potencial de inmunogenicidad.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
En los ensayos clínicos, se han usado dosis de hasta 4 mg en intervalos mensuales y en casos aislados se produjeron sobredosis con 8 mg.
La sobredosificación con un volumen de inyección elevado puede aumentar la presión intraocular. Por lo tanto, en caso de sobredosis se debe monitorizar la presión intraocular e iniciarse el tratamiento adecuado, si el médico responsable del tratamiento lo considera necesario.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: agentes oftalmológicos, agentes antineovascularización. Código ATC: S01LA05.
Aflibercept es una proteína de fusión recombinante que consta de porciones de los dominios extracelulares de los receptores 1 y 2 del VEGF humano fusionados con la porción Fc de la IgG1 humana.
Aflibercept se produce en células K1 de ovario de hámster chino (CHO) mediante tecnología de DNA recombinante.
Aflibercept actúa como un receptor anzuelo soluble que se une al VEGF-A y al PlGF con mayor afinidad que sus receptores naturales, por lo que es capaz de inhibir la unión y activación de estos receptores habituales para el VEGF.
Mecanismo de acción
El factor de crecimiento endotelial vascular-A (VEGF-A) y el factor de crecimiento placentario (PlGF) son miembros de la familia VEGF de factores angiogénicos que pueden actuar como potentes factores mitógenos, quimiotácticos y de permeabilización vascular para las células endoteliales. El VEGF actúa a través de dos receptores tirosina quinasas, VEGFR-1 y VEGFR-2, presentes en la superficie de las células endoteliales. El PlGF se une solamente a VEGFR-1, que también se encuentra en la superficie de los leucocitos. La activación excesiva de estos receptores por el VEGF-A puede provocar una neovascularización patológica y una permeabilidad vascular excesiva. El PlGF puede actuar sinérgicamente con el VEGF-A en estos procesos y se sabe que también favorece la infiltración leucocitaria y la inflamación vascular.
Efectos farmacodinámicos
DMAE exudativa
La DMAE exudativa se caracteriza por una neovascularización coroidea (NVC) patológica. La fuga de sangre y fluido de la NVC puede causar un engrasamiento o edema retiniano y/o hemorragias sub/intrarretinianas, con la consiguiente pérdida de agudeza visual.
En los pacientes tratados con Eylea (una inyección mensual durante tres meses consecutivos, seguida de una inyección cada 2 meses), el grosor central de la retina (GCR) disminuyó poco tiempo después del inicio del tratamiento y el tamaño medio de las lesiones de NVC se redujo, de forma concordante con los resultados observados con la pauta de administración mensual de ranibizumab en dosis de 0,5 mg.
En el ensayo VIEW1, se produjeron reducciones medias del GCR en la tomografía de coherencia óptica (OCT) (de -130 y -129 micras en la semana 52 para los grupos tratados con Eylea 2 mg cada dos meses y con ranibizumab 0,5 mg cada mes, respectivamente). Asimismo, en la semana 52 del ensayo VIEW2 se observaron reducciones medias GCR en la OCT (de -149 y -139 micras para los grupos tratados con Eylea,
2 mg cada dos meses, y con ranibizumab, 0,5 mg cada mes, respectivamente).
En general, las reducciones del tamaño de la NVC y del GCR se mantuvieron en el segundo año de los ensayos.
Edema macular secundario a OVCR y ORVR
En la OVCR y la ORVR, se produce isquemia retiniana lo que activa la liberación de VEGF, lo cual a su vez desestabiliza las uniones estrechas y promueve la proliferación de células endoteliales. La sobre-regulación de VEGF se asocia a la ruptura de la barrera hematoretiniana, aumento de permeabilidad vascular, edema retiniano y complicaciones de la neovascularización.
En los pacientes tratados con 6 inyecciones mensuales consecutivas de Eylea 2 mg, se observó una respuesta morfológica uniforme, rápida y robusta (medida por las mejorías en el GCR medio). En la semana 24, la reducción en el GCR fue estadísticamente superior frente al control en los 3 estudios (COPERNICUS en OVCR: -457 frente a -145 micras; GALILEO en OVCR: -449 frente a -169 micras; VIBRANT en ORVR: -280 frente a -128 micras). Esta reducción con respecto al valor basal de GCR se mantuvo hasta el final de cada estudio, semana 100 en el estudio COPERNICUS, semana 76 en el estudio GALILEO y semana 52 en el estudio VIBRANT.
Edema macular diabético
El edema macular diabético es una consecuencia de la retinopatía diabética y se caracteriza por el aumento de la vasopermeabilidad y lesiones de los capilares retinianos que pueden ocasionar pérdida de la agudeza visual.
En los pacientes tratados con Eylea, la mayoría de los cuales padecían diabetes tipo II, se observó una respuesta rápida y robusta en la morfología (GCR, escala DRSS).
En los ensayos VIVIDDME y VISTADME, se observó una mayor reducción media del GCR estadísticamente significativa desde el valor basal hasta la semana 52 en pacientes tratados con Eylea respecto al grupo de control con láser, de -192,4 y -183,1 micras para los grupos tratados con Eylea 2Q8 y de -66,2 y -73,3 micras para los grupos de control, respectivamente. En la semana 100 las reducciones continuaron, siendo de -195,8 y -191,1 micras para los grupos tratados con Eylea 2Q8 y de -85,7 y -83,9 micras para los grupos de control en los ensayos VIVIDDME y VISTADME, respectivamente.
Se evaluó de forma preespecificada una mejoría de > 2 niveles según la puntuación de la escala DRSS de gravedad de la retinopatía diabética en los ensayos VIVIDDME y VISTADME. La puntuación DRSS fue graduable en el 73,7% de los pacientes en VIVIDDME y en el 98,3% de los pacientes en VISTADME. En la semana 52, el 27,7% y el 29,1% de los grupos tratados con Eylea 2Q8, y el 7,5% y el 14,3% de los grupos de control experimentaron una mejoría de > 2 niveles en la DRSS. En la semana 100, los porcentajes respectivos fueron del 32,6% y el 37,1% en los grupos tratados con Eylea 2Q8 y del 8,2% y el 15,6% de los grupos de control.
Neovascularización coroidea miópica
La neovascularización coroidea miópica (NVC miópica) es una causa frecuente de ceguera en adultos con miopía patológica. Se desarrolla como mecanismo de cicatrización subsiguiente a rupturas de la membrana de Bruch y constituye el acontecimiento de la miopía patológica que más pone en riesgo la visión.
En los pacientes tratados con Eylea en el ensayo MYRROR (una inyección administrada al inicio del tratamiento e inyecciones adicionales administradas en caso de persistencia o recurrencia de la enfermedad), el GCR se redujo poco después de iniciar el tratamiento, favoreciendo a Eylea en la semana 24 (-79 micras y -4 micras para el grupo de tratamiento con Eylea 2 mg y el grupo control, respectivamente), manteniéndose desde el inicio hasta la semana 48. Adicionalmente, se redujo el tamaño medio de la lesión de NVC.
Eficacia clínica y seguridad
DMAE exudativa
La seguridad y la eficacia de Eylea se evaluaron en dos ensayos multicéntricos, aleatorizados, doble ciego y controlados con comparador activo en pacientes con DMAE exudativa (VIEW1 y VIEW2) con un total de 2.412 pacientes tratados y evaluables para la eficacia (1.817 con Eylea). La edad de los pacientes estuvo comprendida entre 49 y 99 años, con una media de 76 años. En estos ensayos clínicos, aproximadamente el 89 % (1.616/1.817) de los pacientes randomizados al tratamiento con Eylea tenían 65 años de edad o más y aproximadamente el 63% (1.139/1.817) tenían 75 años o más. En cada ensayo, los pacientes se asignaron aleatoriamente en una proporción de 1:1:1:1 a 1 de las 4 pautas siguientes de administración:
1) Eylea administrado a la dosis de 2 mg cada 8 semanas tras recibir 3 dosis mensuales (1 dosis cada mes) iniciales (Eylea 2Q8);
2) Eylea administrado a la dosis de 2 mg cada 4 semanas (Eylea 2Q4);
3) Eylea administrado a la dosis de 0,5 mg cada 4 semanas (Eylea 0,5Q4); y
4) ranibizumab administrado a dosis de 0,5 mg cada 4 semanas (ranibizumab 0,5Q4).
En el segundo año de los ensayos, los pacientes continuaron recibiendo la dosis inicialmente asignada, pero con una pauta de dosificación modificada basada en la evaluación de los resultados visuales y anatómicos, con un intervalo de dosificación máximo de 12 semanas definido en el protocolo.
En ambos ensayos, el criterio principal de valoración de la eficacia fue la proporción de pacientes del conjunto por protocolo que mantuvieron la visión, es decir, la pérdida de menos de 15 letras de agudeza visual en la semana 52 desde el valor basal.
En la semana 52 del estudio VIEW1, el 95,1% de los pacientes del grupo con Eylea 2Q8 conservaba la visión frente a un 94,4% de los pacientes del grupo tratado con ranibizumab 0,5Q4.
En la semana 52 del estudio VIEW2, el 95,6% de los pacientes del grupo con Eylea 2Q8 conservaba la visión frente a un 94,4% de los pacientes del grupo tratado con ranibizumab 0,5Q4. En ambos estudios, se constató que el tratamiento con Eylea era no inferior y clínicamente equivalente al del grupo tratado con ranibizumab 0,5Q4.
En la tabla 2 y la figura 1 siguientes se muestran los resultados detallados del análisis combinado de ambos ensayos.
|
Resultado de eficacia |
Eylea 2Q8E) (Eylea 2 mg cada 8 semanas tras 3 dosis iniciales mensuales) (N = 607) |
Ranibizumab 0,5Q4 (ranibizumab 0,5 mg cada 4 semanas) (N = 595) | ||
|
Semana 52 |
Semana 96 |
Semana 52 |
Semana 96 | |
|
Número medio de inyecciones desde el inicio de los estudios |
7,6 |
11,2 |
12,3 |
16,5 |
|
Número medio de inyecciones desde la Semana 52 a la 96) |
4,2 |
4,7 | ||
|
Porcentaje de pacientes con < 15 letras de pérdida desde el valor basal (CPPA)) |
95,33%B) |
92,42% |
94,42%B) |
91,60% |
|
DiferenciaC) (IC del 95%)D) |
0,9% (-1,7; 3,5)F |
0,8% (-2,3; 3,8)F | ||
|
Cambio medio en la MAVC medida mediante la puntuación de letras del ETDRSA) desde el inicio de los estudios |
8,40 |
7,62 |
8,74 |
7,89 |
|
Diferencia en el cambio medio de MCA) (letras del ETDRS)C) (IC del 95%)D) |
-0,32 (-1,87; 1,23) |
-0,25 (-1,98; 1,49) | ||
|
Porcentaje de pacientes con >15 letras de ganancia de visión con respecto al inicio de los estudios |
30,97% |
33,44% |
32,44% |
31,60% |
|
DiferenciaC) (IC del 95%)D) |
-1,5% (-6,8; 3,8) |
1,8% (-3,5; 7,1) | ||
A) MAVC: Mejor agudeza visual corregida
ETDRS: Early Treatment Diabetic Retinopathy Study (estudio sobre el tratamiento precoz de la retinopatía diabética).
MC: media de los mínimos cuadrados derivados del análisis de la covarianza (ANCOVA).
CPP: conjunto por protocolo
B) Conjunto de análisis completos (CAC), traslación de la última observación disponible (TUOD) para todos los análisis, excepto para el porcentaje de pacientes con conservación de la agudeza visual en la semana 52, que se calcula en el CPP.
C) La diferencia es el valor del grupo tratado con Eylea menos el valor del grupo tratado con ranibizumab. Un valor positivo favorece a Eylea.
D) Intervalo de confianza (IC) calculado mediante aproximación normal.
E) Después del inicio del tratamiento con tres dosis mensuales.
F) Un intervalo de confianza que se encuentre completamente por encima de -10% indica una no inferioridad de Eylea con respecto a ranibizumab.
Figura 1. Cambio medio de la agudeza visual desde el inicio hasta la semana 96 para los datos combinados de los estudios VIEW1 y VIEW2
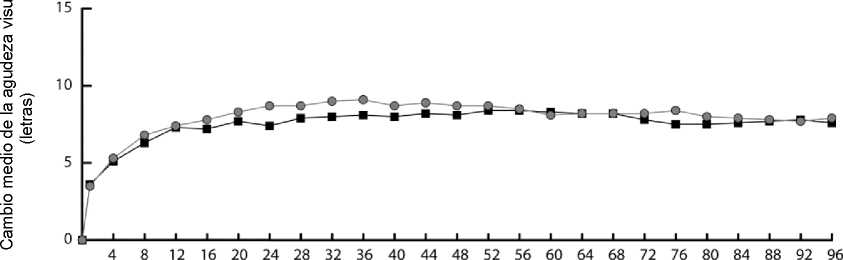
Semanas
" EYLEA 2 mg Q8 Ranibizumab 0,5 mg Q4
semanas semanas
En el análisis de datos combinados de VIEW1 y VIEW2, Eylea demostró cambios clínicamente significativos con respecto al valor basal en el criterio secundario preespecificado de valoración de la eficacia correspondiente al NEI VFQ-25 (National Eye Institute Visual Function Questionnaire: cuestionario de función visual del Instituto Oftalmológico Nacional), sin diferencias clínicamente relevantes respecto a ranibizumab. La magnitud de estos cambios fue similar a la observada en los estudios publicados, lo que corresponde a una ganancia de 15 letras en la agudeza visual mejor corregida (AVMC).
En el segundo año de los ensayos, generalmente se mantuvo la eficacia hasta la última evaluación en la semana 96 y un 2-4% de los pacientes necesitaron todas las inyecciones con una periodicidad mensual y una tercera parte de los paciente necesitaron como mínimo una inyección con intervalo de tratamiento mensual.
En todos los grupos tratados en ambos ensayos se produjeron reducciones evidentes en el área media de NVC.
Los resultados de eficacia en todos los subgrupos evaluables (p. ej., edad, sexo, raza, agudeza visual basal, tipo de lesión, tamaño de la lesión) de cada ensayo y en el análisis combinado fueron concordantes con los resultados de las poblaciones globales.
Edema macular secundario a OVCR
Se evaluó la seguridad y eficacia de Eylea en dos estudios aleatorizados, multicéntricos, doble ciego, controlados con tratamiento simulado en pacientes con edema macular secundario a OVCR (COPERNICUS y GALILEO) con un total de 358 pacientes tratados y evaluables en cuanto a eficacia (217 con Eylea). La edad de los pacientes estuvo comprendida entre 22 y 89 años, con una media de 64 años. En los ensayos de OVCR, aproximadamente el 52% (112/217) de los pacientes asignados a tratamiento con Eylea tenían 65 años o más y aproximadamente el 18% (38/217) tenían 75 años o más. En ambos estudios, los pacientes fueron asignados al azar en una relación de 3:2, o bien a Eylea 2 mg administrado cada 4 semanas (2Q4) o al grupo control que recibió inyecciones simuladas, cada 4 semanas hasta un un total de 6 inyecciones.
Después de 6 inyecciones mensuales consecutivas, los pacientes recibieron tratamiento sólo si cumplían con los criterios pre-definidos de retratamiento, excepto para los pacientes en el grupo de control en el estudio GALILEO que continuaron recibiendo tratamiento simulado (de control a control) hasta la semana 52. A partir de este momento, se trataron a todos los pacientes que cumplían criterios predefinidos.
En ambos estudios, la variable principal de eficacia fue el porcentaje de pacientes que ganaron al menos 15 letras en MAVC en la semana 24, en comparación con el valor basal. Una variable secundaria de eficacia fue el cambio en la agudeza visual en la semana 24, comparado con el valor basal.
La diferencia entre los grupos de tratamiento fue favorable a Eylea en ambos estudios, de forma estadísticamente significativa. La mejoría máxima de la agudeza visual se obtuvo a los 3 meses con la posterior estabilización de la agudeza visual y el GCR hasta los 6 meses. La diferencia estadísticamente significativa se mantuvo hasta la semana 52.
En la tabla 3 y figura 2 siguientes se muestran los resultados detallados de los análisis de ambos estudios.
|
Resultados de eficacia |
COPERNICUS |
GALILEO | ||||||||||
|
24 Semanas |
52 Semanas |
100 Semanas |
24 Semanas |
52 Semanas |
76 Semanas | |||||||
|
Eylea 2 mg Q4 (N=114) |
Control (N=73) |
Eylea 2 mg (N=114) |
ControlE) (N=73) |
Eylea F) 2 mg (N=114) |
Control E,F) (N=73) |
Eylea 2 mg Q4 (N=103) |
Control (N=68) |
Eylea 2 mg (N=103) |
Control (N=68) |
Eylea G) 2 mg (N=103) |
Control G) (N=68) | |
|
Porcentaje de pacientes con una ganancia de >15 letras frente al inicio de los estudios |
56% |
12% |
55% |
30% |
49,1% |
23,3% |
60% |
22% |
60% |
32% |
57,3% |
29,4% |
|
Diferencia ponderadaA,B,E) (95% IC) |
44,8% (33,0; 56,6) |
25,9% (11,8; 40,1) |
26,7% (13,1; 40,3) |
38,3% (24,4; 52,1) |
27,9% (13,0; 42,7) |
28,0% (13,3; 42,6) | ||||||
|
Valor-p |
p < 0,0001 |
p = 0,0006 |
p=0,0003 |
p < 0,0001 |
p = 0,0004 |
p=0,0004 | ||||||
|
Cambio medio en la MAVCC) medida mediante la puntuación de letras del ETDRSC) desde el inicio de los estudios (DE) |
17,3 (12,8) |
-4,0 (18,0) |
16,2 (17,4) |
3,8 (17,1) |
13,0 (17,7) |
1,5 (17,7) |
18,0 (12,2) |
3,3 (14,1) |
16,9 (14,8) |
3,8 (18,1) |
13,7 (17,8) |
6,2 (17,7) |
|
Diferencia del cambio medio de MCAC,D,E) (95% IC) |
21,7 (17,4; 26,0) |
12,7 (7,7; 17,7) |
11,8 (6,7; 17,0) |
14,7 (10,8; 18,7) |
13,2 (8,2; 18,2) |
7,6 (2,1; 13,1) | ||||||
|
Valor-p |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p=0,0070 | ||||||
A) La diferencia es Eylea 2 mg Q4 semanas menos control.
B) La diferencia y el intervalo de confianza (IC) se calculan con el test Cochran-Mantel-Haenszel (CMH) ajustado a cada región (America vs. otros países para COPERNICUS y Europa vs.
Asia/Pacífico para GALILEO) y la categoría del valor basal de la MAVC (> 20/200 y < 20/200).
C) MAVC: Mejor Agudeza Visual Corregida.
ETDRS: Early TreatmentDiabetic Retinopathy Study (Estudio sobre el tratamiento precoz de la retinopatía diabética).
TUOD: traslación de la última observación disponible.
DE: Desviación estándar.
MC: media de los mínimos cuadrados derivados del análisis de la covarianza (ANCOVA).
D) Diferencia en el cambio medio de MC e intervalo de confianza en base a un modelo ANCOVA con los factores grupo de tratamiento, región (America vs. otros países para COPERNICUS y Europa vs. Asia/Pacifico para GALILEO) y la categoría del valor basal de la MAVC (> 20/200 y < 20/200).
E) En el estudio COPERNICUS, los pacientes del grupo control podían recibir Eylea según necesidad, cada 4 semanas desde la semana 24 hasta la semana 52; los pacientes tenían visitas cada 4 semanas. I1 En el estudio COPERNICUS, los pacientes del grupo control y de Eylea recibieron Eylea 2 mg según necesidad, cada 4 semanas desde la semana 52 hasta la semana 96; los pacientes tenían visitas
trimestrales obligatorias, pero si era necesario podían acudir a la consulta con una frecuencia de hasta cada 4 semanas.
G) En el estudio GALILEO, los pacientes del grupo control y de Eylea 2 mg recibieron Eylea 2 mg según necesidad cada 8 semanas desde la semana 52 hasta la semana 68; los pacientes tenían visitas obligatorias cada 8 semanas.
Figura 2: Cambio medio de la agudeza visual desde el inicio hasta la semana 76/100 por grupo de tratamiento para los ensayos COPERNICUS y GALILEO (conjunto de análisis completo)
Cambio medio de la agudeza visual Camb¡0 medio de |g dezg v¡sug|
(letras)
COPERNICUS
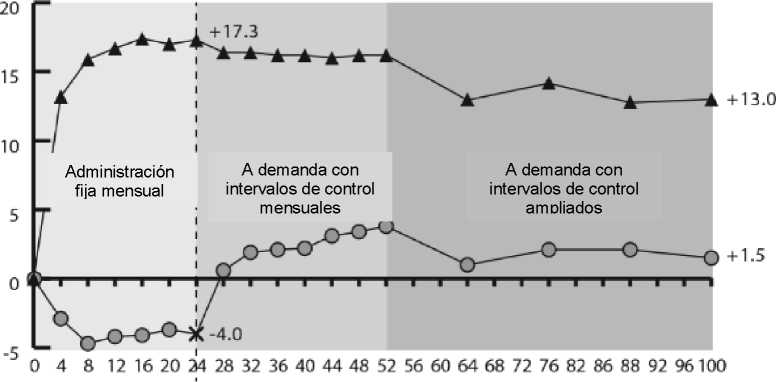
Semanas
GALILEO
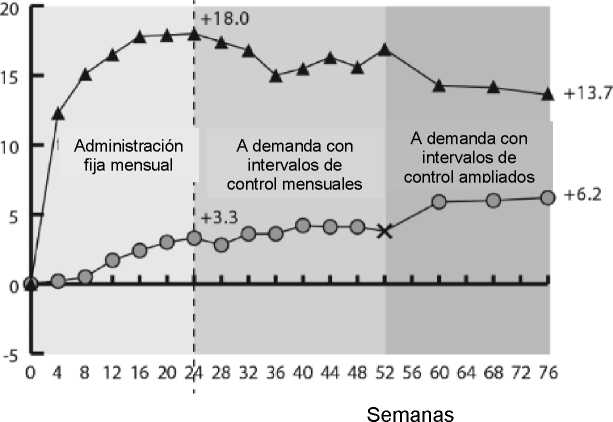
A I : Grupo de control
X Indica el cambio del grupo de control al tratamiento a demanda con EYLEA 2 mg.
En GALILEO, el 86,4% (n=89) del grupo Eylea y el 79,4% (n=54) del grupo de tratamiento simulado tenían OVCR con perfusión en el momento basal. En la semana 24, este porcentaje fue del 91,8% (n=89) en el grupo Eylea y el 85,5% (n=47) en el grupo de tratamiento simulado. Se mantuvieron estas proporciones en la semana 76, con el 84,3% (n=75) en el grupo Eylea y el 84,0% (n=42) en el grupo de tratamiento simulado.
En COPERNICUS, el 67,5% (n = 77) del grupo Eylea y el 68,5% (n = 50) del grupo de tratamiento simulado tenían OVCR con perfusión en el momento basal. En la semana 24, este porcentaje fue del 87,4% (n = 90) en el grupo Eylea y el 58,6% (n = 34) en el grupo de tratamiento simulado. Se mantuvieron estas proporciones en la semana 100 con el 76,8 % (n = 76) en el grupo Eylea y el 78% (n = 39) en el grupo con terapia simulada. Los pacientes del grupo de tratamiento simulado fueron considerados idóneos para recibir Eylea a partir de la semana 24.
El efecto beneficioso del tratamiento con Eylea sobre la función visual fue similar en los subgrupos de pacientes perfundidos y no perfundidos al inicio del estudio. Los efectos del tratamiento en otros subgrupos evaluables (por ejemplo, edad, sexo, raza, agudeza visual basal, duración de la OVCR) en cada estudio fueron en general coherentes con los resultados en las poblaciones generales.
En el análisis de los datos combinados de GALILEO y COPERNICUS, Eylea demostró cambios clínicamente significativos desde el inicio en la variable secundaria predefinida de eficacia, según el Cuestionario de Función Visual del National Eye Institute (NEI VFQ-25). La magnitud de estos cambios fue similar a la observada en los estudios publicados, lo que correspondía a un aumento de 15 letras en la mejor agudeza visual corregida (MAVC).
Edema macular secundario a ORVR
Se evaluó la seguridad y eficacia de Eylea en un estudio aleatorizado, multicéntrico, doble ciego y controlado con tratamiento activo en pacientes con edema macular secundario a ORVR (VIBRANT), que incluye oclusión venosa hemirretiniana. Un total de 181 pacientes fueron tratados y evaluables en cuanto a eficacia (91 con Eylea). La edad de los pacientes estuvo comprendida entre 42 y 94 años, con una media de 65 años. En el estudio ORVR, aproximadamente el 58% (53/91) de los pacientes asignados al tratamiento con Eylea tenían 65 años de edad o más y aproximadamente el 23% (21/91) tenían 75 años o más. En este estudio, los pacientes fueron aleatorizados en una relación 1:1, o bien a Eylea 2 mg, administrado cada 8 semanas después de 6 inyecciones mensuales iniciales, o bien a fotocoagulación con láser administrada en el periodo basal (grupo de control con láser). Los pacientes en el grupo de control con láser podían recibir fotocoagulación con láser adicional (denominada “tratamiento de rescate con láser”) comenzando en la semana 12, con un intervalo mínimo de 12 semanas. En base a criterios previamente establecidos, los pacientes en el grupo con láser podían recibir tratamiento de rescate con Eylea 2 mg a partir de la semana 24, administrado cada 4 semanas durante 3 meses, y a continuación cada 8 semanas.
En el estudio VIBRANT, la variable principal de eficacia fue el porcentaje de pacientes que ganaron al menos 15 letras en la MAVC en la semana 24, en comparación con el valor basal, y el grupo tratado con Eylea fue superior al grupo de control con láser.
Un criterio secundario de eficacia fue el cambio en la agudeza visual en la semana 24, comparado con el valor basal, que fue estadísticamente significativo favorable a Eylea en el estudio VIBRANT. La evolución de la mejoría visual fue rápida y se alcanzó el pico a los 3 meses, con un mantenimiento del efecto hasta el 12° mes.
En el grupo tratado con láser, 67 pacientes recibieron tratamiento de rescate con Eylea a partir de la semana 24 (grupo controlado con tratamiento activo/grupo de Eylea 2 mg), lo que dio lugar a una mejora de la agudeza visual en aproximadamente 5 letras de las semana 24 a la 52.
En la tabla 4 y la figura 3 siguientes se muestran los resultados detallados del análisis del estudio VIBRANT.
Tabla 4: Resultados de eficacia en las semanas 24 y 52 (Conjunto de análisis completo con TUOD) en el estudio VIBRANT
|
Resultados de eficacia |
VIBRANT | |||
|
24 Semanas |
52 Semanas | |||
|
Eylea 2 mg Q4 (N = 91) |
Control con tratamiento activo (láser) (N = 90) |
Eylea 2 mg Q8 (N = 91) |
Control con tratamiento activo (láser)/Eylea 2 mgE) (N = 90) | |
|
Porcentaje de pacientes con una mejoría de >15 letras con respecto al valor basal (%) |
52,7 % |
26,7 % |
57,1 % |
41,1 % |
|
Diferencia ponderadaA,B) (%) IC del 95 %) Valor-p |
26,6 % (13,0; 40,1) p = 0,0003 |
16,2 % (2,0; 30,5) p = 0,0296 | ||
|
Cambio medio en la MAVC medida mediante la puntuación de letras del ETDRS con respecto al valor basal (DE) |
17,0 (11,9) |
6,9 (12,9) |
17,1 (13,1) |
12,2 (11,9) |
|
Diferencia del cambio medio de MCAC) (IC del 95 %) Valor-p |
10,5 (7,1; 14,0) p < 0,0001 |
5,2 (1,7; 8,7) p = 0,0035F) | ||
A) La diferencia es Eylea 2 mg Q4 semanas menos control con láser.
B) La diferencia y el IC del 95 % se calculan con la prueba de Cochran-Mantel-Haenszel ajustado a cada región
(Norteamérica frente a Japón) y el valor basal de la MAVC (> 20/200 y < 20/200).
C) Diferencia en la media de MC e IC del 95% basados en un modelo ANCOVA con los factores grupo de tratamiento, la categoría del valor basal de la MAVC (> 20/200 y < 20/200) y la región (Norteamérica frente a Japón) como efectos fijos y el valor basal de la MAVC como covariable.
D) A partir de la semana 24, se amplió el intervalo de tratamiento del grupo de tratamiento con Eylea de 4 semanas a
8 semanas hasta la semana 48.
E) A partir de la semana 24, los pacientes en el grupo de láser podían recibir tratamiento de rescate con Eylea, si cumplían al menos uno de los criterios de elegibilidad predefinidos. Un total de 67 pacientes recibieron tratamiento de rescate con Eylea. La pauta posológica fija fue de Eylea 2 mg tres veces cada 4 semanas, seguido de inyecciones cada 8 semanas.
F) Valor nominal de p.
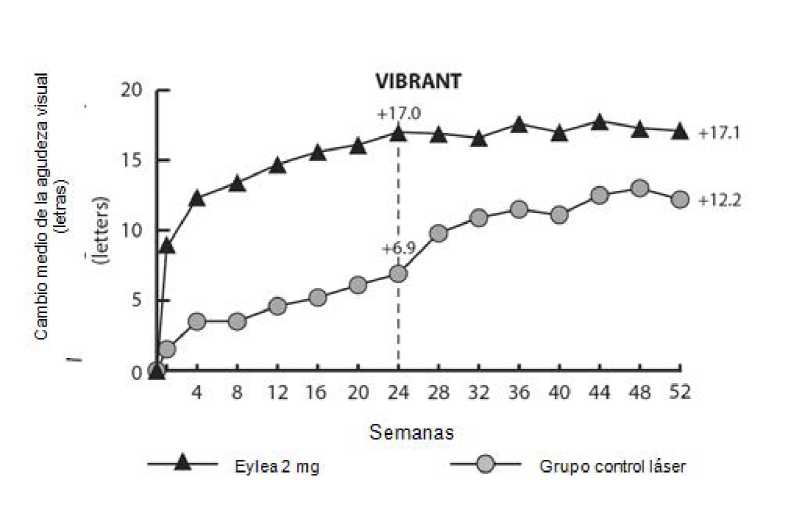
Al inicio, el porcentaje de pacientes perfundidos en los grupos de Eylea y de láser fue del 60% y 68%, respectivamente. En la semana 24 estos porcentajes eran del 80% y 67%, respectivamente. En el grupo de Eylea, el porcentaje de pacientes perfundidos se mantuvo hasta la semana 52. En el grupo tratado con láser, en el que los pacientes fueron aptos para el tratamiento de rescate con Eylea a partir de la semana 24, el porcentaje de pacientes perfundidos aumentó al 78% en la semana 52.
Edema macular diabético
La seguridad y la eficacia de Eylea se evaluaron en dos ensayos multicéntricos, aleatorizados, doble ciego y controlados con comparador activo en pacientes con EMD (VIVIDDME y VISTADME). Un total de 862 pacientes fueron tratados y evaluables en cuanto a eficacia, 576 con Eylea. La edad de los pacientes estuvo comprendida entre 23 y 87 años, con una media de 63 años. En los ensayos en EMD, aproximadamente el 47% (268/576) de los pacientes aleatorizados al tratamiento con Eylea tenían 65 años de edad o más y aproximadamente el 9% (52/576) tenían 75 años o más. La mayoría de los pacientes en ambos ensayos tenían diabetes tipo II. En ambos ensayos, los pacientes se asignaron aleatoriamente en una proporción de 1:1:1 a 1 de las 3 pautas siguientes de administración:
1) Eylea administrado a la dosis de 2 mg cada 8 semanas tras recibir 5 inyecciones mensuales iniciales (Eylea 2Q8);
2) Eylea administrado a la dosis de 2 mg cada 4 semanas (Eylea 2Q4); y
3) fotocoagulación macular con láser (control activo).
A partir de la semana 24, los pacientes que cumplían un umbral predefinido de pérdida de visión eran considerados idóneos para recibir tratamiento adicional: los pacientes de los grupos de Eylea podían recibir láser y los pacientes del grupo de control podían recibir Eylea.
En ambos ensayos, el criterio principal de valoración de la eficacia fue el cambio medio en la MAVC de la semana 52 y tanto el grupo de Eylea 2Q8 como el de Eylea 2Q4 demostraron significación estadística y fueron superioresal grupo de control. Este beneficio se mantuvo hasta la semana 100.
Los resultados detallados del análisis de los ensayos VIVIDDME y VISTADME se muestran en la tabla 5 y en la figura 4 siguientes.
|
Resultados de eficacia |
VIVIDDME |
VISTADME | ||||||||||
|
52 semanas |
100 semanas |
52 semanas |
100 semanas | |||||||||
|
Eylea |
Eylea |
Control |
Eylea |
Eylea |
Control |
Eylea |
Eylea |
Control |
Eylea |
Eylea |
Control | |
|
activo |
activo |
activo |
activo | |||||||||
|
2 mg Q8 A |
2 mg Q4 |
(láser) |
2 mg Q8 A |
2 mg Q4 |
(láser) |
2 mg Q8 A |
2 mg Q4 |
(láser) |
2 mg Q8 A |
2 mg Q4 |
(láser) | |
|
(N = 135) |
(N = 136) |
(N = 132) |
(N = 135) |
(N = 136) |
(N = 132) |
(N = 151) |
(N = 154) |
(N = 154) |
(N=151) |
(N=154) |
(N=154) | |
|
Cambio medio en la MAVC medida mediante la puntuación de letras del ETDRSE respecto al valor basal |
10,7 |
10,5 |
1,2 |
9,4 |
11,4 |
0,7 |
10,7 |
12,5 |
0,2 |
11,1 |
11,5 |
0,9 |
|
Diferencia en la media de |
9,1 |
9,3 |
8,2 |
10,7 |
10,45 |
12,19 |
10,1 |
10,6 | ||||
|
MCB-C-E (IC del 97,5%) |
(6,4; 11,8) |
(6,5; 12,0) |
(5,2; 11,3) |
(7,6; 13,8) |
(7,7; 13,2) |
(9,4; 15,0) |
(7,0; 13,3) |
(7,1; 14,2) | ||||
|
Porcentaje de pacientes con ganancia de >15 letras respecto al valor basal |
33% |
32% |
9% |
31,1% |
38,2% |
12,1% |
31% |
42% |
8% |
33,1% |
38,3% |
13,0% |
|
Diferencia ajustada D,C,E |
24% |
23% |
19,0% |
26,1% |
23% |
34% |
20,1% |
25,8% | ||||
|
(13,5; |
(12,6; |
(8,0; 29,9) |
(14,8; |
(13,5; |
(24,1; |
(9,6; 30,6) |
(15,1; | |||||
|
(IC del 97,5%) |
34,9) |
33,9) |
37,5) |
33,1) |
44,4) |
36,6) | ||||||
A Después del inicio del tratamiento con 5 inyecciones mensuales.
B Media de MC e IC en base a un modelo ANCOVA con una medición de MAVC basal como covarianza y un grupo de tratamiento por factor. Además, la región
(Europa/Australia frente a Japón) se ha incluido como factor para VIVIDDME, y los antecedentes de IM o AVC como factor para VISTADME C La diferencia es el grupo de Eylea menos el grupo de control activo (láser).
D La diferencia con el intervalo de confianza (IC) y la prueba estadística se calculan con el esquema de ponderación de Mantel-Haenszel ajustado a cada región (Europa/Australia frente a Japón) para VIVIDDME y los antecedentes médicos de IM o AVC para VISTADME.
E MAVC: Mejor Agudeza Visual Corregida.
ETDRS: Early Treatment Diabetic Retinopathy Study (Estudio sobre el tratamiento precoz de la retinopatía diabética).
TUOD: Traslación de la última observación disponible.
MC: Media de los mínimos cuadrados derivada de ANCOVA. IC: Intervalo de confianza.
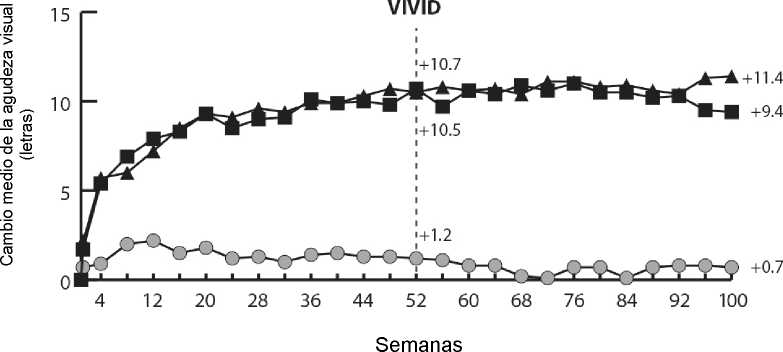
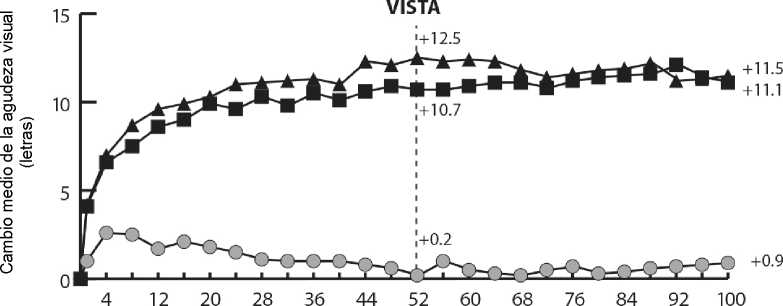
Semanas
|
EYLEA 2mg Q8 |
EYLEA 2mg Q4 semanas | |
|
semanas |
Control activo (laser) |
Los efectos del tratamiento en los subgrupos evaluables (es decir, edad, sexo, raza, HbA1c basal, agudeza visual basal, terapia anterior con anti-VEGF) en cada ensayo y en el análisis combinado fueron por lo general acordes con los resultados en las poblaciones generales.
En los ensayos VIVIDDME y VISTADME, 36 (9%) y 197 (43%) pacientes recibieron terapia anterior con anti-VEGF, respectivamente, con un período de lavado de 3 meses o más. Los efectos del tratamiento en los subgrupos de pacientes que habían sido tratados previamente con un inhibidor del VEGF fueron similares a los observados en pacientes sin tratamiento previo con inhibidores del VEGF.
Los pacientes con enfermedad bilateral se consideraron idóneos para recibir tratamiento con anti-VEGF en el otro ojo si el médico lo consideraba necesario. En el ensayo VISTADME, 217 (70,7%) de los pacientes tratados con Eylea recibieron inyecciones bilaterales de Eylea hasta la semana 100; en el ensayo VIVIDDME, 97 (35,8%) de los pacientes tratados con Eylea recibieron tratamiento con un anti-VEGF diferente en el otro ojo.
Un ensayo comparativo independiente (DRCR.net Protocol T) utilizó una pauta posológica basada en criterios estrictos de retratamiento según OCT y visión. En el grupo de tratamiento con aflibercept (n = 224) en la semana 52, esta pauta de tratamiento dio lugar a pacientes que recibían una media de 9,2 inyecciones, similar al número de dosis administradas en el grupo de Eylea 2Q8 en VIVIDDME y VISTADME, mientras que la eficacia global en el grupo de tratamiento con aflibercept en el Protocol T fue comparable al grupo de
Eylea 2Q8 en VIVIDDME y VISTADME En el Protocol T se observó una ganancia media de 13,3 letras, con el 42% de pacientes que ganaron al menos 15 letras de visión desde el valor basal. Los perfiles de seguridad ocular y sistémica (incluidos los ATA) fueron similares a VIVIDDME y VISTADME.
Neovascularización coroidea miópica
La seguridad y la eficacia de Eylea se evaluaron en un ensayo aleatorizado, multicéntrico, doble ciego, controlado con tratamiento simulado en pacientes asiáticos con NVC miópica que nunca habían recibido tratamiento. En total se trataron y evaluaron en cuanto a la eficacia 121 pacientes (90 con Eylea). La edad de los pacientes estuvo comprendida entre 27 y 83 años, con una media de 58 años. En el estudio de NVC miópica, aproximadamente el 36% (33/91) de los pacientes aleatorizados al tratamiento con Eylea tenían 65 años o más y aproximadamente el 10% (9/91) tenían 75 años o más.
Los pacientes fueron asignados aleatoriamente en una proporción 3:1 para recibir o bien 2 mg de Eylea en inyección intravítrea o inyección simulada, administrada una vez al inicio del ensayo, e inyecciones adicionales administradas mensualmente, en el caso de persistencia o recurrencia de la enfermedad, hasta la semana 24, momento en el que se evaluó el criterio principal de valoración. En la semana 24, los pacientes inicialmente asignados de forma aleatoria al grupo de tratamiento simulado, podían recibir la primera dosis de Eylea. Después, los pacientes de ambos grupos podían seguir recibiendo inyecciones adicionales en caso de persistencia o recurrencia de la enfermedad.
La diferencia entre los grupos de tratamiento fue estadísticamente significativa y favorable a Eylea para el criterio principal de valoración (cambio en la MAVC) y el segundo criterio de valoración confirmatorio (proporción de pacientes que ganaron 15 letras de visión en la MAVC) en la semana 24 con respecto al momento inicial. Las diferencias en ambos criterios de valoración se mantuvieron hasta la semana 48.
Los resultados detallados del análisis del ensayo MYRROR se muestran en la Tabla 6 y la Figura 5 siguientes.
Tabla 6:
|
Resultados de eficacia |
MYRROR | |||
|
24 semanas |
48 semanas | |||
|
Eylea 2mg (N = 90) |
Simulado (N = 31) |
Eylea 2mg (N = 90) |
Simulado/ Eylea 2mgD) (N = 31) | |
|
Cambio medio en la MAVCB) medida mediante la puntuación de letras del ETDRS respecto al valor basal (SD) B) |
12,1 (8,3) |
-2,0 (9,7) |
13,5 (8,8) |
3,9 (14,3) |
|
Diferencia en la media de MCC,D,E) (IC del 95%) |
14,1 (10,8; 17,4) |
9,5 (5,4; 13.7) | ||
|
Porcentaje de pacientes con una ganancia de >15 letras respecto al valor basal |
38,9% |
9,7% |
50,0% |
29,0% |
|
Diferencia ponderada D,F) (IC del 95%) |
29,2% (14,4; 44,0) |
21,0% (1,9; 40,1) | ||
A) TUOD: Traslación de la última observación disponible.
B) MAVC: Mejor Agudeza Visual Corregida
ETDRS: Early Treatment Diabetic Retinopathy Study (Estudio sobre el tratamiento precoz de la retinopatía diabética)
SD: desviación estándar
C) Media MC: medias de mínimos cuadrados obtenidas del modelo ANCOVA
D) IC: Intervalo de confianza.
E) Diferencia en la media de MC e IC del 95% basada en un modelo ANCOVA con el grupo de tratamiento y el país (designaciones de país) como efectos fijos, y MAVC como covariable.
F) La diferencia y el IC del 95% se calculan utilizando la prueba Cochran-Mantel-Haenszel (CMH) ajustada para el país (designaciones de país)
Figura 5: Cambio medio desde el inicio hasta la semana 48 en la agudeza visual por grupo de
tratamiento en el ensayo MYRROR (conjunto de análisis completo, TUOD)
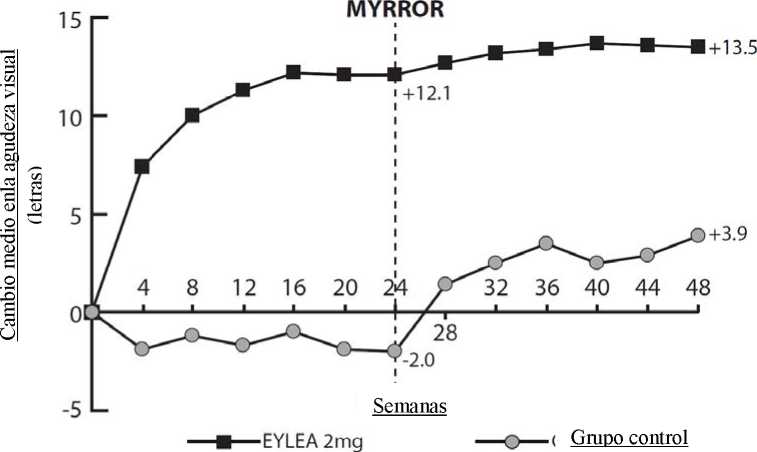
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Eylea en los diferentes grupos de la población pediátrica en la DMAE exudativa, OVCR, ORVR, EMD y poblaciones de NVC miópica (ver sección 4.2 para consultar la información sobre el
uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Eylea se administra directamente en el vitreo para ejercer efectos locales en el ojo. Absorción / Distribución
Tras su administración intravítrea, aflibercept se absorbe lentamente desde el ojo a la circulación sistémica, en la que generalmente se observa formando un complejo estable e inactivo con el VEGF; sin embargo, solamente el “aflibercept libre” es capaz de unirse al VEGF endógeno.
En un sub-estudio farmacocinético realizado en 6 pacientes con DMAE neovascular exudativa con toma de muestras frecuente, las concentraciones plasmáticas máximas de aflibercept libre (Cmax sistémica) fueron bajas, con una media de aproximadamente 0,02 microgramos/ml (intervalo de 0 a 0,054) en el plazo de 1 a 3 días tras la inyección intravítrea de 2 mg, y fueron indetectables dos semanas después de la administración en casi todos los pacientes. Aflibercept no se acumula en el plasma cuando se administra por vía intravítrea cada 4 semanas.
La concentración plasmática máxima media de aflibercept libre es aproximadamente de 50 a 500 veces menor que la concentración de aflibercept necesaria para inhibir la actividad biológica del VEGF sistémico en un 50% en los modelos animales, en los que se observaron cambios en la presión arterial cuando se alcanzaron niveles de aflibercept libre circulantes de alrededor de 10 microgramos/ml, que regresaron a los valores basales cuando los niveles cayeron por debajo de aproximadamente 1 microgramo/ml. En un estudio con voluntarios sanos se estimó que tras la administración intravítrea de 2 mg a los pacientes, la concentración plasmática máxima media de aflibercept libre es más de 100 veces inferior que la concentración de aflibercept necesaria para unirse al VEGF sistémico en niveles equivalentes a la mitad de los máximos (2,91 microgramos/ml). Por lo tanto, son improbables los efectos farmacodinámicos sistémicos, como por ejemplo cambios en la presión arterial.
En sub-estudios de farmacocinética en pacientes con OVCR, ORVR, EMD o NVC miópica, los valores de Cmax media de aflibercept libre en plasma fueron similares en el intervalo de 0,03 a 0,05 microgramos/ml y los valores individuales no fueron superiores a 0,14 microgramos/ml. Posteriormente, las concentraciones plasmáticas de aflibercept libre se redujeron a valores inferiores o cercanos al límite inferior de cuantificación, generalmente en una semana; antes de la siguiente administración, después de 4 semanas, las concentraciones fueron indetectables en todos los pacientes.
Eliminación
Dado que Eylea es un agente terapéutico de tipo proteico, no se han realizado estudios de su metabolismo.
Aflibercept libre se une al VEGF formando un complejo estable e inerte. Como ocurre con otras proteínas de gran tamaño, es de esperar que tanto el aflibercept libre como el fijado se eliminen mediante catabolismo proteolítico.
Insuficiencia renal
No se han realizado estudios especiales con Eylea en pacientes con insuficiencia renal.
El análisis farmacocinético de los pacientes del ensayo VIEW2, de los cuales el 40% presentaba insuficiencia renal (24% leve, 15% moderada y 1% grave), no reveló diferencias con respecto a las concentraciones plasmáticas del medicamento activo tras la administración intravítrea cada 4 u 8 semanas.
Se observaron resultados similares en pacientes con OVCR en el estudio GALILEO, en pacientes con EMD en el ensayo VIVIDDME, y en pacientes con NVC miópica en el ensayo MYRROR.
5.3 Datos preclínicos sobre seguridad
En los estudios no clínicos de toxicidad a dosis repetidas solamente se observaron efectos con exposiciones sistémicas consideradas notablemente superiores a la exposición humana máxima tras la administración intravítrea de la dosis clínica prevista, lo que indica su escasa relevancia con respecto al uso clínico.
Se observaron erosiones y ulceraciones en el epitelio respiratorio de los cornetes nasales en los monos tratados con aflibercept por vía intravítrea con exposiciones sistémicas superiores a la exposición humana máxima. Los valores de exposición sistémica para la Cmax y el AUC del aflibercept libre fueron unas 200 y 700 veces mayores, respectivamente, que los valores correspondientes observados en humanos tras una dosis intravítrea de 2 mg. En el Nivel sin Efecto Adverso Observado (NOAEL) de 0,5 mg/ojo en monos, la exposición sistémica fue 42 y 56 veces superior según los valores de Cmax y AUC, respectivamente.
No se han realizado estudios sobre el potencial mutagénico o carcinogénico de aflibercept.
Se observó un efecto de aflibercept en el desarrollo intrauterino en los estudios de desarrollo embrio-fetal en conejas gestantes con administración intravenosa (3 a 60 mg/kg) así como con administración subcutánea (0,1 a 1 mg/kg). El NOAEL materno fue a la dosis de 3 mg/kg ó 1 mg/kg, respectivamente. No se identificó un NOAEL para el desarrollo. Con la dosis de 0,1 mg/kg, los valores de exposición sistémica para la Cmax y acumulativo de AUC de aflibercept libre fueron unas 17 y 10 veces superiores, respectivamente, que los valores correspondientes observados en humanos tras la administración de una dosis intravítrea de 2 mg.
Los efectos sobre la fertilidad masculina y femenina se evaluaron como parte integral de un estudio de 6 meses de duración en monos, con administración intravenosa de aflibercept en dosis de 3 a 30 mg/kg. En todos los niveles de dosis se observaron menstruaciones ausentes o irregulares asociadas a alteraciones en los niveles de las hormonas reproductivas femeninas y cambios en la morfología y la motilidad del esperma. Los valores de exposición sistémica para la Cmax y el AUC de aflibercept libre observados con la dosis intravenosa de 3 mg/kg fueron, respectivamente, unas 4.900 y 1.500 veces superiores a los valores de exposición observados en humanos tras la administración de una dosis intravítrea de 2 mg. Todos los cambios fueron reversibles.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polisorbato 20
Dihidrógeno fosfato de sodio monohidrato (para ajuste del pH)
Hidrogenofosfato de disodio heptahidrato (para ajuste del pH)
Cloruro de sodio Sacarosa
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez 2 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar el vial en el embalaje exterior para protegerlo de la luz.
Antes del uso, el vial sin abrir de Eylea puede conservarse a temperatura ambiente (por debajo de 25°C) durante un máximo de 24 horas. Tras la apertura del vial, se procederá empleando condiciones asépticas.
6.5 Naturaleza y contenido del envase
100 microlitros de solución en vial (vidrio tipo I) con un tapón (goma elastomérica) y una aguja de filtro de calibre 18 G. Tamaño de envase: 1 vial.
6.6 Precauciones especiales de eliminación y otras manipulaciones
El vial es para un solo uso.
Dado que el vial contiene más volumen (100 microlitros) que la dosis recomendada (50 microlitros), antes de la administración se desechará una parte del volumen contenido en el vial.
Antes de su administración, la solución debe inspeccionarse visualmente para detectar la presencia de partículas y/o cambio de color o cualquier otro cambio del aspecto físico. En caso de observar alguna alteración, no utilizar el medicamento.
Para la inyección intravítrea debe usarse una aguja de inyección de 30 G x pulgada (1,27 cm).
1. Retirar la cápsula de cierre de plástico y desinfectar la parte externa del tapón de goma del vial.
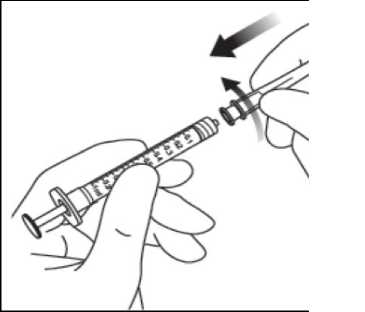
2.
3.
4.
Acoplar la aguja de filtro de 5 micras y calibre 18 G suministrada en la caja a una jeringa estéril de 1 ml con adaptador Luer Lock.
Empujar la aguja de filtro por el centro del tapón del vial hasta que la aguja esté completamente introducida en el vial y su extremo entre en contacto con el fondo o el borde inferior interno del vial.
Utilizando una técnica aséptica, traspasar la totalidad del contenido del vial de Eylea a la jeringa, manteniendo el vial en posición vertical y ligeramente inclinado para facilitar la extracción completa. Para evitar la introducción de aire, asegurar que el bisel de la aguja con filtro esté sumergido en la solución. Continuar inclinando el vial durante la extracción manteniendo el bisel de la aguja con filtro sumergido en la solución.
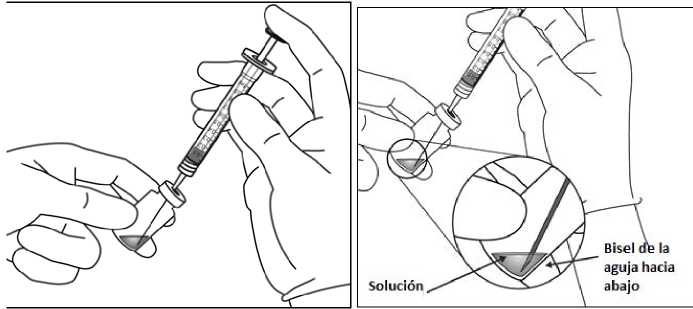
5 Asegurar que el vástago del émbolo está suficientemente retirado hacia atrás cuando se vacíe el vial a fin de vaciar por completo la aguja de filtro.
6. Retirar la aguja de filtro y desechar de forma adecuada.
Nota: la aguja de filtro no debe emplearse para la inyección intravítrea.
Utilizando una técnica aséptica, acoplar firmemente una aguja de inyección de 30 G x / pulgada (1,27 cm) a la punta de la jeringa con el adaptador Luer-Lock realizando un movimiento giratorio.
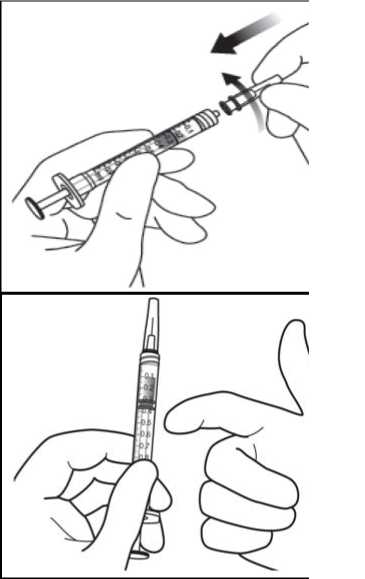
8.
Mantener la jeringa con la aguja apuntando hacia arriba y comprobar que no hay burbujas en su interior. Si las hay, golpear suavemente la jeringa con el dedo hasta que éstas asciendan a su parte superior.
9. Eliminar todas las burbujas y expulsar el exceso de medicamento empujando lentamente el émbolo de forma que su punta se alinee con la línea que indica 0,05 ml en la jeringa.
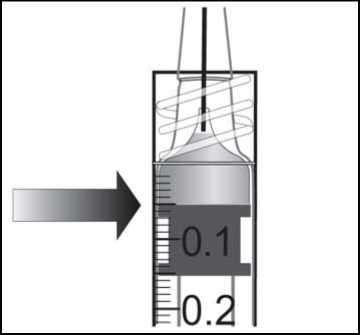
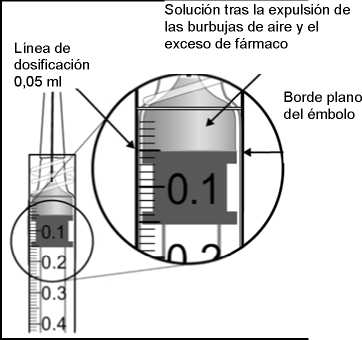
10. El vial es para un solo uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Bayer Pharma AG D13342 Berlin Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/797/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 22 Noviembre 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico Regeneran Pharmaceuticals, Inc.
81 Columbia Turnpike Rensselaer, New York 12144 USA
Nombre y dirección de los fabricantes responsables de la liberación de los lotes
Bayer Pharma AG MüllerstraBe 178 13353 Berlin Germany
GP Grenzach Produktions GmbH Emil-Barell-StraBe 7 79639 Grenzach-Wyhlen Germany
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Poducto, sección 4.2)
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva
información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente
Sistema de Farmacovigilancia
El Titular de la autorización de Comercialización (TAC) debe asegurar que el Sistema de Farmacovigilancia, presentado en el Módulo 1.8.1 de la Autorización de Comercialización esté instaurado y en funcionamiento antes de que el medicamento se comercialice y durante el tiempo que permanezca en el mercado.
• Medidas adicionales de minimización de riesgos
Antes del lanzamiento en cada estado miembro, el Titular de la Autorización de Comercialización (TAC) deberá acordar el material educacional final con cada Autoridad Nacional Competente.
El TAC debe asegurar que, tras las discusiones y acuerdo con cada Autoridad Nacional Competente en cada estado miembro en el que se comercialize Eylea, en el momento del lanzamiento de la nueva indicación neovascularización coroidea miópica (NVC miópica) y periódicamente a partir de entonces, todas las clínicas oftalmológicas en las que se espera que se vaya a utilizar Eylea dispongan de un pack educacional actualizado formado por los siguientes elementos:
• Información para el médico
• Vídeo sobre el procedimiento de inyección intravítrea
• Pictograma sobre el procedimiento de inyección intravítrea
• Packs de información para el paciente
La información para el médico debe contener los siguientes elementos básicos:
• Ficha Técnica o Resumen de las Características del Producto
• Quién deberá tratarse con Eylea
• Técnicas de esterilidad, incluyendo la desinfección ocular y periocular para minimizar el riesgo de
infección
• Uso de antibióticos
• Uso de povidona iodada o equivalente
• Técnicas de inyección intravítrea
• La necesidad de desechar el exceso de volumen de la jeringa precargada antes de inyectar Eylea para evitar una sobredosificación
• Monitorización del paciente después de la inyección intravítrea
• Signos y síntomas clave de los efectos adversos relacionados con la inyección intravítrea, incluyendo endoftalmitis, aumento de la presión intraocular, desgarro del epitelio pigmentario retiniano y catarata
• Manejo de los efectos adversos relacionados con la inyección intravítrea
• Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos y las mujeres embarazadas no deben utilizar Eylea
El pack de información para el paciente se debe proporcionar en forma de folleto con información para el paciente y en audio-CD, que contendrán los siguientes elementos básicos:
• Prospecto para el Paciente
• Quién deberá tratarse con Eylea
• Cómo prepararse para el tratamiento con Eylea
• Pasos a seguir después del tratamiento con Eylea
• Signos y síntomas clave de los efectos adversos relacionados con la inyección intravítrea, incluyendo endoftalmitis, aumento de la presión intraocular, desgarro del epitelio pigmentario retiniano y catarata
• Cuándo deben requerir atención médica urgente
• Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos y las mujeres embarazadas no deben utilizar Eylea • Obligación de llevar a cabo medidas posautorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Estudio posautorización de eficacia (EPAE) Realizar un ensayo aleatorizado posautorización en pacientes con DMAE neovascular (exudativa) con el objetivo principal de comparar la pauta estándar de inyecciones administradas cada 8 semanas con una pauta reactiva basada en los resultados visuales y anatómicos, según un protocolo aprobado por el CHMP. |
Presentación del Informe Final del estudio: 31 Diciembre 2018 |
|
Estudio posautorización de eficacia (EPAE) Realizar un estudio intervencional de eficacia, posautorización, en pacientes con edema macular diabético con el objetivo principal de comparar, tras un año de tratamiento con Eylea, el régimen estándar de inyecciones cada 8 semanas con regímenes alternativos, como por ejemplo, intervalos de tratamiento más prolongados en base a los resultados visuales y anatómicos (PRN y ‘tratar y extender’) |
Presentación del Informe Final del estudio: Noviembre 2019 |
Eylea 40 mg/ml solución inyectable en jeringa precargada Aflibercept
Aflibercept
Excipientes:
Polisorbato 20
Dihidrógenofosfato de sodio monohidrato (para ajuste de pH) Hidrogenofosfato de sodio heptahidrato (para ajuste de pH) Cloruro de sodio Sacarosa
Agua para preparaciones inyectables
Solución inyectable en jeringa precargada
Una jeringa precargada contiene 3,6 mg de aflibercept en 90 microlitros (40 mg/ml) en solución isosmótica Proporciona una dosis única de 2 mg/0,05 ml.
Desechar el exceso de volumen antes de administrar la inyección.
1 jeringa precargada (3,6 mg/90 microlitros)
Dosis única: 2 mg/0,05 mg/ml Desechar el exceso de volumen.
Vía intravítrea.
Para un solo uso.
Leer el prospecto antes de utilizar este medicamento. Abrir el blister estéril únicamente en la sala limpia.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar la jeringa precargada en su blíster dentro del embalaje exterior para protegerla de la luz.
El blíster sin abrir puede conservarse a temperatura ambiente (por debajo de 25°C) antes de su uso, durante un máximo de 24 horas.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Bayer Pharma AG D-13342 Berlin Alemania
EU/1/12/797/001
Lote
Medicamento sujeto a prescripción médica restringida.
Se acepta la justificación para no incluir la información en Braille
Eylea 40 mg/ml solución inyectable Aflibercept
Aflibercept
Una jeringa precargada contiene 3,6 mg/90 microlitros (40 mg/ml) en solución isosmótica. Proporciona una dosis única de 2 mg/0,05 ml.
El exceso de volumen se debe eliminar antes de la inyección.
Vía intravítrea.
Para un solo uso.
Leer el prospecto antes de utilizar este medicamento. Abrir el blister estéril únicamente en la sala limpia.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
EXP
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar la jeringa precargada en su blíster dentro del embalaje exterior para protegerla de la luz.
El blíster sin abrir puede conservarse a temperatura ambiente (por debajo de 25°C) antes de su uso, durante un máximo de 24 horas.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Bayer Pharma AG D-13342 Berlin Alemania
EU/1/12/797/001
Lot
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS
PRIMARIOS
ETIQUETA
Jeringa precargada
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Eylea 40 mg/ml solución inyectable
Aflibercept
Vía intravítrea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
Dosis única = 2 mg/50 microlitros 3,6 mg/90 microlitros
6. OTROS
Eylea 40 mg/ml solución inyectable en vial Aflibercept
Aflibercept
Excipientes:
Polisorbato 20
Dihidrógenofosfato de sodio monohidrato (para ajuste del pH) Hidrogenofosfato de sodio heptahidrato (para ajuste de pH) Cloruro de sodio Sacarosa
Agua para preparaciones inyectables
Solución inyectable en vial
Un vial contiene 4 mg de aflibercept en 100 microlitros (40 mg/ml) en solución isosmótica. Proporciona una dosis única de 2 mg/0,05 ml.
El exceso de volumen debe eliminarse antes de la inyección.
1 vial: (4 mg/0,1 ml)
Aguja con filtro de calibre 18 G Dosis única: 2 mg/0,05 ml Eliminar el exceso de volumen.
Vía intravítrea.
Para un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar el vial en el embalaje exterior para protegerlo de la luz.
El vial sin abrir puede conservarse a temperatura ambiente (por debajo de 25°C) antes de su uso, durante un máximo de 24 horas.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Bayer Pharma AG D-13342 Berlin Alemania
EU/1/12/797/002
Lote
Medicamento sujeto a prescripción médica restringida.
Se acepta la justificación para no incluir la información en Braille
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS
PRIMARIOS
ETIQUETA
Vial
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Eylea 40 mg/ml solución inyectable
Aflibercept
Vía intravítrea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
Dosis única = 2 mg/50 microlitros Contenido extraíble = 4 mg/100 microlitros
6. OTROS
B. PROSPECTO
Prospecto: Información para el paciente
Eylea 40 mg/ml solución inyectable en jeringa precargada
Aflibercept
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Eylea y para qué se utiliza
2. Qué necesita saber antes de que le administren Eylea
3. Cómo se le administrará Eylea
4. Posibles efectos adversos
5. Conservación de Eylea
6. Contenido del envase e información adicional
1. Qué es Eylea y para qué se utiliza
Eylea es una solución que se inyecta en el ojo para tratar unas enfermedades oculares en pacientes adultos, denominadas:
- degeneración macular asociada a la edad neovascular (exudativa) comunmente conocida como DMAE exudativa
- alteración de la visión debida al edema macular a causa de un bloqueo de las venas retinianas (oclusión de la vena central de la retina (OVCR) o de la rama venosa de la retina (ORVR))
- alteración de la visión debida al edema macular diabético (EMD)
- alteración de la visión debida a la neovascularización coroidea miópica (NVC miópica).
Aflibercept, el principio activo de Eylea, bloquea la actividad de un grupo de factores denominados factor de crecimiento endotelial vascular A (VEGF-A) y factor de crecimiento placentario (PlGF).
En pacientes con DMAE exudativa y NVC miópica, cuando estos factores existen en cantidad excesiva influyen en la formación anómala de nuevos vasos sanguíneos en el ojo. Estos nuevos vasos sanguíneos pueden causar una fuga de los componentes de la sangre hacia el interior del ojo, con el consiguiente daño en los tejidos oculares responsables de la visión.
En pacientes con OVCR, se produce un bloqueo de la vena principal que transporta sangre desde la retina. A causa de ello, los niveles de VEGF aumentan causando la fuga de fluido en la retina y por tanto, la hinchazón de la mácula (la parte de la retina responsable de la visión fina), lo cual se conoce como edema macular. Cuando la mácula se llena de líquido, la visión central se vuelve borrosa.
En pacientes con ORVR, se produce un bloqueo de una o más ramas del vaso sanguíneo principal que transporta sangre desde la retina. A causa de ello, los niveles de VEGF aumentan causando la fuga de líquido en la retina y, por tanto, la hinchazón de la mácula.
El edema macular diabético es una hinchazón de la retina que se produce en pacientes con diabetes debido a la fuga de líquido de los vasos sanguíneos de la mácula. La mácula es la parte de la retina responsable de la visión fina. Cuando la mácula se hincha de líquido, la visión central se vuelve borrosa.
Eylea ha demostrado detener el crecimiento de los nuevos vasos sanguíneos anómalos en el ojo que a menudo sangran o presentan fugas de líquido. Eylea puede ayudar a estabilizar y, en muchos casos, a mejorar la pérdida de visión producida por la DMAE exudativa, OVCR, ORVR, EMD y NVC miópica.
2. Qué necesita saber antes de que le administren Eylea No le deben administrar Eylea:
- si es alérgico a aflibercept o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- si tiene una infección activa o sospecha que pueda tener una infección en el ojo o a su alrededor (infección ocular o periocular)
- si padece una inflamación grave del ojo (indicada por dolor o enrojecimiento).
Advertencias y precauciones
Consulte a su médico antes de que le administren Eylea:
- Si sufre glaucoma.
flotantes o si de repente aumenta el las cuatro semanas previas o en las ORVR isquémicas), no está
- Si tiene antecedentes de visión de destellos de luz o partículas tamaño y número de partículas flotantes.
- Si le han operado o tiene programada una cirugía en su ojo en cuatro semanas siguientes.
- Si padece una forma grave de OVCR o bien ORVR (OVCR u recomendado el tratamiento con Eylea.
Además, es importante que sepa que:
- La seguridad y eficacia de Eylea cuando se administra en ambos ojos a la vez no se ha estudiado y si se utiliza de esta forma puede dar lugar a un mayor riesgo de que se produzcan efectos adversos.
- Las inyecciones de Eylea pueden producir un aumento de la presión dentro del ojo (presión intraocular) en algunos pacientes en los 60 minutos siguientes a la inyección. Su médico le realizará un seguimiento después de cada inyección.
- Si desarrolla una infección o inflamación en la parte interna del ojo (endoftalmitis) u otras complicaciones, puede notar dolor o un aumento de las molestias en el ojo, un empeoramiento del enrojecimiento ocular, visión borrosa o disminuida y aumento de la sensibilidad a la luz. Es importante que todo síntoma que aparezca se diagnostique y se trate lo antes posible.
- Su médico comprobará si tiene otros factores de riesgo que puedan aumentar la posibilidad de que se produzca un desgarro o un desprendimiento de las capas posteriores del ojo (desgarro o desprendimiento de retina, o bien un desgarro o desprendimiento del epitelio pigmentario de la retina) en cuyo caso Eylea se le administrará con precaución.
- Eylea no se debe utilizar durante el embarazo, a menos que el beneficio potencial supere el riesgo potencial para el feto.
- Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento y durante al menos tres meses más después de la ultima inyección de Eylea.
El uso sistémico de inhibidores del VEGF, sustancias parecidas a las que contiene Eylea, está potencialmente relacionado con el riesgo de bloqueo de los vasos sanguíneos por coágulos de sangre (acontecimientos tromboembólicos arteriales) que pueden dar lugar a un infarto de miocardio o un accidente cerebrovascular. Tras la inyección de Eylea en el ojo, existe un riesgo teórico de que se puedan producir estos acontecimientos. Los datos sobre la seguridad del tratamiento de pacientes con OVCR, ORVR, EMD y NVC miópica que han sufrido un accidente cerebrovascular, un accidente cerebrovascular transitorio (ataque isquémico transitorio), o bien un infarto de miocardio en los últimos 6 meses son limitados. Si alguno de estos casos le aplica, se le administrará Eylea con precaución.
La experiencia es solo limitada en el tratamiento de:
- Pacientes con EMD debido a diabetes de tipo I.
(Hemoglobina glicosilada conocida como retinopatía
- Pacientes diabéticos con valores medios de azúcar en sangre muy elevados superior al 12%).
- Pacientes diabéticos con una enfermedad ocular provocada por la diabetes, diabética proliferativa.
No existe experiencia en el tratamiento de:
- Pacientes con infecciones agudas.
- Pacientes con otras enfermedades oculares como desprendimiento de retina o agujero macular.
- Pacientes diabéticos con hipertensión no controlada.
- Pacientes no asiáticos con NVC miópica.
- Pacientes que han sido tratados anteriormente por una NVC miópica.
- Pacientes con daños fuera de la parte central de la mácula (lesiones extrafoveales) debido a una NVC miópica.
Si algo de lo anterior le sucede, su médico tendrá en cuenta esta falta de información en el momento de tratarle con Eylea.
Niños y adolescentes
No se ha estudiado el uso de Eylea en niños y adolescentes menores de 18 años, porque la DMAE exudativa, la OVCR, ORVR, EMD y la NVC miópica ocurren principalmente en adultos. Por tanto, no procede su uso en este grupo de edad.
Uso de Eylea con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
- Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento y durante al menos tres meses más después de la ultima inyección de Eylea.
- No hay experiencia con el uso de Eylea en mujeres embarazadas. No se debe utilizar Eylea durante el embarazo a menos que el beneficio potencial supere al riesgo potencial para el feto. Si está embarazada o tiene intención de quedarse embarazada, coméntelo con su médico antes del tratamiento con Eylea.
- No se recomienda el uso de Eylea durante la lactancia, porque se desconoce si Eylea pasa a la leche materna. Consulte a su médico antes de iniciar el tratamiento con Eylea.
Conducción y uso de máquinas
Después de la inyección de Eylea puede experimentar algunas alteraciones visuales transitorias. No conduzca ni use máquinas mientras duren estas alteraciones.
Información importante sobre algunos de los componentes de Eylea
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, por lo que se considera esencialmente “exento de sodio”.
3. Cómo se le administrará Eylea
Eylea le será administrado por un médico con experiencia en la administración de inyecciones oculares, en condiciones asépticas (de limpieza y estériles).
La dosis recomendada es de 2 mg de aflibercept (50 microlitros).
Eylea se administra en forma de inyección en el interior del ojo (inyección intravítrea).
Antes de la inyección, su médico utilizará un lavado ocular desinfectante para limpiar cuidadosamente su ojo para prevenir una infección. Su médico también le administrará un anestésico local para reducir o prevenir cualquier dolor que pudiera sentir con la inyección.
DMAE exudativa
Los pacientes con DMAE exudativa se tratarán con una inyección mensual para las tres primeras dosis, seguido de una inyección cada dos meses.
Tras los 12 primeros meses de tratamiento con Eylea, el intervalo entre tratamientos puede ampliarse hasta cada tres meses, en función de la exploración realizada por su médico.
No es necesario que su médico le visite entre inyecciones, a menos que su médico considere lo contrario o usted experimente algún problema.
Edema macular secundario a OVR (de rama o central)
Su médico determinará el programa de tratamiento más adecuado para usted. Su tratamiento se iniciará con una serie de inyecciones de Eylea administradas una vez al mes.
El intervalo entre dos inyecciones no debe ser inferior a un mes.
Su médico podrá decidir interrumpir el tratamiento con Eylea si no se beneficia del tratamiento continuado.
El tratamiento continuará con una inyección una vez al mes hasta que su enfermedad se estabilice. Puede necesitar tres o más inyecciones mensuales.
Su médico controlará su respuesta al tratamiento y podrá continuar el tratamiento, incrementando de forma gradual el intervalo entre las inyecciones para estabilizar su enfermendad. En caso de empeoramiento con un intervalo entre tratamientos más largo, su médico reducirá el intervalo entre inyecciones.
En función de su respuesta al tratamiento, su médico decidirá el programa de seguimiento y tratamiento.
Edema macular diabético (EMD)
Los pacientes con EMD se tratarán con una inyección mensual para las cinco primeras dosis consecutivas, y a continuación, una inyección cada dos meses.
No es necesario que su médico le visite entre inyecciones, a menos que usted experimente algún problema o que su médico lo considere necesario.
Tras los 12 primeros meses de tratamiento con Eylea, el intervalo entre tratamientos puede ampliarse en función de la exploración realizada por su médico. Su médico decidirá el programa de visitas de seguimiento.
Su médico podrá decidir la interrupción del tratamiento con Eylea si comprueba que usted no se beneficia del tratamiento continuado.
Neovascularización coroidea (NVC) miópica
Los pacientes con NVC miópica serán tratados con una sola inyección. Solamente recibirá más inyecciones si las exploraciones de su médico revelan que su enfermedad no ha mejorado.
El intervalo entre dos inyecciones no debe ser inferior a un mes.
Si su enfermedad desaparece y luego regresa, su médico puede reiniciar el tratamiento. Su médico decidirá sobre el programa de revisiones de seguimiento.
Si no se le administra una dosis de Eylea
Pida una nueva cita para que le examinen y le administren la inyección.
Interrupción del tratamiento con Eylea
Consulte a su médico antes de interrumpir el tratamiento.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Potencialmente podrían producirse reacciones alérgicas (hipersensibilidad). Estas pueden ser graves y requerir que se ponga en contacto con su médico inmediatamente.
Con la administración de Eylea pueden producirse algunos efectos adversos que afectan a los ojos que son debidos al procedimiento de inyección. Algunos pueden ser graves, incluyendo ceguera, una infección grave o inflamación en el interior del ojo (endoftalmitis), desprendimiento, desgarro o hemorragia de la capa sensible a la luz en la parte posterior del ojo (desprendimiento o desgarro de la retina), enturbiamiento del cristalino (catarata), hemorragia en el ojo (hemorragia vítrea), desprendimiento de la sustancia similar a un gel que se encuentra en el interior del ojo en contacto con la retina (desprendimiento de vítreo) y aumento de la presión en el interior del ojo (ver sección 2). Estos efectos adversos graves que afectan a los ojos se produjeron en menos de 1 de 1.900 inyecciones durante los ensayos clínicos.
Si nota una disminución repentina de la visión o un aumento del dolor y sangrado en el ojo después de la inyección, consulte inmediatamente a su médico.
Lista de los efectos adversos comunicados
A continuación se incluye una lista de los efectos adversos comunicados como posiblemente relacionados con el procedimiento de inyección o con el medicamento. No debe alarmarse, ya que puede que usted no experimente ninguno de ellos. Consulte siempre con su médico acerca de cualquier sospecha de efecto adverso.
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10personas):
• deterioro de la visión
• sangre en el ojo debido al sangrado de pequeños vasos sanguíneos en las capas externas del ojo
• dolor ocular
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10personas):
• desprendimiento o desgarro de una de las capas de la parte posterior del ojo que producen destellos de luz con manchas flotantes que en ocasiones progresa a pérdida de visión (desgarro/desprendimiento del epitelio pigmentario de la retina*, desgarro/desprendimiento de la retina)
• degeneración de la retina (que causa alteraciones de la visión)
• sangrado en el ojo (hemorragia vítrea)
• ciertas formas de enturbiamiento del cristalino (catarata)
• daños en la capa superficial del globo ocular (la córnea)
• aumento de la presión en el interior del ojo
• manchas en la visión (partículas flotantes)
• desprendimiento de la sustancia similar a un gel que se encuentra en el interior del ojo de la retina (desprendimiento vitreo, que resulta en destellos de luz con manchas flotantes)
• sensación de tener algo dentro del ojo
• aumento de la producción de lágrimas
• hinchazón del párpado
• sangrado en el lugar de inyección
• enrojecimiento del ojo
*) Efectos adversos que se sabe están asociados a la DMAE exudativa; observados únicamente en pacientes con DMAE exudativa.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100personas):
• reacciones alérgicas (hipersensibilidad)**
• inflamación o infección grave dentro del ojo (endoftalmitis)
• inflamación del iris o de otras partes del ojo (iritis, uveítis, iridociclitis, células flotantes en la cámara
anterior)
• sensación anormal en el ojo
• irritación en el párpado
• hinchazón de la capa superficial del globo ocular (córnea)
** Se notificaron reacciones alérgicas como erupción, picor (prurito), ronchas (urticaria) y algunos casos de reacciones alérgicas (anafilácticas/anafilactoides) graves.
Efectos adversos raros (pueden afectar hasta 1 de cada 1.000 personas)
• ceguera
• enturbiamiento del cristalino debido a lesión (catarata traumática)
• inflamación de la sustancia similar a un gel que se encuentra en el interior del ojo
• pus en el ojo
En los ensayos clínicos se observó un aumento de la incidencia de sangrado de los vasos sanguíneos pequeños en las capas externas del ojo (hemorragia conjuntival) en pacientes con DMAE exudativa que recibían tratamiento con medicamentos anticoagulantes. Este aumento de la incidencia fue comparable en los pacientes tratados con ranibizumab y con Eylea.
El uso de inhibidores del VEGF por vía sistémica, sustancias similares a las contenidas en Eylea, está potencialmente relacionado con el riesgo de formación de coágulos de sangre que bloquean los vasos sanguíneos (eventos tromboembólicos arteriales) que pueden producir un ataque al corazón o una embolia. Hay un riesgo teórico de que pueda producirse este tipo de eventos después de la inyección de Eylea en el ojo.
Al igual que con todas las proteínas terapéuticas, existe la posibilidad de una reacción inmune (formación de anticuerpos) con Eylea.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Eylea
• Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta después de “CAD/EXP”. La fecha de caducidad es el último día del mes que se indica.
• Conservar en nevera (entre 2°C y 8°C). No congelar.
• Antes del uso, el blister sin abrir puede conservarse a temperatura ambiente (por debajo de 25°C) durante un máximo de 24 horas.
• Conservar el blister con la jeringa precargada en la caja para protegerlo de la luz.
• Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Eylea
- El principio activo es: aflibercept. Una jeringa precargada contiene 90 microlitros, equivalente a
3,6 mg de aflibercept. Una jeringa precargada proporciona una dosis de 2 mg de aflibercept en 50 microlitros.
- Los demás componentes son: polisorbato 20, dihidrógenofosfato de sodio monohidrato (para el ajuste del pH), hidrogenofosfato de disodio heptahidrato (para el ajuste del pH), cloruro de sodio, sacarosa, agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Eylea es una solución inyectable (inyectable) en una jeringa precargada (3,6 mg/90 microlitros). La solución es de incolora a amarillo pálido.
Envase con 1 jeringa precargada.
Titular de la autorización de comercialización
Bayer Pharma AG D-13342 Berlin Alemania
Responsable de la fabricación
GP Grenzach Produktions GmbH Emil-Barell-StraBe 7 D-79639 Grenzach-Wyhlen Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie / Belgique / Belgien Bayer SA-NV Tél/Tel: +32-(0)2-535 63 11 Etarapna Eañep Etarapna EOOfl Tea: +359-(0)2-81 401 01 Ceská republika Bayer s.r.o. Tel: +420-266 101 111 Danmark Bayer A/S Tlf: +45-45 235 000 Deutschland Bayer Vital GmbH Tel: +49-(0)214-30 513 48 Eesti Bayer OÜ Tel: +372-655 85 65 EXXáóa Bayer EAAág ABEE Tr|^: +30-210-618 75 00 España Bayer Hispania S.L. Tel: +34-93-495 65 00 France Bayer HealthCare Tél (N° vert): +33-(0)800 87 54 54 Hrvatska Bayer d.o.o. Tel: + 385-(0)1-6599 900 Ireland Bayer Limited Tel: +353-(0)1-2999 313 Ísland Icepharma hf. Sími: +354-540 80 00 Italia Bayer S.p.A. Tel: +39-02-3978 1 Kúnpoq NOVAGEM Limited Tr|^: +357-22-48 38 58 Latvija SIA Bayer Tel: +371-67 84 55 63 |
Lietuva UAB Bayer Tel: +370-5-233 68 68 Luxembourg / Luxemburg Bayer SA-NV Tél/Tel: +32-(0)2-535 63 11 Magyarország Bayer Hungária KFT Tel: +36-1-487 4100 Malta Alfred Gera and Sons Ltd. Tel: +356-21 44 62 05 Nederland Bayer B.V. Tel: +31-(0)297-28 06 66 Norge Bayer AS Tlf: +47-23 13 05 00 Osterreich Bayer Austria Ges. m. b. H. Tel: +43-(0)1 -711 460 Polska Bayer Sp. z o.o. Tel: +48-22-572 35 00 Portugal Bayer Portugal, Lda. Tel: +351-21-416 42 00 Romania SC Bayer SRL Tel: +40-(0)21-528 59 00 Slovenija Bayer d. o. o. Tel: +386-(0)1-58 14 400 Slovenská republika Bayer, spol. s r.o. Tel: +421-(0)2-59 21 31 11 Suomi/Finland Bayer Oy Puh/Tel: +358-(0)20-78521 Sverige Bayer AB Tel: +46-(0)8-580 223 00 United Kingdom Bayer plc Tel: +44-(0)1635-563000 |
Fecha de la última revisión de este prospecto: {MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
<..........................................................................................................................
Esta información está destinada únicamente a profesionales del sector sanitario:
Cada jeringa precargada debe utilizarse para el tratamiento de un solo ojo.
No abrir el blíster con la jeringa precargada estéril fuera de la sala limpia.
Antes de la administración, la solución debe inspeccionarse visualmente para detectar la presencia de
partículas, un cambio de color o cualquier cambio en el aspecto físico. Si observa cualquiera de ellos, no
utilice el medicamento.
Antes del uso, el blíster sin abrir de Eylea puede conservarse a temperatura ambiente (por debajo de 25°C)
durante un máximo de 24 horas. Tras la apertura del blister, proceda bajo condiciones asépticas.
Para la inyección intravítrea debe usarse una aguja de inyección de 30 G x pulgada (1,27 cm).
Instrucciones de uso de la jeringa precargada:
1. Cuando esté preparado para administrar Eylea, abra la caja y extraiga el blíster esterilizado. Despegue cuidadosamente la lámina del blíster, asegurando la esterilidad de su contenido. Mantenga la jeringa en la bandeja estéril hasta que esté listo para el ensamblaje.
2. Utilizando una técnica aséptica, extraer la jeringa del envase de blíster esterilizado.

3. Para retirar la cápsula de cierre de la j eringa, mantener la jeringa con una mano mientras se utiliza la otra para coger la cápsula de cierre entre el índice y el pulgar. Nota importante: debe tirar y desprender la cápsula de cierre de un tirón (no la gire ni la retuerza).
4. Para no poner en peligro la esterilidad del medicamento, no tirar del émbolo hacia atrás.

5. Utilizando una técnica aséptica, encaj ar firmemente la aguja de inyección en la punta de la jeringa con el adaptador Luer Lock realizando un movimiento giratorio.
6. Mantener la j eringa con la aguj a apuntando hacia arriba y comprobar que no hay burbujas en su interior. Si hubiera burbujas, golpear suavemente la jeringa con el dedo hasta que asciendan a su parte superior.
7. Para eliminar todas las burbujas y expulsar el exceso de medicamento, apretar lentamente el émbolo hasta alinear la base cilíndrica de la parte en forma de cúpula del émbolo con la línea de dosificación negra de la jeringa (equivalente a 50 microlitros).


8. La jeringa precargada es para un solo uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Prospecto: Información para el paciente
Eylea 40 mg/ml solución inyectable en vial
Aflibercept
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Eylea y para qué se utiliza
2. Qué necesita saber antes de que le administren Eylea
3. Cómo se le administrará Eylea
4. Posibles efectos adversos
5. Conservación de Eylea
6. Contenido del envase e información adicional
1. Qué es Eylea y para qué se utiliza
Eylea es una solución que se inyecta en el ojo para tratar unas enfermedades oculares en pacientes adultos, denominadas
- degeneración macular asociada a la edad neovascular (exudativa) comunmente conocida como DMAE exudativa
- alteración de la visión debida al edema macular a causa de un bloqueo de las venas retinianas (oclusión de la vena central de la retina (OVCR) o de la rama venosa de la retina (ORVR))
- alteración de la visión debida al edema macular diabético (EMD)
- alteración de la visión debida a la neovascularización coroidea miópica (NVC miópica).
Aflibercept, el principio activo de Eylea, bloquea la actividad de un grupo de factores denominados factor de crecimiento endotelial vascular A (VEGF-A) y factor de crecimiento placentario (PlGF).
En pacientes con DMAE exudativa y NVC miópica, cuando estos factores existen en cantidad excesiva influyen en la formación anómala de nuevos vasos sanguíneos en el ojo. Estos nuevos vasos sanguíneos pueden causar una fuga de los componentes de la sangre hacia el interior del ojo, con el consiguiente daño en los tejidos oculares responsables de la visión.
En pacientes con OVCR, se produce un bloqueo de la vena principal que transporta sangre desde la retina. A causa de ello, los niveles de VEGF aumentan causando la fuga de fluido en la retina y por tanto, la hinchazón de la mácula (la parte de la retina responsable de la visión fina), lo cual se conoce como edema macular. Cuando la mácula se llena de líquido, la visión central se vuelve borrosa.
En pacientes con ORVR, se produce un bloqueo de una o más ramas del vaso sanguíneo principal que transporta sangre desde la retina. A causa de ello, los niveles de VEGF aumentan causando la fuga de líquido en la retina y, por tanto, la hinchazón de la mácula.
El edema macular diabético es una hinchazón de la retina que se produce en pacientes con diabetes debido a la fuga de líquido de los vasos sanguíneos de la mácula. La mácula es la parte de la retina responsable de la visión fina. Cuando la mácula se hincha de líquido, la visión central se vuelve borrosa.
Eylea ha demostrado detener el crecimiento de los nuevos vasos sanguíneos anómalos en el ojo que a menudo sangran o presentan fugas de líquido. Eylea puede ayudar a estabilizar y, en muchos casos, a mejorar la pérdida de visión producida por la DMAE exudativa, OVCR, ORVR, EMD y NVC miópica.
2. Qué necesita saber antes de que le administren Eylea No le deben administrar Eylea:
- si es alérgico a aflibercept o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- si tiene una infección activa o sospecha que pueda tener una infección en el ojo o a su alrededor (infección ocular o periocular)
- si padece una inflamación grave del ojo (indicada por dolor o enrojecimiento).
Advertencias y precauciones
Consulte a su médico antes de que le administren Eylea:
- Si sufre glaucoma.
flotantes o si de repente aumenta el las cuatro semanas previas o en las ORVR isquémicas), no está
- Si tiene antecedentes de visión de destellos de luz o partículas tamaño y número de partículas flotantes.
- Si le han operado o tiene programada una cirugía en su ojo en cuatro semanas siguientes.
- Si padece una forma grave de OVCR o bien ORVR (OVCR u recomendado el tratamiento con Eylea.
Además, es importante que sepa que:
- La seguridad y eficacia de Eylea cuando se administra en ambos ojos a la vez no se ha estudiado y si se utiliza de esta forma puede dar lugar a un mayor riesgo de que se produzcan efectos adversos.
- Las inyecciones de Eylea pueden producir un aumento de la presión dentro del ojo (presión intraocular) en algunos pacientes en los 60 minutos siguientes a la inyección. Su médico le realizará un seguimiento después de cada inyección.
- Si desarrolla una infección o inflamación en la parte interna del ojo (endoftalmitis) u otras complicaciones, puede notar dolor o un aumento de las molestias en el ojo, un empeoramiento del enrojecimiento ocular, visión borrosa o disminuida y aumento de la sensibilidad a la luz. Es importante que todo síntoma que aparezca se diagnostique y se trate lo antes posible.
- Su médico comprobará si tiene otros factores de riesgo que puedan aumentar la posibilidad de que se produzca un desgarro o un desprendimiento de las capas posteriores del ojo (desgarro o desprendimiento de retina, o bien un desgarro o desprendimiento del epitelio pigmentario de la retina) en cuyo caso Eylea se le administrará con precaución.
- Eylea no se debe utilizar durante el embarazo, a menos que el beneficio potencial supere el riesgo potencial para el feto.
- Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento y durante al menos tres meses más después de la ultima inyección de Eylea.
El uso sistémico de inhibidores del VEGF, sustancias parecidas a las que contiene Eylea, está potencialmente relacionado con el riesgo de bloqueo de los vasos sanguíneos por coágulos de sangre (acontecimientos tromboembólicos arteriales) que pueden dar lugar a un infarto de miocardio o un accidente cerebrovascular. Tras la inyección de Eylea en el ojo, existe un riesgo teórico de que se puedan producir estos acontecimientos. Los datos sobre la seguridad del tratamiento de pacientes con OVCR, ORVR, EMD y NVC miópica que han sufrido un accidente cerebrovascular, un accidente cerebrovascular transitorio (ataque isquémico transitorio), o bien un infarto de miocardio en los últimos 6 meses son limitados. Si alguno de estos casos le aplica, se le administrará Eylea con precaución.
La experiencia es solo limitada en el tratamiento de:
- Pacientes con EMD debido a diabetes de tipo I.
(Hemoglobina glicosilada conocida como retinopatía
- Pacientes diabéticos con valores medios de azúcar en sangre muy elevados superior al 12%).
- Pacientes diabéticos con una enfermedad ocular provocada por la diabetes, diabética proliferativa.
No existe experiencia en el tratamiento de:
- Pacientes con infecciones agudas.
- Pacientes con otras enfermedades oculares como desprendimiento de retina o agujero macular.
- Pacientes diabéticos con hipertensión no controlada.
- Pacientes no asiáticos con NVC miópica.
- Pacientes que han sido tratados anteriormente por una NVC miópica.
- Pacientes con daños fuera de la parte central de la mácula (lesiones extrafoveales) debido a una NVC miópica.
Si algo de lo anterior le sucede, su médico tendrá en cuenta esta falta de información en el momento de tratarle con Eylea.
Niños y adolescentes
No se ha estudiado el uso de Eylea en niños y adolescentes menores de 18 años, porque la DMAE exudativa, la OVCR, ORVR, EMD y la NVC miópica ocurren principalmente en adultos. Por tanto, no procede su uso en este grupo de edad.
Uso de Eylea con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
- Las mujeres en edad fértil deben utilizar métodos anticonceptivos durante el tratamiento y durante al menos tres meses más después de la ultima inyección de Eylea.
- No hay experiencia con el uso de Eylea en mujeres embarazadas. No se debe utilizar Eylea durante el embarazo a menos que el beneficio potencial supere al riesgo potencial para el feto. Si está embarazada o tiene intención de quedarse embarazada, coméntelo con su médico antes del tratamiento con Eylea.
- No se recomienda el uso de Eylea durante la lactancia, porque se desconoce si Eylea pasa a la leche materna. Consulte a su médico antes de iniciar el tratamiento con Eylea.
Conducción y uso de máquinas
Después de la inyección de Eylea puede experimentar algunas alteraciones visuales transitorias. No conduzca ni use máquinas mientras duren estas alteraciones.
Información importante sobre algunos de los componentes de Eylea
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, por lo que se considera esencialmente “exento de sodio”.
3. Cómo se le administrará Eylea
Eylea le será administrado por un médico con experiencia en la administración de inyecciones oculares, en condiciones asépticas (de limpieza y estériles).
La dosis recomendada es de 2 mg de aflibercept (50 microlitros).
Eylea se administra en forma de inyección en el interior del ojo (inyección intravítrea).
Antes de la inyección, su médico utilizará un lavado ocular desinfectante para limpiar cuidadosamente su ojo para prevenir una infección. Su médico también le administrará un anestésico local para reducir o prevenir cualquier dolor que pudiera sentir con la inyección.
DMAE exudativa
Los pacientes con DMAE exudativa se tratarán con una inyección mensual para las tres primeras dosis, seguido de una inyección cada dos meses.
Tras los 12 primeros meses de tratamiento con Eylea, el intervalo entre tratamientos puede ampliarse hasta cada tres meses, en función de la exploración realizada por su médico.
No es necesario que su médico le visite entre inyecciones, a menos que su médico considere lo contrario o usted experimente algún problema.
Edema macular secundario a OVR (de rama o central)
Su médico determinará el programa de tratamiento más adecuado para usted. Su tratamiento se iniciará con una serie de inyecciones de Eylea administradas una vez al mes.
El intervalo entre dos inyecciones no debe ser inferior a un mes.
Su médico podrá decidir interrumpir el tratamiento con Eylea si no se beneficia del tratamiento continuado.
El tratamiento continuará con una inyección una vez al mes hasta que su enfermedad se estabilice. Puede necesitar tres o más inyecciones mensuales.
Su médico controlará su respuesta al tratamiento y podrá continuar el tratamiento, incrementando de forma gradual el intervalo entre las inyecciones para estabilizar su enfermendad. En caso de empeoramiento con un intervalo entre tratamientos más largo, su médico reducirá el intervalo entre inyecciones.
En función de su respuesta al tratamiento, su médico decidirá el programa de seguimiento y tratamiento.
Edema macular diabético (EMD)
Los pacientes con EMD se tratarán con una inyección mensual para las cinco primeras dosis consecutivas, y a continuación, una inyección cada dos meses.
No es necesario que su médico le visite entre inyecciones, a menos que usted experimente algún problema o que su médico lo considere necesario.
Tras los 12 primeros meses de tratamiento con Eylea, el intervalo entre tratamientos puede ampliarse en función de la exploración realizada por su médico. Su médico decidirá el programa de visitas de seguimiento.
Su médico podrá decidir la interrupción del tratamiento con Eylea si comprueba que usted no se beneficia del tratamiento continuado.
Neovascularización coroidea (NVC) miópica
Los pacientes con NVC miópica serán tratados con una sola inyección. Solamente recibirá más inyecciones si las exploraciones de su médico revelan que su enfermedad no ha mejorado.
El intervalo entre dos inyecciones no debe ser inferior a un mes.
Si su enfermedad desaparece y luego regresa, su médico puede reiniciar el tratamiento.
Su médico decidirá sobre el programa de revisiones de seguimiento.
Si no se le administra una dosis de Eylea
Pida una nueva cita para que le examinen y le administren la inyección.
Interrupción del tratamiento con Eylea
Consulte a su médico antes de interrumpir el tratamiento.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Potencialmente podrían producirse reacciones alérgicas (hipersensibilidad). Estas pueden ser graves y requerir que se ponga en contacto con su médico inmediatamente.
Con la administración de Eylea pueden producirse algunos efectos adversos que afectan a los ojos que son debidos al procedimiento de inyección. Algunos pueden ser graves, incluyendo ceguera, una infección grave o inflamación en el interior del ojo (endoftalmitis), desprendimiento, desgarro o hemorragia de la capa sensible a la luz en la parte posterior del ojo (desprendimiento o desgarro de la retina), enturbiamiento del cristalino (catarata), hemorragia en el ojo (hemorragia vítrea), desprendimiento de la sustancia similar a un gel que se encuentra en el interior del ojo en contacto con la retina (desprendimiento de vítreo) y aumento de la presión en el interior del ojo (ver sección 2). Estos efectos adversos graves que afectan a los ojos se produjeron en menos de 1 de 1.900 inyecciones durante los ensayos clínicos.
Si nota una disminución repentina de la visión o un aumento del dolor y sangrado en el ojo después de la inyección, consulte inmediatamente a su médico.
Lista de los efectos adversos comunicados
A continuación se incluye una lista de los efectos adversos comunicados como posiblemente relacionados con el procedimiento de inyección o con el medicamento. No debe alarmarse, ya que puede que usted no experimente ninguno de ellos. Consulte siempre con su médico acerca de cualquier sospecha de efecto adverso.
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10personas):
• deterioro de la visión
• sangre en el ojo debido al sangrado de pequeños vasos sanguíneos en las capas externas del ojo
• dolor ocular
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10personas):
• desprendimiento o desgarro de una de las capas de la parte posterior del ojo que producen destellos de luz con manchas flotantes que en ocasiones progresa a pérdida de visión (desgarro/desprendimiento del epitelio pigmentario de la retina*, desgarro/desprendimiento de la retina)
• degeneración de la retina (que causa alteraciones de la visión)
• sangrado en el ojo (hemorragia vítrea)
• ciertas formas de enturbiamiento del cristalino (catarata)
• daños en la capa superficial del globo ocular (la córnea)
• aumento de la presión en el interior del ojo
• manchas en la visión (partículas flotantes)
• desprendimiento de la sustancia similar a un gel que se encuentra en el interior del ojo de la retina (desprendimiento vítreo, que resulta en destellos de luz con manchas flotantes)
• sensación de tener algo dentro del ojo
• aumento de la producción de lágrimas
• hinchazón del párpado
• sangrado en el lugar de inyección
• enrojecimiento del ojo
*) Efectos adversos que se sabe están asociados a la DMAE exudativa; observados únicamente en pacientes con DMAE exudativa.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100personas):
• reacciones alérgicas (hipersensibilidad)**
• inflamación o infección grave dentro del ojo (endoftalmitis)
• inflamación del iris o de otras partes del ojo (iritis, uveítis, iridociclitis, células flotantes en la cámara
anterior)
• sensación anormal en el ojo
• irritación en el párpado
• hinchazón de la capa superficial del globo ocular (córnea)
** Se notificaron reacciones alérgicas como erupción, picor (prurito), ronchas (urticaria) y algunos casos de reacciones alérgicas (anafilácticas/anafilactoides) graves.
Efectos adversos raros (pueden afectar hasta 1 de cada 1.000 personas)
• ceguera
• enturbiamiento del cristalino debido a lesión (catarata traumática)
• inflamación de la sustancia similar a un gel que se encuentra en el interior del ojo
• pus en el ojo
En los ensayos clínicos se observó un aumento de la incidencia de sangrado de los vasos sanguíneos pequeños en las capas externas del ojo (hemorragia conjuntival) en pacientes con DMAE exudativa que recibían tratamiento con medicamentos anticoagulantes. Este aumento de la incidencia fue comparable en los pacientes tratados con ranibizumab y con Eylea.
El uso de inhibidores del VEGF por vía sistémica, sustancias similares a las contenidas en Eylea, está potencialmente relacionado con el riesgo de formación de coágulos de sangre que bloquean los vasos sanguíneos (eventos tromboembólicos arteriales) que pueden producir un ataque al corazón o una embolia. Hay un riesgo teórico de que pueda producirse este tipo de eventos después de la inyección de Eylea en el ojo.
Al igual que con todas las proteínas terapéuticas, existe la posibilidad de una reacción inmune (formación de anticuerpos) con Eylea.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Eylea
• Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta después de “CAD/EXP”. La fecha de caducidad es el último día del mes que se indica.
• Conservar en nevera (entre 2°C y 8°C). No congelar.
• Antes del uso, el vial sin abrir puede conservarse a temperatura ambiente (por debajo de 25°C) durante un máximo de 24 horas.
• Conservar el vial en la caja para protegerlo de la luz.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Eylea
- El principio activo es: aflibercept. Un vial contiene 100 microlitros, equivalente a 4 mg de aflibercept. Un vial proporciona una dosis de 2 mg de aflibercept en 50 microlitros.
- Los demás componentes son: polisorbato 20, dihidrógenofosfato de sodio monohidrato (para el ajuste de pH), hidrogenofosfato de disodio heptahidrato (para el ajuste de pH), cloruro de sodio, sacarosa, agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Eylea es una solución inyectable (inyectable) en vial (4 mg/100 microlitros). La solución es de incolora a amarillo pálido.
Envase con 1 vial.
Titular de la autorización de comercialización
Bayer Pharma AG D-13342 Berlin Alemania
Responsable de la fabricación
Bayer Pharma AG MüllerstraBe 178 D-13353 Berlin Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie / Belgique / Belgien Bayer SA-NV Tél/Tel: +32-(0)2-535 63 11 Etarapna Eañep Etarapna EOOfl Tea: +359-(0)2-81 401 01 Ceská republika Bayer s.r.o. Tel: +420-266 101 111 Danmark Bayer A/S Tlf: +45-45 235 000 Deutschland Bayer Vital GmbH Tel: +49-(0)214-30 513 48 Eesti Bayer OÜ Tel: +372-655 85 65 EXXáóa Bayer EAAág ABEE Tr|^: +30-210-618 75 00 España Bayer Hispania S.L. Tel: +34-93-495 65 00 France Bayer HealthCare Tél (N° vert): +33-(0)800 87 54 54 Hrvatska Bayer d.o.o. Tel: + 385-(0)1-6599 900 Ireland Bayer Limited Tel: +353-(0)1-2999 313 Ísland Icepharma hf. Sími: +354-540 80 00 Italia Bayer S.p.A. Tel: +39-02-3978 1 Kúnpoq NOVAGEM Limited Tr|^: +357-22-48 38 58 Latvija SIA Bayer Tel: +371-67 84 55 63 |
Lietuva UAB Bayer Tel: +370-5-233 68 68 Luxembourg / Luxemburg Bayer SA-NV Tél/Tel: +32-(0)2-535 63 11 Magyarország Bayer Hungária KFT Tel: +36-1-487 4100 Malta Alfred Gera and Sons Ltd. Tel: +356-21 44 62 05 Nederland Bayer B.V. Tel: +31-(0)297-28 06 66 Norge Bayer AS Tlf: +47-23 13 05 00 Osterreich Bayer Austria Ges. m. b. H. Tel: +43-(0)1 -711 460 Polska Bayer Sp. z o.o. Tel: +48-22-572 35 00 Portugal Bayer Portugal, Lda. Tel: +351-21-416 42 00 Romania SC Bayer SRL Tel: +40-(0)21-528 59 00 Slovenija Bayer d. o. o. Tel: +386-(0)1-58 14 400 Slovenská republika Bayer, spol. s r.o. Tel: +421-(0)2-59 21 31 11 Suomi/Finland Bayer Oy Puh/Tel: +358-(0)20-78521 Sverige Bayer AB Tel: +46-(0)8-580 223 00 United Kingdom Bayer plc Tel: +44-(0)1635-563000 |
Fecha de la última revisión de este prospecto: {MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
<..........................................................................................................................
Esta información está destinada únicamente a profesionales del sector sanitario:
Cada vial debe utilizarse para el tratamiento de un solo ojo.
Antes de la administración, la solución debe inspeccionarse visualmente para detectar la presencia de partículas, un cambio de color o cualquier cambio en el aspecto físico. Si observa cualquiera de ellos, no utilice el medicamento.
Antes del uso, el vial sin abrir de Eylea puede conservarse a temperatura ambiente (por debajo de 25°C) durante un máximo de 24 horas. Tras la apertura del vial, proceda bajo condiciones asépticas.
Para la inyección intravítrea debe usarse una aguja de inyección de 30 G x pulgada (1,27 cm).
Instrucciones de uso del vial:
1.
Retirar la cápsula de cierre de plástico y desinfectar la parte externa del tapón de goma del vial.
2.
Acoplar la aguja de filtro de 5 micras y calibre 18 G suministrada en la caja a una jeringa estéril de 1 ml con adaptador Luer Lock.

3.
Empujar la aguja de filtro por el centro del tapón del vial hasta que la aguja esté completamente introducida en el vial y su extremo entre en contacto con el fondo o el borde inferior interno del vial.
4. Utilizando una técnica aséptica, traspasar la totalidad del contenido del vial de Eylea a la jeringa, manteniendo el vial en posición vertical y ligeramente inclinada para facilitar la extracción completa. Para evitar la introducción de aire, asegurar que el bisel de la aguja con filtro se sumerge en la solución. Continuar inclinando el vial durante la extracción manteniendo el bisel de la aguja con filtro sumergido en la solución.


Asegurar que el vástago del émbolo está suficientemente retirado hacia atrás cuando se vacíe el vial a fin de vaciar por completo la aguja de filtro.
6. Retirar la aguja de filtro y desechar de forma adecuada.
Nota: la aguja de filtro no debe emplearse para la inyección intravítrea.

7.
8.
Utilizando una técnica aséptica, acoplar firmemente una aguja de inyección de 30 G x pulgada (1,27 cm) a la punta de la jeringa con el adaptador Luer-Lock realizando un movimiento giratorio.
Mantener la jeringa con la aguja apuntando hacia arriba y comprobar que no hay burbujas en su interior. Si las hay, golpear suavemente la jeringa con el dedo hasta que éstas asciendan a su parte superior.
9. Eliminar todas las burbujas y expulsar el exceso de medicamento empujando
lentamente el émbolo de forma que su punta se alinee con la línea que indica 0,05 ml en la jeringa.
10


El vial es para un solo uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan
estado en contacto con él se realizará de acuerdo con la normativa local.
CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DE LAS
CONDICIONES
DE LAS AUTORIZACIONES DE COMERCIALIZACIÓN
Conclusiones científicas
Teniendo en cuenta lo dispuesto en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre los informes periódicos de seguridad (IPS) para aflibercept (indicado para degeneración macular exudativa y la oclusión de la vena central retiniana (OVCR)), las conclusiones científicas del Comité de Medicamentos de Uso Humano (CHMP) son las siguientes:
Durante el periodo poscomercialización, las notificaciones de reacciones de hipersensibilidad incluyeron erupción, prurito, urticaria y casos aislados de reacciones anafilácticas/anafilactoides graves. Los casos descritos incluyeron reexposición positiva, relación temporal estrecha con la administración de aflibercept y ausencia de causas alternativas. El PRAC consideró que, de acuerdo a la evidencia observada durante el periodo poscomercialización, existe una asociación causal confirmada entre aflibercept y las reacciones de hipersensibilidad mencionadas anteriormente. Por tanto, en vista de los datos presentados en el IPS revisado, el PRAC consideró que los cambios en la información de producto de los medicamentos que contienen aflibercept estaban justificados.
El CHMP está de acuerdo con las conclusiones científicas del PRAC.
Motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
De acuerdo con las conclusiones científicas para aflibercept (indicado para degeneración macular exudativa y OVCR), el CHMP considera que el balance beneficio-riesgo del medicamento o medicamentos que contiene(n) aflibercept (indicado para degeneración macular exudativa y OVCR) no se modifica sujeto a los cambios propuestos en la información del producto.
El CHMP recomienda que se modifiquen las condiciones de la(s) autorización(es) de comercialización.
98
MAVC: Mejor agudeza visual corregida
ETDRS: Early Treatment Diabetic Retinopathy Study (estudio sobre el tratamiento precoz de la retinopatía diabética).
MC: media de los mínimos cuadrados derivados del análisis de la covarianza (ANCOVA).
CPP: conjunto por protocolo
Conjunto de análisis completos (CAC), traslación de la última observación disponible (TUOD) para todos los análisis, excepto para el porcentaje de pacientes con conservación de la agudeza visual en la semana 52, que se calcula en el CPP.
La diferencia es el valor del grupo tratado con Eylea menos el valor del grupo tratado con ranibizumab. Un valor positivo favorece a Eylea.
Intervalo de confianza (IC) calculado mediante aproximación normal.
Después del inicio del tratamiento con tres dosis mensuales.
Un intervalo de confianza que se encuentre completamente por encima de -10% indica una no inferioridad de Eylea con respecto a ranibizumab.