Emla 25 Mg/G + 25 Mg/G Crema Con Apositos

MINISTERIO
DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
íit |
k agencia española de 1 medicamentos y | productos sanitarios |
FICHA TECNICA
1.- NOMBRE DEL MEDICAMENTO
EMLA 25 mg/g + 25 mg/g crema con apósitos EMLA 25 mg/g + 25 mg/g crema
2.- COMPOSICION CUALITATIVA Y CUANTITATIVA
Cada gramo de crema contiene:
Lidocaína (D.O.E.)............................25 mg.
Prilocaína (D.O.E.)............................25 mg.
Para consultar la lista completa de excipientes ver sección 6.1.
3.- FORMA FARMACEUTICA
Crema blanca, suave e hidrófila.
Emla crema es un sistema de emulsión oleo-acuosa en la cual la fase oleosa consiste en una mezcla eutéctica de las formas base de lidocaína y prilocaína en la proporción 1:1.
4.- DATOS CLINICOS
4.1. Indicaciones terapéuticas
Emla Crema está indicada para la anestesia tópica de:
- la piel intacta, en intervenciones menores como punciones (por ej. inserción de catéteres o punciones para extracción de muestras de sangre) e intervenciones quirúrgicas superficiales.
- la mucosa genital en adultos, antes de intervenciones quirúrgicas superficiales o de anestesia por infiltración.
- úlceras en extremidades inferiores, para facilitar la limpieza mecánica/desbridamiento.
Correo electrónicoI
C/ CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Se atenderán exclusivamente incidencias informáticas sobre la aplicación CIMA (http://www.aemps.gob.es/cima)
4.2

Posología y forma de administración
Superficies/Edad Piel intacta
Adultos
Niños
Neonatos 0-2 meses(3) Lactantes 3-11 meses(3) Niños 1-5 años
Niños 6-11 años
Niños con dermatitis atópica
Indicación
Intervenciones dermatológicas menores p.e. inserción de agujas y tratamiento quirúrgico de lesiones localizadas.
Intervenciones dermatológicas sobre áreas grandes en un entorno hospitalario, por ejemplo, trasplante cutáneo.
Procedimientos dermatológicos en piel recién rasurada de zonas amplias del cuerpo, por ejemplo, depilación laser (autoaplicación por parte del paciente).
Intervenciones dermatológicas menores p.ej. inserción de una aguja y tratamiento quirúrgico de lesiones localizadas.
Antes de la extracción del molusco.
Aplicación_
Aplicar una capa gruesa de crema y cubrir con un apósito o vendaje oclusivo.
Aproximadamente 1,5 g/10 cm2.
2 g (aproximadamente medio tubo de 5 g) durante un tiempo de 1 a 5 horas. (1)
Aproximadamente 1,5-2 g/10 cm2 de EMLA durante un tiempo de 2 a 5 horas. (1)
Dosis máxima recomendada: 60g. Área tratada máxima recomendada: 600cm2 durante un mínimo de 1 hora, máximo 5 horas. (1)
Aprox. 1,0 g/10 cm2 durante 1 hora. (ver detalles a continuación).
Hasta 1,0 g y 10 cm2(2)
Hasta 2,0 g y 20 cm2 (4)
Hasta 10,0 g y 100 cm2 durante un tiempo de 1 a 5 horas. (1)
Hasta 20,0 g y 200 cm2 aplicados
durante un tiempo de 1 a 5 horas.
(1)
Tiempo de aplicación: 30 minutos.
E IGUALDAD_
Agencia española de medicamentos y productos sanitarios

|
Superficies/Edad |
Indicación |
Aplicación |
|
Mucosa genital Adultos |
Tratamiento quirúrgico de lesiones localizadas, por ejemplo, eliminación de verrugas genitales (condylomata acuminata) y antes de la inyección de anestésicos locales. |
Aproximadamente 5-10 g de EMLA durante 5-10 minutos(1). No se requiere vendaje oclusivo. Iniciar el procedimiento inmediatamente después de la retirada de la crema . |
|
Antes del raspado cervical. |
Administrar 10 g en los fórnices vaginales laterales durante 10 minutos. | |
|
Piel genital masculina Adultos |
Antes de la inyección de anestésicos locales. |
Aplicar una capa gruesa de EMLA (1 g/10 cm2) y cubrir con vendaje oclusivo durante 15 minutos. |
|
Piel genital femenina Adultos |
Antes de la inyección de anestésicos locales(7) |
Aplicar una capa gruesa de EMLA (1-2 g/10 cm2) y cubrir con vendaje oclusivo durante 60 minutos. |
|
Ulceras en extremidades inferiores Adultos |
Limpieza mecánica/ desbrida-miento de úlceras en extremidades inferiores. |
Aplicar una capa gruesa de crema, aproximadamente 1-2 g/10 cm2 hasta un total de 10 g sobre la(s) úlcera(s)(5)(6). Cubrir con un vendaje oclusivo. Tiempo de aplicación: de 30 a 60 minutos. La limpieza debería comenzar inmediatamente después de retirar la crema. |
1) Después de más de 5 horas de aplicación, la anestesia disminuye.
2) No se ha documentado un tiempo de aplicación superior a 1 hora.
3) Hasta disponer de datos clínicos adicionales, EMLA no deberá emplearse en lactantes de 0-12 meses de edad que reciben tratamiento con agentes inductores de metahemoglobinemia.
4) Después de la aplicación durante un periodo de hasta 4 horas sobre 16 cm2 no se ha observado un incremento clínicamente significativo en los niveles de metahemoglobinemia.
5) EMLA se ha empleado hasta 15 veces en el tratamiento de úlceras en extremidades inferiores durante un periodo de 1-2 meses sin pérdida de eficacia ni aumento en el número o gravedad de las reacciones adversas.
6) No se ha estudiado, con respecto a los niveles plasmáticos, la aplicación de una dosis mayor a 10 g (ver también el apartado 5.2.).
7) En la piel genital femenina, EMLA sola aplicada durante 60 ó 90 minutos no proporciona la anestesia suficiente para la termocauterización o diatermia de las verrugas genitales.
1 g de EMLA crema extraida de un tubo de 30 g es aproximadamente 3,5 cm.

El personal que frecuentemente aplique o retire EMLA debería asegurarse de evitar el contacto con la crema con el fin de prevenir el desarrollo de hipersensibilidad.
4.3. Contraindicaciones
- Hipersensibilidad a los anestésicos locales de tipo amida o a algún otro componente del producto.
4.4. Advertencias y precauciones especiales de empleo
Pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa o metahemoglobinemia congénita o idiopática son más susceptibles a mostrar signos de metahemoglobinemia inducida por el fármaco.
En niños/neonatos menores de 3 meses se observa comúnmente un incremento clínicamente no significativo y transitorio de los niveles plasmáticos de metahemoglobina hasta 12 horas después de la aplicación de EMLA.
Debido a los escasos datos de absorción de sustancias activas disponibles, EMLA no debería aplicarse sobre heridas abiertas (con la excepción de las úlceras en extremidades inferiores).
Los estudios no han sido capaces de demostrar la eficacia de EMLA cuando se empleó la lanceta en el talón de los neonatos.
EMLA no debería de aplicarse sobre la mucosa genital de niños debido a la falta de datos sobre la absorción de sustancias activas. Sin embargo, cuando se utiliza en neonatos para la circuncisión, se ha comprobado que una dosis de 1,0 g de EMLA en el prepucio es segura.
Se debería tener cuidado cuando se aplique EMLA en pacientes con dermatitis atópica. Puede ser suficiente un tiempo más corto de aplicación, de 15-30 minutos (ver el apartado 5.1.). En pacientes con dermatitis atópica, los tiempos de aplicación de más de 30 minutos pueden dar lugar a una mayor incidencia de reacciones vasculares locales, en especial el enrojecimiento del lugar de aplicación y en algunos casos petequias y púrpura (ver apartado 4.8, “Reacciones adversas”). Antes de la extracción del molusco en niños con dermatitis atópica, se recomienda aplicar crema durante 30 minutos.
Se debería tener especial precaución cuando EMLA crema se aplique en zonas próximas a los ojos, dado que puede causar irritación en los mismos. Igualmente, la pérdida de reflejos protectores puede originar irritación corneal y abrasión potencial. No obstante, si existe contacto ocular del producto, aclarar inmediatamente el ojo con agua o una solución de suero salino y protegerlo hasta la recuperación de la sensibilidad.
EMLA no debería aplicarse sobre la membrana del tímpano lesionada. Los ensayos con animales de laboratorio, han demostrado que EMLA tiene un efecto ototóxico cuando se aplica dentro del oído medio.
Los animales con la membrana del tímpano sana, sin embargo, no mostraron ninguna anomalía cuando se les aplicó EMLA en el canal auditivo externo.
Los pacientes en tratamiento con medicamentos antiarrítmicos clase III (por ejemplo, amiodarona) deberían permanecer estrechamente vigilados y considerarse la monitorización por electrocardiograma (ECG), debido a que los efectos cardiacos pueden ser aditivos.
Lidocaína y Prilocaína poseen propiedades bactericidas y antivirales en concentraciones superiores a 0,5-2%. Debido a ello, aunque un estudio clínico sugiere que la respuesta de inmunización no se ve afectada

cuando se emplea EMLA crema antes de la vacuna BCG, se monitorizarán los resultados de las inyecciones intracutáneas de vacunas de gérmenes vivos.
Se informa a los deportistas que este medicamento contiene dos componentes que pueden establecer un resultado analítico de control del dopaje como positivo.
Hasta que no se disponga de datos clínicos adicionales, EMLA no deberá utilizarse en los siguientes casos:
- En lactantes hasta 12 meses de edad bajo tratamiento concomitante con agentes inductores de metahemoglobina.
- En niños prematuros con una edad gestacional inferior a 37 semanas.
EMLA Crema contiene aceite de ricino polioxietilenhidrogenado que puede causar reacciones en la piel.
4.5. Interacción con otros medicamentos y otras formas de interacción
Prilocaína a dosis altas puede causar un incremento de los niveles plasmáticos de metahemoglobina, particularmente junto con otros fármacos inductores de ésta (por ejemplo, sulfonamidas).
Con dosis altas de EMLA, se debe considerar el riesgo de toxicidad sistémica adicional en pacientes que estén siendo tratados con otros anestésicos locales o agentes estructuralmente relacionados con anestésicos locales, ya que los efectos tóxicos son aditivos.
Se recomienda tener precaución con medicamentos antiarrítmicos clase III (por ejemplo, amiodarona), ya que no se han realizado estudios específicos de interacción entre Lidocaína/Prilocaína y estos medicamentos (ver el apartado 4.4.).
Los fármacos que reducen la eliminación de Lidocaína (por ejemplo, cimetidina o betabloqueantes) pueden causar concentraciones potencialmente tóxicas en plasma cuando la Lidocaína se administra repetidamente en dosis altas durante un largo periodo de tiempo. Estas interacciones, por lo tanto, no deberían ser de importancia clínica tras el tratamiento a corto plazo con Lidocaína (por ejemplo, EMLA crema) a las dosis recomendadas.
4.6. Embarazo y lactancia
Estudios en animales no indican efectos perjudiciales directos o indirectos en el embarazo, desarrollo embrionario/fetal, parto o desarrollo post-natal.
Embarazo
Lidocaína y Prilocaína atraviesan la barrera placentaria y pueden ser absorbidas por los tejidos fetales. Es razonable asumir que la Lidocaína y Prilocaína se hayan utilizado en un gran número de embarazadas y de mujeres en edad de tener hijos. Hasta ahora, no se han comunicado alteraciones específicas del proceso reproductor, por ejemplo una mayor incidencia de malformaciones u otros efectos directa o indirectamente perjudiciales para el feto; sin embargo, deberá tenerse precaución cuando se administran en mujeres embarazadas.
Lactancia
Lidocaína y, con toda probabilidad, Prilocaína son excretadas a través de la leche materna, pero en cantidades tan pequeñas que generalmente no existe riesgo de que el niño sea afectado a niveles de dosis terapéutica.
4.7. Efectos sobre la capacidad para conducir vehículos o utilizar maquinaria
EMLA Crema no afecta a la capacidad de conducir ni utilizar máquinas cuando se usa a las dosis recomendadas.
4.8. Reacciones adversas
Frecuentes
(>1/100)
Poco frecuentes (1/1000 a 1/100)
Raras
(<1/1000)

Piel Reacciones locales transitorias en la zona de aplicación, como palidez, eritema (enrojecimiento) y edema. 1 2 3) Sensación inicial y generalmente leve, de quemazón, picor o calor en la zona de aplicación. 2, 3)
Piel Ligera quemazón inicial, sensación de picor o calor en la zona de aplicación. 1)
Parestesia local en la zona de aplicación, por ejemplo, sensación de hormigueo. 2)
Irritación cutánea en la zona de aplicación. 3)
General Metahemoglobinemia. 1)
Casos raros de lesiones locales discretas en la zona de aplicación, como púrpura o petequias, especialmente tras tiempos de aplicación de mayor duración en niños con dermatitis atópica o molusco contagioso. :)
Irritación corneal tras exposición ocular accidental. :) Raramente, las preparaciones anestésicas locales se han asociado a reacciones alérgicas (en los casos más graves, con shock anafiláctico). 1 2 3)
1) Piel intacta
2) Mucosa Genital
3) Úlceras en piernas
4.9. Sobredosificación
Se han comunicado casos raros de metahemoglobinemia clínicamente significativa. Prilocaína a dosis altas puede causar un aumento en los niveles plasmáticos de metahemoglobina, especialmente en conjunción con agentes inductores de ésta (por ejemplo, sulfonamidas). La metahemoglobinemia clínicamente significativa deberá ser tratada con una inyección intravenosa lenta de azul de metileno.
Si se produjeran otros síntomas de toxicidad sistémica, se piensa que los signos serán similares en naturaleza a los producidos con la administración de anestésicos locales por otras vías. La toxicidad anestésica local se manifiesta por síntomas de excitación de sistema nervioso y, en casos graves, con depresión del sistema nervioso central y del sistema cardiovascular.
Los síntomas neurológicos graves (convulsiones, depresión del SNC) deben tratarse sintomáticamente mediante respiración asistida y con la administración fármacos anticonvulsivos; los signos circulatorios se tratarán conforme a las recomendaciones para la reanimación.

Dado que la tasa de absorción de la piel intacta es lenta, un paciente que muestre síntomas de toxicidad debería mantenerse bajo observación durante varias horas después del tratamiento de urgencia.
5.- PROPIEDADES FARMACOLOGICAS
5.1. Propiedades farmacodinámicas
Grupo Farmacoterapéutico: Anestésicos locales tipo amida, código ATC: N01B B20.
EMLA produce anestesia dérmica mediante la liberación de Lidocaína y Prilocaína de la crema hacia las capas de la epidermis y la dermis de la piel, y la acumulación de Lidocaína y Prilocaína en las zonas próximas a los receptores del dolor y a las terminaciones nerviosas. Lidocaína y Prilocaína son anestésicos locales tipo amida. Ambos estabilizan las membranas neuronales por inhibición de los flujos iónicos que se requieren para la iniciación y conducción de los impulsos nerviosos, con lo cual se produce anestesia local.
La eficacia de la anestesia depende del tiempo de aplicación y de la dosis.
EMLA se aplica sobre la piel intacta bajo un vendaje oclusivo. El tiempo necesario para asegurar la anestesia de la piel intacta es de 1-2 horas, en función del tipo de intervención.
En estudios clínicos de EMLA sobre piel intacta, no se observaron diferencias entre pacientes geriátricos (65-96 años) y pacientes más jóvenes en relación a la seguridad o a la eficacia (incluyendo comienzo de la anestesia).
La duración de la anestesia, tras la aplicación de EMLA durante 1-2 horas, es al menos de 2 horas después de retirar el vendaje oclusivo.
La profundidad de la anestesia cutánea aumenta con el tiempo de aplicación. En el 90% de los pacientes, la anestesia es suficiente para la inserción de un sacabocados (4 mm de diámetro) hasta una profundidad de 2 mm tras 60 minutos y de 3 mm tras 120 minutos de tratamiento con EMLA. EMLA es igualmente efectivo y posee el mismo tiempo de inicio de la anestesia en todo el rango de piel clara a oscura pigmentada (tipos de piel I a VI).
En comparación con los pacientes tratados con placebo, el uso de EMLA antes de las vacunas contra sarampión-paperas-rubeola o vacunas intramusculares contra difteria-tosferina-tétanos-poliovirus inactivados-Haemophilus influenza b o Hepatitis B, no afecta los títulos medios de anticuerpos, tasa de seroconversión o la proporción de pacientes que alcanzan unos títulos de anticuerpos protectores o positivos después de la inmunización.
La absorción en la mucosa genital en adultos es más rápida y tarda menos tiempo en empezar el efecto de la anestesia que cuando se aplica sobre la piel.
En la mayoría de pacientes, con un tiempo de aplicación de 30 minutos se obtiene una anestesia suficiente para la limpieza de las úlceras de extremidades inferiores. Un tiempo de aplicación de 60 minutos puede mejorar la anestesia. El procedimiento de limpieza debe iniciarse antes de que transcurran 10 minutos después de retirar la crema. No se dispone de datos clínicos de tiempos superiores de espera.
EMLA reduce el dolor post-quirúrgico durante un periodo de hasta 4 horas tras el desbridamiento. EMLA reduce el número de sesiones de limpieza requeridos para conseguir una úlcera limpia en comparación

con el desbridamiento con crema placebo. No se han observado efectos negativos sobre la curación de la úlcera ni sobre la flora bacteriana.
EMLA produce una respuesta vascular bifásica, que empieza con una vasoconstricción seguida de una vasodilatación, en la zona de aplicación (ver “Reacciones adversas”, en el apartado 4.8.).
Independientemente de la respuesta vascular, EMLA facilita el procedimiento de punción en comparación con crema placebo.
En pacientes con dermatitis atópica, se observa una reacción vascular similar pero de menor duración, produciéndose eritema tras 30-60 minutos, lo que indica una absorción más rápida a través de la piel (ver “Advertencias y precauciones especiales de empleo”, en el apartado 4.4.).
5.2. Propiedades farmacocinéticas
En un estudio a dosis repetidas con administración diaria de 10 gr de EMLA durante 60 minutos a lo largo de 10 días consecutivos en 25 pacientes con úlceras en las extremidades inferiores de 62 a 160 cm2 de tamaño, el pico medio (Cmax) de la suma de las concentraciones de Lidocaína y Prilocaína fue de 615 ng/mL en el percentil 90, a 1154 ng/mL y el intervalo de confianza al 95% superior para el percentil 90 a 1515 ng/mL.
El valor de Cmax no depende de la edad de los pacientes pero está significativamente relacionada (p<0,01) con el tamaño del área de la úlcera. El incremento del área de la úlcera en 1 cm2 resulta en un aumento estimado de la Cmax de 7,2 ng/mL para la suma de las concentraciones de Lidocaína y Prilocaína .
La absorción sistémica de Lidocaína y de Prilocaína de EMLA depende de la dosis, área y del tiempo de aplicación. Otros factores adicionales, como el grosor de la piel (que es diferente según la parte del cuerpo), o de otras características como enfermedades de la piel y afeitado, también pueden influir en la absorción. Tras la aplicación sobre úlceras de extremidades inferiores, las características de las úlceras también pueden afectar a la absorción.
Piel intacta. Tras la aplicación sobre el muslo en adultos (60 g de crema/400 cm2 durante 3 horas), el grado de absorción fue aproximadamente del 5% de Lidocaína y de Prilocaína. Las concentraciones máximas en plasma (media 0,12 y 0,07 pg/ml de Lidocaína y Prilocaína, respectivamente) se alcanzaron aproximadamente de 2-6 horas después de la aplicación.
El grado de absorción sistémica fue aproximadamente del 10% tras la aplicación sobre la piel del rostro (10 g/100 cm2 durante 2 horas). Los niveles máximos en plasma (media 0,16 y 0,06 pg/ml de Lidocaína y Prilocaína, respectivamente) se alcanzaron después de aproximadamente 1,5-3 horas.
Tras la aplicación de EMLA sobre piel intacta, los niveles plasmáticos de Lidocaína y Prilocaína en pacientes geriátricos y no geriátricos son muy bajos y están adecuadamente por debajo de los niveles potencialmente tóxicos.
Niños. Después de la aplicación de 1,0 g de EMLA en niños menores de 3 meses, en una superficie de aproximadamente 10 cm2 durante una hora, las concentraciones plasmáticas máximas de Lidocaína y Prilocaína fueron 0,135 pg/ml y 0,107 pg/ml, respectivamente. Tras la aplicación de 2,0 g de EMLA en lactantes de 3 a 12 meses, en una superficie de aproximadamente 16 cm2 durante 4 horas, las concentraciones plasmáticas máximas de Lidocaína y Prilocaína fueron 0,155 pg/ml y 0,131 pg/ml, respectivamente. Después de la aplicación de 10,0 g de EMLA en niños entre 2 y 3 años en una superficie de aproximadamente 100 cm2 durante 2 horas, las concentraciones plasmáticas máximas de Lidocaína y

Prilocaína fueron 0,315 pg/ml y 0,215 pg/ml, respectivamente. Después de la aplicación de 10,0-16,0 g de EMLA en niños entre 6 y 8 años en una superficie de 100-160 cm2 durante 2 horas, las concentraciones plasmáticas máximas de Lidocaína y Prilocaína fueron 0,299 pg/ml y 0,110 pg/ml, respectivamente.
Mucosa genital en adultos. Tras la aplicación de 10 g de EMLA durante 10 minutos sobre la mucosa vaginal, las concentraciones máximas en plasma de Lidocaína y Prilocaína (media 0,18 pg/ml y 0,15 pg/ml, respectivamente) se alcanzaron después de 20-45 minutos.
Ulceras en extremidades inferiores. Tras una única aplicación de 5 a 10 g de EMLA sobre las úlceras con un área de hasta 64 cm2 durante 30 minutos, los niveles máximos en plasma de Lidocaína (rango 0,05-0,25 pg/ml, con un valor aislado de 0,84 pg/ml) y de Prilocaína (0,02-0,08 pg/ml) se alcanzaron después de 1-2,5 horas.
Después de un tiempo de aplicación de 24 horas sobre úlceras con un área de hasta 50-100 cm2, los niveles máximos en plasma de Lidocaína (0,19-0,71 pg/ml) y de Prilocaína (0,06-0,28 pg/ml) se alcanzan habitualmente al cabo de 2-4 horas.
Tras la aplicación repetida de 2-10 g de EMLA sobre úlceras con un área de hasta 62 cm2 durante 30-60 minutos de 3 a 7 veces en una semana, hasta un total de 15 dosis durante un periodo de un mes, no se produjo una acumulación aparente en plasma de Lidocaína y de sus metabolitos (monoglicinaxilidina y 2,6-xilidina) ni de Prilocaína y su metabolito (orto-toluidina). Los niveles máximos observados en plasma para Lidocaína, monoglicinaxilidina y 2,6-xilidina, fueron 0,41, 0,03 y 0,01 pg/ml, respectivamente. Los niveles máximos observados en plasma para Prilocaína y orto-toluidina fueron 0,08 pg/ml y 0,01 pg/ml, respectivamente.
5.3. Datos preclínicos sobre seguridad
En estudios en animales, la toxicidad observada después de altas dosis tanto de Prilocaína como de Lidocaína, solas o en combinación, consistió en efectos sobre los sistemas nervioso central y cardiovascular. Cuando Lidocaína y Prilocaína se combinaron, sólo se observaron efectos aditivos, sin indicación de sinergismo o toxicidad inesperada. Ambos compuestos mostraron tener una baja toxicidad aguda oral, proporcionando un buen margen de seguridad en el caso en el que EMLA sea ingerido inadvertidamente. En estudios de toxicidad reproductiva, no se han observado efectos adversos relacionados con el fármaco, empleando tanto los compuestos de forma individual como conjunta.
En pruebas de mutagenicidad tanto “in vivo” como “in vitro”, el anestésico local tampoco mostró potencial mutagénico. No han sido llevados a cabo estudios oncológicos con Lidocaína o Prilocaína, tanto solas como en combinación, debido a la indicación y duración del uso terapéutico de estos fármacos.
Un metabolito de la Lidocaína, 2,6-xilidina, y un metabolito de la prilocaina, o-toluidina, mostraron evidencias de actividad mutagénica. En estudios toxicológicos preclínicos para evaluar la exposición crónica se ha demostrado que estos metabolitos presentan potencial carcinogénico. Los análisis de riesgo, comparando la exposición máxima calculada en humanos en el empleo intermitente de Lidocaína y Prilocaína con la exposición utilizada en los estudios preclínicos, indicaron un amplio margen de seguridad para su uso clínico.
Estudios de tolerancia local empleando una mezcla de Lidocaína y Prilocaína 1:1 (p/p) como una emulsión, crema o gel indicaron que estas formulaciones son adecuadamente toleradas por piel intacta, dañada y mucosas.

En un estudio en animales, se observó una marcada reacción irritativa después de la administración ocular de una emulsión de 50 mg/g de Lidocaína+Prilocaína 1:1 (p/p); siendo ésta la misma concentración de los anestésicos locales y una formulación similar que la de EMLA. Esta reacción ocular puede haber estado influenciada por el alto pH de la formulación de la emulsión (aproximadamente 9), pero probablemente, sea también en parte debida al potencial irritativo propio de los anestésicos locales.
6.- DATOS FARMACEUTICOS
6.1. Lista de excipientes
Carboxipolimetileno
Aceite de ricino polioxihidrogenado
Hidróxido sódico (para pH 8,7-9,7)
Agua purificada.
6.2. Incompatibilidades
No aplicable.
6.3. Periodo de validez
Tres años.
6.4. Precauciones especiales de conservación
Sin condiciones especiales de conservación. No refrigerar/congelar.
Tener precaución de cerrar el tubo después del uso.
6.5. Naturaleza y contenido del envase
Tubo de aluminio, recubierto en el interior con laca protectora y tapón de polietileno de alta densidad color blanco.
PRESENTACIONES:
EMLA 25 mg/g + 25 mg/g crema con apósitos: Tubo conteniendo 5 g de crema + 2 apósitos oclusivos
EMLA 25 mg/g + 25 mg/g crema: Tubo conteniendo 30 g de crema
6.6. Instrucciones de uso/manipulación
La membrana protectora del tubo se perfora invirtiendo el tapón y presionando.
Instrucciones de uso para EMLA 25 mg/g + 25 mg/g crema con apósitos

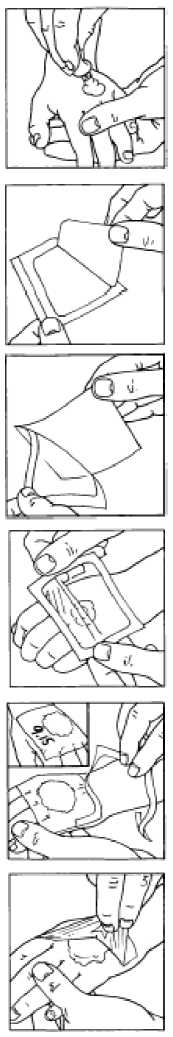
1. Aplicar una cantidad suficiente de crema para cubrir al menos una vena si se emplea antes de una extracción de sangre. Ver apartado 4.2 Posología y forma de administración.
2. Tomar uno de los apósitos oclusivos que se adjuntan y retirar la pieza central recortada.
3. Retirar el papel que recubre el apósito dejando sólo el marco de papel.
4. Cubrir EMLA 25 mg/g + 25 mg/g crema con el apósito de manera que se forme una capa gruesa de crema debajo. Evitar que ésta se extienda. Presionar cuidadosamente los extremos para evitar la pérdida de crema.
5. Retirar el marco de papel. El tiempo de aplicación puede anotarse directamente sobre el apósito. EMLA 25 mg/g + 25 mg/g crema con apósitos se aplicará al menos durante 1 hora antes del inicio de la intervención. Ver los tiempos de aplicación recomendados en el apartado 4.2 Posología y forma de administración.
6. Retirar el apósito oclusivo y eliminar la crema. Limpiar la zona de aplicación y preparar para la intervención.

Instrucciones de uso de EMLA 25 mg/g + 25 mg/g crema para úlceras en extremidades inferiores
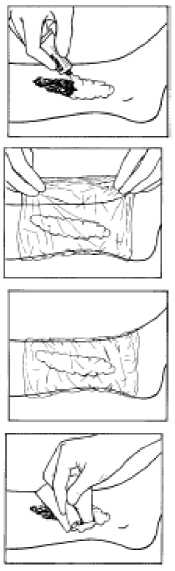
1. Cubrir la superficie de la úlcera con una capa gruesa de crema, aproximadamente 1-2 g/10 cm2. Se recomienda un máximo de 10 g por tratamiento. Desechar la crema no utilizada.
2. Cubrir la crema con un vendaje oclusivo (por ej. plástico transparente).
3. El tiempo de aplicación deberá ser de al menos 30 minutos. En úlceras crónicas muy dolorosas o resistentes a la absorción, se puede prolongar el tiempo a hasta 60 minutos.
4. Retirar el vendaje oclusivo (plástico transparente), eliminar la crema e iniciar el desbridamiento de la herida antes de transcurridos 10 minutos.
En caso de emplear EMLA para úlceras de piernas, deberá descartarse el tubo con la crema restante después de tratar a cada paciente.
7.- TITULAR DE LA AUTORIZACION DE COMERCIALIZACION
AstraZeneca Farmacéutica Spain, S.A.
C/ Serrano Galvache, 56 - Edificio Roble 28033 Madrid
8. - NUMERO DE LA AUTORIZACION DE COMERCIALIZACION
EMLA 25 mg/g + 25 mg/g crema con apósitos: N° Registro 61.095 EMLA 25 mg/g + 25 mg/g crema: N° Registro 61.096
9. - FECHA DE PRIMERA AUTORIZACION/REVALIDACION DE LA AUTORIZACION
10. - FECHA DE LA REVISION DEL TEXTO
Abril 2011.
27 Jul 2010 (Var II.500 update 2010) / 16 Feb 2010 (CDS)
Agencia española de
medicamentos y
productos sanitarios