Emadine 0,05% Colirio En Solucion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
EMADINE 0,5 mg/ml, Colirio en solución.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 0,5 mg de emedastina (como difumarato). Excipiente(s) con efecto conocido: cloruro de benzalconio 0,1 mg/ml Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Colirio en solución.
Solución incolora y transparente.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento sintomático de la conjuntivitis alérgica estacional.
4.2 Posología y forma de administración
EMADINE no se ha estudiado en ensayos clínicos de más de seis semanas.
Posología
La dosis es de una gota de EMADINE en el(los) ojo(s) afectado(s) dos veces al día.
Si se utiliza con otros medicamentos oftálmicos, debe dejarse un intervalo de diez minutos entre las aplicaciones de cada medicamento. Las pomadas oftálmicas deben administrarse en último lugar.
Pacientes de edad avanzada
EMADINE no se ha estudiado en pacientes ancianos mayores de 65 años y por lo tanto no se recomienda su uso en este grupo de pacientes.
Pacientes pediátricos
EMADINE puede utilizarse en pacientes pediátricos (3 años o mayores) a la misma posología que en adultos.
Uso en pacientes con insuficiencia hepática y renal
EMADINE no se ha estudiado en estos pacientes y por lo tanto no se recomienda su uso en este grupo de pacientes.
Forma de administración
Vía oftálmica.
Para evitar una posible contaminación de la punta del cuentagotas y de la solución, debe tenerse la precaución de no tocar los párpados, áreas circundantes ni otras superficies con la punta del frasco.
Después de quitar el tapón, se debe retirar el anillo del precinto de seguridad antes de utilizar este medicamento.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo Infiltrados corneales oculares
Se han observado infiltrados corneales oculares coincidiendo con el uso de EMADINE. En caso de observarse infiltrados corneales, se debe interrumpir la administración del producto e instaurar las medidas adecuadas.
Excipientes
Se ha informado que el cloruro de benzalconio, que se utiliza frecuentemente como conservante en productos oftálmicos causa queratopatía punctata y/o queratopatía ulcerativa tóxica. Puesto que EMADINE contiene cloruro de benzalconio, se recomienda estrecha monitorización si se utiliza con frecuencia o durante periodos prolongados.
Además el cloruro de benzalconio puede causar irritación ocular y se sabe que altera el color de las lentes de contacto blandas. Debe evitarse el contacto con lentes de contacto blandas. Debe instruirse a los pacientes para que se retiren las lentes de contacto antes de la aplicación de EMADINE y esperen 15 minutos después de la instilación de la dosis antes de volver a colocarlas.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos adecuados sobre el uso de emedastina en mujeres embarazadas. Los estudios en animales han mostrado toxicidad sobre la reproducción (ver apartado 5.3). No se conoce el riesgo potencial en humanos. No obstante, considerando la ausencia de efectos de la emedastina sobre los receptores adrenérgicos, dopaminérgicos y serotoninérgicos, EMADINE puede utilizarse durante el embarazo siempre según las recomendaciones de dosificación del apartado 4.2.
Lactancia
La emedastina se ha detectado en leche de ratas después de su administración oral. Se desconoce si su administración oftálmica en humanos puede dar lugar a una absorción sistémica suficiente como para excretar cantidades detectables en leche materna. EMADINE debe administrarse con precaución durante el periodo de lactancia.
Fertilidad
Estudios en animales no han mostrado evidencia de deterioro de la fertilidad (ver sección 5.3). No se dispone de datos en relación a la fertilidad en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de EMADINE sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. Sin embargo, como con cualquier medicación oftálmica, si aparece visión borrosa transitoria u otras alteraciones visuales durante la instilación, el paciente debe esperar hasta que la visión sea nítida antes de conducir o utilizar maquinaria.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En 13 estudios clínicos que incluyeron 696 pacientes, se administró Emadine de una a cuatro veces al día en ambos ojos durante hasta 42 días. En ensayos clínicos, aproximadamente un 7% de los pacientes experimentaron una reacción adversa relacionada con el uso de Emadine; sin embargo, menos del 1% de estos pacientes interrumpieron el tratamiento debido a estas reacciones adversas. No se notificaron reacciones adversas sistémicas u oftálmicas graves en los ensayos clínicos. Las reacciones adversas más frecuentes fueron dolor ocular y prurito ocular, ocurriendo en el 1% al 2,0% de los pacientes.
Tabla resumen de reacciones adversas
Se observaron las siguientes reacciones adversas en estudios clínicos o durante la experiencia postcomercialización. Se distribuyen según la clasificación de órganos y sistemas y se clasifican según el siguiente criterio: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000) o frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad, dentro de cada grupo de frecuencia.
|
Sistema de clasificación de órganos |
Frecuencia |
Reacciones adversas |
|
Trastornos psiquiátricos |
Poco frecuentes |
sueños anormales |
|
Trastornos del sistema nervioso |
Poco frecuentes |
cefalea, cefalea sinusal, disgeusia |
|
Trastornos oculares |
Frecuentes |
dolor ocular, prurito ocular, hiperemia de la conjuntiva |
|
Poco frecuentes |
infiltrados corneales, manchas corneales, visión borrosa, irritación ocular, ojo seco, sensación de cuerpo extraño en los ojos, lagrimeo aumentado, astenopía, hiperemia ocular | |
|
Trastornos cardíacos |
Frecuencia no conocida |
taquicardia |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
erupción |
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9
Sobredosis
No se esperan reacciones específicas con una sobredosis oftálmica de este medicamento.
No hay datos disponibles en humanos relacionados con la sobredosis por ingestión deliberada o accidental. En caso de ingestión accidental del contenido de un frasco de EMADINE, pueden ocurrir efectos sedantes y debe tenerse en cuenta la capacidad de emedastina de incrementar el intervalo QT, debiendo instaurarse una monitorización y un tratamiento adecuados.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: descongestionantes y antialérgicos; otros antialérgicos.
Código ATC: S01G X 06.
La emedastina es un antagonista H1 de la histamina, potente, selectivo y eficaz por vía oftálmica (Ki = 1,3 nM). Los estudios in vitro sobre la afinidad de la emedastina por los receptores de la histamina (H1, H2 y H3) demuestran una selectividad 10.000 veces superior por el receptor H1,
Kis = 1,3 nM, 49.064 nM y 12.430 nM, respectivamente. La administración oftálmica in vivo de emedastina produce una inhibición de la permeabilidad vascular de la conjuntiva estimulada por histamina, dependiente de la concentración. Los estudios con emedastina no han mostrado efectos sobre los receptores adrenérgicos, dopaminérgicos o serotoninérgicos.
5.2 Propiedades farmacocinéticas
Absorción
La emedastina se absorbe a nivel sistémico, al igual que otras sustancias activas administradas por vía oftálmica. En un estudio con diez voluntarios sanos tratados bilateralmente dos veces al día durante 15 días con EMADINE 0,05%, colirio en solución, las concentraciones plasmáticas del fármaco sin metabolizar estuvieron en general por debajo del límite de cuantificación del ensayo (0,3 ng/ml). Las muestras en las que la emedastina fue cuantificable oscilaron entre 0,30 y 0,49 ng/ml.
La biodisponibilidad oral humana de la emedastina es aproximadamente del 50% y las concentraciones plasmáticas máximas se obtienen entre una y dos horas después de la administración.
Metabolismo
La emedastina se metaboliza principalmente en el hígado. La semivida de eliminación de la emedastina oftálmica es de diez horas. Aproximadamente un 44% de una dosis oral se recupera en la orina de 24 horas, excretándose sólo un 3,6% de la dosis como sustancia activa sin metabolizar. Se excretan en orina dos metabolitos primarios, 5-y 6-hidroxiemedastina, en sus formas libres y conjugadas. También se forman como metabolitos menores el N-óxido y los análogos 5'-oxo de 5-y 6-hidroxiemedastina.
5.3 Datos preclínicos de seguridad
El difumarato de emedastina ha demostrado baja toxicidad aguda en varias especies por varias vías de administración. En estudios a largo plazo en conejos por vía oftálmica, no se observaron efectos sistémicos o locales clínicamente significativos.
Se observaron infiltrados celulares mononucleares córneo límbicos en 1/4 monos macho tratados con 0,5 mg/ml y en 4/4 machos y 1/4 hembras tratados con 1,0 mg/ml. Los infiltrados celulares mononucleares esclerales se observaron en 1/4 machos y 1/4 hembras tratados con 0,5 mg/ml y en 2/4 machos y 1/4 hembras tratados con 1,0 mg/ml. Los niveles medios de los picos plasmáticos fueron aproximadamente 1 ng/ml y 2 ng/ml para los tratamientos con 0,5 y 1,0 mg/ml respectivamente.
Se ha observado que la emedastina incrementa el intervalo QT en perros; el nivel sin efecto observable corresponde a niveles 23 veces superiores a los que se encuentran en pacientes (7 ng/ml comparados con 0,3 ng/ml, es decir el límite de detección de la emedastina).
El difumarato de emedastina no resultó ser carcinogénico en estudios en ratas y ratones. El difumarato de emedastina no fue genotóxico en una batería estándar de ensayos de genotoxicidad in vivo e in vitro.
En un estudio de terarogénesis en ratas, se observaron efectos fetotóxicos pero no teratogénicos con la dosis más alta evaluada (140 mg/kg/día); no se observaron efectos a un nivel inferior (40 mg/kg/día) que corresponde a una exposición muy superior a la producida por las dosis terapéuticas recomendadas. En un estudio con conejos, no se observó toxicidad sobre la reproducción.
No hubo evidencia de deterioro de la fertilidad o disminución de la función reproductora en ratas con dosis orales administradas de hasta 30 mg/kg/día de difumarato de emedastina.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de benzalconio 0,1 mg/ml,
Trometamol,
Cloruro de sodio,
Hipromelosa,
Ácido clorhídrico/hidróxido de sodio (para ajustar pH)
Agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Período de validez
30 meses.
No utilizar EMADINE durante más de 4 semanas después de la primera apertura del envase.
6.4 Precauciones especiales de conservación No conservar a temperatura superior a 25°C.
6.5 Naturaleza y contenido del envase
EMADINE se presenta en frascos DROP-TAINER de plástico opaco de 5 ml y 10 ml.
Puede que no se comercialicen todas las presentaciones.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley Camberley Surrey GU16 7SR Reino Unido
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/095/001-2.
9. FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27 de enero de 1999.
Fecha de la última revalidación: 29 de enero de 2004
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
EMADINE 0,5 mg/ml, Colirio en solución en envase monodosis.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 0,5 mg de emedastina (como difumarato). Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Colirio en solución.
Solución incolora y transparente.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento sintomático de la conjuntivitis alérgica estacional.
4.2 Posología y forma de administración
EMADINE no se ha estudiado en ensayos clínicos de más de seis semanas.
Posología
La dosis es de una gota de EMADINE en el(los) ojo(s) afectado(s) dos veces al día.
Cuando se utiliza con otros medicamentos oftálmicos, debe dejarse un intervalo de diez minutos entre las aplicaciones de cada medicamento. Las pomadas oftálmicas deben administrarse en último lugar.
Para un solo uso; un envase es suficiente para tratar ambos ojos. La solución sobrante debe desecharse inmediatamente después del uso de cada envase unidosis.
Pacientes de edad avanzada
EMADINE no se ha estudiado en pacientes ancianos mayores de 65 años y por lo tanto no se recomienda su uso en este grupo de pacientes.
Pacientes pediátricos
EMADINE puede utilizarse en pacientes pediátricos (3 años o mayores) a la misma posología que en adultos.
Uso en pacientes con insuficiencia hepática y renal
EMADINE no se ha estudiado en estos pacientes y por lo tanto no se recomienda su uso en este grupo de pacientes.
Forma de administración
Vía oftálmica.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo Infiltrados corneales oculares
Se han observado infiltrados corneales oculares coincidiendo con el uso de EMADINE. En caso de observarse infiltrados corneales, se debe interrumpir la administración del producto e instaurar las medidas adecuadas.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos adecuados sobre el uso de emedastina en mujeres embarazadas. Los estudios en animales han mostrado toxicidad sobre la reproducción (ver apartado 5.3). No se conoce el riesgo potencial en humanos. No obstante, considerando la ausencia de efectos de la Emedastina sobre los receptores adrenérgicos, dopaminérgicos y serotoninérgicos, EMADINE puede utilizarse durante el embarazo siempre según las recomendaciones de dosificación del apartado 4.2.
Lactancia
La emedastina se ha detectado en leche de ratas después de su administración oral. Se desconoce si su administración oftálmica en humanos puede dar lugar a una absorción sistémica suficiente como para excretar cantidades detectables en leche materna. EMADINE debe administrarse con precaución durante el periodo de lactancia.
Fertilidad
Estudios en animales no han mostrado evidencia de deterioro de la fertilidad (ver sección 5.3). No se dispone de datos en relación a la fertilidad en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de EMADINE sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. Sin embargo, como con cualquier medicación oftálmica, si aparece visión borrosa transitoria u otras alteraciones visuales durante la instilación, el paciente debe esperar hasta que la visión sea nítida antes de conducir o utilizar maquinaria.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En 13 estudios clínicos que incluyeron 696 pacientes, se administró Emadine de una a cuatro veces al día en ambos ojos durante hasta 42 días. En ensayos clínicos, aproximadamente un 7% de los pacientes experimentaron una reacción adversa relacionada con el uso de Emadine; sin embargo, menos del 1% de estos pacientes interrumpieron el tratamiento debido a estas reacciones adversas. No se notificaron reacciones adversas sistémicas u oftálmicas graves en los ensayos clínicos. Las reacciones adversas más frecuentes fueron dolor ocular y prurito ocular, ocurriendo en el 1% al 2,0% de los pacientes.
Tabla resumen de reacciones adversas
Se observaron las siguientes reacciones adversas en estudios clínicos o durante la experiencia postcomercialización. Se distribuyen según la clasificación de órganos y sistemas y se clasifican según el siguiente criterio: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes
9
(>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000) o frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad, dentro de cada grupo de frecuencia.
|
Sistema de clasificación de órganos |
Frecuencia |
Reacciones adversas |
|
Trastornos psiquiátricos |
Poco frecuentes |
sueños anormales |
|
Trastornos del sistema nervioso |
Poco frecuentes |
cefalea, cefalea sinusal, disgeusia |
|
Trastornos oculares |
Frecuentes |
dolor ocular, prurito ocular, hiperemia de la conjuntiva |
|
Poco frecuentes |
infiltrados corneales, manchas corneales, visión borrosa, irritación ocular, ojo seco, sensación de cuerpo extraño en los ojos, lagrimeo aumentado, astenopía, hiperemia ocular | |
|
Trastornos cardíacos |
Frecuencia no conocida |
taquicardia |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
erupción |
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
No se esperan reacciones específicas con una sobredosis oftálmica de este medicamento.
No hay datos disponibles en humanos relacionados con la sobredosis por ingestión deliberada o accidental. En caso de ingestión deliberada del contenido de un gran número de unidosis de EMADINE, pueden ocurrir efectos sedantes y debe tenerse en cuenta la capacidad de emedastina de incrementar el intervalo QT, debiendo instaurarse una monitorización y un tratamiento adecuados.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: descongestionantes y antialérgicos; otros antialérgicos.
Código ATC: S01G X 06.
La emedastina es un antagonista H1 de la histamina, potente, selectivo y eficaz por vía oftálmica (KI = 1,3 nM). Los estudios in vitro sobre la afinidad de la emedastina por los receptores de la histamina (Hi, H2 y H3) demuestran una selectividad 10.000 veces superior por el receptor Hi, Kis = 1,3 nM, 49.064 nM y 12.430 nM, respectivamente. La administración oftálmica in vivo de emedastina produce una inhibición de la permeabilidad vascular de la conjuntiva estimulada por histamina, dependiente de la concentración. Los estudios con emedastina no han mostrado efectos sobre los receptores adrenérgicos, dopaminérgicos o serotoninérgicos.
5.2 Propiedades farmacocinéticas
Absorción
La emedastina se absorbe a nivel sistémico, al igual que otras sustancias activas administradas por vía oftálmica. En un estudio con diez voluntarios sanos tratados bilateralmente dos veces al día durante 15 días con EMADINE 0,05%, colirio en solución, las concentraciones plasmáticas del fármaco sin metabolizar estuvieron en general por debajo del límite de cuantificación del ensayo (0,3 ng/ml). Las muestras en las que la emedastina fue cuantificable oscilaron entre 0,30 y 0,49 ng/ml.
La biodisponibilidad oral humana de la emedastina es aproximadamente del 50% y las concentraciones plasmáticas máximas se obtienen entre una y dos horas después de la administración.
Metabolismo
La emedastina se metaboliza principalmente en el hígado. La semivida de eliminación de la emedastina oftálmica es de diez horas. Aproximadamente un 44% de una dosis oral se recupera en la orina de 24 horas, excretándose sólo un 3,6% de la dosis como sustancia activa sin metabolizar. Se excretan en orina dos metabolitos primarios, 5-y 6-hidroxiemedastina, en sus formas libres y conjugadas. También se forman como metabolitos menores el N-óxido y los análogos 5'-oxo de 5-y 6-hidroxiemedastina.
5.3 Datos preclínicos sobre seguridad
El difumarato de emedastina ha demostrado baja toxicidad aguda en varias especies por varias vías de administración. En estudios a largo plazo en conejos por vía oftálmica, no se observaron efectos sistémicos o locales clínicamente significativos.
Se observaron infiltrados celulares mononucleares córneo límbicos en 1/4 monos macho tratados con 0,5 mg/ml y en 4/4 machos y 1/4 hembras tratados con 1,0 mg/ml. Infiltrados celulares mononucleares esclerales se observaron en 1/4 machos y 1/4 hembras tratados con 0,5 mg/ml y en 2/4 machos y 1/4 hembras tratados con 1,0 mg/ml. Los niveles medios de los picos plasmáticos fueron aproximadamente 1 ng/ml y 2 ng/ml para los tratamientos con 0,5 mg/ml y 1,0 mg/ml respectivamente.
Se ha observado que la emedastina incrementa el intervalo QT en perros; el nivel sin efecto observable corresponde a niveles 23 veces superiores a los que se encuentran en pacientes (7 ng/ml comparados con 0,3 ng/ml, es decir el límite de detección de la emedastina).
El difumarato de emedastina no resultó ser carcinogénico en estudios en ratas y ratones. El difumarato de emedastina no fue genotóxico en una batería estándar de ensayos de genotoxicidad in vivo e in vitro.
En un estudio de teratogénesis en ratas, se observaron efectos fetotóxicos pero no teratogénicos con la dosis más alta evaluada (140 mg/kg/día); no se observaron efectos a un nivel inferior (40 mg/kg/día) que corresponde a una exposición muy superior a la producida por las dosis terapéuticas recomendadas. En un estudio con conejos, no se observó toxicidad sobre la reproducción.
No hubo evidencia de deterioro de la fertilidad o disminución de la función reproductora en ratas con dosis orales administradas de hasta 30 mg/kg/día de difumarato de emedastina.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Trometamol Cloruro de sodio Hipromelosa
Ácido clorhídrico/hidróxido de sodio (para ajustar pH)
Agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
Después de la primera apertura del sobre de aluminio: 7 días.
6.4 Precauciones especiales de conservación No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
EMADINE se presenta en envases unidosis de polietileno de baja densidad que contienen 0,35 ml. Cinco envases unidosis se acondicionan en un sobre de aluminio.
Formatos de presentación: caja con 30 envases unidosis de 0,35 ml y caja con 60 envases unidosis de 0,35 ml. Puede que no se comercialicen todas las presentaciones.
6.6 Precauciones especiales de eliminación
Para un solo uso; Un envase es suficiente para tratar ambos ojos. Debe desecharse la solución sobrante inmediatamente después de la utilización.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley Camberley Surrey GU16 7SR Reino Unido
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/095/003-4
9. FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: (30 de mayo de 2002 MAA Unidosis) 27 de enero de 1999. Fecha de la última revalidación: 29 de enero de 2004
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes responsables de la liberación de los lotes
EMADINE 0,5 mg/ml Colirio en solución.
S.A. Alcon-Couvreur N.V.,
Rijksweg 14,
B-2870 Puurs,
Bélgica.
Alcon Cusí, S.A.,
Camil Fabra 58,
08320 El Masnou,
Barcelona,
España.
EMADINE 0,5 mg/ml, Colirio en solución en envase monodosis.
S.A. Alcon-Couvreur N.V.,
Rijksweg 14,
B-2870 Puurs,
Bélgica.
El etiquetado y prospecto del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES O RESTRICCIONES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
No procede.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
EMADINE 0,5 mg/ml Colirio en solución. Emedastina.
2. PRINCIPIO ACTIVO
Emedastina 0,5 mg/ml como difumarato.
3. LISTA DE EXCIPIENTES
Contiene: cloruro de benzalconio 0,1 mg/ml, trometamol, cloruro de sodio, hipromelosa, ácido clorhídrico/hidróxido de sodio (para ajustar el pH) y agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Colirio en solución; 1 x 5 ml 1 x 10 ml
5. FORMA Y VÍA DE ADMINISTRACIÓN
Vía oftálmica. Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD:
Desechar cuatro semanas después de la primera apertura del envase. Fecha de apertura:
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey GU16 7SR
Reino Unido
12. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/095/001 1 x 5 ml EU/1/98/095/002 1 x 10 ml
13. NÚMERO DE LOTE
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Emadine
ETIQUETA DEL FRASCO DE 5 ml y 10 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
EMADINE 0,5 mg/ml Colirio en solución. Emedastina.
Vía oftálmica.
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD:
Desechar cuatro semanas después de la primera apertura del envase. Fecha de apertura:
4. NÚMERO DE LOTE
Lote:
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 ml. 10 ml.
6. OTROS
1. NOMBRE DEL MEDICAMENTO
EMADINE 0,5 mg/ml Colirio en solución en envase monodosis. Emedastina
2. PRINCIPIO ACTIVO
Emedastina 0,5 mg/ml como difumarato.
3. LISTA DE EXCIPIENTES
Contiene: trometamol, cloruro de sodio, hipromelosa, ácido clorhídrico, hidróxido de sodio y agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Colirio en solución; 30 x 0,35 ml.
60 x 0,35 ml.
5. FORMA Y VÍA DE ADMINISTRACIÓN
Vía oftálmica. Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Para un solo uso; un envase es suficiente para tratar ambos ojos. Sin conservante.
8. FECHA DE CADUCIDAD
CAD:
Desechar el contenido no utilizado de cada envase unidosis inmediatamente después de su utilización. Desechar cualquier envase no utilizado después de una semana de abrir el sobre por primera vez.
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey GU16 7SR
Reino Unido.
12. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/095/003 30 x 0,35 ml EU/1/98/095/004 60 x 0,35 ml
13. NÚMERO DE LOTE
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Emadine
Sobre de aluminio
1. NOMBRE DEL MEDICAMENTO
EMADINE 0,5 mg/ml Colirio en solución en envase monodosis. Emedastina
2. PRINCIPIO ACTIVO
Emedastina 0,5 mg/ml como difumarato.
3. LISTA DE EXCIPIENTES
Contiene: trometamol, cloruro de sodio, hipromelosa, ácido clorhídrico, hidróxido de sodio y agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Colirio en solución; 5 x 0,35 ml.
5. FORMA Y VÍA DE ADMINISTRACIÓN
Vía oftálmica. Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Para un solo uso; un envase es suficiente para tratar ambos ojos. Sin conservante.
8. FECHA DE CADUCIDAD
CAD:
Desechar el contenido no utilizado de cada envase unidosis inmediatamente después de su utilización. Desechar cualquier envase no utilizado después de una semana de abrir el sobre por primera vez.
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey GU16 7SR
Reino Unido.
12. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/095/003 30 x 0,35 ml EU/1/98/095/004 60 x 0,35 ml
13. NÚMERO DE LOTE
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
Abrir el sobre a nivel de las marcas.
Envase unidosis
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
EMADINE. Vía oftálmica
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD:
4. NÚMERO DE LOTE
Lot:
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
EMADINE 0,5 mg/ml Colirio en solución.
Emedastina
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto
1. Qué es EMADINE y para qué se utiliza
2. Qué necesita saber antes de empezar a usar EMADINE
3. Cómo usar EMADINE
4. Posibles efectos adversos
5. Conservación de EMADINE
6. Contenido del envase e información adicional
1. Qué es EMADINE y para qué se utiliza
EMADINE es un medicamento para el tratamiento de la conjuntivitis alérgica estacional en los ojos (afecciones alérgicas de los ojos). Actúa disminuyendo la intensidad de la reacción alérgica.
Conjuntivitis alérgica. Algunos elementos (alergenos) como el polen, el polvo doméstico o el pelo de los animales pueden causar reacciones alérgicas que dan lugar a picor y enrojecimiento así como a inflamación de la superficie de sus ojos.
Debe consultar a un médico si empeora o si no mejora.
2. Qué necesita saber antes de empezar a usar EMADINE No use EMADINE
• Si es alérgico a la emedastina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Consulte a su médico.
Advertencias y precauciones
• No utilice EMADINE en niños menores de 3 años.
• Si lleva lentes de contacto ver sección “EMADINE contiene cloruro de benzalconio”.
• No es recomendable utilizar EMADINE en pacientes mayores de 65 años, ya que en los estudios clínicos no se ha estudiado este grupo de edad.
• No se recomienda utilizar EMADINE en pacientes con problemas de hígado o de riñón. Consulte a su médico o farmacéutico antes de empezar a usar EMADINE.
Uso de EMADINE con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Si utiliza otros colirios a la vez que EMADINE, siga la recomendación del final del apartado 3 “Cómo usar EMADINE”.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
Inmediatamente después de la aplicación de EMADINE puede notar que su visión se vuelve borrosa. No conduzca ni utilice máquinas hasta que su visión sea nítida.
EMADINE contiene cloruro de benzalconio
El conservante de EMADINE (cloruro de benzalconio) puede causar irritación ocular y se sabe que puede alterar el color de las lentes de contacto blandas. Además no debe llevar lentes de contacto mientras esté utilizando EMADINE. Debe esperar 15 minutos después de aplicarse EMADINE antes de volver a colocarse las lentes.
3. Cómo usar EMADINE
Siga exactamente las instrucciones de administración de EMADINE indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es en adultos y niños mayores de 3 años: Una gota en el ojo, dos veces al día. Siga exactamente las instrucciones de administración del medicamento contenidas en este prospecto o las indicadas por su médico. En caso de duda pregunte a su médico o farmacéutico.
Estas gotas deben utilizarse únicamente en los ojos.
Para más información ver cara posterior
(Continúa)
2
3. Cómo usar EMADINE (continuación)
1
La dosis recomendada es Ver cara anterior del prospecto
• Coja el frasco de EMADINE y sitúese ante un espejo.
• Lávese las manos.
• Coja el frasco y desenrosque el tapón.
• Después de abrir el frasco por primera vez, debe retirar el anillo del precinto de seguridad antes de usar este medicamento.
• Sostenga el frasco, boca abajo, entre los dedos pulgar y corazón.
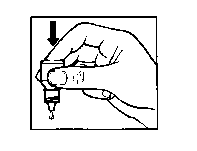
• Incline la cabeza hacia atrás. Separe suavemente el párpado del ojo con un dedo, hasta que se forme una bolsa, en la que deberá caer la gota (Figura 1).
• Acerque la punta del frasco al ojo. Puede serle útil el espejo.
• No toque el ojo, el párpado, zonas próximas ni otras superficies con el cuentagotas, porque las gotas que quedan en el frasco podrían infectarse.
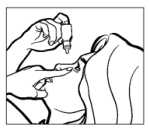
• Presione suavemente la base del frasco para que caiga una gota de EMADINE cada vez.
• No apriete el frasco, está diseñado para que una suave presión sobre la base sea suficiente (Figura 2).
• Si se aplica gotas en ambos ojos, repita los puntos anteriores para el otro ojo.
• Enrosque bien el tapón en el frasco inmediatamente después de utilizar el producto.
Si accidentalmente ha ingerido o se ha inyectado EMADINE contacte con su médico inmediatamente. Podría alterar su ritmo cardíaco.
Si una gota cae fuera del ojo, inténtelo de nuevo.
Si se ha aplicado demasiada cantidad, puede eliminarla lavando los ojos preferiblemente con solución salina estéril o, si no es posible, con agua templada. No se aplique más gotas hasta que vuelva a tocarle.
Si olvidó aplicarse EMADINE cuando correspondía, aplíquese una gota en cuanto se dé cuenta y entonces continúe con su régimen habitual de tratamiento. No se aplique una dosis doble para compensar la olvidada.
Si está utilizando otro colirio, espere por lo menos 10 minutos entre la aplicación de EMADINE y de las otras gotas. Las pomadas deben administrarse en último lugar.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
A menos que los efectos sean graves, siga normalmente con el tratamiento. Si estos efectos le preocupan, consulte a su médico o farmacéutico.
Efectos adversos frecuentes
(pueden afectar hasta 1 de cada 10 personas)
Efectos en el ojo: dolor ocular, picor de ojos, enrojecimiento de los ojos
Efectos adversos poco frecuentes
(pueden afectar hasta 1 de cada 100 personas)
Efectos en el ojo: alteración corneal, sensación anormal en el ojo, incremento en la producción de lágrimas, ojos cansados, irritación del ojo, visión borrosa, manchas corneales, ojo seco.
Otros efectos: dolor de cabeza, dificultad para dormir, dolor de cabeza (alrededor de los senos nasales), mal sabor, erupción
Frecuencia no conocida
(no puede estimarse a partir de los datos disponibles)
Otros efectos: incremento de la frecuencia cardíaca Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de EMADINE
Mantener fuera de la vista y del alcance de los niños.
No utilice EMADINE después de la fecha de caducidad que aparece en el frasco y en la caja después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25°C.
Para evitar infecciones, debe desechar el frasco cuatro semanas después de haberlo abierto por primera vez. Anote la fecha de apertura en el espacio provisto en la etiqueta del frasco y en la caja.
Fecha de apertura:
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medioambiente.
6. Contenido del envase e información adicional
Composición de EMADINE
- El principio activo es emedastina 0,5 mg/ml como difumarato.
- Los demás componentes son cloruro de benzalconio, trometamol, cloruro de sodio, hipromelosa y agua purificada. Se añaden cantidades muy pequeñas de ácido clorhídrico y/o hidróxido de sodio para mantener los niveles de acidez (niveles de pH) normales.
Aspecto del producto y contenido del envase
EMADINE es un líquido (una solución) que se presenta en una caja que contiene un frasco de plástico (DROP-TAINER) de 5 ml o 10 ml con tapón de rosca. Es posible que no se comercialicen todas las presentaciones.
Fabricante Fabricante
Alcon Cusí, S.A. Camil Fabra 58, B-2870 Puurs 08320 El Masnou
Bélgica España
Titular de la autorización de comercialización
Alcon Laboratories (UK) Ltd., Frimley Business Park Frimley Camberley
S.A. Alcon-Couvreur N.V. Rijksweg 14
Surrey GU16 7SR Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Alcon NV W + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien) |
Latvija Alcon Pharmaceuticals Ltd W + 371 67 321 121 |
|
Bt^rapnn Ahkoh Etarapna EOOfl W + 359 2 950 15 65 |
Lietuva Alcon Pharmaceuticals Ltd. atstovybé W + 370 5 2 314 756 |
|
Ceská republika Alcon Pharmaceuticals (Czech Republic) s.r.o. W + 420 225 775 111 |
Magyarország Alcon Hungária Gyógyszerkereskedelmi Kft. W + 36-1-463-9080 |
|
Danmark Alcon Nordic A/S W + 45 3636 4300 |
Nederland Alcon Nederland BV W + 31 (0) 183 654321 |
|
Deutschland Alcon Pharma GmbH W + 49 (0)761 1304-0 |
Norge Alcon Nordic A/S W + 45 3636 4300 |
|
EXXáda Kúnpog A^kov Aagnopáxopig E^ág AEBE W + 30 210 68 78 300 (EUáSa) |
Osterreich Alcon Ophthalmika GmbH W + 43 (0)1 596 69 70 |
|
Eesti Alcon Pharmaceuticals Ltd. Eesti filiaal W + 372 6 313 214 |
Polska Alcon Polska Sp. z o.o. W + 48 22 820 3450 |
|
España Alcon Cusí, S.A. W + 34 93 497 7000 |
Portugal Alcon Portugal - Produtos e Equipamentos Oftalmológicos, Lda. W + 351 214 400 300 |
|
France Laboratoires Alcon W + 33 (0)1 47 10 47 10 |
Romania S.C. Alcon Romania S.R.L. W + 40 21 203 93 24 |
|
Hrvatska Alcon Farmaceutika d.o.o. W + 385 1 4611 988 |
Slovenija Alcon d.o.o. W + 386 1 422 5280 |
|
Ireland Malta United Kingdom Alcon Laboratories (UK) Ltd. W + 44 (0) 871 376 1402 (United Kingdom) |
Slovenská republika Novartis Slovakia s.r.o. Alcon Division W + 421 2 5441 0378 |
|
Ísland |
Suomi/Finland |
|
Alcon Nordic A/S |
Alcon Nordic A/S |
|
® + 45 3636 4300 |
® + 45 3636 4300 |
|
Italia |
Sverige |
|
Alcon Italia S.p.A. |
Alcon Nordic A/S |
|
® + 39 02 81 80 31 |
® + 45 3636 4300 |
Fecha de la última revisión de este prospecto: xxxxxx.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Prospecto: información para el paciente
EMADINE 0,5 mg/ml Colirio en solución en envase monodosis.
Emedastina
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto
1. Qué es EMADINE y para qué se utiliza
2. Qué necesita saber antes de empezar a usar EMADINE
3. Cómo usar EMADINE
4. Posibles efectos adversos
5. Conservación de EMADINE
6. Contenido del envase e información adicional
1. Qué es EMADINE y para qué se utiliza
EMADINE es un medicamento para el tratamiento de la conjuntivitis alérgica estacional en los ojos (afecciones alérgicas de los ojos). Actúa disminuyendo la intensidad de la reacción alérgica.
Conjuntivitis alérgica. Algunos elementos (alergenos) como el polen, el polvo doméstico o el pelo de los animales pueden causar reacciones alérgicas que dan lugar a picor y enrojecimiento así como a inflamación de la superficie de sus ojos.
Debe consultar a un médico si empeora o si no mejora.
2. Qué necesita saber antes de empezar a usar EMADINE No use EMADINE
• Si es alérgico a la emedastina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Consulte a su médico.
Advertencias y precauciones
• No utilice EMADINE en niños menores de 3 años.
• No es recomendable utilizar EMADINE en pacientes mayores de 65 años, ya que en los estudios clínicos no se ha estudiado este grupo de edad.
• No se recomienda utilizar EMADINE en pacientes con problemas de hígado o de riñón.
Consulte a su médico o farmacéutico antes de empezar a usar EMADINE.
Uso de EMADINE con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Si utiliza otro colirio a la vez que EMADINE, siga la recomendación del final del apartado 3 “Cómo usar EMADINE”.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
Inmediatamente después de la aplicación de EMADINE puede notar que su visión se vuelve borrosa. No conduzca ni utilice máquinas hasta que su visión sea nítida.
3. Cómo usar EMADINE
Siga exactamente las instrucciones de administración de EMADINE indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es en adultos y niños mayores de 3 años: Una gota en el ojo, dos veces al día. Siga exactamente las instrucciones de administración del medicamento contenidas en este prospecto o las indicadas por su médico. En caso de duda pregunte a su médico o farmacéutico.
Estas gotas deben utilizarse únicamente en los ojos.
Para más información ver cara posterior
(Continúa)
3. Cómo usar EMADINE (continuación)
1
2
3
La dosis recomendada es Ver cara anterior del prospecto
No utilice un envase unidosis abierto anteriormente. No utilice ningún envase unidosis de un envoltorio de aluminio que haya sido abierto hace más de una semana.
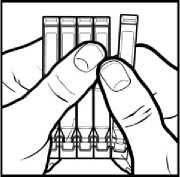
• Abra el envoltorio de aluminio y coja la tira de 5 envases unidosis.
• No utilice la solución si está turbia o si contiene partículas.
• Sostenga la tira con el extremo liso largo hacia arriba y separe uno de los envases unidosis estirando de él hacia usted mientras mantiene los demás sujetos firmemente. Tendrá que desprender los puntos en los que está unido a los otros envases (Figura 1).
• Quédese con el envase unidosis separado. Vuelva a colocar el resto de los envases unidosis en el sobre de aluminio.
• Asegúrese de que tiene a mano un espejo y lávese las manos.
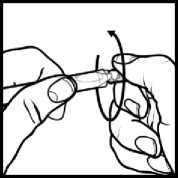
• Mantenga el extremo liso largo del envase unidosis entre sus dedos índice y pulgar y abra el envase girando el otro extremo (Figura 2).
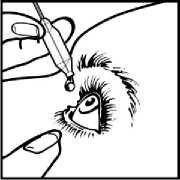
• Incline la cabeza hacia atrás. Separe suavemente el párpado del ojo con un dedo, hasta que se forme una bolsa, en la que deberá caer la gota.
• Sujete el envase con la punta abierta hacia abajo.
• Acerque la punta del envase unidosis al ojo. Puede serle útil el espejo.
• No toque el ojo, el párpado, zonas próximas ni otras superficies con la punta del envase unidosis, porque las gotas podrían infectarse.
• Apriete suavemente el envase unidosis para que caiga una gota en la bolsa formada entre el párpado y el ojo. (Figura 3).
• Si su médico le ha indicado que se aplique las gotas en ambos ojos, repita los pasos anteriores para el otro ojo empleando el mismo envase unidosis.
• Deseche inmediatamente el envase unidosis y la solución restante.
• Deseche cualquier envase unidosis no utilizado una semana después de haber abierto el envoltorio de aluminio-incluso los envases unidosis que aún están sin abrir.
Si accidentalmente ha ingerido o se ha inyectado EMADINE contacte con su médico inmediatamente. Podría alterar su ritmo cardíaco.
Si una gota cae fuera del ojo, inténtelo de nuevo.
Si se ha aplicado demasiada cantidad, puede eliminarla lavando los ojos preferiblemente con solución salina estéril o, si no es posible, con agua templada. No se aplique más gotas hasta que vuelva a tocarle.
Si olvidó aplicarse EMADINE cuando correspondía, aplíquese una gota en cuanto se dé cuenta y entonces continúe con su régimen habitual de tratamiento. No se aplique una dosis doble para compensar la olvidada.
Si está utilizando otro colirio, espere por lo menos 10 minutos entre la aplicación de EMADINE y de las otras gotas. Las pomadas deben administrarse en último lugar.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
A menos que los efectos sean graves, siga normalmente con el tratamiento. Si está preocupado por las molestias de estos efectos, consulte a su médico o farmacéutico.
Efectos adversos frecuentes
(pueden afectar hasta 1 de cada 10 personas)
Efectos en el ojo: dolor ocular, picor de ojos, enrojecimiento de los ojos
Efectos adversos poco frecuentes:
(pueden afectar hasta 1 cada 100 personas)
Efectos en el ojo: alteración corneal, sensación anormal en el ojo, incremento en la producción de lágrimas, ojos cansados, irritación del ojo, visión borrosa, manchas corneales, ojo seco.
Otros efectos: dolor de cabeza, dificultad para dormir, dolor de cabeza (alrededor de los senos nasales), mal sabor, erupción
Frecuencia no conocida
(no puede estimarse a partir de los datos disponibles)
Otros efectos: incremento de la frecuencia cardíaca Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de EMADINE
Mantener fuera de la vista y del alcance de los niños.
No utilice EMADINE después de la fecha de caducidad que aparece en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C.
Debe desechar cada envase unidosis inmediatamente después de utilizarlo. Debe desechar los envases unidosis no utilizados, una vez transcurrida una semana de la primera apertura del sobre de aluminio.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medioambiente.
6. Contenido del envase e información adicional Composición de EMADINE
-El principio activo es emedastina 0,5 mg/ml como difumarato.
-Los demás componentes son trometamol, cloruro de sodio, hipromelosa y agua purificada. Se añaden cantidades muy pequeñas de ácido clorhídrico y/o hidróxido de sodio para mantener los niveles de acidez (niveles de pH) normales.
Aspecto del producto y contenido del envase
EMADINE es un líquido (una solución) que se presenta en envases unidosis de plástico de 0,35 ml. Un sobre contiene cinco envases unidosis. EMADINE se presenta en cajas que contienen 30 ó 60 unidades. Es posible que no se comercialicen todas las presentaciones.
|
Titular de la autorización de comercialización |
Fabricante |
|
Alcon Laboratories (UK) Ltd., Frimley Business Park Frimley Camberley Surrey GU16 7SR Reino Unido |
S.A. Alcon-Couvreur N.V. Rijksweg 14 B-2870 Puurs Bélgica |
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:.
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Alcon NV W + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien) |
Latvija Alcon Pharmaceuticals Ltd W + 371 67 321 121 |
|
Etnrapun Ahkoh Etnrapna EOOfl W + 359 2 950 15 65 |
Lietuva Alcon Pharmaceuticals Ltd. atstovybé W + 370 5 2 314 756 |
|
Ceská republika Alcon Pharmaceuticals (Czech Republic) s.r.o. W + 420 225 775 111 |
Magyarország Alcon Hungária Gyógyszerkereskedelmi Kft W + 36-1-463-9080 |
|
Danmark Alcon Nordic A/S W + 45 3636 4300 |
Nederland Alcon Nederland BV W + 31 (0) 183 654321 |
|
Deutschland Alcon Pharma GmbH W + 49 (0)761 1304-0 |
Norge Alcon Nordic A/S W + 45 3636 4300 |
|
EXXába Kúrcpog A^kov Aagnopáxopig E^ág AEBE W + 30 210 68 78 300 (EUáSa) |
Osterreich Alcon Ophthalmika GmbH W + 43 (0)1 596 69 70 |
|
Eesti Alcon Pharmaceuticals Ltd. Eesti filiaal W + 372 6 313 214 |
Polska Alcon Polska Sp. z o.o. W + 48 22 820 3450 |
|
España Alcon Cusí, S.A. W + 34 93 497 7000 |
Portugal Alcon Portugal - Produtos e Equipamentos Oftalmológicos, Lda. W + 351 214 400 300 |
|
France Laboratoires Alcon W + 33 (0)1 47 10 47 10 |
Romania S.C. Alcon Romania S.R.L. W + 40 21 203 93 24 |
|
Hrvatska Alcon Farmaceutika d.o.o. W + 385 1 4611 988 |
Slovenija Alcon d.o.o. W + 386 1 422 5280 |
|
Ireland Malta United Kingdom Alcon Laboratories (UK) Ltd. W + 44 (0) 871 376 1402 (United Kingdom) |
Slovenská republika Novartis Slovakia s.r.o. Alcon Division W + 421 2 5441 0378 |
|
Ísland Alcon Nordic A/S W + 45 3636 4300 |
Suomi/Finland Alcon Nordic A/S W + 45 3636 4300 |
Italia
Sverige
Alcon Nordic A/S ® + 45 3636 4300
Alcon Italia S.p.A. ® + 39 02 81 80 31
Fecha de la última revisión de este prospecto: xxxxxx.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
39