Elumatic-Iii 2-20 Gbq Generador De Radionucleido
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
ELUMATIC III 2-20 GBq generador de radionucleido
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
• El radionucleido padre se presenta como: Molibdato (99Mo) de sodio: actividad variable
• El radionucleido hijo se presenta como: Pertecnetato (99mTc) de sodio (obtenido por fisión): de 2 a 20 GBq / generador en la fecha y hora de calibración.
Actividades disponibles: 2 GBq, 4 GBq, 6 GBq, 8 GBq, 10 GBq, 12 GBq, 16 GBq ó 20 GBq.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Generador de radionucleido
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Este medicamento es únicamente para uso diagnóstico.
El eluido del generador (solución inyectable de pertecnetato (99mTc) de sodio, Ph.Eur) puede utilizarse como reactivo para el marcaje de varios compuestos portadores que se suministran como equipos de reactivos, o bien puede administrarse directamente in vivo.
Cuando se administra por vía intravenosa, la solución estéril de pertecnetato (99mTc) de sodio se utiliza como ayuda diagnóstica en los siguientes procedimientos:
a) Gammagrafía tiroidea: obtención directa de imágenes y medida de la captación tiroidea para obtener información sobre el tamaño, posición, nodularidad y función de la glándula en la enfermedad tiroidea.
b) Gammagrafía salival: evaluación de la función de las glándulas salivales y de la permeabilidad del conducto.
c) Localización de mucosa gástrica ectópica: divertículo de Meckel.
d) Gammagrafía cerebral: identificación de fisuras de la barrera hematoencefálica producidas por un tumor, infarto, hemorragia o edema, cuando no existen otros métodos disponibles.
Cuando se utiliza junto con un tratamiento previo con un agente reductor para efectuar el marcaje de los hematíes con tecnecio (99mTc):
e) Gammagrafía cardíaca y vascular:
-Angiocardiogammagrafía para:
❖ evaluación de la fracción de eyección ventricular
❖ evaluación de la motilidad global y regional de la pared cardíaca
❖ obtención de imágenes de fase miocárdica
- Obtención de imágenes de perfusión de órganos o de anomalías vasculares.
f) Diagnóstico y localización de hemorragia gastrointestinal oculta
Después de una instilación ocular de solución estéril de pertecnetato (99mTc) de sodio: g) Gammagrafía del conducto lacrimal: evaluación de la permeabilidad de los conductos lacrimales.
4.2 Posología y forma de administración Posología
La actividad recomendada se detalla a continuación:
- Adultos:
• Gammagrafía tiroidea: 18,5 - 80 MBq
• Gammagrafía salival: 40 MBq
• Gammagrafía del divertículo de Meckel: 400 MBq
• Gammagrafía cerebral: 370 - 800 MBq
• Gammagrafía cardíaca y vascular: 740 - 925 MBq
• Hemorragia gastrointestinal: 740 - 925 MBq
• Gammagrafía del conducto lacrimal: 2 - 4 MBq en cada ojo
Pacientes de edad avanzada (mayor de 65 años de edad): No se requiere un esquema de dosificación especial.
Población pediátrica (menor de 18 años de edad): Debe administrarse una fracción de la actividad recomendada para los adultos en función del peso corporal, utilizando los siguientes coeficientes:
|
3 kg = 0,10 |
12 kg = 0,32 |
22 kg = 0,50 |
32 kg = 0,65 |
42 kg = 0,78 |
52-54 kg = 0,90 |
|
4 kg = 0,14 |
14 kg = 0,36 |
24 kg = 0,53 |
34 kg = 0,68 |
44 kg = 0,80 |
56-58 kg = 0,92 |
|
6 kg = 0,19 |
16 kg = 0,40 |
26 kg = 0,56 |
36 kg = 0,71 |
46 kg = 0,82 |
60-62 kg = 0,96 |
|
8 kg = 0,23 |
18 kg = 0,44 |
28 kg = 0,58 |
38 kg = 0,73 |
48 kg = 0,85 |
64-66 kg = 0,98 |
|
10 kg = 0,27 |
20 kg = 0,46 |
30 kg = 0,62 |
40 kg = 0,78 |
50 kg = 0,88 |
68 kg = 0,99 |
En niños muy pequeños (hasta 1 año de edad) se precisa una dosis mínima de 20 MBq (10 MBq en gammagrafía tiroidea) por administración directa, o de 80 MBq para el marcaje de hematíes, con el fin de obtener imágenes de calidad suficiente.
Método de administración de ELUMATIC III y exploración diagnóstica
Este medicamento debe ser administrado exclusivamente por personal autorizado (ver apartado “Advertencias generales” en la sección 4.4.).
El pertecnetato (99mTc) de sodio se administra generalmente por vía intravenosa, aunque existe indicación específica para instilación ocular, con actividades que varían considerablemente dependiendo de la información clínica requerida y el equipo utilizado. En determinadas indicaciones, puede ser necesario el tratamiento previo de los pacientes con agentes bloqueantes del tiroides o con agentes reductores.
Adquisición de las imágenes
• Gammagrafía tiroidea: se realiza 20 minutos después de la inyección intravenosa
• Gammagrafía salival: se realiza inmediatamente después de la inyección intravenosa y a intervalos regulares durante 15 minutos.
• Gammagrafía del divertículo de Meckel: se realiza inmediatamente después de la inyección intravenosa y a intervalos regulares durante 30 minutos.
• Gammagrafía cerebral: incluye imágenes secuenciales rápidas obtenidas inmediatamente, en el primer minuto tras la administración intravenosa. Imágenes estáticas obtenidas 1 a 4 horas más tarde. La glándula tiroides y los plexos coroideos deben ser bloqueados con el fin de evitar la captación no específica de tecnecio (99mTc).
• Gammagrafía cardíaca y vascular: se marcan hematíes in vivo o in vitro mediante un tratamiento previo con un agente reductor. Las imágenes dinámicas se obtienen en el primer minuto después de la administración intravenosa, seguidas de imágenes estáticas durante 30 minutos.
• Hemorragia gastrointestinal: se marcan hematíes in vivo o in vitro mediante un tratamiento previo con un agente reductor. Las imágenes dinámicas se obtienen en el primer minuto después de la administración intravenosa, seguidas de imágenes estáticas a intervalos apropiados durante un período máximo de 24 horas.
• Gammagrafía del conducto lacrimal: las gotas se instilan en el ojo y se obtienen imágenes dinámicas durante 2 minutos, seguidas por imágenes estáticas a intervalos apropiados durante 20 minutos.
Para instrucciones detalladas sobre la correcta administración/uso de Elumatic III, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de sus componentes.
4.4 Advertencias y precauciones especiales de empleo Indicación de la exploración
Para todos los pacientes: la exposición a la radiación ionizante debe estar justificada en función del objetivo médico esperado, obtenido con la mínima dosis posible de radiación recibida por el paciente.
En pacientes con disminución de la función renal: es posible que la exposición a la radiación sea mayor en estos pacientes.
En población pediátrica (menor de 18 años de edad): debe tenerse en cuenta que la dosis efectiva por MBq es mayor que en adultos (ver sección 11. “Dosimetría”).
Advertencias generales
Los radiofármacos deben ser recibidos, utilizados y administrados exclusivamente por personal cualificado, que esté debidamente autorizado para el uso y manipulación de radionucleidos, en centros asistenciales autorizados. Su recepción, almacenamiento, uso, transporte y eliminación están sujetos a las normas y/o licencias correspondientes de los organismos oficiales competentes.
Los radiofármacos destinados a la administración a pacientes deben ser preparados por el usuario de manera que cumplan tanto los requisitos de seguridad radiológica como de calidad farmacéutica. Se deben tomar las precauciones asépticas apropiadas de acuerdo con las Normas de Correcta Fabricación y Uso de Radiofármacos.
Advertencias relacionadas con los excipientes
El contenido de sodio de este medicamento es 3,6 mg/ml. Dependiendo del volumen inyectado, esto debe ser tenido en cuenta en pacientes con una dieta controlada en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se han notificado interacciones farmacológicas en la gammagrafía cerebral, donde puede existir mayor captación de pertecnetato (99mTc) en las paredes de los ventrículos cerebrales como resultado de una ventriculitis inducida por metotrexato. En la captación de imágenes abdominales, fármacos tales como la atropina, la isoprenalina y los analgésicos pueden producir un retraso en el vaciamiento gástrico y en la redistribución del pertecnetato.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad_fértil:
Cuando sea necesario administrar radiofármacos a una mujer en edad fértil, deben buscarse siempre indicios de un posible embarazo. Toda mujer que presente retraso en la menstruación debe considerarse embarazada mientras no se demuestre lo contrario. En caso de duda, es fundamental que la exposición a la radiación sea la mínima necesaria para obtener la información clínica deseada. Debe considerarse la posibilidad de realizar técnicas alternativas que no impliquen el uso de radiaciones ionizantes.
Mujeres embarazadas:
Se ha observado que el tecnecio (99mTc) (como pertecnetato libre) atraviesa la barrera placentaria.
Los procedimientos con radionucleidos llevados a cabo en mujeres embarazadas suponen además dosis de radiación para el feto. Durante el embarazo, sólo deben llevarse a cabo los estudios estrictamente necesarios, cuando el beneficio probable supere el riesgo que sufren la madre y el feto. La administración directa de 800 MBq de pertecnetato (99mTc) de sodio a un paciente supone una dosis absorbida por el útero de 6,5 mGy. Después de un tratamiento previo en pacientes con un agente bloqueante, la administración de 800 MBq de pertecnetato (99mTc) de sodio supone una dosis absorbida por el útero de 5,3 mGy. La administración de 925 MBq de hematíes marcados con 99mTc supone una dosis absorbida por el útero de
4,3 mGy. Las dosis superiores a 0,5 mGy deben considerarse como un riesgo potencial para el feto.
Lactancia:
Antes de administrar un radiofármaco a una mujer que está amamantando a su hijo, debe considerarse la posibilidad de retrasar razonablemente el estudio hasta que la madre haya suspendido la lactancia y plantearse si se ha seleccionado el radiofármaco más adecuado, teniendo en cuenta la secreción de actividad en la leche materna. Si la administración se considera necesaria, debe interrumpirse la lactancia durante 12 horas y desechar la leche extraída. Debe considerarse la posibilidad de extraer la leche antes de la administración y almacenarla para su posterior uso. La lactancia puede reanudarse cuando el nivel de actividad en la leche no suponga una dosis de radiación para el lactante superior a 1 mSv.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han descrito efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Para todos los pacientes: la exposición a la radiación ionizante debe estar justificada en función del objetivo médico esperado, obtenido con la mínima dosis posible de radiación recibida por el paciente.
La exposición a la radiación ionizante está vinculada a la inducción de cáncer y a la posibilidad de desarrollar defectos hereditarios. La probabilidad de que se produzcan estas reacciones es baja debido a las bajas dosis de radiación recibidas. Después de la administración de la máxima actividad recomendada de este producto, la dosis efectiva es de aproximadamente 17,2 mSv.
En pacientes con disminución de la función renal: ver apartado “Indicación de la exploración” en sección 4.4.
En población pediátrica (menor de 18 años de edad): ver apartado “Indicación de la exploración” en sección 4.4.
Reacciones adversas
Las frecuencias indicadas a continuación están definidas según la siguiente convención:
Muy frecuentes (>1/10)_
Frecuentes (>1/100 a <1/10)_
Poco frecuentes (>1/1,000 a <1/100)_
Raras (>1/10,000 a <1/1,000)_
Muy raras (<1/10,000)_
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
|
Clasificación de órganos del sistema MedDRA |
Reacciones adversas |
Frecuencia |
|
Trastornos del sistema inmunológico |
Hioersensibilidad |
Frecuencia no conocida |
|
Trastornos del sistema nervioso |
Coma |
Frecuencia no conocida |
|
Trastornos cardiacos |
Arritmia |
Frecuencia no conocida |
|
Trastornos vasculares |
Vasodilatación |
Frecuencia no conocida |
|
Trastornos de la piel y del tejido subcutáneo |
Urticaria |
Frecuencia no conocida |
|
Prurito |
Frecuencia no conocida | |
|
Trastornos generales y alteraciones en el lugar de administración |
Edema de cara Extravasación |
Frecuencia no conocida Frecuencia no conocida |
Se han notificado reacciones alérgicas tras la inyección intravenosa de pertecnetato (99mTc) de sodio, que incluyen urticaria, edema facial, vasodilatación, prurito, arritmia cardíaca y coma.
Se ha informado sobre reacciones por extravasación.
4.9 Sobredosis
En caso de administración accidental de una sobredosis de radiación con pertecnetato (99mTc) de sodio, debe reducirse la dosis absorbida, cuando sea posible, aumentando la eliminación del radionucleido del organismo. Las medidas para reducir los posibles efectos perjudiciales incluyen un vaciamiento frecuente de la orina y el incremento de la diuresis y de la excreción fecal.
En caso de una sobredosis de hematíes marcados con tecnecio-99m (99mTc) existen muy pocos tratamientos de apoyo, en caso de que puedan realizarse, ya que la eliminación depende del proceso hemolítico normal.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Radiofármacos para diagnóstico, código ATC: V09FX01.
A las concentraciones químicas y actividades utilizadas para las exploraciones diagnósticas no parece que el pertecnetato (99mTc) tenga actividad farmacodinámica.
5.2 Propiedades farmacocinéticas
El ion pertecnetato tiene una distribución biológica similar a la los iones yoduro y perclorato, concentrándose temporalmente en las glándulas salivales, plexos coroideos, estómago (mucosa gástrica) y en la glándula tiroides, de donde se libera en forma intacta. El ion pertecnetato tiende además a concentrarse en áreas con mayor vascularización o con alteración de la permeabilidad vascular, especialmente cuando el tratamiento previo con agentes bloqueantes inhibe la captación en las estructuras glandulares. El tecnecio (99mTc) no atraviesa de forma selectiva la barrera hematoencefálica intacta.
Tras administración intravenosa, el pertecnetato (99mTc) se distribuye por todo el sistema vascular, del cuál se elimina por tres mecanismos principales:
• eliminación rápida, que depende del equilibrio de la difusión con respecto al líquido intersticial,
• tasa intermedia de eliminación, que depende de la concentración del pertecnetato en los tejidos glandulares, principalmente las glándulas tiroides, salivales y del fundus gástrico que tienen un mecanismo de bombeo iónico,
• eliminación lenta, mediante filtración glomerular en los riñones, que depende de la tasa de excreción urinaria.
El aclaramiento plasmático tiene una vida media de aproximadamente 3 horas.
La excreción durante las primeras 24 horas después de la administración es principalmente urinaria (aproximadamente el 25%) y la excreción fecal se produce en las 48 horas siguientes. Aproximadamente el 50% de la actividad administrada se excreta en las primeras 50 horas.
Cuando se inhibe la captación selectiva de pertecnetato (99mTc) en las estructuras glandulares mediante la administración previa de agentes bloqueantes, la excreción sigue las mismas vías, pero la tasa de aclaramiento renal es mayor.
Cuando se administra pertecnetato (99mTc) en asociación con un tratamiento previo con agentes reductores, tales como medronato/estaño que producen una “carga de estaño” en los hematíes, hasta aproximadamente el 95 % de la actividad administrada es captada por los hematíes donde queda fijada en el interior de las células. El pertecnetato (99mTc) no fijado es aclarado por los riñones; la radioactividad en el plasma constituye normalmente menos del 5% de la actividad intravascular.
La concentración de tecnecio (99mTc) sigue la de los hematíes marcados y la actividad es aclarada muy lentamente. Se cree que se produce una elución mínima de la actividad de los hematíes circulantes.
5.3 Datos preclínicos sobre seguridad
a) No se dispone de información sobre toxicidad aguda, subaguda o crónica por la administración de dosis única o administración continuada. La cantidad de pertecnetato (99mTc) de sodio administrada durante los procedimientos de diagnóstico clínico es muy baja y, aparte de reacciones alérgicas, no se han notificado otras reacciones adversas.
b) Toxicidad en la reproducción
Se ha estudiado en ratones la transferencia placentaria del tecnecio-99m (99mTc) a partir de la administración de pertecnetato (99mTc) de sodio por vía intravenosa. Se observó que el útero grávido contiene hasta el 60% del tecnecio (99mTc) inyectado cuando se administró sin tratamiento previo con perclorato. Los estudios realizados en ratones preñados durante la gestación, durante la gestación y lactancia, y solamente durante la lactancia, muestran cambios en la progenie que incluyen reducción de peso, desaparición del pelo y esterilidad.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
El tecnecio (99mTc) se genera a partir del molibdato (99Mo) de sodio adsorbido sobre una columna de alúmina. La columna del generador se eluye con una solución de elución, que contiene cloruro de sodio al 0,9 % y nitrato de sodio al 0,005 %, para producir el eluido, solución inyectable de pertecnetato (99mTc) de sodio, el cual contiene los siguientes excipientes:
Alúmina
Cloruro de sodio al 0,9 %
Nitrato de sodio al 0,005 %
6.2 Incompatibilidades
El pertecnetato (99mTc) de sodio interacciona con los antiácidos basados en el aluminio, con las sulfamidas, con las preparaciones que contienen iones estannosos y productos radiofarmacéuticos. Las exploraciones que aprovechan estas interacciones son la gammagrafía cerebral y tiroidea, y la gammagrafía del divertículo de Meckel. Estas interacciones originan efectos específicos en las imágenes: las preparaciones mencionadas pueden impedir que el pertecnetato abandone el espacio vascular, incrementando el “pool” de actividad en la sangre, que puede visualizarse fácilmente. Por ejemplo, durante la gammagrafía cerebral, se observa incremento de actividad, a nivel del seno sagital superior, senos transversos, y en la región de los plexos coroideos (si la gammagrafía se realiza después de un rastreo óseo).
La falta o la disminución de fijación del pertecnetato (99mTc) en los tejidos normales (tales como el tiroides) o en los tejidos alterados (como en la patología del cerebro) puede conducir a errores de diagnóstico.
Sin embargo, se mantiene la controversia relativa a la administración preliminar de iones estannosos en el tiroides y en el estómago, en el sentido de si ésta provoca un aumento o una disminución de la fijación del pertecnetato (99mTc) de sodio en estos órganos.
Este medicamento no debe mezclarse con otros excepto con los mencionados en el epígrafe 6.6.
6.3 Periodo de validez
El período de validez del generador es de 20 días a partir de la fecha de fabricación. La fecha de caducidad está indicada en la etiqueta.
Una vez eluído, la solución inyectable de pertecnetato (99mTc) de sodio debe ser utilizada en las 10 horas posteriores a la elución.
6.4 Precauciones especiales de conservación
El generador ELUMATIC III debe ser almacenado a una temperatura entre 15 y 25°C, preferiblemente dentro del blindaje específico para almacenamiento y elución "PROTEC-ELU" (disponible bajo pedido) o detrás de una protección de plomo con espesor adecuado. Una vez eluído, la solución inyectable de pertecnetato (99mTc) de sodio debe ser conservada en nevera (entre 2 °C y 8 °C).
El almacenamiento debe realizarse conforme a la normativa nacional sobre materiales radiactivos.
6.5 Naturaleza y contenido del envase
El generador ELUMATIC III es un sistema que permite la elución de solución inyectable de pertecnetato (99mTc) de sodio (obtenido por fisión).
El envase contiene un generador y viales de elución.
Generador
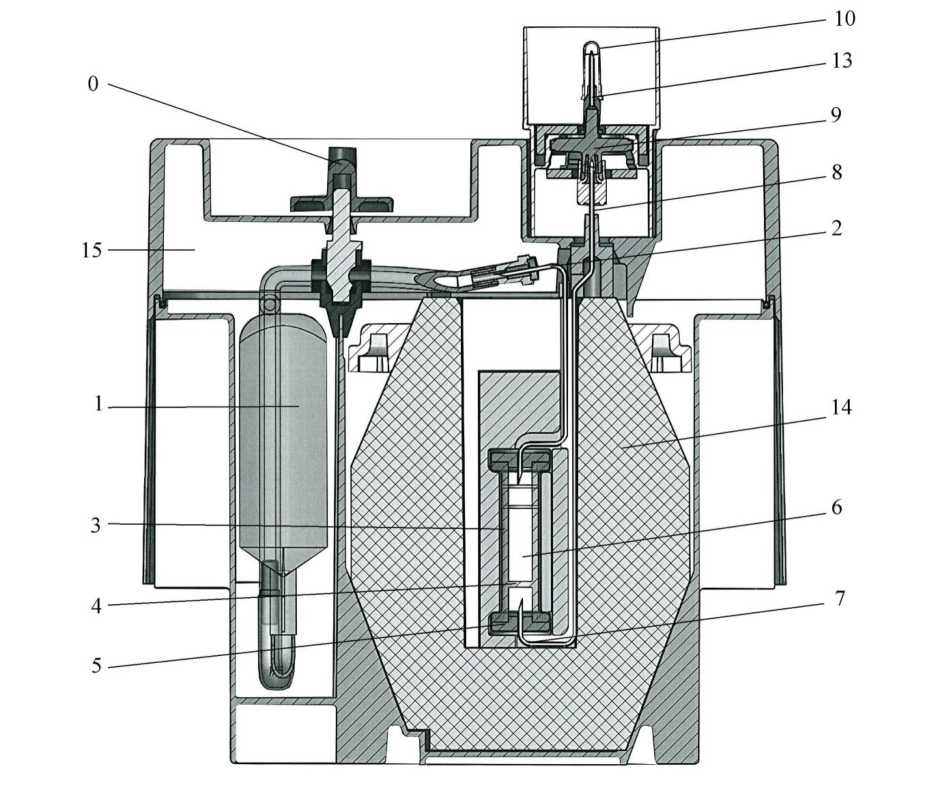
Este generador incluye :
- Una bolsa plástica flexible (1) que contiene el eluyente (solución acuosa de cloruro de sodio al 0,9% y nitrato de sodio al 0,005%). La bolsa está conectada a través de una aguja de acero inoxidable (2) a la parte superior de la columna cromatográfica.
- Una columna cromatográfica de vidrio (3) con un filtro en la parte inferior (4) para impedir cualquier pérdida de alúmina. La columna se encuentra cerrada en ambos extremos con tapas sujetas por cápsulas metálicas (5). Esta columna contiene la alúmina (6), que adsorbe los iones molibdato y que es inerte con respecto a los iones pertecnetato.
- Una aguja con un extremo conectado a la parte inferior de la columna (7). El otro extremo (8) está conectado a una unidad de filtración esterilizante (9). La esterilidad de la aguja de elución de la unidad (13) se mantiene gracias a un tapón protector (10).
La columna y las agujas se encuentran protegidas por un blindaje de plomo cilíndrico-cónico (14), de un grosor mínimo de 52 mm. Todo el sistema se encuentra instalado sobre una cubierta en forma de paralelepípedo (23 x 21 x 14 cm) hecha de nylon moldeado (15).
Cerca de la instalación de elución se encuentra una cavidad con una válvula de seguridad (0) cerrada durante el transporte (O).
La solución inyectable de pertecnetato (99mTc) de sodio obtenida es estéril y libre de pirógenos y cumple con los requisitos de la Farmacopea Europea y de la U.S. Pharmacopoeia, incluyendo los de pureza radioquímica (superior o igual al 95%, valor promedio de 99%) y de pureza radionucleídica (en la fecha y hora de calibración: 99Mo < 0,1%, 131I < 5x10-3%, 103Ru < 5x10-3%, 89Sr < 6x10-5%, 90Sr < 6 x10-6%, impurezas que emiten alfa < 1x10-7%, otras impurezas que emiten gamma < 0,01%). La solución es límpida e incolora, con un pH entre 4,0 y 8,0, y no contiene preservantes antimicrobianos. Esta solución es el eluído de una columna cromatográfica con alúmina en la que se fija el molibdeno (99Mo) (t1/2 = 66 horas) producido por fisión, padre del tecnecio (99mTc) (t1/2 = 6,02 horas). El sistema es automático y se encuentra blindado.
Características del eluído (ver tabla siguiente):
|
pH |
Al |
99Mo/99mTc |
131I/99mTc |
130Ru/99mTc | |
|
ELUMATIC III |
5,5 |
No detectable* |
2x10-5 * |
2x10-8 * |
3x10-9 * |
|
Tolerancias de la Pharmacopoeia |
4 -8 |
< 5pg/ml |
< 10-3 |
< 5x10-5 |
< 5x10-5 |
|
* Valores máximos registrados el día de la calibración desde el |
1 de Enero de 1 |
992. | |||
El generador ELUMATIC III se suministra en un tambor hermético de metal y incluye:
- Diez capuchones esterilizados para agujas, de un solo uso
- Bolsa de 10 viales de elución de 15 ml (TC-ELU 5) estériles, apirógenos y bajo vacío parcial que permiten una elución de 5 ml.
El contenedor de elución se suministra con el primer pedido.
Los viales de elución son viales de 15 ml, incoloros, de vidrio rotulado tipo I de la Farmacopea Europea, cerrados con tapón de goma de clorobutilo y cápsulas de aluminio.
Tamaño del envase: El generador contiene 2, 4, 6, 8, 10, 12, 16 o 20 GBq de pertecnetato (99mTc) de sodio en la fecha de calibración.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Los residuos radiactivos deben eliminarse conforme a la normativa nacional e internacional vigente.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
La administración de radiofármacos supone un riesgo para otras personas por la radiación externa o la contaminación por derrames de orina, vómitos, etc. Por lo tanto, deben adoptarse las medidas de protección radiológica conforme a la legislación nacional.
Previo a su uso, debe verificarse el embalaje, la limpidez, el pH, radiactividad y espectro gamma.
Elución
Deben seguirse las precauciones habituales de esterilidad y seguridad radiológica.
Desinfectar el tapón de los viales de elución antes de cada elución.
Advertencia:
No utilizar etanol ni éter etílico para desinfectar la aguja o el tapón del vial de elución, ya que pueden interferir con el proceso de elución.
Entre dos eluciones, proteger la aguja de elución (13) de una posible contaminación bacteriana colocando uno de los diez capuchones de aguja sobre esta aguja.
Seguir las secuencias indicadas a continuación para obtener resultados satisfactorios.
Primera elución:
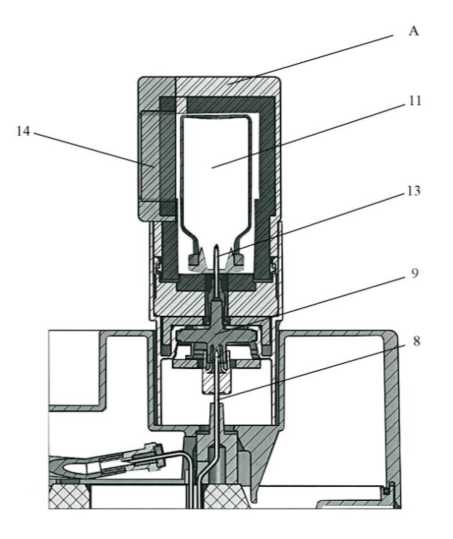
Cuando se comienza a usar el generador, ABRIR la válvula de seguridad (n° 0: ©), ANTES de colocar el vial de elución en su lugar. JAMÁS cerrar la válvula entre dos eluciones. Cerrarla sólo cuando el generador no vaya a ser utilizado nunca más.
Para eluir el generador, sustituir el tapón protector de la aguja de elución (10) por el contenedor de elución (A) con un vial de elución (11) correspondiente al volumen de elución deseado.
La elución puede observarse a través de la ventana de cristal de plomo (14) del contenedor (A). Esperar al menos tres minutos para que la elución sea completa.
Antes de utilizar, verificar la limpidez del eluído. Si el eluido no es transparente, debe desecharse.
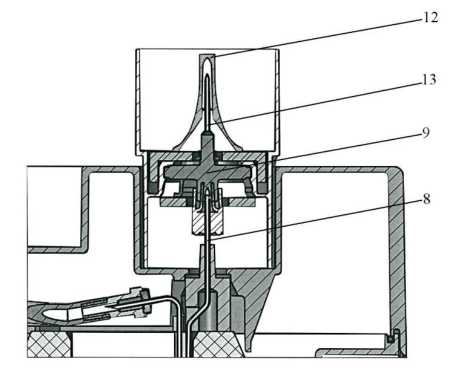
Después de la elución, sustituir inmediatamente el contenedor (A) por uno de los capuchones esterilizados (12) sobre la aguja.
Volúmenes de elución
El generador ELUMATIC III ha sido diseñado para eluir toda la actividad de tecnecio (99mTc) disponible en 5 ml. Por lo tanto, son innecesarias las eluciones fraccionadas. Por otra parte, la elución puede desarrollarse en volúmenes mayores, tales como 10 ó 15 ml.
Posibilidades de utilización
La actividad que aparece en la etiqueta del ELUMATIC III se expresa en tecnecio (99mTc) disponible en la fecha y hora de calibración (12:00 h, hora central europea-CET).
La actividad disponible del tecnecio (99mTc) depende de:
- la actividad del molibdeno (99Mo) en el momento de la elución
- el tiempo transcurrido desde que fue realizada la última elución.
Las actividades de tecnecio (99mTc) disponibles con eluciones realizadas cada 24 horas pueden ser calculadas mediante los datos de la tabla 1.
TABLA 1
Actividad disponible en porcentaje de tecnecio (99mTc) en la fecha y hora de calibración (valores redondeados)
|
Días previos |
Fecha de calibración | |||||||
|
-8 |
-7 |
-6 |
-5 |
-4 |
-3 |
-2 |
-1 |
0 |
|
751 |
584 |
454 |
353 |
274 |
213 |
166 |
129 |
100 |
|
Actividad disponible en porcentaje de tecnecio (99mTc) en la fecha de calibración (valores redondeados) | ||||||||
|
Fecha de calibración |
Días siguientes | |||||||||||||
|
0 |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
+9 |
+10 |
+11 |
+12 |
+13 |
+14 |
|
100 |
78 |
60 |
47 |
36 |
28 |
22 |
17 |
13 |
10 |
8 |
6 |
5 |
4 |
3 |
|
Actividad disponible en porcentaje de tecnecio (99mTc) en la fecha de calibración (valores redondeados) | ||||||||||||||
Es también posible eluir el ELUMATIC III antes de que hayan transcurrido 24 horas realizando eluciones "de tiempo parcial". La tabla 2 muestra el porcentaje de actividad del tecnecio (99mTc) que puede ser recogido después de períodos de tiempo que varían de 0 a 23 horas.
TABLA 2
Actividad disponible en porcentaje de tecnecio (99mTc) en el momento de la elución previa (si se hace aproximadamente 24 horas después de esa elución previa)
|
Tiempo transcurrido desde la última elución (horas) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
23 |
|
Factor de corrección |
0,00 |
0,11 |
0,21 |
0,30 |
0,39 |
0,45 |
0,51 |
0,62 |
0,71 |
0,79 |
0,85 |
0,89 |
0,93 |
0,96 |
0,99 |
1,00 |
|
Desintegrad ón del molibdeno (99Mo) (ver cuadro 1 referente a la desintegraci ón del molibdeno (99Mo ) |
100 |
98,9 5 |
97,9 2 |
96,9 0 |
95,8 9 |
94,8 8 |
93,9 7 |
91,9 4 |
90,0 3 |
88,1 6 |
86,3 3 |
84,5 3 |
82,7 8 |
81,0 5 |
79,3 7 |
78,5 4 |
|
% de tecnecio (99mTc) disponible (valores redondeados ) |
0 |
11 |
21 |
29 |
37 |
43 |
48 |
57 |
64 |
70 |
73 |
75 |
77 |
78 |
79 |
79 |
|
Actividad disponible en porcentaje de tecnecio (99mTc) en el momento de la elución previa (si se hace aproximadamente 24 horas después de esa elución previa) | ||||||||||||||||
CUADRO 1

1 d
CUADRO 2

Ejemplos
a) Un generador de 10 GBq es eluído 24 horas después de la fecha y hora de calibración. La actividad del tecnecio (99mTc) recolectada es (tabla 1):
10 x 18 = 7,8 GBq 100
b) El mismo generador es eluído 6 horas más tarde. La actividad del tecnecio (99mTc) recolectada es (tablas 1 y 2):
7,8 x _i8 = 3,7 GBq 100
c) El mismo generador es eluído 18 horas más tarde, es decir, 48 horas después de la fecha y hora de calibración. Las 24 horas que se requieren para alcanzar el equilibrio entre molibdeno (99Mo) y tecnecio (99mTc) no han transcurrido aún y la actividad del tecnecio (99mTc) recolectada será en vez de 6,0 GBq (tablas 1 y 2: factor correctivo):
6,0 x _93_ = 5,6 GBq 100
Esto queda resumido en la tabla 3.
TABLA 3
|
Lunes |
Martes |
Miércoles |
Jueves |
Viernes | |
|
Hora de elución |
8 a.m. |
8 a.m. |
8 a.m. |
8 a.m. |
8 a.m. |
|
Radioactividad eluída 10 GBq el martes |
13 |
10 |
7,8 |
6,0 |
4,7 | ||
|
Hora de elución |
8 a.m. |
8 a.m. |
8 a.m. |
2 p.m. |
8 a.m. |
12 a.m. |
8 a.m. |
|
Mis mo generador eluído a diferentes horas (GBq) |
13 |
10 |
7,8 |
3,7 |
5,6 |
2,1 |
4,5 |
Nota:
En caso que el usuario espere 48 horas o más entre dos eluciones, obtendrá la actividad indicada en tabla 1 multiplicada por 1,1 (este factor representa la "tasa de equilibrio" que aparece después de 48 horas entre el molibdeno (99Mo) y el tecnecio (99mTc)). Esta observación se aplica en particular:
-a la primera elución: la elución previa fue realizada en el laboratorio fabricante, varios días antes;
-cuando el generador tiene una elevada actividad.
Importancia de las eluciones de tiempo parcial
La utilización potencial de un generador puede aumentarse de manera considerable mediante eluciones de tiempo parcial. ELUMATIC III tiene la ventaja de presentar volúmenes de elución pequeños. Cuando se elige un volumen adecuado para el vial de elución, la concentración radiactiva deseada puede obtenerse incluso si el período de tiempo entre dos eluciones es de pocas horas.
Ejemplo:
Una elución de 10 GBq ha sido realizada a las 10:00 horas con 15 ml. La concentración radiactiva es 0,67 GBq/ml Una nueva elución realizada a las 14:00 horas, 4 horas después de la primera, proporciona 3,7 GBq Si esta actividad es recogida en 5 ml en vez de 15 ml, como la primera vez, la concentración radiactiva, 0,74 GBq/ml será superior a la de la mañana.
En la tabla 4 muestra que se puede obtener una concentración radiactiva constante durante toda la semana:
TABLA 4
|
Fecha de calibració n |
Eluciones los días siguientes | |||||
|
0 |
+1 |
+2 |
+3 |
+4 |
+5 | |
|
Actividad eluída: GBq |
10 |
7,8 |
6,0 |
4,7 |
3,6 |
2,8 |
|
Volumen de elución: ml |
15 |
15 |
10 |
8* |
5 |
5 |
|
Concentración radiactiva: GBq/ml |
0,67 |
0,52 |
0,60 |
0,59 |
0,72 |
0,56 |
* Para alcanzar un volumen final de 8 ml, se añaden 3 ml de una inyección de cloruro de sodio al 0,9% a los 5 ml eluídos en un vial TC-ELU-5.
Advertencia:
La radioactividad máxima contenida en el generador en el momento de la recepción puede ser superior a la indicada en la etiqueta de la fecha y hora de calibración correspondiente. Remitirse al Cuadro 3, que indica la máxima radioactividad del pertecnetato (99mTc) de sodio eluible para cada contenido del generador, con el fin de determinar la máxima radioactividad contenida en el generador en el momento de la recepción.
CUADRO 3
Radioactividad máxima del pertecnetato (99mTc) de sodio eluible en función del contenido del generador (en este cuadro el eje x corresponde a los días, siendo el valor “0” el día de la calibración, mientras que el eje y proporciona la radioactividad en dichos días).
|
-8 |
-7 |
-6 |
-5 |
-4 |
-3 |
-2 |
-1 |
0 |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
+9 |
+1 0 |
+1 1 |
+1 2 |
+1 3 |
+1 4 |
540 | ||
|
GB q |
2 |
15,02 |
11,67 |
9,07 |
7,05 |
5,48 |
4,26 |
3,31 |
2,57 |
2 |
1,55 |
1,21 |
0,9 4 |
0,7 3 |
0,5 7 |
0,4 4 |
0,3 4 |
0,2 7 |
0,2 1 |
0,1 6 |
0,1 3 |
0,1 0 |
0,0 8 |
0,0 6 |
2 |
|
GB q |
4 |
30,03 |
23,34 |
18,1 4 |
14,1 0 |
10,9 6 |
8,52 |
6,62 |
5,15 |
4 |
3,11 |
2,42 |
1,8 8 |
1,4 6 |
1,1 3 |
0,8 8 |
0,6 9 |
0,5 3 |
0,4 1 |
0,3 2 |
0,2 5 |
0,1 9 |
0,1 5 |
0,1 2 |
4 |
|
GB q |
6 |
45,05 |
35,01 |
27,2 1 |
21,1 5 |
16,4 4 |
12,7 8 |
9,93 |
7,72 |
6 |
4,66 |
3,62 |
2,8 2 |
2,1 9 |
1,7 0 |
1,3 2 |
1,0 3 |
0,8 0 |
0,6 2 |
0,4 8 |
0,3 8 |
0,2 9 |
0,2 3 |
0,1 8 |
6 |
|
GB q |
8 |
60,07 |
46,69 |
36,2 9 |
28,2 0 |
21,9 2 |
17,0 4 |
13,2 4 |
10,2 9 |
8 |
6,22 |
4,83 |
3,7 6 |
2,9 2 |
2,2 7 |
1,7 6 |
1,3 7 |
1,0 7 |
0,8 3 |
0,6 4 |
0,5 0 |
0,3 9 |
0,3 0 |
0,2 4 |
8 |
|
GB q |
10 |
75,08 |
58,36 |
45,3 6 |
35,2 5 |
27,4 0 |
21,3 0 |
16,5 5 |
12,8 7 |
10 |
7,77 |
6,04 |
4,7 0 |
3,6 5 |
2,8 4 |
2,2 0 |
1,7 1 |
1,3 3 |
1,0 4 |
0,8 0 |
0,6 3 |
0,4 9 |
0,3 8 |
0,2 9 |
10 |
|
GB q |
12 |
90,10 |
70,03 |
54,4 3 |
42,3 1 |
32,8 8 |
25,5 6 |
19,8 6 |
15,4 4 |
12 |
9,33 |
7,25 |
5,6 3 |
4,3 8 |
3,4 0 |
2,6 5 |
2,0 6 |
1,6 0 |
1,2 4 |
0,9 6 |
0,7 5 |
0,5 8 |
0,4 5 |
0,3 5 |
12 |
|
GB q |
16 |
120,1 3 |
93,37 |
72,5 7 |
56,4 1 |
43,8 4 |
34,0 8 |
26,4 9 |
20,5 9 |
16 |
12,4 4 |
9,67 |
7,5 1 |
5,8 4 |
4,5 4 |
3,5 3 |
2,7 4 |
2,1 3 |
1,6 6 |
1,2 9 |
1,0 0 |
0,7 8 |
0,6 0 |
0,4 7 |
16 |
|
GB q |
20 |
150,1 6 |
116,7 1 |
90,7 2 |
70,5 1 |
54,8 0 |
42,5 9 |
33,1 1 |
25,7 3 |
20 |
15,5 4 |
12,0 8 |
9,3 9 |
7,3 0 |
5,6 7 |
4,4 1 |
3,4 3 |
2,6 6 |
2,0 7 |
1,6 1 |
1,2 5 |
0,9 7 |
0,7 6 |
0,6 0 |
20 |
Nota: Los días con un signo negativo son los días anteriores a la fecha indicada en la etiqueta (fecha y hora de calibración) y los días con un signo positivo son aquellos después de esa fecha.
Peso de (99mTc + 99Tc) en el eluído
El molibdeno (99Mo) es transformado en tecnecio (99mTc) (87,6% de las desintegraciones del molibdeno-99) y tecnecio (99Tc) (12,4% de las desintegraciones del molibdeno (99Mo)). Por lo tanto, la solución eluída no es "libre de transportador". El cálculo del peso total (99Tc + 99mTc) expresado en pg presente en el eluído, puede realizarse utilizando la siguiente fórmula simplificada:
Actividad
99m
Tc en el eluido x k
P (Pg)
F
k = 5,161.10-3 cuando la actividad se expresa en GBq.
F es la relación entre el número de átomos de tecnecio (99mTc) (N99m) y el número total de átomos de tecnecio (Nt):
F = N99m Nt
Los valores de esta relación en términos del tiempo transcurrido entre dos eluciones aparecen en la tabla 5 que sigue:
TABLA 5
|
Horas |
Días | ||||||
|
0 |
1 |
2 |
3 |
4 |
5 |
6 | |
|
0 |
- |
0,277 |
0,131 |
0,076 |
0,0498 |
0,0344 |
0,0246 |
|
3 |
0,727 |
0,248 |
0,121 |
0,072 |
0,0474 |
0,0329 |
0,0236 |
|
6 |
0,619 |
0,223 |
0,113 |
0,068 |
0,0452 |
0,0315 |
0,0227 |
|
9 |
0,531 |
0,202 |
0,105 |
0,064 |
0,0431 |
0,0302 |
0,0218 |
|
12 |
0,459 |
0,184 |
0,098 |
0,061 |
0,0411 |
0,0290 |
0,0210 |
|
15 |
0,400 |
0,168 |
0,092 |
0,058 |
0,0393 |
0,0278 |
0,0202 |
|
18 |
0,352 |
0,154 |
0,086 |
0,055 |
0,0375 |
0,0266 |
0,0194 |
|
21 |
0,311 |
0,141 |
0,081 |
0,052 |
0,0359 |
0,0256 |
0,0187 |
Ejemplos:
1) El tecnecio- (99mTc) de un generador ELUMATIC III ha sido eluído en 5 ml; la actividad medida es 10 GBq; la elución previa fue realizada 27 horas antes. El peso del transportador de tecnecio será:
P (pg)
10 x 5,161. 10-3 0,248
0,208 pg
que corresponde a 0,042 pg/ml.
2) El tecnecio (99mTc) es eluído de un generador ELUMATIC III 4 días después de la preparación, siendo ésta la primera elución para el usuario. Para una actividad de 10 GBq eluída en 5 ml, el peso del transportador del tecnecio será:
10 x 5,161. 10-3
P (pg) - = 1,036 pg
0,0498
que corresponden a 0,207 pg/ml, que es 5 veces superior a la cantidad de transportador del ejemplo anterior. A pesar de ser pequeña, esta cantidad de tecnecio puede afectar el rendimiento del marcaje de algunos compuestos.
La tabla 6 muestra la variación del peso del transportador del tecnecio en un generador de 10 GBq desde el martes y eluído todos los días a intervalos de 24 horas, suponiendo que la primera elución fue realizada 3 días después de aquella realizada el lunes.
TABLA 6
|
Lunes |
Martes |
Miércoles |
Jueves |
Viernes | |
|
Radioactividad eluída GBq |
13 |
10 |
7,8 |
6,0 |
4,7 |
|
Peso del transportador del tecnecio en pg para el conjunto del eluido |
0,883 |
0,186 |
0,145 |
0,112 |
0,088 |
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CIS bio international
BP 32 - 91192 Gif sur Yvette Cedex
Francia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
66653
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Marzo 2005
10. FECHA DE LA REVISIÓN DEL TEXTO DOSIMETRÍA
La siguiente tabla muestra la dosimetría interna de la radiación tras la administración directa de pertecnetato (99mTc) de sodio para los sujetos con función renal normal calculada de acuerdo con la publicación n° 80 de la International Commission on Radiological Protection Radiation (ICRP) titulada “Radiation Dose to Patients from Radiopharmaceuticals” Addendum 2 de la publicación 53 de la ICRP: (i) Sin tratamiento previo con un agente bloqueante:
|
Órgano |
Dosis absorbida por unidad de actividad administrada (mGy/MBq) | ||||
|
Adulto |
15 años |
10 años |
5 años |
1 año | |
|
Glándulas adrenales |
0,0037 |
0,0047 |
0,0072 |
0,011 |
0,019 |
|
Vejiga |
0,018 |
0,023 |
0,030 |
0,033 |
0,060 |
|
Superficies óseas |
0,0054 |
0,0066 |
0,0097 |
0,014 |
0,0026 |
|
Cerebro |
0,002 |
0,0025 |
0,0041 |
0,0066 |
0,012 |
|
Mamas |
0,0018 |
0,0023 |
0,0034 |
0,0056 |
0,011 |
|
Vesícula biliar |
0,0074 |
0,0099 |
0,016 |
0,023 |
0,035 |
|
Tracto gastrointestinal | |||||
|
Estómago |
0,026 |
0,034 |
0,048 |
0,078 |
0,16 |
|
Intestino delgado |
0,016 |
0,020 |
0,031 |
0,047 |
0,082 |
|
Colon |
0,042 |
0,054 |
0,088 |
0,14 |
0,27 |
|
(Intestino grueso ascendente |
0,057 |
0,073 |
0,12 |
0,20 |
0,38) |
|
(Intestino grueso descendente |
0,021 |
0,028 |
0,045 |
0,072 |
0,13) |
|
Corazón |
0,0031 |
0,004 |
0,0061 |
0,0092 |
0,017 |
|
Riñones |
0,005 |
0,006 |
0,0087 |
0,013 |
0,021 |
|
Hígado |
0,0038 |
0,0048 |
0,0081 |
0,013 |
0,022 |
|
Pulmones |
0,0026 |
0,0034 |
0,0051 |
0,0079 |
0,014 |
|
Músculos |
0,0032 |
0,0040 |
0,0060 |
0,009 |
0,016 |
|
Esófago |
0,0024 |
0,0032 |
0,0047 |
0,0075 |
0,014 |
|
Ovarios |
0,01 |
0,013 |
0,018 |
0,026 |
0,045 |
|
Páncreas |
0,0056 |
0,0073 |
0,011 |
0,016 |
0,027 |
|
Médula ósea roja |
0,0036 |
0,0045 |
0,0066 |
0,009 |
0,015 |
|
Glándulas salivales |
0,0093 |
0,012 |
0,017 |
0,024 |
0,039 |
|
Piel |
0,0018 |
0,0022 |
0,0035 |
0,0056 |
0,010 |
|
Bazo |
0,0043 |
0,0054 |
0,0081 |
0,012 |
0,021 |
|
Testículos |
0,0028 |
0,0037 |
0,0058 |
0,0087 |
0,016 |
|
Timo |
0,0024 |
0,0032 |
0,0047 |
0,0075 |
0,014 |
|
Tiroides |
0,022 |
0,036 |
0,055 |
0,12 |
0,22 |
|
Útero |
0,0081 |
0,010 |
0,015 |
0,022 |
0,037 |
|
Resto del organismo |
0,0035 |
0,0043 |
0,0064 |
0,0096 |
0,017 |
|
Dosis efectiva (mSv/MBq) |
0,013 |
0,017 |
0,026 |
0,042 |
0,079 |
La dosis efectiva resultante de la administración de 800 MBq de pertecnetato (99mTc) de sodio (para un adulto de 70 kg de peso) es de 10,4 mSv para un paciente sin tratamiento previo con agentes bloqueantes.
ii) Con tratamiento previo con un agente bloqueante:
|
Órgano |
Dosis absorbida por unidad de actividad administrada (mGy/MBq) | ||||
|
Adulto |
15 años |
10 años |
5 años |
1 año | |
|
Glándulas adrenales |
0,0029 |
0,0037 |
0,0056 |
0,0086 |
0,016 |
|
Vejiga |
0,03 |
0,038 |
0,048 |
0,05 |
0,091 |
|
Superficies óseas |
0,0044 |
0,0054 |
0,0081 |
0,012 |
0,022 |
|
Cerebro |
0,002 |
0,0026 |
0,0042 |
0,0071 |
0,012 |
|
Mamas |
0,0017 |
0,0022 |
0,0032 |
0,0052 |
0,01 |
|
Vesícula biliar |
0,003 |
0,0042 |
0,007 |
0,01 |
0,013 |
|
Tracto gastrointestinal | |||||
|
Estómago |
0,0027 |
0,0036 |
0,0059 |
0,0086 |
0,015 |
|
Intestino delgado |
0,0035 |
0,0044 |
0,0067 |
0,010 |
0,018 |
|
Colon |
0,0036 |
0,0048 |
0,0071 |
0,010 |
0,018 |
|
(Intestino grueso ascendente |
0,0032 |
0,0043 |
0,0064 |
0,010 |
0,017 |
|
(Intestino grueso descendente |
0,0042 |
0,0054 |
0,0081 |
0,011 |
0,019 |
|
Corazón |
0,0027 |
0,0034 |
0,0052 |
0,0081 |
0,014 |
|
Riñones |
0,00044 |
0,0054 |
0,0077 |
0,011 |
0,019 |
|
Hígado |
0,0026 |
0,0034 |
0,0053 |
0,0082 |
0,015 |
|
Pulmones |
0,0023 |
0,0031 |
0,0046 |
0,0074 |
0,013 |
|
Músculos |
0,0025 |
0,0031 |
0,0047 |
0,0072 |
0,013 |
|
Esófago |
0,0024 |
0,0031 |
0,0046 |
0,0075 |
0,014 |
|
Ovarios |
0,0043 |
0,0054 |
0,0078 |
0,011 |
0,019 |
|
Páncreas |
0,003 |
0,0039 |
0,0059 |
0,0093 |
0,016 |
|
Médula ósea roja |
0,0025 |
0,0032 |
0,0049 |
0,0072 |
0,013 |
|
Piel |
0,0016 |
0,002 |
0,0032 |
0,0052 |
0,0097 |
|
Bazo |
0,0026 |
0,0034 |
0,0054 |
0,0083 |
0,015 |
|
Testículos |
0,003 |
0,004 |
0,0006 |
0,0087 |
0,016 |
|
Timo |
0,0024 |
0,0031 |
0,0046 |
0,0075 |
0,014 |
|
Tiroides |
0,0024 |
0,0031 |
0,005 |
0,0084 |
0,015 |
|
Útero |
0,006 |
0,0073 |
0,011 |
0,014 |
0,023 |
|
Resto del organismo |
0,0025 |
0,0031 |
0,0048 |
0,0073 |
0,013 |
|
Dosis efectiva (mSv/MBq) |
0,0042 |
0,0054 |
0,0077 |
0,011 |
0,019 |
Después de un tratamiento previo de los pacientes con un agente bloqueante, la administración de 800 MBq de pertecnetato (99mTc) de sodio produce una dosis efectiva de 3,36 mSv (para un adulto de 70 kg de peso).
(iii) Las dosis de radiación absorbidas por un paciente después de la inyección intravenosa de hematíes marcados con pertecnetato (99mTc ) de sodio son las siguientes:_
|
Órgano |
Dosis absorbida por unidad de actividad administrada (mGy/MBq) | ||||
|
Adulto |
15 años |
10 años |
5 años |
1 año | |
|
Glándulas adrenales |
0,0099 |
0,012 |
0,02 |
0,03 |
0,056 |
|
Vejiga |
0,0085 |
0,011 |
0,014 |
0,017 |
0,031 |
|
Superficies óseas |
0,0074 |
0,012 |
0,019 |
0,036 |
0,074 |
|
Cerebro |
0,0036 |
0,0046 |
0,0075 |
0,012 |
0,022 |
|
Mamas |
0,0035 |
0,0041 |
0,007 |
0,011 |
0,019 |
|
Vesícula biliar |
0,0065 |
0,0081 |
0,013 |
0,02 |
0,03 |
|
Tracto gastrointestinal | |||||
|
Estómago |
0,0046 |
0,0059 |
0,0097 |
0,014 |
0,025 |
|
Intestino delgado |
0,0039 |
0,0049 |
0,0078 |
0,012 |
0,021 |
|
Colon |
0,0037 |
0,0048 |
0,0075 |
0,012 |
0,02 |
|
(Intestino grueso ascendente |
0,004 |
0,0051 |
0,008 |
0,013 |
0,022 |
|
(Intestino grueso descendente |
0,0034 |
0,0044 |
0,0069 |
0,01 |
0,018 |
|
Corazón |
0,023 |
0,029 |
0,043 |
0,066 |
0,11 |
|
Riñones |
0,018 |
0,022 |
0,036 |
0,057 |
0,11 |
|
Hígado |
0,013 |
0,017 |
0,026 |
0,04 |
0,072 |
|
Pulmones |
0,018 |
0,022 |
0,035 |
0,056 |
0,11 |
|
Músculos |
0,0033 |
0,004 |
0,0061 |
0,0094 |
0,017 |
|
Esófago |
0,0061 |
0,007 |
0,0098 |
0,015 |
0,023 |
|
Ovarios |
0,0037 |
0,0048 |
0,007 |
0,011 |
0,019 |
|
Páncreas |
0,0066 |
0,0081 |
0,013 |
0,019 |
0,033 |
|
Médula ósea roja |
0,0061 |
0,0076 |
0,012 |
0,02 |
0,037 |
|
Piel |
0,002 |
0,0024 |
0,0038 |
0,0062 |
0,012 |
|
Bazo |
0,014 |
0,017 |
0,027 |
0,043 |
0,081 |
|
Testículos |
0,0023 |
0,003 |
0,0044 |
0,0069 |
0,013 |
|
Timo |
0,0061 |
0,007 |
0,0098 |
0,015 |
0,023 |
|
Tiroides |
0,0057 |
0,0071 |
0,012 |
0,019 |
0,036 |
|
Útero |
0,0039 |
0,0049 |
0,0074 |
0,011 |
0,019 |
|
Resto del organismo |
0,0035 |
0,0045 |
0,0073 |
0,013 |
0,023 |
|
Dosis efectiva (mSv / MBq) |
0,007 |
0,0089 |
0,014 |
0,014 |
0,039 |
22 de 23
La dosis efectiva resultante de la administración de 925 MBq de hematíes marcados con pertecnetato (99mTc) de sodio es de 6,475 mSv (para un adulto de 70 kg de peso).
(iv) La dosis de radiación absorbida por el cristalino del ojo después de la administración de pertecnetato (99mTc) de sodio para una gammagrafía del conducto lacrimal se calcula que es de 0,038 mGy/MBq (para un adulto de 70 kg de peso). Esto ocasiona una dosis efectiva inferior a 0,01 mSv para una dosis administrada de 4 MBq.
El tecnecio (99mTc) decae, mediante emisión de radiación gamma con una energía media de 140 keV y un periodo de semidesintegración de 6,02 horas, a tecnecio (99Tc) que, en vista de su prolongado periodo de semidesintegración de 2,13 x 105 años, puede ser considerado como casi estable.
INSTRUCCIONES PARA LA PREPARACIÓN DE RADIOFÁRMACOS
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
23 de 23