Elonva 150 Microgramos Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Elonva 100 microgramos solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada jeringa precargada contiene 100 microgramos de corifolitropina alfa* en 0,5 ml de solución inyectable.
*corifolitropina alfa es una glicoproteína producida en células de ovario de hámster chino (CHO) mediante tecnología del DNA recombinante.
Excipiente(s) con efecto conocido:
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por injectable, por lo que se considera esencialmente "exento de sodio".
Para consultar la lista completa de excipientes, ver sección 6.1
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable). Solución acuosa transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Elonva está indicado para la estimulación ovárica controlada (EOC) en combinación con un antagonista de la Hormona Liberadora de las Gonadotropinas (GnRH) para el desarrollo de folículos múltiples en mujeres que participan en un programa de Técnicas de Reproducción Asistida (TRA).
4.2 Posología y forma de administración
El tratamiento con Elonva debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de problemas de fertilidad.
Posología
En el tratamiento de mujeres en edad fértil, la dosis de Elonva depende del peso y de la edad.
- Se recomienda una dosis única de 100 microgramos en mujeres cuyo peso sea menor o igual a 60 kilogramos y cuya edad sea de hasta 36 años inclusive.
- Se recomienda una dosis única de 150 microgramos en mujeres:
- cuyo peso sea mayor de 60 kilogramos, con independencia de cual sea su edad.
- a partir de 50 kilogramos de peso y mayores de 36 años de edad.
No se han realizado estudios en mujeres mayores de 36 años de edad cuyo peso sea inferior a 50 kilogramos.
|
Peso corporal | ||||
|
Menos de 50 kg |
50 - 60 kg |
Más de 60 kg | ||
|
Edad |
Hasta 36 años inclusive |
100 microgramos |
100 microgramos |
150 microgramos |
|
Mayores de 36 años |
No se ha estudiado. |
150 microgramos |
150 microgramos | |
Las dosis recomendadas de Elonva solamente se han establecido en un ciclo de tratamiento con un antagonista de la GnRH, que se administró a partir del día 5 o día 6 de estimulación (ver también las secciones 4.1, 4.4 y 5.1).
Día 1 de estimulación:
Elonva debe administrarse en inyección subcutánea única, preferiblemente en la pared abdominal, durante la fase folicular inicial del ciclo menstrual.
Día 5 ó 6 de estimulación:
El tratamiento con el antagonista de la GnRH se debe iniciar el día 5 ó 6° de estimulación dependiendo de la respuesta ovárica, es decir, del número y tamaño de los folículos en crecimiento. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. El antagonista de la GnRH se usa para evitar la aparición de incrementos prematuros de hormona luteinizante (LH).
Día 8 de estimulación:
Siete días después de la inyección de Elonva el día 1 de estimulación, se puede continuar el tratamiento de la estimulación ovárica controlada con inyecciones diarias de Hormona Estimulante del Folículo (recombinante) [FSH(rec)] hasta que se alcance el criterio para desencadenar la maduración final de los ovocitos (3 folículos > 17 mm). La dosis diaria de FSH(rec) puede depender de la respuesta ovárica. En mujeres con respuesta normal se aconseja una dosis diaria de 150 UI de FSH(rec). Dependiendo de la respuesta ovárica puede omitirse la administración de la dosis de FSH(rec) el día de la administración de la Gonodotropina Coriónica Humana (hCG). Generalmente, de promedio, se logra un desarrollo folicular adecuado el noveno día de tratamiento (en un rango de 6 a 18 días).
Tan pronto como se observe la existencia de tres folículos >17 mm, se administrará el mismo día o el día siguiente, una única inyección de 5.000 hasta 10.000 UI de hCG para inducir la maduración final de los ovocitos. En caso de una excesiva respuesta ovárica, vea las recomendaciones incluidas en la sección 4.4, con objeto de reducir el riesgo de desarrollar Síndrome de Hiperestimulación Ovárica (SHO).
Poblaciones especiales Alteración renal
No se han realizado estudios en pacientes con insuficiencia renal. Como la velocidad de eliminación de la corifolitropina alfa puede verse reducida en pacientes con insuficiencia renal, no se recomienda el uso de Elonva en mujeres con esta patología (ver secciones 4.4 y 5.2).
Alteración hepática
Aunque no hay datos disponibles en pacientes con insuficiencia hepática, es poco probable que la insuficiencia hepática afecte a la excreción de la corifolitropina alfa (ver sección 5.2).
Población pediátrica
No existe una recomendación de uso específica de Elonva para la indicación aprobada en la población pediátrica.
Forma de administración
La inyección subcutánea de Elonva puede ser administrada por la propia mujer o por su pareja siempre que sigan las instrucciones de su médico. La autoadministración de Elonva sólo debe ser realizada por mujeres muy motivadas, adecuadamente entrenadas y con acceso a consejo médico.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Tumores ováricos, de la mama, útero, hipófisis o hipotálamo.
• Hemorragia vaginal anormal (no menstrual) sin causa conocida/diagnosticada.
• Insuficiencia ovárica primaria.
• Quistes ováricos o aumento del tamaño de los ovarios.
• Historia de Síndrome de Hiperestimulación Ovárica (SHO).
• Ciclo previo de Estimulación Ovárica Controlada con resultado de más de 30 folículos > 11 mm medidos por ecografía.
• Un recuento basal de folículos antrales > 20.
• Miomas uterinos incompatibles con el embarazo.
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Síndrome de ovario poliquístico (SOP).
4.4 Advertencias y precauciones especiales de empleo
Evaluación de la infertilidad antes de iniciar el tratamiento
Antes de comenzar el tratamiento debe valorarse adecuadamente la infertilidad de la pareja. En particular, debe evaluarse si la mujer padece hipotiroidismo, insuficiencia suprarrenal, hiperprolactinemia y tumores hipofisarios o hipotalámicos, proporcionándole un tratamiento específico adecuado. También se deben evaluar las condiciones médicas que contraindiquen el embarazo antes de iniciar el tratamiento con Elonva.
Dosificación durante el ciclo de estimulación
Elonva se administra solamente como inyección subcutánea única. No se deben administrar inyecciones adicionales de Elonva dentro del mismo ciclo de tratamiento (ver también sección 4.2).
Después de la administración de Elonva, no se deben administrar productos con FSH adicional antes del día 8 de estimulación (ver también sección 4.2).
Alteración renal
En pacientes con insuficiencia renal leve, moderada o grave la velocidad de eliminación de corifolitropina alfa puede verse reducida (ver secciones 4.2 y 5.2). Por lo tanto, no se recomienda el uso de Elonva en estas mujeres.
No se recomienda en un protocolo con agonista de la GnRH
Los datos sobre el uso de Elonva en combinación con un agonista de la GnRH son limitados. Los resultados de un pequeño estudio no controlado sugieren una respuesta ovárica superior que en combinación con un antagonista de la GnRH. Por lo tanto, no se recomienda el uso de Elonva en combinación con un agonista de la GnRH (ver también sección 4.2).
Síndrome de Hiperestimulación Oválica (SHO)
El SHO es una enfermedad distinta al aumento del tamaño de los ovarios sin complicaciones. Los signos y síntomas clínicos del SHO leve y moderado son dolor abdominal, náuseas, diarrea, aumento de leve a moderado del tamaño de los ovarios y quistes ováricos. El SHO grave puede ser potencialmente mortal. Los signos y síntomas clínicos del SHO grave son quistes ováricos grandes, dolor abdominal agudo, ascitis, derrame pleural, hidrotórax, disnea, oliguria, alteraciones hematológicas y aumento de peso. En casos raros, puede producirse tromboembolismo venoso o arterial junto con el SHO. También se han notificado alteraciones transitorias de las pruebas de función hepática asociadas al SHO, que indican una disfunción hepática con o sin cambios morfológicos en la biopsia de hígado.
El SHO puede producirse por la administración de hCG y por el embarazo (hCG endógena). El SHO incipiente generalmente se produce dentro de los 10 días después de la administración de hCG y puede estar asociado a una respuesta ovárica excesiva a la estimulación de gonadotropina. El SHO tardío se produce más de 10 días después de la administración de hCG, como consecuencia de las alteraciones hormonales del embarazo. Debido al riesgo de desarrollar SHO, se debe controlar a las pacientes durante al menos dos semanas después de la administración de hCG.
Las mujeres con factores de riesgo conocidos a una respuesta ovárica alta, pueden ser especialmente propensas al desarrollo de SHO después del tratamiento con Elonva. En mujeres que tienen su primer ciclo de estimulación ovárica, para quienes los factores de riesgo sólo se conocen parcialmente, se recomienda la estrecha observación de los primeros signos y síntomas del SHO.
Para reducir el riesgo de SHO, se deben realizar evaluaciones ecográficas del desarrollo folicular antes del tratamiento y a intervalos regulares durante el tratamiento. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. En las TRA se produce un aumento del riesgo de SHO con 18 o más folículos de un diámetro de 11 mm o más. Cuando haya 30 o más folículos en total se aconseja interrumpir la administración de hCG.
En función de la respuesta ovárica, se pueden tener en cuenta las siguientes medidas para reducir el riesgo del SHO:
- interrumpir la estimulación posterior con una gonadotropina durante un máximo de 3 días (coasting);
- interrumpir la hCG y cancelar el ciclo de tratamiento;
- administrar una dosis inferior a 10.000 UI de hCG para desencadenar la maduración final de los ovocitos, por ejemplo 5.000 UI de hCG o 250 microgramos de hCG-rec (que es equivalente a aproximadamente 6.500 UI);
- cancelar la transferencia de embriones frescos y crioconservar los embriones;
- evitar la administración de la hCG para facilitar la fase lútea.
El cumplimiento terapéutico de la dosis recomendada de Elonva y del ciclo de tratamiento y un cuidadoso seguimiento de la respuesta ovárica son importantes para reducir el riesgo de SHO.
Si se desarrolla SHO, se debe aplicar un sistema estándar apropiado de gestión y seguimiento del SHO.
Torsión ovárica
Se ha notificado torsión ovárica después del tratamiento con gonadotropinas, incluyendo Elonva. La torsión ovárica puede estar relacionada con otras situaciones, como SHO, embarazo, cirugía abdominal previa, antecedentes de torsión ovárica y quistes ováricos anteriores o actuales. El daño en el ovario debido a la reducción del aporte de sangre puede limitarse mediante un diagnóstico precoz y la destorsión inmediata.
Embarazo múltiple
Se han notificado embarazos y nacimientos múltiples con todos los tratamientos con gonadotropina, incluyendo Elonva. Se debe advertir a la mujer y a su pareja de los posibles riesgos para la madre (complicaciones en el embarazo y en el parto) y para el recién nacido (bajo peso al nacer) antes de iniciar el tratamiento. En las mujeres que se someten a TRA el riesgo de embarazo múltiple está principalmente relacionado con el número de embriones transferidos.
Embarazo ectópico
Las mujeres infértiles que se someten a TRA tienen una mayor incidencia de embarazos ectópicos. Es importante confirmar cuanto antes mediante ecografía que el embarazo sea intrauterino, y descartar la posibilidad de embarazo extrauterino.
Malformaciones congénitas
La incidencia de malformaciones congénitas tras la aplicación de TRA puede ser algo más elevada que tras la concepción espontánea. Esto puede ser debido a diferencias en las características de los progenitores (por ejemplo edad de la madre, características del semen) y la mayor incidencia de embarazos múltiples.
Neoplasias de ovario y otras neoplasias del sistema reproductor
Se han notificado neoplasias de ovario y otras neoplasias del sistema reproductor, benignas y malignas, en mujeres que se han sometido a múltiples tratamientos farmacológicos para el tratamiento de la infertilidad. No se ha establecido si el tratamiento con gonadotropinas aumenta el riesgo de estos tumores en mujeres infértiles.
Complicaciones vasculares
Se han notificado acontecimientos tromboembólicos, tanto en asociación como independientes del SHO después del tratamiento con gonadotropinas, incluyendo Elonva. La trombosis intravascular, que puede tener su origen en vasos arteriales o venosos, puede dar lugar a una reducción del flujo sanguíneo a los órganos vitales o a las extremidades. En mujeres con factores de riesgo de trombosis generalmente reconocidos, como antecedentes personales o familiares, obesidad grave o trombofilia, el tratamiento con gonadotropinas puede aumentar aún más este riesgo. En estas mujeres se sopesarán los beneficios de la administración de gonadotropinas frente a los riesgos. Sin embargo, debe tenerse en cuenta que el embarazo por si solo también conlleva un aumento del riesgo de trombosis.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones con Elonva y otros medicamentos. Como corifolitropina alfa no es un sustrato de las enzimas del citocromo P450, no se esperan interacciones metabólicas con otros medicamentos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
En caso de exposición involuntaria a Elonva durante el embarazo, los datos clínicos no son suficientes para excluir consecuencias adversas en el embarazo. En los estudios en animales se ha observado toxicidad reproductiva (ver los datos preclínicos sobre seguridad en la sección 5.3). No está indicado el uso de Elonva durante el embarazo.
Lactancia
No está indicado el uso de Elonva durante la lactancia.
Fertilidad
Elonva está indicada para su uso en la infertilidad (ver sección 4.1).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Elonva puede producir mareo. Se debe advertir a las mujeres que si se sienten mareadas no deben conducir ni utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas notificadas más frecuentemente durante el tratamiento con Elonva en ensayos clínicos (N=2.397) son molestias pélvicas (6,0%), SHO (4,3%, ver también sección 4.4), cefalea (4,0%), dolor pélvico (2,9%), naúseas (2,3%), fatiga (1,5%) y dolor mamario a la palpación (1,3%).
Lista tabulada de reacciones adversas
La siguiente tabla muestra las principales reacciones adversas en mujeres tratadas con Elonva en ensayos clínicos según el sistema de clasificación de órganos y frecuencia; muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000) y muy raras (<1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Sistema de clasificación de órganos |
Frecuencia |
Reacción adversa |
|
Trastornos psiquiátricos |
Poco frecuentes |
Cambios del estado de ánimo |
|
Trastornos del sistema nervioso |
Frecuentes Poco frecuentes |
Cefalea Mareo |
|
Trastornos vasculares |
Poco frecuentes |
Acaloramiento |
|
Trastornos gastrointestinales |
Frecuentes Poco frecuentes |
Náuseas Distensión abdominal, vómitos, diarrea, estreñimiento |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes |
Dolor de espalda |
|
Embarazo, puerperio y enfermedades perinatales |
Poco frecuentes |
Aborto espontáneo |
|
Trastornos del aparato reproductor y de la mama |
Frecuentes Poco frecuentes |
SHO, dolor pélvico, molestias pélvicas, dolor mamario a la palpación Torsión ovárica, dolor anexial uterino, ovulación prematura, dolor de mama |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuentes Poco frecuentes |
Fatiga Hematoma en la zona de inyección, dolor en la zona de inyección, irritabilidad |
|
Exploraciones complementarias |
Poco frecuentes |
Alanina aminotransferasa elevada, |
_aspartato aminotransferasa elevada
Lesiones traumáticas, intoxicaciones Poco frecuentes Dolor asociado a procedimiento y complicaciones de procedimientos terapéutico
terapéuticos_
Descripción de reacciones adversas seleccionadas
Además se han notificado embarazo ectópico y gestación múltiple. Se considera que estas reacciones están relacionadas con las TRA o con el embarazo posterior.
En casos raros, se ha asociado la aparición de tromboembolismo con la terapia de Elonva, lo que también se ha observado durante el tratamiento con otras gonadotropinas.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Más de una inyección de Elonva dentro de un ciclo de tratamiento o una dosis demasiado alta de Elonva y/o FSH(rec) puede aumentar el riesgo de SHO. Ver sección 4.4 para consultar las medidas para reducir el riesgo del SHO.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotropinas, código ATC: G03GA09
Mecanismo de acción
Corifolitropina alfa se ha diseñado como un estimulante folicular sostenido con el mismo perfil farmacodinámico que FSH(rec), pero con una duración de la actividad FSH sustancialmente prolongada. Por su capacidad para iniciar y mantener el crecimiento folicular múltiple durante una semana entera, una única inyección subcutánea de la dosis recomendada de Elonva puede sustituir las siete primeras inyecciones de cualquier preparación de FSH(rec) diaria en un ciclo de tratamiento de Estimulación Ovárica Controlada. Se consiguió una larga duración de la actividad FSH añadiendo el péptido carboxi-terminal de la subunidad P de la gonadotropina coriónica humana (hCG) a la cadena P de la FSH Humana. Corifolitropina alfa no presenta ninguna actividad LH/hCG intrínseca.
Eficacia clínica y seguridad
En tres ensayos clínicos aleatorizados y doble ciego, el tratamiento con una única inyección subcutánea de Elonva, 100 microgramos (estudio ENSURE) o 150 microgramos (estudio ENGAGE y estudio PURSUE), durante los primeros siete días de estimulación ovárica controlada, se comparó con el tratamiento con una dosis diaria de 150, 200, ó 300 UI de FSH(rec), respectivamente. En cada uno de los tres ensayos clínicos se realizó la supresión hipofisiaria con un antagonista de la GnRH (inyección de acetato de ganirelix a una dosis diaria de 0,25 mg).
En el estudio ENSURE, 396 mujeres sanas con ciclos ovulatorios normales, con edades comprendidas entre los 18 y los 36 años de edad, con un peso corporal menor o igual a 60 kg, fueron tratadas durante un ciclo con 100 microgramos de Elonva y supresión hipofisiaria con un antagonista de la GnRH en el marco de un programa de TRA. La variable principal de valoración de la eficacia fue el número de ovocitos recuperados. La mediana de la duración total de la estimulación fue de 9 días para ambos grupos, lo que indica que se requerían dos días de FSH(rec) para completar la estimulación ovárica desde el día 8 de estimulación en adelante (en este estudio se administró FSH(rec) en el día de la hCG).
En el estudio ENGAGE, 1.506 mujeres sanas con ciclos ovulatorios normales, con edades comprendidas entre los 18 y los 36 años de edad, con un peso corporal mayor de 60 kg y menor o igual a 90 kg, fueron tratadas durante un ciclo con 150 microgramos de Elonva y supresión hipofisiaria con un antagonista de la GnRH en el marco de un programa de TRA. Las variables co-principales de valoración de la eficacia fueron las tasas de embarazo en curso y el número de ovocitos recuperados. La mediana de la duración total de la estimulación fue de 9 días para ambos grupos, lo que indica que se requerían dos días de FSH(rec) para completar la estimulación ovárica desde el día
8 de estimulación en adelante (en este estudio se administró FSH(rec) en el día de la hCG).
En el estudio PURSUE, 1.390 mujeres sanas con ciclos ovulatorios normales, con edades comprendidas entre los 35 y los 42 años de edad, con un peso corporal mayor o igual a 50 kg, fueron tratadas durante un ciclo con 150 microgramos de Elonva y supresión hipofisiaria con un antagonista de la GnRH en el marco de un programa de TRA. La variable principal de valoración de la eficacia fue la tasa de embarazo clínico. El número de ovocitos recuperados fue considerado una variable secundaria de valoración de la eficacia. La mediana de la duración total de la estimulación fue de
9 días para ambos grupos, lo que indica que se requería un día de FSH(rec) para completar la estimulación ovárica desde el día 8 de estimulación en adelante (en este estudio no se administró FSH(rec) en el día de la hCG).
Número de ovocitos recuperados
En los tres estudios, el tratamiento con una única inyección de Elonva, 100 ó 150 microgramos, durante los primeros siete días de estimulación ovárica controlada, provocó un número superior de ovocitos recuperados en comparación con el tratamiento con una dosis diaria de FSH(rec).
No obstante las diferencias estaban dentro de los márgenes de equivalencia predefinidos (ENGAGE y ENSURE) o de los márgenes de no inferioridad (PURSUE). Ver Tabla 1 a continuación.
Tabla 1: Media del número de ovocitos recuperados en los estudios ENSURE, ENGAGE, y PURSUE Población ITT (intención de tratar)
|
Variable |
ENSURE (18-36 años de edad) (peso corporal menor o igual a 60 kg) |
ENGAGE (18-36 años de edad) (peso corporal mayor de 60 kg y menor o igual a 90 kg) |
PURSUE (35-42 años de edad) (peso corporal mayor o igual a 50 kg) | |||
|
Elonva 100 úg |
FSH(rec) 150 UI |
Elonva 150 úg |
FSH(rec) 200 UI |
Elonva 150 úg |
FSH(rec) 300 UI | |
|
N=268 |
N=128 |
N=756 |
N=750 |
N=694 |
N=696 | |
|
Media del número de ovocitos |
13,3 |
10,6 |
13,8 |
12,6 |
10,7 |
10,3 |
|
Diferencia [IC 95%] |
2,5 [1,2; 3,9] |
1,2 [0,5; 1,9] |
0,5 [-0,2; 1,2] | |||
Embarazo a partir de ciclos en fresco en los estudios ENGAGE y PURSUE
En el estudio de ENGAGE, se demostró la no inferioridad en las tasas de embarazo en curso entre Elonva y la FSH(rec), definiendo la tasa de embarazo en curso como la presencia de al menos un feto con actividad cardiaca evaluada al menos 10 semanas después de la transferencia de los embriones.
En el estudio PURSUE, se demostró la no inferioridad en la tasa de embarazo clínico entre Elonva y la FSH(rec), definiendo la tasa de embarazo clínico como el porcentaje de sujetos con al menos un feto con actividad cardiaca evaluada 5 a 6 semanas después de la transferencia de los embriones.
Los resultados de embarazo a partir de ciclos en fresco en los estudios ENGAGE y PURSUE se resumen a continuación en la Tabla 2.
Tabla 2: Resultados de embarazo a partir de ciclos en fresco en los estudios
ENGAGE y PURSUE Población ITT (intención de tratar)
|
Variable |
Ciclos en fresco en el estudio engaget (18-36 años de edad) (peso corporal mayor de 60 kg y menor o igual a 90 kg) |
Ciclos en fresco en el estudio PURSUE* (35-42 años de edad) (peso corporal mayor o igual a 50 kg) | ||||
|
Elonva 150 |
FSH(rec) 200 UI |
Diferencia [IC 95%] |
Elonva 150 ^g |
FSH(rec) 300 UI |
Diferencia [IC 95%] | |
|
N=756 |
N=750 |
N=694 |
N=696 | |||
|
Tasa de embarazo clínico |
39,9% |
39,1% |
1,1 [-3,8; 5,9] |
23,9% |
26,9% |
-3,0 [-7,3; 1,4] |
|
Tasa de embarazo en curso |
39,0% |
38,1% |
1,1 [-3,8; 5,9] |
22,2% |
24,0% |
-1,9 [-6,1; 2,3] |
|
Tasa de nacidos vivos* |
35,6% |
34,4% |
1,3 [-3,5; 6,1] |
21,3% |
23,4% |
-2,3 [-6.5; 1,9] |
tLa variable principal de valoración de la eficacia del estudio ENGAGE fue los embarazos en curso (evaluados al menos 10 semanas después de la transferencia de los embriones).
*La variable principal de valoración de la eficacia del estudio PURSUE fue la tasa de embarazo clínico definida como el porcentaje de sujetos con al menos un feto con actividad cardiaca evaluada 5 a 6 semanas después de la transferencia de los embriones.
*La tasa de nacidos vivos fue una variable secundaria de valoración de la eficacia en los estudios ENGAGE y PURSUE.
En estos ensayos clínicos, el perfil de seguridad de una inyección única de Elonva fue comparable a las inyecciones diarias de FSH(rec).
Embarazo a partir de ciclos de Transferencia de Embriones Congelados (descongelados) (TEC) en los estudios ENGAGE y PURSUE
El estudio de seguimiento de TEC para el estudio ENGAGE incluyó a mujeres que tenían al menos un embrión descongelado para su uso, hasta por lo menos un año después de la criopreservación. El promedio de embriones transferidos en los ciclos de TEC para el estudio ENGAGE fue de 1,7 en ambos grupos de tratamiento.
El estudio de seguimiento de TEC para el estudio PURSUE incluyó a mujeres que tenían al menos un embrión descongelado para su uso, dentro de los dos años siguientes a la fecha de la última criopreservación para ese estudio. El promedio de embriones transferidos en los ciclos de TEC para el estudio PURSUE fue de 2,4 en ambos grupos de tratamiento. Este estudio también proporcionó datos sobre la seguridad de los bebés nacidos a partir de embriones criopreservados.
El número máximo de ciclos de TEC fue de 5 ciclos y de 4 ciclos para los estudios de seguimiento de TEC de ENGAGE y de PURSUE, respectivamente. Los resultados de embarazo de los dos primeros ciclos de TEC en el estudio ENGAGE y el estudio PURSUE se resumen a continuación en la Tabla 3.
Tabla 3: Resultados de embarazo a partir de ciclos de TEC en los estudios
ENGAGE y PURSUE Población ITT (intención de tratar)
|
Ciclos de TEC en el estudio ENGAGE (18-36 años de edad) (peso corporal mayor de 60 kg y menor o igual a 90 kg) |
Ciclos de TEC en el estudio PURSUE (35-42 años de edad) (peso corporal mayor o igual a 50 kg) | |||||||||||
|
Elonva _150 Rg_ |
FSH(rec) 200 IU |
Elonva _150 Rg_ |
FSH(rec) 300 IU | |||||||||
|
n |
N |
% |
n |
N |
% |
n |
N |
% |
n |
N |
% | |
|
Ciclo TEC 1a | ||||||||||||
|
Embarazo en curso |
55 |
148 |
37,2 |
45 |
147 |
30,6 |
43 |
152 |
28,3 |
42 |
145 |
29,0 |
|
Nacidos vivos |
- |
- |
- |
- |
- |
- |
43 |
152 |
28,3 |
41 |
145 |
28,3 |
|
Ciclo TEC 2a | ||||||||||||
|
Embarazo en curso |
9 |
38 |
23,7 |
9 |
31 |
29,0 |
8 |
23 |
34,8 |
6 |
14 |
42,9 |
|
Nacidos vivos |
- |
- |
- |
- |
- |
- |
8 |
23 |
34,8 |
6 |
14 |
42,9 |
n = número de sujetos con el acontecimiento; N = Número total de sujetos a Por transferencia de embrión.
Malformaciones congénitas notificadas en bebés nacidos después de ciclos de transferencia de embriones congelados (descongelados) (TEC)
Tras el uso de Elonva, nacieron 61 bebés después de un ciclo de TEC, y nacieron 630 bebés tras la aplicación de TRA con ciclos en fresco. Las tasas de las malformaciones congénitas (mayores y menores combinadas) notificadas para los bebés nacidos después de un ciclo de TEC (16,4%) fueron similares a las notificadas para los bebés nacidos tras la aplicación de TRA con ciclos en fresco (19,5%).
Inmunogenicidad
De las 2.511 mujeres tratadas con Elonva que fueron evaluadas para analizar la presencia de anticuerpos post-tratamiento, cuatro de ellas (0,16%) mostraron evidencias de la generación de anticuerpos, incluidas tres mujeres que habían sido expuestas una vez a Elonva y una mujer que había sido expuesta dos veces al tratamiento con Elonva. En cada caso, estos anticuerpos no fueron neutralizantes y no interfirieron con la respuesta a la estimulación o con las respuestas fisiológicas normales del eje Hipotálamo-Hipófisis-Ovario (HHO). Dos de estas cuatro mujeres quedaron embarazadas durante el mismo ciclo de tratamiento en el que se detectaron los anticuerpos, lo que sugiere que la presencia de anticuerpos no neutralizantes después de la estimulación con Elonva no es clínicamente significativa.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Elonva en uno o más grupos de la población pediátrica en hipogonadismo hipogonadotrófico (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Los parámetros farmacocinéticos de corifolitropina alfa fueron evaluados después de su administración subcutánea a mujeres sometidas a un ciclo de tratamiento de estimulación ovárica controlada.
Debido a la larga semivida de eliminación, tras la administración de las dosis recomendada, las concentraciones séricas de corifolitropina alfa son suficientes para mantener el crecimiento folicular múltiple durante una semana entera. Esto justifica la sustitución de las primeras siete inyecciones diarias de FSH(rec) por una única inyección subcutánea de Elonva en Estimulación Ovárica Controlada para el desarrollo de folículos múltiples y embarazo en un programa de TRA (ver sección 4.2).
El peso corporal es un factor determinante de la exposición a corifolitropina alfa. La exposición a corifolitropina alfa después de la administración de una única injección subcutánea es de 665 horas*ng/ml (ABC, 426-1.037 horas*ng/m^) y es similar tras la administración de 100 microgramos de corifolitropina alfa a mujeres con un peso corporal menor o igual a 60 kilogramos y de 150 microgramos de corifolitropina alfa a mujeres con un peso corporal mayor de 60 kilogramos.
Absorción
Tras una única inyección subcutánea de Elonva, la concentración sérica máxima de corifolitropina alfa es de 4,24 ng/ml (2,49-7,21 ng/ml1) y se alcanza 44 horas (35-57 horas1) después de la administración de la dosis. La biodisponibilidad absoluta es del 58% (48-70%1).
Distribución
La distribución, metabolismo y eliminación de corifolitropina alfa son muy similares a los de otras gonadotropinas, tales como FSH, hCG y LH. Tras la absorción en la sangre, corifolitropina alfa se distribuye principalmente a los ovarios y riñones. El volumen de distribución en el estado de equilibrio es de 9,2 l (6,5-13,1 l1). La exposición a corifolitropina alfa aumenta proporcionalmente con la dosis en el intervalo de 60 microgramos a 240 microgramos.
Eliminación
Corifolitropina alfa presenta una semivida de eliminación de 70 horas (59-82 horas1) y un aclaramiento de 0,13 l/h (0,10-0,18 l/h1). La eliminación de corifolitropina alfa se produce principalmente a través de los riñones, y el volumen de eliminación puede verse reducido en pacientes con insuficiencia renal (ver secciones 4.2 y 4.4).
El metabolismo hepático contribuye en menor medida a la eliminación de corifolitropina alfa.
Otras poblaciones especiales
Alteración hepática
Aunque no se dispone de datos en pacientes con insuficiencia hepática, no es probable que la insuficiencia hepática afecte al perfil farmacocinético de corifolitropina alfa.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de toxicidad a dosis única y a dosis repetidas y de farmacología de seguridad.
Los estudios de toxicología reproductiva en la rata y el conejo indicaron que corifolitropina alfa no afecta negativamente a la fertilidad. La administración de corifolitropina alfa a ratas y conejos, antes e inmediatamente después del apareamiento, y durante el comienzo del embarazo, provocó embriotoxicidad. En conejos, cuando se administra antes del apareamiento, se ha observado teratogenicidad. Tanto la embriotoxicidad como la teratogenicidad se consideran una consecuencia del estado de superovulación del animal que no es capaz de tolerar un número de embriones por encima del límite fisiológico. La importancia de estos resultados sobre el uso clínico de Elonva es limitada.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Citrato de sodio Sacarosa Polisorbato 20 Metionina
Hidróxido de sodio (para ajuste del pH)
Ácido clorhídrico (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Para su comodidad, se permite al paciente conservar el medicamento a una temperatura igual o inferior a 25°C durante un periodo no superior a 1 mes.
Conservar la jeringa en el embalaje exterior para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Elonva se presenta en jeringas precargadas con cierre en rosca de ajuste hermético de 1 ml (vidrio hidrolítico tipo I), cerradas con un émbolo de elastómero de bromobutilo y una cápsula de cierre. La jeringa está equipada con un sistema de seguridad automático para evitar pinchazos con la aguja después de su uso y está acondicionada con una aguja para inyección estéril. Cada jeringa precargada contiene 0,5 ml de solución inyectable.
Elonva está disponible en envases con 1 jeringa precargada.
6.6 Precauciones especiales de eliminación y otras manipulaciones
No usar Elonva si la solución no es transparente.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/609/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 25 de enero de 2010 Fecha de la última revalidación: 22 de agosto de 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Elonva 150 microgramos solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada jeringa precargada contiene 150 microgramos de corifolitropina alfa* en 0,5 ml de solución inyectable.
*corifolitropina alfa es una glicoproteína producida en células de ovario de hámster chino (CHO) mediante tecnología del DNA recombinante.
Excipiente(s) con efecto conocido:
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por injectable, por lo que se considera esencialmente "exento de sodio".
Para consultar la lista completa de excipientes, ver sección 6.1
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable). Solución acuosa transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Elonva está indicado para la estimulación ovárica controlada (EOC) en combinación con un antagonista de la Hormona Liberadora de las Gonadotropinas (GnRH) para el desarrollo de folículos múltiples en mujeres que participan en un programa de Técnicas de Reproducción Asistida (TRA).
4.2 Posología y forma de administración
El tratamiento con Elonva debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de problemas de fertilidad.
Posología
En el tratamiento de mujeres en edad fértil, la dosis de Elonva depende del peso y de la edad.
- Se recomienda una dosis única de 100 microgramos en mujeres cuyo peso sea menor o igual a 60 kilogramos y cuya edad sea de hasta 36 años inclusive.
- Se recomienda una dosis única de 150 microgramos en mujeres:
- cuyo peso sea mayor de 60 kilogramos, con independencia de cual sea su edad.
- a partir de 50 kilogramos de peso y mayores de 36 años de edad.
No se han realizado estudios en mujeres mayores de 36 años de edad cuyo peso sea inferior a 50 kilogramos.
|
Peso corporal | ||||
|
Menos de 50 kg |
50 - 60 kg |
Más de 60 kg | ||
|
Edad |
Hasta 36 años inclusive |
100 microgramos |
100 microgramos |
150 microgramos |
|
Mayores de 36 años |
No se ha estudiado. |
150 microgramos |
150 microgramos | |
Las dosis recomendadas de Elonva solamente se han establecido en un ciclo de tratamiento con un antagonista de la GnRH, que se administró a partir del día 5 o día 6 de estimulación (ver también las secciones 4.1, 4.4 y 5.1).
Día 1 de estimulación:
Elonva debe administrarse en inyección subcutánea única, preferiblemente en la pared abdominal, durante la fase folicular inicial del ciclo menstrual.
Día 5 ó 6 de estimulación:
El tratamiento con el antagonista de la GnRH se debe iniciar el día 5 ó 6° de estimulación dependiendo de la respuesta ovárica, es decir, del número y tamaño de los folículos en crecimiento. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. El antagonista de la GnRH se usa para evitar la aparición de incrementos prematuros de hormona luteinizante (LH).
Día 8 de estimulación:
Siete días después de la inyección de Elonva el día 1 de estimulación, se puede continuar el tratamiento de la estimulación ovárica controlada con inyecciones diarias de Hormona Estimulante del Folículo (recombinante) [FSH(rec)] hasta que se alcance el criterio para desencadenar la maduración final de los ovocitos (3 folículos > 17 mm). La dosis diaria de FSH(rec) puede depender de la respuesta ovárica. En mujeres con respuesta normal se aconseja una dosis diaria de 150 UI de FSH(rec). Dependiendo de la respuesta ovárica puede omitirse la administración de la dosis de FSH(rec) el día de la administración de la Gonodotropina Coriónica Humana (hCG). Generalmente, de promedio, se logra un desarrollo folicular adecuado el noveno día de tratamiento (en un rango de 6 a 18 días).
Tan pronto como se observe la existencia de tres folículos >17 mm, se administrará el mismo día o el día siguiente, una única inyección de 5.000 hasta 10.000 UI de hCG para inducir la maduración final de los ovocitos. En caso de una excesiva respuesta ovárica, vea las recomendaciones incluidas en la sección 4.4, con objeto de reducir el riesgo de desarrollar Síndrome de Hiperestimulación Ovárica (SHO).
Poblaciones especiales Alteración renal
No se han realizado estudios en pacientes con insuficiencia renal. Como la velocidad de eliminación de la corifolitropina alfa puede verse reducida en pacientes con insuficiencia renal, no se recomienda el uso de Elonva en mujeres con esta patología (ver secciones 4.4 y 5.2).
Alteración hepática
Aunque no hay datos disponibles en pacientes con insuficiencia hepática, es poco probable que la insuficiencia hepática afecte a la excreción de la corifolitropina alfa (ver sección 5.2).
Población pediátrica
No existe una recomendación de uso específica de Elonva para la indicación aprobada en la población pediátrica.
Forma de administración
La inyección subcutánea de Elonva puede ser administrada por la propia mujer o por su pareja siempre que sigan las instrucciones de su médico. La autoadministración de Elonva sólo debe ser realizada por mujeres muy motivadas, adecuadamente entrenadas y con acceso a consejo médico.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Tumores ováricos, de la mama, útero, hipófisis o hipotálamo.
• Hemorragia vaginal anormal (no menstrual) sin causa conocida/diagnosticada.
• Insuficiencia ovárica primaria.
• Quistes ováricos o aumento del tamaño de los ovarios.
• Historia de Síndrome de Hiperestimulación Ovárica (SHO).
• Ciclo previo de Estimulación Ovárica Controlada con resultado de más de 30 folículos > 11 mm medidos por ecografía.
• Un recuento basal de folículos antrales > 20.
• Miomas uterinos incompatibles con el embarazo.
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Síndrome de ovario poliquístico (SOP).
4.4 Advertencias y precauciones especiales de empleo
Evaluación de la infertilidad antes de iniciar el tratamiento
Antes de comenzar el tratamiento debe valorarse adecuadamente la infertilidad de la pareja. En particular, debe evaluarse si la mujer padece hipotiroidismo, insuficiencia suprarrenal, hiperprolactinemia y tumores hipofisarios o hipotalámicos, proporcionándole un tratamiento específico adecuado. También se deben evaluar las condiciones médicas que contraindiquen el embarazo antes de iniciar el tratamiento con Elonva.
Dosificación durante el ciclo de estimulación
Elonva se administra solamente como inyección subcutánea única. No se deben administrar inyecciones adicionales de Elonva dentro del mismo ciclo de tratamiento (ver también sección 4.2).
Después de la administración de Elonva, no se deben administrar productos con FSH adicional antes del día 8 de estimulación (ver también sección 4.2).
Alteración renal
En pacientes con insuficiencia renal leve, moderada o grave la velocidad de eliminación de corifolitropina alfa puede verse reducida (ver secciones 4.2 y 5.2). Por lo tanto, no se recomienda el uso de Elonva en estas mujeres.
No se recomienda en un protocolo con agonista de la GnRH
Los datos sobre el uso de Elonva en combinación con un agonista de la GnRH son limitados. Los resultados de un pequeño estudio no controlado sugieren una respuesta ovárica superior que en combinación con un antagonista de la GnRH. Por lo tanto, no se recomienda el uso de Elonva en combinación con un agonista de la GnRH (ver también sección 4.2).
Síndrome de Hiperestimulación Oválica (SHO)
El SHO es una enfermedad distinta al aumento del tamaño de los ovarios sin complicaciones. Los signos y síntomas clínicos del SHO leve y moderado son dolor abdominal, náuseas, diarrea, aumento de leve a moderado del tamaño de los ovarios y quistes ováricos. El SHO grave puede ser potencialmente mortal. Los signos y síntomas clínicos del SHO grave son quistes ováricos grandes, dolor abdominal agudo, ascitis, derrame pleural, hidrotórax, disnea, oliguria, alteraciones hematológicas y aumento de peso. En casos raros, puede producirse tromboembolismo venoso o arterial junto con el SHO. También se han notificado alteraciones transitorias de las pruebas de función hepática asociadas al SHO, que indican una disfunción hepática con o sin cambios morfológicos en la biopsia de hígado.
El SHO puede producirse por la administración de hCG y por el embarazo (hCG endógena). El SHO incipiente generalmente se produce dentro de los 10 días después de la administración de hCG y puede estar asociado a una respuesta ovárica excesiva a la estimulación de gonadotropina. El SHO tardío se produce más de 10 días después de la administración de hCG, como consecuencia de las alteraciones hormonales del embarazo. Debido al riesgo de desarrollar SHO, se debe controlar a las pacientes durante al menos dos semanas después de la administración de hCG.
Las mujeres con factores de riesgo conocidos a una respuesta ovárica alta, pueden ser especialmente propensas al desarrollo de SHO después del tratamiento con Elonva. En mujeres que tienen su primer ciclo de estimulación ovárica, para quienes los factores de riesgo sólo se conocen parcialmente, se recomienda la estrecha observación de los primeros signos y síntomas del SHO.
Para reducir el riesgo de SHO, se deben realizar evaluaciones ecográficas del desarrollo folicular antes del tratamiento y a intervalos regulares durante el tratamiento. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. En las TRA se produce un aumento del riesgo de SHO con 18 o más folículos de un diámetro de 11 mm o más. Cuando haya 30 o más folículos en total se aconseja interrumpir la administración de hCG.
En función de la respuesta ovárica, se pueden tener en cuenta las siguientes medidas para reducir el riesgo del SHO:
- interrumpir la estimulación posterior con una gonadotropina durante un máximo de 3 días (coasting);
- interrumpir la hCG y cancelar el ciclo de tratamiento;
- administrar una dosis inferior a 10.000 UI de hCG para desencadenar la maduración final de los ovocitos, por ejemplo 5.000 UI de hCG o 250 microgramos de hCG-rec (que es equivalente a aproximadamente 6.500 UI);
- cancelar la transferencia de embriones frescos y crioconservar los embriones;
- evitar la administración de la hCG para facilitar la fase lútea.
El cumplimiento terapéutico de la dosis recomendada de Elonva y del ciclo de tratamiento y un cuidadoso seguimiento de la respuesta ovárica son importantes para reducir el riesgo de SHO.
Si se desarrolla SHO, se debe aplicar un sistema estándar apropiado de gestión y seguimiento del SHO.
Torsión ovárica
Se ha notificado torsión ovárica después del tratamiento con gonadotropinas, incluyendo Elonva. La torsión ovárica puede estar relacionada con otras situaciones, como SHO, embarazo, cirugía abdominal previa, antecedentes de torsión ovárica y quistes ováricos anteriores o actuales. El daño en el ovario debido a la reducción del aporte de sangre puede limitarse mediante un diagnóstico precoz y la destorsión inmediata.
Embarazo múltiple
Se han notificado embarazos y nacimientos múltiples con todos los tratamientos con gonadotropina, incluyendo Elonva. Se debe advertir a la mujer y a su pareja de los posibles riesgos para la madre (complicaciones en el embarazo y en el parto) y para el recién nacido (bajo peso al nacer) antes de iniciar el tratamiento. En las mujeres que se someten a TRA el riesgo de embarazo múltiple está principalmente relacionado con el número de embriones transferidos.
Embarazo ectópico
Las mujeres infértiles que se someten a TRA tienen una mayor incidencia de embarazos ectópicos. Es importante confirmar cuanto antes mediante ecografía que el embarazo sea intrauterino, y descartar la posibilidad de embarazo extrauterino.
Malformaciones congénitas
La incidencia de malformaciones congénitas tras la aplicación de TRA puede ser algo más elevada que tras la concepción espontánea. Esto puede ser debido a diferencias en las características de los progenitores (por ejemplo edad de la madre, características del semen) y la mayor incidencia de embarazos múltiples.
Neoplasias de ovario y otras neoplasias del sistema reproductor
Se han notificado neoplasias de ovario y otras neoplasias del sistema reproductor, benignas y malignas, en mujeres que se han sometido a múltiples tratamientos farmacológicos para el tratamiento de la infertilidad. No se ha establecido si el tratamiento con gonadotropinas aumenta el riesgo de estos tumores en mujeres infértiles.
Complicaciones vasculares
Se han notificado acontecimientos tromboembólicos, tanto en asociación como independientes del SHO después del tratamiento con gonadotropinas, incluyendo Elonva. La trombosis intravascular, que puede tener su origen en vasos arteriales o venosos, puede dar lugar a una reducción del flujo sanguíneo a los órganos vitales o a las extremidades. En mujeres con factores de riesgo de trombosis generalmente reconocidos, como antecedentes personales o familiares, obesidad grave o trombofilia, el tratamiento con gonadotropinas puede aumentar aún más este riesgo. En estas mujeres se sopesarán los beneficios de la administración de gonadotropinas frente a los riesgos. Sin embargo, debe tenerse en cuenta que el embarazo por si solo también conlleva un aumento del riesgo de trombosis.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones con Elonva y otros medicamentos. Como corifolitropina alfa no es un sustrato de las enzimas del citocromo P450, no se esperan interacciones metabólicas con otros medicamentos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
En caso de exposición involuntaria a Elonva durante el embarazo, los datos clínicos no son suficientes para excluir consecuencias adversas en el embarazo. En los estudios en animales se ha observado toxicidad reproductiva (ver los datos preclínicos sobre seguridad en la sección 5.3). No está indicado el uso de Elonva durante el embarazo.
Lactancia
No está indicado el uso de Elonva durante la lactancia.
Fertilidad
Elonva está indicada para su uso en la infertilidad (ver sección 4.1).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Elonva puede producir mareo. Se debe advertir a las mujeres que si se sienten mareadas no deben conducir ni utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas notificadas más frecuentemente durante el tratamiento con Elonva en ensayos clínicos (N=2.397) son molestias pélvicas (6,0%), SHO (4,3%, ver también sección 4.4), cefalea (4,0%), dolor pélvico (2,9%), naúseas (2,3%), fatiga (1,5%) y dolor mamario a la palpación (1,3%).
Lista tabulada de reacciones adversas
La siguiente tabla muestra las principales reacciones adversas en mujeres tratadas con Elonva en ensayos clínicos según el sistema de clasificación de órganos y frecuencia; muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000) y muy raras (<1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Sistema de clasificación de órganos |
Frecuencia |
Reacción adversa |
|
Trastornos psiquiátricos |
Poco frecuentes |
Cambios del estado de ánimo |
|
Trastornos del sistema nervioso |
Frecuentes Poco frecuentes |
Cefalea Mareo |
|
Trastornos vasculares |
Poco frecuentes |
Acaloramiento |
|
Trastornos gastrointestinales |
Frecuentes Poco frecuentes |
Náuseas Distensión abdominal, vómitos, diarrea, estreñimiento |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes |
Dolor de espalda |
|
Embarazo, puerperio y enfermedades perinatales |
Poco frecuentes |
Aborto espontáneo |
|
Trastornos del aparato reproductor y de la mama |
Frecuentes Poco frecuentes |
SHO, dolor pélvico, molestias pélvicas, dolor mamario a la palpación Torsión ovárica, dolor anexial uterino, ovulación prematura, dolor de mama |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuentes Poco frecuentes |
Fatiga Hematoma en la zona de inyección, dolor en la zona de inyección, irritabilidad |
|
Exploraciones complementarias |
Poco frecuentes |
Alanina aminotransferasa elevada, |
_aspartato aminotransferasa elevada
Lesiones traumáticas, intoxicaciones Poco frecuentes Dolor asociado a procedimiento y complicaciones de procedimientos terapéutico
terapéuticos_
Descripción de reacciones adversas seleccionadas
Además se han notificado embarazo ectópico y gestación múltiple. Se considera que estas reacciones están relacionadas con las TRA o con el embarazo posterior.
En casos raros, se ha asociado la aparición de tromboembolismo con la terapia de Elonva, lo que también se ha observado durante el tratamiento con otras gonadotropinas.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Más de una inyección de Elonva dentro de un ciclo de tratamiento o una dosis demasiado alta de Elonva y/o FSH(rec) puede aumentar el riesgo de SHO. Ver sección 4.4 para consultar las medidas para reducir el riesgo del SHO.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotropinas, código ATC: G03GA09
Mecanismo de acción
Corifolitropina alfa se ha diseñado como un estimulante folicular sostenido con el mismo perfil farmacodinámico que FSH(rec), pero con una duración de la actividad FSH sustancialmente prolongada. Por su capacidad para iniciar y mantener el crecimiento folicular múltiple durante una semana entera, una única inyección subcutánea de la dosis recomendada de Elonva puede sustituir las siete primeras inyecciones de cualquier preparación de FSH(rec) diaria en un ciclo de tratamiento de Estimulación Ovárica Controlada. Se consiguió una larga duración de la actividad FSH añadiendo el péptido carboxi-terminal de la subunidad P de la gonadotropina coriónica humana (hCG) a la cadena P de la FSH Humana. Corifolitropina alfa no presenta ninguna actividad LH/hCG intrínseca.
Eficacia clínica y seguridad
En tres ensayos clínicos aleatorizados y doble ciego, el tratamiento con una única inyección subcutánea de Elonva, 100 microgramos (estudio ENSURE) o 150 microgramos (estudio ENGAGE y estudio PURSUE), durante los primeros siete días de estimulación ovárica controlada, se comparó con el tratamiento con una dosis diaria de 150, 200, ó 300 UI de FSH(rec), respectivamente. En cada uno de los tres ensayos clínicos se realizó la supresión hipofisiaria con un antagonista de la GnRH (inyección de acetato de ganirelix a una dosis diaria de 0,25 mg).
En el estudio ENSURE, 396 mujeres sanas con ciclos ovulatorios normales, con edades comprendidas entre los 18 y los 36 años de edad, con un peso corporal menor o igual a 60 kg, fueron tratadas durante un ciclo con 100 microgramos de Elonva y supresión hipofisiaria con un antagonista de la GnRH en el marco de un programa de TRA. La variable principal de valoración de la eficacia fue el número de ovocitos recuperados. La mediana de la duración total de la estimulación fue de 9 días para ambos grupos, lo que indica que se requerían dos días de FSH(rec) para completar la estimulación ovárica desde el día 8 de estimulación en adelante (en este estudio se administró FSH(rec) en el día de la hCG).
En el estudio ENGAGE, 1.506 mujeres sanas con ciclos ovulatorios normales, con edades comprendidas entre los 18 y los 36 años de edad, con un peso corporal mayor de 60 kg y menor o igual a 90 kg, fueron tratadas durante un ciclo con 150 microgramos de Elonva y supresión hipofisiaria con un antagonista de la GnRH en el marco de un programa de TRA. Las variables co-principales de valoración de la eficacia fueron las tasas de embarazo en curso y el número de ovocitos recuperados. La mediana de la duración total de la estimulación fue de 9 días para ambos grupos, lo que indica que se requerían dos días de FSH(rec) para completar la estimulación ovárica desde el día
8 de estimulación en adelante (en este estudio se administró FSH(rec) en el día de la hCG).
En el estudio PURSUE, 1.390 mujeres sanas con ciclos ovulatorios normales, con edades comprendidas entre los 35 y los 42 años de edad, con un peso corporal mayor o igual a 50 kg, fueron tratadas durante un ciclo con 150 microgramos de Elonva y supresión hipofisiaria con un antagonista de la GnRH en el marco de un programa de TRA. La variable principal de valoración de la eficacia fue la tasa de embarazo clínico. El número de ovocitos recuperados fue considerado una variable secundaria de valoración de la eficacia. La mediana de la duración total de la estimulación fue de
9 días para ambos grupos, lo que indica que se requería un día de FSH(rec) para completar la estimulación ovárica desde el día 8 de estimulación en adelante (en este estudio no se administró FSH(rec) en el día de la hCG).
Número de ovocitos recuperados
En los tres estudios, el tratamiento con una única inyección de Elonva, 100 ó 150 microgramos, durante los primeros siete días de estimulación ovárica controlada, provocó un número superior de ovocitos recuperados en comparación con el tratamiento con una dosis diaria de FSH(rec).
No obstante las diferencias estaban dentro de los márgenes de equivalencia predefinidos (ENGAGE y ENSURE) o de los márgenes de no inferioridad (PURSUE). Ver Tabla 1 a continuación.
Tabla 1: Media del número de ovocitos recuperados en los estudios ENSURE, ENGAGE, y PURSUE Población ITT (intención de tratar)
|
Variable |
ENSURE (18-36 años de edad) (peso corporal menor o igual a 60 kg) |
ENGAGE (18-36 años de edad) (peso corporal mayor de 60 kg y menor o igual a 90 kg) |
PURSUE (35-42 años de edad) (peso corporal mayor o igual a 50 kg) | |||
|
Elonva 100 pg |
FSH(rec) 150 UI |
Elonva 150 Pg |
FSH(rec) 200 UI |
Elonva 150 Pg |
FSH(rec) 300 UI | |
|
N=268 |
N=128 |
N=756 |
N=750 |
N=694 |
N=696 | |
|
Media del número de ovocitos |
13,3 |
10,6 |
13,8 |
12,6 |
10,7 |
10,3 |
|
Diferencia [IC 95%] |
2,5 [1,2; 3,9] |
1,2 [0,5; 1,9] |
0,5 [-0,2; 1,2] | |||
Embarazo a partir de ciclos en fresco en los estudios ENGAGE y PURSUE
En el estudio de ENGAGE, se demostró la no inferioridad en las tasas de embarazo en curso entre Elonva y la FSH(rec), definiendo la tasa de embarazo en curso como la presencia de al menos un feto con actividad cardiaca evaluada al menos 10 semanas después de la transferencia de los embriones.
En el estudio PURSUE, se demostró la no inferioridad en la tasa de embarazo clínico entre Elonva y la FSH(rec), definiendo la tasa de embarazo clínico como el porcentaje de sujetos con al menos un feto con actividad cardiaca evaluada 5 a 6 semanas después de la transferencia de los embriones.
Los resultados de embarazo a partir de ciclos en fresco en los estudios ENGAGE y PURSUE se resumen a continuación en la Tabla 2.
Tabla 2: Resultados de embarazo a partir de ciclos en fresco en los estudios
ENGAGE y PURSUE Población ITT (intención de tratar)
|
Variable |
Ciclos en fresco en el estudio engaget (18-36 años de edad) (peso corporal mayor de 60 kg y menor o igual a 90 kg) |
Ciclos en fresco en el estudio PURSUE* (35-42 años de edad) (peso corporal mayor o igual a 50 kg) | ||||
|
Elonva 150 |
FSH(rec) 200 UI |
Diferencia [IC 95%] |
Elonva 150 ^g |
FSH(rec) 300 UI |
Diferencia [IC 95%] | |
|
N=756 |
N=750 |
N=694 |
N=696 | |||
|
Tasa de embarazo clínico |
39,9% |
39,1% |
1,1 [-3,8; 5,9] |
23,9% |
26,9% |
-3,0 [-7,3; 1,4] |
|
Tasa de embarazo en curso |
39,0% |
38,1% |
1,1 [-3,8; 5,9] |
22,2% |
24,0% |
-1,9 [-6,1; 2,3] |
|
Tasa de nacidos vivos* |
35,6% |
34,4% |
1,3 [-3,5; 6,1] |
21,3% |
23,4% |
-2,3 [-6.5; 1,9] |
tLa variable principal de valoración de la eficacia del estudio ENGAGE fue los embarazos en curso (evaluados al menos 10 semanas después de la transferencia de los embriones).
*La variable principal de valoración de la eficacia del estudio PURSUE fue la tasa de embarazo clínico definida como el porcentaje de sujetos con al menos un feto con actividad cardiaca evaluada 5 a 6 semanas después de la transferencia de los embriones.
*La tasa de nacidos vivos fue una variable secundaria de valoración de la eficacia en los estudios ENGAGE y PURSUE.
En estos ensayos clínicos, el perfil de seguridad de una inyección única de Elonva fue comparable a las inyecciones diarias de FSH(rec).
Embarazo a partir de ciclos de Transferencia de Embriones Congelados (descongelados) (TEC) en los estudios ENGAGE y PURSUE
El estudio de seguimiento de TEC para el estudio ENGAGE incluyó a mujeres que tenían al menos un embrión descongelado para su uso, hasta por lo menos un año después de la criopreservación. El promedio de embriones transferidos en los ciclos de TEC para el estudio ENGAGE fue de 1,7 en ambos grupos de tratamiento.
El estudio de seguimiento de TEC para el estudio PURSUE incluyó a mujeres que tenían al menos un embrión descongelado para su uso, dentro de los dos años siguientes a la fecha de la última criopreservación para ese estudio. El promedio de embriones transferidos en los ciclos de TEC para el estudio PURSUE fue de 2,4 en ambos grupos de tratamiento. Este estudio también proporcionó datos sobre la seguridad de los bebés nacidos a partir de embriones criopreservados.
El número máximo de ciclos de TEC fue de 5 ciclos y de 4 ciclos para los estudios de seguimiento de TEC de ENGAGE y de PURSUE, respectivamente. Los resultados de embarazo de los dos primeros ciclos de TEC en el estudio ENGAGE y el estudio PURSUE se resumen a continuación en la Tabla 3.
Tabla 3: Resultados de embarazo a partir de ciclos de TEC en los estudios
ENGAGE y PURSUE Población ITT (intención de tratar)
|
Ciclos de TEC en el estudio ENGAGE (18-36 años de edad) (peso corporal mayor de 60 kg y menor o igual a 90 kg) |
Ciclos de TEC en el estudio PURSUE (35-42 años de edad) (peso corporal mayor o igual a 50 kg) | |||||||||||
|
Elonva _150 Rg_ |
FSH(rec) 200 IU |
Elonva _150 Rg_ |
FSH(rec) 300 IU | |||||||||
|
n |
N |
% |
n |
N |
% |
n |
N |
% |
n |
N |
% | |
|
Ciclo TEC 1a | ||||||||||||
|
Embarazo en curso |
55 |
148 |
37,2 |
45 |
147 |
30,6 |
43 |
152 |
28,3 |
42 |
145 |
29,0 |
|
Nacidos vivos |
- |
- |
- |
- |
- |
- |
43 |
152 |
28,3 |
41 |
145 |
28,3 |
|
Ciclo TEC 2a | ||||||||||||
|
Embarazo en curso |
9 |
38 |
23,7 |
9 |
31 |
29,0 |
8 |
23 |
34,8 |
6 |
14 |
42,9 |
|
Nacidos vivos |
- |
- |
- |
- |
- |
- |
8 |
23 |
34,8 |
6 |
14 |
42,9 |
n = número de sujetos con el acontecimiento; N = Número total de sujetos a Por transferencia de embrión.
Malformaciones congénitas notificadas en bebés nacidos después de ciclos de transferencia de embriones congelados (descongelados) (TEC)
Tras el uso de Elonva, nacieron 61 bebés después de un ciclo de TEC, y nacieron 630 bebés tras la aplicación de TRA con ciclos en fresco. Las tasas de las malformaciones congénitas (mayores y menores combinadas) notificadas para los bebés nacidos después de un ciclo de TEC (16,4%) fueron similares a las notificadas para los bebés nacidos tras la aplicación de TRA con ciclos en fresco (19,5%).
Inmunogenicidad
De las 2.511 mujeres tratadas con Elonva que fueron evaluadas para analizar la presencia de anticuerpos post-tratamiento, cuatro de ellas (0,16%) mostraron evidencias de la generación de anticuerpos, incluidas tres mujeres que habían sido expuestas una vez a Elonva y una mujer que había sido expuesta dos veces al tratamiento con Elonva. En cada caso, estos anticuerpos no fueron neutralizantes y no interfirieron con la respuesta a la estimulación o con las respuestas fisiológicas normales del eje Hipotálamo-Hipófisis-Ovario (HHO). Dos de estas cuatro mujeres quedaron embarazadas durante el mismo ciclo de tratamiento en el que se detectaron los anticuerpos, lo que sugiere que la presencia de anticuerpos no neutralizantes después de la estimulación con Elonva no es clínicamente significativa.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Elonva en uno o más grupos de la población pediátrica en hipogonadismo hipogonadotrófico (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Los parámetros farmacocinéticos de corifolitropina alfa fueron evaluados después de su administración subcutánea a mujeres sometidas a un ciclo de tratamiento de estimulación ovárica controlada.
Debido a la larga semivida de eliminación, tras la administración de las dosis recomendada, las concentraciones séricas de corifolitropina alfa son suficientes para mantener el crecimiento folicular múltiple durante una semana entera. Esto justifica la sustitución de las primeras siete inyecciones diarias de FSH(rec) por una única inyección subcutánea de Elonva en Estimulación Ovárica Controlada para el desarrollo de folículos múltiples y embarazo en un programa de TRA (ver sección 4.2).
El peso corporal es un factor determinante de la exposición a corifolitropina alfa. La exposición a corifolitropina alfa después de la administración de una única injección subcutánea es de 665 horas*ng/ml (ABC, 426-1.037 horas*ng/m^) y es similar tras la administración de 100 microgramos de corifolitropina alfa a mujeres con un peso corporal menor o igual a 60 kilogramos y de 150 microgramos de corifolitropina alfa a mujeres con un peso corporal mayor de 60 kilogramos.
Absorción
Tras una única inyección subcutánea de Elonva, la concentración sérica máxima de corifolitropina alfa es de 4,24 ng/ml (2,49-7,21 ng/ml2) y se alcanza 44 horas (35-57 horas2) después de la administración de la dosis. La biodisponibilidad absoluta es del 58% (48-70%2).
Distribución
La distribución, metabolismo y eliminación de corifolitropina alfa son muy similares a los de otras gonadotropinas, tales como FSH, hCG y LH. Tras la absorción en la sangre, corifolitropina alfa se distribuye principalmente a los ovarios y riñones. El volumen de distribución en el estado de equilibrio es de 9,2 l (6,5-13,1 l2). La exposición a corifolitropina alfa aumenta proporcionalmente con la dosis en el intervalo de 60 microgramos a 240 microgramos.
Eliminación
Corifolitropina alfa presenta una semivida de eliminación de 70 horas (59-82 horas2) y un aclaramiento de 0,13 l/h (0,10-0,18 l/h2). La eliminación de corifolitropina alfa se produce principalmente a través de los riñones, y el volumen de eliminación puede verse reducido en pacientes con insuficiencia renal (ver secciones 4.2 y 4.4).
El metabolismo hepático contribuye en menor medida a la eliminación de corifolitropina alfa.
Otras poblaciones especiales
Alteración hepática
Aunque no se dispone de datos en pacientes con insuficiencia hepática, no es probable que la insuficiencia hepática afecte al perfil farmacocinético de corifolitropina alfa.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de toxicidad a dosis única y a dosis repetidas y de farmacología de seguridad.
Los estudios de toxicología reproductiva en la rata y el conejo indicaron que corifolitropina alfa no afecta negativamente a la fertilidad. La administración de corifolitropina alfa a ratas y conejos, antes e inmediatamente después del apareamiento, y durante el comienzo del embarazo, provocó embriotoxicidad. En conejos, cuando se administra antes del apareamiento, se ha observado teratogenicidad. Tanto la embriotoxicidad como la teratogenicidad se consideran una consecuencia del estado de superovulación del animal que no es capaz de tolerar un número de embriones por encima del límite fisiológico. La importancia de estos resultados sobre el uso clínico de Elonva es limitada.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Citrato de sodio Sacarosa Polisorbato 20 Metionina
Hidróxido de sodio (para ajuste del pH)
Ácido clorhídrico (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Para su comodidad, se permite al paciente conservar el medicamento a una temperatura igual o inferior a 25°C durante un periodo no superior a 1 mes.
Conservar la jeringa en el embalaje exterior para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Elonva se presenta en jeringas precargadas con cierre en rosca de ajuste hermético de 1 ml (vidrio hidrolítico tipo I), cerradas con un émbolo de elastómero de bromobutilo y una cápsula de cierre. La jeringa está equipada con un sistema de seguridad automático para evitar pinchazos con la aguja después de su uso y está acondicionada con una aguja para inyección estéril. Cada jeringa precargada contiene 0,5 ml de solución inyectable.
Elonva está disponible en envases con 1 jeringa precargada.
6.6 Precauciones especiales de eliminación y otras manipulaciones
No usar Elonva si la solución no es transparente.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/609/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 25 de enero de 2010 Fecha de la última revalidación: 22 de agosto de 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico.
N.V. Organon Kloosterstraat 6 5349 AB Oss Países Bajos
N.V. Organon Veersemeer 4,
5347 JN Oss Países Bajos
Nombre y dirección de los fabricantes responsables de la liberación de los lotes N.V. Organon
Kloosterstraat 6 5349 AB Oss P.O. Box 20 5340 BH Oss Países Bajos
Organon (Ireland) Ltd.
Drynam Road, Swords, Co. Dublín Irlanda
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden
presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Elonva 100 microgramos solución inyectable corifolitropina alfa
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene 100 microgramos de corifolitropina alfa en 0,5 ml de solución inyectable.
3. LISTA DE EXCIPIENTES
Otros componentes: citrato de sodio, sacarosa, polisorbato 20, metionina, hidróxido de sodio (para ajuste del pH), ácido clorhídrico (para ajuste del pH), agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable
1 jeringa precargada con un sistema de seguridad automático (para la prevención de pinchazos con la aguja) y una aguja para inyección estéril. 0,5 ml.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Únicamente para un solo uso.
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Conservación por el farmacéutico Conservar en nevera. No congelar
Conservación por el paciente Existen dos opciones:
1. Conservar en nevera. No congelar.
2. Conservar a una temperatura igual o inferior a 25°C durante un periodo no superior a 1 mes. Conservar la jeringa en el embalaje exterior para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/609/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
<Se acepta la justificación para no incluir la información en Braille>
ETIQUETA DE LA JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Elonva 100 microgramos inyectable corifolitropina alfa
Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,5 ml
6. OTROS
1. NOMBRE DEL MEDICAMENTO
Elonva 150 microgramos solución inyectable corifolitropina alfa
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene 150 microgramos de corifolitropina alfa en 0,5 ml de solución inyectable.
3. LISTA DE EXCIPIENTES
Otros componentes: citrato de sodio, sacarosa, polisorbato 20, metionina, hidróxido de sodio (para ajuste del pH), ácido clorhídrico (para ajuste del pH), agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable
1 jeringa precargada con un sistema de seguridad automático (para la prevención de pinchazos con la aguja) y una aguja para inyección estéril. 0,5 ml.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Únicamente para un solo uso.
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Conservación por el farmacéutico Conservar en nevera. No congelar
Conservación por el paciente Existen dos opciones:
1. Conservar en nevera. No congelar.
2. Conservar a una temperatura igual o inferior a 25°C durante un periodo no superior a 1 mes. Conservar la jeringa en el embalaje exterior para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/609/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
<Se acepta la justificación para no incluir la información en Braille>
ETIQUETA DE LA JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Elonva 150 microgramos inyectable corifolitropina alfa
Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,5 ml
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Elonva 100 microgramos solución inyectable
corifolitropina alfa
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto
1. Qué es Elonva y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Elonva
3. Cómo usar Elonva
4. Posibles efectos adversos
5. Conservación de Elonva
6. Contenido del envase e información adicional
1. Qué es Elonva y para qué se utiliza
Elonva contiene el principio activo corifolitropina alfa y pertenece al grupo de medicamentos llamado hormonas gonadotróficas. Las hormonas gonadotróficas desempeñan un papel importante en la fertilidad y en la reproducción humana. Una de estas hormonas gonadotróficas es la hormona estimulante del folículo (FSH), que se necesita en las mujeres para el crecimiento y desarrollo de los folículos (pequeños sacos redondos en sus ovarios que contienen los óvulos).
Elonva se usa para ayudar a conseguir el embarazo en mujeres que están siguiendo tratamiento por infertilidad, tales como fecundación in vitro (FIV). La FIV incluye la extracción de óvulos del ovario, fecundación de los óvulos en el laboratorio y la transferencia de los embriones al útero unos días después. Elonva provoca el crecimiento y el desarrollo de varios folículos al mismo tiempo mediante una estimulación controlada de los ovarios.
2. Qué necesita saber antes de empezar a usar Elonva
No use Elonva:
- si es alérgico (hipersensible) a corifolitropina alfa o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- si presenta cáncer de ovario, mama, útero o cerebro (hipófisis o hipotálamo)
- si ha tenido recientemente sangrado vaginal inesperado, que no sea el sangrado menstrual, por causas que no han sido diagnosticadas
- si sus ovarios no funcionan por una enfermedad llamada insuficiencia ovárica primaria
- si tiene quistes ováricos o aumento del tamaño de los ovarios
- si tiene síndrome de ovario poliquístico (SOP)
- si ha tenido síndrome de hiperestimulación ovárica (SHO). El SHO es un problema clínico grave que puede ocurrir cuando los ovarios se sobreestimulan. Se explica con detalle más adelante en este prospecto.
- si ha recibido previamente un ciclo de tratamiento de estimulación de los ovarios controlada con resultado de un crecimiento de más de 30 folículos con un tamaño de 11 mm o mayor.
- si su recuento basal de folículos antrales (número de pequeños folículos presentes en sus ovarios al comienzo del ciclo menstrual) es superior a 20
- si presenta malformaciones de los órganos sexuales que hacen imposible un embarazo normal
- si tiene miomas en el útero que hacen imposible un embarazo normal
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Elonva.
Síndrome de hiperestimulación ovárica (SHO)
El tratamiento con hormonas gonadotróficas como Elonva puede provocar síndrome de hiperestimulación ovárica (SHO). Éste es una afección grave en el que los ovarios se sobreestimulan y los folículos en crecimiento se hacen más grandes de lo normal. En casos raros, el SHO grave puede ser potencialmente mortal. Por lo tanto, es muy importante la supervisión estrecha de su médico. Para comprobar los efectos del tratamiento, su médico le hará ecografías de sus ovarios. Su médico también puede comprobar los niveles de hormonas en sangre. (Ver también la sección 4).
El SHO hace que se acumule líquido de repente en su estómago y en zonas del pecho pudiendo causar la formación de coágulos de sangre. Informe a su médico de inmediato si tiene:
- hinchazón abdominal intensa y dolor en el zona del estómago (abdomen)
- mareos (náuseas)
- vómitos
- aumento repentino de peso debido a la acumulación de líquido
- diarrea
- disminución del volumen de orina
- dificultad para respirar
Solamente debe usar Elonva una vez durante el mismo ciclo de tratamiento, si no la posibilidad de presentar SHO puede aumentar.
Antes de iniciar el tratamiento con este medicamento, informe a su médico si ha tenido alguna vez el síndrome de hiperestimulación ovárica (SHO).
Torsión ovárica
Torsión ovárica es el retorcimiento de un ovario. El retorcimiento del ovario podría provocar que se corte el flujo de sangre al ovario.
Antes de empezar a usar este medicamento, informe a su médico si:
- ha tenido alguna vez el síndrome de hiperestimulación ovárica (SHO).
- está embarazada o cree que podría estarlo.
- le han operado alguna vez la zona del estómago (cirugía abdominal).
- ha tenido alguna vez una torsión de un ovario.
- tiene quistes o ha tenido quistes en su ovario u ovarios.
Coágulos de sangre (Trombosis)
El tratamiento con hormonas gonadotróficas como Elonva puede (como el embarazo) aumentar el riesgo de presentar coágulos de sangre (trombosis). La trombosis es la formación de un coágulo de sangre en un vaso sanguíneo.
Los coágulos de sangre pueden producir enfermedades graves, como:
- obstrucción en sus pulmones (embolia pulmonar)
- ictus
- ataque al corazón
- problemas de los vasos sanguíneos (tromboflebitis)
- falta de flujo de sangre (trombosis venosa profunda), que puede producir la pérdida de su brazo o pierna.
Comente esto con su médico, antes de iniciar el tratamiento, especialmente si:
- ya sabe que tiene un riesgo aumentado de trombosis
- usted o alguno de sus familiares directos ha tenido alguna vez trombosis
- tiene un sobrepeso importante.
Parto múltiple o defectos de nacimiento
Existe un aumento de la posibilidad de tener gemelos o incluso más de dos bebés, incluso cuando se transfiere un solo embrión en el útero. Los embarazos múltiples suponen un aumento del riesgo para la salud tanto de la madre como de sus bebés. Los embarazos múltiples y las características específicas de las parejas con problemas de fertilidad (por ejemplo, la edad de la mujer, ciertos problemas del semen, antecedentes genéticos de ambos padres) pueden estar asociados con un aumento de la probabilidad de defectos de nacimiento.
Complicaciones en el embarazo
Si el tratamiento con Elonva tiene como resultado el embarazo, existe una mayor probabilidad de embarazo fuera del útero (un embarazo ectópico). Por lo tanto, su médico debe hacerle una ecografía al principio para excluir la posibilidad de embarazo fuera del útero.
Tumores de ovario y otros tumores del sistema reproductor
Se han comunicado casos de tumores de ovario y otros tumores del sistema reproductor en mujeres que han seguido un tratamiento de infertilidad. No se sabe si el tratamiento con medicamentos para la fertilidad aumenta el riesgo de estos tumores en mujeres infértiles.
Otras enfermedades
Además, antes de empezar a usar este medicamento, informe a su médico si:
- tiene una enfermedad de los riñones.
- no tiene controlada la glándula pituitaria o tiene problemas hipotálamicos.
- tiene poco activa la glándula tiroides (hipotiroidismo).
- las glándulas suprarrenales no le funcionan adecuadamente (insuficiencia suprarrenal).
- tiene niveles altos de prolactina en la sangre (hiperprolactinemia).
- tiene cualquier otra enfermedad (por ejemplo, diabetes, enfermedad del corazón, o cualquier otra enfermedad de larga duración).
- su médico le ha informado que el embarazo sería peligroso para usted.
Uso de Elonva con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
No debe utilizar Elonva si ya está embarazada, o cree que podría estar embarazada o si está en periodo de lactancia.
Consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
Elonva puede causar mareo. Si se encuentra mareado no debe conducir o usar máquinas.
Elonva contiene sodio
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por inyectable, por lo que se considera esencialmente “exento de sodio”.
3. Cómo usar Elonva
Siga exactamente las instrucciones de administración de Elonva indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Elonva se usa en mujeres que están siguiendo un tratamiento para la infertilidad como la fecundación in vitro (FIV). Durante este tratamiento, Elonva se usa en combinación con un medicamento (llamado antagonista de la GnRH) para evitar que su ovario libere un óvulo demasiado pronto. El tratamiento con el antagonista de la GnRH generalmente se inicia de 5 a 6 días después de la inyección de Elonva.
No es recomendable el uso de Elonva en combinación con un agonista de la GnRH (otro medicamento para evitar que su ovario libere un óvulo demasiado pronto).
Dosis
En el tratamiento de mujeres en edad fértil, la dosis de Elonva depende del peso y de la edad.
- Se recomienda una dosis única de 100 microgramos en mujeres cuyo peso sea menor o igual a 60 kilogramos y cuya edad sea de hasta 36 años inclusive.
- Se recomienda una dosis única de 150 microgramos en mujeres:
- cuyo peso sea mayor de 60 kilogramos, con independencia de cual sea su edad.
- a partir de 50 kilogramos de peso y mayores de 36 años de edad.
No se han realizado estudios en mujeres mayores de 36 años de edad cuyo peso sea inferior a 50 kilogramos.
|
Peso corporal | ||||
|
Menos de 50 kg |
50 - 60 kg |
Más de 60 kg | ||
|
Edad |
Hasta 36 años inclusive |
100 microgramos |
100 microgramos |
150 microgramos |
|
Mayores de 36 años |
No se ha estudiado. |
150 microgramos |
150 microgramos | |
Durante los primeros siete días después de la inyección de Elonva, no debe usar Hormona Estimulante del Folículo (recombinante) (FSH(rec)). Siete días después de la inyección de Elonva, su médico puede decidir continuar el ciclo de estimulación con otra hormona gonadotrófica, como la FSH(rec). Éste se puede continuar durante unos días hasta que haya suficientes folículos de un tamaño adecuado. Esto lo puede comprobar mediante una ecografía. Entonces se interrumpe el tratamiento con FSH(rec) y los óvulos maduran mediante la administración de hCG (Gonadotropina Coriónica humana). Los óvulos se extraen del ovario 34-36 horas después.
Cómo se administra Elonva
El tratamiento con Elonva debe ser supervisado por un médico con experiencia en el tratamiento de problemas de fertilidad. Elonva debe inyectarse debajo de la piel (por vía subcutánea) en un pliegue de la piel (pellizcándose con su pulgar y el dedo índice), preferiblemente justo debajo del ombligo. Le puede administrar la inyección un profesional sanitario (por ejemplo una enfermera), su pareja o usted misma, siempre que su médico le haya enseñado cuidadosamente. Use siempre Elonva tal y como su médico le haya indicado. Debe consultar con su médico o farmacéutico si no está segura. Al final de este prospecto figuran unas “instrucciones de uso” paso a paso.
No inyecte Elonva en el músculo.
Elonva se presenta en jeringas precargadas que tienen un sistema de seguridad automático que ayuda a evitar pinchazos con la aguja después de su uso.
Si usa más Elonva o FSH(rec) del que debe
Si cree que ha usado más Elonva o FSH(rec) del que debe, informe a su médico inmediatamente.
Si olvidó usar Elonva
Si olvidó inyectarse Elonva el día que debería, informe a su médico inmediatamente. No inyecte Elonva sin consultar con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Una posible complicación del tratamiento con hormonas gonadotróficas como Elonva es la sobreestimulación no deseada de los ovarios. La posibilidad de sufrir esta complicación se puede reducir mediante un control minucioso del número de folículos maduros. Su médico le hará ecografías de sus ovarios para controlar minuciosamente el número de folículos maduros. Su médico también puede verificar los niveles de hormonas en sangre. Los primeros síntomas de sobreestimulación ovárica se pueden notar como un dolor en el estómago (abdomen), mareos o diarrea. La sobreestimulación ovárica puede desencadenar una afección llamada síndrome de hiperestimulación ovárica (SHO), que puede ser un problema clínico grave. En casos más graves puede provocar aumento del tamaño de los ovarios, acumulación de líquido en el abdomen y/o pecho (que puede causar aumento repentino de peso debido a la acumulación de líquido) o coágulos en los vasos sanguíneos.
Informe a su médico inmediatamente si presenta dolor en el estómago (abdomen) o cualquier otro síntoma de hiperestimulación ovárica, incluso si se producen algunos días después de la administración de la inyección.
La posibilidad de padecer un efecto adverso se clasifica en las siguientes categorías:
Frecuentes (pueden afectar hasta 1 de cada 10 mujeres)
- Síndrome de hiperestimulación ovárica (SHO)
- Dolor en la pelvis
- Mareos (náuseas)
- Dolor de cabeza
- Molestias en la pelvis
- Sensibilidad en las mamas
- Cansancio (fatiga)
Poco frecuentes (pueden afectar hasta 1 de cada 100 mujeres)
- Retorcimiento de un ovario (torsión ovárica)
- Aumento de las enzimas del hígado
- Aborto involuntario
- Dolor después de la recuperación de los ovocitos
- Dolor asociado a procedimiento terapéutico
- Liberación del óvulo demasiado pronto (ovulación prematura)
- Distensión del abdomen
- Vómitos
- Diarrea
- Estreñimiento
- Dolor de espalda
- Dolor en las mamas
- Moretones o dolor en la zona de la inyección
- Irritabilidad
- Cambios de humor
- Mareos
- Sofocos
También han sido comunicados embarazos fuera del útero (un embarazo ectópico) y embarazos múltiples. Estos efectos adversos no se consideran relacionados con el uso de Elonva, sino con las Técnicas de Reproducción Asistida (TRA) o un embarazo posterior.
En casos raros, se han asociado con la terapia de Elonva, así como con otras gonadotropinas, coágulos de sangre (trombosis), que se forman dentro de un vaso sanguíneo, pudiéndose romper y viajar dentro del torrente sanguíneo para bloquear otro vaso sanguíneo (tromboembolismo).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Elonva
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de “CAD” o “EXP” (fecha de caducidad). La fecha de caducidad es el último día del mes que se indica.
Conservación por el farmacéutico
Conservar en nevera (entre 2°C y 8°C). No congelar.
Conservación por el paciente
Existen dos opciones:
1. Conservar en nevera (entre 2°C y 8°C). No congelar.
2. Conservar a una temperatura igual o inferior a 25°C durante un periodo no superior a un mes. Anote la fecha en la que ha empezado a conservar el medicamento fuera de la nevera, y úselo dentro de un mes a partir de esa fecha.
Conservar la jeringa en el embalaje exterior para protegerlo de la luz.
No use Elonva
- Si se ha conservado fuera de la nevera durante más de un mes.
- Si se ha conservado fuera de la nevera a una temperatura superior a 25°C.
- Si observa que la solución no es transparente.
- Si se da cuenta que la jeringa o la aguja están dañadas.
Las jeringas vacías o sin utilizar no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Elonva
- El principio activo es corifolitropina alfa. Cada jeringa precargada contiene 100 microgramos en 0,5 mililitros (ml) de solución inyectable.
- Los demás componentes son: citrato de sodio, sacarosa, polisorbato 20, metionina y agua para preparaciones inyectables. El pH se puede haber ajustado con hidróxido de sodio y/o ácido clorhídrico.
Aspecto del producto y contenido del envase
Elonva es una solución inyectable (inyectable) acuosa, transparente e incolora en una jeringa precargada con un sistema de seguridad automático, que evita pinchazos con la aguja después de su uso. La jeringa se acondiciona con una aguja para inyección estéril. Cada jeringa contiene 0,5 ml de solución.
La jeringa precargada se presenta en un envase individual.
Elonva está disponible en dos dosis: 100 microgramos y 150 microgramos solución inyectable. Titular de la autorización de comercialización
Merck Sharp & Dohme Limited, Hertford Road, Hoddesdon, Hertfordshire EN11 9BU, Reino Unido.
Responsables de la fabricación
N.V. Organon, Kloosterstraat 6, 5349 AB Oss, Países Bajos.
Organon (Ireland) Ltd., Drynam Road, Swords, Co. Dublín, Irlanda.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Lietuva
UAB Merck Sharp & Dohme Tel: + 370 5 2780247 msd_lietuva@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL Tel/Tél: +32(0)27766211 dpoc_belux@merck.com
Magyarország
MSD Pharma Hungary Kft.
Tel.: + 36 1 888-5300 hungary_msd@merck.com
Malta
Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com
Nederland
Merck Sharp & Dohme BV
Tel: 0800 99 99 000 (+ 31 23 5153153)
Norge
MSD (Norge) AS Tlf: + 47 32 20 73 00 msdnorge@msd.no
Osterreich
Merck Sharp & Dohme Ges.m.b.H.
Tel: +43 (0) 1 26 044 msd-medizin@merck.com
Belgie/Belgique/Belgien
MSD Belgium BVBA/SPRL
Tel/Tél: 0800 38 693 (+32(0)27766211)
Etarapna
MepK fflapn u floyM Etarapua EOOfl Tea.: + 359 2 819 37 37 info-msdbg@merck.com
Ceská republika
Merck Sharp & Dohme s.r.o.
Tel.: +420 233 010 111 dpoc_czechslovak@merck.com
Danmark
MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com
Deutschland
MSD SHARP & DOHME GMBH
Tel: 0800 673 673 673 (+49 (0) 89 4561 2612)
Eesti
Merck Sharp & Dohme OÜ Tel: + 372 6144 200 msdeesti@merck.com
EXXáSa
MSDA.O.B.E.E
Tp^: + 30 210 98 97 300
|
España Merck Sharp & Dohme de España, S.A. Tel: +34 91 321 06 00 msd info@merck.com |
Polska MSD Polska Sp.z o.o. Tel.: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél. + 33 (0) 1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: + 351 214465700 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia info@merck.com |
Romania Merck Sharp & Dohme Romania S.R.L. Tel: + 40 21 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o. Tel: + 386 1 5204201 msd_slovenia@merck.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika Merck Sharp & Dohme, s. r. o. Tel: + 421 (2) 58282010 dpoc_czechslovak@merck.com |
|
Italia MSD Italia S.r.l. Tel: +39 06 361911 medicalinformation.it@merck.com |
Suomi/Finland MSD Finland Oy Puh/Tel: + 358 (0)9 804650 info@msd.fi |
|
Kúnpoq Merck Sharp & Dohme Cyprus Limited Tp^: 800 00 673 +357 22866700 cyprus_info@merck.com |
Sverige Merck Sharp & Dohme (Sweden) AB Tel: + 46 (0)77 5700488 medicinskinfo@merck.com |
|
Latvija SIA Merck Sharp &Dohme Latvija Tel: + 371 67 364224 msd lv@merck.com |
United Kingdom Merck Sharp & Dohme Limited Tel: +44 (0) 1992 467272 medicalinformationuk@merck.com |
Fecha de la última revisión de este prospecto: MM/AAAA Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Instrucciones de uso
Componentes de la jeringa de Elonva y de la aguja
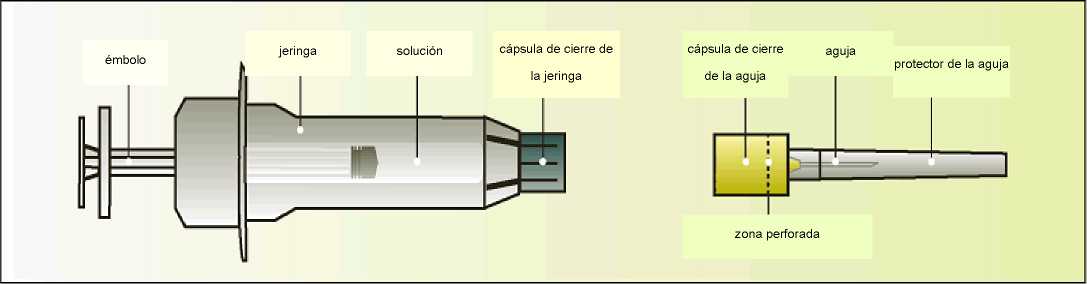
Preparación de la inyección
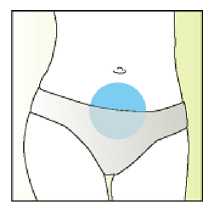
1.
2.
3.
Lávese las manos con agua y jabón y séqueselas antes de usar Elonva.
Limpie el sitio de inyección (la superficie justo debajo del ombligo) con un desinfectante (por ejemplo, alcohol) para eliminar cualquier bacteria de la superficie.
Limpie alrededor de 5 cm alrededor del punto donde introducirá la aguja y deje que el desinfectante se seque durante al menos un minuto antes de continuar.
Mientras espera a que el desinfectante se seque, rompa la zona
perforada y retire la cápsula de cierre de la aguja
Deje el protector de la aguja sobre la aguja
Coloque el protector de la aguja (que contiene la aguja) sobre una
superficie limpia y seca mientras prepara la jeringa.
Coloque la jeringa con la cápsula de cierre gris hacia arriba Dé ligeros golpecitos con el dedo a la jeringa para ayudar a que las burbujas de aire suban a la parte superior.
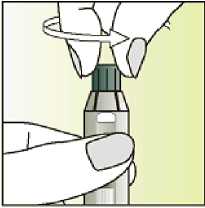
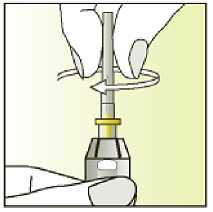
5.
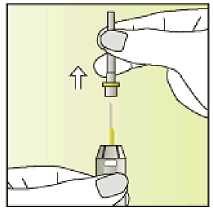
6.
Mantenga la jeringa en posición vertical
Desenrosque la cápsula de cierre de la jeringa en sentido contrario a las agujas del reloj.
Mantenga la jeringa en posición vertical
Enrosque el protector de la aguja (que contiene la aguja) en la
jeringa en el sentido de las agujas del reloj.
Mantenga la jeringa en posición
Retire el protector de la aguja hacia arriba y deséchelo
TENGA CUIDADO con la aguja.
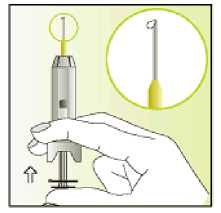
7.
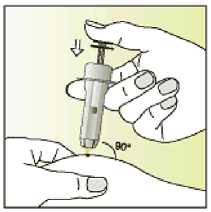
8.
Ahora coja la jeringa entre el dedo índice y el dedo corazón mirando hacia arriba
Coloque el pulgar sobre el émbolo
Empuje ligeramente el émbolo hacia arriba hasta que aparezca una diminuta gota en la punta de la jeringa.
Pellizque un pliegue de la piel con el dedo índice y el pulgar Inserte toda la aguja con un ángulo de 90 grados en el pliegue de la piel
Presione CUIDADOSAMENTE el émbolo hasta que no pueda
avanzar más y mantenga el émbolo abajo
CUENTE HASTA CINCO para asegurar la inyección de toda la
solución.
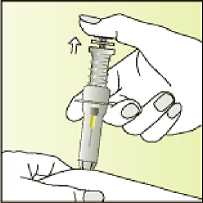
Retire el pulgar del émbolo
La aguja se retirará automáticamente en el interior de la jeringa, dónde quedará encerrada permanentemente.
Prospecto: información para el usuario
Elonva 150 microgramos solución inyectable
corifolitropina alfa
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto
1. Qué es Elonva y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Elonva
3. Cómo usar Elonva
4. Posibles efectos adversos
5. Conservación de Elonva
6. Contenido del envase e información adicional
1. Qué es Elonva y para qué se utiliza
Elonva contiene el principio activo corifolitropina alfa y pertenece al grupo de medicamentos llamado hormonas gonadotróficas. Las hormonas gonadotróficas desempeñan un papel importante en la fertilidad y en la reproducción humana. Una de estas hormonas gonadotróficas es la hormona estimulante del folículo (FSH), que se necesita en las mujeres para el crecimiento y desarrollo de los folículos (pequeños sacos redondos en sus ovarios que contienen los óvulos).
Elonva se usa para ayudar a conseguir el embarazo en mujeres que están siguiendo tratamiento por infertilidad, tales como fecundación in vitro (FIV). La FIV incluye la extracción de óvulos del ovario, fecundación de los óvulos en el laboratorio y la transferencia de los embriones al útero unos días después. Elonva provoca el crecimiento y el desarrollo de varios folículos al mismo tiempo mediante una estimulación controlada de los ovarios.
2. Qué necesita saber antes de empezar a usar Elonva
No use Elonva:
- si es alérgico (hipersensible) a corifolitropina alfa o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- si presenta cáncer de ovario, mama, útero o cerebro (hipófisis o hipotálamo)
- si ha tenido recientemente sangrado vaginal inesperado, que no sea el sangrado menstrual, por causas que no han sido diagnosticadas
- si sus ovarios no funcionan por una enfermedad llamada insuficiencia ovárica primaria
- si tiene quistes ováricos o aumento del tamaño de los ovarios
- si tiene síndrome de ovario poliquístico (SOP)
- si ha tenido síndrome de hiperestimulación ovárica (SHO). El SHO es un problema clínico grave que puede ocurrir cuando los ovarios se sobreestimulan. Se explica con detalle más adelante en este prospecto.
- si ha recibido previamente un ciclo de tratamiento de estimulación de los ovarios controlada con resultado de un crecimiento de más de 30 folículos con un tamaño de 11 mm o mayor.
- si su recuento basal de folículos antrales (número de pequeños folículos presentes en sus ovarios al comienzo del ciclo menstrual) es superior a 20
- si presenta malformaciones de los órganos sexuales que hacen imposible un embarazo normal
- si tiene miomas en el útero que hacen imposible un embarazo normal
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Elonva.
Síndrome de hiperestimulación ovárica (SHO)
El tratamiento con hormonas gonadotróficas como Elonva puede provocar síndrome de hiperestimulación ovárica (SHO). Éste es una afección grave en el que los ovarios se sobreestimulan y los folículos en crecimiento se hacen más grandes de lo normal. En casos raros, el SHO grave puede ser potencialmente mortal. Por lo tanto, es muy importante la supervisión estrecha de su médico. Para comprobar los efectos del tratamiento, su médico le hará ecografías de sus ovarios. Su médico también puede comprobar los niveles de hormonas en sangre. (Ver también la sección 4).
El SHO hace que se acumule líquido de repente en su estómago y en zonas del pecho pudiendo causar la formación de coágulos de sangre. Informe a su médico de inmediato si tiene:
- hinchazón abdominal intensa y dolor en el zona del estómago (abdomen)
- mareos (náuseas)
- vómitos
- aumento repentino de peso debido a la acumulación de líquido
- diarrea
- disminución del volumen de orina
- dificultad para respirar
Solamente debe usar Elonva una vez durante el mismo ciclo de tratamiento, si no la posibilidad de presentar SHO puede aumentar.
Antes de iniciar el tratamiento con este medicamento, informe a su médico si ha tenido alguna vez el síndrome de hiperestimulación ovárica (SHO).
Torsión ovárica
Torsión ovárica es el retorcimiento de un ovario. El retorcimiento del ovario podría provocar que se corte el flujo de sangre al ovario.
Antes de empezar a usar este medicamento, informe a su médico si:
- ha tenido alguna vez el síndrome de hiperestimulación ovárica (SHO).
- está embarazada o cree que podría estarlo.
- le han operado alguna vez la zona del estómago (cirugía abdominal).
- ha tenido alguna vez una torsión de un ovario.
- tiene quistes o ha tenido quistes en su ovario u ovarios.
Coágulos de sangre (Trombosis)
El tratamiento con hormonas gonadotróficas como Elonva puede (como el embarazo) aumentar el riesgo de presentar coágulos de sangre (trombosis). La trombosis es la formación de un coágulo de sangre en un vaso sanguíneo.
Los coágulos de sangre pueden producir enfermedades graves, como:
- obstrucción en sus pulmones (embolia pulmonar)
- ictus
- ataque al corazón
- problemas de los vasos sanguíneos (tromboflebitis)
- falta de flujo de sangre (trombosis venosa profunda), que puede producir la pérdida de su brazo o pierna.
Comente esto con su médico, antes de iniciar el tratamiento, especialmente si:
- ya sabe que tiene un riesgo aumentado de trombosis
- usted o alguno de sus familiares directos ha tenido alguna vez trombosis
- tiene un sobrepeso importante.
Parto múltiple o defectos de nacimiento
Existe un aumento de la posibilidad de tener gemelos o incluso más de dos bebés, incluso cuando se transfiere un solo embrión en el útero. Los embarazos múltiples suponen un aumento del riesgo para la salud tanto de la madre como de sus bebés. Los embarazos múltiples y las características específicas de las parejas con problemas de fertilidad (por ejemplo, la edad de la mujer, ciertos problemas del semen, antecedentes genéticos de ambos padres) pueden estar asociados con un aumento de la probabilidad de defectos de nacimiento.
Complicaciones en el embarazo
Si el tratamiento con Elonva tiene como resultado el embarazo, existe una mayor probabilidad de embarazo fuera del útero (un embarazo ectópico). Por lo tanto, su médico debe hacerle una ecografía al principio para excluir la posibilidad de embarazo fuera del útero.
Tumores de ovario y otros tumores del sistema reproductor
Se han comunicado casos de tumores de ovario y otros tumores del sistema reproductor en mujeres que han seguido un tratamiento de infertilidad. No se sabe si el tratamiento con medicamentos para la fertilidad aumenta el riesgo de estos tumores en mujeres infértiles.
Otras enfermedades
Además, antes de empezar a usar este medicamento, informe a su médico si:
- tiene una enfermedad de los riñones.
- no tiene controlada la glándula pituitaria o tiene problemas hipotálamicos.
- tiene poco activa la glándula tiroides (hipotiroidismo).
- las glándulas suprarrenales no le funcionan adecuadamente (insuficiencia suprarrenal).
- tiene niveles altos de prolactina en la sangre (hiperprolactinemia).
- tiene cualquier otra enfermedad (por ejemplo, diabetes, enfermedad del corazón, o cualquier otra enfermedad de larga duración).
- su médico le ha informado que el embarazo sería peligroso para usted.
Uso de Elonva con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
No debe utilizar Elonva si ya está embarazada, o cree que podría estar embarazada o si está en periodo de lactancia.
Consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
Elonva puede causar mareo. Si se encuentra mareado no debe conducir o usar máquinas.
Elonva contiene sodio
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por inyectable, por lo que se considera esencialmente “exento de sodio”.
3. Cómo usar Elonva
Siga exactamente las instrucciones de administración de Elonva indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Elonva se usa en mujeres que están siguiendo un tratamiento para la infertilidad como la fecundación in vitro (FIV). Durante este tratamiento, Elonva se usa en combinación con un medicamento (llamado antagonista de la GnRH) para evitar que su ovario libere un óvulo demasiado pronto. El tratamiento con el antagonista de la GnRH generalmente se inicia de 5 a 6 días después de la inyección de Elonva.
No es recomendable el uso de Elonva en combinación con un agonista de la GnRH (otro medicamento para evitar que su ovario libere un óvulo demasiado pronto).
Dosis
En el tratamiento de mujeres en edad fértil, la dosis de Elonva depende del peso y de la edad.
- Se recomienda una dosis única de 100 microgramos en mujeres cuyo peso sea menor o igual a 60 kilogramos y cuya edad sea de hasta 36 años inclusive.
- Se recomienda una dosis única de 150 microgramos en mujeres:
- cuyo peso sea mayor de 60 kilogramos, con independencia de cual sea su edad.
- a partir de 50 kilogramos de peso y mayores de 36 años de edad.
No se han realizado estudios en mujeres mayores de 36 años de edad cuyo peso sea inferior a 50 kilogramos.
|
Peso corporal | ||||
|
Menos de 50 kg |
50 - 60 kg |
Más de 60 kg | ||
|
Edad |
Hasta 36 años inclusive |
100 microgramos |
100 microgramos |
150 microgramos |
|
Mayores de 36 años |
No se ha estudiado. |
150 microgramos |
150 microgramos | |
Durante los primeros siete días después de la inyección de Elonva, no debe usar Hormona Estimulante del Folículo (recombinante) (FSH(rec)). Siete días después de la inyección de Elonva, su médico puede decidir continuar el ciclo de estimulación con otra hormona gonadotrófica, como la FSH(rec). Éste se puede continuar durante unos días hasta que haya suficientes folículos de un tamaño adecuado. Esto lo puede comprobar mediante una ecografía. Entonces se interrumpe el tratamiento con FSH(rec) y los óvulos maduran mediante la administración de hCG (Gonadotropina Coriónica humana). Los óvulos se extraen del ovario 34-36 horas después.
Cómo se administra Elonva
El tratamiento con Elonva debe ser supervisado por un médico con experiencia en el tratamiento de problemas de fertilidad. Elonva debe inyectarse debajo de la piel (por vía subcutánea) en un pliegue de la piel (pellizcándose con su pulgar y el dedo índice), preferiblemente justo debajo del ombligo. Le puede administrar la inyección un profesional sanitario (por ejemplo una enfermera), su pareja o usted misma, siempre que su médico le haya enseñado cuidadosamente. Use siempre Elonva tal y como su médico le haya indicado. Debe consultar con su médico o farmacéutico si no está segura. Al final de este prospecto figuran unas “instrucciones de uso” paso a paso.
No inyecte Elonva en el músculo.
Elonva se presenta en jeringas precargadas que tienen un sistema de seguridad automático que ayuda a evitar pinchazos con la aguja después de su uso.
Si usa más Elonva o FSH(rec) del que debe
Si cree que ha usado más Elonva o FSH(rec) del que debe, informe a su médico inmediatamente.
Si olvidó usar Elonva
Si olvidó inyectarse Elonva el día que debería, informe a su médico inmediatamente. No inyecte Elonva sin consultar con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Una posible complicación del tratamiento con hormonas gonadotróficas como Elonva es la sobreestimulación no deseada de los ovarios. La posibilidad de sufrir esta complicación se puede reducir mediante un control minucioso del número de folículos maduros. Su médico le hará ecografías de sus ovarios para controlar minuciosamente el número de folículos maduros. Su médico también puede verificar los niveles de hormonas en sangre. Los primeros síntomas de sobreestimulación ovárica se pueden notar como un dolor en el estómago (abdomen), mareos o diarrea. La sobreestimulación ovárica puede desencadenar una afección llamada síndrome de hiperestimulación ovárica (SHO), que puede ser un problema clínico grave. En casos más graves puede provocar aumento del tamaño de los ovarios, acumulación de líquido en el abdomen y/o pecho (que puede causar aumento repentino de peso debido a la acumulación de líquido) o coágulos en los vasos sanguíneos.
Informe a su médico inmediatamente si presenta dolor en el estómago (abdomen) o cualquier otro síntoma de hiperestimulación ovárica, incluso si se producen algunos días después de la administración de la inyección.
La posibilidad de padecer un efecto adverso se clasifica en las siguientes categorías:
Frecuentes (pueden afectar hasta 1 de cada 10 mujeres)
- Síndrome de hiperestimulación ovárica (SHO)
- Dolor en la pelvis
- Mareos (náuseas)
- Dolor de cabeza
- Molestias en la pelvis
- Sensibilidad en las mamas
- Cansancio (fatiga)
Poco frecuentes (pueden afectar hasta 1 de cada 100 mujeres)
- Retorcimiento de un ovario (torsión ovárica)
- Aumento de las enzimas del hígado
- Aborto involuntario
- Dolor después de la recuperación de los ovocitos
- Dolor asociado a procedimiento terapéutico
- Liberación del óvulo demasiado pronto (ovulación prematura)
- Distensión del abdomen
- Vómitos
- Diarrea
- Estreñimiento
- Dolor de espalda
- Dolor en las mamas
- Moretones o dolor en la zona de la inyección
- Irritabilidad
- Cambios de humor
- Mareos
- Sofocos
También han sido comunicados embarazos fuera del útero (un embarazo ectópico) y embarazos múltiples. Estos efectos adversos no se consideran relacionados con el uso de Elonva, sino con las Técnicas de Reproducción Asistida (TRA) o un embarazo posterior.
En casos raros, se han asociado con la terapia de Elonva, así como con otras gonadotropinas, coágulos de sangre (trombosis), que se forman dentro de un vaso sanguíneo, pudiéndose romper y viajar dentro del torrente sanguíneo para bloquear otro vaso sanguíneo (tromboembolismo).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Elonva
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de “CAD” o “EXP” (fecha de caducidad). La fecha de caducidad es el último día del mes que se indica.
Conservación por el farmacéutico
Conservar en nevera (entre 2°C y 8°C). No congelar.
Conservación por el paciente
Existen dos opciones:
1. Conservar en nevera (entre 2°C y 8°C). No congelar.
2. Conservar a una temperatura igual o inferior a 25°C durante un periodo no superior a un mes. Anote la fecha en la que ha empezado a conservar el medicamento fuera de la nevera, y úselo dentro de un mes a partir de esa fecha.
Conservar la jeringa en el embalaje exterior para protegerlo de la luz.
No use Elonva
- Si se ha conservado fuera de la nevera durante más de un mes.
- Si se ha conservado fuera de la nevera a una temperatura superior a 25°C.
- Si observa que la solución no es transparente.
- Si se da cuenta que la jeringa o la aguja están dañadas.
Las jeringas vacías o sin utilizar no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Elonva
- El principio activo es corifolitropina alfa. Cada jeringa precargada contiene 150 microgramos en 0,5 mililitros (ml) de solución inyectable.
- Los demás componentes son: citrato de sodio, sacarosa, polisorbato 20, metionina y agua para preparaciones inyectables. El pH se puede haber ajustado con hidróxido de sodio y/o ácido clorhídrico.
Aspecto del producto y contenido del envase
Elonva es una solución inyectable (inyectable) acuosa, transparente e incolora en una jeringa precargada con un sistema de seguridad automático, que evita pinchazos con la aguja después de su uso. La jeringa se acondiciona con una aguja para inyección estéril. Cada jeringa contiene 0,5 ml de solución.
La jeringa precargada se presenta en un envase individual.
Elonva está disponible en dos dosis: 100 microgramos y 150 microgramos solución inyectable. Titular de la autorización de comercialización
Merck Sharp & Dohme Limited, Hertford Road, Hoddesdon, Hertfordshire EN11 9BU, Reino Unido.
Responsables de la fabricación
N.V. Organon, Kloosterstraat 6, 5349 AB Oss, Países Bajos.
Organon (Ireland) Ltd., Drynam Road, Swords, Co. Dublín, Irlanda.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Lietuva
UAB Merck Sharp & Dohme Tel: + 370 5 2780247 msd_lietuva@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL Tel/Tél: +32(0)27766211 dpoc_belux@merck.com
Magyarország
MSD Pharma Hungary Kft.
Tel.: + 36 1 888-5300 hungary_msd@merck.com
Malta
Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com
Nederland
Merck Sharp & Dohme BV
Tel: 0800 99 99 000 (+ 31 23 5153153)
Norge
MSD (Norge) AS Tlf: + 47 32 20 73 00 msdnorge@msd.no
Osterreich
Merck Sharp & Dohme Ges.m.b.H.
Tel: +43 (0) 1 26 044 msd-medizin@merck.com
Belgie/Belgique/Belgien
MSD Belgium BVBA/SPRL
Tel/Tél: 0800 38 693 (+32(0)27766211)
Etarapna
MepK fflapn u floyM Etarapua EOOfl Tea.: + 359 2 819 37 37 info-msdbg@merck.com
Ceská republika
Merck Sharp & Dohme s.r.o.
Tel.: +420 233 010 111 dpoc_czechslovak@merck.com
Danmark
MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com
Deutschland
MSD SHARP & DOHME GMBH
Tel: 0800 673 673 673 (+49 (0) 89 4561 2612)
Eesti
Merck Sharp & Dohme OÜ Tel: + 372 6144 200 msdeesti@merck.com
EXXáSa
MSDA.O.B.E.E
Tp^: + 30 210 98 97 300
|
España Merck Sharp & Dohme de España, S.A. Tel: +34 91 321 06 00 msd info@merck.com |
Polska MSD Polska Sp.z o.o. Tel.: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél. + 33 (0) 1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: + 351 214465700 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia info@merck.com |
Romania Merck Sharp & Dohme Romania S.R.L. Tel: + 40 21 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o. Tel: + 386 1 5204201 msd_slovenia@merck.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika Merck Sharp & Dohme, s. r. o. Tel: + 421 (2) 58282010 dpoc_czechslovak@merck.com |
|
Italia MSD Italia S.r.l. Tel: +39 06 361911 medicalinformation.it@merck.com |
Suomi/Finland MSD Finland Oy Puh/Tel: + 358 (0)9 804650 info@msd.fi |
|
Kúnpoq Merck Sharp & Dohme Cyprus Limited Tp^: 800 00 673 +357 22866700 cyprus_info@merck.com |
Sverige Merck Sharp & Dohme (Sweden) AB Tel: + 46 (0)77 5700488 medicinskinfo@merck.com |
|
Latvija SIA Merck Sharp &Dohme Latvija Tel: + 371 67 364224 msd lv@merck.com |
United Kingdom Merck Sharp & Dohme Limited Tel: +44 (0) 1992 467272 medicalinformationuk@merck.com |
Fecha de la última revisión de este prospecto: MM/AAAA Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Instrucciones de uso
Componentes de la jeringa de Elonva y de la aguja
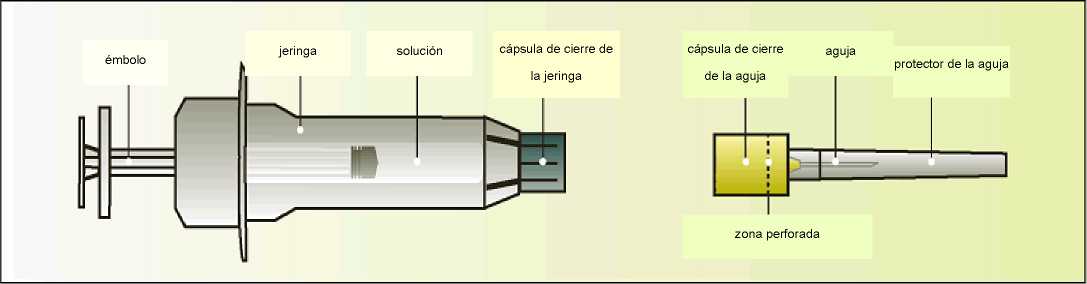
Preparación de la inyección
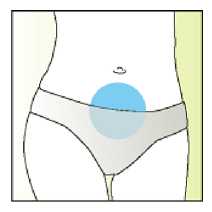
1.
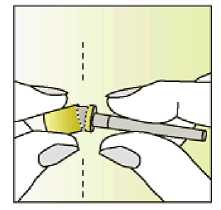
2.
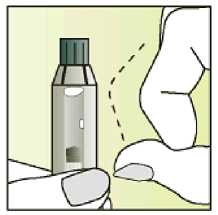
3.
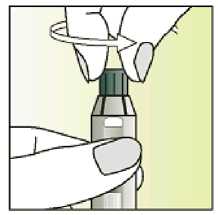
4.
Lávese las manos con agua y jabón y séqueselas antes de usar Elonva.
Limpie el sitio de inyección (la superficie justo debajo del ombligo) con un desinfectante (por ejemplo, alcohol) para eliminar cualquier bacteria de la superficie.
Limpie alrededor de 5 cm alrededor del punto donde introducirá la aguja y deje que el desinfectante se seque durante al menos un minuto antes de continuar.
Mientras espera a que el desinfectante se seque, rompa la zona
perforada y retire la cápsula de cierre de la aguja
Deje el protector de la aguja sobre la aguja
Coloque el protector de la aguja (que contiene la aguja) sobre una
superficie limpia y seca mientras prepara la jeringa.
Coloque la jeringa con la cápsula de cierre gris hacia arriba Dé ligeros golpecitos con el dedo a la jeringa para ayudar a que las burbujas de aire suban a la parte superior.
Mantenga la jeringa en posición vertical
Desenrosque la cápsula de cierre de la jeringa en sentido contrario a las agujas del reloj.
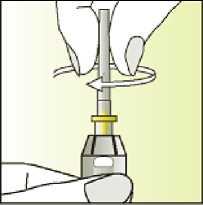
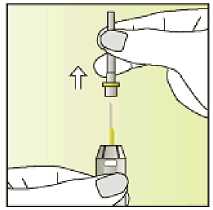
6.
Mantenga la jeringa en posición vertical
Enrosque el protector de la aguja (que contiene la aguja) en la
jeringa en el sentido de las agujas del reloj.
Mantenga la jeringa en posición
Retire el protector de la aguja hacia arriba y deséchelo
TENGA CUIDADO con la aguja.
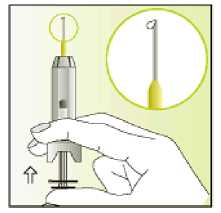
7.
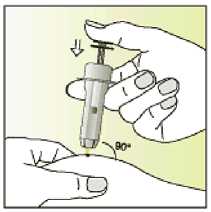
8.
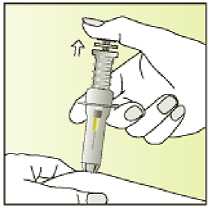
9.
Ahora coja la jeringa entre el dedo índice y el dedo corazón mirando hacia arriba
Coloque el pulgar sobre el émbolo
Empuje ligeramente el émbolo hacia arriba hasta que aparezca una diminuta gota en la punta de la jeringa.
Pellizque un pliegue de la piel con el dedo índice y el pulgar Inserte toda la aguja con un ángulo de 90 grados en el pliegue de la piel
Presione CUIDADOSAMENTE el émbolo hasta que no pueda
avanzar más y mantenga el émbolo abajo
CUENTE HASTA CINCO para asegurar la inyección de toda la
solución.
Retire el pulgar del émbolo
La aguja se retirará automáticamente en el interior de la jeringa, dónde quedará encerrada permanentemente.
60
Intervalo previsto para el 90 % de sujetos.
Intervalo previsto para el 90 % de sujetos.