Ekzem 250 Microgramos/Ml Gotas Oticas En Solucion En Envases Unidosis
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Ekzem 250 microgramos/ml gotas óticas en solución en envases unidosis.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 250 microgramos de Fluocinolona Acetónido.
Cada ampolla con 0,40 ml de solución contiene 100 microgramos de Fluocinolona Acetónido.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Gotas óticas en solución.
Solución acuosa transparente.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Ekzem contiene un corticoide de potencia baja media indicado para el tratamiento del eccema ótico en adultos con la membrana timpánica intacta.
4.2 Posología y forma de administración
Vía ótica.
Posología
Aplicar el contenido de una ampolla dentro del oído afectado, dos veces al día durante siete días.
Población pediátrica
No se ha estudiado el uso de Fluocinolona Acetónido en niños y adolescentes. No se recomienda utilizar este medicamento en estos subgrupos de población.
Forma de administración
El paciente debe inclinar la cabeza hacia un lado de forma que el oído afectado quede hacia arriba, y después se debe aplicar todo el contenido de la ampolla. Tirar del lóbulo de la oreja cuatro veces para facilitar la penetración del medicamento dentro del canal auditivo. Mantener esta posición durante un minuto. Repetir la operación, en caso necesario, en el otro oído.
Es recomendable calentar el frasco antes de su utilización manteniéndolo en la palma de la mano durante algunos minutos. Esto evitará la sensación de incomodidad cuando la solución fría entre en contacto con el oído.
4.3 Contraindicaciones
Hipersensibilidad al principio activo Fluocinolona Acetónido, a otros corticoides o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Ekzem es solo para uso ótico. No se debe utilizar por vía oftálmica ni para inyección o inhalación.
El tratamiento con Ekzem debe interrumpirse si aparece una erupción cutánea o cualquier otro signo de hipersensibilidad local o sistémica.
En presencia de infecciones óticas concomitantes, se debe usar un agente antimicótico o antibacteriano apropiado. Si no se produce una respuesta favorable rápidamente, se debe suspender el tratamiento con Fluocinolona Acetónido hasta que la infección se controle adecuadamente.
Este medicamento debe usarse en la menor dosis posible y solo durante el tiempo estrictamente necesario para conseguir y mantener el efecto terapéutico deseado.
Los glucocorticoides no deben utilizarse para el tratamiento del eccema ótico húmedo.
General
En algunos pacientes sometidos a tratamiento tópico con corticosteroides se ha notificado supresión del eje hipotálamo-hipofisario-adrenal (HHA) con dosis superiores a 2 gramos (aproximadamente 1.000 veces la dosis máxima de Ekzem). Sin embargo, no se ha descrito supresión del eje HHA después de la administración por vía ótica de corticoides. Teniendo en cuenta la baja dosis total de principio activo administrada tras el tratamiento con Ekzem, es improbable que la absorción sistémica de Fluocinolona Acetónido pueda causar cambios significativos en los niveles de cortisol.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Los corticosteroides han demostrado ser teratogénicos en animales de laboratorio cuando se administran por vía sistémica en dosis relativamente bajas. Los corticosteroides más potentes han demostrado ser teratogénicos tras una aplicación dérmica en animales de laboratorio.
No hay estudios adecuados y bien controlados en mujeres embarazadas sobre los efectos teratogénicos de los corticosteroides aplicados por vía tópica. Por tanto, los corticosteroides tópicos solo deberían utilizarse durante el embarazo si el beneficio derivado del tratamiento justifica el riesgo potencial para el feto. En pacientes embarazadas, no deberían utilizarse en zonas extensas, en altas concentraciones o durante periodos de tiempo prolongados.
Lactancia
Los corticosteroides administrados sistémicamente se secretan a través de la leche materna y pueden afectar el crecimiento, interferir con la producción endógena de corticosteroides o causar otros efectos adversos.
No se sabe si la administración tópica de corticosteroides puede dar lugar a una absorción sistémica suficiente para producir cantidades detectables en la leche humana.
Debido a que muchos fármacos se secretan en la leche humana, se debe tener precaución cuando se administre Ekzem a una mujer lactante.
Fertilidad
No se han llevado a cabo estudios con animales para evaluar el efecto de la Fluocinolona Acetónido tópica sobre la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Ekzem sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Se han utilizado las siguientes terminologías (según MedDRA) a fin de clasificar la frecuencia de las reacciones adversas: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), desconocida (no puede estimarse a partir de los datos de que se dispone).
Trastornos generales y alteraciones en el lugar de administración
Frecuentes: sensación de ardor, sequedad en el sitio de aplicación, prurito en la zona de administración.
Trastornos de la piel y del tejido subcutáneo:
Frecuentes: prurito, irritación de la piel.
Poco frecuentes: foliculitis, acné, decoloración de la piel, dermatitis, dermatitis de contacto.
Raras: atrofia cutánea, estrías en la piel, eritema por calor.
Trastornos del oído y del laberinto:
Frecuentes: molestia en el oído, trastorno del oído.
Infecciones e infestaciones:
Raras: infección.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es.
4.9 Sobredosis
Los corticoides aplicados por vía tópica pueden absorberse en cantidades suficientes para producir efectos sistémicos (ver sección 4.4).
En caso de ingesta accidental del preparado, deberían llevarse a cabo medidas rutinarias como el lavado gástrico. No hay un antídoto específico para casos de sobredosis con Fluocinolona Acetónido. Los pacientes deben ser tratados sintomáticamente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Preparados óticos. Corticosteroides. Código ATC: S02BA08.
Mecanismo de acción
La Fluocinolona Acetónido es un corticosteroide fluorado sintético con propiedades antiinflamatorias, antipruríticas y vasoconstrictoras. La rápida acción antiinflamatoria de los corticosteroides tópicos incluye la inhibición del movimiento de los macrófagos y los leucocitos y actúan en la zona inflamada revirtiendo la dilatación vascular y la permeabilidad. Los corticosteroides también inhiben procesos inflamatorios más tardíos como la producción capilar, la deposición de colágeno y la formación de queloides (cicatriz).
Ensayo clínico
Se llevó a cabo un ensayo clínico de fase III multicéntrico, aleatorizado, paralelo y doble ciego, con pacientes de 18 años o mayores, de ambos sexos, y diagnosticados de eccema ótico susceptible de tratamiento local.
Se incluyeron pacientes con prurito moderado o severo en la piel del conducto auditivo externo (con o sin afectación del pabellón auditivo) y con imagen otoscópica compatible con descamación de la piel del conducto auditivo. Se excluyeron del estudio aquellos pacientes que presentaban signos de otitis externa eccematosa complicada, otitis externa u otitis media bacteriana o fungica.
Se administraron gotas óticas de 250 microgramos/ml de Fluocinolona Acetónido o placebo dos veces al día (cada 12 horas) durante 7 días. Los pacientes fueron asignados de forma aleatoria a uno de los dos grupos de tratamiento: gotas óticas de 250 microgramos/ml de Fluocinolona Acetónido o placebo (solución idéntica al medicamento experimental pero sin principio activo).
Criterios _para la evaluación de la eficacia Variable principal:
- La eficacia se midió según el cambio del prurito al final del tratamiento (media de prurito en los días 4 a 8 respecto a visita basal).
Variables secundarias:
- Cambio en el prurito al final del seguimiento (media de prurito en los días 9 a 15 respecto a visita basal)
- Cambio en la puntuación combinada de los signos otoscópicos al final del tratamiento: Diferencia entre la media de las puntuaciones de los signos otoscópicos (eritema, edema y descamación) al final del tratamiento (día 8) y en la visita basal (día 1).
- Cambio en la puntuación combinada de los signos otoscópicos al final del seguimiento: Diferencia entre la media de las puntuaciones de los signos otoscópicos (eritema, edema y descamación) al final del seguimiento (día 15) y en la visita basal (día 1).
Resultados de eficacia
Los valores medios basales de prurito fueron casi idénticos en ambos grupos de tratamiento (2,34 en el grupo de placebo y 2,37 en el grupo Fluocinolona Acetónido).
Los resultados del ensayo clínico demostraron la eficacia del tratamiento con Fluocinolona Acetónido 250 microgramos/ml gotas óticas en solución, ya que el análisis estadístico de eficacia basado en la variable principal del estudio (cambio en el prurito al final del tratamiento) mostró una reducción significativamente mayor con Fluocinolona Acetónido que con placebo (p=0.005). Dicha diferencia fue de 0.36 puntos a favor del grupo experimental, utilizando la metodología estándar de la última valoración válida (“Last observation carried forward - LOCF”). La figura muestra los datos de la evolución diaria del prurito medio en ambos grupos de tratamiento.
2,5
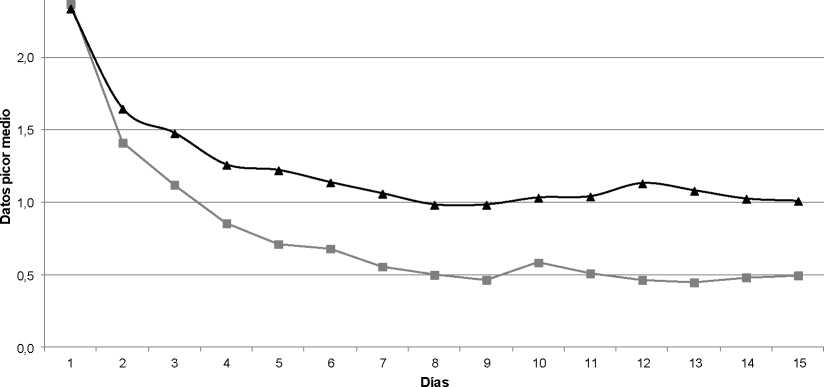
Fluocinolona
Placebo
Los análisis secundarios de eficacia mostraron también resultados significativamente mejores con Fluocinolona Acetónido en comparación con placebo: mejor evolución del prurito al final del seguimiento, y mejor evolución de las puntuaciones individuales y combinadas de signos otoscópicos (eritema, edema y descamación), tanto al final del tratamiento (día 8) como al final del seguimiento (día 15).
5.2 Propiedades farmacocinéticas
Absorción
La absorción de la Fluocinolona Acetónido tras una administración tópica es en general baja, y varía ostensiblemente según el lugar de aplicación. No hay datos sobre la absorción después de la aplicación ótica.
El grado de absorción percutánea de los corticosteroides tópicos está determinado por muchos factores, incluyendo el vehículo, la integridad de la barrera epidérmica y el uso de vendajes oclusivos.
Los corticosteroides tópicos pueden absorberse por la piel intacta normal. La inflamación y/u otros procesos en enfermedades de la piel aumentan la absorción percutánea.
Una vez absorbidos a través de la piel, las propiedades farmacocinéticas serían similares a los corticoides administrados por vía sistémica.
Los corticosteroides se unen a las proteínas plasmáticas en diversos grados. Los corticosteroides se metabolizan principalmente en el hígado y se eliminan por los riñones. Algunos de los corticosteroides tópicos y sus metabolitos también se excretan en la bilis.
5.3 Datos preclínicos sobre seguridad
En relación a la potencial ototoxicidad y a la tolerancia local de Fluocinolona Acetónido, los resultados de los estudios preclínicos tras la administración intratimpánica de la combinación de Fluocinolona Acetónido 0.025% con Ciprofloxacino 0.3% demostraron otoxicidad y toxicidad sistémica bajas. Los ensayos con animales han demostrado que la combinación no es un agente irritante o sensibilizador de la piel.
Fluocinolona Acetónido demostró no ser genotóxica in vitro en el test de Ames ni en el ensayo TK (timidin kinasa) en células de linfoma de ratón así como tampoco in vivo en el ensayo con micronúcleos de médula ósea de ratón.
No se han realizado estudios a largo plazo para evaluar el potencial carcinogénico de Fluocinolona Acetónido.
Se ha demostrado que algunos corticosteroides son teratogénicos después de la aplicación tópica en animales de laboratorio pero no hay estudios de toxicidad en la reproducción ni en el desarrollo adecuadamente controlados con Fluocinolona Acetónido.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polisorbato 80, glicerol, povidona K90F, ácido láctico, hidróxido sódico 1N, agua purificada.
6.2 Incompatibilidades No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
Conservar por debajo de 25°C.
Conservar en el embalaje original para protegerlo de la luz. Desechar 3 meses después de abrir el sobre protector.
Desechar la ampolla después de la administración.
6.5 Naturaleza y contenido del envase
La solución está envasada en una ampolla de polietileno de baja densidad. Cada ampolla contiene 0,40 ml de solución estéril. Las ampollas están en el interior de un sobre protector de aluminio.
Cada sobre protector de aluminio, impreso y sellado por calor, contiene 15 ampollas.
Cada envase contiene 15 ó 30 ampollas. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial para su eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratorios SALVAT, S.A.
Gall, 30-36
08950 Esplugues de Llobregat Barcelona (España)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Julio 2015
Febrero 2015
7 de 7