Duodopa 20 Mg/Ml + 5 Mg/Ml Gel Intestinal
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Duodopa 20 mg/ml + 5 mg/ml gel intestinal.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml contiene 20 mg de levodopa y 5 mg de carbidopa monohidrato.
100 ml contienen 2.000 mg de levodopa y 500 mg de carbidopa monohidrato. Para consultar la lista completa de excipientes, ver sección 6.1
3. FORMA FARMACÉUTICA
Gel intestinal
Gel de color blanquecino a amarillento.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de la enfermedad de Parkinson en estado avanzado con fluctuaciones motoras graves e hiper/discinesia cuando las combinaciones de medicamentos disponibles para el Parkinson no han proporcionado resultados satisfactorios
4.2 Posología y forma de administración
Duodopa es un gel para una administración intestinal continua. Para la administración a largo plazo, el gel debe administrarse con una bomba portátil directamente en el duodeno o yeyuno superior a través de una gastrostomía endoscópica percutánea mediante una sonda transabdominal externa y una sonda intestinal interna. Si la gastrostomía endoscópica percutánea no es adecuada por alguna razón, se puede considerar como alternativa una gastroyeyunostomía radiológica. La realización del puerto transabdominal y los ajustes de la dosis deben llevarse a cabo en combinación con una clínica neurológica.
Se debe considerar la colocación de una sonda nasoduodenal/nasoyeyunal temporal con el fin de valorar si el paciente responde de manera favorable a esta forma de tratamiento antes de la colocación de la sonda yeyunal (PEG-J) mediante gastrostomía endoscópica percutánea permanente. En los casos en los que el médico considere que esta prueba no es necesaria, puede prescindirse de la fase de prueba con sonda nasoyeyunal e iniciar directamente el tratamiento mediante la colocación del PEG-J. Debe realizarse el ajuste de dosis hasta obtener una respuesta clínica óptima para cada paciente, lo que significa aumentar al máximo el tiempo ON (activo) funcional durante el día mediante la minimización del número y de la duración de los episodios OFF (bradicinesia) y la minimización del tiempo ON con discinesia discapacitante. Ver las recomendaciones en Dosis.
Duodopa debe administrarse inicialmente como monoterapia. Si es preciso, se puede tomar a la vez otra medicación para el Parkinson. Para la administración de Duodopa, sólo debe utilizarse la bomba CADD-Legacy 1400 (CE 0473). Junto con la bomba portátil se facilita un Manual con las instrucciones de uso.
El tratamiento con Duodopa puede interrumpirse en cualquier momento retirando la sonda y dejando que la herida se cure. Luego se debe continuar el tratamiento con medicamentos orales que incluyen
levodopa/carbidopa.
Dosis:
La dosis total diaria de Duodopa se compone de tres dosis ajustadas individualmente: dosis matinal, dosis de mantenimiento y dosis adicionales en bolo, administradas a lo largo de aproximadamente16 horas.
Los cartuchos con el medicamento son para un solo uso y no deberán usarse durante más de 16 horas, aunque quedara algún resto de medicamento. Los cartuchos abiertos no se deben volver a utilizar.
En proximidad de la fecha de caducidad, el gel puede volverse ligeramente amarillo. Este cambio no afecta a la concentración del fármaco o al tratamiento.
Dosis matinal. La dosis matinal en bolo se administra mediante la bomba para conseguir rápidamente un nivel terapéutico (en 10-30 minutos). La dosis deberá basarse en la dosis de levodopa que el paciente tomaba por vía oral en la mañana más la cantidad necesaria para rellenar el volumen de la sonda. La dosis matinal total suele ser de 5-10 ml, correspondientes a 100-200 mg de levodopa. La dosis total matinal no deberá superar los 15 ml (300 mg de levodopa).
Dosis de mantenimiento.
La dosis de mantenimiento es ajustable a razón de 2 mg/hora (0,1 ml/hora). La dosis debe ser calculada según la dosis de levodopa que el paciente tomaba por vía oral. Si se interrumpe la administración de medicamentos complementarios, la dosis de Duodopa deberá ajustarse nuevamente. La dosis de mantenimiento se ajusta individualmente. Debería mantenerse en un intervalo de 1-10 ml/hora (20-200 mg levodopa/hora) y suele ser de 2-6 ml/hora (40-120 mg levodopa/hora). En casos excepcionales, puede ser necesaria una dosis más elevada.
Ejemplo:
La administración diaria de levodopa como Duodopa: 1.640 mg/día.
Dosis en bolo matinal: 140 mg = 7 ml (excluido el volumen para llenar la sonda intestinal).
Dosis de mantenimiento: 1.500 mg/día.
1500 mg/día: 20 mg/ml = 75 ml de Duodopa al día.
La administración se calcula en 16 horas: 75 ml/16 horas = 4,7 ml/hora.
Dosis adicional en bolo.
Debe administrarse según si el paciente se encuentra hipocinético durante el día. La dosis adicional debe ajustarse de forma individualizada, y normalmente es de 0,5 hasta 2 ml.
En raras ocasiones, puede ser necesaria una dosis más elevada.
Si la necesidad de dosis adicionales excede de 5 veces al día, la dosis de mantenimiento deberá aumentarse. Tras establecer las dosis, durante varias semanas deben realizarse ajustes finos de la dosis matinal, la dosis de mantenimiento y las dosis adicionales en bolo.
Si está médicamente justificado, Duodopa puede administrarse durante la noche.
Monitorización del tratamiento.
Un deterioro súbito en la eficacia del tratamiento con fluctuaciones motoras recurrentes debe conducir a la sospecha de que la sonda se ha movido del duodeno/yeyuno al estómago. La ubicación de la sonda debe determinarse mediante rayos X y el extremo de la sonda deberá volver a colocarse en el duodeno/yeyuno.
Poblaciones especiales Población pediátrica
Duodopa no presenta ningún uso relevante respecto de población pediátrica para la indicación de la enfermedad de Parkinson avanzada sensible a levodopa con graves fluctuaciones motoras e hiper/discinesia.
Población geriátrica
Hay una considerable experiencia en el uso de levodopa/carbidopa en pacientes ancianos. Las dosis para todos los pacientes, incluida la población geriátrica, se ajustan individualmente mediante ajuste de dosis.
Insuficiencia renal/hepática
No se han realizado estudios sobre la farmacocinética de carbidopa y levodopa en pacientes con insuficiencia hepática o renal. La dosis con Duodopa se individualiza mediante ajuste de dosis para lograr el efecto óptimo (que corresponde con unas exposiciones plasmáticas a levodopa y carbidopa optimizadas individualmente); por lo tanto, los efectos potenciales de la insuficiencia hepática o renal con exposición a levodopa y carbidopa se tienen indirectamente en cuenta en el ajuste de la dosis. El ajuste de la dosis debe llevarse a cabo con precaución en pacientes con insuficiencia renal y hepática graves (ver sección 4.4).
Interrupción del tratamiento
En caso de que se requiera una reducción súbita de la dosis o si llega a ser necesario suspender el tratamiento con Duodopa, los pacientes deberán ser observados cuidadosamente, y en especial si los pacientes están recibiendo antipsicóticos. Ver sección 4.4.
En aquellos casos de sospecha o diagnóstico de demencia con disminución del umbral de confusión o si es necesario retirar la bomba, esta deberá ser manejada sólo por el personal de enfermería o un cuidador.
De acuerdo con el Manual de instrucciones, a punto de ser utilizado un cartucho deberá estar conectado a la bomba portátil. El sistema así constituido deberá entonces conectarse a la sonda nasoduodenal o a la sonda duodenal/yeyunal para la administración
4.3 Contraindicaciones
Duodopa está contraindicado en pacientes con:
• Hipersensibilidad a levodopa, carbidopa o a cualquiera de los excipientes enumerados en la sección 6.1.
• Glaucoma de ángulo estrecho
• Insuficiencia cardíaca grave
• Arritmia cardíaca grave
• Accidente cerebrovascular agudo
• Los inhibidores no selectivos de la MAO y los inhibidores selectivos tipo A de la MAO no deben administrarse junto con Duodopa. Estos inhibidores deberán retirarse al menos dos semanas antes del inicio del tratamiento con Duodopa. Duodopa podrá administrase simultáneamente a la dosis recomendada del fabricante de cualquier inhibidor de la MAO con selectividad por la MAO tipo B (como, por ejemplo, la selegilina HCl) (ver sección 4.5).
• Aquellas situaciones en las que los adrenérgicos están contraindicados, por ejemplo, feocromocitoma, hipertiroidismo y síndrome de Cushing.
Dado que levodopa puede activar un melanoma maligno, no deberá emplearse en pacientes con lesiones cutáneas sospechosas no diagnosticadas ni historial de melanoma
4.4 Advertencias y precauciones especiales de empleo
Varias advertencias y precauciones mencionadas a continuación son genéricas para la levodopa y, por
tanto, también para Duodopa:
• No se recomienda Duodopa para el tratamiento de las reacciones extrapiramidales inducidas por fármacos.
• El tratamiento con Duodopa debe administrarse con cuidado en pacientes con enfermedades cardiovasculares o pulmonares graves, asma bronquial, enfermedades renales, hepáticas o endocrinológicas o antecedentes de enfermedad ulcerosa o de convulsiones.
• En pacientes con antecedentes de infarto de miocardio que tienen arritmias nodales o ventriculares residuales, debe monitorizarse la función cardiaca con especial cuidado durante el período de ajustes iniciales de la dosis.
• Todos los pacientes tratados con Duodopa deben observarse en busca de cambios mentales, depresión con tendencias suicidas y otros cambios mentales graves. Los pacientes con psicosis previa o actual deben tratarse con precaución.
• La administración concomitante de antipsicóticos con propiedades bloqueantes del receptor de la dopamina, especialmente los antagonistas del receptor D2 deberá realizarse con cuidado y el paciente deberá ser observado con atención con respecto a la pérdida del efecto antiparkinsoniano o el empeoramiento de los síntomas parkinsonianos, ver sección 4.5.
• Los pacientes con glaucoma crónico simple (glaucoma de ángulo abierto) pueden ser tratados con Duodopa con precaución y siempre que la presión intraocular esté bien controlada y se pueda medir durante el tratamiento.
• Duodopa puede inducir hipotensión ortostática. Por lo tanto, Duodopa debe administrarse con precaución en pacientes que están tomando otros medicamentos que pueden producir hipotensión ortostática, ver sección 4.5.
• La Levodopa ha sido asociada a somnolencia y episodios de sueño súbito en pacientes con enfermedad de Parkinson y, por tanto, debe tenerse precaución cuando se conduce y se manejan máquinas (ver sección 4.7).
• Se ha comunicado un conjunto de síntomas parecido al síndrome neuroléptico maligno (SNM), incluida rigidez muscular, aumento de la temperatura corporal, cambios mentales (p. ej., agitación, confusión, coma) y aumento de la creatina fosfoquinasa sérica cuando se han retirado bruscamente medicamentos antiparkinsonianos. En raras ocasiones en pacientes con enfermedad de Parkinson se han observado rabdomiólisis secundaria al síndrome neuroléptico maligno o discinesias graves. Por lo tanto, será necesario observar con atención a los pacientes cuando se reduzca o suspenda bruscamente la dosis de combinaciones de levodopa/carbidopa, y especialmente si el paciente está recibiendo antipsicóticos. No se han comunicado ni SNM ni rabdomiólisis asociadas al tratamiento con Duodopa.
• Los pacientes deben ser monitorizados regularmente durante el desarrollo de trastornos de control de impulsos. Los pacientes y cuidadores deben ser conscientes de que los síntomas conductuales de trastornos del control de impulsos incluyen patología del juego, aumento de la libido e hipersexualidad, gasto y compra compulsiva, comer en exceso y compulsivamente puede ocurrir en pacientes tratados con agonistas de la dopamina y / u otros tratamientos dopaminérgicos que contienen levodopa incluyendo Duodopa. Se recomienda revisión del tratamiento si se producen tales síntomas.
• Estudios epidemiológicos han demostrado que los pacientes con enfermedad de Parkinson presentan mayor riesgo de desarrollar melanoma que la población en general. No está claro si el aumento del riesgo observado se debe a la enfermedad de Parkinson o a otros factores, tales como los medicamentos empleados para tratar la enfermedad de Parkinson. Por lo tanto, se recomienda a pacientes y cuidadores vigilar habitualmente la presencia de melanomas mientras estén usando Duodopa para cualquier indicación. Lo ideal sería que las exploraciones periódicas de la piel las realizaran personas debidamente cualificadas (por ejemplo, dermatólogos).
• Si se necesita anestesia general, el tratamiento con Duodopa puede continuarse siempre que al paciente se le permita tomar líquidos y medicamentos por vía oral. Si el tratamiento debe suspenderse temporalmente, Duodopa puede reiniciarse a la misma dosis que antes en cuanto se
permita la ingesta oral.
• Puede ser necesario reducir la dosis de Duodopa para evitar las discinesias inducidas por levodopa.
• Se recomienda controlar periódicamente las funciones hepática, hematopoyética, cardiovascular y renal durante el tratamiento a largo plazo con Duodopa.
• Duodopa contiene hidrazina, un producto de degradación de carbidopa que puede ser genotóxico y posiblemente carcinogénico. La dosis diaria media recomendada de Duodopa son 100 ml, que contienen 2 g de levodopa y 0,5 g de carbidopa. La dosis diaria máxima recomendada son 200 ml. Esto incluye hidrazina hasta una exposición media de 4 mg/día, con un máximo de 8 mg/día. La significancia clínica de esta exposición a la hidrazina es desconocida.
• Antecedentes de cirugía en la parte superior del abdomen pueden dificultar la realización de la gastrostomía/yeyunostomía.
• Las complicaciones encontradas en ensayos clínicos y post comercialización, incluyen bezoar, íleo, erosión/úlcera en lugar de implantación, hemorragia intestinal, isquemia intestinal, obstrucción intestinal, perforación intestinal, invaginación intestinal, pancreatitis, peritonitis, neumoperitoneo e infección postoperatoria de heridas. Los bezoares son concreciones retenidas de material indigerible en el tracto intestinal (como fibra no digerible de verduras o frutas). La mayoría de bezoares reside en el estómago, si bien estos pueden encontrarse en cualquier parte del tracto intestinal. Un bezoar alrededor de la punta de la sonda yeyunal, podría ocasionar la obstrucción intestinal o la formación de una invaginación intestinal. El dolor abdominal puede ser un síntoma de las complicaciones mencionadas anteriormente. Algunos acontecimientos pueden derivar en consecuencias graves, como la cirugía y/o la muerte. Se advierte a los pacientes de que deberán informar a su médico si experimentan cualquiera de los síntomas asociados con los acontecimientos anteriores.
• Una capacidad reducida del paciente para manejar el sistema (bomba, conexiones de la sonda) puede llevar a complicaciones. En tales pacientes, un cuidador (p. ej., enfermera, ayudante de la enfermera o un familiar cercano) debe ayudar al paciente.
• Un empeoramiento súbito o gradual de la bradicinesia puede indicar una obstrucción en el dispositivo por la razón que sea y debe explorarse.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción con Duodopa. Las interacciones siguientes son conocidas por la combinación genérica de levodopa/carbidopa.
Hay que tener cuidado en la administración simultánea de Duodopa con los siguientes medicamentos: Antihipertensivos
Se ha producido hipotensión postural cuando se han añadido combinaciones de levodopa y un inhibidor de la descarboxilasa al tratamiento de pacientes que ya estaban recibiendo antihipertensivos. Puede ser necesario un ajuste de la dosis del antihipertensivo.
Antidepresivos
En raras ocasiones se han comunicado reacciones adversas, incluidas la hipertensión y la discinesia, producidas por la administración simultánea de antidepresivos tricíclicos y preparados con carbidopa/levodopa.
Anticolinérgicos
Los anticolinérgicos pueden actuar sinérgicamente con la levodopa para disminuir el temblor. Sin embargo, el uso combinado puede exacerbar los movimientos involuntarios anormales. Los anticolinérgicos pueden disminuir los efectos de la levodopa retrasando su absorción.
Inhibidores de la COMT (tolcapona, entacapona)
El uso simultáneo de inhibidores de la COMT (catecol-O-metil transferasa) y Duodopa puede aumentar la biodisponibilidad de la levodopa. La dosis de Duodopa puede precisar ajuste.
Otros medicamentos
Los antagonistas del receptor de la dopamina (algunos antipsicóticos, p. ej., fenotiacinas, butirofenonas y risperidona y antieméticos, p. ej., metoclopramida), benzodiacepinas, isoniazida, fenitoína y papaverina pueden reducir el efecto terapéutico de la levodopa. Los pacientes que toman estos medicamentos junto con Duodopa deben ser observados cuidadosamente con respecto a la pérdida de respuesta terapéutica.
Duodopa puede tomarse simultáneamente con la dosis recomendada de un inhibidor de la MAO, que sea selectivo para la MAO tipo B (por ejemplo, selegilina-HCl). Puede ser necesario reducir la dosis de levodopa cuando se añade un inhibidor selectivo para la MAO tipo B.
El uso simultáneo de selegilina y levodopa-carbidopa se ha asociado a hipotensión ortostática grave.
La amantadina tiene un efecto sinérgico con la levodopa y puede aumentar los acontecimientos adversos relacionados con la levodopa. Puede ser necesario el ajuste de la dosis de Duodopa.
Los simpaticomiméticos pueden aumentar los acontecimientos adversos cardiovasculares relacionados con la levodopa.
La levodopa forma un quelato con el hierro en el tubo digestivo que conduce a menor absorción de la levodopa.
Debido a que la levodopa compite con determinados aminoácidos para su absorción, ésta puede verse alterada en pacientes con dieta rica en proteínas.
No se ha estudiado el efecto de la administración de antiácidos y Duodopa sobre la biodisponibilidad de la levodopa.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
No se dispone de datos o la cantidad de datos sobre el uso de levodopa/carbidopa en mujeres embarazadas es limitada. Estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). No está recomendado el uso de Duodopa durante el embarazo ni en mujeres en edad fértil que no utilicen métodos anticonceptivos a menos que los beneficios para la madre superen los posibles riesgos para el feto.
4.6.2 Lactancia
La levodopa, y posiblemente sus metabolitos, se excretan en la leche humana. Hay pruebas de que la lactancia se suprime durante el tratamiento con levodopa.
Se desconoce si la carbidopa o sus metabolitos se excretan en la leche humana. Los estudios en animales han demostrado que la carbidopa se excreta en la leche materna.
No disponemos de información suficiente sobre los efectos de levodopa/carbidopa o de sus metabolitos en recién nacidos/bebés. La lactancia materna deberá interrumpirse durante el tratamiento con Duodopa.
4.6.3 Fertilidad
No se han observado reacciones adversas en materia de fertilidad en estudios preclínicos con carbidopa o levodopa exclusivamente. No se han realizado estudios sobre fertilidad en animales con la combinación de levodopa y carbidopa.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
El uso de Duodopa puede ejercer una influencia considerable sobre la capacidad para conducir y usar máquinas. La levodopa y la carbidopa pueden producir mareos e hipotensión ortostática. Por tanto, debe tenerse precaución al conducir o usar máquinas. Los pacientes tratados con Duodopa que presenten somnolencia y/o episodios de sueño súbito deben ser advertidos de abstenerse de conducir o realizar actividades en las que una vigilancia disminuida puede ponerles, a ellos o a terceros, en peligro de sufrir lesiones graves o muerte (como manejar máquinas) hasta que se hayan resuelto dichos episodios, ver también la sección 4.4
4.8 Reacciones adversas
Las reacciones adversas medicamentosas que se producen con frecuencia con el sistema Duodopa incluyen náuseas y discinesia.
Las reacciones adversas relativas a dispositivos o procedimientos que se producen con frecuencia con el sistema Duodopa incluyen dolor abdominal, complicaciones en la inserción del dispositivo, excesivo tejido de granulación, eritema en el lugar de la incisión, infección postoperatoria de heridas, liberación post procedimental, dolor procedimental y reacción en el lugar del procedimiento.
Casi todas estas reacciones adversas se notificaron al poco de comenzar los estudios, después del procedimiento de gastrostomía endoscópica percutánea, y se produjeron durante los primeros 28 días.
Reacciones adversas detectadas con Duodopa
La seguridad de Duodopa se comparó con la formulación oral estándar de levodopa/carbidopa (100 mg/25 mg) en un total de 71 pacientes con enfermedad de Parkinson avanzada que participaron en un estudio aleatorizado, doble ciego, de doble enmascaramiento, de control activo y de 12 semanas de duración. Se recopiló información adicional en materia de seguridad en un estudio abierto de 12 meses en el que participaron 354 pacientes con enfermedad de Parkinson avanzada y en estudios de extensión abierta.
Se llevó a cabo un análisis respecto de los pacientes que recibieron Duodopa en todos los estudios, con independencia del diseño de los mismos (doble ciego o abierto) para obtener un resumen de las reacciones adversas medicamentosas. Se llevó a cabo otro análisis respecto de los pacientes que recibieron gel de Duodopa o de placebo a través de una gastrostomía endoscópica percutánea con sonda yeyunal (PEG-J) para obtener un resumen de las reacciones adversas relativas a procedimientos o dispositivos en todos los estudios, con independencia del diseño de los mismos (doble ciego o abierto).
En la Tabla 1 se recogen las reacciones adversas medicamentosas y relacionadas con procedimientos y dispositivos junto con las detectadas durante el uso post autorización de Duodopa.
Tabla 1. Datos sobre reacciones adversas procedentes de ensayos clínicos y de la experiencia post comercialización
|
Clasificación MedDRA por órganos y sistemas |
Muy frecuentes3 (> 1/10) |
Frecuentes (> 1/100 a < 1/10)3 |
Poco frecuentesb (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000)b |
Desconocidas Postcomercialización |
|
Reacciones at |
versas medicamentosas | ||||
|
Trastornos de |
Anemia |
Leucopenia | |||
|
Clasificación MedDRA por órganos y sistemas |
Muy frecuentesa (> 1/10) |
Frecuentes (> 1/100 a < 1/10)a |
Poco frecuentesb (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000)b |
Desconocidas Postcomercialización |
|
Reacciones ad |
versas medicamentosas | ||||
|
la sangre y del sistema linfático |
T rombocitopenia | ||||
|
Trastornos del sistema inmune |
Reacción anafiláctica | ||||
|
Trastornos del metabolismo y la nutrición |
Pérdida de peso |
Aumento de peso Aumento del nivel de amino ácidos (aumento de ácido metil malónico) Hiperhomocistei nemia Descenso del apetito Deficiencia de vitamina B6 Deficiencia de vitamina B12 | |||
|
Trastornos psiquiátricos |
Ansiedad Depresión Insomnio |
Sueños anormales Agitación Estado de confusión Alucinaciones Comportamiento impulsivo0 Trastornos psicóticos Ataques de sueño Trastornos del sueño |
Suicidio consumado Demencia Desorientación Euforia Miedos Incremento de la libido (ver sección 4.4) Pesadillas Intento de suicidio |
Pensamiento anormal | |
|
Trastornos del sistema nervioso |
Discinesia Enfermedad de Parkinson |
Mareos Distonía Dolor de cabeza Hipostesia Fenómeno on y off Parestesia Polineuropatía |
Ataxia Convulsiones Alteración de la marcha | ||
|
Clasificación MedDRA por órganos y sistemas |
Muy frecuentesa (> 1/10) |
Frecuentes (> 1/100 a < 1/10)a |
Poco frecuentesb (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000)b |
Desconocidas Postcomercialización |
|
Reacciones at |
versas medicamentosas | ||||
|
Somnolencia Síncope Temblores | |||||
|
Trastornos oculares |
Blefaroespasmo Diplopia Neuropatía isquémica ópica Visión borrosa | ||||
|
Trastornos cardíacos |
Ritmo cardíaco irregular |
Palpitaciones | |||
|
Trastornos vasculares |
Hipotensión ortostática |
Hipertensión Hipotensión |
Flebitis | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea Dolor orofaríngeo Neumonía por aspiración |
Dolor en el pecho Disfonía |
Respiración anormal | ||
|
Trastornos gastrointestin ales |
Náuseas Estreñimiento |
Distensión abdominal Diarrea Boca seca Disgeusia Dispepsia Disfagia Flatulencia Vómitos |
Hipersecreción salival |
Bruxismo Decoloración salival Glosodinia Hipo | |
|
Trastornos de la piel y del tejido subcutáneo |
Dermatitis de contacto Hiperhidrosis Edema Prurito Erupción |
Alopecia Eritema Urticaria |
Decoloración del sudor Melanoma maligno (ver sección 4.4) | ||
|
Trastornos musculoesqu eléticos y del tejido conjuntivo |
Espasmos musculares Dolor de cuello | ||||
|
Trastornos renales y urinarios |
Incontinencia urinaria Retención |
Cromaturia |
Priapismo | ||
|
Clasificación MedDRA por órganos y sistemas |
Muy frecuentes3 (> 1/10) |
Frecuentes (> 1/100 a < 1/10)a |
Poco frecuentesb (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000)b |
Desconocidas Postcomercialización |
|
Reacciones ar |
versas medicamentosas | ||||
|
urinaria | |||||
|
Trastornos generales y problemas en el lugar de la administració n |
Fatiga Dolor Astenia |
Malestar | |||
|
Lesiones traumáticas, intoxicacione s y complicacion es de procedimient os |
Caídas | ||||
|
Reacciones adversas relativas a dispositivos y procedimientos | |||||
|
Infecciones e infestaciones |
Infección postoperatoria de heridas |
Celulitis en el lugar de incisión Infección post procedimental |
Absceso postoperatorio | ||
|
Trastornos gastrointestin ales |
Dolor abdominal |
Malestar abdominal Dolor abdominal superior Peritonitis Neumoperitoneo |
Bezoar(ver sección 4.4) Colitis isquémica Isquemia gastrointestinal Obstrucción gastrointestinal Invaginación Intestinal Pancreatitis Hemorragia del intestino delgado Úlcera del intestino delgado Perforación del intestino grueso |
Perforación gástrica Perforación gastrointestinal Isquemia del intestino delgado Perforación del intestino delgado | |
|
Trastornos de la piel y del tejido subcutáneo |
Excesivo tejido de granulación | ||||
|
Trastornos generales y problemas en |
Complicaciones en la inserción del dispositivod |
Dislocación del dispositivo Oclusión del | |||
|
Clasificación MedDRA por órganos y sistemas |
Muy frecuentesa (> 1/10) |
Frecuentes (> 1/100 a < 1/10)a |
Poco frecuentesb (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000)b |
Desconocidas Postcomercialización |
|
Reacciones at |
versas medicamentosas | ||||
|
el lugar de la administració n |
dispositivo | ||||
|
Lesiones traumáticas, intoxicacione s y complicacion es de procedimient os |
Eritema en el lugar de la incisión Liberación post procedimental Dolor procedimental Reacción en el lugar del procedimiento |
Complicación del estoma gastrointestinal Dolor en el lugar de la incisión Íleo post procedimental Complicación post procedimental Malestar post procedimental Hemorragia post procedimental | |||
“Reacciones adversas medicamentosas (RAMs) observadas en ensayos clínicos. Las frecuencias asignadas reflejan la frecuencia de los acontecimientos y son independientes de la causa asignada por el investigador. b RAMs observadas con Duodopa para las que no había información disponible para la estimación de las frecuencias. Las frecuencias se asignaron basándose en datos de levodopa/carbidopa oral.
“Trastornos del control de impulsos: juego patológico, aumento de la libido e hipersexualidad, gasto y compra compulsiva, comer en exceso y compulsivamente puede ocurrir en pacientes tratados con agonistas de dopamina y / u otros tratamientos dopaminérgicos que contienen levodopa incluyendo Duodopa (ver sección 4.4 "Advertencias y precauciones especiales de empleo ").
d Las complicaciones en la inserción del dispositivo fueron de las reacciones adversas más frecuentes notificadas tanto con la NJ como con el PEG-J. Esta reacción adversa se detectó junto con una o más de las siguientes reacciones adversas con la NJ: dolor orofaríngeo, distensión abdominal, dolor abdominal, malestar abdominal, dolor, irritación de garganta, lesión gastrointestinal, hemorragia esofágica, ansiedad, disfagia y vómitos. Con el PEG-J, esta reacción adversa se notificó junto con una o más de las siguientes reacciones adversas: dolor abdominal, malestar abdominal, distensión abdominal, flatulencia o neumoperitoneo. Otras reacciones adversas menos graves notificadas junto con las complicaciones en la inserción del dispositivo incluyeron malestar abdominal, dolor abdominal superior, úlcera duodenal, hemorragia por úlcera duodenal, duodenitis erosiva, gastritis erosiva, hemorragia gastrointestinal, peritonitis, neumoperitoneo y úlcera del intestino delgado.
La dislocación de la sonda intestinal hacia atrás en el estómago o la obstrucción del dispositivo derivan en la reaparición de las fluctuaciones motoras.
Se han observado las siguientes reacciones adversas (enumeradas en los términos preferidos por MedDRA) con levodopa/carbidopa oral, y podrían producirse con Duodopa:
|
Clasificación MedDRA por órganos y sistemas |
Raras (>1/10.000 a <1/1.000) |
Muy raras (>1/100.000 a <1/1.000) |
|
Trastornos de la sangre y del sistema linfático |
Anemia hemolítica |
Agranulocitis |
|
Trastornos del sistema nervioso |
Trismo Síndrome neuroléptico maligno (ver |
|
sección 4.4) | ||
|
Trastornos oculares |
Síndrome de Horner Midriasis Crisis oculogíricas | |
|
Trastornos de la piel y del tejido subcutáneo |
Angioedema Púrpura de Henoch-Schonlein |
Valores de laboratorio: Se han comunicado las siguientes anormalidades de laboratorio en el tratamiento con levodopa/carbidopa y, por tanto, deberán tenerse en cuenta al tratar a pacientes con Duodopa: aumento de nitrógeno ureico, fosfatasas alcalinas, S-AST, S-ALT, LDH, bilirrubina, azúcar en sangre, creatinina, ácido úrico y prueba de Coombs positiva y valores disminuidos de hemoglobina y hematocrito. Se han comunicado casos de leucocitos, bacterias y sangre en la orina. Levodopa/carbidopa y, por tanto, Duodopa, pueden producir resultados falsos positivos cuando se usa una tira reactiva para la cetona urinaria; esta reacción no se altera si se lleva a ebullición la muestra de orina. El empleo de métodos que utilizan la glucosa oxidasa puede dar resultados falsos negativos para la glucosuria.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
Los síntomas clínicos más importantes de una sobredosis con levodopa/carbidopa son distonía y discinesia. Los blefaroespasmos pueden ser un signo precoz de sobredosis.
El tratamiento de una sobredosis aguda de Duodopa es en general el mismo que el de una sobredosis aguda de levodopa. Sin embargo, la piridoxina no tiene efecto sobre la reversión de la acción de Duodopa. Debe usarse monitorización electrocardiografía y debe observarse cuidadosamente al paciente respecto al desarrollo de arritmias cardíacas; si es necesario, debe administrarse un tratamiento antiarrítmico adecuado. Debe tenerse en cuenta la posibilidad de que el paciente tomara otros medicamentos junto con Duodopa. Hasta la fecha, no se ha publicado experiencia con la diálisis, por lo que se desconoce su valor en el tratamiento de la sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos antiparkinsonianos, levodopa e inhibidor de la descarboxilasa.
Código ATC: N04BA02.
5.1.1 Mecanismo de acción
Duodopa es una combinación de levodopa y carbidopa (proporción 4:1) en un gel para la perfusión enteral continua en estados avanzados de la enfermedad del Parkinson con fluctuaciones motoras graves e hiper/discinesia. La levodopa es un precursor metabólico de la dopamina que alivia los síntomas de la enfermedad de Parkinson tras su descarboxilación a dopamina en el cerebro. La carbidopa, que no traspasa la barrera hemato-encefálica, inhibe la descarboxilación extracerebral de la levodopa, lo que hace que haya una mayor cantidad de levodopa disponible para el transporte al cerebro y para su transformación en dopamina. Sin la administración simultánea de carbidopa, se necesitarían cantidades mucho mayores de levodopa para obtener el efecto deseado. La perfusión enteral de dosis individualizadas de Duodopa
mantiene las concentraciones de levodopa en plasma a niveles estables dentro de las ventanas terapéuticas individuales
5.1.2 Efectos farmacodinámicos
La perfusión enteral con Duodopa reduce las fluctuaciones motoras y disminuye el tiempo OFF de los pacientes en estados avanzados de la enfermedad de Parkinson que hayan recibido anteriormente un tratamiento oral con levodopa asociada a un inhibidor de la descarboxilasa durante muchos años. Las fluctuaciones motoras y las hiper/discinesias se reducen debido a que las concentraciones en plasma son menos variables que las de carbidopa/levodopa oral, lo que permite el tratamiento dentro de una ventana terapéutica estrecha. El efecto terapéutico sobre las fluctuaciones motoras e hiper/discinesias a menudo se consigue durante el primer día de tratamiento.
5.1.3 Eficacia clínica y seguridad
La eficacia de Duodopa se demostró en dos estudios de diseño idéntico de Fase 3, 12 semanas de duración, aleatorizados, doble ciego, de doble simulación, con control activo, grupo paralelo y multicéntricos encaminados a evaluar la eficacia, seguridad y tolerancia de Duodopa frente a los comprimidos de levodopa/carbidopa de 100/25 mg. Los estudios se llevaron a cabo con un total de 71 pacientes con enfermedad de Parkinson avanzada, sensibles a levodopa y con fluctuaciones motoras persistentes a pesar de llevar un tratamiento oral con levodopa carbidopa optimizado y de recibir otros medicamentos disponibles contra la enfermedad de Parkinson. Los resultados de los dos estudios se combinaron y se realizó un único análisis.
La variable principal de eficacia, el cambio en el tiempo OFF normalizado (desde el momento basal al final del seguimiento) a partir de datos del Parkinson's Disease Diary© empleando la última observación recogida mostró una diferencia en la media de mínimos cuadrados (MC) estadísticamente significativa a favor del grupo de tratamiento que recibió Duodopa (Tabla 3).
Los resultados de las variables principales de estuvieron respaldados por un análisis de Modelo Mixto de Mediciones Repetidas (MMRM) que examinó el cambio desde la visita basal respecto de cada visita de estudio posterior. Este análisis del tiempo OFF demostró una mayor mejoría estadísticamente significativa en el grupo que recibió Duodopa respecto del grupo que recibió tratamiento oral con LC a la semana 4, y se observó que dicha mejoría era estadísticamente significativa a las semanas 8, 10 y 12.
Este cambio en el tiempo “OFF” se asoció con una diferencia de la media de MC estadísticamente significativa desde el punto de partida en el tiempo “ON” medio diario normalizado sin discinesias problemáticas entre el grupo de tratamiento que recibió Duodopa y el grupo de control activo a partir de datos del Parkinson's Disease Diary©. Los valores en el punto de partida se recopilaron tres días antes de la aleatorización y tras 28 días de normalización del tratamiento oral.
Tabla 3. Cambios desde el punto de partida hasta punto final en el tiempo OFF y ON sin discinesia problemática
|
Media en el |
Media de MC |
Media de MC | ||||
|
Grupo de tratamiento |
N |
punto de partida (DT) (horas) |
Punto final (DT) (horas) |
(EE) de cambio (horas) |
(EE) de diferencia (horas) |
Valor p |
|
Medición primaria | ||||||
|
Tiempo OFF Control activo3 |
31 |
6,90 (2,06) |
4,95 (2,04) |
-2,14 (0,66) | ||
|
Duodopa |
35 |
6,32 (1,72) |
3,05 (2,52) |
-4,04 (0,65) |
-1,91 (0,57) |
0,0015 |
|
Medición secundaria | ||||||
|
Tiempo "ON" sin | ||||||
|
discinesia problemática Control activo Duodopa |
31 35 |
8,04 (2,09) 8,70 (2,01) |
9,92 (2,62 11,95 (2,67) |
2,24 (0,76) 4,11 (0,75) |
1,86 (0,65) |
0,0059 |
|
DT = desviación típica; E |
3E = error estándar | |||||
a' Control activo, comprimidos orales de levodopa/carbidopa de 100/25 mg
Los análisis de las otras variables secundarias de evaluación de la eficacia, siguiendo el procedimiento de análisis de variable jerarquizado, , demostraron resultados estadísticamente significativos respecto de Duodopa en comparación con el tratamiento oral con levodopa/-carbidopa en el Índice resumen del Cuestionario de la Enfermedad de Parkinson (PDQ-39), la puntuación de la Impresión Clínica Global (CGI-I) y la puntuación en la Escala Unificada de Evaluación de la Enfermedad de Parkinson (UPDRS) Parte II (Actividades de la vida diaria). El Índice resumen PDQ-39 mostró un descenso desde el punto de partida de 10,9 puntos a la semana 12. Otras variables secundarias de evaluación, la puntuación UPDRS Parte III, el Índice resumen EQ-5D y la puntuación total ZBI, no reflejaron significación estadística según el análisis de variable jerarquizado.
Se llevó a cabo un estudio de Fase 3, abierto, de brazo único y multicéntrico para valorar la seguridad y la tolerancia a largo plazo de Duodopa durante un periodo de 12 meses en 354 pacientes. La población objetivo eran pacientes con enfermedad de Parkinson avanzada, sensibles a levodopa y con fluctuaciones motoras a pesar de llevar un tratamiento optimizado con medicamentos disponibles contra dicha enfermedad. El tiempo OFF medio diario normalizado se redujo en 4,44 horas desde el punto de partida hasta el punto final (6,77 en el punto de partida y 2,32 horas en el punto final) con un aumento correspondiente de 4,8 horas en el tiempo ON sin discinesia.
5.1.4 Población pediátrica
No se ha establecido la seguridad de Duodopa en pacientes menores de 18 y, por lo tanto, no se recomienda su uso en los mismos.
5.2 Propiedades farmacocinéticas
5.2.1 Absorción
Duodopa se administra a través de una sonda introducida directamente en el duodeno o el yeyuno. La levodopa se absorbe rápida y eficazmente desde el intestino a través de un sistema de transporte de alta capacidad para los aminoácidos. La biodisponibilidad de levodopa suministrada mediante comprimidos orales de liberación inmediata de levodopa/carbidopa asciende a entre el 84% y el 99%. Un análisis farmacocinético de estudio cruzado poblacional sugirió que Duodopa presenta una biodisponibilidad de levodopa comparable a la de los comprimidos orales de levodopa/carbidopa (100/25 mg).
En un estudio de Fase 1, la administración intrayeyunal de Duodopa alcanzó rápidamente los niveles en plasma terapéuticos de levodopa y mantuvo estables los niveles de levodopa durante el transcurso de la perfusión. Tras finalizar la perfusión, los niveles de levodopa descendieron rápidamente (Figura1). La variabilidad intra-sujeto de las concentraciones plasmáticas de levodopa a partir de la hora 2 y hasta la hora 16 tras iniciarse la perfusión fue baja (13%).
Figura 1. Concentraciones plasmáticas (media ± desviación típica) vs. Perfil temporal de Levodopa con perfusión de 16 horas de Duodopa
ÜE
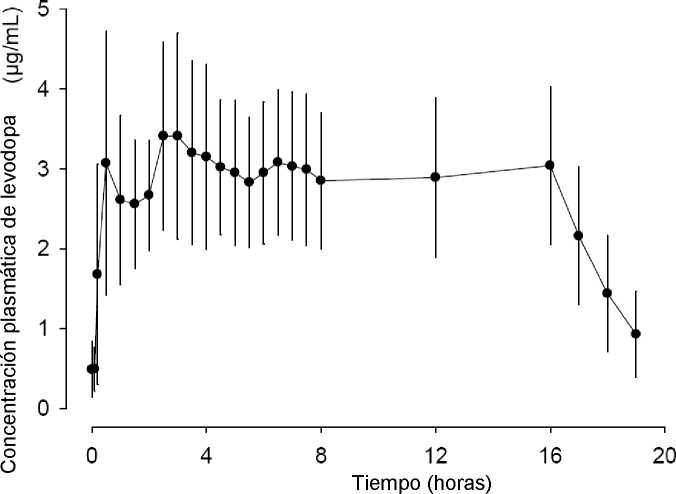
En un estudio Fase 3 con Duodopa, doble ciego, de control activo, la variabilidad intra-sujeto de la concentración plasmática de levodopa fue menor en los pacientes tratados con Duodopa (21%) respecto a los pacientes tratados con levodopa/carbidopa 100/25 mg oral en comprimidos encapsulados (67%).
5.2.2 Distribución
La levodopa se administra conjuntamente con carbidopa, un inhibidor de la descarboxilasa que aumenta la biodisponibilidad y reduce la eliminación de levodopa. La eliminación y volumen de distribución de levodopa es de 0,3 l/hora/kg y 0,9-1,6 l/kg respectivamente cuando se administra junto con un inhibidor de la descarboxilasa. El ratio de separación de levodopa en eritrocitos y plasma es, aproximadamente, de 1. La unión de levodopa a las proteínas plasmáticas no es significativa (entre un 10% y un 30% aproximadamente). La levodopa es transportada al cerebro mediante el mecanismo de transporte de los aminoácidoneutros grandes.
La unión de carbidopa a las proteínas plasmáticas es, aproximadamente, del 36%. La carbidopa no atraviesa la barrera hemato-encefálica
5.2.3 Metabolismo o Biotransformación
Cuando se administra junto con la carbidopa, la semivida de eliminación de la levodopa es aproximadamente de 1,5 horas. La levodopa se elimina completamente a través del metabolismo, y los metabolitos formados se excretan principalmente en la orina. Se conocen cuatro vías metabólicas, pero la levodopa se elimina fundamentalmente vía metabolismo mediante la descarboxilasa de aminoácidos aromáticos (AAAD) y la enzima catecol-O-metiltransferasa (COMT). Otras vías de metabolismo son la transaminación y la oxidación. La descarboxilación de levodopa en dopamina mediante el AAAD es la ruta enzimática principal cuando no se administra conjuntamente un inhibidor enzimático. Cuando se administra levodopa junto con carbidopa, se inhibe la enzima descarboxilasa, de forma que el metabolismo vía catecol-O-metiltransferasa (COMT) se convierte en la ruta metabólica predominante. La O-metilación de levodopa mediante COMT forma 3-O-metildopa.
La carbidopa se metaboliza en dos metabolitos principales (ácido a-metil-3-metoxi-4-hidroxifenil propiónico y ácido a-metil-3,4-dihidroxifenil propiónico). Estos 2 metabolitos se eliminan, en primer lugar, a través de la orina, y pueden hacerlo sin alterarse o como conjugados de glucorónido. La carbidopa sin
alterar supone un 30% de la excreción urinaria total. La semivida de eliminación de carbidopa es aproximadamente de 2 horas.
5.2.6 Datos de farmacocinética/ farmacodinamia(s)
La disminución de las fluctuaciones de la concentración plasmática de levodopa redunda en una disminución de las fluctuaciones de la respuesta al tratamiento. La dosis de levodopa varía considerablemente en los estados avanzados de la enfermedad de Parkinson, y es importante ajustar la dosis individualmente a partir de la respuesta clínica. Con Duodopa no se ha observado el desarrollo de tolerancia con el paso del tiempo.
5.3 Datos preclínicos sobre seguridad
Los estudios no clínicos no revelan un riesgo especial para los humanos en base a los estudios convencionales de seguridad, farmacología, toxicidad a dosis repetidas, genotoxicidad y potencial carcinógeno. En los estudios de toxicidad reproductiva, tanto la levodopa como la combinación de carbidopa/levodopa han producido malformaciones viscerales y esqueléticas en conejos.
La hidrazina es un producto de degradación de la carbidopa. En los estudios en animales, la hidrazina demostró una toxicidad sistémica notable, en particular por inhalación. Estos estudios demostraron que la hidrazina es hepatotóxica, tiene toxicidad sobre el SNC (aunque no se ha descrito después de la administración oral), y es genotóxica así como carcinogénica (ver también sección 4.4).
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Carmelosa sódica Agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
Sin abrir: 15 semanas.
Una vez abierto: Usar inmediatamente. Se puede usar el producto un máximo de 16 horas una vez fuera de la nevera. Desechar la porción no usada
6.4 Precauciones especiales de conservación
Almacenar en nevera (entre 2°C y 8°C).
Mantener el cartucho en la caja con el fin de proteger de la luz.
Para conocer las condiciones de almacenamiento después de la primera apertura, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Cantidad total de 100 ml en bolsa de PVC dentro de un cartucho de plástico duro protector, caja con 7 cartuchos.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Los cartuchos son de un solo uso.
No reutilizar un cartucho abierto.
¡m
La eliminación de cualquier medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Los cartuchos vacíos/usados deben devolverse a la farmacia para ser destruidos.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AbbVie Spain, S.L.U.
Avenida de Burgos 91,
28050 Madrid, España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
66.547
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: Febrero de 2005 Fecha de la última renovación: Enero de 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2016
17 de 17