Duaklir Genuair 340/12 Microgramos Polvo Para Inhalacion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Duaklir Genuair 340 microgramos/12 microgramos polvo para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada dosis liberada (la dosis que sale por la boquilla) contiene 396 microgramos de bromuro de aclidinio (equivalente a 340 microgramos de aclidinio) y 11,8 microgramos de formoterol fumarato dihidrato. Esto corresponde a una dosis medida de 400 microgramos de bromuro de aclidinio (equivalente a 343 microgramos de aclidinio) y una dosis medida de 12 microgramos de formoterol fumarato dihidrato.
Excipientes con efecto conocido
Cada dosis administrada contiene aproximadamente 11 mg de lactosa (como monohidrato).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para inhalación.
Polvo blanco o casi blanco en un inhalador de color blanco con un indicador de dosis integrado y un botón de dosificación de color naranja.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Duaklir Genuair está indicado como tratamiento broncodilatador de mantenimiento para aliviar los síntomas en los pacientes adultos con enfermedad pulmonar obstructiva crónica (EPOC).
4.2 Posología y forma de administración
Posología
La dosis recomendada es una inhalación de Duaklir Genuair 340 microgramos/12 microgramos dos veces al día.
Si se olvida una dosis, la siguiente se debe administrar lo antes posible y la dosis posterior a esta se debe administrar a la hora habitual. No se administre una dosis doble para compensar las dosis olvidadas.
Edad avanzada
No es necesario ajuste de dosis en los pacientes de edad avanzada (ver sección 5.2).
Insuficiencia renal
No es necesario ajuste de dosis en los pacientes con insuficiencia renal (ver sección 5.2).
Insuficiencia hepática
No es necesario ajuste de dosis en los pacientes con insuficiencia hepática (ver sección 5.2).
Población pediátrica
No existe una recomendación de uso específica para Duaklir Genuair en niños y adolescentes (menores de 18 años de edad) para la indicación de EPOC.
Forma de administración Vía inhalatoria.
Los pacientes deben recibir instrucciones sobre la forma correcta de administrar el producto. Para conocer las instrucciones detalladas, ver el prospecto. Es preciso indicar a los pacientes que deben leerlas detenidamente.
Descripción general de las instrucciones de uso de Duaklir Genuair
Botón naranja
Indicador
de dosis

Ventana de control con indicador de color
Boquilla
Tapa
protectora
'
Para usar el inhalador Genuair, los pacientes deben seguir dos pasos después de retirar la tapa. Los pacientes deben sujetar el inhalador Genuair en posición horizontal, con la boquilla orientada hacia él y el botón naranja hacia arriba.
PASO 1: Los pacientes deben PULSAR el botón naranja hasta el fondo (imagen 1) y, a continuación, SOLTARLO (imagen 2).
Recuerde a los pacientes que NO DEBEN MANTENER PULSADO EL BOTÓN NARANJA.
Los pacientes deben comprobar que el color de la ventana de control es verde. Este color indica que el inhalador está listo para su uso (imagen 3).
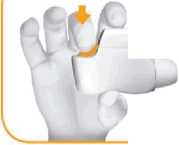
IMAGEN 1

IMAGEN 2

IMAGEN 3
SI EL COLOR DE LA VENTANA DE CONTROL ES ROJO, LOS PACIENTES DEBEN REPETIR LAS ACCIONES DE PULSAR Y SOLTAR (VER PASO 1).
PASO 2: Los pacientes deben inhalar CON FUERZA y PROFUNDAMENTE
boquilla (imagen 4). Los pacientes deben seguir inspirando, incluso después de que hayan oído un
“clic” del inhalador.
• Los pacientes deben comprobar que el color de la ventana de control ha cambiado de verde a rojo, lo que indica que han realizado correctamente la inhalación (imagen 5).

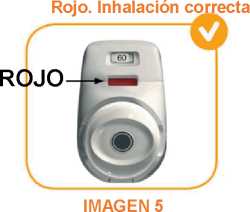
SI EL COLOR DE LA VENTANA DE CONTROL SIGUE SIENDO VERDE, LOS PACIENTES DEBEN VOLVER A INHALAR CON FUERZA Y PROFUNDAMENTE A TRAVÉS DE LA BOQUILLA (VER PASO 2).
Recuerde a los pacientes que, una vez retirado el inhalador Genuair de la boca, deben contener la respiración mientras se sientan cómodos y, a continuación, expulsar el aire lentamente por la nariz.
Tras la inhalación, los pacientes deben recordar volver a poner la tapa protectora. Algunos pacientes pueden experimentar un gusto ligeramente dulce o amargo, dependiendo del paciente al inhalar el medicamento. Los pacientes no deben tomar una dosis adicional si no notan ningún gusto después de la inhalación.
El inhalador Genuair cuenta con un indicador de dosis que le muestra aproximadamente cuántas dosis quedan en el inhalador. Cada inhalador Genuair administrará al menos 30 o 60 dosis, dependiendo del tamaño de envase. Cuando aparece una banda a rayas rojas en el indicador de dosis, significa que se acerca a la última dosis y debe obtener un nuevo inhalador Genuair. Cuando la última dosis esté lista para inhalar, el botón naranja no recuperará su posición superior, sino que se quedará bloqueado en una posición intermedia. Cuando el botón está bloqueado, es posible inhalar la última dosis pero, después de hacerlo, el inhalador Genuair no se podrá volver a utilizar y el paciente tendrá que empezar a usar un nuevo inhalador Genuair.
El inhalador Genuair no precisa limpieza pero, en caso necesario, puede limpiar la superficie exterior de la boquilla con un pañuelo o una toalla de papel secos. Recuerde al paciente que NUNCA utilice agua para limpiar el inhalador Genuair ya que podría causar daños en el medicamento.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Asma
Duaklir Genuair no se debe utilizar para el tratamiento de asma; no se han realizado ensayos clínicos de Duaklir Genuair en pacientes con asma.
Broncoespasmo paradójico
No se ha observado broncoespasmo paradójico en los ensayos clínicos de Duaklir Genuair a la dosis recomendada. No obstante, se ha observado broncoespasmo paradójico con otros tratamientos inhalados. En caso de producirse, se debe interrumpir el tratamiento con Duaklir Genuair y considerar otros tratamientos.
No indicado para el uso en episodios agudos
Duaklir Genuair no está indicado para el tratamiento de episodios agudos de broncoespasmo.
Efectos cardiovasculares
Los pacientes con infarto de miocardio en los seis meses previos, angina inestable, arritmia de nuevo diagnóstico en los tres meses previos, intervalo QTc (método de Bazett) por encima de 470 ms u hospitalización en los 12 meses previos debido a insuficiencia cardíaca de las clases funcionales III y IV según la New York Heart Association fueron excluidos de los ensayos clínicos, por tanto, Duaklir Genuair se debe utilizar con precaución en este grupo de pacientes.
En algunos pacientes, los agonistas p2-adrenérgicos pueden causar un aumento de la frecuencia de pulso y la tensión arterial, así como cambios en el electrocardiograma (ECG), como el aplanamiento de la onda T, la depresión del segmento ST y la prolongación del intervalo QTc. En caso de producirse tales efectos, es posible que sea necesario interrumpir el tratamiento. Los agonistas p2-adrenérgicos de acción prolongada se deben usar con precaución en pacientes con antecedentes o prolongación conocida del intervalo QTc o que hayan sido tratados con medicamentos que afecten al intervalo QTc (ver sección 4.5).
Efectos sistémicos
Duaklir Genuair se debe utilizar con precaución en aquellos pacientes que presenten trastornos cardiovasculares graves, trastornos convulsivos, tirotoxicosis y feocromocitoma.
Es posible observar trastornos metabólicos de hiperglucemia e hipopotasemia con dosis elevadas de agonistas p2-adrenérgicos. En ensayos clínicos de fase III, la frecuencia de aumentos considerables de la glucemia con Duaklir Genuair fue baja (0,1%) y similar a la del placebo. La hipopotasemia normalmente es transitoria y no precisa suplemento de potasio. En pacientes con EPOC grave, la hipopotasemia se puede ver exacerbada por la hipoxia y el tratamiento concomitante (ver sección 4.5). La hipopotasemia aumenta la susceptibilidad a experimentar arritmias cardíacas.
Debido a su actividad anticolinérgica, Duaklir Genuair se debe emplear con precaución en pacientes con hiperplasia prostática sintomática, retención urinaria o glaucoma de ángulo estrecho (aunque el contacto directo del producto con los ojos es muy improbable). La sequedad de boca, que se ha observado con el tratamiento anticolinérgico, se puede asociar a largo plazo con caries dentales.
Excipientes
Los pacientes con intolerancia hereditaria a la galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Medicamentos para la EPOC
No se ha estudiado la administración concomitante de Duaklir Genuair y otro medicamento anticolinérgico y/o agonista p2-adrenérgico de acción prolongada y, por lo tanto, no se recomienda.
Aunque no se han realizado estudios formales de interacción farmacológica in vivo, Duaklir Genuair se ha utilizado de manera concomitante con otros medicamentos para la EPOC, incluidos broncodilatadores p2-adrenérgicos de acción breve, metilxantinas y corticoesteroides orales e inhalados, sin evidencia clínica de interacciones farmacológicas.
Interacciones metabólicas
Los estudios in vitro indican que, a dosis terapéuticas, no se prevé que el aclidinio ni sus metabolitos causen interacciones con los fármacos sustratos de la glicoproteína P (P-gp) o con los fármacos metabolizados por las enzimas del citocromo P450 (CYP450) y esterasas. El formoterol, en concentraciones terapéuticas adecuadas, no inhibe las enzimas CYP450 (ver sección 5.2).
Tratamientos que disminuyen el potasio
El tratamiento concomitante con derivados de la metilxantina, corticoesteroides o diuréticos no ahorradores de potasio puede exacerbar el posible efecto hipopotasémico de los agonistas B2-adrenérgicos y, por lo tanto, es conveniente extremar la precaución en caso de uso concomitante de estos (ver sección 4.4).
Bloqueantes B-adrenérgicos
Los bloqueantes B-adrenérgicos pueden debilitar o antagonizar el efecto de los agonistas B2-adrenérgicos. En caso de ser necesario el uso de bloqueantes B-adrenérgicos (incluidos colirios), es preferible utilizar bloqueantes beta-adrenérgicos cardio-selectivos, si bien estos también se deben administrar con precaución.
Otras interacciones farmacodinámicas
Duaklir Genuair se debe administrar con precaución a pacientes en tratamiento con medicamentos conocidos por prolongar el intervalo QTc, como inhibidores de la monoaminooxidasa, antidepresivos tricíclicos, antihistamínicos o macrólidos. Estos medicamentos pueden potenciar la acción del formoterol, un componente de Duaklir Genuair, en el sistema cardiovascular. Los medicamentos conocidos por prolongar el intervalo QTc están asociados a un riesgo mayor de arritmias ventriculares.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos disponibles sobre la utilización de Duaklir Genuair en mujeres embarazadas.
Los estudios realizados en animales han mostrado fetotoxicidad solo a niveles de dosis muy superiores a la dosis humana máxima de exposición al aclidinio y efectos adversos en estudios de reproducción con formoterol en niveles de exposición sistémica muy elevados (ver sección 5.3).
Duaklir Genuair solo se debe utilizar durante el embarazo si los beneficios esperados superan los posibles riesgos.
Lactancia
Se desconoce si aclidinio (y/o sus metabolitos) y formoterol se excretan en la leche materna. Dado que los estudios realizados en ratas han mostrado excreción de pequeñas cantidades de aclidinio (y/o sus metabolitos) y formoterol en la leche, el uso de Duaklir Genuair por parte de mujeres lactantes se debe considerar únicamente si el beneficio esperado para la madre es superior al riesgo posible para el niño.
Fertilidad
Los estudios realizados en ratas han revelado una leve reducción de la fertilidad solo con niveles de dosis muy superiores a la dosis máxima de exposición para humanos al aclidinio y el formoterol (ver sección 5.3). No obstante, se considera poco probable que Duaklir Genuair administrado a la dosis recomendada afecte a la fertilidad de los humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Duaklir Genuair sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. La aparición de visión borrosa o mareo puede afectar a la capacidad para conducir o utilizar máquinas.
4.8 Reacciones adversas
La presentación del perfil de seguridad está basada en la experiencia con Duaklir Genuair y de sus componentes individuales.
Resumen del perfil de seguridad
La experiencia de seguridad de Duaklir Genuair comprende la exposición a la dosis terapéutica recomendada durante un periodo máximo de 12 meses.
Las reacciones adversas asociadas con Duaklir Genuair fueron similares a las de sus componentes individuales. Debido a que Duaklir Genuair contiene aclidinio y formoterol, cabe esperar que el tipo y la gravedad de las reacciones adversas asociadas a Duaklir Genuair sean los mismos que los de cada uno de sus componentes.
Las reacciones adversas notificadas con mayor frecuencia con Duaklir Genuair fueron nasofaringitis (7,9 %) y cefalea (6,8 %).
Tabla resumen de las reacciones adversas
El programa de desarrollo clínico de Duaklir Genuair se circunscribió a pacientes con EPOC moderada o grave. El número total de pacientes tratados con Duaklir Genuair 340 microgramos/12 microgramos fue 1222. Las frecuencias asignadas a las reacciones adversas que se incluyen a continuación se basan en la tasa de incidencia cruda de reacciones adversas con Duaklir Genuair 340 microgramos/12 microgramos, obtenida del análisis conjunto de diversos ensayos clínicos de fase III aleatorizados y controlados con placebo de al menos seis meses de duración.
La frecuencia de las reacciones adversas se define utilizando el siguiente convenio: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1000 a <1/100); raras (>1/10.000 a <1/1000); muy raras (<1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles).___
|
Sistema de clasificación de órganos |
Reacción adversa |
Frecuencia |
|
Infecciones e infestaciones |
Nasofaringitis3 Infección de las vías urinarias1 Sinusitis2 Absceso dental1 |
Frecuente |
|
Trastornos del sistema inmunológico |
Hipersensibilidad2 |
Rara |
|
Angioedema4 Reacción anafiláctica2 |
No conocida | |
|
Trastornos del metabolismo y de la nutrición |
Hipopotasemia3 |
Poco frecuente |
|
Hiperglucemia3 |
Poco frecuente | |
|
Trastornos psiquiátricos |
Insomnio2 Ansiedad2 |
Frecuente |
|
Agitación3 |
Poco frecuente | |
|
Trastornos del sistema nervioso |
Cefalea3 Mareo3 Temblor2 |
Frecuente |
|
Disgeusia3 |
Poco frecuente | |
|
Trastornos oculares |
Visión borrosa2 |
Poco frecuente |
|
Trastornos cardiacos |
Taquicardia2 QTc prolongado en el ECG2 Palpitaciones3 |
Poco frecuente |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos3 |
Frecuente |
|
Disfonía2 Irritación de garganta3 |
Poco frecuente | |
|
Broncoespasmo, incluido paradójico4 |
Rara | |
|
Trastornos gastrointestinales |
Diarrea3 Náuseas3 Sequedad bucal2 |
Frecuente |
|
Estomatitis3 |
Poco frecuente |
1 Reacciones adversas observadas con Duaklir Genuair pero no notificadas en la Ficha Técnica de los componentes individuales
|
Trastornos de la piel y del tejido subcutáneo |
Exantema3 Prurito3 |
Poco frecuente |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Mialgia2 Espasmos musculares2 |
Frecuente |
|
Trastornos renales y urinarios |
Retención urinaria3 |
Poco frecuente |
|
Trastornos generales y alteraciones en el lugar de administración |
Edema periférico3 |
Frecuente |
|
Exploraciones complementarias |
Elevación de creatina fosfocinasa (CPK) en sangre1 |
Frecuente |
|
Tensión arterial elevada3 |
Poco frecuente |
2 Reacciones adversas observadas con Duaklir Genuair y notificadas en la Ficha Técnica de al menos uno de los componentes individuales
3 Reacciones adversas notificadas en la Ficha Técnica de al menos uno de los componentes individuales, pero notificadas para Duaklir Genuair 340/12 microgramos con una incidencia inferior o comparable a la del placebo.
4 Reacciones adversas notificadas en la Ficha Técnica de al menos uno de los componentes individuales, pero no observadas con Duaklir Genuair 340/12 microgramos; la categoría de frecuencia corresponde a la indicada en la sección 4.8 de la Ficha Técnica del componente correspondiente.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Los datos de sobredosis con Duaklir Genuair son limitados. Las dosis elevadas de Duaklir Genuair pueden provocar signos y síntomas anticolinérgicos y/o p2-adrenérgicos exagerados; los más frecuentes son visión borrosa, sequedad bucal, náuseas, espasmos musculares, temblores, cefalea, palpitaciones e hipertensión.
En caso de sobredosis, se debe interrumpir el tratamiento con Duaklir Genuair y se recomienda tratamiento de soporte y sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos para el tratamiento de enfermedades obstructivas de las vías respiratorias, adrenérgicos en combinación con anticolinérgicos, código ATC: R03AL05
Mecanismo de acción
Duaklir Genuair contiene dos broncodilatadores: aclidinio, que es un antagonista muscarínico de acción prolongada (también denominado anticolinérgico), y formoterol, que es un agonista p2-adrenérgico de acción prolongada. La combinación de estos principios activos con diferentes mecanismos de acción se traduce en una eficacia aditiva, en comparación con la lograda con cada uno de estos componentes por sí solos. Como consecuencia de la densidad diferencial de los receptores muscarínicos y los receptores p2-adrenérgicos en las vías respiratorias centrales y periféricas pulmonares, los antagonistas muscarínicos deberían ser más eficaces en la relajación de las vías respiratorias centrales y los agonistas p2-adrenérgicos en la relajación de las vías respiratorias periféricas; la relajación de las vías respiratorias centrales y periféricas con un tratamiento combinado puede contribuir a los efectos beneficiosos de éste en la función pulmonar. A continuación se proporciona información adicional sobre estos dos principios activos.
Aclidinio es un antagonista selectivo competitivo de los receptores muscarínicos, con un tiempo de permanencia más prolongado en los receptores M3 que en los receptores M2. Los receptores M3 median en la contracción del músculo liso de las vías respiratorias. Bromuro de aclidinio inhalado actúa localmente en los pulmones para antagonizar los receptores M3 en el músculo liso de las vías respiratorias e inducir la broncodilatación. Asimismo, aclidinio ha mostrado que es beneficioso para los pacientes con EPOC en términos de reducción de los síntomas, mejoría del estado de salud específico de la enfermedad, reducción de las tasas de exacerbación y mejoras en la tolerancia al ejercicio. Debido a que el bromuro de aclidinio se hidroliza con rapidez en el plasma, el grado de reacciones adversas anticolinérgicas sistémicas es bajo.
Formoterol es un potente agonista selectivo de los receptores p2-adrenérgicos. La broncodilatación se propicia mediante la relajación directa del músculo liso de las vías respiratorias como consecuencia del aumento de AMP cíclico resultado de la activación de la enzima adenilato ciclasa. Además de mejorar la función pulmonar, también formoterol ha mostrado mejorar los síntomas y la calidad de vida de los pacientes con EPOC.
Efectos farmacodinámicos
Los estudios de eficacia mostraron que Duaklir Genuair mejoraba de forma clínicamente significativa la función pulmonar (medida como el volumen espiratorio forzado en un segundo [FEV1]) a lo largo de 12 horas tras la administración.
En comparación con el placebo, Duaklir Genuair demostró un inicio de la acción rápido, en los 5 minutos posteriores a la primera inhalación (p<0,0001). El inicio de la acción de Duaklir Genuair era comparable al efecto de formoterol p2-agonista 12 microgramos de acción rápida. El efecto broncodilatador máximo (FEV1 máximo) respecto al inicio fue evidente desde el primer día (304 ml) y se mantuvo durante el periodo de tratamiento de 6 meses (326 ml).
Electrofisiología cardíaca
No se observó que Duaklir Genuair tuviera efectos clínicamente relevantes en los parámetros electrocardiográficos (incluido el intervalo QT) en comparación con aclidinio, formoterol y placebo en el marco de diversos ensayos clínicos de fase III de 6 a 12 meses de duración en los que participaron aproximadamente 4000 pacientes con EPOC. Además, tampoco se observaron efectos clínicamente relevantes de Duaklir Genuair en el ritmo cardíaco, monitorizado con Holter durante 24 horas, en un subconjunto de 551 pacientes, 114 de los cuales recibieron Duaklir Genuair dos veces al día.
Eficacia clínica y seguridad
El programa de desarrollo clínico de fase III incluyó aproximadamente a 4000 pacientes con un diagnóstico clínico de EPOC y constó de dos estudios aleatorizados controlados con placebo y con tratamiento activo de seis meses de duración (ACLIFORM-COPD y AUGMENT), un ensayo clínico de extensión de 6 meses del estudio AUGMENT y un estudio adicional aleatorizado y controlado de 12 meses de duración. Durante estos estudios, se permitió que los pacientes prosiguieran con su tratamiento estable con corticoesteroides inhalados, corticoesteroides orales en dosis bajas, oxigenoterapia (siempre que fuera inferior a 15 h/día) o metilxantinas, así como utilizar salbutamol como medicamento de rescate.
La eficacia se evaluó mediante medidas de la función pulmonar, las variables sintomáticas, el estado de salud específico de la enfermedad, el uso de medicación de rescate y la aparición de exacerbaciones. En los estudios de seguridad a largo plazo, Duaklir Genuair se asoció a una eficacia sostenida cuando se administraba a lo largo de un periodo de tratamiento de un año sin evidencias de taquifilaxia.
Efectos en la función pulmonar
Duaklir Genuair 340/12 microgramos dos veces al día proporcionó de forma constante una mejora clínicamente significativa de la función pulmonar (determinada mediante FEVi, capacidad vital forzada y capacidad inspiratoria) en comparación con el placebo. En los estudios de fase III, se observaron efectos broncodilatadores clínicamente significativos en el plazo de los 5 minutos posteriores a la administración de la primera dosis y dichos efectos se mantuvieron durante todo el intervalo de dosificación. Este efecto se mantuvo en el tiempo en los estudios de fase III de seis meses y un año de duración.
Tanto el FEVi 1 hora después de la dosis como el FEVi mínimo (en comparación con aclidinio 400 microgramos y formoterol 12 microgramos, respectivamente) se definieron como criterios de valoración principales en los dos estudios de fase III pivotales de 6 meses de duración, con el fin de demostrar el efecto broncodilatador del formoterol y el aclidinio en Duaklir Genuair, respectivamente.
En el estudio ACLIFORM-COPD, Duaklir Genuair mostró mejoras en el FEV1 1 hora después de la dosis de 299 ml y 125 ml (ambas p<0,0001) respecto al placebo y el aclidinio, respectivamente, y mejoras en el FEV1 mínimo de 143 ml y 85 ml (ambas p<0,0001) respecto al placebo y el formoterol, respectivamente. En el estudio AUGMENT, Duaklir Genuair mostró mejoras en el FEV1 1 hora después de la dosis de 284 ml y 108 ml (ambas p<0,0001) respecto al placebo y el aclidinio, respectivamente, y mejoras en el FEV1 mínimo de 130 ml (p<0,0001) y 45 ml (p=0,01) respecto al placebo y el formoterol, respectivamente.
Alivio de los síntomas y mejora del estado de salud específico de la enfermedad Dificultad para respirar y otras variantes sintomáticas:
Duaklir Genuair proporcionó mejoras clínicamente significativas en la disnea (evaluada mediante el Índice de Transición de la Disnea [ITD]) con una mejora de la puntuación focal del ITD a los 6 meses en comparación con el placebo de 1,29 unidades en el estudio ACLIFORM-COPD (p<0,0001) y 1,44 unidades en el estudio AUGMENT (p<0,0001). Los porcentajes de pacientes con mejoras clínicamente significativas en la puntuación focal del ITD (definidas como un aumento de al menos 1 unidad) fueron mayores con Duaklir Genuair que con el placebo en ACLIFORM-COPD (el 64,8 % en comparación con el 45,5 %; p<0,001) y en AUGMENT (el 58,1 % en comparación con el 36,6 %;
p<0,0001).
El análisis conjunto de estos dos estudios mostró que Duaklir Genuair se asoció a mejoras de la puntuación focal del ITD estadísticamente significativas superiores a las de aclidinio (0,4 unidades, p = 0,016) o formoterol (0,5 unidades, p = 0,009). Asimismo, el porcentaje de pacientes tratados con Duaklir Genuair que respondió con una mejora clínicamente significativa de la puntuación focal del ITD fue superior al de aclidinio o formoterol (61,9 % frente a 55,7 % y 57,0 %, respectivamente; p = 0,056 y p = 0,100, respectivamente).
Duaklir Genuair mejoró los síntomas diarios de la EPOC, tales como “dificultad para respirar”, “síntomas torácicos”, “tos y esputo” (evaluados por la puntuación total de la E-RS) así como los síntomas generales nocturnos y matutinos y los síntomas que limitan la actividad matutina, en comparación con placebo, aclidinio y formoterol, pero las mejoras no siempre fueron estadísticamente significativas. Aclidinio/formoterol no redujo de manera estadísticamente significativa el número medio de despertares nocturnos debidos a la EPOC comparado con placebo o formoterol.
Calidad de vida relacionada con la salud:
Duaklir Genuair proporcionó una mejora clínicamente significativa en el estado de salud específico de la enfermedad (evaluado mediante el St. George’s Respiratory Questionnaire, [SGRQ]) en el estudio AUGMENT, con una mejora en la puntuación total de SGRQ en comparación con el placebo de -4,35 unidades (p<0,0001). El porcentaje de pacientes en AUGMENT que lograron una mejora clínicamente significativa con respecto al inicio en la puntuación total de SGRQ (definida como una disminución de al menos 4 unidades) fue superior con Duaklir Genuair que con el placebo (el 58,2 % comparado con el 38,7 %, respectivamente; p<0,001). En el estudio ACLIFORM-COPD, solo se observó una ligera disminución de la puntuación SGRQ total en comparación con el placebo, debido a una respuesta al placebo inesperadamente elevada (p = 0,598) y el porcentaje de pacientes que lograron mejoras clínicamente significativas con respecto al inicio fue del 55,3 % con Duaklir Genuair y del 53,2 % con el placebo (p = 0,669).
En el análisis conjunto de estos dos estudios Duaklir Genuair mostró mejoras de la puntuación SGRQ total superiores a las del formoterol (-1,7 unidades; p=0,018) o el aclidinio (-0,79 unidades; p=0,273). Además, el porcentaje de pacientes tratados con Duaklir Genuair que respondió con una mejora clínicamente significativa de la puntuación SGRQ total fue superior al del aclidinio y el formoterol (56,6 % frente a 53,9 % y 52,2 %, respectivamente; p=0,603 y p=0,270, respectivamente).
Reducción de la exacerbación de la EPOC
El análisis de eficacia conjunto de los dos ensayos clínicos de fase III de 6 meses de duración demostró una reducción estadísticamente significativa (del 29 %) en la tasa de exacerbaciones de moderadas a graves (que precisaron tratamiento con antibióticos o corticoesteroides o que requirieron hospitalización) con Duaklir Genuair en comparación con placebo (tasa por paciente por año: 0,29 frente a 0,42, respectivamente; p=0,036).
Además, Duaklir Genuair prolongó de forma estadísticamente significativa el tiempo hasta la primera exacerbación moderada o grave en comparación con el placebo (hazard ratio =0,70; p=0,027).
Uso de medicación de rescate
Duaklir Genuair redujo el uso de medicación de rescate a lo largo de 6 meses en comparación con placebo (en 0,9 inhalaciones/día [p<0,0001]), aclidinio (en 0,4 inhalaciones/día [p<0,001]) y formoterol (en 0,2 inhalaciones/día [p=0,062]).
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Duaklir Genuair en los diferentes grupos de la población pediátrica en la EPOC (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Cuando aclidinio y formoterol se administraron en combinación por vía inhalatoria, las propiedades farmacocinéticas de cada uno de los componentes no mostraron diferencias relevantes con respecto a las propiedades observadas cuando los medicamentos se administran por separado.
Absorción
Después de la inhalación de una dosis única de Duaklir Genuair 340/12 microgramos, aclidinio y formoterol se absorbieron rápidamente en el plasma, alcanzando la concentración plasmática máxima 5 minutos después de la inhalación en sujetos sanos y en el plazo de los 24 minutos posteriores a la inhalación en pacientes con EPOC. Las concentraciones plasmáticas máximas en estado estacionario de aclidinio y formoterol observadas en pacientes con EPOC tratados con Duaklir Genuair dos veces al día durante 5 días se alcanzaron en los 5 minutos posteriores a la inhalación y fueron de 128 pg/ml y 17 pg/ml, respectivamente.
Distribución
La deposición pulmonar total de aclidinio inhalado mediante el inhalador Genuair fue aproximadamente del 30 % de media de la dosis medida. La unión a proteínas plasmáticas de aclidinio determinada in vitro muy probablemente corresponde a la unión a proteínas de los metabolitos debida a la rápida hidrólisis de aclidinio en el plasma; la unión a proteínas plasmáticas fue del 87 % para el metabolito de ácido carboxílico y del 15 % para el metabolito de alcohol. La principal proteína plasmática que se une a aclidinio es la albúmina.
La unión a las proteínas plasmáticas de formoterol es del 61 % al 64 % (34 % principalmente a albúmina). No se produce la saturación de los sitios de unión en el intervalo de concentraciones alcanzado con dosis terapéuticas.
Biotransformación
Aclidinio se hidroliza rápida y ampliamente en sus derivados de alcohol y ácido carboxílico, farmacológicamente inactivos. La concentración plasmática del metabolito ácido es aproximadamente 100 veces superior a la del metabolito alcohol y a la del principio activo inalterado después de la inhalación. La hidrólisis se produce tanto por vía química (no enzimática) como enzimática a través de las esterasas, siendo la butirilcolinesterasa la principal esterasa humana que interviene en la hidrólisis. La baja biodisponibilidad absoluta de aclidinio inhalado (<5 %) se debe al hecho de que aclidinio experimenta una amplia hidrólisis sistémica y presistémica cuando se deposita en el pulmón o se traga. La biotransformación a través de las enzimas CYP450 desempeña un papel menor en la eliminación metabólica total de aclidinio. Los estudios in vitro han puesto de manifiesto que aclidinio en dosis terapéuticas o sus metabolitos no inhiben ni inducen las enzimas del citocromo P450 (CYP450), ni tampoco inhiben las esterasas (carboxilesterasa, acetilcolinesterasa y butirilcolinesterasa). Los estudios in vitro han mostrado que ni aclidinio ni sus metabolitos son sustratos o inhibidores de la glicoproteína P.
Formoterol se elimina principalmente por vía metabólica. La glucuronidación directa es la vía principal y la O-desmetilación seguida de la conjugación de glucurónidos constituye una vía metabólica adicional. Las isoenzimas CYP2D6, CYP2C19, CYP2C9 y CYP2A6 del citocromo P450 participan en la O-desmetilación de formoterol. Formoterol no inhibe las enzimas CYP450 en concentraciones terapéuticas relevantes.
Eliminación
Después de la inhalación de Duaklir Genuair 340/12 microgramos, aclidinio y formoterol presentaron una semivida de eliminación terminal de aproximadamente 5 h y 8 h, respectivamente.
Después de la administración intravenosa de aclidinio 400 microgramos radiomarcado a sujetos sanos, aproximadamente el 1 % de la dosis se excretó en forma de bromuro de aclidinio inalterado en la orina. Hasta un 65 % de la dosis se eliminó en forma de metabolitos en la orina y hasta un 33 % en forma de metabolitos en las heces. Después de la inhalación de aclidinio 200 microgramos y 400 microgramos por parte de sujetos sanos o pacientes con EPOC, la excreción urinaria de aclidinio inalterado fue muy baja, alrededor del 0,1 % de la dosis administrada, lo que indica que el aclaramiento renal desempeña un papel menor en la eliminación total del aclidinio del plasma.
La mayor parte de la dosis de formoterol se transforma por metabolismo hepático, seguido por la eliminación renal. Después de la inhalación, entre un 6 y un 9 % de la dosis de formoterol administrada se excreta inalterada en la orina o en forma de conjugados directos de formoterol.
Poblaciones especiales
Pacientes de edad avanzada
No se han realizado estudios farmacocinéticos de la combinación aclidinio/formoterol en sujetos de edad avanzada. No obstante, debido a que no es preciso ajustar la dosis de los medicamentos aclidinio y formoterol en las poblaciones de pacientes de edad avanzada, tampoco se justifica hacerlo en el caso de la combinación aclidinio/formoterol en pacientes de edad avanzada.
Pacientes con insuficiencia renal y hepática
No se dispone de datos relativos al uso específico de la combinación aclidinio/formoterol en pacientes con insuficiencia renal o hepática. No obstante, debido a que no es preciso ajustar la dosis de los medicamentos aclidinio y formoterol en los pacientes con insuficiencia renal o hepática, tampoco se justifica hacerlo en el caso de la combinación aclidinio/formoterol.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran que aclidinio y formoterol tengan riesgos especiales para los seres humanos según los estudios convencionales de seguridad farmacológica, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico y toxicidad para la reproducción y el desarrollo.
Unicamente se observaron efectos de aclidinio en los estudios no clínicos en exposiciones consideradas superiores a la exposición máxima humana en lo que respecta a la toxicidad reproductiva (efectos fetotóxicos) y la fertilidad (ligeros descensos en la tasa de concepción, el número de cuerpos lúteos y las pérdidas pre y postimplantación), lo que indica poca relevancia para su uso clínico.
Formoterol mostró una reducción de la fertilidad (pérdidas de implantación) en ratas, así como de la tasa de supervivencia postnatal temprana y del peso al nacer con una exposición sistémica elevada a formoterol. También se ha observado un ligero aumento de la incidencia de liomiomas uterinos en ratas y ratones; un efecto que se considera un efecto de esta clase de fármacos en roedores tras la exposición de larga duración a dosis elevadas de agonistas de los receptores p2-adrenérgicos.
Los estudios no clínicos que analizaban los efectos de la combinación aclidinio/formoterol en los parámetros cardiovasculares mostraron valores elevados de la frecuencia cardíaca y arritmias con exposiciones muy por encima de la indicación de exposición máxima humana, lo que indica poca relevancia para su uso clínico. Estos efectos son respuestas farmacológicas exageradas conocidas observadas con agonistas p2-adrenérgicos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Lactosa monohidrato.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
Usar en los 60 días posteriores a la apertura de la bolsa.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
Mantener el inhalador Genuair protegido dentro de la bolsa cerrada hasta que se inicie el tratamiento.
6.5 Naturaleza y contenido del envase
El inhalador Genuair es un dispositivo multicomponente compuesto de plástico (policarbonato, acrilonitrilo-butadieno-estireno, polioximetileno, poliéster-butileno-tereftalato, polipropileno y poliestireno) y acero inoxidable. Es de color blanco con un indicador de dosis integrado y un botón de dosificación de color naranja. La boquilla está cubierta por una tapa protectora desmontable de color naranja. El inhalador se proporciona cerrado en una bolsa protectora de aluminio laminado, que contiene una bolsita de material desecante, situada dentro de un envase de cartón.
Envase que contiene 1 inhalador con 30 dosis.
Envase que contiene 1 inhalador con 60 dosis.
Envase que contiene 3 inhaladores con 60 dosis cada uno.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Para consultar las instrucciones de uso, ver la sección 4.2.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca AB SE-151 85 Sódertalje Suecia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/964/001
EU/1/14/964/002
EU/1/14/964/003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 19/noviembre/2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes Industrias Farmacéuticas Almirall, S.A.
Ctra. Nacional II, Km. 593
08740 Sant Andreu de la Barca, Barcelona
España
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de seis meses después de la autorización. Posteriormente, el titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de gestión de riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva
información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
• Obligación de llevar a cabo medidas post-autorización
El TAC completará, dentro del plazo indicado, las siguientes medidas:
|
Descripción |
Fecha de vencimiento |
|
La presentación de los resultados del estudio de uso del fármaco (Drug Utilisation Study, DUS) acordado y el estudio de seguridad posterior a la autorización (Post-Authorisation Safety Study, PASS) para bromuro de aclidinio para evaluar la mortalidad general y los criterios de valoración propuestos de la seguridad cardiovascular (con un criterio de valoración adicional de arritmia cardiaca) entre pacientes con EPOC que utilicen aclidinio/formoterol, de acuerdo con un protocolo acordado por el PRAC (Pharmacovigilance Risk Assessment Committee). |
3T de 2018 |
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA EXTERIOR
1. NOMBRE DEL MEDICAMENTO
Duaklir Genuair 340/12 microgramos polvo para inhalación Aclidinio/formoterol fumarato dihidrato
2. PRINCIPIO(S) ACTIVO(S)
Cada dosis liberada contiene 396 microgramos de bromuro de aclidinio (equivalente a 340 microgramos de aclidinio) y 11,8 microgramos de formoterol fumarato dihidrato.
3. LISTA DE EXCIPIENTES
También contiene: lactosa
Para mayor información consultar el prospecto
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1 inhalador que contiene 30 dosis 1 inhalador que contiene 60 dosis 3 inhaladores que contienen 60 dosis cada uno
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía inhalatoria.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Usar en los 60 días posteriores a la apertura de la bolsa.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Mantener el inhalador Genuair protegido dentro de la bolsa cerrada hasta que se inicie el tratamiento.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca AB SE-151 85 Sódertalje Suecia
AstraZeneca (logotipo AstraZeneca)
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
|
EU/1/14/964/001 |
1 inhalador con 60 dosis | |
|
EU/1/14/964/002 3 inhaladores con 60 dosis cada uno | ||
|
EU/1/14/964/003 1 inhalador con 30 dosis | ||
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
duaklir genuair
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
Incluido el código de barras 2D que lleva el identificador único. | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS BOLSA DE ALUMINIO
1. NOMBRE DEL MEDICAMENTO
Duaklir Genuair 340/12 microgramos polvo para inhalación Aclidinio/formoterol fumarato dihidrato
|
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN | |
|
AstraZeneca (logotipo AstraZeneca) | |
|
3. FECHA DE CADUCIDAD | |
CAD
Usar en los 60 días posteriores a la apertura de la bolsa.
4. NÚMERO DE LOTE
Lote
5. OTROS_
Mantener el inhalador Genuair protegido dentro de la bolsa cerrada hasta que se inicie el tratamiento. [flecha] Abrir aquí
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DEL INHALADOR
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Duaklir Genuair 340/12 mcg polvo para inhalación Aclidinio/formoterol fumarato dihidrato
2. FORMA DE ADMINISTRACIÓN
Vía inhalatoria.
3. FECHA DE CADUCIDAD
Usar en los 60 días posteriores a la apertura de la bolsa. CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
30 dosis 60 dosis
6. OTROS
AstraZeneca (logotipo AstraZeneca)
B. PROSPECTO
Prospecto: información para el paciente
Duaklir Genuair 340 microgramos/12 microgramos polvo para inhalación
adidinio/formoterol fumarato dihidrato
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Duaklir Genuair y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Duaklir Genuair
3. Cómo usar Duaklir Genuair
4. Posibles efectos adversos
5. Conservación de Duaklir Genuair
6. Contenido del envase e información adicional
7. Inhalador Genuair: instrucciones de uso
1. Qué es Duaklir Genuair y para qué se utiliza Qué es Duaklir Genuair
Este medicamento contiene dos principios activos denominados aclidinio y formoterol fumarato dihidrato. Ambos pertenecen a un grupo de medicamentos denominados broncodilatadores. Lo que hacen los broncodilatadores es relajar el músculo de sus vías respiratorias, lo que permite abrir más las vías respiratorias y le ayudará a respirar con más facilidad. El inhalador Genuair administra los principios activos directamente en los pulmones cuando usted inspira.
Para qué se utiliza Duaklir Genuair
Duaklir Genuair se utiliza en pacientes adultos que tienen dificultad para respirar debido a una enfermedad pulmonar denominada enfermedad pulmonar obstructiva crónica (EPOC), en la que las vías respiratorias y los alvéolos en los pulmones resultan dañados o se bloquean. Al abrir las vías respiratorias, el medicamento ayuda a aliviar síntomas como la dificultad para respirar. El uso regular de Duaklir Genuair le ayudará a minimizar los efectos de la EPOC en su vida diaria.
2. Qué necesita saber antes de empezar a usar Duaklir Genuair No use Duaklir Genuair:
- si es alérgico a aclidinio, al formoterol fumarato dihidrato o a cualquiera de los demás componentes de este medicamento, lactosa (ver sección 2 en “Duaklir Genuair contiene lactosa”.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Duaklir Genuair si presenta alguno de los síntomas/enfermedades siguientes:
- Si tiene asma. Este medicamento no se debe utilizar para el tratamiento del asma.
- Si tiene problemas cardíacos.
- Si tiene epilepsia.
- Si tiene trastornos de tiroides (tirotoxicosis).
- Si tiene un tumor en una glándula suprarrenal (feocromocitoma).
- Si tiene dificultad para orinar o presenta problemas por agrandamiento de la próstata.
- Si tiene una afección ocular denominado glaucoma de ángulo estrecho, que provoca una presión elevada en el ojo.
Deje de utilizar Duaklir Genuair y busque inmediatamente ayuda médica si experimenta cualquiera de los siguientes síntomas:
- Si súbitamente tiene dificultad para respirar o tragar, se le inflama la lengua, la garganta, los labios o la cara, o presenta sarpullido y/o picor. Pueden ser signos de una reacción alérgica.
- Si nota opresión repentina en el pecho, tiene tos, pitidos al respirar o dificultad para respirar inmediatamente después de utilizar el medicamento. Pueden ser signos de un trastorno denominado “broncoespasmo paradójico”, que es una contracción severa y prolongada de los músculos de las vías respiratorias inmediatamente después del tratamiento con un broncodilatador.
Duaklir Genuair se utiliza como tratamiento de mantenimiento (largo plazo) de la EPOC. No se debe emplear este medicamento para tratar un ataque repentino de dificultad para respirar o pitidos respiratorios.
Si los síntomas habituales de la EPOC (dificultad para respirar, pitidos al respirar o tos) no mejoran o empeoran durante el tratamiento con Duaklir Genuair, debe continuar utilizando el medicamento pero es preciso que además acuda a su médico cuanto antes para que éste determine si necesita otra medicación.
Si ve halos en torno a las luces o imágenes en color, tiene dolor o molestias en los ojos o experimenta temporalmente visión borrosa, acuda a su médico cuanto antes.
La sequedad de boca se ha observado con medicamentos como Duaklir Genuair. A largo plazo, la sequedad de boca se puede asociar con caries dental, por lo que es importante que cuide su higiene bucal.
Niños y adolescentes
Duaklir Genuair no se debe usar en niños o adolescentes menores de 18 años de edad.
Uso de Duaklir Genuair con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento. Si utiliza Duaklir Genuair con otros medicamentos, es posible que el efecto de Duaklir Genuair o de los otros medicamentos se vea alterado.
Informe a su médico o farmacéutico si está tomando:
• Cualquier medicamento que pueda ser similar a Duaklir Genuair para el tratamiento de la
dificultad para respirar.
• Medicamentos que reduzcan el nivel de potasio en la sangre. Estos incluyen:
o corticoesteroides orales (como prednisolona), o diuréticos (como furosemida o hidroclorotiazida),
o determinados medicamentos empleados para tratar enfermedades respiratorias (como teofilina).
• Medicamentos denominados betabloqueantes que se pueden emplear para tratar la hipertensión
arterial y otras afecciones cardíacas (como atenolol o propranolol) o para tratar el glaucoma (como timolol).
• Medicamentos que pueden causar un tipo de cambio en la actividad eléctrica del corazón
denominado “prolongación del intervalo QT” (que se observa en un electrocardiograma).
Entre estos se incluyen medicamentos para el tratamiento de:
o depresión (como inhibidores de la monoaminooxidasa o antidepresivos tricíclicos), o infecciones bacterianas (como eritromicina, claritromicina o telitromicina), o reacciones alérgicas (antihistamínicos).
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico, farmacéutico o enfermero antes de utilizar este medicamento. No debe utilizar Duaklir Genuair si está embarazada o dando el pecho a menos que se lo haya recomendado su médico.
Conducción y uso de máquinas
Es poco probable que Duaklir Genuair afecte a la capacidad para conducir o utilizar máquinas. En algunos pacientes, este medicamento puede producir visión borrosa o mareo. Si experimenta cualquiera de estas reacciones adversas no conduzca ni utilice máquinas hasta que haya desaparecido el mareo y se haya normalizado su visión.
Duaklir Genuair contiene lactosa
Este medicamento contiene lactosa. Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo usar Duaklir Genuair
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
- La dosis recomendada es una inhalación dos veces al día, por la mañana y por la noche.
- Los efectos de Duaklir Genuair duran 12 horas, por lo tanto, debe intentar utilizar Duaklir Genuair a la misma hora todas las mañanas y noches ya queesto garantizará que siempre haya suficiente medicamento en su cuerpo para ayudarle a respirar más fácilmente durante todo el día y toda la noche. Además, usarlo siempre a la misma hora contribuirá a que se acuerde de que debe utilizarlo.
- Instrucciones de uso: consulte las instrucciones de uso del inhalador Genuair en la sección 7, al final de este prospecto. En caso de duda sobre cómo usar Duaklir Genuair, consulte a su médico o farmacéutico.
- Puede usar Duaklir Genuair en cualquier momento, antes o después de haber comido o bebido.
La EPOC es una enfermedad de larga evolución y, por lo tanto, Duaklir Genuair se debe usar todos los días, dos veces al día, y no solo cuando se tengan problemas para respirar u otros síntomas de la EPOC.
La dosis recomendada se puede utilizar en pacientes de edad avanzada y en pacientes con problemas de riñón o hígado. No es necesario ajustar la dosis en estos pacientes.
Si usa más Duaklir Genuair del que debe
Si cree que ha usado más Duaklir Genuair del que debe, es más probable que experimente algunos de sus efectos adversos, como visión borrosa, sequedad de boca, náuseas, temblores, dolor de cabeza, palpitaciones o aumento de la tensión arterial; en tal caso, póngase inmediatamente en contacto con su médico o acuda a la unidad de urgencias más cercana. Lleve consigo el envase de Duaklir Genuair. Es posible que necesite asistencia médica.
Si olvidó usar Duaklir Genuair
Si olvida una dosis de Duaklir Genuair, se debe administrar lo antes posible y la dosis posterior a esta se debe administrar a la hora habitual. No se administre una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Duaklir Genuair
Este medicamento es para un tratamiento de larga duración. Si desea interrumpir el tratamiento, consulte primero a su médico, ya que sus síntomas pueden empeorar.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Algunos efectos adversos pueden ser graves: si experimenta alguno de estos efectos adversos, informe a su médico inmediatamente.
Poco frecuentes: pueden afectar hasta 1 de cada 100 pacientes
- Debilidad o espasmos musculares y/o ritmo cardíaco anormal, ya que pueden ser signos de una disminución del nivel de potasio en la sangre
- Cansancio, aumento de la sed y/o necesidad de orinar con más frecuencia de lo habitual, ya que pueden ser signos de un aumento del nivel de azúcar en la sangre
- Palpitaciones, ya que pueden ser un signo de un latido cardíaco inusualmente acelerado o un ritmo cardíaco anormal
Raros: pueden afectar hasta 1 de cada 1000 pacientes
- Presión en el pecho, tos, pitidos respiratorios o dificultad para respirar inmediatamente después de usar el medicamento
- Dificultad súbita para respirar o tragar, inflamación de la lengua, la garganta, los labios o la cara, sarpullido y/o picor cutáneos; pueden ser signos de una reacción alérgica
Frecuencia no conocida: no puede estimarse a partir de los datos disponibles
Hinchazón de cara, garganta, labios o lengua (con o sin dificultad para respirar o tragar), ronchas y
picazón severa en la piel (urticaria), ya que pueden ser síntomas de una reacción alérgica.
Otros efectos adversos que se pueden producir durante el uso de Duaklir Genuair:
Frecuentes: pueden afectar hasta 1 de cada 10pacientes
- Combinación de dolor de garganta y aumento de mucosidad; pueden ser signos de nasofaringitis
- Dolor de cabeza
- Dolor al orinar y/u orinar de manera frecuente; pueden ser signos de infección de las vías urinarias
- Tos
- Diarrea
- Nariz taponada o congestionada, aumento de mucosidad y/o dolor o sensación de presión en las mejillas o la frente; pueden ser síntomas de sinusitis
- Mareo
- Calambres musculares
- Náuseas (sensación de malestar)
- Dificultad para conciliar el sueño
- Sequedad bucal
- Dolor muscular
- Inflamación de manos, tobillos o pies
- Absceso (infección) de la encía dental
- Niveles elevados en la sangre de una proteína que se encuentra en el tejido muscular y se denominada creatina fosfocinasa
- Temblores
- Ansiedad
Poco frecuentes:
- Latido cardíaco acelerado (taquicardia)
- Visión borrosa
- Cambios en el tono de la voz (disfonía)
- Dificultad para orinar o sensación de que la vejiga no se vacía por completo (retención urinaria)
- Trazado electrocardiografía anormal (prolongación del intervalo QT) que puede derivar en un ritmo cardíaco anormal
- Sentido del gusto alterado (disgeusia)
- Irritación de garganta
- Inflamación de la boca (estomatitis)
- Aumento de la tensión arterial
- Nerviosismo
- Sarpullido
- Picor cutáneo
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Duaklir Genuair
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del inhalador, el estuche y la bolsa del inhalador después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Mantener el inhalador Genuair protegido dentro de la bolsa cerrada hasta que se inicie el tratamiento. Usar en los 60 días posteriores a la apertura de la bolsa.
No utilice Duaklir Genuair si observa que el envase está dañado o muestra signos de manipulación.
Una vez que haya utilizado la última dosis, el inhalador se debe desechar. Los medicamentos no se deben tirar a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Duaklir Genuair
- Los principios activos son bromuro de aclidinio y formoterol fumarato dihidrato. Cada dosis liberada contiene 396 microgramos de bromuro de aclidinio equivalente a 340 microgramos de aclidinio y 11,8 microgramos de formoterol fumarato dihidrato.
- El otro componente es lactosa monohidrato.
Aspecto del producto y contenido del envase
Duaklir Genuair es un polvo blanco o casi blanco.
El inhalador Genuair es un dispositivo de color blanco con un indicador de dosis integrado y un botón de dosificación de color naranja. La boquilla está cubierta por una tapa protectora desmontable de
color naranja. Se proporciona en una bolsa protectora de aluminio cerrada que contiene una bolsita de material desecante.
Tamaños de envase proporcionados:
Envase que contiene 1 inhalador con 30 dosis.
Envase que contiene 1 inhalador con 60 dosis.
Envase que contiene 3 inhaladores con 60 dosis cada uno.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
AstraZeneca AB SE-151 85 Sódertalje Suecia
Responsable de la fabricación:
Industrias Farmacéuticas Almirall, S.A.
Ctra. Nacional II, Km. 593
08740 Sant Andreu de la Barca, Barcelona
España
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien Lietuva
AstraZeneca S.A./N.V. UAB AstraZeneca Lietuva
Tel: +32 2 370 48 11
Tel: +370 5 2660550
Etarapna
Acrpa3eHeKa Etarapna EOOfl Tea.: +359 (2) 44 55 000
Ceská republika
AstraZeneca Czech Republic s.r.o.
Tel: +420 222 807 111
Malta
Associated Drug Co. Ltd
Tel: +356 2277 8000
EXXáSa
AstraZeneca A.E.
T^: +302 106871500
Ireland
Slovenija
AstraZeneca UK Limited Tel: +386 1 51 35 600
Slovenská republika
AstraZeneca AB, o.z.
Tel: +421 2 5737 7777
Suomi/Finland
AstraZeneca Oy Puh/Tel: +358 10 23 010
Sverige
AstraZeneca AB Tel: +46 8 553 26 000
United Kingdom
AstraZeneca UK Ltd Tel: +44 1582 836 836
España
AstraZeneca Farmacéutica Spain, S.A. Tel: +34 91 301 91 00
France
AstraZeneca
Tél: +33 1 41 29 40 00
Hrvatska
AstraZeneca d.o.o.
Tel: +385 1 4628 000
Polska
AstraZeneca Pharma Poland Sp. z o.o.
Tel.: +48 22 245 73 00
Portugal
AstraZeneca Produtos Farmacéuticos, Lda. Tel: +351 21 434 61 00
Romanía
AstraZeneca Pharma SRL Tel: +40 21 317 60 41
A. Menarini Pharmaceuticals Ireland Ltd Tel: +353 1 284 6744
Ísland
Vistor hf.
Sími: +354 535 70 00 Italia
AstraZeneca S.p.A.
Tel: +39 02 9801 1
Kúrcpog
A^skt©p Oap^aKeuxiKq AxS T^: +357 22490305
Latvija
SIA AstraZeneca Latvija Tel: +371 67377100
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu/.
7. Inhalador Genuair: instrucciones de uso
Esta sección contiene información sobre cómo usar el inhalador Genuair. También ponemos a su disposición un vídeo de demostración del uso del inhalador Genuair que está disponible en www.genuair.com y utilizando el código que figura a continuación. Si tiene alguna duda acerca de cómo usar el inhalador, consulte a su médico, farmacéutico o enfermero.

Antes de usar el inhalador Genuair, por favor lea todas las instrucciones.
Familiarizarse con Duaklir Genuair: extraiga el inhalador Genuair de la bolsa y familiarícese con sus componentes.

Boquilla
Cómo usar Duaklir Genuair
Resumen
Para usar su inhalador Genuair hay dos pasos que debe realizar después de retirar la tapa:
Paso 1: Pulse y SUELTE el botón naranja y suelte todo el aire completamente con la boca apartada del inhalador.
Paso 2: Apriete los labios alrededor de la boquilla e inspire CON FUERZA y PROFUNDAMENTE a través del inhalador.
Tras la inhalación, recuerde volver a poner la tapa protectora.
Cómo empezar
• Antes del primer uso, abra la bolsa cerrada por la hendidura y extraiga el inhalador Genuair. Deseche la bolsa y la bolsita con material desecante.
• Cuando se vaya a administrar su dosis de medicamento, retire la tapa protectora presionando ligeramente las flechas que aparecen a cada lado y estirando hacia fuera (ver imagen 1).
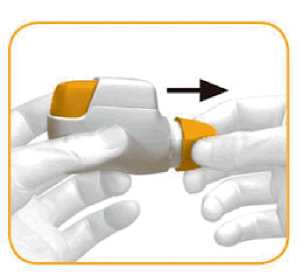
IMAGEN 1
• Compruebe que no hay nada que bloquee la boquilla.
Sostenga el inhalador Genuair en posición horizontal con la boquilla hacia usted y el botón naranja hacia arriba (ver imagen 2).
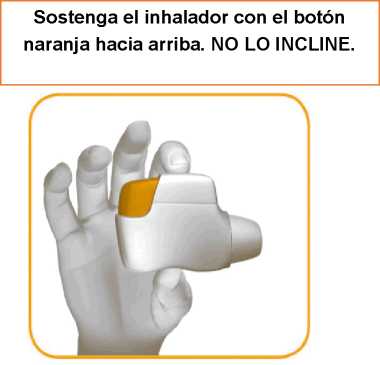
IMAGEN 2
PASO 1: PULSE el botón naranja hasta el fondo y luego SUÉLTELO (ver imágenes 3 y 4). NO SIGA PULSANDO EL BOTÓN NARANJA.
PULSE el botón naranja SUELTE el botón
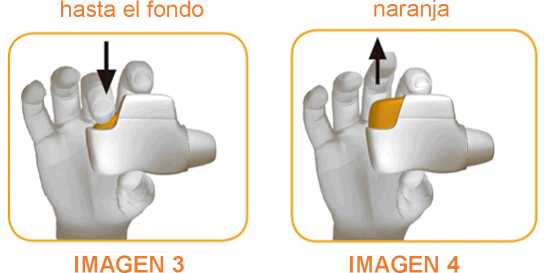
Pare y compruebe: Asegúrese de que la dosis está lista para la inhalación
• Compruebe que la ventana de control con indicador de color ha cambiado a verde (ver imagen 5).
• La ventana de color verde confirma que su medicamento está listo para la inhalación.

SI LA VENTANA DE CONTROL CON INDICADOR DE COLOR SIGUE ROJA, POR FAVOR REPITA LAS ACCIONES DE PULSAR Y SOLTAR (VER PASO 1).
• Antes de llevarse el inhalador a la boca, suelte todo el aire completamente. No expulse el aire
dentro del inhalador.
PASO 2:
• Apriete los labios alrededor de la boquilla del inhalador Genuair e inhale CON FUERZA y
PROFUNDAMENTE a través de la boquilla (ver imagen 6).
- Esta inspiración fuerte y profunda hace que el medicamento atraviese el inhalador y entre en sus pulmones.
ATENCIÓN: NO MANTENGA PULSADO EL BOTÓN NARANJA MIENTRAS INHALA.
IMAGEN 6
• Mientras inspira oirá un “CLIC” que indica que está utilizando el inhalador Genuair
correctamente.
• Siga inspirando incluso después de oír el “CLIC” del inhalador para asegurarse de que se
administra la dosis completa.
• Retire el inhalador Genuair de su boca y contenga la respiración mientras se sienta cómodo y
luego expulse el aire lentamente por la nariz.
Nota: algunos pacientes pueden experimentar un sabor levemente dulce o ligeramente amargo, dependiendo del paciente, al inhalar el medicamento. No se administre una dosis adicional si no nota ningún sabor después de la inhalación.
Pare y compruebe: Asegúrese de que ha inhalado correctamente
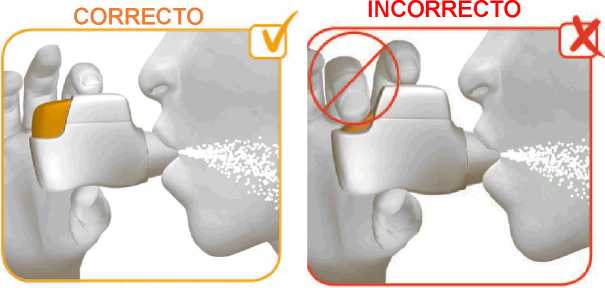
• Compruebe que la ventana de control ha cambiado a rojo (ver imagen 7). Esto confirma que ha inhalado correctamente la dosis completa.

SI LA VENTANA DE CONTROL CON INDICADOR DE COLOR SIGUE SIENDO VERDE, POR FAVOR VUELVA A INHALAR CON FUERZA Y PROFUNDAMENTE POR LA BOQUILLA (VER PASO 2).
• Si la ventana sigue sin cambiar a rojo, es posible que haya olvidado soltar el botón naranja antes
de inhalar o que no haya inhalado correctamente. En ese caso, vuelva a intentarlo.
Asegúrese de SOLTAR el botón naranja e inhale CON FUERZA y profundamente a través de la boquilla.
Nota: si no es capaz de inhalar correctamente después de varios intentos, consulte a su médico.
• Una vez que la ventana se vuelva roja, vuelva a colocar la tapa protectora presionándola sobre la
boquilla (ver imagen 8).

V f
IMAGEN 8
¿Cuándo debe conseguir un nuevo inhalador Genuair?
• El inhalador Genuair cuenta con un indicador de dosis que le muestra aproximadamente cuántas dosis quedan en el inhalador. El indicador de dosis desciende lentamente mostrando intervalos de 10 (60, 50, 40, 30, 20, 10 y 0) (ver imagen A). Cada inhalador Genuair administrará al menos 30 o 60 dosis, dependiendo del tamaño de envase.
Cuando aparece una banda a rayas rojas en el indicador de dosis (ver imagen A) significa que se
acerca a la última dosis y debe obtener un nuevo inhalador Genuair.
El indicador de dosis desciende a intervalos de 10: 60, 50, 40, 30, 20, 10 y 0.
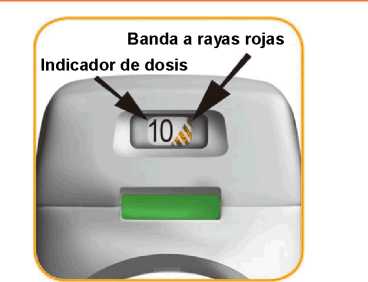
IMAGEN A
Nota: si el inhalador Genuair parece dañado o si pierde la tapa, debe reemplazar su inhalador. NO NECESITA limpiar el inhalador Genuair. Sin embargo, si desea limpiarlo, pase un pañuelo seco o una toalla de papel por la parte exterior de la boquilla.
NUNCA utilice agua para limpiar el inhalador Genuair porque podría dañar el medicamento.
¿Cómo sabe que el inhalador Genuair está vacío?
• Cuando aparece 0 (cero) en el centro del indicador de dosis, debe seguir utilizando las dosis que queden en el inhalador Genuair.
• Cuando la última dosis esté lista para inhalar, el botón naranja no recuperará su posición superior, sino que se quedará bloqueado en una posición intermedia (ver imagen B). Aun cuando el botón naranja esté bloqueado, puede seguir inhalando la última dosis. Después de eso, el inhalador Genuair no se puede volver a utilizar y debe empezar a usar un nuevo inhalador Genuair.
Bloqueado

IMAGEN B
Anexo IV
Conclusiones científicas y motivos por los que se recomienda la modificación de las condiciones de las autorizaciones de comercialización
Conclusiones científicas
Teniendo en cuenta el informe de evaluación del Comité para la evaluación de Riesgos en Farmacovigilancia (PRAC) del IPS para bromuro de aclidinio/formoterol fumarato dihidrato, las conclusiones científicas del Comité de Medicamentos de Uso Humano (CHMP) son las siguientes:
El Titular de la Autorización de Comercialización (TAC) ha propuesto añadir “reacción anafiláctica” y “estomatitis” en la sección 4.8 de la Ficha Técnica.
Se han notificado casos de reacción anafiláctica en ensayos clínicos con budesónida/formoterol o con sus mono-componentes en monoterapia en inhaladores separados usados en los mismos días por el mismo paciente. Se ha notificado un caso pos comercialización de shock anafiláctico sin desenlace mortal con bromuro de aclidinio/formoterol fumarato durante el periodo de notificación. Se ha notificado reacción anafiláctica durante la vigilancia posterior a la comercialización de bromuro de aclidinio y budesónida/formoterol. Teniendo en cuenta esta información, el PRAC considera aceptable añadir en la sección 4.8 de la Ficha Técnica de bromuro de aclidinio/formoterol fumarato dihidrato el efecto adverso “reacción anafiláctica” (con frecuencia no conocida).
Teniendo en cuenta que la estomatitis se incluye para aclidinio en monoterapia como poco frecuente y que se han notificado en ensayos clínicos y seguimiento pos-autorización una serie de casos de estomatitis relacionados con el bromuro de aclidinio/formoterol fumarato dihidrato, es aceptable la propuesta de incluir la estomatitis en la sección 4.8 de la Ficha Técnica para bromuro de aclidinio/formoterol fumarato dihidrato con la misma frecuencia que se ha notificado en la Ficha Técnica de aclidinio en monoterapia (poco frecuente).
Por lo tanto, a la vista de los datos presentados en los IPS revisados, el PRAC consideró que los cambios en la información del producto de los medicamentos que contienen bromuro de aclidinio/formoterol fumarato dihidrato estaban justificados.
El CHMP está de acuerdo con las conclusiones científicas del PRAC.
Motivos para la modificación de los términos de las Autorizaciones de Comercialización
De acuerdo con las conclusiones científicas para bromuro de aclidinio/formoterol fumarato dihidrato, el CHMP considera que el balance beneficio-riesgo del medicamento o medicamentos que contienen bromuro de aclidinio/formoterol fumarato dihidrato no se modifica, sujeto a los cambios propuestos en la información del producto.
El CHMP recomienda que se modifiquen las condiciones de la Autorización de Comercialización.
38