Drytec
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. DENOMINACIÓN DEL MEDICAMENTO
DRYTEC
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
El nucleido padre se presenta como:
Molibdato (99Mo) de sodio 2,5-100GBq/generador
en la fecha y hora de calibración
El nucleido hijo se presenta como:
Pertecnetato (99mTc) de sodio Variable
La cantidad de solución inyectable de pertecnetato (99mTc) de sodio Ph.Eur. que puede ser eluido de un generador en un momento dado, depende de la cantidad de molibdato (99Mo) de sodio presente, del volumen de eluato obtenido, y del intervalo de tiempo transcurrido desde la elución previa.
El tecnecio-99m (99mTc) es producido mediante un generador de (99Mo/"mTc) y se desintegra por emisión de radiación gamma con una energía media de 140keV y un periodo de semidesintegración de 6,02 horas, a tecnecio-99 (99Tc) que, en vista de su periodo de semidesintegración prolongada de 2,13 x 105 años, puede ser considerado como casi estable.
Lista de excipientes, en 6.1.
3. FORMA FARMACÉUTICA
Generador de radionucleido.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Este medicamento es únicamente para uso diagnóstico.
El eluato del generador (Solución inyectable de pertecnetato (99mTc) de sodio, Ph.Eur.) puede utilizarse como reactivo para el radiomarcaje de varios compuestos portadores suministrados como equipos, o bien para administración directa in vivo.
Cuando se administra por vía intravenosa, la solución estéril de pertecnetato (99mTc) de sodio se utiliza como ayuda diagnóstica en los siguientes procedimientos:
a) Gammagrafía tiroidea: obtención directa de imágenes y medida de la captación tiroidea
para obtener información sobre el tamaño, la posición, la nodularidad y la función de la glándula en la enfermedad tiroidea.
b) Gammagrafía salival: evaluación de la función de las glándulas salivares y del estado del conducto.
c) Localización de mucosa gástrica ectópica: divertículo de Meckel.
d) Gammagrafía cerebral: para identificar fisuras en la barrera hematoencefálica causadas por un tumor, un infarto, una hemorragia o un edema, cuando no se dispone de otro método.
Cuando se utiliza junto con un tratamiento previo de un agente reductor que permita el marcaje de los hematíes con tecnecio-99m (99mTc):
e) Gammagrafía cardíaca y vascular:
- angiocardiogammagrafía para:
* evaluación de la fracción de eyección ventricular.
* evaluación de la motilidad global y regional de la pared cardiaca.
* obtención de imágenes de fase miocárdica.
- obtención de imágenes de perfusión de órganos o anormalidades vasculares.
f) Diagnóstico y localización de hemorragia gastrointestinal oculta
Después de una instilación de pertecnetato (99mTc) de sodio en el ojo.
g) Gammagrafía del conducto lagrimal: evaluación del estado de los conductos lagrimales.
4.2 Posología y forma de administración
El pertecnetato (99mTc) de sodio se administra por vía intravenosa u oftálmica dependiendo del tipo de exploración que se realice, con actividades que varían considerablemente conforme a la información clínica que se busca y al equipo utilizado. En determinadas indicaciones, puede ser necesario el tratamiento previo de los pacientes con agentes bloqueantes del tiroides o agentes reductores.
Las actividades recomendadas son las siguientes:
Adultos y ancianos:
Gammagrafía tiroidea: 18,5-80MBq
Gammagrafía realizada 20 minutos después de la inyección intravenosa.
Gammagrafía salival: 40MBq
Gammagrafía realizada inmediatamente después de la inyección intravenosa y a intervalos regulares de hasta 15 minutos.
Gammagrafía del divertículo de Meckel: 400MBq
Gammagrafía realizada inmediatamente después de la inyección intravenosa y a intervalos regulares de hasta 30 minutos.
Gammagrafía cerebral: 370-800MBq
Imágenes secuenciales rápidas captadas inmediatamente, en el minuto que sigue a la administración intravenosa. Imágenes estáticas 1 a 4 horas más tarde. El tiroides y los plexos coroideos deben ser bloqueados con el fin de evitar la captación no específica de tecnecio-99m (99mTc).
Gammagrafía cardíaca y vascular: 740-925MBq
Los hematíes son marcados in vivo o in vitro con un tratamiento previo de un agente reductor. Las imágenes dinámicas se obtienen en el primer minuto después de la administración intravenosa, seguidas de imágenes regulares durante 30 minutos.
Hemorragia gastrointestinal: 740-925MBq
Los hematíes son marcados in vivo o in vitro con un tratamiento previo de un agente reductor. Las imágenes dinámicas se obtienen en el primer minuto después de la administración intravenosa, seguidas de imágenes regulares a intervalos adecuados de hasta 24 horas.
Gammagrafía del conducto lacrimal: 2-4MBq en cada ojo
Las gotas se instilan en el ojo y las imágenes dinámicas se captan durante 2 minutos, seguidas por imágenes estáticas a intervalos apropiados durante 20 minutos.
Niños:
La actividad que debe administrarse a niños puede calcularse a partir de la actividad recomendada para adultos, ajustada conforme al peso corporal o al área corporal.
Sin embargo, el Grupo de trabajo pediátrico de la Asociación Europea de Medicina Nuclear recomienda que la actividad administrada a un niño se calcule a partir del peso corporal conforme al cuadro siguiente:
Fracción de la dosis de adultos:
|
3 Kg = 0,1 |
22 Kg = 0,50 |
42 Kg = 0,78 |
|
4 Kg = 0,14 |
24 Kg = 0,53 |
44 Kg = 0,80 |
|
6 Kg = 0,19 |
26 Kg = 0,56 |
46 Kg = 0,82 |
|
8 Kg = 0,23 |
28 Kg = 0,58 |
48 Kg = 0,85 |
|
10 Kg = 0,27 |
30 Kg = 0,62 |
50 Kg = 0,88 |
|
12 Kg = 0,32 |
32 Kg = 0,65 |
52-54 Kg = 0,90 |
|
14 Kg = 0,36 |
34 Kg = 0,68 |
56-58 Kg = 0,92 |
|
16 Kg = 0,40 |
36 Kg = 0,71 |
60-62 Kg = 0,96 |
|
18 Kg = 0,44 |
38 Kg = 0,73 |
64-66 Kg = 0,98 |
|
20 Kg = 0,46 |
40 Kg = 0,76 |
68 Kg = 0,99 |
En niños muy pequeños (hasta 1 año), es necesaria una dosis mínima de 20MBq (10MBq en gammagrafía tiroidea) por administración directa, o de 80MBq para el marcaje de hematíes, para obtener imágenes de calidad suficiente.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a algunos de los excipientes.
4.4 Advertencias y precauciones especiales de empleo
Los radiofármacos deben ser utilizados exclusivamente por personal cualificado con la oportuna autorización gubernamental para el uso y manipulación de radionucleidos.
Este radiofármaco debe ser recibido, utilizado y administrado exclusivamente por personal autorizado en centros asistenciales autorizados. Su recepción, almacenamiento, utilización, transporte y eliminación están sujetos a las normas y/o licencias correspondientes de los organismos oficiales competentes locales.
Los radiofármacos deben ser preparados por el usuario de manera que cumplan con los requisitos de seguridad radiológica y de calidad farmacéutica. Se deben tomar las precauciones asépticas adecuadas, que satisfagan los requisitos de las Normas de Correcta Fabricación de Radiofármacos.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se han notificado interacciones farmacológicas en gammagrafía cerebral, donde puede presentarse una mayor captación de pertecnetato (99mTc) en las paredes de los ventrículos cerebrales como resultado de una ventriculitis inducida por metotrexato. En la obtención de imágenes abdominales, fármacos tales como la atropina, la isoprenalina y los analgésicos pueden producir un retraso en el vaciamiento gástrico y en la redistribución del pertecnetato.
4.6 Embarazo y lactancia
Se ha observado que el tecnecio-99m (99mTc) (como pertecnetato libre) atraviesa la barrera placentaria.
Cuando es necesaria la administración de un radiofármaco a una mujer en edad reproductora, debe buscarse siempre información sobre un posible embarazo. Toda mujer que presente retraso en la menstruación debe considerarse embarazada mientras no se demuestre lo contrario. En caso de duda, es fundamental que la exposición a la radiación sea la mínima necesaria para la obtención de la información clínica deseada. Debe considerarse la posibilidad de técnicas alternativas que no impliquen radiaciones ionizantes.
Los procedimientos con radionucleidos llevados a cabo en mujeres embarazadas implican además dosis de radiación al feto. Durante el embarazo, solo deben llevarse a cabo investigaciones estrictamente necesarias, cuando el beneficio probable supere el riesgo que corren madre y feto. La administración directa de 800MBq de pertecnetato (99mTc) de sodio a un paciente resulta en una dosis absorbida por el útero de 6,5mGy. Después de un tratamiento previo de los pacientes con un agente bloqueante, la administración de 800MBq de pertecnetato (99mTc) de sodio se traduce en una dosis absorbida por el útero de 5,3mGy. La administración de 925MBq de hematíes radiomarcados con tecnecio-99m (99mTc) resulta en una dosis absorbida por el útero de 4,3mGy. Las dosis que proporcionen más de 0,5mGy deben considerarse como un riesgo potencial para el feto.
Antes de administrar un radiofármaco a una madre que esta amamantando a su hijo, debe considerarse la posibilidad de retrasar razonablemente la investigación hasta que la madre haya terminado el período de lactancia, y plantearse si se ha hecho la elección más apropiada del radiofármaco, teniendo en cuenta la secreción de actividad en la leche materna. Si la administración se considera necesaria, la lactancia debe suspenderse durante 12 horas y la leche obtenida debe desecharse. La lactancia puede volver a reanudarse cuando los niveles de actividad en la leche no supongan una dosis de radiación para el niño superior a 1mSv.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han descrito efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Se han notificado reacciones alérgicas tras la inyección intravenosa de pertecnetato (99mTc) de sodio, que incluyen urticaria, edema facial, vasodilatación, prurito, arritmia cardíaca y coma.
Para cada paciente, la exposición a la radiación ionizante debe estar justificada en función del posible beneficio clínico. La actividad administrada debe ser tal que la dosis de radiación resultante sea la más baja que se pueda lograr razonablemente, considerando la necesidad de obtener el resultado diagnóstico o terapéutico deseado.
La exposición a las radiaciones ionizantes se encuentra vinculada a la inducción de cáncer y a una posibilidad potencial de desarrollo de defectos hereditarios. Para las investigaciones diagnósticas en medicina nuclear, las evidencias actuales indican que estos efectos adversos ocurrirán con una baja frecuencia dadas las bajas dosis de radiación involucradas.
Para la mayoría de los estudios diagnósticos que utilizan procedimientos de medicina nuclear, la dosis de radiación (DEE) es inferior a 20mSv. Dosis más altas pueden estar justificadas en determinadas circunstancias clínicas.
4.9 Sobredosis
Si se administrara una sobredosis de radiación con pertecnetato (99mTc) de sodio, la dosis absorbida debe disminuirse, cuando sea posible, aumentando la eliminación del radionucleido del cuerpo. Las medidas para reducir los posibles efectos negativos incluyen un vaciado frecuente de la orina y el estímulo de la diuresis y de la excreción fecal.
En el caso de una sobredosis accidental de hematíes marcados con tecnecio-99m (99mTc), pueden adoptarse muy pocos tratamientos, ya que la eliminación depende del proceso hemolítico normal.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Radiofármacos para diagnóstico Código ATC: V09F X01
No se ha observado actividad farmacológica en el rango de las dosis administradas con fines de diagnóstico.
Propiedades farmacocinéticas
5.2
El ión pertecnetato tiene una distribución biológica similar a la de los iones ioduro y perclorato, concentrándose temporalmente en las glándulas salivares, plexos coroideos, estómago (mucosa gástrica) y la glándula tiroidea, de donde es liberado en forma intacta. El ion pertecnetato tiende además a concentrarse en áreas con mayor vascularización o con una permeabilidad vascular anormal, en particular cuando un tratamiento previo con agentes bloqueantes inhibe la captación en las estructuras glandulares. El tecnecio-99m es excluido selectivamente del líquido cerebroespinal.
Después de una administración intravenosa, el pertecnetato (99mTc) se distribuye en todo el sistema vascular, del cual es eliminado por tres mecanismos principales:
* eliminación rápida, que depende del equilibrio de la difusión con respecto al fluido intersticial
* tasa intermedia de eliminación, que depende de la concentración de pertecnetato en los tejidos glandulares, principalmente en el tiroideo y salivar, así como en las glándulas del fundus gástrico que tienen un mecanismo de bombeo iónico
* eliminación lenta, mediante filtración glomerular por los riñones, que depende de la tasa de excreción urinaria.
El aclaramiento plasmático tiene un periodo de semidesintegración de aproximadamente 3 horas.
La excreción durante las primeras 24 horas que siguen a la administración es fundamentalmente urinaria (aproximadamente el 25%) y la excreción fecal tiene lugar en las 48 horas siguientes. Aproximadamente el 50% de la actividad administrada es excretada en las primeras 50 horas.
Cuando se inhibe la captación selectiva de pertecnetato (99mTc) en las estructuras glandulares mediante la administración previa de agentes bloqueantes, la excreción sigue las mismas vías, pero hay una tasa más alta de aclaramiento renal.
Cuando se administra pertecnetato (99mTc) en asociación con un tratamiento previo de agentes reductores, tales como medronato/estaño, que causan una "carga de estaño" en los hematíes, aproximadamente, hasta el 95% de la actividad administrada es captada por los hematíes y queda fijada al interior de las células. Cualquier pertecnetato (99mTc) no unido es eliminado por los riñones; la radiactividad en el plasma constituye normalmente menos del 5% de la actividad intravascular.
El destino que sigue el tecnecio-99m (99mTc) es el de los propios eritrocitos marcados, y la actividad es aclarada muy lentamente. Se supone que tiene lugar un pequeño nivel de elución de la actividad desde los hematíes circulantes.
5.3 Datos preclínicos sobre seguridad
a) No se dispone de información acerca de toxicidad aguda, subaguda o crónica a partir de la administración de dosis únicas o repetidas. La cantidad de pertecnetato (99mTc) de sodio administrado durante los procedimientos de diagnóstico clínico es muy baja y, excepto las reacciones alérgicas, no se han notificado otras reacciones adversas.
b) Toxicidad reproductiva
Se ha estudiado en ratones la transferencia a través de la placenta del tecnecio-99m (99mTc) a partir de pertecnetato (99mTc) de sodio administrado por vía intravenosa. El útero grávido contenía hasta 60% del tecnecio-99m (99mTc) inyectado cuando se administró sin una administración previa de perclorato. Los estudios realizados en ratones grávidos durante la gestación, durante la gestación y lactancia y durante la lactancia, muestran cambios en la progenie que incluyen reducción de peso, falta de pelo y esterilidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
El tecnecio-99m (99mTc) se genera a partir del molibdato (99mMo) adsorbido sobre una columna de alúmina. La columna del generador se eluye con una infusión intravenosa de cloruro sódico BP para producir el eluato, solución inyectable de pertecnetato (99mTc) de sodio, el cual contiene los siguientes excipientes:
Cloruro sódico.
Agua para inyectables.
6.2 Incompatibilidades
No hay incompatibilidades conocidas.
6.3 Periodo de validez
El período de validez del generador es de 24 días a partir de la fecha de fabricación. Las fechas y horas de calibración y caducidad están indicadas sobre la etiqueta del generador.
El eluato del generador, solución inyectable de pertecnetato (99mTc) de sodio, debe ser utilizado dentro de las 8 horas desde su elución.
6.4 Precauciones especiales de conservación
Tanto el generador como el eluato, solución inyectable de pertecnetato (99mTc) de sodio, deben conservarse a una temperatura no superior a 25°C. No congelar.
El almacenamiento debe realizarse conforme a la reglamentación nacional sobre materiales radiactivos.
6.5 Naturaleza y contenido del recipiente
El generador DRYTEC comprende una columna de vidrio de borosilicato neutro que contiene alúmina sobre la que está adsorbido el molibdato (99Mo) de sodio. La columna está sellada con un cierre de caucho natural, un cierre de goma pura y precinto de aluminio. El punzón de entrada con purga de aire está conectado a la parte superior de la columna por un tubo de silicona. La aguja de salida de acero inoxidable está conectada a un filtro de esterilización, el cual está conectado a la parte inferior de la columna mediante un tubo de silicona. Se suministran tres variantes del generador, que se diferencian en el diseño de la geometría de la columna y en los materiales de protección. El tipo de generador está indicado por el peso del mismo, que está indicado en la etiqueta del generador. La columna está rodeada por un blindaje de plomo (generador de 11 y 15 kg) o de uranio empobrecido y tungsteno (generador de 17 kg). Los componentes internos del generador se encuentran dentro de una carcasa de plástico duro equipado con un asa para su transporte.
Equipos de elución y accesorios
Equipo de elución que se proporciona con el generador
Con el generador se proporcionan los siguientes elementos:
. Viales de eluyente salino que contienen solución de cloruro sódico al 0,9 %
. Viales de elución a vacío para recoger el eluato del generador
. Protectores estériles del punzón de entrada - Para mantener la esterilidad del sistema del generador entre eluciones
. Protectores estériles de gomaespuma de la aguja de elución - Para mantener la esterilidad del sistema del generador entre las eluciones
. Agujas estériles de repuesto - para permitir al usuario sustituir las agujas de elución.
. Algodones sanitarios bactericidas de repuesto - para mantener asépticos los cierres de los viales de solución salina y los cierres de los viales de elución cuando se realizan las eluciones.
. Etiquetas de los viales de elución - para registrar actividad, volumen y hora de elución . Prospecto
Accesorios disponibles Viales de eluyente salino
Para permitir que el eluato del generador sea recogido a diferentes concentraciones radiactivas, el eluyente salino está disponible en una serie de volúmenes distintos.
Paquetes de viales que contienen solución de cloruro sódico al 0,9 %. Los viales están envasados en cajas.
Viales de elución a vacío
Los viales están envasados en cajas.
6.6 Precauciones especiales de eliminación
Para eluir el generador, se coloca un vial de infusión intravenosa de cloruro sódico BP sobre el punzón de entrada. El vial de solución salina es un vial de vidrio transparente sellado con un tapón de caucho y precinto de metal. La recogida del eluato, solución inyectable de pertecnetato (99mTc) de sodio, se consigue colocando en el puerto de elución un vial de elución a vacío estéril, que consta de un vial de vidrio transparente con un cierre de caucho y precinto de metal. Con el generador se pueden suministrar viales de eluyente salino disponibles en un rango de diferentes volúmenes.
La administración de radiofármacos supone un riesgo para otras personas por radiación externa o contaminación por gotas de orina, vómitos, etc. Deben aplicarse las reglamentaciones nacionales para materiales radiactivos, en cuanto a protección radiológica y eliminación de residuos.
Instrucciones para la elución del Generador Drytec
Manipulación segura
El peso del generador depende del blindaje utilizado. Los pesos aproximados son:
Generador blindado con un espesor de plomo de 45 mm = 11 kg Generador blindado con un espesor de plomo de 54 mm = 15 kg Generador con blindaje de uranio empobrecido = 17 kg
Deberá extremarse la precaución para levantar y transportar de forma segura los generadores. Para reducir el riesgo de daño causado por actividades de manipulación, deberán seguirse las reglamentaciones locales relativas a la seguridad en el trabajo
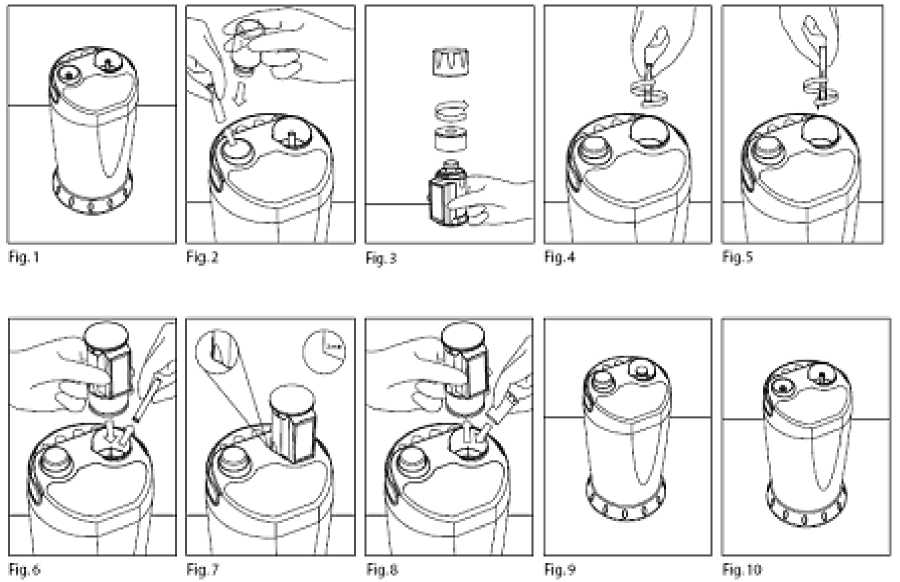
Instrucciones de Elución - Ver los gráficos adjuntos
Las instalaciones en las que se vaya a realizar el proceso de elución deben ajustarse a la reglamentación apropiada respecto a la seguridad en la manipulación radiológica. Para asegurar la esterilidad del eluato del generador, deberán utilizarse estrictas técnicas asépticas durante la elución del mismo. Para evitar un resultado insatisfactorio en la elución, es importante ajustarse a la siguiente secuencia de pasos.
Primera elución
1. Retirar el generador y los accesorios que lo acompañan de sus envases. Colocar el generador sobre una superficie horizontal y nivelada, en un lugar adecuadamente autorizado y protegido (Fig. 1). No retirar los protectores del punzón y de la aguja hasta que no se esté preparado para realizar la primera elución.
2. Seleccionar un vial de solución salina que contenga el volumen requerido.
3. Retirar el sobresello del vial de solución salina y limpiar el cierre del vial utilizando uno de los algodones bactericidas suministrados. Dejar secar.
4. Retirar el protector del punzón (Fig. 2).
5. Colocar el vial de solución salina en el punzón, asegurándose de que está completamente presionado hasta el fondo de la cavidad de entrada. Una pequeña rotación ayudará a la colocación del vial.
6. Seleccionar un vial de elución a vacío y limpiar el cierre del vial utilizando uno de los algodones bactericidas suministrados. Dejar secar. Antes de colocarlo dentro del blindaje del vial de elución, asegurarse de que las superficies del blindaje en contacto con el vial han sido limpiadas utilizando uno de los algodones bactericidas suministrados. Colocar de nuevo la tapa de cierre a rosca del blindaje tal y como se muestra en la Fig.3. La tapa del blindaje de elución que se ajusta a presión, no se requiere hasta que la elución se haya completado.
7. Retirar el protector del puerto de elución haciéndolo girar en sentido contrario a las agujas del reloj (Fig. 4). Aseguarse de que el filtro tipo “luer” queda unido al protector del puerto de elución al retirarlo. Guardar el protector del puerto de elución para su utilización cuando se devuelva el generador. Inmediatamente después, encajar (girando en el sentido de las agujas del reloj) una de las agujas de elución que se suministran en el equipo de accesorios (Fig. 5). No retirar el capuchón de la aguja de elución hasta que se esté preparado para colocar el vial de elución sobre la aguja.
8. Retirar el capuchón de la aguja de elución (Fig. 6) y colocar el blindaje con el vial de elución sobre la aguja, alineando el relieve lateral dentro de su guía, con la ventana transparente hacia el frente.
Presionar para asegurar que el vial se inserta completamente en la aguja de elución (Fig. 7).
9. Mantener el vial en esta posición durante 3 minutos para que se complete la elución. Se considera que la elución se ha completado cuando cesa totalmente el burbujeo dentro del vial de elución. No retirar el vial de solución salina, ni el vial de elución antes de que la elución se haya completado.
10. Retirar lentamente el blindaje con el vial de elución para prevenir el daño a la aguja de elución (Fig. 8), y volver a colocar la tapa que se ajusta a presión para aumentar la protección radiológica.
11. Seleccionar un nuevo protector de gomaespuma de la aguja de elución del equipo de accesorios y presionarlo sobre esta para preservar la esterilidad (Fig. 8).
12. Dejar el vial de solución salina vacío en la misma posición hasta la próxima elución para preservar la esterilidad (Fig. 9)
Eluciones posteriores
Repetir los pasos 5-12 utilizando un nuevo vial de solución salina con el volumen requerido.
Si la aguja de elución ha de ser cambiada, simplemente retirar (girando en sentido contrario a las agujas del reloj) la aguja dañada, limpiar el puerto de elución para asegurar que se mantiene la esterilidad, e insertar una nueva aguja. Colocar un protector de gomaespuma sobre la nueva aguja.
Transcurrido el periodo de validez, el generador deberá devolverse conforme a las instrucciones de devolución aprobadas. Deberán utilizarse un protector de repuesto del punzón y el protector del puerto de elución que se había guardado, para cubrir el punzón y el puerto de elución respectivamente (Fig. 10).
Volumen de elución y rendimiento de tecnecio-99m
Debido a las características de elución de los distintos diseños de la columna, se recomienda que el volumen de elución mínimo para los generadores blindados con plomo sea de 5 ml. Para los generadores blindados con uranio empobrecido, el volumen de elución mínimo deberá ser de 10 ml. Si se utilizan eluciones de 5 ml, se obtendrá una concentración radiactiva mayor, pero se puede esperar una pequeña reducción en el rendimiento.
DRYTEC está calibrado en función de la cantidad de molibdeno cargado en la columna. El tecnecio-99m (99mTc) disponible en un momento dado, depende del tiempo transcurrido antes o después de la fecha y hora de calibración (debido a la desintegración del molibdeno-99), del tiempo transcurrido desde la elución previa (debido al crecimiento del tecnecio-99m (99mTc) ) y de las características de desintegración del molibdeno-99 (del total de la desintegración, el 86% corresponde a tecnecio-99m (99mTc)). Para calcular la actividad de tecnecio-99m (99mTc) disponible, pueden usarse los factores enumerados en las Tablas 1 y 2, utilizándose el siguiente método.
En primer lugar, multiplicar la actividad de calibración expresada en la etiqueta por el factor apropiado de la Tabla 1 (que considera la desintegración de molibdeno-99). A continuación, multiplicar el producto por el factor apropiado de la Tabla 2 (que considera el crecimiento de tecnecio-99m (99mTc) y las características de desintegración del molibdeno-99).
El rendimiento real de tecnecio-99m (99mTc) variará ligeramente debido a la variación en la eficiencia de elución de un generador a otro. Normalmente, no deberá ser menor al 90% de la actividad de tecnecio-99m (99mTc) disponible.
Los residuos radiactivos deben eliminarse conforme a la legislación nacional sobre materiales radiactivos.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GE Healthcare Bio-Sciences, S.A.U.
C/ Gobelas, 35-37,La Florida (Madrid)
- 28023 - España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
65.219
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Febrero 2003
10. FECHA DE LA REVISIÓN DEL TEXTO
Abril 2009
DRYTEC es marca registrada de GE Healthcare Limited.
11. DOSIMETRÍA
Conforme al ICRP 80, las dosis de radiación absorbidas por los pacientes después de una administración directa de pertecnetato (99mTc) de sodio son las siguientes:
(i) Sin tratamiento previo con un agente bloqueante:
Dosis absorbida por unidad de actividad administrada __ (mGy/MBq)_
|
Órgano |
Adulto |
15 años |
10 años |
5 años |
1 año |
|
Glándulas adrenales |
3,7 10-03 |
4,7 10-03 |
7,2 10-03 |
1,1 10-02 |
1,9 10-02 |
|
Vejiga |
1,8 10-02 |
2,3 10-02 |
3,0 10-02 |
3,3 10-02 |
6,0 10-02 |
|
Superficie óseas |
5,4 10-03 |
6,6 10-03 |
9,7 10-03 |
1,4 10-02 |
2,6 10-02 |
|
Cerebro |
2,0 10-03 |
2,5 10-03 |
4,1 10-03 |
6,6 10-03 |
1,2 10-02 |
|
Mamas |
1,8 10-03 |
2,3 10-03 |
3,4 10-03 |
5,6 10-03 |
1,1 10-02 |
|
Vesícula biliar Tracto gastrointestinal |
7,4 10-03 |
9,9 10-03 |
1,6 10-02 |
2,3 10-02 |
3,5 10-02 |
|
Estómago |
2,6 10-02 |
3,4 10-02 |
4,8 10-02 |
7,8 10-02 |
1,6 10-01 |
|
Intestino delgado |
1,6 10-02 |
2,0 10-02 |
3,1 10-02 |
4,7 10-02 |
8,2 10-02 |
|
Colon |
4,2 10-02 |
5,4 10-02 |
8,8 10-02 |
1,4 10-01 |
2,7 10-01 |
|
Intestino grueso ascendente. |
5,7 10-02 |
7,3 10-02 |
1,2 10-01 |
2,0 10-01 |
3,8 10-01 |
|
Intestino grueso descendente. |
2,1 10-02 |
2,8 10-02 |
4,5 10-02 |
7.2 10-02 |
1,3 10-01 |
|
Corazón |
3,1 10-03 |
4,0 10-03 |
6,1 10-03 |
9,2 10-03 |
1,7 10-02 |
|
Riñones |
5,0 10-03 |
6,0 10-03 |
8,7 10-03 |
1,3 10-02 |
2,1 10-02 |
|
Hígado |
3,8 10-03 |
4,8 10-03 |
8,1 10-03 |
1,3 10-02 |
2,2 10-02 |
|
Pulmones |
2,6 10-03 |
3,4 10-03 |
5,1 10-03 |
7,9 10-03 |
1,4 10-02 |
|
Músculos |
3,2 10-03 |
4,0 10-03 |
6,0 10-03 |
9,0 10-03 |
1,6 10-02 |
|
Esófago |
2,4 10-03 |
3,2 10-03 |
4,7 10-03 |
7,5 10-03 |
1,4 10-02 |
|
Ovarios |
1,0 10-02 |
1,3 10-02 |
1,8 10-02 |
2,6 10-02 |
4,5 10-02 |
|
Páncreas |
5,6 10-03 |
7,3 10-03 |
1,1 10-02 |
1,6 10-02 |
2,7 10-02 |
|
Médula ósea roja |
3,6 10-03 |
4,5 10-03 |
6,6 10-03 |
9,0 10-03 |
1,5 10-02 |
|
Glándulas salivares |
9,3 10-03 |
1,2 10-02 |
1,7 10-02 |
2,4 10-02 |
3,9 10-02 |
|
Piel |
1,8 10-03 |
2,2 10-03 |
3,5 10-03 |
5,6 10-03 |
1,0 10-02 |
|
Bazo |
4,3 10-03 |
5,4 10-03 |
8,1 10-03 |
1,2 10-02 |
2,1 10-02 |
|
Testículos |
2,8 10-03 |
3,7 10-03 |
5,8 10-03 |
8,7 10-03 |
1,6 10-02 |
|
Timo |
2,4 10-03 |
3,2 10-03 |
4,7 10-03 |
7,5 10-03 |
1,4 10-02 |
|
Tiroides |
2,2 10-02 |
3,6 10-02 |
5,5 10-02 |
1,2 10-01 |
2,2 10-01 |
|
Útero |
8,1 10-03 |
1,0 10-02 |
1,5 10-02 |
2,2 10-02 |
3,7 10-02 |
|
Resto del organismo |
3,5 10-03 |
4,3 10-03 |
6,4 10-03 |
9,6 10-03 |
1,7 10-02 |
|
Dosis equivalente efectiva (mSv/MBq) |
1,3 10-02 |
1,7 10-02 |
2,6 10-02 |
4,2 10-02 |
7,9 10-02 |
(ii) Con tratamiento previo con un agente bloqueante:
Dosis absorbida por unidad de actividad administrada
(mGy/MBq)
|
Órgano |
Adulto |
15 años |
10 años |
5 años |
1 año |
|
Glándulas adrenales |
2,9 10-03 |
3,7 10-03 |
5,6 10-03 |
8,6 10-02 |
1,6 10-02 |
|
Vejiga |
3,0 10-02 |
3,8 10-02 |
4,8 10-02 |
5,0 10-02 |
9,1 10-02 |
|
Superficie óseas |
4,4 10-03 |
5,4 10-03 |
8,1 10-03 |
1,2 10-02 |
2,2 10-02 |
|
Cerebro |
2,0 10-03 |
2,6 10-03 |
4,2 10-03 |
7,1 10-03 |
1,2 10-02 |
|
Mamas |
1,7 10-03 |
2,2 10-03 |
3,2 10-03 |
5,2 10-03 |
1,0 10-02 |
|
Vesícula biliar Tracto gastrointestinal |
3,0 10-03 |
4,2 10-03 |
7,0 10-03 |
1,0 10-02 |
1,3 10-02 |
|
Estómago |
2,7 10-03 |
3,6 10-03 |
5,9 10-03 |
8,6 10-02 |
1,5 10-02 |
|
Intestino delgado |
3,5 10-03 |
4,4 10-03 |
6,7 10-03 |
1,0 10-02 |
1,8 10-02 |
|
Colon |
3,6 10-03 |
4,8 10-03 |
7,1 10-03 |
1,0 10-01 |
1,8 10-02 |
|
Intestino grueso ascendente. |
3,2 10-03 |
4,3 10-03 |
6,4 10-03 |
1,0 10-01 |
1,7 10-02 |
|
Intestino grueso descendente |
4,2 10-03 |
5,4 10-03 |
8,1 10-03 |
1,1 10-02 |
1,9 10-02 |
|
Corazón |
2,7 10-03 |
3,4 10-03 |
5,2 10-03 |
8,1 10-03 |
1,4 10-02 |
|
Riñones |
4,4 10-03 |
5,4 10-03 |
7,7 10-03 |
1,1 10-02 |
1,9 10-02 |
|
Hígado |
2,6 10-03 |
3,4 10-03 |
5,3 10-03 |
8,2 10-02 |
1,5 10-02 |
|
Pulmones |
2,3 10-03 |
3,1 10-03 |
4,6 10-03 |
7,4 10-03 |
1,3 10-02 |
|
Músculos |
2,5 10-03 |
3,1 10-03 |
4,7 10-03 |
7,2 10-03 |
1,3 10-02 |
|
Esófago |
2,4 10-03 |
3,1 10-03 |
4,6 10-03 |
7,5 10-03 |
1,4 10-02 |
|
Ovarios |
4,3 10-03 |
5,4 10-03 |
7,8 10-03 |
1,1 10-02 |
1,9 10-02 |
|
Páncreas |
3,0 10-03 |
3,9 10-03 |
5,9 10-03 |
9,3 10-02 |
1,6 10-02 |
|
Médula ósea roja |
2,5 10-03 |
3,2 10-03 |
4,9 10-03 |
7,2 10-03 |
1,3 10-02 |
|
Piel |
1,6 10-03 |
2.0 10-03 |
3.2 10-03 |
5,2 10-03 |
9,7 10-03 |
|
Bazo |
2,6 10-03 |
3,4 10-03 |
5,4 10-03 |
8,3 10-02 |
1,5 10-02 |
|
Testículos |
3,0 10-03 |
4,0 10-03 |
6,0 10-03 |
8,7 10-03 |
1,6 10-02 |
|
Timo |
2,4 10-03 |
3,1 10-03 |
4,6 10-03 |
7,5 10-03 |
1,4 10-02 |
|
Tiroides |
2,4 10-03 |
3,1 10-03 |
5,0 10-03 |
8,4 10-01 |
1,5 10-02 |
|
Útero |
6,0 10-03 |
7,3 10-03 |
1,1 10-02 |
1,4 10-02 |
2,3 10-02 |
|
Resto del organismo |
2,5 10-03 |
3,1 10-03 |
4,8 10-03 |
7,3 10-03 |
1,3 10-02 |
|
Dosis equivalente efectiva (mSv/MBq) |
4,2 10-03 |
5,4 10-03 |
7,7 10-03 |
1,1 10-02 |
1,9 10-02 |
La Dosis equivalente efectiva resultante de la administración de 800MBq de pertecnetato (99mTc) de sodio es de 10,4mSv. Después del tratamiento previo de los pacientes con un agente bloqueante, la administración de 800MBq de pertecnetato (99mTc) de sodio resulta en una Dosis equivalente efectiva de 4,24mSv.
Las Dosis de radiación absorbidas por un paciente tras la administración intravenosa de hematíes marcados con tecnecio-99m (99mTc), son las siguientes:
Dosis absorbida por unidad de actividad administrada ___(mGy/MBq)
|
Órgano |
Adulto |
15 años |
10 años |
5 años |
1 año |
|
Glándulas adrenales |
9,9 10-03 |
1,2 10-02 |
2,0 10-02 |
3,0 10-02 |
5.6 10-02 |
|
Vejiga |
8,5 10-03 |
1,1 10-02 |
1,4 10-02 |
1,7 10-02 |
3,1 10-02 |
|
Superficie óseas |
7,4 10-03 |
1,2 10-02 |
1,9 10-02 |
3,6 10-02 |
7,4 10-02 |
|
Cerebro |
3,6 10-03 |
4,6 10-03 |
7,5 10-03 |
1,2 10-02 |
2,2 10-02 |
|
Mamas |
3,5 10-03 |
4,1 10-03 |
7,0 10-03 |
1,1 10-02 |
1,9 10-02 |
|
Vesícula biliar Tracto gastrointestinal |
6,5 10-03 |
8,1 10-03 |
1,3 10-02 |
2,0 10-02 |
3,0 10-02 |
|
Estómago |
4,6 10-03 |
5,9 10-03 |
9,7 10-03 |
1,4 10-02 |
2,5 10-02 |
|
Intestino delgado |
3,9 10-03 |
4,9 10-03 |
7,8 10-03 |
1,2 10-02 |
2,1 10-02 |
|
Colon |
3,7 10-03 |
4,8 10-03 |
7,5 10-03 |
1,2 10-02 |
2,0 10-02 |
|
Intestino grueso ascendente |
4,0 10-03 |
5,1 10-03 |
8,0 10-03 |
1,3 10-02 |
2,2 10-02 |
|
Intestino grueso descendente |
3,4 10-03 |
4,4 10-03 |
6,9 10-03 |
1,0 10-02 |
1,8 10-02 |
|
Corazón |
2,3 10-02 |
2,9 10-02 |
4,3 10-02 |
6,6 10-02 |
1,1 10-01 |
|
Riñones |
1,8 10-02 |
2,2 10-02 |
3,6 10-02 |
5,7 10-02 |
1,1 10-01 |
|
Hígado |
1,3 10-02 |
1,7 10-02 |
2,6 10-02 |
4,0 10-02 |
7,2 10-02 |
|
Pulmones |
1,8 10-02 |
2,2 10-02 |
3,5 10-02 |
5,6 10-02 |
1,1 10-01 |
|
Músculos |
3,3 10-03 |
4,0 10-03 |
6,1 10-03 |
9,4 10-03 |
1,7 10-02 |
|
Esófago |
6,1 10-03 |
7,0 10-03 |
9,8 10-03 |
1,5 10-02 |
2,3 10-02 |
|
Ovarios |
3,7 10-03 |
4,8 10-03 |
7,0 10-03 |
1,1 10-02 |
1,9 10-02 |
|
Páncreas |
6,6 10-03 |
8,1 10-03 |
1,3 10-02 |
1,9 10-02 |
3,3 10-02 |
|
Médula ósea roja |
6,1 10-03 |
7,6 10-03 |
1,2 10-02 |
2,0 10-02 |
3,7 10-02 |
|
Piel |
2.0 10-03 |
2,4 10-03 |
3,8 10-03 |
6,2 10-03 |
1,2 10-02 |
|
Bazo |
1,4 10-02 |
1,7 10-02 |
2,7 10-02 |
4,3 10-02 |
8,1 10-02 |
|
Testículos |
2,3 10-03 |
3,0 10-03 |
4,4 10-03 |
6,9 10-03 |
1,3 10-02 |
|
Timo |
6,1 10-03 |
7,0 10-03 |
9,8 10-03 |
1,5 10-02 |
2,3 10-02 |
|
Tiroides |
5,7 10-03 |
7,1 10-03 |
1,2 10-02 |
1,9 10-02 |
3,6 10-02 |
|
Útero |
3,9 10-03 |
4,9 10-03 |
7,4 10-03 |
1,1 10-02 |
1,9 10-02 |
|
Resto del organismo |
3,5 10-03 |
4,5 10-03 |
7,3 10-03 |
1,3 10-02 |
2,3 10-02 |
|
Dosis equivalente efectiva (mSv/MBq) |
7,0 10-03 |
8,9 10-03 |
1,4 10-02 |
2,1 10-02 |
3,9 10-02 |
La dosis equivalente efectiva resultante de la administración de 925MBq de hematíes marcados con tecnecio-99m (99mTc), es de 7,86mSv.
(iv) La dosis de radiación absorbida por el cristalino tras la administración de pertecnetato (99mTc) de
sodio por gammagrafía del conducto lacrimal, se estima en 0,038mGy/MBq. Esto resulta en una dosis equivalente efectiva de menos de 0,01mSv por una actividad administrada de 4MBq.
GMT Días a partir de la hora de calibración
del generador
(hrs) -10 -9 -8 -7 -6 -5 -4 -3 -2
2.00 13,81 10,73 8,343 6,484 5,039 3,916 3,044 2,366 1,838
4.00 13,52 10,51 8,169 6,349 4,934 3,835 2,980 2,316 1,800
6.00 13,24 10,29 8,000 6,217 4,832 3,755 2,919 2,268 1,763
8.00 12,96 10,07 7,833 6,088 4,731 3,677 2,858 2,221 1,726
10.00 12,69 9,869 7,670 5,961 4,633 3,601 2,798 2,175 1,690
12.00 12,43 9,664 7,511 5,837 4,537 3,526 2,740 2,130 1,655
14.00 12,17 9,463 7,355 5,716 4,442 3,453 2,683 2,085 1,621
16.00 11,92 9,267 7,202 5,597 4,350 3,381 2,628 2,042 1,587
18.00 11,67 9,074 7,052 5,481 4,260 3,311 2,573 2,000 1,554
20.00 11,43 8,885 6,906 5,367 4,171 3,242 2,519 1,958 1,522
22.00 11,19 8,701 6,762 5,255 4,084 3,174 2,467 1,917 1,490
-1 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
1,429 1,110 0,863 0,670 0,521 0,405 0,315 0,244 0,190 0,147 0,114 0,089 0,069 0,054 0,041 0,032 1739530839934096 1,399 1,087 0,845 0,657 0,510 0,396 0,308 0,239 0,186 0,144 0,112 0,087 0,068 0,052 0,041 0,031 4630 6947385508 1 9
1,370 1,065 0,827 0,643 0,500 0,388 0,302 0,234 0,182 0,141 0,110 0,085 0,066 0,051 0,040 0,031 4083 0607482667 2 3
1,341 1,042 0,810 0,630 0,489 0,380 0,295 0,229 0,178 0,138 0,107 0,083 0,065 0,050 0,039 0,030 9950 6579689927 4 6
1,314 1,021 0,793 0,616 0,479 0,372 0,289 0,225 0,174 0,136 0,105 0,082 0,063 0,049 0,038 0,030 0279466190718660 1,286 1,000 0,777 0,604 0,469 0,364 0,283 0,220 0,171 0,133 0,103 0,080 0,062 0,048 0,037 0,029 7020596431545683 1,259 0,979 0,761 0,591 0,459 0,357 0,277 0,215 0,167 0,130 0,101 0,078 0,061 0,047 0,037 0,028 9205 7378743726 0 7
1,233 0,958 0,745 0,579 0,450 0,349 0,271 0,211 0,164 0,127 0,099 0,077 0,059 0,046 0,036 0,028 7922299327219621 1,208 0,938 0,729 0,567 0,440 0,342 0,266 0,206 0,160 0,125 0,097 0,075 0,058 0,045 0,035 0,027 1972863980257645 1,183 0,919 0,714 0,555 0,431 0,335 0,260 0,202 0,157 0,122 0,095 0,073 0,057 0,044 0,034 0,027 0464 6576541957 7 0
1,158 0,900 0,699 0,543 0,422 0,328 0,255 0,198 0,154 0,119 0,093 0,072 0,056 0,043 0,034 0,026 4378 7534292437 0 4
1,134 0,881 0,685 0,532 0,413 0,321 0,250 0,194 0,151 0,117 0,091 0,070 0,055 0,042 0,033 0,025 3625970304291839
Tabla 2.
|
Horas |
Factor |
Horas |
Factor |
Horas |
Factor |
Horas |
Factor |
Horas |
Factor |
Horas |
Factor |
|
1 |
0,094 |
9 |
0,579 |
17 |
0,788 |
25 |
0,879 |
33 |
0,918 |
41 |
0,935 |
|
2 |
0,179 |
10 |
0,615 |
18 |
0,804 |
26 |
0,884 |
34 |
0,921 |
42 |
0,937 |
|
3 |
0,256 |
11 |
0,648 |
19 |
0,818 |
27 |
0,892 |
35 |
0,924 |
43 |
0,938 |
|
4 |
0,324 |
12 |
0,678 |
20 |
0,831 |
28 |
0,898 |
36 |
0,926 |
44 |
0,940 |
|
5 |
0,386 |
13 |
0,705 |
21 |
0,843 |
29 |
0,903 |
37 |
0,929 |
45 |
0,941 |
|
6 |
0,442 |
14 |
0,729 |
22 |
0,853 |
30 |
0,907 |
38 |
0,930 |
46 |
0,941 |
|
7 |
0,492 |
15 |
0,751 |
23 |
0,863 |
31 |
0,911 |
39 |
0,932 |
47 |
0,941 |
|
8 |
0,538 |
16 |
0,771 |
24 |
0,871 |
32 |
0,915 |
40 |
0,934 |
48 |
0,942 |
Mayo 2009