Donepezilo Sandoz 5 Mg Laminas Bucodispersables Efg
•4^
sm
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Donepezilo Sandoz 5 mg láminas bucodispersables EFG Donepezilo Sandoz 10 mg láminas bucodispersables EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Donepezilo Sandoz 5 mg:
Cada lámina bucodispersable contiene 5 mg de donepezilo hidrocloruro.
Excipiente(s) con efecto conocido: cada lámina bucodispersable contiene 0,48 mg de sucralosa.
Este medicamento contiene pequeñas cantidades de etanol (alcohol), inferiores a 100 mg por dosis.
Donepezilo Sandoz 10mg:
Cada lámina bucodispersable contienen 10 mg de donepezilo hidrocloruro.
Excipiente(s) con efecto conocido: cada lámina bucodispersable contiene 0,96 mg de sucralosa.
Este medicamento contiene pequeñas cantidades de etanol (alcohol), inferiores a 100 mg por dosis.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Lámina bucodispersable.
Donepezilo Sandoz 5 mg: son de color blanco a ligeramente amarillo, rectangulares (3 cm2) y flexibles. Donepezilo Sandoz 10 mg: son de color blanco a ligeramente amarillo, rectangulares (6 cm2) y flexibles.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Donepezilo es está indicado para el tratamiento sintomático de la enfermedad de Alzheimer de leve a moderadamente grave.
4.2 Posología y forma de administración
Adultos/Pacientes de edad avanzada:
El tratamiento se inicia con 5 mg/día (administrados en una sola dosis al día). Las láminas bucodispersables se deben administrar por vía oral, por la noche, inmediatamente antes de acostarse. La lámina debe situarse en la lengua donde se disolverá rápidamente con o sin agua, conforme prefiera el paciente. Ver a continuación “Instrucciones para el uso de las láminas bucodispersables”. La dosis de 5 mg/día se debe mantener durante al menos un mes, con el fin de permitir evaluar las primeras respuestas clínicas al tratamiento y para permitir que se alcancen las concentraciones del estado estable de hidrocloruro de donepezilo. Tras la evaluación clínica del tratamiento con 5 mg/día durante un mes, la dosis puede incrementarse hasta 10 mg (administrados en una sola dosis al día). La dosis diaria máxima recomendada es de 10 mg. Dosis mayores de 10 mg/día no han sido estudiadas en los ensayos clínicos. El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el diagnóstico y en el tratamiento de la demencia de Alzheimer. El diagnóstico se debe realizar de acuerdo a las directrices aceptadas (por ejemplo, el DSM IV, CIE 10). El tratamiento con donepezilo se debe iniciar únicamente si un cuidador está disponible el cual controlará regularmente la toma del medicamento por parte del paciente. El tratamiento de mantenimiento puede continuar durante todo el tiempo como un beneficio terapéutico para el paciente.
- m •

ÍTT1
Por lo tanto, el beneficio clínico de donepezilo debe ser reevaluado en forma regular. Debe considerarse la interrupción cuando la evidencia de un efecto terapéutico ya no está presente. La respuesta individual a donepezilo no se puede predecir.
Tras la interrupción del tratamiento se ha observado una reducción gradual de los efectos beneficiosos de donepezilo.
Insuficiencia renal y hepática:
Se puede seguir una pauta de dosis similar en pacientes con insuficiencia hepática de intensidad leve a moderada o con insuficiencia renal.
Se observa un daño hepatico de medio a moderado debido a un incremento en la exposición (ver sección 5.2), el aumento de la dosis se debe realizar de acuerdo a la tolerancia individual. No existen datos en
pacientes con insuficiencia hepática grave.
Niños y adolescentes:
No se recomienda el uso de donepezilo en niños y adolescentes menores de 18 años.
Instrucciones para el uso de las láminas bucodispersables Importante: no utilice las láminas con las manos mojadas.
a) Coja el sobre, a la altura de la marca con forma de flecha por la zona de los lados cortos y sujete el sobre mirando hacia esa cara. El sobre no esta sellado en esa zona.
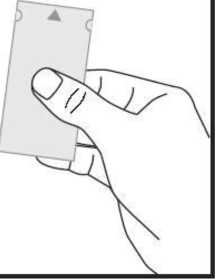
b) Suavemente separe ambas partes del sobre por la marca con forma de flecha. De esta manera puede sujetar ambas partes con la ayuda de sus dedos gordo e índice de cada mano.
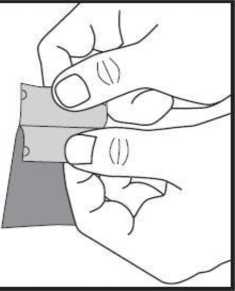
c) Cuidadosamente tire de ambas partes del sobre en direcciones opuestas hasta su separación. La lámina bucodispersable aparecerá en una de las partes del sobre.
Agencia es pañosa de medicamentos y oroouctos saratanos
.<3f.
-'lili'--'-
sm
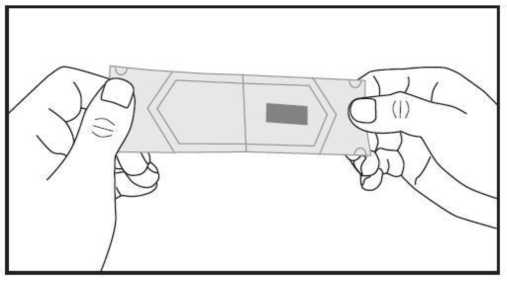
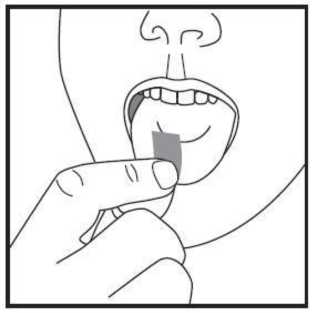
d) Coja la lámina bucodispersable con las manos secas y colóquesela en la lengua directamente. Rápidamente se disolverá y podrá tragarse fácilmente. Puede utilizar agua si lo desea.
4.3 Contraindicaciones
Hipersensibilidad a hidrocloruro de donepezilo, a derivados de la piperidina o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
No se ha investigado el uso de donepezilo en pacientes con demencia de Alzheimer grave, con otros tipos de demencia, ni con otros tipos de deterioro de la memoria (p.ej.: deterioro cognitivo asociado al envejecimiento).
Anestesia:
Donepezilo, como inhibidor de la colinesterasa, es probable que acentúe la relajación muscular tipo succinilcolina durante la anestesia.
Procesos Cardiovasculares:
Debido a su acción farmacológica, los inhibidores de la colinesterasa pueden tener efectos vagotónicos sobre la frecuencia cardiaca (por ejemplo, bradicardia). El potencial para esta acción puede ser particularmente importante en pacientes con “enfermedad del seno” u otras alteraciones de la conducción cardiaca supraventricular, tales como bloqueo sinoauricular o auriculoventricular.
Se han notificado casos de síncope y de convulsiones. Al investigar a estos pacientes se debe tener en cuenta la posibilidad de bloqueo cardíaco y pausas sinusales prolongadas.
Procesos Gastrointestinales:
Los pacientes con un mayor riesgo de desarrollar úlceras, por ejemplo, aquellos con antecedentes de enfermedad ulcerosa, o aquellos que estén recibiendo medicamentos antiinflamatorios no esteroideos
¿iliii’i;
(AINEs) de forma concomitante, deben ser controlados en cuanto a sus síntomas. Sin embargo, los estudios clínicos con donepezilo no demostraron un incremento, relacionados con placebo, en la incidencia de úlceras pépticas o de hemorragias gastrointestinales.
Aparato Genitourinario:
Aunque no se ha observado en los ensayos clínicos con donepezilo, los colinomiméticos pueden causar la obstrucción del flujo de salida de la vejiga.
Procesos Neurológicos:
Convulsiones: se cree que los colinomiméticos tienen cierto potencial para causar convulsiones generalizadas. Sin embargo, las convulsiones pueden ser también una manifestación de la enfermedad de Alzheimer.
Los colinomiméticos pueden tener la capacidad de exacerbar o inducir síntomas extrapiramidales.
Síndrome maligno neuroléptico (SMN): SMN es un proceso que pone la vida en peligro caracterizado por hipertermia, rigidez muscular, inestabilidad autonómica, consciencia alterada y niveles incrementados de creatinina fosfoquinasa sérica, se han detectado muy rara vez en asociación con donepezilo, particularmente en pacientes que están recibiendo simultáneamente antipsicóticos. Signos adicionales pueden incluir mioglobinuria (rabdomiolisis) y fallo renal agudo. Si el paciente desarrolla signos y síntomas indicativos de SMN, o presenta una fiebre alta inexplicada sin manifestaciones clínicas adicionales de SMN, debe interrumpirse el tratamiento.
Procesos Pulmonares:
Debido a sus acciones colinomiméticas, los inhibidores de la colinesterasa deben ser prescritos con precaución a pacientes con antecedentes de asma o de enfermedad pulmonar obstructiva.
Debe evitarse la administración de donepezilo concomitantemente con otros inhibidores de la acetilcolilnesterasa, agonistas o antagonistas del sistema colinérgico.
Daño hepático grave:
No existen datos respecto a los pacientes que sufren un daño hepático grave.
Mortalidad en los Ensayos Clínicos sobre Demencia Vascular:
Se realizaron tres ensayos clínicos de 6 meses de duración para evaluar individuos que cumplieron los criterios NINDS-AIREN de probable o posible demencia vascular (VaD).
Los criterios NINDS-AIREN se han diseñado para identificar a los pacientes cuya demencia parece ser debida únicamente a causas vasculares y para excluir a los pacientes con la enfermedad de Alzheimer.
En el primer estudio, las tasas de mortalidad fueron 2/198 (1,0%) con hidrocloruro de donepezilo 5 mg, 5/206 (2,4%) con hidrocloruro de donepezilo 10 mg y 7/199 (3,5%) con placebo. En el segundo estudio, las tasas de mortalidad fueron 4/208 (1,9%) con hidrocloruro de donepezilo 5 mg, 3/215 (1,4%) con hidrocloruro de donepezilo 10 mg y 1/193 (0,5%) con placebo. En el tercer estudio, las tasas de mortalidad fueron 11/648 (1,7%) con hidrocloruro de donepezilo 5 mg y 0/326 (0%) con placebo. La tasa de mortalidad para los tres estudios VaD combinados en el grupo de hidrocloruro de donepezilo (1,7%) fue numéricamente mayor que en el grupo de placebo (1,1%). Sin embargo, esta diferencia no fue estadísticamente significativa. La mayoría de las muertes en los pacientes que tomaron hidrocloruro de donepezilo o placebo parecen ser el resultado de varias causas vasculares relacionadas que se podrían esperar en esta población anciana con enfermedad vascular subyacente. Un análisis de todos los acontecimientos vasculares no mortales y mortales graves no mostró ninguna diferencia en la incidencia en el grupo de hidrocloruro de donepezilo con relación a placebo.
En los estudios combinados para la enfermedad de Alzheimer (n=4146), y cuando estos estudios fueron combinados con los de demencia, que incluyeron los estudios de demencia vascular (total n=6888), la tasa de mortalidad en los grupos de placebo superó numéricamente a la tasa en los grupos de hidrocloruro de donepezilo.
Advertencias sobre excipientes
Donepezilo láminas bucodispersables contiene sucralosa, que es un derivado de la sacarosa. Los pacientes con intolerancia hereditaria a la fructosa, malabsorción de glucosa o galactosa, o insuficiencia de sacarasa-isomaltasa, no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
• Hidrocloruro de donepezilo y/o cualquiera de sus metabolitos no inhiben el metabolismo de teofilina, warfarina, cimetidina, digoxina, en humanos. La administración concomitante de digoxina, cimetidina, no afecta al metabolismo de hidrocloruro de donepezilo.
• Estudios in vitro han demostrado que las isoenzimas 3A4 del citocromo P450 y en menor proporción la 2D6 están involucradas en el metabolismo de hidrocloruro de donepezilo. Los estudios de interacción del medicamento llevados a cabo in vitro demuestran que ketoconazol y quinidina, inhibidores de la CYP3A4 y de la 2D6 respectivamente, inhiben el metabolismo de donepezilo. Por lo tanto, éstos y otros inhibidores de la CYP3A4, como itraconazol y eritromicina, y los inhibidores de la CYP2D6, como fluoxetina podrían inhibir el metabolismo de donepezilo.
• En un estudio en voluntarios sanos, ketoconazol incrementó las concentraciones medias de donepezilo en un 30% aproximadamente.
• Los inductores de enzimas, como rifampicina, fenitoína, carbamazepina y alcohol pueden reducir los niveles de hidrocloruro de donepezilo. Puesto que la magnitud de un efecto de inhibición o inducción es desconocida, las asociaciones de dichos medicamentos deben ser utilizadas con precaución.
• Hidrocloruro de donepezilo potencialmente puede interferir con medicamentos que presenten actividad anticolinérgica. También tiene el potencial de actividad sinérgica con tratamientos concomitantes tales como succinilcolina, otros medicamentos bloqueantes neuromusculares o agonistas colinérgicos o medicamentos beta bloqueantes que tienen efectos sobre la conducción cardiaca.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos adecuados relativos al uso de donepezilo en mujeres embarazadas.
Los estudios realizados en animales no han demostrado efecto teratogénico, pero han mostrado toxicidad peri y post natal (ver sección 5.3). El riesgo potencial en humanos es desconocido.
Donepezilo no se debería utilizar durante el embarazo excepto si fuese claramente necesario.
Lactancia
Donepezilo es excretado a traves de la leche en las ratas.Se desconoce si hidrocloruro de donepezilo se excreta en la leche materna humana y no se han realizado estudios en mujeres en período de lactancia.
Por tanto, las mujeres que estén tomando hidrocloruro de donepezilo no deben proporcionar lactancia natural.
Fertilidad
En los estudios realizados en animales, no se ha observado efectos sobre la fertilidad (ver sección 5.3), sin embargo no se dispone de datos de los efectos sobre la fertilidad en humanos.
rj$k
an
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La enfermedad de Alzheimer puede provocar un deterioro gradual de la capacidad de conducción o comprometer la capacidad de utilizar máquinas. Además, donepezilo puede provocar mareos y somnolencia, principalmente cuando se inicia el tratamiento o al aumentar la dosis. La influencia de donepezilo sobre la capacidad para conducir y utilizar máquinas es leve o moderada. Por tanto, el médico evaluará regularmente la capacidad de los pacientes con demencia para seguir conduciendo o manejando maquinaria compleja.
4.8 Reacciones adversas
Las reacciones adversas más frecuentes son: diarrea, calambres musculares, fatiga, náuseas, vómitos e insomnio.
A continuación se relacionan las reacciones adversas que se han notificado en más de un solo caso aislado ordenadas por sistema de órganos y frecuencia. Las frecuencias se definen como:
Muy frecuentes (>1/10).
Frecuentes (>1/100 a <1/10).
Poco frecuentes (>1/1.000 a <1/100).
Raras (>1/10.000 a <1/1.000).
Muy raras (<1/10.000).
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clase de sistema de organos |
Muy F recuentes |
F recuentes |
Poco frecuentes |
Raras |
Muy raras |
|
Infecciones e infectaciones |
Resfriado común | ||||
|
Trastornos de metabolismo y de la nutrición |
Anorexia | ||||
|
Trastornos psiquiátricos |
alucinaciones* * Agitación** Conducta agresiva** Sueños extraños y pesadillas** | ||||
|
Trastornos del sistema nervioso |
Sincope* Mareos Insomnio |
Convulsiones * |
Sintomas Extrapiramid ales |
Síndrome neuroléptico maligno | |
|
Trastornos cardiacos |
Bradicardia |
Bloqueo sinoauricular Bloqueo auriculoventri cular | |||
|
Trastornos gastrointestinales |
Diarrea Nauseas |
Vómitos Molestias abdominales |
Hemorragia gastrointestin al Úlcera gástrica y duodenal | ||
|
Trastornos hepatobiliares |
Disfunción hepatica que |
|
incluye hepatitis *** | |||||
|
Trastornos de la piel y tejido subcutaneo |
Erupción Prurito | ||||
|
Trastornos musculoesqueleticos y del tejido conjuntivo |
Calambres musculares | ||||
|
Trastornos renales y urinarios |
Incontienencia urinaria | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
Dolor de cabeza |
Fatiga Dolor | |||
|
Exploraciones complementarias |
Pequeño incremento en la concentració n sérica de la creatininquin asa muscular | ||||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos |
Accidentes |
* En la investigación en pacientes con episodios de síncope o de convulsiones, se debería considerar la posibilidad de aparición de bloqueo cardiaco o pausas sinusales prolongadas (ver seccion 4.4)
**Los casos de alucinaciones, sueños extraños y pesadillas **, agitación y conducta agresiva se han resuelto al reducir la dosis o interrumpir el tratamiento
*** En casos de disfunción hepática de origen desconocido, se debe considerar la suspensión del tratamiento.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación: Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es.
4.9 Sobredosis
La mediana estimada de la dosis letal de hidrocloruro de donepezilo hidrocloruro, tras la administración de una dosis oral única a ratones y a ratas es de 45 y de 32 mg/kg, respectivamente, es decir, aproximadamente 225 y 160 veces la dosis máxima recomendada en humanos de 10mg/día.
Síntomas:
Se observaron en animales signos de estimulación colinérgica relacionada con las dosis, que incluyeron reducción de los movimientos espontáneos, posición en decúbito prono, marcha tambaleante, lagrimeo, convulsiones clónicas, insuficiencia respiratoria, salivación, miosis, fasciculación e hipotermia en la superficie corporal.
La sobredosis con inhibidores de la colinesterasa puede dar lugar a crisis colinérgicas, caracterizadas por náuseas violentas, vómitos, salivación, sudores, bradicardia, hipotensión, insuficiencia respiratoria, colapso y convulsiones. Es posible que se observe un incremento de la debilidad muscular, que podría conducir a la muerte si los músculos respiratorios están involucrados.
Tratamiento:
Como en cualquier caso de sobredosis, se deben utilizar medidas generales de soporte. Los anticolinérgicos terciarios tales como atropina pueden ser utilizados como antídotos en la sobredosis por donepezilo. Se recomienda administrar una inyección intravenosa de sulfato de atropina de forma titulada: una dosis inicial de 1.0 a 2.0 mg i.v., con dosis posteriores basadas en la respuesta clínica. Se han comunicado respuestas atípicas en la tensión arterial y en la frecuencia cardiaca con otros colinomiméticos cuando se administran conjuntamente con anticolinérgicos cuaternarios como glucopirrolato. Se desconoce si hidrocloruro de donepezilo y/o sus metabolitos pueden ser eliminados mediante diálisis (hemodiálisis, diálisis peritoneal, o hemofiltración).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: medicamentos anti-demencia; anticolinesterasas.
Código ATC: N06DA02
Hidrocloruro de donepezilo es un inhibidor específico y reversible de la acetilcolinesterasa, la colinesterasa predominante en el cerebro. Hidrocloruro de donepezilo es in vitro un inhibidor más de 1000 veces más potente de esta enzima que de la butirilcolinesterasa, una enzima que se encuentra principalmente fuera del Sistema Nervioso Central.
En pacientes con enfermedad de Alzheimer que participaron en los ensayos clínicos, la administración de dosis únicas diarias de 5mg y 10mg de hidrocloruro de donepezilo ,produjo una inhibición de la actividad de la acetilcolinesterasa en el estado estacionario (medida en la membrana de eritrocitos) del 63.6% y del 77.3% respectivamente, cuando se les practicaron medidas post-administración. Se ha demostrado que la inhibición de la acetilcolinesterasa (AChE) en los eritrocitos por hidrocloruro de donepezilo está relacionada con los cambios en la ADAS-cog, una escala sensible que examina aspectos selectivos de la cognición. El potencial de hidrocloruro de donepezilo para alterar el curso de la neuropatía subyacente no ha sido estudiado. Por tanto, no se puede considerar que donepezilo tenga ningún efecto sobre el progreso de la enfermedad.
La eficacia del tratamiento con donepezilo ha sido investigada en cuatro ensayos controlados con placebo,
2 ensayos de 6 meses de duración y 2 ensayos de un año de duración.
En los ensayos clínicos de 6 meses de duración se realizó un análisis al finalizar el tratamiento con donepezilo utilizando una combinación de tres criterios de eficacia: la subescala cognitiva de la escala de evaluación de la enfermedad de Alzheimer (ADAS-cog) (una medida de la función cognitiva), la impresión clínica global de cambio evaluada por un médico con la opinión del cuidador (CIBIC-plus) (una medida de la función global) y la subescala de actividades de la vida diaria de la escala de puntuación clínica de la demencia (CDR-ADL) (una medida de la capacidad en las relaciones sociales, en el hogar, en los hobbies y en el aseo personal).
Se consideró que respondieron al tratamiento los pacientes que cumplieron los criterios expuestos a continuación:
Respuesta = Mejoría en la ADAS-cog de al menos 4 puntos No deterioro en la CIBIC-plus No deterioro en la CDR-ADL
|
% Respuesta | ||
|
Intención de tratar la población n = 365 |
Población evaluable n = 352 | |
|
Grupo placebo |
10% |
10% |
|
Grupo donepezilo hidrocloruro 5 mg |
18%* |
18%* |
|
Grupo Donepezilo hidrocloruro 10 mg |
21%* |
22%** |
**p<0,05
*** p<0,01
Donepezilo produjo un incremento dosis dependiente estadísticamente significativo en el porcentaje de pacientes que se les consideró que respondieron al tratamiento.
5.2 Propiedades farmacocinéticas
Absorción:
Los niveles plasmáticos máximos se alcanzan aproximadamente a las 3 - 4 horas tras la administración oral. Las concentraciones plasmáticas y el área bajo la curva se incrementan proporcionalmente con las dosis. La semivida de eliminación es aproximadamente de 70 horas, por lo tanto, la administración de dosis únicas diarias múltiples da lugar a una aproximación gradual al estado estacionario. La aproximación al estado estable se alcanza en el intervalo de las 3 semanas posteriores al inicio del tratamiento. Una vez se alcanza el estado estacionario, las concentraciones plasmáticas de hidrocloruro de donepezilo y la actividad farmacodinámica relacionada muestran poca variabilidad a lo largo del curso del día.
Los alimentos no afectaron a absorción de hidrocloruro de donepezilo.
Distribución:
Aproximadamente el 95% de hidrocloruro de donepezilo está unido a las proteínas plasmáticas humanas. No se conoce la unión a las proteínas plasmáticas del metabolito activo 6-O desmetildonepezilo. La distribución de hidrocloruro de donepezilo en diferentes tejidos corporales no ha sido estudiada definitivamente. Sin embargo, en un estudio de equilibrio de masas llevado a cabo en varones voluntarios sanos, a las 240 horas de la administración de una dosis única de 5mg de hidrocloruro de donepezilo14Cradiomarcado, aproximadamente el 28% de la dosis permanecía sin recuperar. Esto indica que hidrocloruro de donepezilo y/o sus metabolitos pueden persistir en el organismo durante más de 10 días.
Metabolismo/Excreción:
Hidrocloruro de donepezilo se excreta en la orina inalterado y se metaboliza por el sistema citocromo P450 dando lugar a múltiples metabolitos, no todos ellos identificados.
Tras la administración de una dosis única de 5mg de hidrocloruro de donepeziloC14 radiomarcado, la radioactividad en plasma, expresada como porcentaje de la dosis administrada, estuvo presente principalmente como hidrocloruro de donepezilo inalterado (30%), como 6-O-desmetil donepezilo (11% -único metabolito que muestra una actividad similar a la de hidrocloruro de donepezilo), como donepezilo-cis-N-óxido (9%), como 5-O-desmetil donepezilo (7%) y como el conjugado glucurónido del 5-O-desmetil donepezilo (3%). Aproximadamente el 57% de la radioactividad total administrada fue recuperada en la orina (17% como donepezilo inalterado) y un 14.5% fue recuperada en las heces, indicando que la biotransformación y la excreción urinaria son las vías principales de eliminación. No hay evidencia que sugiera una recirculación enterohepática de hidrocloruro de donepezilo y/o de cualquiera de sus otros metabolitos.
Las concentraciones plasmáticas de hidrocloruro de donepezilo descienden con una semivida de eliminación de aproximadamente 70 horas.
El sexo, la raza y el hábito de fumar no tienen una influencia clínicamente significativa sobre las concentraciones plasmáticas de hidrocloruro de donepezilo. La farmacocinética de hidrocloruro de donepezilo no ha sido estudiada formalmente en voluntarios de edad avanzada sanos o en pacientes con
.<gp.
Alzheimer. Sin embargo los niveles plasmáticos medios de los pacientes concuerdan estrechamente con los de los voluntarios sanos jóvenes.
5.3 Datos preclínicos sobre seguridad
Numerosos ensayos en animales de experimentación han demostrado que este compuesto causa otros efectos aparte de los efectos farmacológicos previstos, consistentes con su acción colinomimética (ver sección 4.9). Hidrocloruro de donepezilo no es mutagénico en ensayos de mutación de células de mamíferos o bacterianas. Se observaron algunos efectos clastogénicos in vitro a concentraciones claramente tóxicas para las células y a más de 3000 veces las concentraciones plasmáticas en el estado estacionario. No se observaron efectos clastogénicos u otros efectos genotóxicos en el modelo de micronúcleo de ratón in vivo. En estudios de carcinogénesis a largo plazo realizados tanto en ratas como en ratones no hay evidencia alguna de potencial oncogénico.
Hidrocloruro de donepezilo no tuvo efectos sobre la fertilidad de las ratas, y no fue teratogénico en ratas ni en conejos, sin embargo produjo un ligero incremento de los nacidos muertos y un leve descenso de la supervivencia de las crías el día 4 post parto cuando se administró a ratas preñadas a dosis 50 veces superiores a la dosis en humanos (ver sección 4.6).
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Glicerol
Hipromelosa
Levomentol
Maltodextrina
Celulosa microcristalina
Saborizante a menta
Sucralosa
Dióxido de titanio (E 171)
Etanol
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 2 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase Sobres de PET/Alu/PE (84x7 mm)
Cada lámina bucodispersable esta envasada en un sobre sellado.
Envases de: 7, 10, 14, 21, 28, 30, 49, 50, 56, 60, 90, 98, 100 o 120 láminas bucodispersables. Puede que no todos los formatos estén comercializados.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz Farmacéutica, S.A.
Centro Empresarial Osa Mayor Avda. Osa Mayor, n° 4 28023 (Aravaca) Madrid España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
5 mg: 75326 10 mg: 75325
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
26/Enero/2012
10. FECHA DE LA REVISIÓN DEL TEXTO
Enero de 2014