Desogestrel/Etinilestradiol Sandoz 0,15 Mg/0,03 Mg Comprimidos Recubiertos Con Pelicula Efg
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Desogestrel/Etinilestradiol Sandoz 0,15 mg/0,03 mg comprimidos recubiertos con película EFG.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido contiene: 0,15 miligramos de desogestrel y 0,03 miligramos de etinilestradiol.
Excipiente(s) con efecto conocido: lactosa monohidrato. cada comprimido recubierto con película contiene 66,34 mg de lactosa monohidrato.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Comprimido recubierto con película.
Comprimidos recubiertos con película redondos, blancos, biconvexos, marcados con las letras “DT” en una de las caras y “EE2” en la otra cara.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Anticoncepción oral.
La decisión de prescribir desogestrel/etinilestradiol debe tener en cuenta los factores de riesgo actuales de cada mujer en particular, concretamente los de tromboembolismo venoso (TEV), y cómo se compara el riesgo de TEV con desogestrel/etinilestradiol con el de otros anticonceptivos orales combinados (AHCs) (ver secciones 4.3 y 4.4.).
4.2 Posología y forma de administración
Vía oral
Cómo tomar Desogestrel/Etinilestradiol Sandoz
Los comprimidos se deben tomar cada día aproximadamente a la misma hora, con un poco de líquido en caso necesario, siguiendo el orden que se indica en el blíster. Se toma un comprimido al día, durante 21 días consecutivos. Cada blíster posterior se comienza tras un intervalo de 7 días sin tomar comprimidos; durante este tiempo se suele producir una hemorragia por deprivación. La hemorragia se inicia habitualmente el día 2 ó 3 después de haber tomado el último comprimido y puede no haber cesado antes de empezar el nuevo blíster.
Cómo empezar a tomar Desogestrel/Etinilestradiol Sandoz
Cuando no se han tomado anticonceptivos hormonales previamente (en el mes anterior)
La toma de comprimidos se debe iniciar el día 1 del ciclo menstrual de la mujer (es decir, el primer día de su menstruación). También puede empezar a tomar los comprimidos el día 2-5, pero en el primer ciclo es recomendable utilizar simultáneamente un método de barrera durante los primeros 7 días que tome los comprimidos.
Cuando se cambia desde un anticonceptivo hormonal combinado (anticonceptivo oral combinado (AOC), anillo vaginal o parche transdérmico)
La mujer debe empezar a tomar desogestrel/etinilestradiol preferiblemente el día siguiente al último comprimido activo (el último comprimido que contiene los principios activos) de su anterior AOC pero,
como muy tarde, el día siguiente al intervalo habitual sin tomar comprimidos o después de los comprimidos placebo de su AOC anterior. En caso de que se haya utilizado un anillo vaginal o parche transdérmico, la mujer debe empezar a tomar desogestrel/etinilestradiol preferiblemente el día de la retirada pero, a más tardar, el dia que correspondería a la siguiente aplicación del parche o anillo vaginal.
Cuando se cambia desde un método con progestágeno solo (implante, inyección, comprimido con progestágeno solo) o desde un sistema de liberación intrauterino (SLI) de progestágeno.
La mujer puede cambiar cualquier día en el caso de la píldora con progestágeno (el día de su extracción si lleva un implante o un SLI, en el caso del inyectable, cuando corresponda la siguiente inyección), pero en todos estos casos se debe recomendar la utilización de un método de barrera complementario durante los primeros 7 días de toma de comprimidos.
Después de un aborto en el primer trimestre
La mujer puede empezar inmediatamente. En este caso, no es necesario que tome otras medidas anticonceptivas.
Después de un parto o de un aborto en el segundo trimestre
Se le aconseja a la mujer que empiece el día 21 a 28 después del parto o del aborto en el segundo trimestre. Si empieza más tarde, se le debe recomendar a la mujer que utilice, además, un método de barrera durante los 7 primeros días. Sin embargo, si ya ha mantenido relaciones sexuales, se debe descartar el embarazo antes de empezar a utilizar AOC, o la mujer debe esperar al primer periodo menstrual.
Para mujeres en periodo de lactancia, ver sección 4.6.
Recomendaciones en caso de olvido de la toma de algún comprimido
Si la paciente ha olvidado tomar un comprimido y han transcurrido menos de 12 horas, la protección anticonceptiva no se ve reducida.
La mujer debe tomar el comprimido tan pronto como se acuerde, y el resto de los comprimidos los debe tomar a la hora habitual.
Si el retraso es mayor de 12 horas, la protección anticonceptiva puede verse reducida. Las pautas de actuación para mantener la protección anticonceptiva en este caso, se deben seguir las dos reglas básicas siguientes:
1. La toma de los comprimidos nunca debe interrumpirse durante más de 7 días.
2. Es necesario tomar los comprimidos durante 7 días consecutivos para alcanzar una supresión suficiente del eje hipotálamo-hipofisario-ovárico.
Por lo tanto, en la práctica diaria se pueden dar los siguientes consejos:
Semana 1
La usuaria debe tomar el último comprimido que haya olvidado tan pronto como se acuerde, aunque esto signifique tomar dos comprimidos al mismo tiempo. Después, seguirá tomando los comprimidos a la hora habitual. Además, durante los 7 días siguientes debe utilizarse un método de barrera como, por ejemplo, un preservativo. Si en los 7 días previos ha mantenido relaciones sexuales, debe tenerse en cuenta la posibilidad de un embarazo. Cuantos más comprimidos haya olvidado y cuanto más cerca esté del intervalo habitual sin comprimidos, mayor es el riesgo de un embarazo.
Semana 2
La usuaria debe tomar el último comprimido que haya olvidado tan pronto como se acuerde, aunque esto signifique tomar dos comprimidos al mismo tiempo. Después, seguirá tomando los comprimidos a la hora habitual. Siempre que la mujer haya tomado los comprimidos correctamente durante los 7 días anteriores al primer comprimido olvidado, no es necesario tomar más precauciones anticonceptivas. Sin embargo, si ha olvidado más de 1 comprimido, debe recomendarse a la mujer que utilice precauciones adicionales durante 7 días.
Semana 3
El riesgo de reducción de la fiabilidad es inminente porque a continuación viene el intervalo sin comprimidos de 7 días. Sin embargo, esta reducción de la protección anticonceptiva puede evitarse ajustando el calendario de toma de los comprimidos. Por lo tanto, no es necesario utilizar medidas anticonceptivas adicionales si se sigue cualquiera de las dos opciones siguientes, siempre que la mujer haya tomado correctamente los comprimidos durante los 7 días previos al primer comprimido olvidado. De no ser éste el caso, debe seguir la primera de estas dos opciones y utilizar precauciones adicionales durante los 7 días siguientes.
1. La usuaria debe tomar el último comprimido que haya olvidado tan pronto como se acuerde, aunque esto signifique tomar dos comprimidos al mismo tiempo. Después, seguirá tomando los comprimidos a la hora habitual. Empezará a tomar el siguiente blíster tan pronto como se haya acabado el blíster actual, es decir, no debe quedar descanso entre los blísteres. No es probable que la usuaria tenga una hemorragia por deprivación hasta el final del segundo blíster, pero puede experimentar oligometrorragia o metrorragia intercurrente los días que esté tomando comprimidos.
2. A la mujer también se le puede aconsejar que deje de tomar los comprimidos del blíster actual.
En este caso, debe esperar hasta un intervalo de 7 días sin tomar comprimidos, incluyendo los días en que olvidó tomar los comprimidos, y en lo sucesivo continuar con el siguiente blíster.
Si la mujer ha olvidado comprimidos y después no tiene hemorragia por deprivación en el primer intervalo normal sin comprimidos, se debe considerar la posibilidad de un embarazo.
Recomendaciones en caso de alteraciones gastrointestinales
En caso de trastornos gastrointestinales importantes (p. ej., vómitos o diarrea), es posible que la absorción no sea completa y deben tomarse medidas anticonceptivas adicionales. Si aparecen vómitos dentro de las 34 horas posteriores a la toma del comprimido, debe tomarse un comprimido nuevo (de sustitución) tan pronto como sea posible. El comprimido nuevo se debe tomar antes de transcurridas 12 horas de la hora habitual de toma del comprimido, si es posible. Si transcurren más de 12 horas, se aplica el consejo relativo a los comprimidos olvidados de la sección "Recomendaciones en caso de olvido de la toma de algún comprimido"". Si la mujer no quiere cambiar su calendario normal de toma de comprimidos, tiene que tomar el comprimido o los comprimidos adicionales de otro blíster.
Cómo retrasar una hemorragia por deprivación
Para retrasar un periodo, la mujer debe continuar tomando otro blíster de Desogestrel/Etinilestradiol Sandoz sin un intervalo libre de comprimidos. La prolongación puede mantenerse todo lo que se desee hasta el final del segundo blíster. Durante la prolongación, la mujer puede experimentar metrorragia intraterapéutica u oligometrorragia. La toma normal de Desogestrel/Etinilestradiol Sandoz se reanuda a continuación después del intervalo habitual de 7 días sin tomar comprimidos.
Para cambiar los periodos a otro día de la semana distinto al que la mujer está acostumbrada con su pauta actual, se le puede aconsejar que acorte el siguiente intervalo sin comprimidos tantos días como desee. Cuanto más corto sea el intervalo, mayor será el riesgo de que no presente hemorragia por deprivación, y de que tenga metrorragia intercurrente u oligometrorragia durante el blíster posterior (tal como ocurre cuando se retrasa un periodo).
4.3 Contraindicaciones
Los anticonceptivos orales combinados (AOC) no se deben utilizar en presencia de cualquiera de las siguientes afecciones. Si alguna de ellas apareciese por primera vez mientras se están tomando AOC, su utilización se debe suspender inmediatamente:
- Presencia o riesgo de tromboembolismo venoso (TEV).
- Tromboembolismo venoso: TEV actual (con anticoagulantes) o antecedentes del mismo (p. ej., trombosis venosa profunda (TVP) o embolia pulmonar (EP)),
- predisposición hereditaria o adquirida conocida al tromboembolismo venoso, tal como resistencia a la PCA (incluyendo el factor V Leiden), deficiencia de antitrombina III, deficiencia de proteína C, deficiencia de proteína S.
- cirugía mayor con inmovilización prolongada (ver sección 4.4).
- riesgo elevado de tromboembolismo venoso debido a la presencia de varios factores de riesgo (ver sección 4.4).
- Presencia o riesgo de tromboembolismo arterial (TEA).
- Tromboembolismo arterial: tromboembolismo arterial actual, antecedentes del mismo (p. ej. infarto de miocardio) o afección prodrómica (p. ej. Angina de pecho)enfermedad cerebrovascular: ictus actual, antecedentes de ictus o afección prodrómica (p. ej. accidente inquémico transitorio, AIT)
- predisposición hereditaria o adquirida conocida al tromboembolismo arterial, tal como hiperhomocisteinemia y anticuerpos antifosfolípidos (anticuerpos anticardiolipina, anticoagulante del lupus)
- Antecedentes de migraña con síntomas neurológicos focales
- Riesgo elevado de tromboembolismo arterial debido a múltiples factores de riesgo (ver sección 4.4) o a la presencia de un factor de riesgo grave como:
o Diabetes mellitus con síntomas vasculares, o Hipertensión grave, o Dislipoproteinemia intensa,
- pancreatitis o antecedentes de pancreatitis si está asociada a hipertrigliceridemia grave,
- presencia o antecedentes de enfermedad hepática grave mientras los valores de función hepática no hayan vuelto a la normalidad,
- presencia o antecedentes de tumores hepáticos (benignos o malignos),
- tumores malignos que se sepa o sospeche se vean influidos por esteroides sexuales (p.ej., de los órganos genitales o las mamas),
- sangrado vaginal no diagnosticado,
- hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Advertencias
Si alguna de las afecciones o factores de riesgo que se mencionan a continuación está presente, se debe comentar con la mujer la idoneidad de desogestrel/etinilestradiol.
Si alguna de estas afecciones o de estos factores de riesgo se agrava o aparece por primera vez, se debe aconsejar a la mujer que consulte con su médico para determinar si se debe interrumpir el uso de desogestrel/etinilestradiol.
Trastornos circulatorios
Riesgo de tromboembolismo venoso (TEV)El uso de cualquier anticonceptivo hormonal combinado (AHC) aumenta el riesgo de tromboembolismo venoso (TEV), comparado con la no utilización. Los medicamentos que contienen levonorgestrel, norgestimato o noretisterona se asocian con el riesgo más bajo de TEV. Otros medicamentos como [Denominación de fantasía] pueden tener hasta el doble de este nivel de riesgo. La decisión de utilizar cualquier medicamento diferente del que tiene el menor riesgo de TEV se debe tomar solamente después de comentarlo con la mujer para garantizar que comprende el riesgo de TEV con [Denominación de fantasía], cómo afectan sus actuales factores de riesgo a este riesgo y que su riesgo de TEV es mayor durante el primer año de uso. También
Entre las mujeres que no utilizan un AHC y que no están embarazadas, aproximadamente 2 de cada 10.000 presentarán un TEV en el plazo de un año. No obstante, el riesgo puede ser mucho mayor en cada mujer en particular, en función de sus factores de riesgo subyacentes (ver a continuación).
existen ciertas evidencias de que el riesgo aumenta cuando se reinicia el AHC después de una interrupción del uso de 4 semanas o más.
Se estima1 que de cada 10.000 mujeres que utilizan un AHC que contiene desogestrel, entre 9 y 12 presentarán TEV en un año, en comparación con unas 63 mujeres que utilizan un AHC con levonorgestrel.
En ambos casos, el número de TEVs por año es inferior al número esperado en mujeres durante el embarazo o en el período de posparto.
El TEV puede ser mortal en el 1-2 % de los casos.
Número de episodios de TEV por cada 10.000 mujeres en un
año
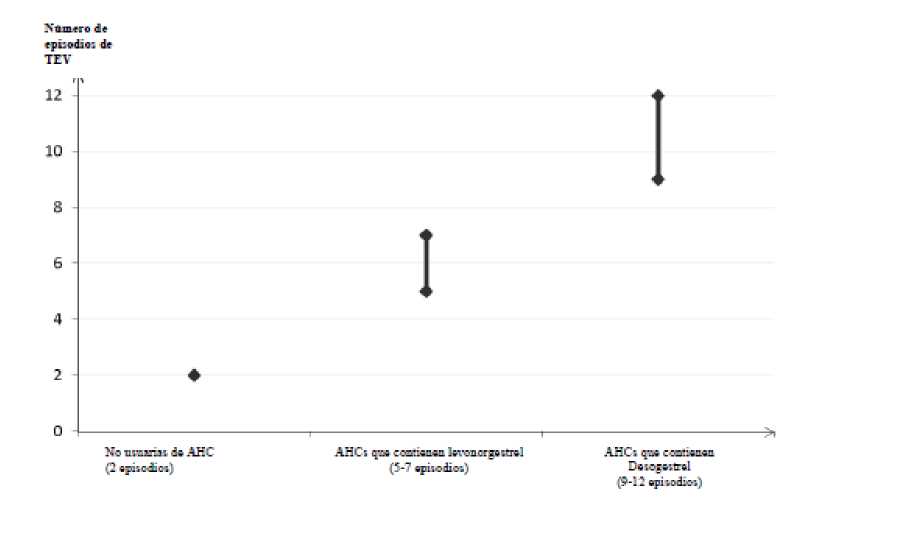
De forma extremadamente rara, se han notificado casos de trombosis en otros vasos sanguíneos, p. ej., en venas y arterias hepáticas, mesentéricas, renales o retinianas, en usuarias de AHC.
Factores de riesgo de TEV
El riesgo de complicaciones tromboembólicas venosas en usuarias de AHC puede aumentar sustancialmente en una mujer con factores de riesgo adicionales, en particular si existen varios factores de riesgo (ver tabla).
Desogestrel/etinilestradiol está contraindicado si una mujer tiene varios factores de riesgo que la ponen en una situación de alto riesgo de trombosis venosa (ver sección 4.3). Si una mujer tiene más de un factor de riesgo, es posible que el aumento del riesgo sea mayor que la suma de los factores individuales; en este caso se debe tener en cuenta su riesgo total de TEV. Si se considera que la relación beneficio/riesgo es negativa, no se debe prescribir un AHC (ver sección 4.3).
Tabla: Factores de riesgo de TEV
|
Factor de riesgo |
Comentario |
|
Obesidad (índice de masa corporal (IMC) superior a 30 kg/m2) |
El riesgo aumenta considerablemente a medida que el índice de masa corporal aumenta. Es especialmente importante considerar si existen otros factores de riesgo. |
|
Inmovilización prolongada, cirugía mayor, cualquier cirugía de las piernas o de la pelvis, neurocirugía o traumatismo mayor. Nota: entre la inmovilización temporal se incluyen los viajes en avión >4 horas que puede ser también un factor de riesgo de TEV, en particular en mujeres que ya tienen otros factores de riesgo. |
Si se da cualquiera de estas situaciones, se recomienda interrumpir el uso delparche/píldora/anillo (en el caso de cirugí al menos 4 semanas antes de la misma) y no reanudar el tratamiento hasta pasadas 2 semanas tras la movilización completa. Se pueden utilizar otros métodos anticonceptivos para evitar el embarazo. Se debe considerar el tratamiento antitrombótico si no se ha discontinuado previamente el tratamiento con desogestrel/etinilestradiol. |
|
Antecedentes familiares positivos (algún caso de tromboembolismo venoso en un hermano o en un progenitor, especialmente a una edad relativamente temprana, p. ej. antes de los 50 años). |
Si se sospecha que existe una predisposición hereditaria, la mujer debe ser derivada a un especialista antes de tomar la decisión de usar un AHC. |
|
Otras enfermedades asociadas al TEV |
Cáncer, lupus eritematoso sistémico, síndrome urémico hemolítico, enfermedad intestinal inflamatoria crónica (enfermedad de Crohn o colitis ulcerosa) y anemia de células falciformes. |
|
Aumento de la edad |
En especial por encima de los 35 años. |
No existe consenso acerca del posible papel de las venas varicosas y de la tromboflebitis en la aparición o en la progresión de la trombosis venosa.
Es preciso tener en cuenta el aumento del riesgo de tromboembolismo en el embarazo, y en particular en el período de 6 semanas del puerperio (para obtener información sobre “Embarazo y lactancia”, ver sección 4.6).- Síntomas de TEV (trombosis venosa profunda y embolia pulmonar)
En el caso de que se produzcan síntomas, se debe aconsejar a la mujer que busque asistencia médica urgente y que informe al profesional sanitario de que está tomando un AHC.
Los síntomas de trombosis venosa profunda (TVP) pueden incluir:
- hinchazón unilateral de una pierna y/o un pieo a lo largo de la pierna,
- dolor o sensibilidad en la pierna, que tal vez de advierta sólo al ponerse de pie o caminar,
- aumento de la temperatura de la pierna afectada; enrojecimiento o decoloración de la piel de la pierna.
Los síntomas de embolia pulmonar (EP) pueden incluir:
- aparición repentina de falta de aliento o respiración rápida injustificadas,
- tos repentina que puede estar asociada a hemoptisis;
- dolor torácico agudo;
- aturdimiento intenso o mareo;
- latidos cardiacos acelerados o irregulares.
Algunos de estos síntomas (p. ej. “falta de aliento”, “tos”) son inespecíficos y se pueden confundir con acontecimientos más frecuentes o menos graves (p. ej. infecciones del tracto respiratorio).
Otros signos de oclusión vascular pueden incluir: dolor repentino, hinchazón y ligera coloración azul de una extremidad.
Si la oclusión se produce en el ojo, los síntomas pueden variar desde visión borrosa indolora, que puede evolucionar a pérdida de la visión. A veces la pérdida de la visión se puede producir casi de inmediato.
Riesgo de tromboembolismo arterial (TEA)
Estudios epidemiológicos han asociado el uso de AHC con el aumento del riesgo de tromboembolismo arterial (infarto de miocardio) o de accidente cerebrovascular (p. ej. accidente isquémico transitorio, ictus). Los episodios tromboembolicos arteriales pueden ser mortales.
Factores de riesgo de TEA
El riesgo de que se produzcan complicaciones tromboémbolicas arteriales o un accidente cerebrovascular en mujeres usuarias de AHC aumenta en aquellas mujeres que tienen factores de riesgo (ver tabla). Desogestrel/etinilestradiol está contraindicado en mujeres que tienen uno o varios factores de riesgo que pueden aumentar su riesgo global de sufrir trombosis arterial (ver sección 4.3.). Si una mujer tiene más de un factor de riesgo, es posible que el aumento del riesgo sea mayor que la suma de los factores individuales, en este caso su riesgo total se debe reconsiderar. Si se considera que la relación beneficio-riesgo se considera negativa, no se debe prescribir AHC (ver sección 4.3.).
Tabla: Factores de riesgo de TEA
|
Factor de riesgo |
Comentario |
|
Aumento de la edad |
Especialmente si es mayor de 35 años. |
|
Tabaquismo |
Se debe aconsejar a las mujeres que no fumen si desean utilizar un AHC. Se debe aconsejar encarecidamente a las mujeres de más de 35 años que continúan fumando que utilicen un método anticonceptivo diferente. |
|
Hipertensión arterial |
|
Obesidad (índice de masa corporal mayor de 30 kg/m2) |
El riesgo aumenta de forma sustancial con el aumento del IMC. Especialmente importante en mujeres que tienen otros factores de riesgo. |
|
Antecendentes familiares p ositivos (algún caso de tromboembolismo arterial en hermanos o en un progenitor, especialmente a una edad relativamente temprana p. ej. menos de 50 años). |
Si se sospecha que existeuna predisposición hereditaria, la mujer debe ser enviada a un especialista antes de tomar la decisión de usar un AHC. |
|
Migraña |
Un aumento en la frecuencia o en la intensidad de las migrañas durante el uso de AHC (que puede ser prodrómico de un accidente cerebrovascular) puede motivar su interrupción inmediata. |
|
Otras enfermedades asociadas a acontecimientos vasculares adversos |
Diabetes mellitus, hiperhomocistinemia, valvulopatía y fribrilación auricula r, dislipoproteinemia y lupus eritematoso sistémico.. |
Síntomas de TEA
En el caso de que se produzcan síntomas, se debe aconsejar a la mujer que busque asistencia médica urgente y que informe al profesional sanitario de que está tomando un AHC.
Los síntomas de un accidente cerebrovascular pueden incluir:
- Entumecimiento o debilidad repentinos de la cara, brazo o pierna, especialmente en un lado del cuerpo.
- Dificultad repentina para caminar, mareo, pérdida del equilibrio o de la coordinación.
- Confusión repentina, dificultad para hablar o para comprender.
- Dificultad repentina de visión en un ojo o en ambos.
- Cefalea repentina, intensa o prolongada sin causa conocida.
- Pérdida del conocimiento o desmayo, con o sin convulsiones.
Los síntomas temporales sugieren que el episodio es un accidente isquémico transitorio (AIT).
Los síntomas de infarto de miocardio (IM) pueden incluir:
- Dolor, molestias, presión, pesadez, sensación de opresión o plenitud en el toráx, brazo o debajo del esternón
- Malestar que irradia a la espalda, la mandíbula, la garganta, el brazo o el estómago.
- Sensación de plenitud, indigestión o ahogo.
- Sudoración, náuseas, vómitos o mareo.
- Debilidad extrema, ansiedad o falta de aliento.
- Latidos cardíacos acelerados o irregulares.
Tumores
En algunos estudios epidemiológicos se ha descrito que el uso a largo plazo de AOC (más de 5 años) constituye un factor de riesgo de desarollar cáncer de cuello uterino, pero sigue existiendo controversia acerca de hasta qué punto este resultado es atribuible a los efectos de confusión de la conducta sexual y a otros factores como el virus del papiloma humano (VPH).
Un metanálisis de 54 estudios epidemiológicos indicó que existe un ligero incremento del riesgo relativo (RR = 1,24) de ser diagnosticada de cáncer de mama en mujeres que están tomando AOC. El riesgo adicional disminuye gradualmente durante el transcurso de los 10 años posteriores a la suspensión del tratamiento. Como el cáncer de mama es una enfermedad rara en las mujeres menores de 40 años, el exceso de diagnósticos de cáncer de mama en usuarias que toman actualmente o que han tomado AOC es pequeño comparado con el riesgo global de cáncer de mama. Estos estudios no dan indicios de que exista una relación causal. El patrón observado de un incremento del riesgo puede deberse al diagnóstico más precoz del cáncer de mama en las usuarias de AOC, a los efectos biológicos de los AOC o a la combinación de ambos. Los cánceres de mama diagnosticados en mujeres que los han utilizado alguna vez tienden a estar menos avanzados clínicamente que los casos de cáncer de mama diagnosticados en mujeres que nunca los han utilizado.
En usuarias de AOC se han descrito casos raros de tumores hepáticos benignos y, más raramente, de tumores hepáticos malignos. En casos aislados, estos tumores han dado lugar a hemorragias intraabdominales potencialmente mortales. En mujeres que tomen AOC se debe considerar el tumor hepático en el diagnóstico diferencial cuando aparezca dolor intenso en la parte alta del abdomen, en caso de hepatomegalia, o si aparecen signos de hemorragia intraabdominal.
Con la utilización de AOC de dosis altas (50 pg de etinilestradiol) se reduce el riesgo de cáncer de endometrio y de ovario. Falta confirmar que esto sea aplicable también a los AOC de dosis bajas.
Otras patologías
Las mujeres con hipertrigliceridemia o con antecedentes familiares de ésta pueden tener un aumento del riesgo de padecer pancreatitis cuando toman AOC.
Durante el uso de AOC se ha observado que muchas mujeres presentan pequeños incrementos de la presión arterial, aunque, los aumentos clínicamente significativos son raros. Sólo en estos casos raros está justificada una suspensión inmediata de la utilización del AOC. No se ha demostrado que exista una relación sistemática entre la utilización de AOC y la hipertensión clínica. Si, durante la utilización de un AOC en caso de hipertensión preexistente, los valores de presión arterial constantemente elevados, o un aumento significativo de la presión arterial no responden adecuadamente al tratamiento antihipertensor, debe retirarse el AOC. Cuando se considere adecuado, la utilización de AOC se puede reanudar cuando se alcancen valores normotensos con el tratamiento antihipertensor.
Se ha notificado la aparición o empeoramiento de las siguientes afecciones, tanto con el embarazo como con la utilización de AOC, pero la evidencia de que exista una asociación a la utilización de AOC no es concluyente: ictericia y/o prurito relacionado con colestasis; cálculos biliares; porfiria; lupus eritematoso sistémico; síndrome hemolítico-urémico; corea de Sydenham; herpes gestacional; pérdida de audición relacionada con otosclerosis.
En mujeres con angioedema hereditario, los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema.
Trastornos agudos o crónicos de la función hepática pueden hacer necesario suspender la utilización de los AOC hasta que los marcadores de la función hepática se hayan normalizado. La recurrencia de la ictericia colestásica y/o el prurito relacionado con colestasis que hayan aparecido previamente durante el embarazo o durante la utilización previa de esteroides sexuales hacen necesario suspender la utilización de AOC.
Aunque los AOC pueden tener un efecto sobre la resistencia periférica a la insulina y sobre la tolerancia a la glucosa, no hay indicios de que sea necesario alterar el régimen terapéutico en mujeres diabéticas que utilizan AOC a dosis bajas (que contienen menos de 0,05 mg de etinilestradiol). No obstante, debe realizarse un cuidadoso seguimiento a las mujeres diabéticas, sobre todo en la fase preliminar de utilización de AOC.
Se ha descrito empeoramiento de la depresión endógena, de la epilepsia, de la enfermedad de Crohn y de la colitis ulcerosa durante la utilización de AOC.
De vez en cuando puede aparecer cloasma, en especial en mujeres con antecedentes médicos de cloasma gravídico. Las mujeres con tendencia al cloasma deben evitar exponerse a la luz solar o a la radiación ultravioleta mientras tomen AOC.
Desogestrel/Etinilestradiol Sandoz contiene lactosa. Las pacientes con intolerancia hereditaria a la galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben tomar este medicamento.
Exploración/consulta médica
Antes de iniciar o reanudar el tratamiento con [denominación de fantasía], se debe realizar una anamnesis completa (incluidos los antecedentes familiares) y descartarse un posible embarazo. Se debe medir la tensión arterial y realizar una exploración física, guiada por las contraindicaciones (ver sección 4.3) y por las advertencias (ver sección 4.4). Es importante dirigir la atención de la mujer hacia la información sobre la trombosis venosa y arterial, incluido el riesgo de [denominación de fantasía] en comparación con otros AHCs, los síntomas de TEV y TEA, los factores de riesgo conocidos y qué debe hacer en caso de una sospecha de trombosis.
También se debe indicar a la mujer que lea cuidadosamente el prospecto y siga las instrucciones que allí descritas La frecuencia y la naturaleza de las exploraciones deben basarse en las directrices clínicas establecidas y se adaptarán a cada mujer en particular.
Debe advertirse a las mujeres que los anticonceptivos hormonales no protegen frente a la infección por VIH (SIDA) ni frente a otras enfermedades de transmisión sexual.
Reducción de la eficacia
La eficacia de los AOC puede verse reducida en caso de, por ej.: olvido de comprimidos (sección 4.2), trastornos gastrointestinales (sección 4.2) o medicamentos concomitantes (sección 4.5).
Reducción del control del ciclo
Con todos los AOC pueden aparecer sangrados irregulares (oligometrorragia y metrorragia intraterapéutica), especialmente durante los primeros meses de utilización. Por lo tanto, sólo procede evaluar la aparición de cualquier sangrado irregular después de un intervalo de adaptación de aproximadamente 3 ciclos.
Si las irregularidades en los sangrados persisten o aparecen después de ciclos previos regulares, se debe considerar causas no hormonales, y se deben tomar las medidas diagnósticas adecuadas para excluir un tumor maligno o un embarazo. Entre ellas se puede incluir un legrado.
En algunas mujeres es posible que no aparezca hemorragia por deprivación durante el intervalo sin tomar comprimidos. Si el AOC se ha tomado según las instrucciones descritas en la sección 4.2, es poco probable que la mujer esté embarazada. Sin embargo, si el AOC no se ha tomado de acuerdo con estas instrucciones antes de la primera hemorragia de privación que no se ha producido, o si no se han producido dos hemorragias por deprivación, se debe descartar un embarazo antes de seguir tomando el AOC.
4.5 Interacción con otros medicamentos y otras formas de interacción
Atención: debe consultarse la información de prescripción de los medicamentos concomitantes para identificar posibles interacciones.
Influencia de otros medicamentos en Desogestrel/Etinilestradiol Sandoz
Las interacciones entre los anticonceptivos orales y otros medicamentos pueden provocar metrorragia intercurrente y/o fallos anticonceptivos. En la bibliografía se han descrito las siguientes interacciones.
Metabolismo hepático
Pueden aparecer interacciones con medicamentos inductores de las enzimas hepáticas que pueden tener como resultado un aumento del aclaramiento de las hormonas sexuales (por ej.: fenitoína, barbitúricos, primidona, carbamazepina, rifampicina, bosentán, rifabutina, modafinilo) y con medicamentos inhibidores de la VIH proteasa con una inducción potencial (por ej.: ritonavir y nelfinavir) e inhibidores de la transcriptasa inversa no nucleosido (por ej.: nevirapina y efavirenz) y, posiblemente, también con oxcarbazepina, topiramato, felbamato, griseofulvina y fitopreparados que contengan hierba de San Juan (Hypericum perforatum). La inducción enzimática máxima se suele observar en aproximadamente 10 días, pero después puede persistir durante al menos 4 semanas tras el cese del tratamiento.
Interferencia en la circulación enterohepática
También se han descrito fallos anticonceptivos con antibióticos tales como penicilinas y tetraciclinas. No se ha aclarado el mecanismo de este efecto.
Control
Las mujeres sometidas a tratamiento a corto plazo con cualquiera de las clases farmacológicas o los principios activos individuales mencionados (medicamentos inductores de las enzimas hepáticas) excepto rifampicina deben utilizar temporalmente un método de barrera además del AOC, es decir, durante el período de administración concomitante de otros medicamentos y durante 7 días después de suspender esta medicación.
En las mujeres que toman rifampicina debe utilizarse un método de barrera además del AOC durante el período de administración de rifampicina y durante 28 días después de su suspensión.
En mujeres sometidas a tratamiento a largo plazo con principios activos inductores de las enzimas hepáticas, se recomienda utilizar otro método anticonceptivo no hormonal fiable.
Las mujeres sometidas a tratamiento con antibióticos (excepto rifampicina, ver más arriba y griseofulvina, que también actua como inductor enzimático microsomal) deben utilizar el método de barrera hasta 7 días después de la suspensión del tratamiento.
Si la administración concomitante de otros medicamentos excede el número de comprimidos del blíster de AOC, debe empezarse el siguiente blíster de AOC sin guardar el intervalo habitual sin comprimidos.
Influencia de Desogestrel/Etinilestradiol Sandoz en otros medicamentos
Los anticonceptivos orales pueden afectar al metabolismo de otros principios activos. Así, las concentraciones en plasma y tejidos de estos principios activos pueden aumentar (p ej.: ciclosporina) o disminuir (p ej.: lamotrigina).
Interferencia con pruebas analíticas
El uso de anticonceptivos esteroideos puede influir en los resultados de ciertos pruebas de laboratorio, como los parámetros bioquímicos de función hepática, tiroidea, suprarrenal y renal; los niveles plasmáticos de proteínas (transportadoras), por ej.: corticoesteroides de unión a globulina y fracciones lipídicas/lipoproteicas; los parámetros del metabolismo de los hidratos de carbono y los parámetros de la coagulación y la fibrinólisis. Las alteraciones suelen mantenerse dentro del rango de referencia normal de los valores de laboratorio.
4.6 Fertilidad, embarazo y lactancia
Desogestrel/etinilestradiol no está indicado en el embarazo.
Embarazo
Si se produce un embarazo durante la utilización de desogestrel/etinilestradiol, el medicamento se debe interrumpir inmediatamente. Estudios epidemiológicos extensos no han evidenciado un aumento del riesgo de aparición de defectos congénitos en niños nacidos de mujeres que utilizaron AOC antes del embarazo, ni un efecto teratogénico cuando los AOC se tomaron de forma inadvertida durante el embarazo.
Se debe tener en cuenta el aumento de riesgo de TEV durante el periodo de posparto cuando se reinicia la administración con desogestrel/etinilestradiol (ver sección 4.2 y 4.4).
Lactancia
La lactancia puede verse afectada por los AOC, ya que éstos pueden reducir la cantidad y modificar la composición de la leche materna. Por tanto, la utilización de AOC no se debe recomendar hasta que la madre lactante haya dejado completamente de dar el pecho a su hijo. Pequeñas cantidades de los esteroides
anticonceptivos y/o de sus metabolitos pueden excretarse con la leche durante la utilización de AOC. Estas cantidades pueden afectar al niño.
Fertilidad
No existen datos relevantes disponibles que avalen que este medicamento pueda provocar infertilidad a corto plazo. No obstante, en pacientes que han recibido un tratamiento similar con anticonceptivos orales, se ha producido una reacción adversa no frecuente de infertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Desogestrel/Etinilestradiol Sandoz sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Para las reacciones adversas graves en usuarias de AOC ver la sección 4.4.
Al igual que ocurre con los AOC, puede producirse un cambio en los ciclos de sangrado vaginal, especialmente durante los primeros meses de uso. Los cambios pueden ser cambios en la frecuencia de sangrado (inexistente, menos, más frecuente y más continuo), en la intensidad (reducción u aumento) o duración.
Las reacciones adversas se clasifican por sistema de órganos y frecuencias siguientes:muyfrecuentes(=1/10),frecuentes(=1/100a<1/10),
pocofrecuentes(=1/1.000a<1/100),raras(=1/10,000a<1/1,000),muyraras(<1/10,000), No conocidas (no puede estimarse a partir de los datos disponibles)
|
Clasificación órgano-sistema |
Frecuentes |
Poco frecuentes |
Raras |
|
Infecciones e infestaciones |
Candidiasis vaginal | ||
|
Trastornos del sistema inmunolónico |
Hipersensibilidad | ||
|
Trastornos del metabolismo y de la nutrici ón |
Retención de líquidos | ||
|
Trastornos psiquiátricos |
Disminución de la libido Estado de ánimo depresivo |
Aumento de la libido | |
|
Trastornos del sistema nervioso |
Cefalea Mareos | ||
|
Trastornos oculares |
Intolerancia a las lentes | ||
|
Trastornos del oído y del laberinto |
Otosclerosis |
14 de 19 WINISTWIODE
SANIDAD, POLÍTICA SOCIALE IGUALDAD Agencia es parto» de medicamentos y Sfoouctos sarttanos
|
Trastornos vasculares |
Migraña |
TEV | ||
|
Hipertensión |
TEA | |||
|
Trastornos gastrointestinales |
Náuseas | |||
|
Trastornos de la piel y |
Vené |
Eritema nudoso | ||
|
del tejido subcutáneo |
Exantema |
Eritema multiforme Prurito | ||
|
Trastornos del aparato |
Amenorrea |
Leucorrea | ||
|
reproductor y de la |
Dolor mamario a la | |||
|
mama |
Sangrado irregular |
palpación |
Galactorrea | |
|
Trastornos generales y alteraciones en el lugar de administración |
Aumento de peso | |||
Se ha observado un aumento del riesgo de episodios trombóticos y tromboembólicos arteriales y venosos, entre ellos infarto de miocardio, accidente cerebrovascular, accidentes isquémicos transitorios, trombosis venosa y embolia pulmonar, en mujeres que utilizan AHCs, que se comentan con más detalle en la sección 4.4.
Se han descrito las siguientes reacciones adversas graves, que se comentan en la sección 4.4, en mujeres que utilizaban AOC:
- hipertensión,
- tumores hepáticos,
- aparición o empeoramiento de enfermedades para las que no se ha establecido de forma concluyente una asociación a la utilización de anticonceptivos orales: enfermedad de Crohn, colitis ulcerosa, epilepsia, migraña, endometriosis, mioma uterino, porfiria, lupus eritematoso sistémico, herpes gestacional, corea de Sydenham, síndrome hemolítico-urémico, ictericia colestásica,
- cloasma.
- trastornos agudos o crónicos de la función hepática pueden hacer necesario suspender la utilización
de los AOC hasta que los marcadores de la función hepática se hayan normalizado,
- en mujeres con angioedema hereditario, los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema.
La frecuencia de diagnóstico de cáncer de mama se ve muy ligeramente aumentada en las usuarias de anticonceptivos orales. Como el cáncer de mama es raro en mujeres menores de 40 años, el mayor número de casos es pequeño en relación con el riesgo global de cáncer de mama. Se desconoce la relación causal con la utilización de AOC. Para más información, ver secciones 4.3 y 4.4.
Notificación de sospechas de reacciones adversas
Es importante nofificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://notificaram.es
4.9 Sobredosis
No ha habido ninguna experiencia de sobredosis con desogestrel/etinilestradiol. Partiendo de la experiencia general con los anticonceptivos orales combinados, los síntomas que pueden posiblemente aparecer en este caso son: náuseas, vómitos y, en chicas jóvenes, un ligero sangrado vaginal. No existen antídotos y el tratamiento posterior debe ser sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Progestágenos y estrógenos, combinaciones fijas,
Código ATC: G03AA09
La acción anticonceptiva de los AOC se basa en la interacción de distintos factores, el más importante de los cuales es la inhibición de la ovulación y los cambios de la secreción cervical. Además de la protección frente al embarazo, los AOC poseen varias propiedades positivas que, junto a sus propiedades negativas (ver Advertencias, Reacciones adversas), pueden ser útiles a la hora de decidir el método anticonceptivo. El ciclo es más regular y la menstruación es a menudo menos dolorosa y el sangrado es más ligero. Este último fenómeno puede tener como resultado un descenso de la aparición de ferropenia. En el ensayo multicéntrico más extenso (n = 23.258 ciclos) se estima un Índice de Pearl no corregido de 0,1 (intervalo de confianza del 95%: 0,0-0,3). Además, el 4,5% de las mujeres describió ausencia de metrorragia de privación y el 9,2% describió la aparición de sangrado irregular después de 6 ciclos de tratamiento.
Desogestrel/Etinilestradiol Sandoz es un AOC con etinilestradiol y el progestágeno desogestrel.
Etinilestradiol es un estrógeno sintético bien conocido.
Desogestrel es un progestágeno sintético. Después de la administración oral tiene una potente actividad inhibidora de la ovulación.
Con la utilización de los AOC de dosis altas (50 microgramos de etinilestradiol) se reduce el riesgo de cáncer de endometrio y de ovario. Sigue sin estar confirmado que esto sea aplicable también a los AOC de dosis bajas.
Población pediátrica
No hay datos clínicos disponibles acerca de la seguridad y eficacia en adolescentes menores de 18 años de edad.
5.2 Propiedades farmacocinéticas Desogestrel
Absorción
Tras la administración oral de Desogestrel/Etinilestradiol Sandoz, desogestrel se absorbe rápidamente y se convierte en 3-ceto-desogestrel. Los niveles plasmáticos máximos se alcanzan al cabo de 1,5 horas. La biodisponibilidad absoluta de 3-ceto-desogestrel es del 62%-81%.
Distribución
3-ceto-desogestrel se une a las proteínas plasmáticas en un 95,5%-99%, principalmente a albúmina y a globulina transportadora de las hormonas sexuales (SHBG). El aumento inducido por etinilestradiol de
SHBG influye tanto en la cantidad de uniones como en la distribución de 3-ceto-desogestrel en las proteínas plasmáticas. Como consecuencia, la concentración de 3-ceto- desogestrel aumenta lentamente durante el tratamiento hasta que se alcanza el estado estacionario en 3-13 días.
Metabolismo
Dentro del metabolismo de fase I de desogestrel hay una hidroxilación catalizada por el citocromo P450 y la subsiguiente deshidrogenación en el C3. El metabolito activo 3-ceto-desogestrel se reduce aún más, y los productos de degradación se conjugan a sulfatos y glucurónidos. Estudios en animales indican que la circulación enterohepática no tiene relevancia para la actividad gestagénica de desogestrel.
Eliminación
3-ceto-desogestrel se elimina con una semivida media de aprox. 31 horas (24-38 horas), el aclaramiento plasmático varía de 5,0-9,5 l/hora. Desogestrel y sus metabolitos se eliminan a través de la orina y en las heces, ya sea como esteroides libres o como conjugados. La proporción de eliminación en la orina o en las heces es de 1,5:1.
Condiciones de estado estacionario
En condiciones de estado estacionario el nivel sérico de 3-ceto-desogestrel se eleva hasta multiplicarse por 2-3.
Etinilestradiol
Absorción
Etinilestradiol se absorbe rápidamente y alcanza los niveles plasmáticos máximos al cabo de 1,5 horas. Como consecuencia de la conjugación presistémica y del metabolismo de primer paso, la biodisponibilidad absoluta es del 60%. Puede esperarse que el área bajo la curva y la Cmáx aumenten ligeramente con el tiempo.
Distribución
Etinilestradiol se une en un 98,8% a las proteínas plasmáticas, casi exclusivamente a albúmina.
Metabolismo
Etinilestradiol sufre una conjugación presistémica tanto en la mucosa del intestino delgado como en el hígado. La hidrólisis de los conjugados directos de etinilestradiol con la ayuda de la microflora intestinal da lugar a etinilestradiol, que puede ser reabsorbido, y así se establece una circulación enterohepática. La vía principal del metabolismo de etinilestradiol es la hidroxilación mediada por el citocromo P-450, en la que los principales metabolitos son 2-OH-EE y 2-metoxi-EE. 2-OH-EE se sigue metabolizando y da lugar a metabolitos químicamente reactivos.
Eliminación
Etinilestradiol desaparece del plasma con una semivida de aprox. 29 horas (26-33 horas), el aclaramiento plasmático varía de 10-30 l/hora. Los conjugados de etinilestradiol y sus metabolitos se excretan a través de la orina y de las heces (proporción 1:1).
Condiciones de estado estacionario
Las condiciones de estado estacionario se alcanzan al cabo de 3 ó 4 días, cuando el nivel sérico del medicamento es aproximadamente un 30%-40% más elevado que tras la administración de una sola dosis.
5.3 Datos preclínicos sobre seguridad
Estudios toxicológicos no han revelado otros efectos aparte de los que pueden explicarse debido al perfil hormonal de desogestrel/etinilestradiol Sandoz.
En el contexto de los datos de los estudios preclínicos convencionales sobre toxicidad con dosis repetidas genotocidad, carcinogenicidad y toxicidad para la reproducción no han monstrado riesgo para los humanos. Debe tenerse en cuenta que los esteroides sexuales puede inducir el crecimiento de tejidos dependientes de hormonas y de tumores.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido:
Lactosa monohidrato Todo-rae-alfa-tocoferol (E307)
Povidona K30 Sílice coloidal anhidra Talco (E553b)
Almidón de maíz Ácido esteárico Estearato magnésico Recubrimiento del comprimido:
Hipromelosa (E464)
Dióxido de titanio (E171)
Macrogol 400 (PEG 400)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
24 meses.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
Conservar el blíster en su funda original.
6.5 Naturaleza y contenido del envase
Blíster de PVC transparente como material base principal y lámina selladora de aluminio. Cada blíster se envasa en fundas de aluminio que a su vez se acondicionan en el cartonaje.
Cada blíster contiene 21 comprimidos.
Blíster de PVC/Aclar transparente como material base principal y lámina selladora de aluminio.
Cada blíster se envasa en fundas de aluminio que a su vez se acondicionan en el cartonaje.
Cada blíster contiene 21 comprimidos.
Este medicamento está disponible en envases de 21 (1x21), 63 (3x21), 126 (6x21) y 273 (13x21) comprimidos.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz Farmacéutica, S.A.
Centro Empresarial Osa Mayor Avda. Osa Mayor, n° 4 28023 (Aravaca) Madrid España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Agosto 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
Julio 2014
19 de 19