Deltius 10.000 Ui/Ml Gotas Orales En Solucion
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
DELTIUS 10.000 Ul/ml gotas orales en solución.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución oral (50 gotas) contiene 10.000 UI de colecalciferol (vitamina D3), equivalentes a 0,25mg. 1 gota contiene 200 UI de colecalciferol (vitamina D3)
Para consultar la lista completa de excipientes, ver sección 6.1
3. FORMA FARMACÉUTICA Gotas orales en solución.
Solución oleosa transparente, de incolora a amarillo-verdosa, sin partículas sólidas visibles y/o precipitados.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
• Prevención del raquitismo y la osteomalacia en niños y adultos
• Prevención del raquitismo en niños prematuros
• Prevención de la deficiencia de vitamina D en niños y adultos con riesgo identificado
• Prevención de la deficiencia de vitamina D en niños y adultos con malabsorción
• Tratamiento del raquitismo y la osteomalacia en niños y adultos
4.2 Posología y forma de administración
4.2.1 Posología
1 gota contiene 200 UI de vitamina D3
Población pediátrica
- Prevención de la deficiencia entre 0 y 1 años: 400 UI/día (2 gotas).
- Prevención de la deficiencia entre 1 y 18 años: 600 UI/día (3 gotas).
- Para prevenir la deficiencia en algunos niños, se pueden necesitar dosis de hasta 1000 UI/día (5
gotas).
- Tratamiento de la deficiencia entre 0 y 18 años: 2000 UI/día (10 gotas) durante 6 semanas, seguido de
un tratamiento de mantenimiento de 400-1000 UI/día (2-5 gotas).
Pacientes embarazadas o en período de lactancia:
- Prevención de la deficiencia: 400 UI/día (2 gotas).
- Para prevenir la deficiencia en algunas mujeres, se pueden necesitar dosis de hasta 2000 UI/día (10
gotas). Ver más adelante.
- En caso de que la mujer en período de lactancia haya preferido no suplementar al bebé con vitamina
D3, se podrían necesitar dosis mayores.
Adultos
- Prevención de la deficiencia de vitamina D: 600-800 Ul/día (3-4 gotas). Podrían ser necesarias dosis
mayores en determinadas situaciones, ver más adelante.
- Como adyuvante en el tratamiento específico de la osteoporosis: 800 UI/día (4 gotas).
Poblaciones de alto riesgo de deficiencia en vitamina D, estas poblaciones podrían requerir dosis mayores y monitorización de la 25(OH)D sérica:
- Pacientes institucionalizados u hospitalizados
- Personas de piel oscura
- Personas con exposición limitada al sol debido al uso de prendas protectoras o al uso continuado de
cremas de protección solar.
- Personas obesas
- Pacientes en evaluación por sospecha de osteoporosis
- Pacientes en tratamiento concomitante con algunos medicamentos (por ejemplo, antiepilépticos o
glucocorticoides)
- Mujeres embarazadas
-Pacientes con síndromes de malabsorción, incluyendo enfermedad inflamatoria intestinal ó enfermedad celiaca.
- Pacientes tratados recientemente por deficiencia de vitamina D que requieran tratamiento de mantenimiento.
La ingesta máxima tolerable recomendada de vitamina D3 es la siguiente:
Adultos, incluyendo mujeres embarazadas o en período de lactancia 4000UI/día; niños y adolescentes entre 11 y 17 años 4000UI/día; niños entre 1 y 10 años 2000UI/día; niños entre 0 y 1 año 1000UI/día.
Poblaciones especiales
- Pacientes con deterioro de la función renal:
no se necesita dosis específica.
- Otras situaciones:
pueden ser necesarias dosis mayores (de 2 a 3 veces) para el tratamiento y prevención de la deficiencia de vitamina D en pacientes obesos, en pacientes con síndromes de malabsorción y en pacientes tratados con medicamentos que interfieran el metabolismo de la vitamina D
4.2.2 Forma de administración
Se debería advertir a los pacientes para que tomen Deltius 10.000 UI/ml gotas orales preferiblemente con las comidas (ver sección 5.2 Propiedades farmacocinéticas “Absorción”).
El producto debe agitarse antes de usar.
Deltius 10.000 UI/ml gotas orales tiene sabor a aceite de oliva. Deltius puede tomarse directamente del frasco o mezclado con una pequeña cantidad de comida fría o templada inmediatamente antes de su ingesta. El paciente debe asegurarse de tomar la dosis completa.
En niños, Deltius 10.000 UI/ml gotas orales puede mezclarse con una pequeña cantidad de alimento para niños, yogur, leche, queso u otros productos lácteos. Los padres deberían ser advertidos para que no incorporen Deltius a biberones de leche u otros recipientes con alimentos que el niño no vaya a ingerir por completo, a fin de evitar que el niño no tome la dosis completa. Los padres deberían asegurarse de que el
.<3tt>. 'luis:
niño tome la dosis completa. En caso de niños han superado la etapa de lactancia, la dosis prescrita debe ser administrada junto con alguna comida principal.
Para consultar las instrucciones de uso del medicamento antes de la administración, ver sección 6.6. Instrucciones de uso:
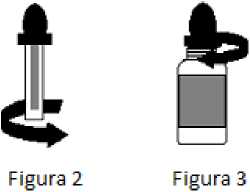
El envase contiene un frasco y un tapón gotero dosificador. El frasco está sellado con un cierre de plástico a prueba de niños. El gotero está protegido mediante un anillo de plástico. Para utilizar el medicamento se han de seguir las instrucciones de uso siguientes:
a. Para abrir el frasco, presionar el tapón hacia abajo y girar al mismo tiempo (ver Figura 1);
b. Antes de utilizar el tapón gotero por primera vez, retirar el anillo de plástico desenroscándolo del gotero (ver Figura 2);
c. Insertar el tapón gotero en el frasco para extraer el contenido. Poner en una cuchara el número de gotas prescritas;
d. Para cerrar el frasco, introducir cuidadosamente el tapón gotero y girarlo hasta su perfecto cierre (no es necesario presionar hacia abajo) (ver Figura 3);
e. Conservar el medicamento en su envase original.
*
Figura 1
4.3 Contraindicaciones
• Hipersensibilidad al principio activo colecalciferol (vitamina D3) o a alguno de los
excipientes incluidos en la sección 6.1.
• Hipercalcemia o hipercalciuria.
• Hipervitaminosis D.
• Cálculos renales (nefrolitiasis, nefrocalcinosis) en pacientes con hipercalcemia crónica.
4.4 Advertencias y precauciones especiales de empleo
Deterioro de la función renal:
La vitamina D3 debería ser utilizada con precaución en pacientes con deterioro de la función renal y se debería monitorizar su efecto sobre los niveles de calcio y fosfato. Se debería tener en cuenta el riesgo de calcificación de los tejidos blandos.
Enfermedades cardiovasculares:
Es necesario tener precaución con los pacientes en tratamiento por enfermedades cardiovasculares (ver sección “4.5. Interacción con otros medicamentos y otras formas de interacción”, en especial la información sobre glicósidos cardiacos que contengan digitalina).
Sarcoidosis:
Deltius debería prescribirse con precaución en pacientes con sarcoidosis, debido a un posible aumento del metabolismo de la forma activa de la vitamina D. En estos pacientes deberían monitorizarse los niveles de calcio en suero y orina.
En caso de tratamiento con otros productos que contengan vitamina D o ingesta de alimentos enriquecidos con vitamina D (incluida leche enriquecida) o dependiendo del grado de exposición solar, se permite un margen de tolerancia en la dosis total de vitamina D3.
No hay evidencia clara sobre la relación entre suplementación con vitamina D3 y aparición de cálculos renales, aunque dicha relación es plausible, especialmente en caso de que la suplementación sea simultánea. La necesidad de suplementación adicional con calcio debería ser considerada de forma individual en cada paciente. La suplementación con calcio debería efectuarse bajo estrecha supervisión médica.
Se ha comunicado un aumento del riesgo de fracturas en personas de edad avanzada asociado a la administración oral de dosis ultra-altas de vitamina D3 (500.000 U.I. en una toma única anual), siendo dicho riesgo mayor durante los 3 primeros meses posteriores a la toma única.
Durante los tratamientos de larga duración en los que la dosis diaria excede de las 1.000 UI de vitamina D3, el calcio sérico ha de ser monitorizado.
4.5 Interacción con otros medicamentos y otras formas de interacción
El uso concomitante de antiepilépticos (como fenitoína) o de barbitúricos o, posiblemente, de otros medicamentos inductores de enzimas hepáticos, puede reducir el efecto de la vitamina D3 mediante su inactivación metabólica.
Se recomienda la monitorización de la concentración de calcio sérico en caso de de tratamiento con diuréticos tiazídicos, ya que éstos pueden reducir la eliminación de calcio en orina.
El uso concomitante de glucocorticoides puede disminuir el efecto de la vitamina D3.
La administración de vitamina D3 puede aumentar el riesgo de toxicidad por digitalina (arritmia), en caso de tratamiento con medicamentos que contengan digitalina u otros glicósidos cardiacos. En estos casos es necesaria una supervisión médica estricta, así como la monitorización de las concentraciones de calcio sérico y, si fuera necesario, controles electrocardiográficos.
La absorción gastrointestinal de vitamina D3 puede verse reducida por el tratamiento simultáneo con resinas intercambiadoras de iones, tales como colestiramina, hidrocloruro de colestipol, orlistat o algunos laxantes como el aceite de parafina.
Algunos agentes citotóxicos como la actinomicina y los antifungicos imidazólicos interfieren con la actividad de la vitamina D3 inhibiendo la conversión de 25-hidroxivitamina D3 a 1,25-dihidroxivitamina D3 mediante el enzima renal 25-hidroxivitamina D-1-hidroxilasa.
4.5.1 Población pediátrica
4.6 Fertilidad, embarazo y lactancia
Durante el embarazo y la lactancia, no se recomiendan las dosis altas de vitamina D3 ydeberían utilizarse, por el contrario, formulaciones con dosis bajas.
4.6.1 Embarazo
Hay muy pocos datos sobre los efectos del colecalciferol (vitamin D3)en mujeres embarazadas. Se ha demostrado toxicidad reproductiva en estudios con animales (ver sección “5.3. Datos preclínicos sobre seguridad”). La ingesta diaria recomendada en mujeres embarazadas es de 400 UI, sin embargo, en caso de mujeres con deficiencia en vitamina D3, se puede administrar una dosis mayor (hasta 2000 UI/día - 10 gotas). Las mujeres embarazadas deberían seguir el consejo de su médico, ya que los requerimientos pueden variar en función de la gravedad de su enfermedad y de su respuesta al tratamiento con vitamina D3 y sus respectivos metabolitos que se eliminan por leche materna.
4.6.2 Lactancia
Si es necesario, se puede prescribir vitamina D3 en mujeres en periodo de lactancia. Esta suplementación no sustituye a la administración de vitamina D3 en el neonato.
No se han observado sobredosis inducidas por madres suplementadas con vitamina D3 durante el período de lactancia en bebés; sin embargo, cuando se prescriba vitamina D3 a un lactante, el médico debe tener en cuenta la dosis adicional de vitamina D3 que está tomando la madre.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No hay datos sobre los efectos de Deltius en la capacidad para conducir y utilizar máquinas. No obstante, un efecto en este sentido parece improbable.
4.8 Reacciones adversas
Las frecuencias de las reacciones adversas se definen como: poco frecuentes (>1/1.000 a <1/100) ó raras (>1/10.000 a <1/1.000).
Trastornos del metabolismo y la nutrición:
Poco frecuentes : hipercalcemia e hipercalciuria
Trastornos de la piel y subcutáneos:
Raros : prurito, rash y urticaria.
Notificación de sospechas de reaciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
El tratamiento con Deltius debería interrumpirse cuando la calcemia supere 10,6 mg / dl (2,65 mmol / l) o si la calciuria supera los 300 mg / 24 horas en adultos o los 4-6 mg / kg / día en niños.
La sobredosis se manifiesta mediante hipercalcemia e hipercalciuria, cuyos síntomas son: náuseas, vómitos, sed, estreñimiento, poliuria, polidipsia y deshidratación.
La sobredosis crónica puede dar lugar a calcificación vascular y orgánica como consecuencia de la hipercalcemia.
Tratamiento en el caso de sobredosis:
Interrumpir el tratamiento con Deltius e iniciar la rehidratación.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: vitamina D3 y análogos, colecalciferol código ATC: A11CC05
5.1.1 Mecanismo de acción
La vitamina D, en su forma biológicamente activa, estimula la absorción intestinal de calcio, la incorporación de calcio en el osteoide y la liberación de calcio del tejido óseo. En el intestino delgado, promueve la captación de calcio, tanto rápida como diferida. Además, estimula el transporte activo y pasivo de fosfato. A nivel renal, inhibe la excreción de calcio y fosfato al favorecer la reabsorción tubular.
La forma biológicamente activa de la vitamina D inhibe directamente la producción de hormona paratiroidea (PTH) en la glándulas paratiroides. La secreción de PTH es inhibida, además, debido al aumento en la absorción de calcio que la forma biológicamente activa de la vitamina D provoca en el intestino delgado.
5.2 Propiedades farmacocinéticas
La farmacocinética de la vitamina D3 es bien conocida.
Absorción:
La vitamina D3 se absorbe fácilmente en el tracto gastro-intestinal en la presencia de sales biliares, por lo que su administración con las principales comidas puede facilitar su absorción.
Distribución y biotransformación:
Inicialmente, la vitamina D3 se hidroxilada en el hígado dando lugar a 25-hidroxi-colecalciferol. Posteriormente es hidroxilada de nuevo en los riñones dando lugar al metabolito activo, 1,25-dihidroxi-colecalciferol (calcitriol).
Eliminación:
Los metabolitos de la vitamina D circulan en el torrente sanguíneo unidos a una globulina plasmática específica, a - globina . La vitamina D y sus metabolitos se excretan principalmente en la bilis y en las heces.
Poblaciones especiales:
3E
Pacientes con alteraciones de la función renal
Se ha comunicado una disminución de un 57% en la tasa de aclaramiento metabólico en pacientes con deterioro de la función renal, en comparación con voluntarios sanos.
Pacientes con síndrome de malabsorción :
Puede producirse una reducción de la absorción y un aumento de la eliminación de la vitamina D3.
Personas obesas :
Para las personas obesas es más difícil poder mantener los niveles de vitamina D con la exposición solar y, en consecuencia, pueden necesitar mayores dosis orales de vitamina D3 para compensar el déficit
5.3 Datos preclínicos sobre seguridad
Los estudios pre-clínicos llevados a cabo en varias especies animales revelaron que los efectos tóxicos en animales tienen lugar a dosis mucho más altas que las requeridas para uso terapéutico en humanos.
En los estudios de toxicidad a dosis repetidas, los acontecimientos adversos más frecuentes fueron aumento de la calciuria y disminución de la fosfaturia y de la proteinuria.
Se ha observado hipercalcemia a dosis altas. En estados de hipercalcemia prolongada, se han dado casos de alteraciones histológicas (calcificación); principalmente en riñones, corazón, aorta, testículos, timo y mucosa intestinal.
Se ha demostrado el efecto teratogénico del colecalciferol (vitamina D3) a dosis altas en animales. Sin embargo, no se observó ningún efecto teratogénico cuando se les administraron dosis de colecalciferol (vitamina D3) dentro del rango terapéutico humano.
El colecalciferol (vitamin D3) no ha demostrado potencial mutagénico ni carcinogenético.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes Aceite de oliva refinado.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 3 años.
Después de la primera apertura del envase, el producto puede ser almacenado durante un período máximo de 6 meses.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30° C.
]£
No refrigerar o congelar.
Conservar en el envase original para protegerlo de la luz.
Para consultar las condiciones de almacenamiento una vez abierto el envase, ver la sección 6.3.
6.5 Naturaleza y contenido del envase
Frascos de vidrio tipo III color topacio de 20ml de capacidad, conteniendo 10ml de gotas orales en solución (correspondientes a 500 gotas) y sellado con un tapón de polipropileno a prueba de niños.
Se adjunta un tapón dosificador con un gotero de cristal tipo II incoloro y tapón de polipropileno.
Cada envase contiene 1 frasco y un tapón gotero dosificador.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Se debe administrar Deltius preferiblemente durante una de las comidas principales (ver sección “5.2, Propiedades farmacocinéticas, Absorción”).
No almacenar ningún producto, ni alimento que contenga Deltius para ser utilizado posteriormente o en la comida siguiente (ver sección “4.2. Posología y forma de administración”).
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
ITALFARMACO, S.A.
San Rafael, 3 - 28108 Alcobendas (Madrid). España Tel.: 916572323
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
78380
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Enero 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
Noviembre 2014
¡y
taños
8 de 8