Combiprasal 0.5 Mg/2.5 Mg Solucion Para Inhalacion Por Nebulizacion
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
COMBIPRASAL 0.5 mg/2.5 mg solución para inhalación por nebulizador
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Composición cualitativa y cuantitativa
Cada ampolla de 2.5 ml contiene 0.5 mg de bromuro de ipratropio (equivalentes a 0.52 mg de bromuro de ipratropio monohidrato) y 2.5 mg de salbutamol (equivalentes a 3 mg de sulfato de salbutamol).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Solución para inhalación por nebulizador.
Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento del broncoespasmo reversible asociado con la enfermedad pulmonar obstructiva crónica (EPOC) en pacientes que requieren más de un único broncodilatador.
4.2 Posología y forma de administración
Combiprasal puede administrarse mediante un nebulizador adecuado o un ventilador de presión positiva intermitente.
La dosis recomendada es:
Adultos
1 envase monodosis, 3 veces al día.
Los pacientes con obstrucción moderada-grave al flujo aéreo pueden beneficiarse de una dosis adicional, es decir 1 envase monodosis 4 veces al día.
Ancianos: Los pacientes ancianos pueden utilizar este medicamento a la dosis recomendada.
Niños: Los niños mayores de 12 pueden utilizar este medicamento a la dosis recomendada. No se ha establecido la seguridad y eficacia de este medicamento en pacientes menores de 12 años.
4.3 Contraindicaciones
Miocardiopatía hipertrófica obstructiva y taquiarritmia.
Historial de hipersensibilidad a la atropina o sus derivados, o a cualquier otro componente del producto.
4.4 Advertencias y precauciones especiales de empleo
Si se requiren dosis superiores a las recomendadas de Combiprasal para el control de los síntomas, el médico deberá revisar el plan terapéutico del paciente.
Los medicamentos inhalados pueden provocar broncoespasmo inducido por inhalación. En caso de disnea aguda o que se agrave rápidamente, debe consultarse de inmediato a un médico.
En raros casos se pueden producir reacciones de hipersensibilidad inmediata después de la administración del preparado, tales como urticaria, angioedema, erupción cutánea, broncoespasmo y edema orofaríngeo.
Al igual que ocurre con otros fármacos anticolinérgicos, este medicamento debe utilizarse con precaución en pacientes con glaucoma de ángulo estrecho, hiperplasia prostática u obstrucción del cuello de la vejiga.
Debe advertirse a los pacientes para que eviten la introducción de la solución en los ojos ajustando adecuadamente la mascarilla. Esto puede provocar o empeorar un glaucoma de ángulo estrecho, dolor o molestia ocular, visión borrosa transitoria, halos visuales o imágenes coloreadas, junto con enrojecimiento ocular por congestión de la conjuntiva y la córnea. Los pacientes deben interrumpir el uso de Combiprasal y consultar inmediatamente al médico cuando aparezcan signos y síntomas de glaucoma de ángulo estrecho.
La sequedad de boca, observada con el tratamiento anticolinérgico, a largo plazo puede asociarse con caries dental.
En las siguientes situaciones, Combiprasal sólo puede ser utilizado después de una cuidadosa valoración de la relación beneficio/riesgo: diabetes mellitus insuficientemente controlada, infarto de miocardio reciente, trastornos vasculares o cardíacos funcionales graves, hipertiroidismo o feocromocitoma.
Se pueden presentar efectos cardiovasculares con cualquier medicamento simpaticomimético, incluido COMBIPRASAL. Hay algunas evidencias de isquemia miocárdica asociada a beta agonistas obtenidas a partir de datos post-comercialización y publicaciones científicas. Debe advertirse a los pacientes con enfermedades cardiacas subyacentes graves (ej. Isquemia cardiaca, arritmia o insuficiencia cardiaca grave) que están siendo tratados con COMBIPRASAL que deben acudir al médico si experimentan dolor torácico u otros síntomas de empeoramiento de la enfermedad cardiaca. Deben valorarse con atención síntomas tales como disnea, dolor torácico, ya que pueden tener un origen tanto respiratorio como cardíaco.
El tratamiento con beta-2 adrenérgicos puede ocasionar una hipopotasemia potencialmente grave.
Además, la hipoxia puede agravar los efectos de la hipopotasemia sobre el ritmo cardíaco.
Los pacientes con fibrosis quística pueden tener mayor riesgo de presentar trastornos de la motilidad gastrointestinal.
Uso en deportistas
Se debe advertir a los pacientes que este medicamento contiene salbutamol, un componente que puede producir un resultado positivo en las pruebas de control de dopaje.
4.5 Interacción con otros medicamentos y otras formas de interacción
La administración simultánea de derivados de la xantina, así como de otros beta-adrenérgicos y anticolinérgicos, puede incrementar los efectos adversos de Combiprasal.
La hipopotasemia inducida por beta-adrenérgicos puede ser potenciada por el tratamiento simultáneo con derivados de la xantina, glucocorticosteroides y diuréticos. Esto debe ser especialmente tenido en cuenta en los pacientes con obstrucción grave de las vías respiratorias.
En los pacientes tratados con digoxina, la hipopotasemia puede conducir a una susceptibilidad incrementada a las arritmias.
En estas situaciones se recomienda monitorizar los niveles de potasio en suero.
La administración simultánea de beta-bloqueantes puede producir una reducción potencialmente grave del efecto broncodilatador.
Los agonistas beta-adrenérgicos deben administrarse con precaución en pacientes tratados con inhibidores de la monoaminooxidasa o antidepresivos tricíclicos, debido a que puede incrementarse la acción de los agonistas beta-adrenérgicos.
La inhalación de hidrocarburos halogenados anestésicos tales como el halotano, tricloroetileno y enflurano puede incrementar la susceptibilidad a los efectos cardiovasculares de los beta-adrenérgicos.
4.6 Fertilidad, embarazo y lactancia
No se dispone de datos clínicos sobre la exposición de Combiprasal durante el embarazo. Los estudios en animales con salbutamol han mostrado fisuras palatinas a dosis elevadas en el ratón.
Sin embargo, no se ha podido demostrar su significación clínica.
Se ha de tener en cuenta el efecto inhibidor de Combiprasal sobre las contracciones uterinas.
El sulfato de salbutamol y el bromuro de ipratropio se excretan en la leche materna y se desconocen sus efectos sobre el neonato. Aunque es poco probable que estas sustancias pasen al lactante en cantidades importantes cuando se administran por inhalación, Combiprasal se debe administrar con precaución a las mujeres en período de lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han llevado a cabo estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se recomienda que los pacientes que vayan a conducir, realizar actividades potencialmente peligrosas o utilizar maquinaria, no superen la dosis recomendada y que tengan en cuenta su respuesta al fármaco.
4.8 Reacciones adversas
Las reacciones adversas que se relacionan a continuación han sido clasificadas por órgano, sistema y frecuencia. Las frecuencias se han definido de la siguiente forma: muy frecuentes (> 1/10), frecuentes (> 1/100 y < 1/10), poco frecuentes (> 1/1000 y < 1/100), raras (> 1/10000 y < 1/1000), muy raras (< 1/10000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). A partir de los datos de los ensayos clínicos se han identificado las reacciones muy frecuentes, frecuentes y poco frecuentes. Los acontecimientos raros y muy raros proceden de datos notificados espontáneamente.
Trastornos del sistema inmunológico
Raras: Reacciones de hipersensibilidad.
Trastornos del metabolismo y de la nutrición
Raras: Hipopotasemia.
Trastornos psiquiátricos
Frecuentes: Nerviosismo.
Raras: Alteraciones psíquicas.
Trastornos del sistema nervioso
Frecuentes: Cefaleas.
Poco frecuentes: Vértigo, temblor, disfonía.
Trastornos oculares
Raras: Glaucoma de ángulo estrecho, aumento de la presión intraocular, dolor ocular, midriasis.
Trastornos cardiacos
Poco frecuentes: Taquicardia, palpitaciones, arritmia.
Desconocida: Isquemia miocárdica *(ver sección 4.4.)
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes: Tos.
Poco frecuentes: Irritación de garganta.
Raras: Broncoespasmo paradójico.
Trastornos gastrointestinales Frecuentes: Sequedad de boca.
Poco frecuentes: Náuseas.
Raras: Vómitos, trastornos de la motilidad gastrointestinal.
Trastornos de la piel y del tejido subcutáneo
Raras: Reacción cutánea, aumento de la sudoración.
Trastornos musculoesqueléticos y del tejido conjuntivo
Raras: Mialgia, calambres musculares, debilidad muscular.
Trastornos renales y urinarios
Poco frecuentes: Retención urinaria
Pruebas complementarias
Raras: Descenso de la presión sanguínea diastólica, aumento de la presión sanguínea sistólica.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es
4.9 Sobredosis
Los síntomas esperados de sobredosificación son los debidos a una excesiva estimulación beta-adrenérgica, siendo los más destacados; taquicardia, palpitaciones, temblor, hipertensión, hipotensión, alteraciones de la amplitud del pulso, dolor anginoso, arritmias y sofocos.
Los síntomas esperados de sobredosificación con bromuro de ipratropio (tales como sequedad de boca, trastornos de la acomodación visual) son generalmente leves y transitorios. En caso de sobredosificación se aplicarán las medidas de soporte adecuadas.
Los beta-bloqueantes, preferiblemente los beta-1 selectivos, son antídotos específicos adecuados; sin embargo, se debe prestar atención a un posible incremento de la obstrucción bronquial y ajustar cuidadosamente la dosis en pacientes con asma bronquial.
*Notificaciones espontáneas de datos post-comercialización, por lo que la frecuencia se clasifica como desconocida.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico Salbutamol y bromuro de ipratropio
Código ATC R03AL02
Combiprasal es una asociación a dosis fijas que proporciona la liberación simultánea de bromuro de ipratropio y sulfato de salbutamol, permitiendo un efecto aditivo sobre los receptores beta2-adrenérgicos y muscarínicos pulmonares y produciendo una broncodilatación superior a la de cada componente por separado.
El bromuro de ipratropio es un fármaco anticolinérgico que inhibe los reflejos vagales por un antagonismo de la acción de la acetilcolina, neurotransmisor liberado por el nervio vago. La broncodilatación que se produce después de la inhalación de bromuro de ipratropio es principalmente local, produciéndose específicamente a nivel de los pulmones, y no tiene carácter sistémico.
El salbutamol sulfato es un fármaco beta-2 adrenérgico que actúa a nivel del músculo liso de las vías aéreas produciendo miorrelajación. El salbutamol relaja todo el músculo liso, de la tráquea a los bronquiolos terminales, y protege frente a todos los estímulos broncoconstrictores.
5.2 Propiedades farmacocinéticas
El bromuro de ipratropio se absorbe rápidamente después de la inhalación oral. Se estima una biodisponibilidad sistémica inferior al 10% de la dosis después de la inhalación. La excreción renal de bromuro de ipratropio es del 46% de la dosis después de la administración intravenosa. La vida media de la fase de eliminación terminal es de aproximadamente 1.6 horas, determinada tras la administración intravenosa y la semivida es de 3.6 horas para el fármaco total y metabolitos después del marcado radioactivo. El bromuro de ipratropio no atraviesa la barrera hematoencefálica.
El salbutamol se absorbe rápida y completamente después de la administración oral, ya sea por vía inhalatoria o digestiva. Las concentraciones plasmáticas máximas de salbutamol se observan a las tres horas siguientes a la administración y el fármaco se excreta inalterado en la orina a las 24 horas. La vida media de eliminación es de 4 horas. El salbutamol atraviesa la barrera hematoencefálica, alcanzando concentraciones que llegan a ser un 5% de las concentraciones plasmáticas.
Existen datos que demuestran que la inhalación conjunta de bromuro de ipratropio y salbutamol no potencia la absorción sistémica de los componentes.
5.3 Datos preclínicos sobre seguridad
Los datos preclínicos no revelan especial riesgo en humanos en base a los estudios convencionales de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico.
Los principios activos por separado, bromuro de ipratropio y sulfato de salbutamol, se han estudiado en modelos de animales, y los aspectos de seguridad no tienen significación clínica cuando Combiprasal se utiliza como solución para nebulización a las dosis recomendadas en pacientes.
En los estudios de toxicidad subcrónica, a dosis elevadas se observaron los efectos cardíacos del salbutamol.
En estudios de teratogénesis, el salbutamol ocasionó fisuras palatinas a dosis elevadas en el ratón. Sin embargo, no se ha podido demostrar su significación clínica.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro sódico Ácido clorhídrico Agua para inyectables
6.2 Incompatibilidades
No se han descrito.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C.
Conservar en el embalaje exterior para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Cada caja contiene 20 ampollas de polietileno de baja densidad en tiras de 10 envueltas por una cubierta de aluminio. Cada ampolla monodosis contiene 2.5 ml de solución.
6.6 Precauciones especiales de eliminación y otras manipulaciones.
Ninguna en especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local
Instrucciones para la correcta administración del preparado:
Su medicación es para inhalación mediante un nebulizador o ventilador, por lo que no debe inyectarse ni
ÜE
tragarse.
1. Prepare su nebulizador siguiendo las instrucciones dadas por el fabricante y su médico. Asegúrese de que el dispositivo nebulizador está limpio.
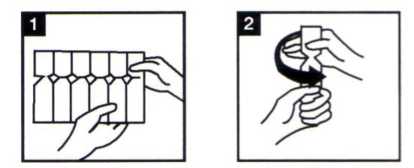
2. Saque de la caja una tira de plástico con ampollas, ábralo y saque una de las ampollas (Fig. 1). Deje el resto de las ampollas en la tira y devuelva ésta a la caja.
3. Coja la ampolla y ábrala girando la parte superior (Fig.2).
4. A menos que su médico le dé otras indicaciones, añada todo el líquido de la ampolla de plástico en el contenedor de solución del nebulizador.
5. Utilice el nebulizador de acuerdo con las instrucciones del médico. Tire la ampolla de plástico vacía.
6. Tras usar el nebulizador, límpielo de acuerdo con las instrucciones del fabricante.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratorio Aldo-Unión, S.L.
Baronessa de Maldá, 73
08950 Esplugues de Llobregat (Barcelona) España
Telf: 93 372 71 11
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
73.561
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
10. FECHA DE LA REVISIÓN DEL TEXTO
Octubre 2013
7 de 7