Cloruro De Sodio Meinsol 9 Mg/Ml Disolvente Para Uso Parenteral
FICHA TÉCNICA

1. NOMBRE DEL MEDICAMENTO
Cloruro de sodio Meinsol 9 mg/ml disolvente para uso parenteral
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
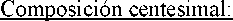
mmol/l
+
Cloruro de sodio 0,9 g Na+
Agua para preparaciones inyectables c.s.p. 100 ml Cl-
mEq/l
154
154
154
154
Cada ml contiene 9 mg de cloruro de sodio.
Osmolaridad: 308 mOsmol/litro.
Para la lista completa de excipientes ver 6.1.
3. FORMA FARMACÉUTICA
Disolvente para uso parenteral.
Solución clara e incolora, libre o prácticamente libre de partículas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Vehículo o diluyente para administración parenteral de medicamentos por vía intravenosa, intramuscular o subcutánea.
4.2 Posología y forma de administración
Posología
La cantidad a utilizar será variable en función de la concentración a la que se vaya a administrar el medicamento que se va a disolver.
Forma de administración
Vía de administración intravenosa, intramuscular o subcutánea.
4.3 Contraindicaciones
Dadas las indicaciones de la especialidad, las contraindicaciones están en función del medicamento a disolver.
Agencia esparioiaóe medicamentos y proouctos san-ianos
ílMt
ÍTTI
En general, la administración de este producto está contraindicada en las siguientes situaciones:
• Hipernatremia
• Hipertonía
• Insuficiencia cardíaca
• Estados edematosos en pacientes con alteraciones cardíacas, hepáticas o renales
• Hipertensión grave
• Acidosis metabólica
4.4 Advertencias y precauciones especiales de empleo
La solución, una vez abierto el envase, debe utilizarse inmediatamente.
En caso de administración subcutánea, no debe añadirse ningún suplemento que pueda cambiar la isotonía.
No usar la solución si no es transparente y sin precipitados.
Antes de añadir el contenido de la ampolla al medicamento, debe verificarse la compatibilidad de la sustancia a administrar con el cloruro sódico.
Los recién nacidos, tanto prematuros como a término, pueden presentar niveles de sodio excesivamente elevados debido a la inmadurez de la función renal. Por tanto, en recién nacidos, tanto prematuros como a término, solo pueden administrarse inyecciones repetidas de cloruro de sodio una vez determinados los niveles de sodio en sangre.
El cloruro de sodio se debe utilizar con precaución en pacientes con hipertensión, fallo cardiaco, edema pulmonar o periférico, insuficiencia renal, pre-eclampsia, hiperaldosteronismo, cirrosis y otras enfermedades del hígado, hipervolemia, obstrucción del tracto urinario, hipoproteinemia y otras enfermedades y tratamientos (e.j. corticosteroides) asociados con retención de sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
Las interacciones están en función del medicamento que se disuelva.
El cloruro sódico presenta incompatibilidad con el carbonato de litio, cuya excreción renal es directamente proporcional a los niveles de sodio en el organismo. De esta manera, la administración de cloruro sódico acelera la excreción renal de litio, dando lugar a una disminución de la acción terapéutica de éste.
Debe evitarse la adición de alcohol a las soluciones de cloruro sódico.
4.6 Fertilidad, embarazo y lactancia
Por las características del medicamento, no es de esperar ningún efecto sobre la mujer embarazada y en el periodo de lactancia, siempre que la administración sea correcta y controlada.
Los datos de numerosos embarazos expuestos, que constan en la literatura científica, indican que la perfusión materna de soluciones de cloruro sódico durante el embarazo no provoca reacciones
ÍTTI
adversas en la salud del feto o del recién nacido. Asimismo, no existen evidencias que indiquen que la administración materna de cloruro de sodio 9 mg/ml durante el periodo de lactancia sea perjudicial para el neonato. Hasta el momento, no se dispone de otros datos epidemiológicos relevantes, ni relacionados con el embarazo ni con la lactancia, por lo que se recomienda que, si se utiliza durante estos períodos, se haga con precaución
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
Pueden producirse trastornos generales y alteraciones en el lugar de la administración.
La administración inadecuada o excesiva de cloruro de sodio 9 mg/ml puede producir hiperhidratación, hipernatremia, hipercloremia y manifestaciones relacionadas, como acidosis metabólica, por disminución de la concentración de bicarbonato, y formación de edemas.
Un exceso de cloruro sódico puede producir náuseas, vómitos, dolor de cabeza.
Cuando se utiliza Cloruro de sodio Meinsol 9 mg/ml, solución inyectable como diluyente de otras preparaciones inyectables, la naturaleza del producto añadido determina la probabilidad de aparición de otros efectos adversos.
En caso de que se produzcan reacciones adversas debidas al medicamento asociado, hay que detener la administración, evaluar al paciente, establecer las medidas correctoras adecuadas y conservar la solución para el posterior análisis si fuese necesario.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, http:\www.notificaram.es.
4.9 Sobredosis
Dada la naturaleza del producto, si su indicación y administración son correctas y controladas, no existe riesgo de intoxicación.
No obstante, un exceso de cloruro sódico, en su forma más aguda, produce deshidratación de los órganos internos, náuseas, vómitos, diarrea, calambres abdominales, sed, disminución de la salivación y lagrimeo, sudoración, fiebre, hipotensión, taquicardia, fallo renal, edema pulmonar, acidosis, paro respiratorio, dolor de cabeza, vértigos, irritabilidad, espasmos musculares, rigidez, coma y muerte.
Población pediátrica
En los niños, el coma y las convulsiones pueden persistir hasta producir lesiones vasculares. También puede aparecer dificultad respiratoria con taquipnea y enrojecimiento de las alas de la nariz.
En el caso de que la ingestión en exceso de cloruro sódico sea reciente, inducir la émesis o realizar un lavado gástrico. Las convulsiones se tratarán con diazepam por vía intravenosa.
.<áp,
Los niveles normales de sodio sérico se restablecerán administrando entre 10 y 15 mmol al día de una solución salina hipotónica por vía intravenosa.
En el caso de lesión renal importante, si el paciente está moribundo o si la concentración de sodio sérico es superior a 200 mmol/litro, llevar a cabo un tratamiento por diálisis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes solventes y diluyentes, incluyendo Soluciones para irrigación. Código ATC: V07AB:
El cloruro sódico, principal sal implicada en la tonicidad del líquido extracelular, se emplea en el tratamiento de la reducción del volumen extracelular, en casos de deshidratación y cuando se produce un déficit de sodio, como ocurre en casos de excesiva diuresis, gastroenteritis o por reducción del consumo de sal.
El sodio, esencial e insustituible, es el principal catión del fluido extracelular y el componente osmótico más importante en el control de la volemia. El ión cloruro, sin embargo, puede ser reemplazado por el ión bicarbonato, siempre disponible para el metabolismo celular en forma de dióxido de carbono.
Cloruro de sodio 9 mg/ml disolvente para uso parenteral presenta la misma presión osmótica que los fluidos corporales.
En los casos de alcalosis leves, la administración de la solución salina fisiológica permitirá la reposición del ión cloruro perdido, mientras que el exceso de bicarbonato será excretado por el riñón, con el consiguiente descenso y normalización de la reserva alcalina.
Asimismo, la solución isotónica de cloruro sódico constituye un vehículo idóneo para la administración de numerosos medicamentos y electrolitos.
5.2 Propiedades farmacocinéticas
Absorción
Dada la administración intravenosa del producto, no se producirá proceso de absorción.
Distribución
Los electrolitos sodio y cloruro se distribuyen, principalmente, en el líquido extracelular. Puesto que la solución salina fisiológica es isotónica, la administración de esta solución no producirá cambio en la presión osmótica del líquido extracelular, por lo que no habrá paso de agua al compartimento intracelular y ambos iones no penetrarán, prácticamente, en la célula.
Sin embargo, sí se producirá un descenso (por dilución) de la presión oncótica de las proteínas plasmáticas, lo que conllevará a un paso de agua al compartimento intersticial a través de las paredes de los capilares, pudiendo así alcanzar la normalidad.
Debe tenerse en cuenta que el tejido más rico en agua es el muscular, mientras que el sodio se halla, principalmente, en el tejido óseo, constituyendo las principales reservas de los mismos.
Eliminación
El ión sodio se elimina, principalmente, a través del riñón (95%) y el resto por la piel (sudoración) y el aparato digestivo.
El agua, por su parte, se elimina a través del riñón, la piel, los pulmones y el aparato digestivo.
Así pues, el riñón constituye el órgano más importante en el mantenimiento de la concentración de sodio extracelular, excretándose mayor o menor cantidad de este catión de acuerdo con las necesidades del organismo, pudiendo llegar a producir orina con concentraciones inferiores a 1mEq sodio/l.
5.3 Datos preclínicos sobre seguridad
La seguridad de las soluciones isotónicas de cloruro sódico está suficientemente reconocida en el campo de la fluidoterapia a nivel mundial, gracias a la amplia experiencia existente con relación al uso de esta solución como restauradora del equilibrio hidroelectrolítico.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Ácido clorhídrico (para ajuste de pH)
Hidróxido de sodio (para ajuste de pH)
Agua para preparaciones inyectables.
6.2 Incompatibilidades
Antes de añadir el contenido de la ampolla a un medicamento, se debe comprobar la compatibilidad de los productos añadidos.
Presenta incompatibilidades con hidrocortisona, anfotericina B, tetraciclinas, cefalotina, eritromicina, lactobionato y sales de litio.
Es incompatible con principios activos no solubles en la solución de cloruro sódico, por eventual precipitación del principio activo, así como con medicamentos cuya estabilidad o solubilidad exijan un pH muy ácido o marcadamente alcalino.
6.3 Periodo de validez
Periodo de validez del medicamento: 2 años
Periodo de validez una vez abierto el envase: uso inmediato
6.4 Precauciones especiales de conservación
No se precisan condiciones especiales de conservación.
ÍTTI
6.5 Naturaleza y contenido del envase
Ampollas de polietileno de baja densidad (LDPE).
- Envase con 20 ampollas de 5 ml (Envase Clínico)
- Envase con 50 ampollas de 5 ml (Envase Clínico)
- Envase con 20 ampollas de 10 ml (Envase Clínico)
- Envase con 50 ampollas de 10 ml (Envase Clínico)
- Envase con 20 ampollas de 20 ml (Envase Clínico)
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
No es preciso aseptizar la ampolla antes de su apertura.
No es necesario ningún elemento cortante para abrir la ampolla.
Una vez abierta la ampolla, la boquilla se ajusta perfectamente al cono de la jeringa (cono Luer), con lo cual no es necesario utilizar aguja.
Para abrir:
Para separar una ampolla del resto, gire una ampolla sobre sí misma en contra del resto de las ampollas de la tira sin tocar la cabeza y cuello de las ampollas (1). Agitar la ampolla con un único movimiento tal como se muestra en el dibujo para eliminar el líquido que pueda estar en el tapón (2).
Para abrir la ampolla, girar el cuerpo y la cabeza de la ampolla en sentidos opuestos hasta que se rompa por el cuello (3). Conectar la jueringa Luer o Luer-lock tal como se muestra en el dibujo (4).
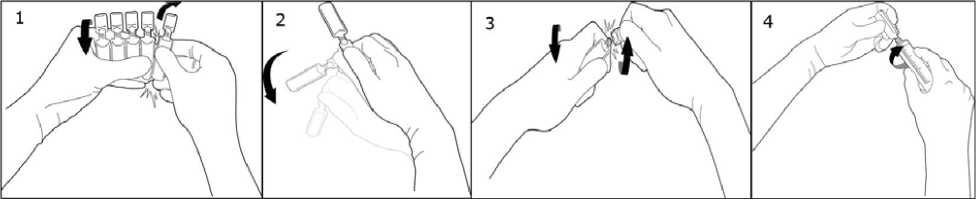
Por lo que no se necesita aguja para extraer la solución.
Extraer el líquido.
No contiene ningún tipo de conservador ni bactericida, por lo que las ampollas abiertas y no utilizadas deberán desecharse inmediatamente.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Fresenius Kabi España, S.A.U.
Marina 16-18, 08005 - Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
59.374
an
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
26.05.1992
10. FECHA DE LA REVISIÓN DEL TEXTO
15 de Enero de 2015
7 de 7