Clinimix N14G30E Solucion Para Perfusion
'P'
sm
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Clinimix N14G30E solución para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
CLINIMIX N14G30E se acondiciona en una bolsa de plástico de dos compartimentos que contienen respectivamente una solución de aminoácidos con electrolitos y una solución de glucosa con calcio.
La solución de aminoácidos contiene 15 L-aminoácidos (8 aminoácidos esenciales) necesarios para la síntesis proteica.
El perfil de aminoácidos es el siguiente:
- Aminoácidos esenciales/Aminoácidos totales = 41,3 %
- Aminoácidos esenciales/Nitrógeno total = 2,83
- Aminoácidos de cadena ramificada/Aminoácidos totales = 19 %
La composición cuantitativa de CLINIMIX N14G30E es la siguiente:
|
Solución de aminoácidos al 8,5% con electrolitos |
Solución de glucosa al 30 % con calcio | |
|
Principios activos L-Leucina |
6,20 g/l | |
|
L-Fenilalanina |
4,76 g/l | |
|
L-Metionina |
3,40 g/l | |
|
L-Lisina |
4,93 g/l | |
|
(como L-Lisina hidrocloruro) |
(6,16) g/l | |
|
L-Isoleucina |
5,10 g/l | |
|
L-Valina |
4,93 g/l | |
|
L-Histidina |
4,08 g/l | |
|
L-Treonina |
3,57 g/l | |
|
L-Triptófano |
1,53 g/l | |
|
L-Alanina |
17,6 g/l | |
|
L-Arginina |
9,78 g/l | |
|
Glicina |
8,76 g/l | |
|
L-Prolina |
5,78 g/l | |
|
L-Serina |
4,25 g/l | |
|
L-Tirosina |
0,34 g/l | |
|
Acetato de sodio trihidrato |
5,94 g/l | |
|
Fosfato de potasio dibásico |
5,22 g/l | |
|
Cloruro de sodio |
1,54 g/l | |
|
Cloruro de magnesio hexahidrato |
1,02 g/l | |
|
Glucosa |
300 g/l | |
|
(como glucosa monohidrato) |
(330) g/l | |
|
Cloruro de calcio dihidrato |
0,66 g/l |
Para consultar la lista completa de excipientes ver sección 6.1
Después de mezclar los contenidos de ambos compartimentos, la composición de la mezcla binaria, para todos los tamaños de bolsa disponible es la siguiente:
|
N14G30E 1 litro |
N14G30E 1,5 litros |
N14G30E 2 litros | |||
|
Nitrógeno (g) |
7,0 |
10,5 |
14,0 | ||
'p'
sm
|
Aminoácidos (g) Glucosa (g) |
43 150 |
64 225 |
85 300 |
|
Calorías totales (kcal) |
770 |
1155 |
1540 |
|
Calorías de glucosa (kcal) |
600 |
900 |
1200 |
|
Sodio (mmol) |
35 |
53 |
70 |
|
Potasio (mmol) |
30 |
45 |
60 |
|
Magnesio (mmol) |
2,5 |
3,8 |
5,0 |
|
Calcio (mmol) |
2,3 |
3,4 |
4,5 |
|
Acetato (mmol) |
70 |
105 |
140 |
|
Cloruro (mmol) |
40 |
60 |
80 |
|
Fosfato como HPO42-(mmol) |
15 |
23 |
30 |
|
pH Osmolaridad (mOsm/l) |
6 1415 | ||
3. FORMA FARMACÉUTICA
Solución para perfusión.
• Apariencia antes de la mezcla de los compartimentos: las soluciones de aminoácidos y de glucosa son transparentes e incoloras o ligeramente amarillentas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Nutrición parenteral cuando la alimentación oral o enteral es imposible, insuficiente o está contraindicada.
Para pacientes en nutrición parenteral a largo plazo, es posible añadir a CLINIMIX una emulsión de lípidos para proporcionar tanto calorías como ácidos grasos esenciales.
4.2 Posología y forma de administración
Posología
La dosificación se elige de acuerdo con las necesidades metabólicas, el consumo energético y el estado clínico del paciente.
Para adultos, las necesidades oscilan entre 0,16 g de nitrógeno/kg/día (aproximadamente 1 g de aminoácidos/kg/ día) y 0,35 g de nitrógeno/kg/ día (aproximadamente 2 g de aminoácidos/kg/ día).
Para niños, las necesidades varían entre 0,35 g de nitrógeno/kg/ día (aproximadamente 2 g de aminoácidos/kg/ día) y 0,45 g de nitrógeno/kg/ día (aproximadamente 3 g de aminoácidos/kg/ día).
Las necesidades calóricas oscilan entre 25 kcal/kg/día y 40 kcal/kg/día, dependiendo del estado nutricional del paciente y del grado de catabolismo.
La dosis máxima diaria de cada constituyente de CLINIMIX N14G30E (p.e. aminoácidos y glucosa) debe estar basada en los requerimientos nutricionales individuales totales y la tolerancia del paciente.
La máxima velocidad de perfusión es de 1,7 ml/kg/hora o de 100 ml/hora a 120 ml/hora (para un paciente de 60 a 70 kg de peso). La dosis diaria máxima es de 40 ml/kg p.e. de 2400 ml a 2800 ml (para un paciente de 60 a 70 kg de peso).
•4^
am
Población pediátrica: no hay datos disponibles.
Forma de administración Para un solo uso.
Se recomienda que después de abrir la bolsa, el contenido sea utilizado inmediatamente, y no se almacene para una perfusión posterior.
Únicamente administrar el producto después de romper el sello no permanente y mezclar el contenido de ambos compartimentos. Apariencia después de la mezcla: solución transparente e incolora o ligeramente amarillenta. Para las instrucciones de preparación y manejo, ver sección 6.6.
En caso de administración periférica la osmolaridad de la solución para perfusión específica se debe tener en cuenta. Las soluciones o mezclas con una osmolaridad superior a 800 mOsm/l deberían perfundirse por vena central (ver Sección 4.4).
Cuando sea apropiado, en casos particulares se pueden añadir vitaminas y oligoelementos así como otros componentes (incluyendo los lípidos) al régimen, para prevenir las deficiencias y el desarrollo de complicaciones (ver Sección 6.2).
La velocidad de flujo se debe aumentar gradualmente durante la primera hora.
La velocidad de administración debe ser ajustada de acuerdo con la dosis, las características de la solución perfundida, la ingesta de volumen total por 24 horas y la duración de la perfusión. El tiempo de perfusión debe ser superior a 8 horas.
Para reducir el riesgo de hipoglucemia después de la interrupción, se debe considerar la posibilidad de una disminución gradual en la velocidad de flujo en la última hora de la administración.
4.3 Contraindicaciones
• Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1 o a los componentes del envase
• Alteraciones del metabolismo de los aminoácidos
• Hiperglucemia grave
• Acidosis metabólica, hiperlactatemia
• CLINIMIX con electrolitos (CLINIMIX N14G30E) no debe utilizarse en pacientes con hiperpotasemia e hipernatremia, ni en pacientes con concentraciones plasmáticas de magnesio, calcio, y/o fósforo patológicamente elevadas.
• Como en otras soluciones de perfusión que contienen calcio, la administración concomitante de ceftriaxona y CLINIMIX N14G30E está contraindicada en recién nacidos (< 28 días de edad), aunque se utilicen líneas de infusión separadas (riesgo de precipitación mortal de la sal de calcio con ceftriaxona en el torrente sanguíneo del recién nacido). Para la co-administracion en pacientes ancianos, ver secciones 4.5. y 6.2.
4.4 Advertencias y precauciones especiales de empleo
ADVERTENCIAS
Con formulaciones de CLINIMIX se han notificado reacciones de hipersensibilidad/a la perfusión, incluyendo hipotensión, hipertensión, cianosis periférica, taquicardia, disnea, vómitos, náuseas, urticaria, erupción cutánea, prurito, eritema, hiperhidrosis, fiebre y escalofríos.
.<gp.
Con otros productos de nutrición parenteral se ha notificado anafilaxia.
Al iniciar cualquier perfusión intravenosa es necesaria una monitorización clínica especial. En caso de producirse signo o síntoma anormal, por ejemplo una reacción de hipersensibilidad o reacción a la perfusión, debe interrumpirse la perfusión inmediatamente.
Las soluciones que contienen glucosa se deben usar con precaución, en todo caso, en pacientes con alergia conocida al maíz o productos derivados del maíz.
Se han notificado precipitados vasculares pulmonares en pacientes que reciben nutrición parenteral. En algunos casos, se han producido resultados mortales. La adición excesiva de calcio y fosfato aumenta el riesgo de la formación de precipitados de fosfato de calcio. Los precipitados se han notificado incluso en ausencia de la sal de fosfato en la solución. También se han notificado precipitación distal en el filtro en línea y se sospecha en la formación de precipitado in vivo.
Si se presentan signos de sufrimiento pulmonar, la perfusión debe interrumpirse e iniciarse una evaluación médica.
Además de la inspección de la solución, el equipo de infusión y el catéter también deben ser comprobados periódicamente buscando precipitados.
En los pacientes mayores de 28 días (incluyendo adultos), no debe administrarse ceftriaxona por vía intravenosa al mismo tiempo que las soluciones que contienen calcio, incluyendo CLINIMIX N14G30E, a través de la misma vía de perfusión (por ejemplo conector en Y). Si se utiliza la misma línea de perfusión para la administración secuencial, debe limpiarse cuidadosamente con un líquido compatible entre las infusiones.
La utilización de catéteres intravenosos para administrar formulaciones parenterales, un mal mantenimiento de los catéteres o las soluciones contaminadas pueden dar lugar a infección y sepsis. La inmunosupresión y otros factores, como la hiperglucemia, la desnutrición y/o el estado de enfermedad subyacente pueden predisponer a los pacientes a complicaciones infecciosas.
El cuidado sintomático y el control de laboratorio de fiebre/escalofríos, leucocitosis, complicaciones técnicas con el dispositivo de acceso y la hiperglucemia pueden ayudar a reconocer las infecciones tempranas.
La aparición de complicaciones sépticas se puede disminuir haciendo un mayor énfasis en el uso de una técnica aséptica en la colocación del catéter, en su mantenimiento, y en la preparación de la fórmula nutricional.
La realimentación de pacientes gravemente desnutridos puede dar a un síndrome de realimentación, que se caracteriza por el cambio del potasio, fósforo y magnesio intracelular dado que el paciente se encuentra en estado anabólico. También pueden aparecer una deficiencia de tiamina y una retención de líquidos. La supervisión estricta y la ingesta gradual de nutrientes evitando la sobrealimentación pueden prevenir estas complicaciones.
Las soluciones hipertónicas pueden provocar irritación venosa si se perfunden a través de una vena periférica. La elección de una vena periférica o de una vena central depende de la osmolaridad final de la mezcla.
El límite aceptado generalmente para una perfusión periférica es alrededor de 800 mOsm/l, pero varía considerablemente con la edad y estado general del paciente y las características de las venas periféricas.
No conectar en serie envases de plástico con el fin de evitar embolias gaseosas debidas al posible aire residual contenido en el envase primario.
4 de 14 MINISTRO DE
SANIDAD, POLITICA SOCIALE IGUALDAD Agaica es parlo» de medicamentos y proouctos sanearos
PRECAUCIONES
Antes de iniciar la perfusión, deben corregirse las alteraciones graves en el equilibrio del agua y los electrolitos, los estados graves de sobrecarga de fluidos, y los trastornos metabólicos graves.
Se pueden producir complicaciones metabólicas si la ingesta de nutrientes no se adapta a los requerimientos del paciente, o la capacidad metabólica de cualquier componente alimenticio no es evaluada con precisión. Pueden aparecer efectos metabólicos adversos por la administración inadecuada o excesiva de nutrientes, o por la composición de una mezcla no apropiada para las necesidades específicas del paciente.
Es imprescindible realizar evaluaciones clínicas y determinaciones de laboratorio con frecuencia para el correcto control durante la administración. Éstas incluirán determinación de ionograma y pruebas funcionales del riñón y del hígado.
Deben determinarse y controlarse cuidadosamente las necesidades electrolíticas de los pacientes que reciban estas soluciones, sobre todo en el caso de soluciones sin electrolitos.
La intolerancia a la glucosa es una complicación metabólica común en pacientes gravemente estresados. La perfusión de esta solución puede producir hiperglucemia, glucosuria y síndrome hiperosmolar. La glucosa en sangre y orina debe controlarse de forma rutinaria y si es necesario, para los diabéticos debe adaptarse la dosis de insulina.
Usar con precaución en pacientes con insuficiencia renal, especialmente si hay una hiperpotasemia presente, debido al riesgo de aparición o empeoramiento de la acidosis metabólica e hiperazotemia si no se está realizando la eliminación extra-renal de los desechos. El estado de los líquidos y electrolitos debe ser controlado cuidadosamente en estos pacientes. En caso de insuficiencia renal grave, se deben elegir soluciones de aminoácidos especialmente formuladas.
Se debe tener precaución al administrar Clinimix a los pacientes con insuficiencia suprarrenal.
Se debe evitar la sobrecarga circulatoria especialmente en pacientes con edema pulmonar, insuficiencia y/o fallo cardíaco. El estado de los fluidos debe controlarse cuidadosamente.
Aparte de las pruebas de la función hepática de rutina, en los pacientes con enfermedad hepática preexistente o insuficiencia hepática se deben controlar los posibles síntomas de hiperamonemia.
Es conocido que en algunos pacientes con nutrición parenteral aparecen trastornos hepatobiliares incluyendo colestasis, esteatosis hepática, fibrosis y cirrosis, que pueden dar lugar a insuficiencia hepática, así como colecistitis y colelitiasis. Se cree que la etiología de estos trastornos es multifactorial y puede diferir entre pacientes. Aquellos que desarrollen parámetros de laboratorio anormales u otros signos de trastornos hepatobiliares deben ser evaluados rápidamente por un experto clínico en enfermedades hepáticas con el fin de identificar los posibles factores causales y contribuyentes, y las posibles intervenciones terapéuticas y profilácticas.
En pacientes que reciben soluciones de aminoácidos puede tener lugar un aumento de los niveles de amoniaco en sangre y la hiperamonemia. En algunos pacientes, esto puede indicar la presencia de un trastorno congénito del metabolismo de los aminoácidos (véase la Sección 4.3) o de una insuficiencia hepática.
Se debe medir con frecuencia el amoníaco en sangre en recién nacidos y lactantes para detectar la hiperamonemia, que puede indicar la presencia de una anormalidad congénita del metabolismo de los aminoácidos.
Según el grado y etiología, la hiperamonemia puede requerir una intervención inmediata.
.<gp.
Una perfusión de aminoácidos demasiado rápida puede provocar náuseas, vómitos y escalofríos. En estos casos hay que interrumpir inmediatamente la perfusión.
En general, la dosis para los pacientes ancianos debe ser cautelosa, teniendo en cuenta la mayor frecuencia de insuficiencia hepática, renal o cardíaca y de enfermedades concomitantes o la farmacoterapia.
Población pediátrica
• No se han realizado estudios en la población pediátrica.
• Ver más arriba en relación con el seguimiento de la hiperamonemia en pacientes pediátricos.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
Al igual que en otras soluciones para perfusión que contienen calcio, el tratamiento concomitante con ceftriaxona y CLINIMIX N14G30E está contraindicado en recién nacidos (< 28 días de edad), incluso si las líneas para la perfusión se usan por separado (riesgo de precipitados mortales de sales de ceftriaxona-calcio en el torrente sanguíneo del recién nacido (ver sección 4.3).
En pacientes mayores de 28 días (incluyendo adultos), no debe administrarse ceftriaxona por vía intravenosa al mismo tiempo que las soluciones que contienen calcio, incluyendo las soluciones de CLINIMIX N14G30E, a través de la misma vía de perfusión.
Si se utiliza la misma línea de perfusión para la administración secuencial, debe limpiarse cuidadosamente con un líquido compatible entre las infusiones (ver sección 4.4).
Por su contenido en potasio, CLINIMIX N14G30E se debe administrar con precaución en pacientes tratados con fármacos o productos que pueden causar o aumentar el riesgo de hiperpotasemia, tales como diuréticos ahorradores de potasio (amilorida, espironolactona, triamtereno), con inhibidores de la enzima convertidora de la angiotensina (IECA), con los antagonistas del receptor II de la angiotensina o con los inmunosupresores tacrolimus y ciclosporina.
4.6 Fertilidad, embarazo y lactancia
La seguridad de CLINIMIX en la fertilidad, el embarazo y la lactancia no ha sido probada debido a la falta de estudios clínicos. El prescriptor debe considerar la relación riesgo/beneficio para administrar CLINIMIX a mujeres embarazadas o en lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas potenciales pueden producirse como resultado de unas condiciones de uso inadecuadas: por ejemplo, sobredosis, una perfusión demasiado rápida (Ver secciones 4.4 y 4.9).
Reacciones adversas post-comercialización
Las reacciones adversas que se han notificado con las formulaciones de CLINIMIX en la experiencia postcomercialización, se enumeran por la clasificación de órganos sistema de MedDRA (SOC) y por término preferente.
'p'
sm
|
(SOC) | ||
|
Trastornos del sistema inmunológico |
Hipersensibilidad* |
No conocida |
a: la frecuencia se define como Muy frecuentes (>1/10); Frecuentes(>.1/100 a <1/10); Poco frecuentes (>1/1.000 a <1/100); Raras (>1/10.000 a <1/1.000); Muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
* Incluye las siguientes manifestaciones: hipotensión, hipertensión, cianosis periférica, taquicardia, disnea, vómitos, náuseas, urticaria, erupción cutánea, prurito, eritema, hiperhidrosis, fiebre, escalofríos.
Reacciones ligadas a la clase
Otras reacciones adversas notificadas con nutrición parenteral incluyen:
• Anafilaxia.
• Precipitados vasculares pulmonares.
• Hiperglucemia, hiperamonemia, azotemia.
• Insuficiencia hepática, cirrosis hepática, fibrosis hepática, colestasis, esteatosis hepática, aumento de bilirrubina en sangre, aumento de las enzimas hepáticas.
• Colecistitis, colelitiasis.
• Tromboflebitis en el lugar de perfusión, irritación venosa (flebitis en el lugar de la perfusión, dolor, eritema, ardor, tumefacción, induración).
La intolerancia a la glucosa es una complicación metabólica común en pacientes graves. La infusión de la solución puede provocar hiperglucemia, glucosuria y síndrome hiperosmolar.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
En el caso de una administración inapropiada (sobredosis y/o velocidad de perfusión superior a la recomendada), pueden aparecer hipervolemia, alteraciones electrolíticas o acidosis y dar lugar a consecuencias graves o fatales. En tales situaciones, la perfusión debe detenerse inmediatamente. Además, si es oportuno desde el punto de vista médico, pueden estar indicadas otras intervenciones.
Con una perfusión excesiva de glucosa puede producirse hiperglucemia, glucosuria y un síndrome hiperosmolar.
Una perfusión demasiado rápida de aminoácidos puede dar como resultado náuseas, vómitos y escalofríos. En estos casos, interrumpir la perfusión inmediatamente (ver sección 4.4).
En algunos casos serios, puede ser necesaria la hemodiálisis, hemofiltración o hemodiafiltración.
No existe un antídoto específico para la sobredosis. Los procedimientos de emergencia deben incluir las medidas correctoras adecuadas, con especial atención a los sistemas respiratorio y cardiovascular.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: soluciones para nutrición parenteral / mezclas Código ATC: B05BA10
Como fluido intravenoso para nutrición parenteral, las soluciones para perfusión CLINIMIX proporcionan aporte nutritivo para mantener el complejo equilibrio nitrógeno/energía que puede resultar alterado por depleción nutritiva y trauma. Las soluciones CLINIMIX suministran una fuente de nitrógeno disponible biológicamente (L-aminoácidos), hidratos de carbono (como glucosa) y electrolitos.
5.2 Propiedades farmacocinéticas
Los aminoácidos, electrolitos y glucosa de CLINIMIX se distribuyen, metabolizan y excretan de forma idéntica a la de las soluciones intravenosas de aminoácidos, glucosa y electrolitos por separado.
5.3 Datos preclínicos sobre seguridad
No se han realizado estudios preclínicos con CLINIMIX.
Los estudios preclínicos realizados utilizando las soluciones de aminoácidos y glucosa contenidas en CLINIMIX con diferentes composiciones cualitativas y concentraciones no han revelado, no obstante, ninguna toxicidad específica.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Solución de aminoácidos: Ácido acético glacial (para ajuste del pH)
Agua para preparaciones inyectables
Solución de glucosa: Ácido clorhídrico (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Los aditivos pueden ser incompatibles: dirigirse al fabricante para más detalles.
Si es necesario añadir aditivos, se deben revisar las compatibilidades y controlar la estabilidad de las mezclas.
La solución no debe administrarse con, antes, ni después de una administración de sangre a través del mismo equipo, dada la posibilidad de pseudoaglutinación.
CLINIMIX N14G30E contiene iones de calcio lo que supone un riesgo adicional de coagulación en sangre anticoagulada/conservada con citrato, o sus componentes.
Como con cualquier mezcla de nutrición parenteral, las proporciones de calcio y fosfato deben ser tenidas en cuenta. La adición de un exceso de calcio y fosfato, especialmente en forma de sales minerales, puede dar lugar a la formación de precipitados de fosfato de calcio.
• Como en otras soluciones de perfusión que contienen calcio, la administración concomitante de ceftriaxona y CLINIMIX N14G30E está contraindicada en recién nacidos (< 28 días de edad),
úfe
aunque se utilicen líneas de perfusión separadas (riesgo de precipitación mortal de la sal de calcio con ceftriaxona en el torrente sanguíneo del recién nacido).
• En pacientes mayores de 28 días (incluyendo adultos), no debe administrarse ceftriaxona por vía intravenosa al mismo tiempo que las soluciones que contienen calcio, incluyendo las soluciones de CLINIMIX N14G30E, a través de la misma vía de perfusión (ver sección 4.4).
• Si se utiliza la misma línea de perfusión para la administración secuencial, debe limpiarse cuidadosamente con un líquido compatible entre las perfusiones.
6.3 Periodo de validez
- El periodo de validez es de 2 años para la bolsa doble en su sobrebolsa.
- Tras la activación del sello no permanente, se ha demostrado que la estabilidad química y física en uso es de 7 días a 2-8°C, seguida de 48 horas a temperatura inferior a 25°C.
- Desde el punto de vista microbiológico, las mezclas deben utilizarse inmediatamente después de realizar las adiciones. Si no se utilizan inmediatamente, el tiempo de conservación en uso y las condiciones antes de su utilización son responsabilidad del usuario, no debiendo ser superior a 24 horas a 2-8°C, a menos que las adiciones se hubieran realizado en condiciones asépticas controladas y validadas. Si se precisan períodos de conservación más largos en condiciones excepcionales, se puede contactar con la compañía dado que dispone de datos de estabilidad física y química en uso a 7 días a 2-8°C seguidos de 48 horas a temperatura inferior a 25°C para los productos indicados en la sección 6.6.c.
6.4 Precauciones especiales de conservación
No congelar.
Para las condiciones de conservación del medicamento, ver sección 6.3.
Para el producto suministrado en sobrebolsa transparente, mantener la bolsa en la caja de cartón de envío para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
CLINIMIX N14G30E está acondicionado en una bolsa de plástico con dos compartimentos que contienen respectivamente una solución de aminoácidos con electrolitos y una solución de glucosa con calcio.
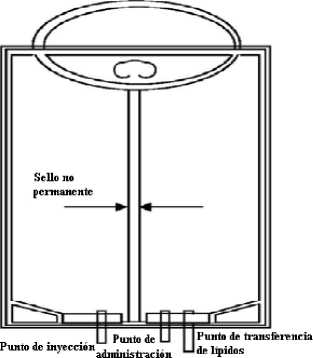
El envase doble consta de una bolsa de plástico multicapa acondicionada en una sobrebolsa que actúa como una barrera de oxígeno. La sobrebolsa puede ser una lámina plástica aluminizada o una lámina plástica transparente con una bolsita con absorbente de oxígeno. Después de retirar la sobrebolsa debe desecharse la bolsita. El material de la bolsa es una lámina plástica multicapa, cuya capa interna es de EVA (etil vinil acetato). La bolsa se presenta en uno de los dos diseños, con sello no permanente horizontal o vertical (Ver Figuras 2 y 4 respectivamente). La situación de los tubos de las bolsas depende del diseño. El plástico multicapa es compatible con lípidos.
Ambos compartimentos están separados por un sello no permanente. Justo antes de la administración, debe mezclarse el contenido de las cámaras presionado o haciendo rodar los compartimentos para romper el sellado.
Están disponibles 3 formatos distintos:
9 de 14 MINISTBUODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agaiciaespaiaaoe medie ámenlos y prooucios sawlanos
1 litro Tamaño de envase: 8
1 bolsa de 1 litro
1,5 litros Tamaño de envase: 6
1 bolsa de 1,5 litros
2 litros Tamaño de envase: 4
1 bolsa de 2 litros
Los volúmenes de los compartimentos son los siguientes:
|
Tamaño de la bolsa | |||
|
Compartimentos |
1 l |
1,5 l |
2 l |
|
Solución aminoácidos |
500 ml |
750 ml |
1000 ml |
|
Solución glucosa |
500 ml |
750 ml |
1000 ml |
Puede ser que no todos los tamaños se comercialicen.
6.6 Precauciones especiales de eliminación y otras manipulaciones
ADVERTENCIA: Únicamente administrar el producto después de romper el sello no permanente y mezclar el contenido de ambos compartimentos.
Las soluciones CLINIMIX se presentan en dos diseños de bolsa diferentes, para mayor detalle ver la Sección 6.5. Las siguientes instrucciones de uso aplican a ambos diseños.
La activación de CLINIMIX puede realizarse en la sobrebolsa o tras su apertura.
a. Abrir la sobrebolsa
- Usar las incisiones a ambos lados para rasgar la sobrebolsa.
- No utilizar a menos que la solución sea trasparente, incolora o ligeramente amarillenta y el envase esté sin dañar.
b. Mezclar las soluciones
- Verificar que el producto está a temperatura ambiente.
- Sujetar firmemente el envase por ambos lados de la parte superior de la bolsa.
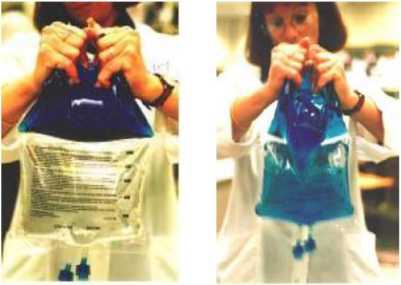
- Apretar para activar, (véase figura 1 o 3). El producto suministrado con diseño de sello no permanente vertical puede también activarse enrollando la bolsa (ver la Figura 3).
- Mezclar invirtiendo la bolsa 2 o 3 veces.
- Apariencia después de la mezcla: solución transparente e incolora o ligeramente amarillenta.
c. Adición a CLINIMIX (ver también la sección 6.2)
Para llevar a cabo una adición:
• Debe realizarse en condiciones de asepsia.
• Garantizar la estabilidad y la compatibilidad de los aditivos.
• Activar las cámaras de bolsa antes de la introducción de los aditivos.
• Preparar el punto de inyección de la bolsa.
• Perforar el punto de inyección e inyectar los aditivos utilizando una aguja o un dispositivo de reconstitución.
• Mezclar vigorosamente la solución y los aditivos.
• Inspeccionar la solución final para buscar partículas y decoloración.
• Comprobar si hay fugas en la bolsa.
• Verificar que se siguen los requisitos de almacenamiento de aditivos adecuados.
10 de 14 MINISTBUODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia espado» de medicamentos y proouctos samtanos
.<$p.
1Q«
mi
am
Al igual que con todas las soluciones parenterales, se debe verificar la compatibilidad cuando se utilizan aditivos. Es obligatoria una mezcla aséptica, minuciosa y cuidadosa de los mismos.
Advertencia: La suplementación puede hacerse después de abrir los sellos no permanentes para todos los aditivos (una vez que se han mezclado las dos soluciones). CLINIMIX puede suplementarse con:
- Emulsiones lipídicas (por ejemplo ClinOleic) a un ritmo de 50 a 250 ml por litro de CLINIMIX.
Nitrógeno (g) Aminoácidos (g) Glucosa (g) Lípidos (g)_
Calorías totales (kcal) Calorías de glucosa (kcal) Calorías lipídicas (kcal) Relación glucosa/lípidos
Sodio (mmol)
Potasio (mmol)
Magnesio (mmol)
Calcio (mmol)
Acetato (mmol)
Cloruro (mmol)
Fosfato como HPO42 (mmol)
pH
Osmolaridad (mOsm/l)
CLINIMIX N14G30E 1 l
+ 250 ml de Lípidos 20%*
7,0
43
150
50
1270
600
500
55/45
35
30
2,5
2,3
70
40
15
6
1190
CLINIMIX N14G30E 1,5 l
+ 250 ml de Lípidos 20%*
10,5
64
225
50
1655
900
500
64/36
53
45
3,8
3,4
105
60
23
6
1255
CLINIMIX N14G30E 2 l
+ 500 ml de Lípidos 20%*
14,0
85
300
100
2540
1200
1000
55/45
70
60
5,0
4,5
140
80
30
6
1190
Electrolitos: por litro de CLINIMIX
Hasta una concentración final de
|
Sodio |
Potasio |
Magnesio |
Calcio |
|
80 mmol |
60 mmol |
5,6 mmol |
3,0 mmol |
Elementos traza: por litro de CLINIMIX
Hasta una concentración final de
|
Cobre |
10 gmol |
Zinc |
77 pmol |
|
Cromo |
0,14 pmol |
Manganeso |
2,5 pmol |
|
Flúor |
38 gmol |
Cobalto |
0,0125 pmol |
|
Selenio |
0,44 pmol |
Molibdeno |
0,13 pmol |
|
Yodo |
0,5 pmol |
Hierro |
10 pmol |
Vitaminas: por litro de CLINIMIX
Hasta una concentración final de
|
Vitamina A |
1750 UI |
Biotina |
35 pg |
|
Vitamina B6 |
2,27 mg |
Vitamina B1 |
1,76 mg |
|
Vitamina D |
110 UI |
Ácido fólico |
207 pg |
|
Vitamina B12 |
3,0 pg |
Vitamina B2 |
2,07 mg |
|
Vitamina E |
5,1 mg |
Vitamina C |
63 mg |
|
Vitamina PP |
23 mg |
Vitamina B5 |
8,63 mg |
|
Vitamina K |
75 pg | ||
.<gp.
Datos de estabilidad para la suplementación de CLINIMIX con otras emulsiones lipídicas comercializadas y otros aditivos o nutrientes están disponibles bajo petición.
Si se observa la formación de una ligera crema, mezclar completamente la mezcla mediante una suave agitación para obtener una emulsión uniforme antes de la perfusión.
Las adiciones deben efectuarse en condiciones asépticas.
Las adiciones pueden realizarse con una jeringa o con un equipo de transferencia.
• Adición con jeringa o equipo de transferencia con aguja.
- Preparar el punto de inyección (el tubo único, véase figuras 2 o 4).
- Pinchar el tubo e inyectar.
- Mezclar las soluciones y los aditivos.
• Adición con equipo de transferencia con punzón
- Por favor, consulte las instrucciones de uso del equipo de transferencia de lípidos a utilizar.
- Conectar el punzón al punto de transfusión (tubo más largo).
d Preparación para la administración
- Colgar el envase.
- Retirar la cubierta protectora del tubo con punto de administración (el tubo más pequeño del par de tubos del envase, ver figuras 2 o 4).
- Introducir firmemente el punzón del equipo de administración en el tubo de administración.
- Para un solo uso. No almacene bolsas parcialmente utilizadas y deseche todo el equipo después de su uso. No vuelva a conectar bolsas parcialmente utilizadas. No conectar en serie con el fin de evitar la embolia gaseosa debido al posible aire residual contenido en la bolsa primaria.
e Administración
Para un solo uso.
Administrar el producto únicamente después de romper el sello no permanente y mezclar el contenido de los dos compartimentos.
No vuelva a conectar bolsas parcialmente utilizadas.
No conectar en serie con el fin de evitar la embolia gaseosa debido al posible aire residual contenido en la bolsa primaria.
Se recomienda el uso de un filtro final en la administración de todas las soluciones para nutrición parenteral, cuando sea posible.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
.<3f.
gBg
ÍTT1
Figura 1 Figura 2
Compresión del CLINIMIX horizontal Esquema de la bolsa doble con sellado horizontal
Fuito il» ivrtccion

fiuitc •U rumo ,U
ntnuuili u bn *
Figura 3 Figura 2
Compresión o plegado del CLINIMIX Esquema de la bolsa doble con sellado vertical
vertical

7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Baxter Healthcare Ltd Caxton Way, Thetford, Norfolk Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
61.218
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27 de Diciembre de 1.996
Fecha de la última renovación: 12 de Diciembre de 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2015.
14 de 14