Cetrotide 0,25 Mg Polvo Y Disolvente Para Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Cetrotide 0,25 mg polvo y disolvente para solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene 0,25 mg de cetrorelix (como acetato).
Después de la reconstitución con el disolvente proporcionado, cada ml de la solución contiene 0,25 mg de cetrorelix.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
Aspecto del polvo: liofilizado blanco.
Aspecto del disolvente: solución límpida e incolora.
El pH de la solución reconstituida es 4,0-6,0.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Prevención de la ovulación prematura en pacientes sometidas a una estimulación ovárica controlada seguida de la extracción de oocitos y técnicas de reproducción asistida.
En los ensayos clínicos Cetrotide se utilizó en combinación con gonadotropina menopáusica humana (HMG), sin embargo, la limitada experiencia con la hormona estimuladora del folículo (FSH) recombinante sugirió una eficacia similar.
4.2 Posología y forma de administración
Cetrotide sólo debe recetarse por un especialista con experiencia en esta área.
Posología
La primera administración de Cetrotide debe realizarse bajo la supervisión de un médico y en condiciones en que se disponga de forma inmediata de tratamiento para posibles reacciones alérgicas/pseudoalérgicas (incluyendo anafilaxis potencialmente mortal). Las siguientes inyecciones pueden autoadministrarse, siempre que la paciente esté bien informada sobre los signos y síntomas que pueden indicar hipersensibilidad, de las consecuencias de tales reacciones y de la necesidad de intervención médica inmediata.
El contenido de un vial (0,25 mg cetrorelix) se debe administrar una vez al día, en intervalos de 24 horas, bien por la mañana o por la noche. Tras la primera administración, se aconseja que la paciente permanezca bajo control médico durante 30 minutos, para asegurarse de que no existe una reacción alérgica /pseudoalérgica a la inyección.
Pacientes de edad avanzada
No existe una indicación de uso específica para Cetrotide en pacientes de edad avanzada
Población pediátrica
No existe una recomendación de uso específica para Cetrotide en la población pediátrica.
Forma de administración
Cetrotide se debe inyectar por vía subcutánea en la región inferior abdominal.
Las reacciones en el lugar de inyección se pueden minimizar rotando los lugares de inyección, retrasando la inyección en el mismo lugar e inyectando lentamente el producto para facilitar su absorción gradual.
Administración por la mañana: El tratamiento con Cetrotide debe iniciarse al quinto o sexto día de la estimulación ovárica (aproximadamente 96 a 120 horas después del inicio de la estimulación ovárica) con gonadotropinas urinarias o recombinantes y deberá continuar durante el período de tratamiento con gonadotropinas incluyendo el día de la inducción de la ovulación.
Administración _por la noche: El tratamiento con Cetrotide debe iniciarse al quinto día de la estimulación ovárica (aproximadamente 96 a 108 horas después del inicio de la estimulación ovárica) con gonadotropinas urinarias o recombinantes y deberá continuar durante el período de tratamiento con gonadotropinas hasta la noche anterior al día de la inducción de la ovulación.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Cetrorelix no se debe utilizar ante cualquiera de las situaciones siguientes:
• Hipersensibilidad al principio activo o a cualquier análogo estructural de hormona liberadora de gonadotropina (GnRH), a hormonas peptídicas extrínsecas o a alguno de los excipientes incluidos en la sección 6.1.
• Durante el embarazo y la lactancia.
• Pacientes con insuficiencia renal grave.
4.4 Advertencias y precauciones especiales de empleo
Alergia
Se han notificado casos de reacciones alérgicas/pseudoalérgicas, incluyendo anafilaxis potencialmente mortal con la primera dosis (ver sección 4.8).
Debe tenerse especial precaución en mujeres con signos y síntomas de alergia activa o historia conocida de predisposición alérgica. El tratamiento con Cetrotide no se aconseja en mujeres con problemas alérgicos graves.
Síndrome de hiperestimulación ovárica (SHO)
Durante o después de una estimulación ovárica puede presentarse un síndrome de hiperestimulación ovárica. Este suceso debe considerarse como un riesgo intrínseco de la estimulación con gonadotropinas.
Un síndrome de hiperestimulación ovárica se debe tratar de forma sintomática, p.ej. con descanso, tratamiento intravenoso con electrolitos/coloides y heparina.
El apoyo a la fase lútea se debe dar de acuerdo con la práctica del centro médico de reproducción. Procedimiento repetido de estimulación ovárica
Hay una escasa experiencia con la administración de cetrorelix en estimulación ovárica de forma repetida. Por lo tanto, cetrorelix se debe utilizar en ciclos repetidos sólo después de una cuidadosa evaluación beneficio/riesgo.
Anomalías congénitas
La prevalencia de anomalías congénitas tras el uso de tecnologías de reproducción asistida (TRA), con o sin antagonistas de la GnRH, puede ser ligeramente más alta que tras las concepciones espontáneas, aunque no está claro si esto guarda relación con factores inherentes a la infertilidad de la pareja o con los procedimientos de TRA. Los escasos datos procedentes de estudios de seguimiento clínico de 316 recién nacidos de mujeres a las que se había administrado cetrorelix para el tratamiento de la infertilidad sugieren que cetrorelix no aumenta el riesgo de anomalías congénitas en la descendencia.
Insuficiencia hepática
Cetrorelix no ha sido estudiado en pacientes con insuficiencia hepática, por lo que se debe tener precaución.
Insuficiencia renal
Cetrorelix no ha sido estudiado en pacientes con insuficiencia renal, por lo que se debe tener precaución.
Cetrorelix está contraindicado en pacientes con insuficiencia renal grave (ver sección 4.3)
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacciones farmacológicas con cetrorelix. Investigaciones in vitro han mostrado que las interacciones con medicamentos metabolizados mediante el citocromo P450, glucuronizados o conjugados de alguna otra forma, son improbables. Sin embargo, la posibilidad de interacciones con gonadotropinas o productos que pueden provocar una liberación de histamina en individuos susceptibles no puede excluirse totalmente.
4.6 Fertilidad, embarazo y lactancia
Embarazo y lactancia
No debe utilizarse Cetrotide durante el embarazo y la lactancia (ver sección 4.3).
Fertilidad
Estudios en animales han indicado que cetrorelix presenta una influencia dosis-dependiente sobre la fertilidad, la capacidad reproductora y el embarazo. No se presentan efectos teratogénicos si se administra el medicamento durante la fase sensible de la gestación.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Cetrotide sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Los efectos adversos notificados más frecuentemente son reacciones locales en el lugar de inyección tales como eritema, hinchazón y prurito que son normalmente de naturaleza pasajera y de intensidad leve. En ensayos clínicos, estos efectos fueron observados con una frecuencia del 9,4% después de varias inyecciones de Cetrotide 0,25 mg.
Se ha notificado frecuentemente síndrome de hiperestimulación ovárica (SHO) de leve a moderado (grado I o II de la OMS) y se debe considerar como un riesgo intrínseco del procedimiento de estimulación. Por el contrario, el SHO grave sigue siendo poco frecuente.
Se han notificado casos poco frecuentes de reacciones de hipersensibilidad que incluyen reacciones pseudoalérgicas/anafilácticas.
Lista de reacciones adversas
Las reacciones adversas notificadas más abajo se clasifican de acuerdo con la siguiente frecuencia de aparición: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000).
Trastornos del sistema inmunológico
Poco frecuentes: Reacciones sistémicas alérgicas/pseudoalérgicas incluyendo anafilaxis potencialmente mortal.
Trastornos del sistema nervioso Poco frecuentes: Cefalea
Trastornos gastrointestinales Poco frecuentes: Náuseas
Trastornos del aparato reproductor y de la mama
Frecuentes: Puede producirse un síndrome de hiperestimulación ovárica de leve a moderado
(grado I o II de la OMS), que constituye un riesgo intrínseco del proceso de estimulación (ver sección 4.4).
Poco frecuentes: Síndrome de hiperestimulación ovárica grave (grado III de la OMS)
Trastornos generales y alteraciones en el lugar de administración
Frecuentes: Se han descrito reacciones locales en el lugar de la inyección (p.ej. eritema,
hinchazón y prurito).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Una sobredosis en humanos puede provocar una duración prolongada de la acción, pero es improbable que se asocie con efectos tóxicos agudos.
En estudios de toxicidad aguda en roedores se observaron síntomas tóxicos inespecíficos tras la administración intraperitoneal de cetrorelix a dosis 200 veces superiores a la dosis farmacológica eficaz en administración por vía subcutánea.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas liberadoras de antigonadotropina, código ATC: H01CC02 Mecanismo de acción
Cetrorelix es un antagonista de la hormona liberadora de la hormona luteinizante (LHRH). La LHRH se une a los receptores de membrana de las células de la hipófisis. Cetrorelix compite con la LHRH endógena en la unión a dichos receptores. Por su mecanismo de acción, cetrorelix controla la secreción de gonadotropinas (LH y FSH).
Cetrorelix inhibe de forma dosis-dependiente la secreción de LH y FSH por la hipófisis. El inicio de la inhibición es prácticamente inmediato y se mantiene con un tratamiento continuo sin efecto estimulante inicial.
Eficacia clínica y seguridad
Cetrorelix retrasa en las mujeres el pico de LH y, por tanto, la ovulación. La duración de la acción de cetrorelix en mujeres sometidas a una estimulación ovárica es dosis-dependiente. Inyecciones repetidas con una dosis de 0,25 mg por inyección cada 24 horas lograrán un efecto constante de cetrorelix.
Tanto en animales como en humanos, los efectos antagonistas hormonales de cetrorelix fueron totalmente reversibles tras finalizar el tratamiento.
5.2 Propiedades farmacocinéticas
Absorción
La biodisponibilidad absoluta de cetrorelix tras administración subcutánea es de un 85%.
Distribución
El volumen de distribución (Vd) es 1,1 1 x kg-1.
Eliminación
Los valores de aclaramiento plasmático total y de aclaramiento renal son 1,2 ml x min-1 x kg-1 y 0,1 ml x min-1 x kg-1, respectivamente.
Las vidas medias terminales del medicamento tras administración intravenosa y subcutánea son aproximadamente de 12 h y 30 h, respectivamente, demostrando el efecto del proceso de absorción en el lugar de inyección.
Linealidad
La administración subcutánea de dosis únicas (de 0,25 mg a 3 mg de cetrorelix), así como la de dosis diarias durante los 14 días de tratamiento muestra una cinética lineal.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico y toxicidad para la reproducción.
No se ha observado evidencia de toxicidad en órganos durante los estudios de toxicidad aguda, subaguda y crónica en ratas y perros tras administración subcutánea de cetrorelix.
No se registraron signos de irritación local o incompatibilidad asociada con el medicamento tras inyección intravenosa, intraarterial y paravenosa en perros a los que se administró cetrorelix a dosis claramente superiores a las previstas en el uso clínico en humanos.
Cetrorelix no mostró potencial mutagénico o clastogénico alguno en los ensayos de mutación génica y cromosómica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
Manitol
Disolvente:
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez 2 años.
La solución debe administrarse inmediatamente tras su preparación.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C.
Conservar el (los) vial(es) en el embalaje exterior para protegerlo(s) de la luz.
6.5 Naturaleza y contenido del envase
Caja con 1 ó 7 viales de vidrio Tipo I sellados con tapón de caucho.
Adicionalmente, para cada vial la caja contiene:
1 jeringa precargada (cartucho de vidrio Tipo I con tapones de caucho) con 1 ml de disolvente para uso parenteral
1 aguja para inyección (calibre 20)
1 aguja para inyección hipodérmica (calibre 27)
2 torundas empapadas en alcohol.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Cetrotide se debe reconstituir solamente con el disolvente que se suministra para tal fin, realizando rotaciones suaves. No agitar fuertemente para evitar la formación de burbujas.
La solución reconstituida está libre de partículas y es límpida. No usar si la solución contiene partículas o si no está límpida.
Utilice todo el contenido del vial. Dicho contenido garantiza a la paciente una dosis mínima de 0,23 mg de cetrorelix.
Usar la solución inmediatamente después de su reconstitución.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Serono Europe Limited 56, Marsh Wall London E14 9TP Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/99/100/001
EU/1/99/100/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 13 de abril de 1999 Fecha de la primera renovación: 15 de abril de 2004 Fecha de la última renovación: 13 de abril de 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes responsables de la liberación de los lotes
Eterna Zentaris GmbH WeismüllerstraBe 50 D-60314 Frankfurt Alemania
Merck KGaA,
Frankfurter StraBe 250 D-64293 Darmstadt Alemania
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, párrafo 7, de la Directiva 2001/83/CE y cualquier actualización publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
CAJA DE 1 VIAL Y 1 JERINGA PRECARGADA CAJA DE 7 VIALES Y 7 JERINGAS PRECARGADAS
1. NOMBRE DEL MEDICAMENTO
Cetrotide 0,25 mg polvo y disolvente para solución inyectable cetrorelix
2. PRINCIPIO(S) ACTIVO(S)
Cada vial con polvo contiene:
0,25 mg de cetrorelix (como acetato).
3. LISTA DE EXCIPIENTES
Excipiente: manitol.
Cada jeringa precargada con disolvente contiene: 1 ml de agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1 vial con polvo para solución inyectable.
1 jeringa precargada con disolvente para uso parenteral. Adicionalmente, la caja contiene:
1 aguja para inyección (calibre 20)
1 aguja para inyección hipodérmica (calibre 27)
2 torundas empapadas de alcohol
7 viales con polvo para solución inyectable.
7 jeringas precargadas con disolvente para uso parenteral. Adicionalmente, la caja contiene:
7 agujas para inyección (calibre 20)
7 agujas para inyección hipodérmica (calibre 27)
14 torundas empapadas en alcohol
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía subcutánea.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25°C. Conservar el vial en el embalaje exterior para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Serono Europe Limited 56 Marsh Wall London E14 9TP Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/99/100/001
EU/1/99/100/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
cetrotide 0,25 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
|
18. IDENTIFICADOR ÚNICO |
INFORMACIÓN EN CARACTERES VISUALES |
|
PC: {número} SN: {número} NN: {número} |
ETIQUETA DEL VIAL DE CETROTIDE 0,25 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Cetrotide 0,25 mg polvo para solución inyectable
cetrorelix
Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,25 mg
6. OTROS
ETIQUETA DE LA JERINGA PRECARGADA DE DISOLVENTE
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Disolvente para Cetrotide 0,25 mg Agua para preparaciones inyectables
|
2. |
FORMA DE ADMINISTRACIÓN |
|
3. |
FECHA DE CADUCIDAD |
|
CAD |
4. NÚMERO DE LOTE
|
Lote | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES |
|
1 ml | |
|
6. |
OTROS |
B. PROSPECTO
Cetrotide 0,25 mg polvo y disolvente para solución inyectable
Acetato de cetrorelix
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Cetrotide y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Cetrotide
3. Cómo usar Cetrotide
4. Posibles efectos adversos
5. Conservación de Cetrotide
6. Contenido del envase e información adicional
Cómo mezclar e inyectar Cetrotide
1. Qué es Cetrotide y para qué se utiliza Qué es Cetrotide
Cetrotide contiene una sustancia denominada “acetato de cetrorelix”. Esta sustancia impide que su cuerpo libere un óvulo desde el ovario (ovulación) durante su ciclo menstrual. Cetrotide pertenece a un grupo de medicamentos conocidos como “antihormonas liberadoras de gonadotropina”.
Para qué se utiliza Cetrotide
Cetrotide es uno de los medicamentos utilizados durante las “técnicas de reproducción asistida” para ayudarle a quedarse embarazada. Actúa deteniendo de inmediato la liberación de los óvulos. Esto se debe a que si los óvulos se liberan demasiado pronto (ovulación prematura), es posible que su médico no sea capaz de recogerlos.
Cómo funciona Cetrotide
Cetrotide bloquea una hormona natural de su organismo, denominada LHRH (“hormona liberadora de la hormona luteinizante”).
- La LHRH controla otra hormona, denominada LH (“hormona luteinizante”).
- La LH estimula la ovulación durante el ciclo menstrual.
Esto significa que Cetrotide detiene la cadena de sucesos que conduce a la liberación de un óvulo desde el ovario. Cuando sus óvulos estén listos para su recogida, se le administrará otro medicamento que los liberará (inducción de la ovulación).
2. Qué necesita saber antes de empezar a usar Cetrotide No use Cetrotide
• si es alérgica al acetato de cetrorelix o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
• si es alérgica a medicamentos similares a Cetrotide (cualquier otra hormona peptídica).
• si está embarazada o en periodo de lactancia.
• si tiene una enfermedad renal grave.
No use Cetrotide si cualquiera de las situaciones anteriores se le aplica a usted. Si no está segura, consulte con su médico antes de usar este medicamento.
Advertencias y precauciones
Alergias
Consulte con su médico antes de usar Cetrotide si usted tiene un problema alérgico activo o ha tenido alergias en el pasado.
Síndrome de hiperestimulación ovárica (SHO)
Cetrotide se utiliza junto con otros medicamentos que estimulan sus ovarios para que desarrollen más óvulos listos para ser liberados. Durante o después de recibir estos medicamentos, puede sufrir un síndrome de hiperestimulación ovárica (SHO). Esta situación se produce cuando sus folículos se desarrollan demasiado y se convierten en quistes de gran tamaño. Para conocer los posibles signos a tener en cuenta y qué hacer si se producen, ver sección 4 “Posibles efectos adversos”.
Uso de Cetrotide durante más de un ciclo
La experiencia del uso de Cetrotide durante más de un ciclo es limitada. Su médico evaluará cuidadosamente los beneficios y riesgos para usted en caso de que necesitase usar Cetrotide durante más de un ciclo.
Enfermedad hepática
Informe a su médico antes de usar Cetrotide si padece alguna enfermedad del hígado. Cetrotide no ha sido estudiado en pacientes con enfermedad hepática.
Enfermedad renal
Informe a su médico antes de usar Cetrotide si padece alguna enfermedad del riñón. Cetrotide no ha sido estudiado en pacientes con enfermedad renal.
Niños y adolescentes
Cetrotide no está indicado para uso en niños y adolescentes.
Uso de Cetrotide con otros medicamentos
Informe a su médico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Embarazo y lactancia
No utilice Cetrotide si está embarazada, piensa que pudiera estarlo o durante el periodo de lactancia. Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
No se espera que la utilización de Cetrotide afecte a su capacidad para conducir y utilizar máquinas.
3. Cómo usar Cetrotide
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
Uso de este medicamento
Este medicamento está exclusivamente destinado para ser inyectado justo debajo de la piel de su vientre (vía subcutánea). Para reducir la irritación de la piel, seleccione una parte diferente de su vientre cada día.
• Su médico debe supervisar la primera inyección. Su médico o enfermera le enseñarán cómo preparar e inyectar el medicamento.
• Puede ponerse las siguientes inyecciones usted misma, siempre y cuando su médico le haya informado de los síntomas que pueden indicar alergia y de las posibles consecuencias graves o potencialmente mortales que necesitarían tratamiento inmediato (ver sección 4 “Posibles efectos adversos").
• Lea y siga cuidadosamente las instrucciones recogidas al final de este prospecto, tituladas
“Cómo mezclar e inyectar Cetrotide".
• Usted comenzará usando otro medicamento en el día 1 de su ciclo de tratamiento. A continuación, comenzará a usar Cetrotide unos días más tarde. (Ver sección siguiente
“Qué cantidad utilizar".)
Qué cantidad utilizar
Inyecte el contenido de un vial (0,25 mg de Cetrotide) una vez cada día. Es mejor usar el medicamento a la misma hora cada día, dejando 24 horas entre cada dosis.
Puede elegir entre realizar la inyección cada mañana o bien cada noche.
• Si realiza la inyección cada mañana: Comience sus inyecciones al quinto o sexto día del ciclo de tratamiento. Su médico le indicará la fecha y la hora exactas. Usted seguirá usando este medicamento hasta la mañana en que se recojan sus óvulos, esa mañana inclusive (inducción de la ovulación).
O BIEN
• Si realiza la inyección cada noche: Comience sus inyecciones al quinto día del ciclo de tratamiento. Su médico le indicará la fecha y la hora exactas. Usted seguirá usando este medicamento hasta la noche anterior a la obtención de sus óvulos, esa noche inclusive (inducción de la ovulación).
Si usa más Cetrotide del que debe
No se espera que se produzcan efectos adversos si se inyecta accidentalmente más medicamento del que debiera. El efecto del medicamento será más prolongado. En general, no es necesario adoptar medidas específicas.
Si olvidó usar Cetrotide
• Si olvida una dosis, inyéctesela tan pronto como se acuerde y hable con su médico.
• No se inyecte una dosis doble para compensar las dosis olvidadas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Reacciones alérgicas
• Enrojecimiento y sensación de calor en la piel, picor (a menudo en la ingle o las axilas), zonas enrojecidas, hinchadas y con picor (urticaria), moqueo, pulso acelerado o irregular, hinchazón de la lengua y la garganta, estornudos, sonido silbante durante la respiración (sibilancias), graves dificultades para respirar o mareos. Podría estar sufriendo una posible reacción alérgica grave, potencialmente mortal, al medicamento. Esto es poco frecuente (afecta a menos del 1% de las mujeres).
Si observa alguno de los efectos adversos descritos anteriormente, interrumpa el uso de Cetrotide y consulte a su médico inmediatamente.
Síndrome de hiperestimulación ovárica (SHO)
Se puede producir debido a los demás medicamentos que esté utilizando para estimular sus ovarios.
• Los síntomas del síndrome de hiperestimulación ovárica (SHO) pueden manifestarse como un dolor en el bajo vientre, junto con sensación de náuseas o vómitos. Esto puede indicar que los ovarios han sobrerreaccionado al tratamiento y que se han desarrollado quistes ováricos de gran tamaño. Este efecto es frecuente (puede afectar hasta a 1 de cada 10 mujeres).
• El SHO puede convertirse en grave, presentando ovarios claramente aumentados de tamaño, disminución de la producción de orina, aumento de peso, dificultad para respirar o acumulación de líquido en el estómago o el pecho. Este efecto es poco frecuente (puede afectar hasta a 1 de cada 100 mujeres).
Si observa alguno de los efectos adversos descritos anteriormente, consulte a su médico inmediatamente.
Otros efectos adversos
Frecuentes (pueden afectar hasta a 1 de cada 10 mujeres):
• Se han descrito reacciones cutáneas leves y de corta duración en la zona de inyección tales como enrojecimiento, picor o hinchazón.
Poco frecuentes (pueden afectar hasta a 1 de cada 100 mujeres):
• Sensación de náuseas.
• Dolor de cabeza.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Cetrotide
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el vial después de CAD. La fecha de caducidad es el último día del mes que se indica.
Tanto el vial de polvo de Cetrotide como la jeringa precargada con el agua estéril (disolvente) poseen la misma fecha de caducidad. Dicha fecha está impresa en las etiquetas y en la caja.
No conservar a temperatura superior a 25°C.
Conservar el vial en el embalaje exterior para protegerlo de la luz.
La solución debe ser utilizada inmediatamente después de su preparación.
No utilice este medicamento si observa que el gránulo blanco del vial ha cambiado de aspecto. No lo utilice si la solución preparada en el vial ya no es transparente e incolora o contiene partículas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Si tiene alguna otra pregunta, consulte a su médico o farmacéutico.
Composición de Cetrotide
• El principio activo es acetato de cetrorelix. Cada vial contiene 0,25 mg de acetato de cetrorelix.
• El otro componente es manitol.
• El disolvente es agua estéril para preparaciones inyectables.
Aspecto del producto y contenido del envase
Cetrotide es un polvo blanco para solución inyectable en un vial de vidrio con tapón de caucho. Se presenta en cajas de uno o siete viales (puede que solamente estén comercializados algunos tamaños de envases).
Para cada vial, la caja contiene:
• una jeringa precargada con agua estéril para preparaciones inyectables (disolvente). Este agua se utiliza para mezclar con el polvo en el vial
• una aguja con una marca amarilla para inyectar el agua estéril en el vial y retirar el medicamento preparado del vial
• una aguja con una marca gris para inyectar el medicamento en su vientre
• dos torundas empapadas en alcohol para limpiar.
Titular de la autorización de comercialización
Merck Serono Europe Limited, 56 Marsh Wall, London E14 9TP, Reino Unido.
Responsable de la fabricación
Eterna Zentaris GmbH, WeismüllerstraBe 50, D-60314 Frankfurt, Alemania o
Merck KGaA, Frankfurter StraBe 250 D-64293, Darmstadt, Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Lietuva
Merck Serono UAB Tel: +370 37320603
Belgie/Belgique/Belgien
MERCK NV/SA Tél/Tel: +32 2 686 07 11
Etarapna
„MepK Euarapua“ EAfl Tea.: +359 24461 111
Luxembourg/Luxemburg
MERCK NV/SA, Belgique/Belgien Tél/Tel: +32 2 686 07 11
Ceská republika
Merck spol.s.r.o
Tel: +420 272084211
Danmark
Merck A/S Tlf: +45 35253550
Malta
Vivian Corporation Ltd Tel: +356-22-588600
Norge
Merck Serono Norge
Tlf: +47 67 90 35 90
Eesti
Merck Serono OÜ Tel: +372 682 5882
EAAáSa Merck A.E.
Osterreich
Merck GesmbH. Tel: +43 1 57600-0
T^A: +30-210-61 65 100
|
España Merck S.L. Línea de Información: 900 102 964 Tel: +34-91-745 44 00 |
Polska Merck Sp. z o.o. Tel.: +48 22 53 59 700 |
|
France Merck Serono s.a.s. Tél.: +33-4-72 78 25 25 Numéro vert : 0 800 888 024 |
Portugal Merck, s.a. Tel: +351-21-361 35 00 |
|
Hrvatska Merck d.o.o, Tel: +385 1 4864 111 |
Romania MERCK d.o.o., Slovenia Tel: +386 1 560 3 800 |
|
Íreland Merck Serono Ltd, United Kingdom Tel: +44-20 8818 7200 |
Slovenija MERCK d.o.o. Tel: +386 1 560 3 800 |
|
Ísland Icepharma hf Tel: + 354 540 8000 |
Slovenská republika Merck spol. s r.o. Tel: + 421 2 49 267 111 |
|
Italia Merck Serono S.p.A. Tel: +39-06-70 38 41 |
Suomi/Finland Merck Oy Puh/Tel: +358-9-8678 700 |
|
Kúnpoq Xp. r. nanaAot^ou AtS T^A.: +357 22490305 |
Sverige Merck AB Tel: +46-8-562 445 00 |
|
Latvija Merck Serono SIA Tel: +371 67152500 |
United Kingdom Merck Serono Ltd Tel: +44-20 8818 7200 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
CÓMO MEZCLAR E INYECTAR CETROTIDE
- En esta sección se explica cómo mezclar el polvo y el agua estéril (disolvente) y, a continuación, cómo inyectarse el medicamento.
- Antes de comenzar a usar este medicamento, lea primero estas instrucciones por completo.
- Este medicamento es únicamente para usted; no permita que nadie más lo use.
- Use cada aguja, vial y jeringa solamente una vez.
Antes de empezar
1. Lávese las manos
- Es importante que sus manos y los objetos que use estén tan limpios como sea posible.
2. Coloque todo lo que necesita sobre una superficie limpia:
- un vial de polvo
- una jeringa precargada con agua estéril (disolvente)
- una aguja con una marca amarilla para inyectar el agua estéril en el vial y retirar el medicamento preparado del vial
- una aguja con una marca gris para inyectar el medicamento en su vientre
- dos torundas empapadas en alcohol.
Mezcla del polvo y el agua para preparar su medicamento
1. Quite la tapa de plástico del vial
- Encontrará un tapón de caucho debajo; manténgalo en el vial.
- Limpie el tapón de caucho y el aro metálico con la primera torunda empapada en alcohol.
2. Añada el agua de la jeringa precargada al polvo en el vial
- Retire el envoltorio de la aguja con la marca amarilla.
- Retire la tapa de la jeringa precargada y enrosque la aguja amarilla. Quite el capuchón de la aguja.
- Haga penetrar la aguja amarilla por el centro del tapón de caucho del vial.
- Empuje lentamente el émbolo de la jeringa para inyectar el agua en el vial. No utilice ningún otro tipo de agua.
- Deje la jeringa en el tapón de caucho.
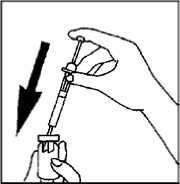
3. Mezcle el polvo y el agua en el vial
- Mientras sostiene la jeringa y el vial con cuidado, mueva suavemente para mezclar el polvo y el agua. Una vez mezclada, la solución tendrá un aspecto transparente y sin partículas.
- No agite el vial, dado que creará burbujas en el medicamento.
4. Vuelva a llenar la jeringa con el medicamento del vial
- Coloque el vial al revés.
- Tire suavemente del émbolo para retirar el medicamento del vial a la jeringa.
- Si queda medicamento en el vial, tire de la aguja hasta que el extremo de la aguja quede justo dentro del tapón de caucho. Si mira de costado a través del espacio vacío en el tapón de caucho, puede controlar el movimiento de la aguja y del líquido.
Asegúrese de retirar todo el medicamento del vial.
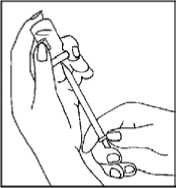
- Vuelva a poner el capuchón en la aguja amarilla. Desenrosque la aguja amarilla de la jeringa y deposite la jeringa.
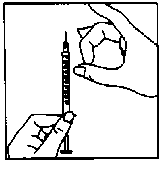
Preparación del lugar de inyección e inyección del medicamento 1. Eliminación de las burbujas de aire
- Retire el envoltorio de la aguja con la marca gris. Enrosque la aguja gris en la jeringa y quite el capuchón de la aguja gris.
- Sujete la jeringa con la aguja gris apuntando hacia arriba y compruebe que no existan burbujas de aire.
- Para eliminar las burbujas de aire, golpee suavemente la jeringa hasta que el aire se acumule en la parte superior. A continuación, empuje lentamente el émbolo hasta que las burbujas desaparezcan.
- No toque la aguja gris ni permita que la aguja toque ninguna superficie.
2. Limpie el lugar de inyección
- Elija un lugar de inyección en su vientre. Lo mejor es una zona alrededor del ombligo. Para reducir la irritación de la piel, seleccione una parte diferente de su vientre cada día.
- Limpie la piel del lugar de inyección elegido con la segunda torunda empapada en alcohol, con un movimiento circular.
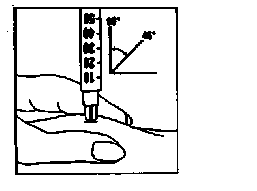
3. Perfore la piel
- Sostenga la jeringa con una mano, como si fuera un lápiz.
- Tome suavemente un pliegue de piel alrededor del lugar donde inyectar y sostenga firmemente con la otra mano.
- Introduzca lentamente la aguja gris por completo en la piel con un ángulo de
aproximadamente 45 a 90 grados. A continuación, suelte la piel.
4. Inyección del medicamento
- Tire suavemente del émbolo de la jeringa. Si aparece sangre, continúe según lo indicado en el paso 5.
- Si no aparece sangre, empuje el émbolo con suavidad para inyectar el medicamento.
- Cuando la jeringa esté vacía, retire lentamente la aguja gris con el mismo ángulo.
- Utilice la segunda torunda empapada en alcohol para aplicar una suave presión en el lugar de inyección.
5. Si aparece sangre:
- retire lentamente la aguja gris con el mismo ángulo
- utilice la segunda torunda empapada en alcohol para aplicar una suave presión en el lugar de perforación de la piel
- vacíe el medicamento en un lavabo y continúe según lo indicado en el paso 6 a continuación
- lávese las manos y vuelva a empezar con un vial y jeringa precargada nuevos.
6. Eliminación
- Use cada aguja, vial y jeringa solamente una vez.
- Vuelva a poner los capuchones en las agujas, de modo que se puedan eliminar de forma segura.
- Pregunte a su farmacéutico como deshacerse de las agujas, del vial y de la jeringa usados.
27