Cetirizina Tevagen 10 Mg Comprimidos Recubiertos Con Pelicula Efg
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Cetirizina Tevagen 10 mg comprimidos recubiertos con película EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
Excipiente(s) con efecto conocido:
Lactosa monohidrato (66 mg)
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Comprimido recubierto con película.
Comprimido blanco a blanquecino, redondo, biconvexo con una línea de rotura en un lado y un diámetro de aproximadamente 6,5 mm.
El comprimido se puede dividir en dosis iguales.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
En adultos y pacientes pediátricos a partir de 6 años:
- cetirizina está indicada para el alivio de los síntomas nasales y oculares de la rinitis alérgica estacional y perenne.
- cetirizina está indicada para el alivio de los síntomas de la urticaria crónica idiopática.
4.2 Posología y forma de administración
Niños de 6 a 12 años:
5 mg dos veces al día (medio comprimido dos veces al día).
Adultos y adolescentes mayores de 12 años:
10 mg una vez al día (1 comprimido).
Pacientes de edad avanzada:
En pacientes de edad avanzada con función renal normal, los datos disponibles indican que no es necesario reducir la dosis.
Pacientes con insuficiencia renal de moderada a severa
No hay datos disponibles que documenten la relación eficacia/seguridad en pacientes con insuficiencia renal. Debido a que la cetirizina se excreta principalmente vía renal (ver sección 5.2) los intervalos de dosis deben individualizarse según la función renal en los casos en los que no se pueda utilizar tratamiento alternativo.
Ver la siguiente tabla y ajustar la dosis según se indica. Para seguir la tabla de dosificación, se necesita una estimación del aclaramiento de creatinina (CLcr). El CLcr (ml/min) puede estimarse a partir de la determinación de creatinina sérica (mg/dl) utilizando la siguiente fórmula:
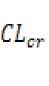
[140 - edad (años)] x peso(kg)
-7 (x 0.3 á para raujeres)
72 X creatinina sérica í
Ajustes de dosis para pacientes adultos con insuficiencia renal
|
Grupo |
Aclaramiento creatinina (ml/min) |
Frecuncia de dosis |
|
Normal |
> 80 |
10 mg una vez al día |
|
Leve |
50 - 79 |
10 mg una vez al día |
|
Moderada |
30 - 49 |
5 mg una vez al día |
|
Severa |
< 30 |
5 mg una vez cada 2 días |
|
Últimas etapas de insuficiencia renal - Pacientes en diálisis |
< 10 |
Contraindicado |
En pacientes pediátricos que sufren insuficiencia renal, la dosis deberá ajustarse individualmente teniendo en cuenta el aclaramiento renal del paciente y su peso.
Pacientes con insuficiencia hepática
No se necesita ajuste de dosis en pacientes que sólo tienen insuficiencia hepática
Pacientes con insuficiencia hepática e insuficiencia renal:
Se recomienda ajustar la dosis (ver “Pacientes con insuficiencia renal de moderada a severa”)
Forma de administración
Los comprimidos tienen que tragarse con un vaso de líquido.
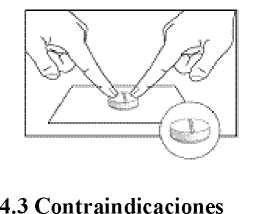
Indicación para la partición de los comprimidos
Depositar el comprimido en una superficie dura y plana (por ejemplo encima de una tabla o un plato) con la línea de fractura hacia arriba. A continuación presione con los dedos índices (o pulgares) al mismo tiempo brevemente y firmemente en los bordes a la derecha e izquierda de la línea de fractura como se muestra en la representación gráfica a continuación.
Hipersensibilidad al principio activo, o a alguno de los excipientes incluidos en la sección 6.1, a la hidroxizina o a cualquier derivado piperazínico.
Pacientes con insuficiencia renal grave con un aclaramiento renal inferior a 10 ml/min.
4.4 Advertencias y precauciones especiales de empleo
A dosis terapéuticas, no se ha demostrado interacción clínicamente significativa con alcohol (para un nivel de alcohol en sangre de 0,5 g/l). Sin embargo, se recomienda precaución si se toma concomitantemente alcohol.
Se recomienda precaución en pacientes con factores predisponentes a la retención urinaria (por ej. Lesión de la médula espinal, hiperplasia prostática) ya que la cetirizina puede aumentar el riesgo de retención urinaria.
Se recomienda precaución en pacientes epilépticos y pacientes con riesgo de convulsiones.
No se recomienda el uso de la formulación de comprimidos recubiertos con película en niños menores de 6 años, ya que esta formulación no permite realizar ajustes apropiados de la dosis.
Las pruebas de alergia en piel son inhibidas por los antistamínicos, por lo que se requiere un periodo de descanso (de tres días) antes de realizarlas.
Población pediátrica
No se recomienda el uso de la formulación de comprimidos recubiertos con película en niños menores de 6 años, ya que esta formulación no permite realizar ajustes apropiados de la dosis.
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a la galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Debido a la farmacocinética, farmacodinamia y al perfil de tolerancia de la cetirizina, no se esperan interacciones con este antihistamínico. De hecho, no se han notificado ni interacciones farmacodinámicas ni farmacocinéticas significativas en los estudios de interacción fármaco-fármaco desarrollados, especialmente con pseudoefedrina o teofilina (400 mg/día).
La absorción de levocetirizina no se reduce con la comida, aunque la velocidad de absorción disminuye.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
Hay muy pocos datos clínicos disponibles sobre la exposición de cetirizina durante el embarazo. Los estudios en animales no muestran efectos dañinos directos o indirectos sobre el embarazo, desarrollo embrional/fetal, parto o desarrollo postnatal. Debe tenerse precaución en la prescripción a mujeres embarazadas.
4.6.2 Lactancia
La cetirizina se excreta por la leche materna a concentraciones que representan desde el 0,25 al 0,90 de las medidas en plasma, según el tiempo de muestreo tras la administración. Por lo tanto, debe tenerse precaución cuando se prescriba cetirizina a mujeres lactantes.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Las medidas objetivas no han mostrado efectos clínicos relevantes de la cetirizina, a las dosis recomendadas de 10 mg, sobre la capacidad para conducir, la latencia al sueño y la respuesta motora. Por lo tanto, los pacientes que vayan a conducir, realizar actividades potencialmente peligrosas o utilizar maquinaria deberán no exceder la dosis recomendada y tener en cuenta su respuesta al fármaco. En estos pacientes sensibles, el uso conjunto de alcohol o cualquier depresor del SNC puede causar disminuciones adicionales en el estado de alerta y alteración del rendimiento.
4.8 Reacciones adversas
Los estudios clínicos han demostrado que cetirizina a la dosis recomendada tiene reacciones adversas menores sobre el SNC, incluyendo somnolencia, fatiga, mareo y dolor de cabeza. En algunos casos se ha notificado estimulación paradójica del SNC.
Aunque la cetirizina es un antagonista selectivo de los receptores periféricos H y esta relativamente libre de actividad anticolinérgica, se han notificado casos aislados de dificultad para la micción, trastornos de la acomodación ocular y sequedad de boca.
Se han notificado casos de función hepática anormal con aumento de las enzimas hepáticas, acompañadas por aumento de la bilirrubina. Muchos de estos casos se resuelven tras la interrupción del tratamiento.
Ensayos clínicos
Están disponibles los datos de los ensayos clínicos controlados doble ciego o ensayos farmacoclínicos, que incluyeron más de 3.200 pacientes expuestos a cetirizina, que cuantificaron la seguridad comparando la cetirizina con un placebo u otro antihistamínico a la dosis recomendada (10 mg al día de cetirizina).
En este conjunto, se notificaron en una proporción igual o superior al 1% las siguientes reacciones adversas para 10 mg de cetirizina en los ensayos controlados con placebo:
|
Reacciones adversas (WHO-ART) |
10 mg de cetirizina (n= 3260) |
Placebo (n=3061) |
|
Trastornos generales de organismo Fatiga |
1,63 % |
0,95 % |
|
Trastornos del sistema nervioso central y periférico Mareos |
1, 10% |
0,98 % |
|
Dolor de cabeza |
7,42 % |
8,07 % |
|
Trastornos gastrointestinales Dolor abdominal |
0,98 % |
1,08 % |
|
Sequedad de boca |
2, 09 % |
0,82 % |
|
Náusea |
1,07 % |
1,14 % |
|
Trastornos psiquiátricos Somnolencia |
9,63 % |
5,00 % |
|
Trastornos respiratorios Faringitis |
1,29 % |
1,34 % |
Aunque estadísticamente más frecuente que en el grupo placebo, la somnolencia fue de leve a moderada en la mayoría de los casos. Las pruebas objetivas han demostrado que las actividades usuales diarias no se ven afectadas por la dosis diaria recomendada en voluntarios jóvenes sanos, como se demostró por otros estudios.
Las reacciones adversas en una proporción igual o superior al 1% en niños de 6 meses a 12 años, incluidos en los ensayos controlados con placebo, son:
|
Reacciones adversas (WHO-ART) |
10 mg de cetirizina (n= 1656) |
Placebo (n=1294) |
|
Trastornos gastrointestinales Diarrea |
1,0 % |
0,6 % |
|
Trastornos psiquiátricos Somnolencia |
1,8 % |
1,4 % |
|
Trastornos respiratorios, mediastínicos y torácicos Rinitis |
1,4 % |
1,1 % |
|
Trastornos generales del organismo Fatiga |
1,0 % |
0,3 % |
Experiencia post-comercialización
Además de las reacciones adversas notificadas durante los ensayos clínicos y mencionadas anteriormente, en la experiencia post-comercialización se han descrito casos aislados de las siguientes reacciones adversas al fármaco. Para estas reacciones adversas notificadas menos frecuentemente, la estimación de la frecuencia (muy frecuentes (> 1/10); frecuentes (> 1/100 a <1/10); poco frecuentes (>1/1000 a 1/100); raros (> 1/10.000 a <1/1.000); muy raras (<1/10.000), no conocida (no puede estimarse a partir de los datos disponibles) se hizo basándose en la experiencia post-comercialización:
Trastornos de la sangre y del sistema linfático Muy raros: trombocitopenia
Trastornos del sistema inmune Raros: hipersensibilidad Muy raros: shock anafiláctico Trastornos psiquiátricos Poco frecuentes: agitación
Raros: agresividad, confusión, depresión, alucinación, insomnio Muy raros: tic No conocida: ideas suicidas
Trastornos del sistema nervioso Poco frecuentes: parestesia
Raros: convulsionesMuy raros: disgeusia, discinesia, distonía, síncope, temblor No conocida: amnesia, fallos de memoria
Trastornos oculares
Muy raros: trastornos de la acomodación, visión borrosa, giro ocular
Trastornos del oído y del laberinto No conocida: vértigo
Trastornos cardiacos Raros: taquicardia
Trastornos gastrointestinales Poco frecuentes: diarrea
Trastornos hepatobiliares
Raros: función hepática anormal (aumento de las transaminasas, fosfatasa alcalina, GT y bilirrubina)
Trastornos de la piel y del tejido subcutáneo
Poco frecuentes: prurito, sarpullido Raros: urticaria
Muy raros: edema angioneurótico, erupción debida al fármaco
Trastornos renales y urinarios Muy raros: disuria, enuresis No conocida: retención urinaria
Trastornos generales y alteraciones en el lugar de administración Poco frecuentes: astenia, malestar Raros: edema
Exploraciones complementarias Raros: aumento de peso
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
Síntomas
Los síntomas observados después de una sobredosis de cetirizina están principalmente asociados con efectos sobre el SNC o con efectos que podrían sugerir un efecto anticolinérgico.
Los efectos adversos notificados después de la ingesta de al menos 5 veces la dosis diaria recomendada son: confusión, diarrea, mareo, fatiga, dolor de cabeza, malestar, midriasis, prurito, nerviosismo, sedación, somnolencia, estupor, taquicardia, temblor y retención urinaria.
Tratamiento
No hay un antídoto conocido específico para cetirizina.
De producirse, se recomienda un tratamiento sintomático o de apoyo. El lavado gástrico se podrá realizar tras una ingesta reciente. La cetirizina no se elimina de forma efectiva por diálisis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: derivados de la piperazina, código ATC: R06AE07
La cetirizina es un metabolito humano de la hidroxizina, es un potente y selectivo inhibidor de los receptores periféricos H1. Los estudios in vitro de unión a receptores no han mostrado afinidad medible nada más que por los receptores H1.
Además de su efecto anti- H1, la cetirizina demostró que exhibía actividades antialérgicas: a una dosis de 10 mg una vez al día o dos veces al día, inhibe la última fase de reclutamiento de eosinófilos, en la piel y el tejido conjuntivo de sujetos a los que se sometió a un test de alérgenos por vía tópica.
Estudios en voluntarios sanos muestran que la cetirizina a dosis de 5 y 10 mg inhibe estrechamente las pápulas y eritemas inducidos por altas concentraciones de histamina en la piel, pero no se establece la correlación con la eficacia.
En un estudio de 35 días en niños de 5 a 12 años, no se encontró tolerancia a los efectos antihistamínicos de la cetirizina (supresión de la pápula y del eritema). Cuando se interrumpe el tratamiento con cetirizina después de una administración repetida, la piel recupera su reactividad normal a la histamina en 3 días.
En un estudio de 6 semanas, controlado con placebo con 186 pacientes con rinitis alérgica y asma de leve a moderado, 10 mg de cetirizina administrados una vez al día, mejoraron los síntomas de la rinitis y no alteraron la función pulmonar. Este estudio avala la seguridad de la administración de cetirizina a pacientes alérgicos con asma de leve a moderado.
En un estudio controlado con placebo, la cetirizina administrada a la dosis diaria mayor de 60 mg durante 7 días no provocó una prolongación estadísticamente significativa del intervalo QT.
A la dosis recomendada, la cetirizina ha demostrado que mejora la calidad de vida de los pacientes con rinitis perenne o rinitis alérgica estacional.
5.2 Propiedades farmacocinéticas
La concentración plasmática en el estado de equilibrio es aproximadamente de 300 ng/ml y se alcanza en 1,0 ± 0,5 h. No se observa acumulación de cetirizina tras la administración de dosis diarias de 10 mg durante 10 días. La distribución de los parámetros farmacocinéticos como la concentración máxima (Cmax) y el área debajo de la curva (AUC) es monocompartimental en voluntarios sanos. El grado de absorción de la cetirizina no se reduce con la comida, aunque la velocidad de absorción disminuye.
El grado de biodisponibilidad es similar cuando la cetirizina se administra como solución, cápsula o comprimido.
El volumen aparente de distribución es 0,50 l/kg. La unión a proteínas plasmáticas de cetirizina es del 93 ± 0,3 %. La cetirizina no modifica la unión de la warfarina a proteínas.
La cetirizina no sufre mayoritariamente efecto primer paso. Dos terceras partes de la dosis se excreta sin modificación por la orina. La semivida terminal es aproximadamente de 10 horas.
La cetirizina muestra una cinética lineal en el rango de 5 a 60 mg.
Poblaciones especiales
Pacientes de edad avanzada
Tras una única administración de una dosis oral de 10 mg a 16 pacientes de edad avanzada, la semivida aumentó un 50 % y el aclaramiento disminuyó en un 40 % en comparación con los pacientes normales. La disminución en el aclaramiento de la cetirizina es estos voluntarios parece relacionarse con la disminución de su función renal.
Niños, lactantes y niños pequeños
La semivida de la cetirizina fue de 6 horas en niños de 6 - 12 años y 5 horas en niños de 2 -6 años. En lactantes y niños pequeños de 6 a 24 meses, se redujo a 3,1 horas.
Pacientes con insuficiencia renal
La farmacocinética del fármaco fue similar en pacientes con insuficiencia leve (aclaramiento de creatinina mayor de 40 ml/min) y voluntarios sanos. Los pacientes con insuficiencia renal moderada tuvieron un incremento de 3 veces en la semivida y una disminución del 70 % del aclaramiento comparado con voluntarios sanos. Los pacientes con hemodiálisis (aclaramiento de creatinina de menos de 7 ml/min) a los que se daba una única dosis oral de 10 mg de cetirizina tuvieron un aumento de 3 veces en la semivida y una disminución del 70 % en el aclaramiento comparados con los voluntarios sanos. La cetirizina se eliminaba poco por hemodiálisis. Es necesario el ajuste de dosis en pacientes con insuficiencia renal moderada o grave (ver sección 4.2)
Pacientes con insuficiencia hepática
Los pacientes con enfermedad hepática crónica (cirrosis hepatocelular, colestática y biliar) a los que se dio 10 ó 20 mg de cetirizina en una única dosis, tuvieron un incremento del 50 % en la semivida con una disminución de un 40 % en el aclaramiento comparado como los voluntarios sanos.
Solo es necesario el ajuste de la dosis en pacientes con la función hepática dañada si presentan daño renal concomitante.
5.3 Datos preclínicos sobre seguridad
Los datos en los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre farmacología de seguridad, toxicidad de dosis repetida, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido:
Lactosa monohidrato Celulosa microcristalina Sílice coloidal anhidra Estearato magnésico
Recubrimiento:
Dióxido de titanio (E-171)
Hipromelosa Macrogol 400
6.2 Incompatibilidades
No aplicable
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Blister de PVC/PVDC- Aluminio sellado con calor.
7, 14, 15, 20, 28,30 y 50 comprimidos.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial
]£
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
MI MISTERIO DE )E
SANIDAD.POLITICA LITIGA
SOCIAL E IGUALDAD IALDAD
Agencia esparto» de cSacse-
medicamentos y ¡y
Cfoouctos san-tanos [finos
Teva Pharma S.L.U.
C/ Anabel Segura, 11 Edificio Albatros B 1a planta 28108 Alcobendas Madrid
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
77494
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
20 septiembre 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
Septiembre 2015
9 de 9