Cayston 75 Mg Polvo Y Disolvente Para Solucion Para Inhalacion Por Nebulizador
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Cayston 75 mg polvo y disolvente para solución para inhalación por nebulizador.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene aztreonam lisina equivalente a 75 mg de aztreonam. Tras la reconstitución la solución para inhalación por nebulizador contiene 75 mg de aztreonam.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución para inhalación por nebulizador. Polvo de color entre blanco y blancuzco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Cayston está indicado para el tratamiento de infección pulmonar crónica por Pseudomonas aeruginosa en pacientes con fibrosis quística (FQ) a partir de 6 años de edad.
Deben tenerse en cuenta las recomendaciones oficiales sobre el uso adecuado de agentes antibacterianos.
4.2 Posología y forma de administración
Posología
Los pacientes deben utilizar un broncodilatador antes de cada dosis de Cayston. Los broncodilatadores de acción corta pueden usarse entre 15 minutos y 4 horas antes de cada dosis de Cayston y los de acción larga entre 30 minutos y 12 horas antes.
En pacientes que estén en tratamiento con múltiples terapias por vía inhalatoria, el orden recomendado de administración es el siguiente:
1. broncodilatador
2. mucolíticos
3. y, por último, Cayston.
Adultos y niños de 6 años de edad y mayores
La dosis recomendada en adultos es de 75 mg tres veces al día, durante 28 días.
Las dosis deben administrarse separadas por un intervalo de al menos 4 horas.
Cayston puede administrarse en ciclos repetidos de 28 días de terapia seguidos de 28 días sin terapia con Cayston.
La pauta posológica para los niños de 6 años de edad y mayores es la misma que para los adultos.
En los ensayos clínicos con Cayston no se incluyeron pacientes tratados con Cayston de edad igual o superior a 65 años para determinar si su respuesta es distinta a la de pacientes más jóvenes. Cuando se prescriba Cayston a pacientes de edad avanzada la posología recomendada será la misma que para adultos.
Insu ficiencia renal
Aztreonam se excreta a través del riñón, por lo que la administración de Cayston a pacientes con insuficiencia renal (creatinina sérica > 2 veces por encima del límite superior de la normalidad) debe realizarse con cuidado. No es necesario ajustar la dosis en los casos de insuficiencia renal, ya que la concentración sistémica de aztreonam tras la administración de Cayston por vía inhalatoria es muy baja (aproximadamente el 1% de la concentración que resultaría de administrar una dosis de 500 mg de aztreonam inyectable).
Insuficiencia hepática
No existen datos sobre el uso de Cayston en pacientes con insuficiencia hepática grave (ALT o AST más de 5 veces por encima del límite superior de la normalidad). No es necesario ajustar la dosis en los casos de insuficiencia hepática.
Población pediátrica
No se ha establecido la seguridad y eficacia de Cayston en niños menores de 6 años. Los datos actualmente disponibles están descritos en la sección 5.1, sin embargo no se puede hacer una recomendación posológica.
Forma de administración
Por vía inhalatoria.
Cayston sólo debe utilizarse con el dispositivo nebulizador de mano Altera y el generador de aerosol Altera, conectados a un eBase Controller o a una unidad de mando eFlow rapid. Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Reacciones alérgicas
En caso de producirse una reacción alérgica al aztreonam, detenga la administración del medicamento y tome las medidas adecuadas. La aparición de exantema puede ser indicativa de una reacción alérgica al aztreonam.
Puede producirse reactividad cruzada en pacientes con antecedentes de alergia a los antibióticos betalactámicos, como penicilinas, cefalosporinas y/o carbapenemos. Los datos en animales y seres humanos demuestran que existe un bajo riesgo de reactividad cruzada entre aztreonam y los antibióticos betalactámicos. Aztreonam, un monobactámico, es débilmente inmunógeno. Se aconseja actuar con precaución cuando Cayston se administre a pacientes con antecedentes de alergia a betalactámicos.
Las siguientes reacciones adversas raras y graves se han notificado después del uso por vía parenteral de otros medicamentos que contienen aztreonam: necrolisis epidérmica tóxica, anafilaxia, púrpura, eritema multiforme, dermatitis exfoliativa, urticaria, petequias, prurito, diaforesis.
Broncoespasmo
El broncoespasmo (un descenso acusado de > 15% en el VEFi) es una complicación asociada a los tratamientos administrados por nebulización. Se ha notificado broncoespasmo tras la administración de Cayston (ver sección 4.8). Los pacientes deben usar un broncodilatador antes de la administración de cada dosis de Cayston. Si se sospecha que un caso de broncoespasmo forma parte de una reacción alérgica, deben tomarse las medidas adecuadas (ver el párrafo “Reacciones alérgicas”, más arriba).
Hemoptisis
La inhalación de soluciones administradas por nebulización puede inducir un reflejo tusígeno. El uso de Cayston en pacientes pediátricos con FQ se ha asociado con hemoptisis durante los ciclos de tratamiento y podría haber agravado enfermedades subyacentes. La administración de Cayston en los pacientes con FQ y hemoptisis activa solo debe realizarse si se considera que los beneficios del tratamiento superan a los riesgos de inducir más hemorragia.
Otras precauciones
No se ha establecido la eficacia en los pacientes con un VEFi esperado > 75%. Los pacientes en los que se había aislado Burkholderia cepacia en esputo en los 2 años previos fueron excluidos de los ensayos.
No se debe usar aztreonam inyectable en el sistema Altera ni en ningún otro nebulizador. El aztreonam inyectable no se ha formulado para su uso por vía inhalatoria y contiene arginina, una sustancia que provoca inflamación pulmonar.
Resistencias al aztreonam, otros antibióticos y microorganismos surgidos en relación con el tratamiento
La aparición de P. aeruginosa resistente a antibióticos y la sobreinfección por otros agentes patógenos son riesgos potenciales asociados al tratamiento antibiótico. El desarrollo de resistencias durante el tratamiento con aztreonam inhalado podría limitar las opciones de tratamiento durante las exacerbaciones agudas. En los ensayos clínicos con Cayston se observó una reducción de la sensibilidad de P. aeruginosa al aztreonam y a otros antibióticos betalactámicos. En un ensayo clínico sobre la terapia con Cayston, de 24 semanas de duración controlado con un agente activo, se observaron aumentos de la CMI90 para todos los aislados de P. aeruginosa, así como en los porcentajes de pacientes con P. aeruginosa resistente (CMI por encima del punto de corte parenteral) al aztreonam, a un antibiótico betalactámico como mínimo y a los 6 antibióticos betalactámicos investigados (ver sección 5.1). No obstante, esta reducción de la sensibilidad de P. aeruginosa no fue predictiva de la eficacia clínica de Cayston durante el ensayo. En los pacientes con P. aeruginosa multirresistente se observaron mejorías en los síntomas respiratorios y en la función pulmonar tras el tratamiento con Cayston. La aparición de resistencias parenterales de P. aeruginosa al aztreonam o a otros antibióticos betalactámicos puede tener consecuencias potenciales para el tratamiento de las exacerbaciones pulmonares agudas con antibióticos sistémicos.
Se observó un aumento de la prevalencia de las especies de Staphylococcus aureus resistentes a la meticilina (SARM), Staphylococcus aureus sensibles a la meticilina (SASM), Aspergillus y Candida con el transcurso del tiempo en los pacientes tratados con varios ciclos de tratamiento con Cayston. En la bibliografía médica se ha notificado una asociación entre el aislamiento persistente de SARM y peores resultados clínicos. Durante los ensayos clínicos con Cayston, el aislamiento de SARM no provocó un empeoramiento de la función pulmonar.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones. No obstante, no se observaron indicios de interacciones farmacológicas con aztreonam durante los ensayos clínicos en los que Cayston se administró de forma concomitante con broncodilatadores, dornasa alfa, enzimas pancreáticas, azitromicina, tobramicina, esteroides orales (menos de 10 mg al día / 20 mg en días alternos) y esteroides inhalados.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de aztreonam en mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales ni directos ni indirectos en términos de toxicidad para la reproducción (ver sección 5.3).
La concentración sistémica de aztreonam tras la administración de Cayston por vía inhalatoria es baja en comparación con una dosis estándar de aztreonam inyectable (aproximadamente el 1% de la concentración que resultaría de administrar una dosis de 500 mg de aztreonam inyectable).
No debe utilizarse Cayston durante el embarazo a no ser que la situación clínica de la mujer requiera tratamiento con aztreonam.
Lactancia
Tras la administración de aztreonam inyectable, aztreonam se excreta en la leche materna en concentraciones muy bajas. La concentración sistémica de aztreonam tras la administración de Cayston por vía inhalatoria es aproximadamente el 1% de la concentración que resultaría de administrar una dosis estándar de aztreonam inyectable. Por lo tanto, debido a su escasa absorción oral, se espera que la exposición a aztreonam de los niños lactantes como consecuencia del tratamiento de sus madres con Cayston sea extremadamente baja.
Cayston puede ser utilizado durante la lactancia.
Fertilidad
Los datos en los estudios no clínicos de aztreonam inyectable acerca de la fertilidad no indican ningún efecto adverso.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Cayston sobre la capacidad para conducir o utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas Resumen del perfil de seguridad
La evaluación de las reacciones adversas se basa en la experiencia obtenida a partir de cuatro ensayos clínicos de fase 3 en los que participaron pacientes con FQ e infección crónica por P. aeruginosa y en las notificaciones espontáneas posteriores a la comercialización.
En los dos ensayos clínicos de fase 3 controlados con placebo en los que los pacientes recibieron Cayston durante 28 días, las reacciones adversas a Cayston que se presentaron con mayor frecuencia fueron: tos (58%), congestión nasal (18%), sibilancias (15%) dolor faringolaríngeo (13,0%), pirexia (12%) y disnea (10%).
Un descenso acusado de > 15% en el VEFj es una complicación asociada a los tratamientos administrados por nebulización, incluido Cayston (ver sección 4.4).
Resumen tabulado de reacciones adversas
Las reacciones adversas consideradas al menos posiblemente relacionadas con el tratamiento que se observaron durante los ensayos clínicos y la experiencia posterior a la comercialización se indican a continuación, clasificadas por órganos y sistemas y por frecuencia.
Las frecuencias se definen del siguiente modo: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10) y poco frecuentes (> 1/1.000 a < 1/100).
|
Trastornos respiratorios, torácicos y mediastínicos: | |
|
Muy frecuentes: |
tos, congestión nasal, sibilancias, dolor faringolaríngeo, disnea |
|
Frecuentes: |
broncoespasmo1, molestias torácicas, rinorrea, hemoptisis1 |
|
Trastornos de la piel y del tejido subcutáneo: | |
|
Frecuentes: |
exantema1 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo: | |
|
Frecuentes: |
artralgias |
|
Poco frecuentes: |
tumefacción articular |
|
Trastornos generales y alteraciones en el lugar de administración: | |
|
Muy frecuentes: |
pirexia |
|
Exploraciones complementarias: | |
|
Frecuentes: |
descenso en las pruebas de función pulmonar1 |
1 Ver sección c. Descripción de las reacciones adversas seleccionadas
Descripción de las reacciones adversas seleccionadas
Broncoespasmo
Los tratamientos administrados por nebulización, incluyendo Cayston, pueden asociarse a broncoespasmo (un descenso acusado de > 15% en el VEFj). Consultar la sección 4.4.
Hemoptisis
La inhalación de soluciones administradas por nebulización puede inducir un reflejo tusígeno que podría agravar enfermedades subyacentes (ver sección 4.4).
Reacciones alérgicas
Se ha notificado exantema con el uso de aztreonam y puede ser indicativo de una reacción alérgica a Cayston (ver sección 4.4).
Descenso en las pruebas de función pulmonar
Se ha notificado un descenso en las pruebas de función pulmonar con el uso de Cayston, pero no se asoció con una disminución sostenida del VEFi (ver sección 5.1).
Las siguientes reacciones adversas raras y graves se han notificado después del uso por vía parenteral de otros medicamentos que contienen aztreonam: necrolisis epidérmica tóxica, anafilaxia, púrpura, eritema multiforme, dermatitis exfoliativa, urticaria, petequias, prurito, diaforesis.
Población pediátrica
Un total de 137 pacientes pediátricos de 6 a 17 años de edad con infección crónica por P. aeruginosa y un VEFi esperado < 75% han recibido Cayston en los ensayos clínicos de fase 2 y fase 3 (6-12 años, n=35; 13-17 años, n=102).
Se observó una mayor tasa de incidencia de pirexia en los pacientes pediátricos de 6 a 17 años que en los adultos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se han identificado reacciones adversas específicamente asociadas con la sobredosis de Cayston. Dado que la concentración plasmática de aztreonam tras la administración de Cayston (75 mg) es de aproximadamente 0,6 pg/ml, frente a niveles séricos de 54 pg/ml tras la administración de aztreonam inyectable (500 mg), no se prevén problemas de seguridad en relación con la sobredosis de aztreonam.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antibacterianos para uso sistémico, otros antibacterianos betalactámicos, código ATC: J01DF01
Mecanismo de acción
Aztreonam presenta actividad in vitro contra patógenos aerobios gramnegativos, incluido P. aeruginosa. Aztreonam se fija a las proteínas de unión a la penicilina de las bacterias sensibles, lo que causa la inhibición de la síntesis de la pared bacteriana, seguida de filamentación y lisis celular.
Mecanismos de resistencia
Se produce la pérdida de sensibilidad al aztreonam en pacientes con FQ con infección por P. aeruginosa, bien por la selección de cepas con mutaciones localizadas en el cromosoma o, raramente, mediante la adquisición de genes mediados por plásmidos/integrones.
Los mecanismos conocidos de resistencia al aztreonam mediados por mutación de genes cromosómicos incluyen: hiperexpresión de AmpC de betalactamasa de clase C y aumento de la actividad de la bomba de eflujo MexAB-OprM. El mecanismo conocido de resistencia al aztreonam mediado por la adquisición de genes supone la adquisición de enzimas betalactámicas de espectro ampliado (ESBL) que hidrolizan el anillo de aztreonam, que tiene cuatro miembros y contiene nitrógeno.
Las ESBL de las betalactamasas de clases A, B y D pueden tener actividad contra el aztreonam. Entre las betalactamasas de clase A que se ha notificado que hidrolizan el aztreonam se encuentran el tipo VEB (principalmente Asia suroriental), el tipo PER (Turquía), y los tipos GES e IBC (Francia, Grecia y Suráfrica). Se han notificado casos raros de organismos con metalobetalactamasas (MBL), de clase B, que son resistentes al aztreonam, VIM-5 (K. pneumoniae y P. aeruginosa en Turquía), VIM-6 (P. putida en Singapur) y VIM-7 (P. aeruginosa en Estados Unidos). Sin embargo, es posible que estos organismos estuvieran expresando mecanismos de resistencia múltiple y, por tanto, una MBL no fuera responsable de la resistencia observada al aztreonam. Se han notificado casos raros de betalactamasas de clase D de aislados clínicos de P. aeruginosa, OXA-11 (Turquía) y OXA-45 (Estados Unidos) que hidrolizan el aztreonam.
Microbiología
Una única muestra de esputo de un paciente con FQ puede contener múltiples aislados de P. aeruginosa, cada uno de los cuales puede presentar diferentes grados de sensibilidad in vitro a aztreonam. Los métodos de análisis de la sensibilidad antimicrobiana in vitro utilizados para el tratamiento parenteral con aztreonam pueden emplearse para monitorizar la sensibilidad de P. aeruginosa aislada en los pacientes con FQ.
En los ensayos de fase 3, controlados con placebo, de Cayston, las concentraciones locales de aztreonam fueron, por lo general, superiores a los valores de CMI de aztreonam para P. aeruginosa, independientemente del grado de sensibilidad de P. aeruginosa.
El tratamiento con hasta nueve ciclos de 28 días de Cayston administrado en dosis de 75 mg, tres veces al día, produjo mejorías clínicamente relevantes en los síntomas respiratorios, la función pulmonar y la densidad de UFC de P. aeruginosa en el esputo; no se observaron aumentos de la CMI50 para P. aeruginosa (cambio de ± 2 diluciones), mientras que la CMI90 aumentó intermitentemente hasta 4 veces la CMI inicial. En un ensayo controlado de 24 semanas de duración con un agente activo sobre la terapia con Cayston, no se observaron aumentos de la CMI50 para P. aeruginosa (cambio de ± 2 diluciones), mientras que se demostró un aumento de la CMI90 de hasta 4 veces la CMI inicial. Al final del ensayo, el porcentaje de pacientes con una CMI del aztreonam para P. aeruginosa por encima del punto de corte parenteral (> 8 pg/ml) aumentó desde un 34% en la situación inicial hasta un 49%, el porcentaje de pacientes con P. aeruginosa resistente al menos a 1 antibiótico betalactámico aumentó desde un 56% en la situación inicial hasta un 67% y el porcentaje de pacientes con P. aeruginosa resistente a los 6 antibióticos betaláctamicos investigados aumentó desde un 13% en la situación inicial hasta un 18%. Existe un riesgo de que los aislados de P. aeruginosa puedan desarrollar resistencias al aztreonam o a otros antibióticos betalactámicos en los pacientes tratados con Cayston. La aparición de resistencias parenterales de P. aeruginosa al aztreonam y otros antibióticos betalactámicos pueden tener consecuencias potenciales para el tratamiento de las exacerbaciones pulmonares agudas con antibióticos sistémicos. No obstante, se observaron mejorías similares de la función pulmonar tras el tratamiento con Cayston en los pacientes con aislados de P. aeruginosa sensibles o resistentes al aztreonam.
En ensayos en los que se administraron hasta nueve ciclos de 28 días de tratamiento con Cayston, no se observaron incrementos clínicamente relevantes en el aislamiento de otros patógenos respiratorios bacterianos gramnegativos surgidos en relación con el tratamiento (especies de Burkholderia, Stenotrophomonas maltophilia y especies de Alcaligenes). Durante la fase aleatorizada de 6 meses del ensayo GS-US-205-0110, el aislamiento de SASM y SARM surgido en relación con el tratamiento se observó con mayor frecuencia entre los pacientes tratados con aztreonam que entre los tratados con tobramicina en solución para nebulizador (TNS). La mayoría de los aislamientos surgidos en relación con el tratamiento fueron intermitentes. El aislamiento persistente de SASM surgido en relación con el tratamiento (definido como ausente en la fase de cribado/inicial y posteriormente presente en 3 o más visitas consecutivas subsiguientes) ocurrió en el 6% de los pacientes tratados con aztreonam frente al 3% de los tratados con TNS. El aislamiento intermitente de SARM surgido en relación con el tratamiento ocurrió en el 7% de los pacientes tratados con aztreonam frente al 1% de los tratados con TNS y el aislamiento persistente de SARM surgido en relación con el tratamiento ocurrió en el 3% de los pacientes tratados con aztreonam frente a ninguno de los tratados con TNS. En la bibliografía médica se ha notificado una asociación entre el aislamiento persistente de SARM y mayor gravedad de la enfermedad e incremento de la mortalidad. Durante los ensayos clínicos con Cayston, el aislamiento de SARM no provocó un empeoramiento de la función pulmonar.
Eficacia clínica y seguridad
Cayston se comparó con la TNS durante tres ciclos de tratamiento de 28 días en un ensayo multicéntrico, aleatorizado y controlado con un agente activo (GS-US-205-0110). Los pacientes participantes en este ensayo en Europa que completaron al menos 1 ciclo de Cayston o TNS durante la fase aleatorizada podían recibir posteriormente hasta tres ciclos de 28 días de Cayston en una fase de extensión en régimen abierto. Entre los criterios de inclusión se encontraban FQ, un VEFi esperado < 75%, enfermedad pulmonar estable, un cultivo de esputo reciente positivo para P. aeruginosa y tratamiento previo con antibióticos en aerosol sin demostración de intolerancia medicamentosa.
Cayston se evaluó durante un periodo de 28 días de tratamiento (un ciclo), en dos ensayos multicéntricos, aleatorizados, doble ciego, controlados con placebo (CP-AI-005 y CP-AI-007). Los pacientes que participaron en estos ensayos pudieron recibir posteriormente varios ciclos de Cayston en un ensayo de seguimiento abierto (CP-AI-006). Entre los criterios de inclusión se encontraban que el VEF1 inicial de la fibrosis quística estuviera entre el 25% y el 75%, y la presencia de infección pulmonar crónica por P. aeruginosa.
En total, en estos ensayos se trató a 539 pacientes (78% adultos). Los ensayos se realizaron utilizando el sistema nebulizador Altera para la administración de Cayston.
GS-US-205-0110
En el ensayo GS-US-205-0110, se aleatorizó a 268 pacientes con FQ e infección pulmonar crónica por P. aeruginosa a recibir Cayston(n=136) o TNS (n=132). En el ensayo se incluyó a 59 pacientes pediátricos de 6 a 17 años de edad. Los pacientes se aleatorizaron en una proporción 1:1 a recibir aztreonam (75 mg) administrado mediante inhalación tres veces al día o TNS (300 mg) administrado dos veces al día. Los tratamientos se administraron durante tres ciclos de 28 días de terapia seguidos de 28 días sin terapia. Las variables de eficacia coprimarias fueron la no inferioridad de Cayston con respecto a la TNS en el cambio relativo desde la situación inicial hasta el día 28 en el % de VEFj esperado y la superioridad de Cayston con respecto a la TNS en el cambio real desde la situación inicial en el % de VEF1 esperado a lo largo de 3 ciclos de tratamiento (el promedio del cambio real en el % de VEF1 esperado observado al final de cada ciclo de tratamiento).
El cambio porcentual medio ajustado desde la situación inicial hasta el día 28 en el % de VEFi esperado fue de 8,35 y 0,55 en los grupos tratados con Cayston y TNS, respectivamente (diferencia entre tratamientos: 7,80; p=0,0001; IC del 95%: 3,86; 11,73). El cambio real medio ajustado desde la situación inicial en el % de VEF1 esperado a lo largo de 3 ciclos de tratamiento fue de 2,05 y -0,66 en los grupos tratados con Cayston y TNS, respectivamente (diferencia entre tratamientos: 2,70; p=0,0023; IC del 95%: 0,98; 4,43). En los pacientes tratados con aztreonam transcurrió un periodo de tiempo más prolongado hasta necesitar antibióticos contra Pseudomonas por vía IV en relación con acontecimientos respiratorios que en los tratados con TNS (p=0,0025). Las estimaciones de Kaplan-Meier para esta tasa de acontecimientos en la semana 24 fueron del 36% para los pacientes tratados con aztreonam y del 54% para los tratados con TNS. Además, los pacientes tratados con aztreonam presentaron menos hospitalizaciones debidas a acontecimientos respiratorios (40 frente a 58, p=0,044) y menos acontecimientos respiratorios que precisaron el uso de antibióticos contra Pseudomonas por vía IV o inhalatoria (84 frente a 121, p=0,004) que los tratados con TNS. Los pacientes tratados con aztreonam también demostraron mejorías medias de mayor magnitud en las puntuaciones de síntomas respiratorios CFQ-R que los tratados con TNS a lo largo de 3 ciclos de tratamiento (6,30 frente a 2,17, p=0,019).
En el limitado subgrupo de pacientes que recibieron tobramicina por vía inhalatoria durante menos de 84 días en los 12 meses anteriores (n=40), las mejorías en la función pulmonar el día 28 y a lo largo de tres ciclos de tratamiento de 28 días fueron numéricamente más bajas en los pacientes tratados con aztreonam que entre los tratados con TNS.
CP-AI-007
En el ensayo CP-AI-007 se incluyeron 164 pacientes adultos (en su mayoría) y pediátricos, aleatorizados en una proporción de 1:1, y se comparó Cayston 75 mg (80 pacientes) administrado tres veces al día, durante 28 días (un ciclo) frente a placebo (84 pacientes). Los pacientes no debían haber recibido antibióticos contra pseudomonas por lo menos en los 28 días anteriores al inicio del tratamiento con el medicamento en estudio.
La función pulmonar y los síntomas respiratorios mejoraron significativamente con respecto a los valores iniciales hasta el día 28 en pacientes tratados con un ciclo de Cayston.
CP-AI-005
En el ensayo CP-AI-005 se incluyeron 246 pacientes adultos (en su mayoría) y pediátricos. Todos los pacientes recibieron tratamiento con 300 mg de tobramicina en solución para nebulizador (TNS), dos veces al día, en las cuatro semanas inmediatamente anteriores a recibir Cayston o placebo, dos o tres veces al día, durante 28 días. Los pacientes siguieron recibiendo sus medicamentos iniciales, incluidos los antibióticos macrólidos. Se aleatorizó a los pacientes en una proporción 2:2:1:1 para recibir tratamiento con aztreonam 75 mg, dos o tres veces al día, o un placebo con un volumen idéntico, dos o tres veces al día, durante 28 días inmediatamente después del ciclo de 28 días de preinclusión con TNS administrado durante la fase abierta.
El tratamiento con aztreonam produjo mejorías significativas de la función pulmonar y los síntomas respiratorios en el día 28 en los 66 pacientes tratados con un ciclo de Cayston 75 mg, tres veces al día.
CP-AI-006
CP-AI-006 fue un ensayo de seguimiento abierto de los ensayos CP-AI-005 y CP-AI-007, para evaluar la seguridad de la exposición repetida al aztreonam y el efecto sobre las variables de eficacia relacionadas con la enfermedad, con respecto a varios ciclos de 28 días. Los pacientes recibieron Cayston a la misma frecuencia (dos o tres veces al día) que tomaron Cayston o placebo en los ensayos aleatorizados. Los pacientes siguieron recibiendo sus medicamentos iniciales y, cuando estuvo indicado, se usaron otros antibióticos en la mayoría de los pacientes para tratar las exacerbaciones. Después de cada ciclo de 28 días de Cayston hubo un periodo de 28 días sin medicación. Después de nueve ciclos de 28 días de tratamiento, las medidas de función pulmonar (VEF1), puntuaciones de síntomas respiratorios CFQ-R y densidad de P. aeruginosa en el esputo mostraron una tendencia a la mejoría, mientras los pacientes recibían tratamiento, en comparación con la ausencia de tratamiento. Sin embargo, debido a la naturaleza no controlada del ensayo y a la utilización de medicación concomitante, no puede extraerse ninguna conclusión acerca del mantenimiento del beneficio observado a corto plazo sobre los ciclos posteriores de tratamiento.
Población pediátrica
Un total de 137 pacientes pediátricos de 6 a 17 años de edad con infección crónica por P. aeruginosa y un VEFi esperado < 75% han recibido Cayston en los ensayos clínicos de fase 2 y fase 3. Los pacientes pediátricos presentaron mejorías clínicas con aztreonam puestas de manifiesto por un aumento del VEF1, una mejoría en las puntuaciones de síntomas respiratorios CFQ-R y un descenso de la densidad de P. aeruginosa en el esputo. De acuerdo con esta experiencia clínica, el uso de Cayston está indicado en los pacientes pediátricos de 6 o más años de edad con ciclos repetidos de 28 días de terapia seguidos de 28 días sin terapia con Cayston.
En un ensayo abierto de fase 2 (GS-US-205-0162), 105 pacientes pediátricos de 3 meses a < 18 años de edad (24 pacientes de 3 meses a < 2 años; 25 pacientes de 2 a < 6 años; 56 pacientes de 6 a < 18 años) con FQ e infección o colonización por P. aeruginosa inicial o de nueva aparición documentada recibieron Cayston tres veces al día, durante un único ciclo de 28 días.
De los 101 pacientes, todos con cultivos positivos para P. aeruginosa en los 30 días previos a su inscripción en el ensayo, 56 (55,4%) estaban libres de P. aeruginosa al inicio del ensayo; todos los pacientes completaron un ciclo de tratamiento de 28 días; de estos pacientes el 89,1% (n = 90) estaban libres de P. aeruginosa al final del tratamiento (día 28) y el 75,2% (n = 76) estaban libres de P. aeruginosa 1 mes después del final del tratamiento (día 56).Un total de 79 pacientes que completaron un ciclo de tratamiento de 28 días y no recibieron un antibiótico adicional contra pseudomonas durante el periodo de tratamiento fueron evaluables 6 meses después del final del tratamiento; de ellos, el 58,2% (n = 46) permanecieron libres de P. aeruginosa a largo de todo este periodo de tiempo.
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Cayston en uno o más grupos de la población pediátrica en pacientes con fibrosis quística, con infección o colonización pulmonar por Pseudomonas aeruginosa (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
Concentraciones en esputo
Las concentraciones de aztreonam en el esputo de los pacientes considerados de forma individual mostraron una considerable variabilidad. En los ensayos combinados de fase 3 controlados con placebo, diez minutos después de la administración de una dosis única de 75 mg de aztreonam inhalado los días 0, 14 y 28, las concentraciones medias en el esputo de 195 pacientes con FQ fueron de 726 pg/g, 711 pg/g y 715 pg/g, respectivamente, lo que indica que tras la administración de dosis repetidas no se produce acumulación de aztreonam.
Concentraciones plasmáticas
Las concentraciones plasmáticas de aztreonam en los pacientes considerados de forma individual mostraron una considerable variabilidad.
Una hora después de la administración de una dosis única de 75 mg de aztreonam inhalado (aproximadamente en el pico de la concentración plasmática), el nivel plasmático medio de los pacientes con FQ fue de 0,59 pg/ml. La media de los picos de los niveles plasmáticos los días 0, 14 y 28 de un ciclo de tratamiento con aztreonam inhalado en dosis de 75 mg -3 veces al día fue de 0,55 pg/ml, 0,67 pg/ml y 0,65 pg/ml, respectivamente, lo que indica la ausencia de acumulación sistémica de aztreonam tras una pauta de dosificación de 3 veces al día. En contraste, la concentración sérica de aztreonam tras la administración de aztreonam inyectable (500 mg) es de aproximadamente 54 pg/ml.
Las concentraciones plasmáticas de aztreonam en los pacientes pediátricos de 3 meses a < 6 años de edad son comparables a las observadas en los niños > 6 años, los adolescentes y los adultos.
Distribución
La unión de aztreonam a proteínas en el plasma es de aproximadamente el 77% a concentraciones plasmáticas clínicamente relevantes.
Metabolismo
Aztreonam no sufre un metabolismo amplio. El principal metabolito (SQ26,992) es inactivo y se forma por la apertura del anillo betalactámico por hidrólisis. Los datos de recuperación indican que alrededor de un 10% de la dosis se excreta en forma de este metabolito.
Eliminación
La semivida de eliminación sérica de aztreonam es de aproximadamente 2,1 horas para la administración por vía inhalatoria, semejante a lo notificado para aztreonam inyectable. Aproximadamente el 10% de la dosis total de aztreonam inhalado se excreta en la orina como fármaco sin cambios, frente a un 60-65% tras la administración por vía intravenosa de aztreonam inyectable. El aztreonam absorbido sistémicamente se elimina aproximadamente en partes iguales mediante secreción tubular activa y mediante filtración glomerular.
Farmacocinética en poblaciones especiales
Edad y sexo
No se observaron efectos clínicamente relevantes de la edad o el sexo sobre la farmacocinética del aztreonam.
Insuficiencia hepática y renal
No se han realizado estudios farmacocinéticos en pacientes con insuficiencia hepática o renal.
Propiedades farmacocinéticas de aztreonam inyectable
El pico de los niveles de aztreonam se alcanza alrededor de una hora después de su administración por vía IM. Tras dosis únicas idénticas administradas por vía IM o IV, las concentraciones séricas son comparables al cabo de 1 hora (1,5 horas desde el inicio de la perfusión IV), con pendientes similares de concentraciones séricas a partir de entonces. La semivida sérica media de aztreonam fue de 1,7 horas en los individuos con función renal normal, independientemente de la dosis y la vía de administración. En los sujetos sanos, se recuperó en la orina el 60-70% de una dosis única administrada por vía IM o IV al cabo de 8 horas y la excreción urinaria fue prácticamente completa al cabo de 12 horas.
Población pediátrica
Los ensayos de registro controlados con placebo de fases 2 y 3 permitieron comparar las concentraciones plasmáticas 1 hora después de la dosis de Cayston en función de la edad (6 a 12 años, 13 a 17 años y > 18 años). Los datos de estos ensayos revelaron diferencias mínimas en las concentraciones plasmáticas medias de aztreonam entre los grupos de edad en los pacientes tratados con Cayston tres veces al día.
Los datos combinados de concentración en el esputo de los ensayos de registro de fases 2 y 3 revelaron algunos indicios de concentraciones medias en el esputo más bajas en los pacientes de 13 a 17 años tras una dosis de Cayston tres veces al día. Sin embargo, todos los valores medios de concentración en el esputo se asociaron a desviaciones estándar relativamente grandes.
5.3 Datos preclínicos sobre seguridad
En un estudio toxicológico de inhalación en ratas de 104 semanas de duración para evaluar el potencial carcinogénico de dosis crecientes de aztreonam, se demostró la ausencia de un aumento en la incidencia de tumores malignos en relación con el fármaco.
Los estudios de genotoxicidad (ensayo de aberración cromosómica y de mutación del linfoma del ratón) con aztreonam fueron negativos.
Se han realizado estudios de fertilidad, teratología, así como estudios perinatales y postnatales con aztreonam inyectable por vía IV en ratas, con dosis diarias de hasta 750 mg/kg, sin que se observasen efectos adversos. La tasa de supervivencia durante el periodo de lactancia de la descendencia de las ratas tratadas con la dosis más elevada se redujo ligeramente.
6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes
Polvo
L-lisina
Disolvente
Cloruro de sodio
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez Vial de polvo: 4 años.
Disolvente: 3 años.
Tras la reconstitución, se recomienda utilizar Cayston de forma inmediata. Si no se usa de inmediato, la solución reconstituida debe conservarse entre 2°C y 8°C y utilizarse en un plazo máximo de 8 horas. Los tiempos de conservación durante el uso y las condiciones previas al mismo son responsabilidad del usuario.
6.4 Precauciones especiales de conservación
Vial de polvo y ampolla de disolvente: conservar en nevera (entre 2°C y 8°C). Puede conservarse fuera de la nevera, pero a una temperatura inferior a 25°C durante un máximo de 28 días.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de polvo: vial de vidrio ámbar tipo I con tapón de goma gris siliconada y sobresellado de aluminio desprendible con o sin una cápsula de cierre azul.
Disolvente: ampolla de polietileno de baja densidad de 1 ml.
Cada envase de Cayston para 28 días contiene 84 viales de aztreonam liofilizado y 88 ampollas de disolvente. Las cuatro ampollas adicionales de disolvente se suministran por si se producen derrames.
Este medicamento está disponible en:
• Envase de Cayston para 28 días
• Envase que contiene un envase de Cayston para 28 días más un dispositivo nebulizador de mano Altera
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Reconstitución
Cayston sólo debe reconstituirse con el disolvente suministrado. Tras la reconstitución, Cayston es una solución transparente entre incolora y ligeramente coloreada.
Se recomienda administrar Cayston inmediatamente después de su reconstitución con el disolvente. Cayston no debe reconstituirse hasta que sea necesario administrar una dosis. Se abre un vial de vidrio que contiene Cayston desprendiendo y levantando la cápsula de cierre azul o levantando la solapa de metal; el anillo metálico se extrae tirando cuidadosamente de la solapa (si es necesario, pueden utilizarse unas pinzas o tenacillas para extraer el anillo metálico) y se quita el tapón de goma gris. La ampolla de disolvente se aprieta para traspasar el líquido de su interior al vial de vidrio. A continuación, se agita suavemente el vial con un movimiento circular, hasta que su contenido se haya disuelto por completo. Cayston reconstituido se vierte en el dispositivo nebulizador de mano Altera y se administa la dosis.
Cayston se administra por vía inhalatoria durante un periodo de 2 a 3 minutos, utilizando un dispositivo nebulizador de mano Altera, específico de Cayston y el generador de aerosol Altera, conectados a un eBase Controller o a una unidad de mando eFlow rapid. Cayston no debe utilizarse con ningún otro tipo de dispositivo de mano ni generador de aerosol. Cayston no debe mezclarse con ningún otro medicamento en el dispositivo nebulizador de mano Altera. No introduzca otros medicamentos en el dispositivo nebulizador de mano Altera.
No reconstituya ni mezcle Cayston con ningún otro disolvente ni medicamento. No reconstituya más de una dosis cada vez. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB216GT
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/543/001
EU/1/09/543/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 21/septiembre/2009 Fecha de la última renovación:
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricantc(s) rcsponsablc(s) de la liberación de los lotes
Gilead Sciences Ireland UC
IDA Business & Technology Park
Carrigtohill
County Cork
Irlanda
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo
acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de
Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR EMBALAJE EXTERIOR DE CAYSTON
(Con Blue Box - No para ser embalado con el dispositivo nebulizador de mano Altera)
Cayston 75 mg polvo y disolvente para solución para inhalación por nebulizador aztreonam
Cada vial de polvo contiene 75 mg de aztreonam.
Tras la reconstitución, cada ml de la solución para inhalación por nebulizador contiene 75 mg de aztreonam (como lisina).
3. LISTA DE EXCIPIENTES_
El vial de polvo también contiene L-lisina
La ampolla de disolvente contiene cloruro de sodio y agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución para inhalación por nebulizador 84 viales de un solo uso
88 ampollas de un solo uso que contienen 1 ml de disolvente
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Sólo para uso por vía inhalatoria. Reconstituir antes de su uso. El polvo sólo debe mezclarse con el disolvente suministrado.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera. Puede conservarse fuera de la nevera, pero a una temperatura inferior a 25°C durante un máximo de 28 días.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB216GT
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/543/001: envase de Cayston para 28 días
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Cayston 75 mg
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR EMBALAJE EXTERIOR
(Embalaje exterior que contiene un envase de Cayston para 28 días y un dispositivo nebulizador de mano Altera con Blue Box)
Cayston 75 mg polvo y disolvente para solución para inhalación por nebulizador aztreonam
Cada vial de polvo contiene 75 mg de aztreonam.
Tras la reconstitución, cada ml de la solución para inhalación por nebulizador contiene 75 mg de aztreonam (como lisina).
El vial de polvo también contiene L-lisina
La ampolla de disolvente contiene cloruro de sodio y agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución para inhalación por nebulizador 84 viales de un solo uso
88 ampollas de un solo uso que contienen 1 ml de disolvente Este envase contiene un dispositivo nebulizador de mano Altera.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Sólo para uso por vía inhalatoria. Reconstituir antes de su uso. El polvo sólo debe mezclarse con el disolvente suministrado.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. Puede conservarse fuera de la nevera, pero a una temperatura inferior a 25°C durante un máximo de 28 días.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB216GT
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/543/002: envase de Cayston para 28 días más un dispositivo nebulizador de mano Altera
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Cayston 75 mg
(Sin Blue Box - para uso solamente al ser embalado con el dispositivo nebulizador de mano Altera)
|
1. |
NOMBRE DEL MEDICAMENTO |
Cayston 75 mg polvo y disolvente para solución para inhalación por nebulizador aztreonam
Cada vial de polvo contiene 75 mg de aztreonam.
Tras la reconstitución, cada ml de la solución para inhalación por nebulizador contiene 75 mg de aztreonam (como lisina).
3. LISTA DE EXCIPIENTES_
El vial de polvo también contiene L-lisina
La ampolla de disolvente contiene cloruro de sodio y agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución para inhalación por nebulizador 84 viales de un solo uso
88 ampollas de un solo uso que contienen 1 ml de disolvente Este envase no es para ser vendido por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Sólo para uso por vía inhalatoria. Reconstituir antes de su uso. El polvo sólo debe mezclarse con el disolvente suministrado.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. Puede conservarse fuera de la nevera, pero a una temperatura inferior a 25°C durante un máximo de 28 días.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB216GT
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/543/002: envase de Cayston para 28 días más un dispositivo nebulizador de mano Altera
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Cayston 75 mg
Cayston 75 mg polvo y disolvente para solución para inhalación por nebulizador aztreonam
Cada vial de polvo contiene 75 mg de aztreonam.
Tras la reconstitución, cada ml de la solución para inhalación por nebulizador contiene 75 mg de aztreonam (como lisina).
3. LISTA DE EXCIPIENTES_
El vial de polvo también contiene L-lisina
La ampolla de disolvente contiene cloruro de sodio y agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución para inhalación por nebulizador 42 viales de un solo uso
44 ampollas de un solo uso que contienen 1 ml de disolvente
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Sólo para uso por vía inhalatoria. Reconstituir antes de su uso. El polvo sólo debe mezclarse con el disolvente suministrado.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera. Puede conservarse fuera de la nevera, pero a una temperatura inferior a 25°C durante un máximo de 28 días.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB216GT
Reino Unido
EU/1/09/543/001: envase de Cayston para 28 días
3U/1/09/543/002: envase de Cayston para 28 días más un dispositivo nebulizador de mano Altera
Lote
Cayston 75 mg
ETIQUETA DEL VIAL de Cayston_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Cayston 75 mg polvo para solución para inhalación por nebulizador aztreonam
Sólo para uso por vía inhalatoria.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
75 mg
6. OTROS
GILEAD
ETIQUETA DE LA AMPOLLA DE DISOLVENTE
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Solvent for Cayston Sodium Chloride 0.17%
2. FORMA DE ADMINISTRACIÓN
Inhalation use only
3. FECHA DE CADUCIDAD
4. NÚMERO DE LOTE
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 ml
6. OTROS
GILEAD SCIENCES
B. PROSPECTO
Prospecto: información para el usuario
Cayston 75 mg polvo y disolvente para solución para inhalación por nebulizador
Aztreonam
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Cayston y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Cayston
3. Cómo usar Cayston
4. Posibles efectos adversos
5. Conservación de Cayston
6. Contenido del envase e información adicional
1. Qué es Cayston y para qué se utiliza
Cayston contiene el principio activo aztreonam. Cayston es un antibiótico que se utiliza para el tratamiento de las infecciones pulmonares crónicas causadas por la bacteria Pseudomonas aeruginosa en pacientes de 6 o más años de edad con fibrosis quística. La fibrosis quística, también conocida como mucoviscidosis, es una enfermedad hereditaria potencialmente mortal, que afecta a las glándulas mucosas de los órganos internos, especialmente a los pulmones, pero también al hígado, al páncreas y al aparato digestivo. En los pulmones, la fibrosis quística causa una congestión con moco pegajoso. Esto produce dificultad para respirar.
2. Qué necesita saber antes de empezar a usar Cayston No use Cayston
- si es alérgico al aztreonam o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Cayston:
- si es alérgico a cualquier otro antibiótico (como penicilinas, cefalosporinas y/o carbapenemos)
- si no tolera o siente opresión en el pecho al tomar otros medicamentos inhalados
- si tiene problemas en los riñones
- si ha expectorado sangre en alguna ocasión
- si ha tenido pruebas de función pulmonar baja en alguna ocasión.
Si se encuentra en alguna de las circunstancias anteriores, informe a su médico antes de usar Cayston.
Dado que es un medicamento inhalado, Cayston puede provocarle tos, lo que podría causar una expectoración de sangre. Si ha expectorado sangre en alguna ocasión, solo debe usar Cayston si su médico cree que el beneficio de tomar este medicamento supera al riesgo de expectorar sangre.
Durante el tratamiento con Cayston puede presentar una disminución temporal de las pruebas de función pulmonar, pero, por regla general, no es un efecto que perdure.
Niños
Cayston no debe administrarse a niños menores de 6 años.
Uso de Cayston con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
No existen datos clínicos sobre el uso de Cayston en mujeres embarazadas, por lo tanto, no debe usar Cayston durante el embarazo, a menos que lo haya discutido específicamente con su médico.
Si planea dar el pecho a su bebé, consulte a su médico antes de usar Cayston. Puede dar el pecho durante el tratamiento con Cayston, ya que la cantidad de medicamento que probablemente pase a su hijo durante la lactancia será extremadamente pequeña.
Conducción y uso de máquinas
No es de esperar que Cayston afecte a su capacidad para conducir o usar máquinas.
3. Cómo usar Cayston
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es:
- Use Cayston 3 veces al día en ciclos repetidos de 28 días de terapia seguidos de 28 días sin terapia con Cayston. Cada una de las tres dosis debe administrarse mediante inhalación con un intervalo de separación de al menos cuatro horas, utilizando un dispositivo nebulizador de mano Altera. Puede utilizar un eBase Controller o una unidad de mando eFlow rapid con el dispositivo de mano Altera.
- Cada dosis consiste en un vial de Cayston que se mezcla con el contenido de la ampolla de disolvente. Es necesario mezclar Cayston con un disolvente antes de inhalarse utilizando el nebulizador Altera.
Introduzca la solución Cayston preparada en el dispositivo nebulizador de mano Altera (ver a
continuación). Cada tratamiento tarda alrededor de 2 a 3 minutos en inhalarse.
Utilice un broncodilatador antes de cada dosis de Cayston. Los broncodilatadores de acción corta
pueden usarse entre 15 minutos y 4 horas antes de cada dosis de Cayston, y los de acción prolongada,
entre 30 minutos y 12 horas antes.
Si está utilizando otras terapias por vía inhalatoria para tratar la fibrosis quística, el orden de uso recomendado es el siguiente:
1. broncodilatador
2. mucolíticos (un medicamento que ayuda a disolver el espeso moco producido en los pulmones) y finalmente:
3. Cayston.
No mezcle Cayston con ningún otro medicamento en el dispositivo nebulizador de mano Altera.
- No introduzca otros medicamentos en el dispositivo nebulizador de mano Altera.
- No introduzca aztreonam para administración intravenosa (inyectable) en el dispositivo nebulizador de mano Altera. El aztreonam intravenoso no es adecuado para la inhalación.
Cómo administrar Cayston utilizando el dispositivo nebulizador de mano Altera
Necesitará los siguientes elementos:
■ Un vial de color ámbar de Cayston con o sin una cápsula de cierre azul.
■ Una ampolla de plástico de disolvente (cloruro de sodio al 0,17% p/v). La información que aparece en la ampolla de disolvente se presenta en inglés solamente (ver sección 6).
■ Un dispositivo nebulizador de mano Altera con un generador de aerosol Altera conectado a una unidad de mando eFlow de tipo 178 (eFlow rapid) o de tipo 678 (eBase Controller).
Debe utilizar el dispositivo nebulizador de mano Altera específico de Cayston, con el generador de aerosol Altera. No intente utilizar Cayston con ningún otro tipo de dispositivo nebulizador de mano (incluso el dispositivo de mano eFlow rapid).
Compruebe que el nebulizador funciona adecuadamente antes de comenzar el tratamiento con Cayston. Lea atentamente las instrucciones de uso del fabricante suministradas con el sistema nebulizador Altera.
Preparación de Cayston para la inhalación
- No prepare Cayston hasta que esté listo para administrar la dosis.
- No utilice Cayston si observa que el envase ha sido manipulado.
- No utilice Cayston si se ha conservado fuera de la nevera durante más de 28 días.
- No utilice el disolvente o Cayston ya preparado si presenta un aspecto turbio o se observan partículas en la solución.
1. Extraiga un vial de color ámbar de Cayston y una ampolla de disolvente de la caja. Las ampollas de disolvente deben separarse tirando suavemente de ellas.
2. Golpee suavemente el vial de color ámbar de Cayston, de modo que el polvo se deposite en el fondo. Esto ayuda a garantizar que la dosis administrada sea la correcta.
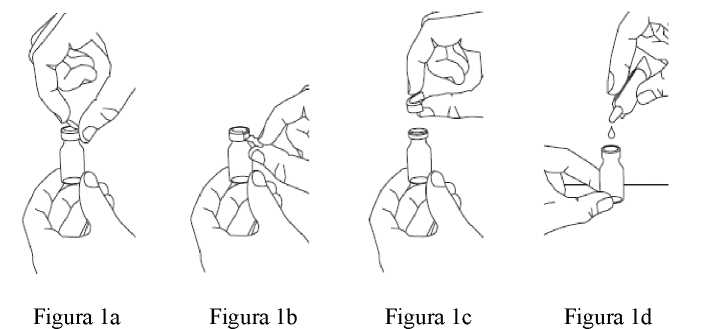
3. Abra el vial de color ámbar: desprenda y levante la cápsula de cierre azul o levante la solapa de metal que se encuentra en su parte superior (Figura 1a) y tire hacia abajo (Figura 1b) para extraer cuidadosamente por completo del vial el anillo metálico y la cápsula de cierre superpuesta (Figura 1c). Deseche el anillo de forma segura. Saque cuidadosamente el tapón de goma.
4. Abra la ampolla de disolvente retorciendo su punta hasta extraerla. Apriete la ampolla para transferir su contenido íntegro al vial (Figura 1d). A continuación, agite suavemente el vial con un movimiento circular hasta que el polvo se haya disuelto por completo y el líquido tenga un aspecto claro.
Es mejor utilizar Cayston inmediatamente después de preparar la solución. Pero, si no puede usar la dosis preparada de forma inmediata, vuelva a colocar el tapón al vial y guárdelo en la nevera.
Utilice la solución preparada en un plazo máximo de 8 horas.
Preparación del nebulizador Altera para la administración de Cayston
1. Asegúrese de que el dispositivo nebulizador de mano Altera se encuentre apoyado sobre una superficie lisa y estable.
2. Extraiga la tapa del contenedor del medicamento girándola en el sentido contrario al de las agujas del reloj.
3. Vierta todo el Cayston preparado del vial en el interior del contenedor del medicamento del dispositivo nebulizador de mano Altera (Figura 2a). Asegúrese de vaciar completamente el vial. Golpee suavemente el vial contra el lateral del contenedor del medicamento, si es necesario.
4. Cierre el contenedor del medicamento alineando las guías de la tapa del contenedor del medicamento con las ranuras del contenedor. Presione hacia abajo y gire la tapa en el sentido de las agujas del reloj hasta alcanzar el tope (Figura 2b).
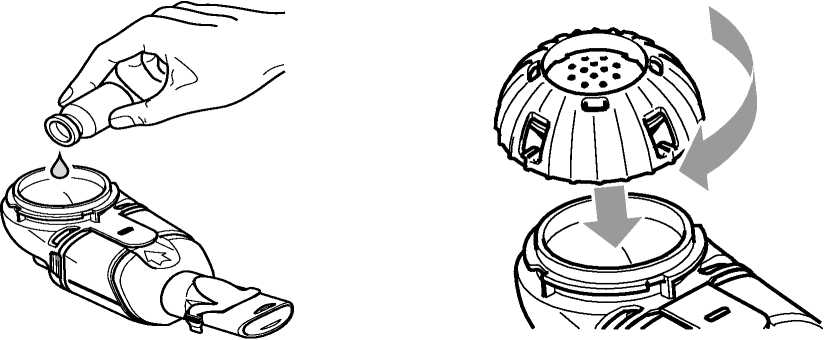
Figura 2a Figura 2b
Utilización del nebulizador Altera para la administración de Cayston
1. Comience el tratamiento. Siéntese en posición relajada, con la espalda erguida. Sujete el
dispositivo de mano en posición horizontal, introduzca la boquilla en su boca y cierre los labios a su alrededor (Figura 3).
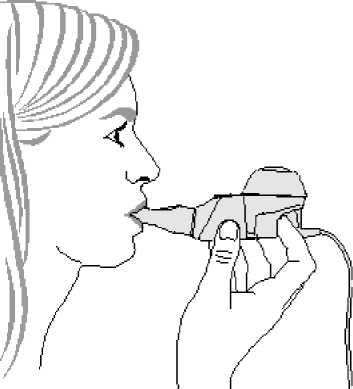
Figura 3
Mantenga el dispositivo de mano en posición horizontal.
2. Apriete y mantenga presionada la tecla On/Off de la unidad de mando durante unos segundos. Oirá una señal acústica y la luz de estado se iluminará en verde.
3. Al cabo de unos segundos, un aerosol en forma de neblina empezará a fluir hacia el interior de la cámara del nebulizador del dispositivo nebulizador de mano Altera. Si la neblina no comienza a fluir, consulte el manual del sistema Altera para obtener información.
4. Respire con normalidad (inhale y expulse el aire) a través de la boquilla. Evite respirar por la nariz. Continúe inspirando y espirando cómodamente hasta terminar el tratamiento.
5. Cuando se haya suministrado todo el medicamento, oirá un sonido que significa “tratamiento completo” (2 señales acústicas).
6. Cuanto el tratamiento esté completo, abra la tapa del contenedor del medicamento para asegurarse de que éste se ha utilizado en su totalidad. Pueden quedar algunas gotas de medicamento en el contenedor una vez finalizado el tratamiento. Si quedan más que unas gotas de líquido, vuelva a colocar la tapa del contenedor del medicamento y reinicie el tratamiento.
7. Una vez finalizado el tratamiento, desconecte la unidad de mando y aparte el dispositivo nebulizador de mano Altera para limpiarlo y desinfectarlo. Para obtener información detallada sobre los procedimientos de limpieza y desinfección, consulte las instrucciones de uso del fabricante suministradas con el dispositivo nebulizador de mano Altera.
¿Y si necesito interrumpir el tratamiento antes de terminarlo?
8. Si, por cualquier motivo, tiene que interrumpir el tratamiento antes de terminarlo, apriete y mantenga presionada la tecla On/Off durante un segundo completo. Para reiniciar el tratamiento, apriete y mantenga presionada la tecla On/Off durante un segundo completo y reinicie el tratamiento.
Recambio del dispositivo nebulizador de mano Altera
El dispositivo nebulizador de mano Altera está diseñado para durar tres ciclos de 28 días de
tratamiento con Cayston cuando se utiliza conforme a las instrucciones suministradas. Una vez
transcurrido este tiempo, recambie su dispositivo nebulizador de mano Altera, incluido el generador de
aerosol. Si nota que su funcionamiento ha sufrido cambios antes de transcurrido este tiempo (por
ejemplo, si tarda más tiempo en generar la neblina, más de cinco minutos), consulte las instrucciones de uso del nebulizador Altera.
Si usa más Cayston del que debe
Si ha usado más Cayston del que debiera, consulte inmediatamente a un médico o farmacéutico.
Si olvidó usar Cayston
Si olvida una dosis, puede continuar administrándose las 3 dosis diarias siempre que deje un intervalo de al menos 4 horas de separación entre ellas. Si no puede dejar un espacio de 4 horas, omita la dosis que se saltó.
Si interrumpe el tratamiento con Cayston
No interrumpa el tratamiento con Cayston sin consultar antes con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si le aparece un exantema, consulte a su médico inmediatamente, ya que puede significar que está sufriendo una reacción alérgica a Cayston.
Efectos adversos muy frecuentes (afectan a más de 1 de cada 10 pacientes)
- Tos
- Obstrucción nasal
- Silbidos respiratorios
- Dolor de garganta
- Sensación de falta de aire
- Fiebre. Puede ser más frecuente en los niños que en los adultos.
Efectos adversos frecuentes (afectan a entre 1 y 10 de cada 100 pacientes)
- Dificultad para respirar
- Molestias en el pecho
- Secreción nasal
- Expectoración de sangre
- Exantema
- Dolor en las articulaciones
- Resultados más bajos en las pruebas de función pulmonar
Efectos adversos poco frecuentes (afectan a entre 1 y 10 de cada 1.000 pacientes)
- Hinchazón de las articulaciones
Se han observado los siguientes efectos adversos después del uso de aztreonam inyectable, pero no después de la administración de Cayston: hinchazón de la cara, labios, lengua o garganta con dificultad para tragar o respirar, sudoración, irritación y descamación de la piel, erupción cutánea con picor, rubor, pequeñas manchas rojas y, muy rara vez, ampollas en la piel. Todos estos signos pueden indicar una reacción alérgica.
Informe a su médico si sufre cualquiera de estos efectos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Cayston
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del vial, la ampolla de disolvente y el embalaje. La fecha de caducidad es el último día del mes que se indica.
Vial de polvo y ampolla de disolvente:
Conservar en nevera (entre 2°C y 8°C). Los viales sin abrir también pueden conservarse fuera de la nevera, pero a una temperatura inferior a 25°C durante un máximo de 28 días.
Use este medicamento inmediatamente después de su preparación. Si no se usa de inmediato, la solución preparada debe conservarse entre 2°C y 8°C y utilizarse en un plazo máximo de 8 horas. No prepare más de una dosis cada vez.
No utilice este medicamento si observa que el envase ha sido manipulado.
No utilice este medicamento si se ha conservado fuera de la nevera durante más de 28 días.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Cayston y del disolvente
- El vial de polvo contiene 75 mg de aztreonam (como lisina).
- La ampolla de disolvente contiene agua para preparaciones inyectables y cloruro de sodio. La ampolla está impresa en inglés solamente. La información que aparece en la ampolla se presenta a continuación:
Disolvente para Cayston
Cloruro de sodio al 0,17%_
Sólo para uso por vía inhalatoria
1 ml_
GILEAD SCIENCES
Aspecto del producto y contenido del envase
Cayston es un polvo de color entre blanco y blancuzco y disolvente para solución para inhalación por nebulizador.
Cayston se encuentra en el interior de un vial de vidrio de color ámbar de 2 ml con un tapón de goma gris y un sobresellado de aluminio desprendible con o sin una cápsula de cierre azul.
El disolvente (1 ml) se encuentra en el interior de una ampolla de plástico.
Cada envase de Cayston para 28 días contiene 84 viales de Cayston liofilizado y 88 ampollas de disolvente. Las cuatro ampollas adicionales de disolvente se suministran por si se producen derrames.
Este medicamento está disponible en:
• Envase de Cayston para 28 días
• Envase que contiene un envase de Cayston para 28 días más un dispositivo nebulizador de mano Altera
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización:
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB216GT
Reino Unido
Responsable de la fabricación:
Gilead Sciences Ireland UC
IDA Business & Technology Park
Carrigtohill
County Cork
Irlanda
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Gilead Sciences Belgium SPRL-BVBA Tél/Tel: + 32 (0) 2 401 35 50
Etarapun
Gilead Sciences International Ltd Tea.: + 44 (0) 20 7136 8820
Ceská republika
Gilead Sciences s.r.o Tel: + 420 910 871 9862
Danmark
Gilead Sciences Sweden AB Tlf: + 46 (0) 8 5057 1849
Deutschland
Gilead Sciences GmbH Tel: + 49 (0) 89 899890-0
Eesti
Gilead Sciences Sweden AB Tel: + 46 (0) 8 5057 1849
medicamento dirigiéndose al representante local del Lietuva
Gilead Sciences Sweden AB Tel: + 46 (0) 8 5057 1849
Luxembourg/Luxemburg
Gilead Sciences Belgium SPRL-BVBA Tél/Tel: + 32 (0) 2 401 35 79
Magyarország
Gilead Sciences International Ltd Tel: + 44 (0) 20 7136 8820
Malta
Gilead Sciences International Ltd Tel: + 44 (0) 20 7136 8820
Nederland
Gilead Sciences Netherlands B.V.
Tel: + 31 (0) 20 718 36 98
Norge
Gilead Sciences Sweden AB Tlf: + 46 (0) 8 5057 1849
|
España Gilead Sciences, S.L. Tel: + 34 91 378 98 30 |
Polska Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 |
|
France Gilead Sciences Tél: + 33 (0) 1 46 09 41 00 |
Portugal Gilead Sciences, Lda. Tel: + 351 21 7928790 |
|
Hrvatska Gilead Sciences International Ltd Tel: + 44 (0) 20 7136 8820 |
Romania Gilead Sciences International Ltd Tel: + 44 (0) 20 7136 8820 |
|
Ireland Gilead Sciences Ltd Tel: + 44 (0) 8000 113700 |
Slovenija Gilead Sciences International Ltd Tel: + 44 (0) 20 7136 8820 |
|
Ísland Gilead Sciences Sweden AB Sími: + 46 (0) 8 5057 1849 |
Slovenská republika Gilead Sciences International Ltd Tel: + 421 232 121 210 |
|
Italia Gilead Sciences S.r.l. Tel: + 39 02 439201 |
Suomi/Finland Gilead Sciences Sweden AB Puh/Tel: + 46 (0) 8 5057 1849 |
|
Kúnpoq Gilead Sciences EA,Mg M.EnE. Tqk + 30 210 8930 100 |
Sverige Gilead Sciences Sweden AB Tel: + 46 (0) 8 5057 1849 |
|
Latvija Gilead Sciences Sweden AB Tel: + 46 (0) 8 5057 1849 |
United Kingdom Gilead Sciences Ltd Tel: + 44 (0) 8000 113700 |
|
Fecha de la última revisión de este prospecto: Otras fuentes de información |
EXlába
Gilead Sciences EA,Mg M.EnE. Tqk +30 210 8930 100
Osterreich
Gilead Sciences GesmbH Tel: + 43 1 260 830
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
38